②. 中国科学院大学, 北京 100049;
③. 国家海洋局第二海洋研究所, 杭州 310012;
④. 国家海洋局海洋生态系统与生物地球化学重点实验室, 杭州 310012)
湖泊生态系统作为陆地生态系统的重要组成成分,为人类提供重要生态服务,比如淡水和旅游资源等,而人类生产和生活活动又会影响湖泊生态系统内部的平衡与结构[1]。现代湖泊生态系统的研究手段主要集中于定点观测、 围隔实验、 生态和模型模拟等方面,这些研究可以很好地揭示湖泊生态系统在有观测记录以来的演替和变化过程,但是不能提供历史时期湖泊生态系统对气候变化的响应。因此,需要借助湖泊沉积物来研究更长时间尺度下,湖泊生态系统对全球气候变化与人类活动的响应。湖泊沉积物中记录着丰富的气候环境变化信息,保存在沉积物中的生物、 地球化学元素等指标可以指示湖泊内部的环境变化,以及水生生态系统的演变信息[2~5],因而,该方法已被广泛用于湖泊古生态以及古气候的研究中[6~8]。湖泊研究中常用到的生物指标有硅藻[9, 10]、 摇蚊[11~13]、 介形虫[14, 15]和孢粉[16, 17],以及近年来广泛应用的生物标志化合物(包括脂肪酸[18]、 烯酮[19, 20]、 GDGTs[21]和正构烷烃[22~25]等),通过构建这些指标与其对应环境参数之间的关系,进而建立转换函数,开展定量或半定量地重建湖泊营养状况、 温度、 盐度等历史变化的研究工作[26, 27]。虽然这些指标可以很好地揭示某类生物体或该生物体细胞、 叶蜡等组份与外界生存环境之间的关系,但很难揭示整个湖泊生态系统结构和生物群落的变化。色素包括叶绿素、 类胡萝卜素、 光保护化合物及其衍生化合物等,广泛存在于藻类、 光合细菌、 浮游动物、 大型水生植物以及陆生植物等生物体内[28],且具有一定的分类学属性[29],因而在一定程度上可以指示水生生态系统中光合自养生物群落结构特征。湖泊沉积物能够保存水体中光合生物的色素信息,这使得它们成为理想的指示湖泊生态系统结构的生物标志化合物[28, 30]
近些年,沉积色素作为湖泊生物标志化合物已被广泛应用于生态系统等研究中[28]。由于沉积色素的含量、 不同色素之间的相对比例与初级生产者的群落结构和丰度存在密切关系[31, 32],可被用于研究湖泊系统中生态群落结构、 初级生产力与湖泊营养水平以及气候变化历史等相关问题[26, 33~37]。此外,沉积色素也被用于研究湖泊水体理化性质的变化,如湖泊水体的历史氧化还原条件[38, 39]、 遭受的紫外辐射强度[8, 40]、 营养状态[41]和酸化过程[42]等。沉积色素还被用于研究人类活动对湖泊生态环境的影响,例如土地利用[43]、 水坝建设[44]和农业活动等[34, 45]。
我国已经开展了许多关于湖泊沉积色素的研究[46~54],这些研究主要利用传统的紫外分光光度计方法对色素进行定性和定量分析,并利用叶绿素及其衍生物(CD)、 总胡萝卜素(TC)、 蓝藻叶黄素(Myxoxanthophyll)、 颤藻黄素(Oscillaxanthin)、 未分解叶绿素即保存指数(NC)CD/TC以及 Oscillaxanthin/Myxoxanthophyll 的比值等研究过去湖泊初级生产力和群落结构的变化[46~54]。紫外分光光度计由于其自身的局限性,无法鉴定出更多种类的色素,因而不能对浮游植物群落结构进行更加详细的研究。近年来高效液相色谱分析技术(High Performance Liquid Chromatography,简称HPLC)被应用于色素研究中,由于HPLC可以对叶绿素、 类胡萝卜素及其降解产物进行定性和定量的分析,并且其具有快速和高分辨率等特征,使得HPLC成为目前色素研究中的主要分析手段。HPLC最早于20世纪70年代引入高等植物色素研究[55],随后被广泛应用于海洋以及湖泊浮游植物色素的分析中[56~58]。目前国内利用HPLC分析手段分析湖泊沉积色素的研究尚在起步阶段,Hu等[59]利用HPLC方法分析了青藏高原东缘2个湖泊的沉积色素,通过与其他环境代用指标的对比,认为近百年来该湖泊富营养化主要是由于空气中氮沉降造成的,并且该湖泊中的沉积色素很好地记录了北半球氮沉降引起的湖泊生态系统的变化。Chen等[44]利用HPLC方法通过对洞庭湖沉积物中浮游植物色素组成的分析,研究了洞庭湖水生生态系统对气候变化以及三峡大坝修建的响应。
利用沉积色素定量重建过去浮游植物群落结构及生产力需要对色素的稳定性及其降解机制进行深入的探索。已有的关于色素降解机制的研究主要针对海洋沉积物中的色素,对湖泊沉积色素的降解机制研究目前仍较少且存在一定争议。Leavitt和Hodgson[28]认为埋藏在沉积物中的色素含量与上层水体中的色素含量之间具有很好的相关性; 然而也有学者认为[60~62],99%的自生色素在沉降过程中就已经被降解掉。鉴于以上两种看似矛盾的观点,沉积色素在湖泊古生态中的应用受到很大质疑。本文将通过总结沉积色素的形成过程以及埋藏机制,结合相关色素降解模型,探讨沉积色素与湖泊中浮游植物群落之间的关系,研究沉积色素作为生物标志物在湖泊环境演化历史研究中的潜力。
2 色素 2.1 色素的来源与结构色素存在于植物的光合器官中,其主要功能是捕获光能转化成维持自身生命活动所需能量,并在遭受过量光能照射时对自身起到一定的光保护作用[63]。表 1列出了一些常见色素的来源和稳定性(主要摘自文献[28, 64]),色素的稳定性由最高(1)到最低(4)。从表 1可以看出,部分色素具有明显的特征指示意义,只由某一种藻类产生(如别藻黄素(Alloxanthin)主要由隐藻产生),然而大部分色素具有多重来源。
| 表 1 湖泊沉积物中常见色素来源及其稳定性 Table 1 Summary of pigments and their taxonomic affinities. The relative degree of chemical stability is ranked from most (1) to least (4) stable,from references[28, 64] |
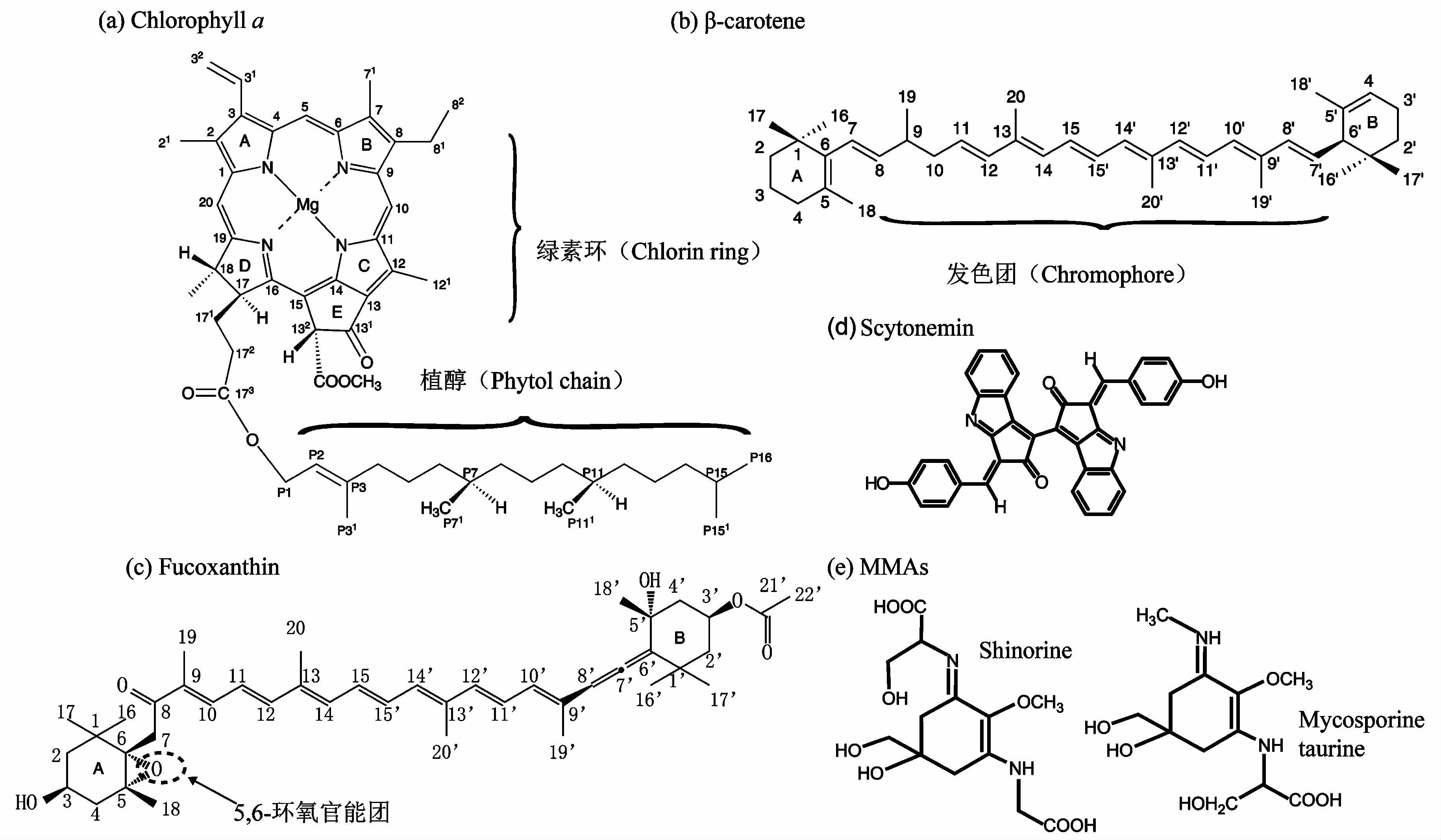
叶绿素是由4个吡咯环(图 1a中A、 B、 C和D),镁原子位于4个吡咯环的中心,1个碳环(图 1a中E)和与卟啉环相连的叶绿醇(植醇)组成,主要包括植物叶绿素a、 b和细菌叶绿素a、 b。叶绿素c不含叶绿醇侧链,细菌叶绿素c、 d和e的叶绿醇被法妮基取代,他们是光合作用发生的必需色素。叶绿素结构的另一个特点是含有吡咯环,当吡咯环D不饱和时为叶绿素c,称为卟啉; 吡咯环D被H还原后为叶绿素a、 b和细菌叶绿素c、 d和e,称为绿素; 吡咯环B和D同时被还原时,为细菌叶绿素a、 b,称为细菌绿素。
|
图 1 色素结构示意图(a)叶绿素a;(b)β胡萝卜素;(c)岩藻黄素;(d)伪枝藻素;(e)类菌胞素氨基酸 Fig. 1 Chemical structures of (a) Chlorophyll a,(b)β-carotene,(c)Fucoxanthin,(d)Scytonemin and (e) MMAs |
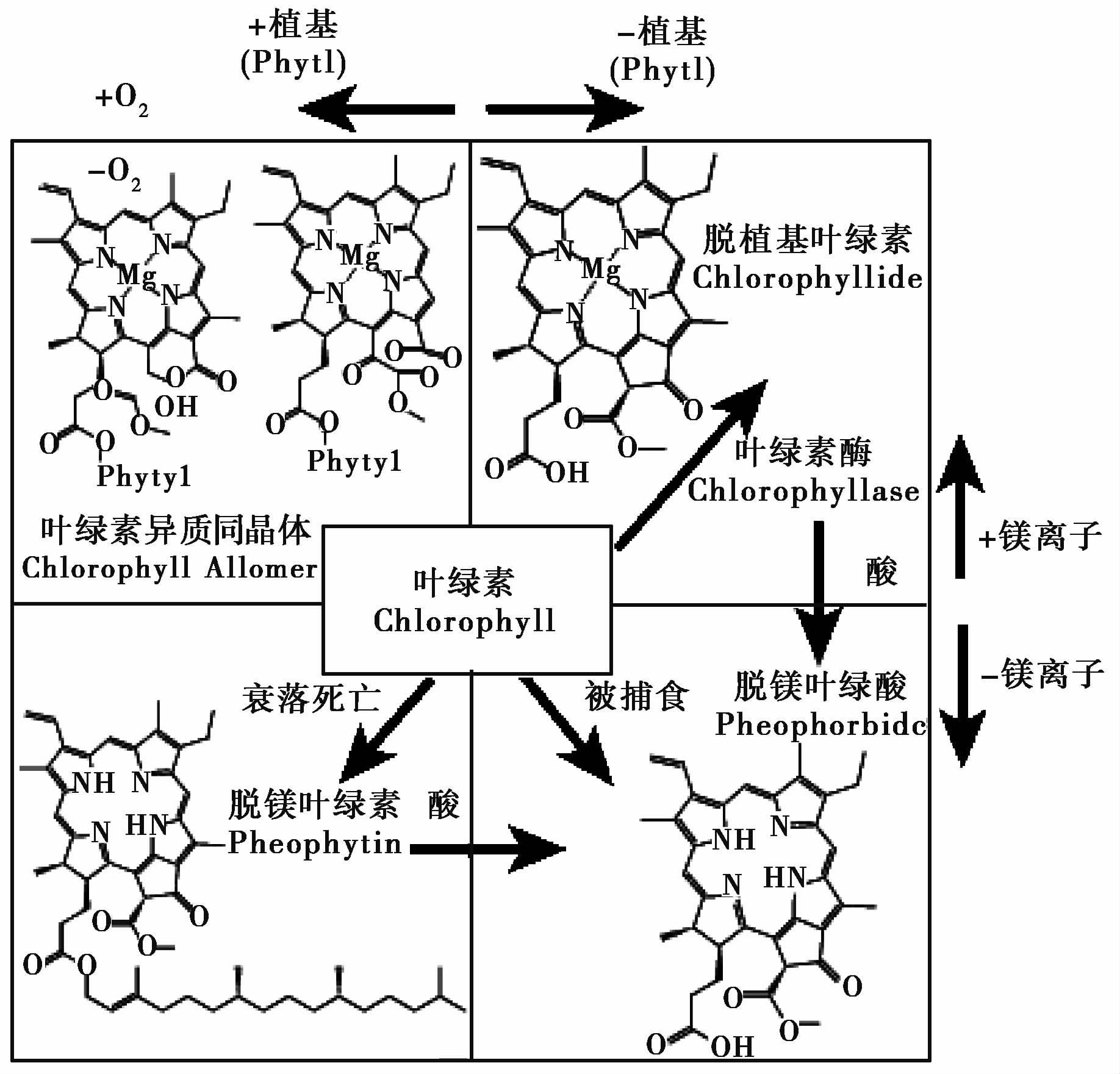
叶绿素易降解为有色产物,例如细菌降解、 动物摄食导致叶绿素脱Mg,形成脱镁叶绿素; 在叶绿素酶的作用下,脱脂化反应导致脱植基,形成脱植基叶绿素; 当Mg原子与叶绿醇同时脱去,形成脱镁叶绿酸(图 2)。甾醇绿素酯(Steryl chlorin esters,简称SCEs)是叶绿素的另一类降解产物,它是浮游动物摄食叶绿素后,甾醇与叶绿素在动物肠道内发生酯化反应形成,它比叶绿素更加稳定,被广泛用于指示摄食活动以及初级生产力[39]。
|
图 2 叶绿素降解为有色产物的示意图(Ⅰ型反应),修改自文献[32] Fig. 2 Production of colored Chlorophyll derivatives (Type 1 reactions),adapted from reference[32] |
2.1.2 类胡萝卜素及其降解产物
类胡萝卜素是由一种含共轭键的C40骨架组成的四萜类化合物(图 1b),其结构中11个共价双键用于吸收光量子,称为发色团(Chromophore),其主要作用是辅助叶绿素进行光合作用,同时保护叶绿素免受过量光能的损害。胡萝卜素有两类,包括胡萝卜素(Carotenes)和叶黄素(Xanthophylls),胡萝卜素只是碳氢化合物,而叶黄素是胡萝卜素衍生的醇类,衍生发生在末端的官能团(见图 1b中A、 B位置),例如岩藻黄素(Fucoxanthin)的5、 6环氧官能团(图 1c)、 海胆酮(Echinenone)的酮官能团等。
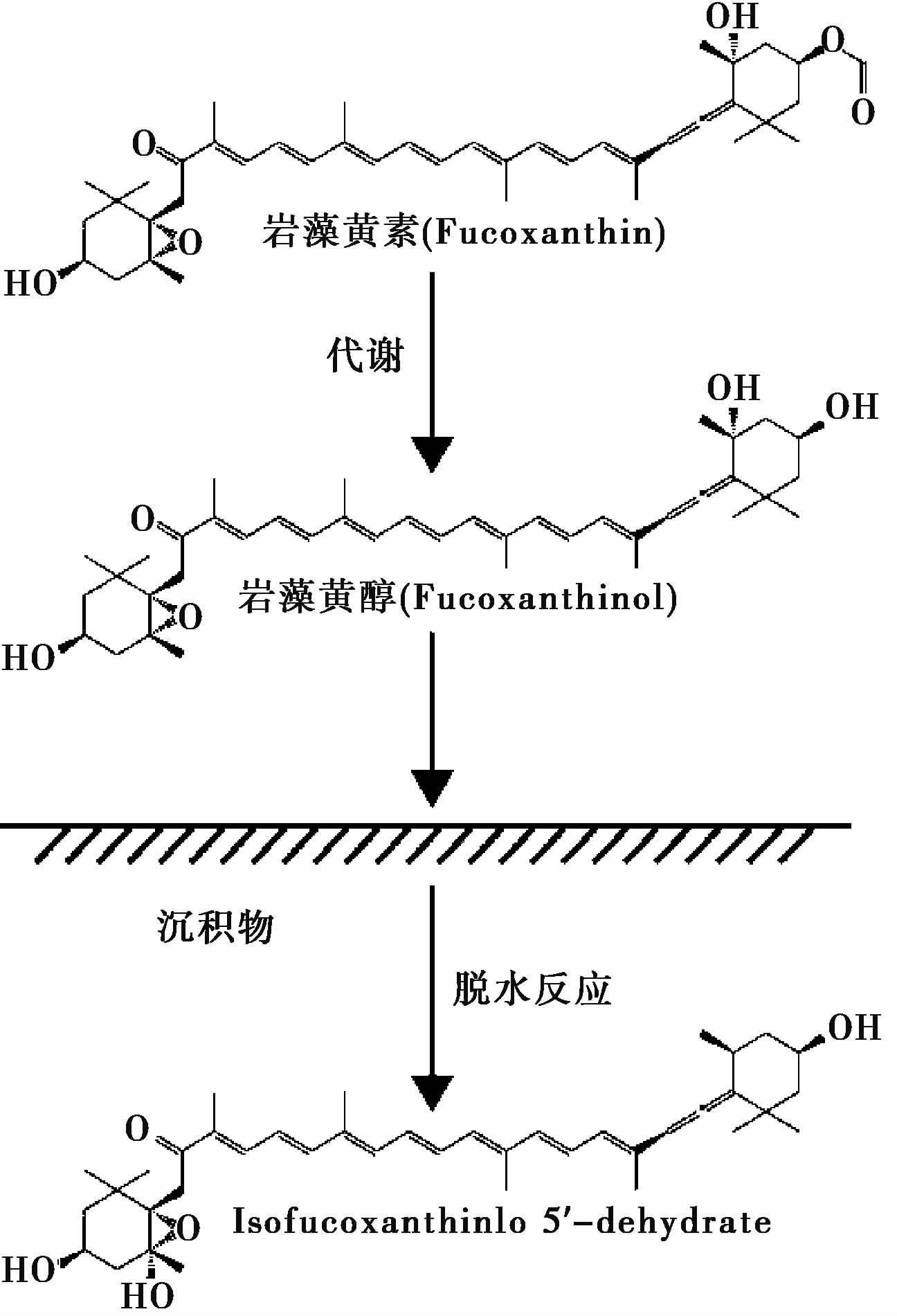
类胡萝卜素降解产生无色的降解产物,降解包括硫化作用[41]、 去苯基作用、 微生物的扰动降解[65, 66] 以及早期成岩过程中生物和缺氧(羟基和环氧基等)降解。与叶绿素的降解产物相反,类胡萝卜素的降解产物大多无法使用分光光度计测出。类胡萝卜素里Fucoxanthin等叶黄素的降解速率比胡萝卜素(β-carotene)要快。典型极不稳定的叶黄素如岩藻黄素(Fucoxanthin)和多甲藻黄素(Peridinin),由于含有5、 6环氧官能团,导致岩藻黄素主要出现在沉积物的上层,很少在沉积物中发现多甲藻黄素。图 3为Fucoxanthin色素降解示意图。胡萝卜素醇绿素酯(Carotenoid chlorin esters,简称CCEs)是岩藻黄醇(Fucoxanthol)与绿素的酯化产物,是食草动物摄食过程中以其消化道酶作为催化剂产生,CCEs被用做指示动物摄食活动。
|
图 3 类胡萝卜素岩藻黄素(Fucoxanthin)降解示意图,修改自修改自文献[67] Fig. 3 Production of Fucoxanthin derivatives,adapted from reference[67] |
2.1.3 吸收紫外光线的伪枝藻素和类菌胞素氨基酸
除叶绿素与类胡萝卜素外,还有一类特殊的色素。叶绿素与类胡萝卜素吸收光谱为可见光(400~700nm),水生生物体中存在一类吸收紫外光谱(280~400nm)的色素,称为伪枝藻素(Scytonemin)(图 1d),该物质主要来自于蓝藻[68]。湖泊沉积物中的伪枝藻素及其降解产物,被用于重建湖泊过去的紫外光谱记录[40, 69]; 另一个紫外线吸收的物质是类菌胞素氨基酸(Mycosporine-like amino acids,简称MAAs),见图 1e,来自于海洋中的甲藻、 硅藻和定鞭藻,可富集于无脊椎动物和鱼,以及湖泊中的蓝藻、 微藻和浮游动物等[70, 71]。MMAs是以环己烯酮为基本骨架,与不同类型氨基酸缩合而成的水溶性物质,它具有防护紫外辐射的作用[70, 71]。Carreto等[72]首先发现随着辐射增加,MMAs的含量也增加; 随后,Ingalls等[73]发现二者具有很好的相关性,可以利用MMAs重建过去的太阳辐射变化。
2.2 浮游植物群落与色素组成之间的关系目前大部分关于沉积色素的研究仍处于半定量,即基于特殊藻类的特征色素重建过去生态结构[64]。对于水体中的色素往往通过应用多元回归、 倒推联立方程或矩阵因子分析方法对色素与浮游植物定量分析。利用多元回归方法(公式1~4)寻找不同标志色素与总叶绿素a的关系,进而决定哪一种色素其代表的浮游植物为群落的主要贡献者。虽然目前有许多数学研究方法,但是多元回归法仍然是研究者探寻色素与浮游植物之间关系的首要方法[64]。
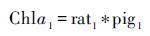
|
(1) |
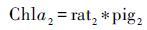
|
(2) |
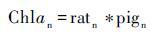
|
(3) |
最终结果为:
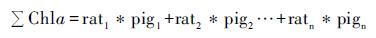
|
(4) |
其中Chlai(i=1,2…n)为特定的浮游植物中所含的叶绿素; ratj(j=1,2…n)为该浮游植物所含叶绿素与标志色素含量的比值; pigm(m=1,2…n)为该浮游植物所含的标志色素[64]。
倒推联立方程的方法是通过建立标志色素含量/浓度与浮游植物生物量的联立方程,利用最小二乘法寻求最可能的浮游植物组合[64]。与多元回归和倒推联立方程相比,基于矩阵因子分析的CHEMTAX方法是目前处理色素数据常用的方法。CHEMTAX方法[74]通过构建两个矩阵进行色素数据分析,即利用AX=B的矩阵,A矩阵是每种藻类的标志色素与叶绿素a的初始比率(比率矩阵),B矩阵包含样品中色素含量(数据矩阵),X是样品中藻类的组成(结果矩阵)。通过色素比率矩阵的多重优化,最终获得样品中藻类的组成和丰度。但是CHEMTAX方法也存在一些缺陷,比如B矩阵本身含有HPLC色素分析方法带来的偏差等。在A矩阵中,当初始比率存在较大偏差时,CHEMTAX方法往往无法得出准确的结果,Latasa[75]通过多次迭代运行程序发现在一定情况下可以减少结果的这一偏差。事实上,AX永远无法正好等于矩阵B,因此AX=B中也会一直存在误差,CHEMTAX方法通过利用最小平方的方法减少这种误差。与CHEMTAX方法处理误差的方式不同,基于R环境下的Bayesian Compositional Estimator(简称BCE)[76]程序利用贝叶斯统计方法以及Markov Chain Monte Carlo(简称MCMC)算法减少误差。BCE程序的先验知识包括对样品中种类的估计和不同藻类的标志色素与叶绿素a的比值; 由贝叶斯推论获得的后验概率分布在程序中利用MCMC算法进行描述[76]。该算法不仅所获得的群落组成结果与CHEMTAX方法精度相近,且可以给出相关的统计参数,如标准差、 协方差等。Browne[77]基于色素的不同数学方法重建的佛罗里达的湿地藻类群落,认为BCE方法与CHEMTAX方法最大的区别在于前者认为比率数据有随机的误差,而后者方法被认为所有比率数据的分布满足正态分布,它是一个伽马分布并且利用MCMC寻求准确的后验分布(藻类的群落组成)。
虽然有很多数学方法可以将湖水中的色素与浮游植物建立定量关系,但是在湖泊沉积物中沉积色素与其对应的群落结构之间的研究仍处于定性与半定量的阶段[78~82]。早期的研究中,Mary等[78]发现颤藻黄素(Oscillaxanthin)与颤藻(Oscillatoria)具有很强的相关性。随后,在加拿大的一个富营养湖227中,Leavitt和Findlay[80]将沉积物与20年的监测数据对比发现,色素所指示的群落与观测结果吻合; 与近20年的浮游植物进行对比发现:β-胡萝卜素(β-carotene)、 脱镁叶绿素a(Pheophytin a)与生物量显著相关(r=0.56~0.65),叶黄素(Lutein)与玉米黄素(Zeaxanthin)之和以及脱镁叶绿素b(Pheophytin b)的含量与绿藻的生物量显著相关(r=0.53~0.55),但是也发现α-胡萝卜素(α-carotene)与别藻黄素(Alloxanthin)与隐藻生物量弱相关,岩藻黄素(Fucoxanthin)、 叶绿素c(Chlorophyll c)与多甲藻黄素(Peridinin)降解迅速,仅出现在沉积物的上层。通过与长期监测数据对比,沉积色素还可以很好地反应群落组成,即当湖泊变为富营养时,有显著的绿藻和蓝藻的增加[80]。爱尔兰北部的Lough Neagh的27年监测记录显示蓝藻与其对应色素蓝藻叶黄素(Myxoxanthophyll)具有很强的相关性(r2=0.837)[83]。Teresa和Catalan[84]对法国与西班牙边境的83个湖泊表层沉积物与湖水化学性质、 湖泊物理性质、 流域信息,土壤信息以及生物信息等研究表明,指示摄食活动的脱镁叶绿酸以及合成动物组织的色素(虾青素(Astanxanthin)、 角黄素(Canthxanthin)和海胆酮(Echinenone))与浮游动物丰度有很好的相关性。
2.3 色素的降解与模拟对色素沉积过程和降解机制的了解直接关系到利用其作为生物标志物研究过去生态系统变化和环境变化的准确性。在沉积过程中,化学、 光化学以及生物过程都会对造成色素降解[85]。早在70年前,Fox[86]研究表明水体中的色素在沉积前有33%的胡萝卜素和97%类胡萝卜素已经丢失,并且伴随着埋藏深度的增加这种选择性保存越来越明显。也有一些研究表明超过95%的自生色素在沉降过程中丢失[60~62]。在沉降的过程中,叶绿素由于含有氮(N),在降解过程中比类胡萝卜素相更容易被动物捕获和被微生物降解。叶绿素降解的途径包括: 氧化、 脱镁、 脱植基。类胡萝卜素(胡萝卜素和叶黄素)的降解主要是通过破坏长链改变双键,最终降解为无色物质。总体来说,色素在水中的沉积过程的降解主要是由于氧、 光、 微生物分解和动物捕食消化造成的; 而一旦沉降到沉积物表面,色素的降解则主要受化学反应或生物过程影响。在不同的湖泊中,不同要素对于色素的影响程度也不同,主要是由于水深、 透光度、 溶解氧以及藻类集中的深度等不同所致。Leavitt[32]建立的色素沉积概念模型,包含色素在水中的降解过程(氧化、 被浮游动物摄食、 细胞溶解、 酶促反应等)以及埋藏于沉积物中的降解过程(图 4)。该模型很好地解释了地质研究结果显示沉积色素的含量与浮游植物的显著相关,但实验室培养实验结果显示90%的色素在其沉降过程中降解之间的矛盾。其认为每一个湖泊都有一个独特的沉积环境,包含湖水的热力学分层深度、 溶解氧、 透光性以及浮游植物的群落组成[32]。尽管色素在沉降的过程中会产生一定的降解,但每种色素在该湖中降解速率基本是恒定的,一旦埋藏入沉积物中,色素降解会变得更慢,其降解的周期为千年以上,不同年际之间色素降解的程度基本一致[31]。因此,埋藏在沉积物中的色素可以完整的记录古生态信息,并且在半对流型湖泊(湖水常年分层,下层水体温度极低,一般为2°C左右,且溶解氧含量几乎为零)及深度较浅的湖泊(色素可以快速的埋藏于沉积物中)都可以很好的保存色素。
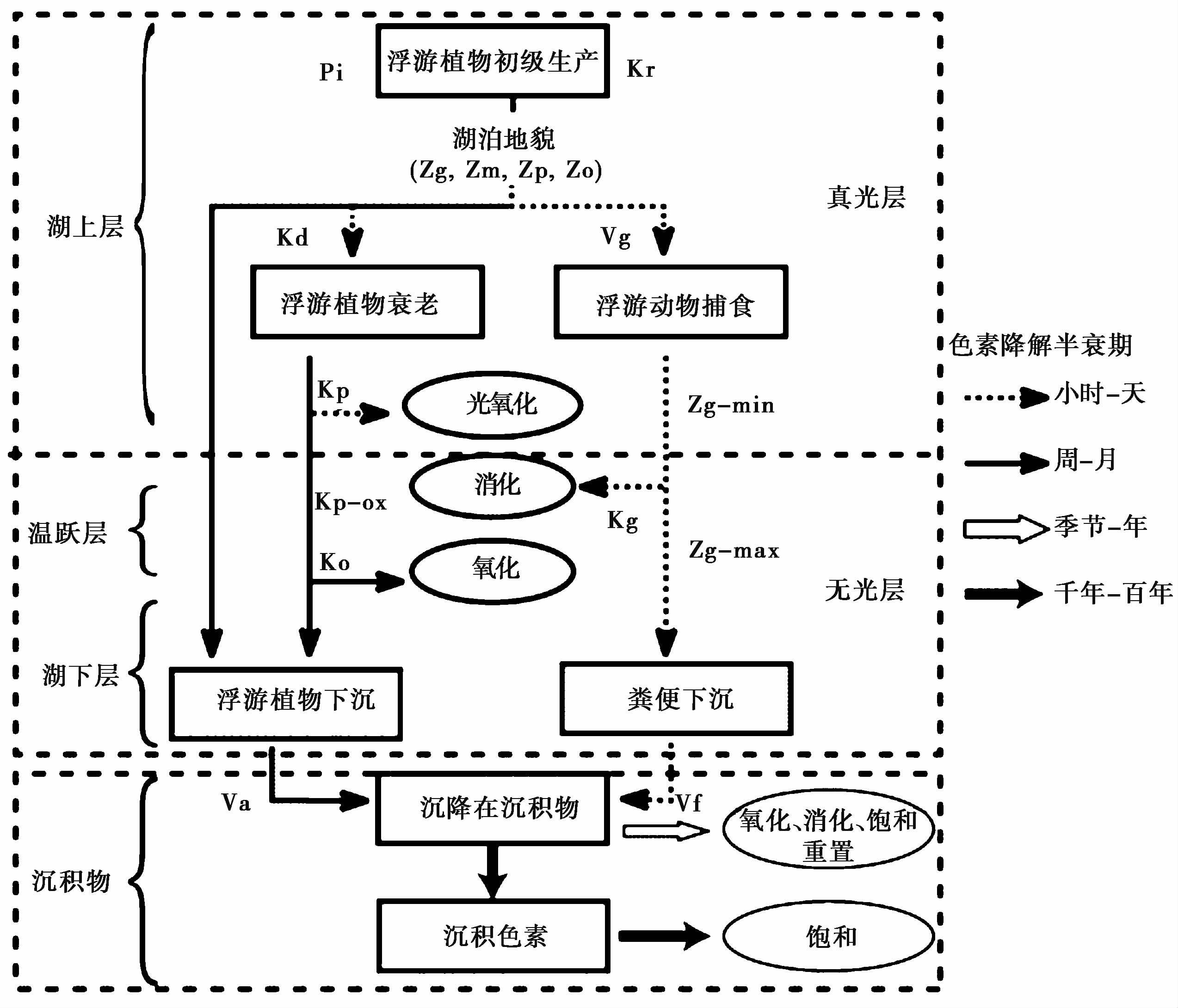
|
图 4 色素从水中埋藏至沉积物的途径及降解原理图,修改自文献[31, 32],速率等参数见表 2 Fig. 4 Pathways and rate of pigments degradation during transport through the water column and deposition in the sediments,adapted from references[31, 32]),and rate coefficients are presented in Table 2 |
色素沉降过程中,除了湖泊的物理属性会对色素产生降解外,动物摄食藻类是色素降解的另一个重要组成部分,并且这个过程具有两面性[32]。一方面被动物摄食可能会破坏色素,但是另一方面浮游动物消化并随粪便排出又保护色素免于受光氧化的沉降。在早期的培养实验中发现: 利用蓝细菌培养蚤类的145小时内,有70%的叶绿素转换为脱镁叶绿素或脱镁叶绿酸[87, 88]; 海洋培养实验中发现,桡足类动物摄食也会导致叶绿素降解为无色产物[89~91]。对于类胡萝卜素而言,它的降解主要发生在捕食动物的内脏[92]。
Cuddington和Leavitt[31]在前期所提出的概念模型[32]基础上,结合湖泊物理属性和动物降解等因素对沉积色素埋藏和降解机制进行了研究,创建了湖泊色素单体模型,从而定量寻找色素沉积过程中湖泊的地形、 分层、 藻类的繁殖和埋藏、 降解等重要控制因素(图 4)。Cuddington和Leavitt[31]发现湖泊中生物参数,即捕食降解百分数(Kg)、 浮游植物沉积速率(Va)、 浮游植物再生产(Kr)以及物理参数湖水深度(Zm)和最大溶氧深度(Zo)对色素的降解具有重要影响(表 2); 由于认为浮游动物主要在湖上层,湖下层属于缺氧区,因此假定该区域没有动物,所以最大捕食深度(Zg-max)=Zo,捕食深度Zg=(Zg-min)-(Zg-max)。与质量平衡研究、 湖泊围隔实验、 经验模型以及沉积物分析共同比较发现,在单个湖泊中,沉积色素可以反映湖泊生态环境的历史变化信息,尤其是在湖水深度变化较小的湖泊; 但是,当研究多个湖泊利用色素重建的浮游群落时,由于湖泊本身物理性质(透明度、 分层、 湖深和浮游动物群落)的差异,导致色素降解的程度不同,埋藏机制与色素聚集度也不同[31],这也是沉积色素在湖泊研究中无法直接通过线性关系或CHEMTAX和BCE等程序直接定量浮游植物群落组成的原因。
| 表 2 模型参数与色素沉降相关性(斜率)及其显著性(P)(据文献[31])(其中*代表该参数与色素沉积显著相关(P≤0.0001); +表示色素沉积与该参数正相关; -表示色素沉积与该参数负相关) Table 2 Estimate from multiple regression analysis of the effect of variation in model parameters on predicted pigment deposition rate(slope)and significance of these estimates(P value)[31],*represents significant relationship; +represents pigment deposition was positively correlated with parameter; -represents pigment deposition was negatively correlated with parameter |
尽管沉积色素目前无法完全准确定量重建过去浮游植物群落结构,但是对于色素沉积与降解机制的研究仍在不断发展中。Berner[93]首次提出降解模型,将有机物视为一个整体,并且降解速率与其浓度呈正比(公式5):
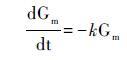
|
(5) |
公式(5)中Gm表示可降解的物质含量; k为一阶降解速率; t为时间。该模式假设有机物降解浓度与降解速率均随着时间t呈指数递减,且降解速率k被认为是常数。Chen等[94]利用一阶降解速率的对比降解模型(Comparative Decay Model,简称CDM)研究了密西西比河和路易斯安那大陆架的水体与沉积叶绿素及其降解产物的降解过程。他们假设色素1与色素2具有恒定的降解速率k1和k2,初始值分别为C01和C02,随着时间的变化,两个色素的含量变为C1和C2:
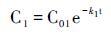
|
(6) |
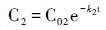
|
(7) |
色素1与色素2的相对含量可表示为:
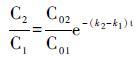
|
(8) |
当k1=k2时,C2与C1之间存在线性关系; 当k1≠k2时,C2与C1之间存在指数关系。他们发现脱镁叶绿素a(Pheophytin a)、 焦脱镁色素a(Pyropheophytin a)、 Chlorophyllone a、 SCEs和CCEs是密西西比河中叶绿素a的主要降解产物,其中Chlorophyllone a与浮游植物的衰亡和微生物的分解紧密相关[94]。
上述的模型虽然可以定量重建沉积色素的含量,但也存在一定的局限性。由于沉积物中有机质来源的复杂,且其易与其他颗粒吸附,因此将沉积物中的有机质视为统一整体并使用单一降解速率来模拟沉积有机质的降解,该方法会与真实情况之间存在较大误差。这主要体现在降解过程对沉积有机质的选择性上,不稳定的物质先于稳定的物质发生降解,且在降解过程中不断消耗氧气,致使最终由有氧降解变为无氧降解,同时伴随着沉积有机质的降解,残留物质的反应活性和降解速率随时间增长而持续降低。针对该问题,研究者随后提出了Multi-G降解模型[95],该模式将沉积物质分为具有不同降解速率的多种组份(公式9~11):
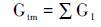
|
(9) |
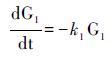
|
(10) |
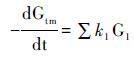
|
(11) |
其中,Gtm表示总的可降解有机质含量; G1其中一种有机碳的含量; k1为该种有机碳的降解速率; t为时间。虽然Multi-G降解模型考虑到有机物不同组份和速率随时间变化的特性,将有机物降解进行分组处理,但是这一模式很难运用到实际的降解过程研究。因为同一物质在不同环境的降解特性不一样,因而降解速率k在不同环境也不一样。在实际应用的过程中,需要掌握每一组物质的降解速率及其含量,同样加大了应用难度。Li等[96]利用Multi-G模型研究了长江口-东海内陆架沉积色素所代表的海洋浮游植物生物量,由于叶绿素在水体中的降解速率与沉积物中的降解速率相差2~4个数量级,认为颗粒物在水中的停留时间是影响色素降解的主要因素。Middelburg[97]提出Power模型计算有机质降解,该模型将降解速率k认为是一个随时间变化的量(公式12):
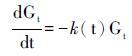
|
(12) |
其中Gt为总有机碳的浓度; k为以时间t为变量的函数,指示降解速率。公式(13)为一阶反应的特点:
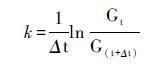
|
(13) |
k值通过培养实验由上式得出,其中Δt为一段时间的间隔,假设k在Δt这段时间内不变。Middelburg[97]结合不同实验室测量的TOC值,运用Power模式计算出TOC降解速率常数k,并发现其与Multi-G模型模拟的浓度值及变化趋势相近,可以较好地描述生物标志化合物的降解。
需要注意的是,虽然降解模型可以定量重建过去的浮游植物群落结构,但是沉积色素埋藏由于受研究区域的多因素影响,导致重建的结果与实际监测结果会产生偏差。Bianchi等[82]对比波罗的海的20年监测数据显示,硅藻藻华在有年纹层的湖泊沉积色素中可清楚地测出,其沉积色素重建的结果与监测数据相差很大,这主要由于藻类的选择性沉降、 不同色素的降解机制不同和藻类监测技术的局限性导致监测的数据无法涵盖整个湖泊藻类信息。因此利用沉积色素重建过去浮游植物群落时,必须综合考虑其埋藏区域的环境因素(再悬浮,低氧)以及浮游植物自身等因素的影响。
2.4 色素化合物同位素为了减少色素降解对色素定量重建研究的影响,湖泊色素同位素技术被引入到水生生态系统研究中,Sachs等[98]首先将绿素中的氮同位素进行分析,并重建了晚更新世的泥炭事件; 随后,更多的研究者[99~101]对色素中的碳、 氮同位素的分析方法进行改进,利用化学的方法将绿素转化为单个的吡咯单元,然后在测量其中的 δ15N 值,比如Higgins等[99]创建了可以快速分析色素同位素的高效液相色谱法,并且测试混合的卟啉中氮同位素而非单个纯化后的吡咯。该方法减少了分析时间与所需的样品量,从而使得色素同位素可以更加快速准确地重建水生系统的N循环[102]。Tyler等[101]在日本的Suigetsu湖中对比了绿素同位素与沉积物同位素,发现来自于沉积物中的δ13C与来自于绿素中的δ13C表现出相同的变化,并且都反应了水生系统的变化,相反的是沉积物有机质与绿素的 δ15N 所反应的趋势不同,这说明成岩作用对沉积物有机质中 δ15N 高低有明显的影响,而来自于绿素的 δ15N 值则可以更好地反应湖泊初级生产力以及对冰消期环境变化的响应。
3 沉积色素在古湖沼学研究中的应用在过去的几十年里,沉积色素作为生物标志化合物已经成功用在浮游植物群落组成历史变化、 初级生产力变化、 物质来源示踪、 指示气候事件以及富营养化的研究当中[28]。湖泊沉积色素及其衍生物不仅在全新世沉积物中很好的保存[57],并且也被用于重建更新世以来的环境变化,比如在俄罗斯[102]、 意大利[103]、 南极[104]等地湖泊。在北美洲的Green River地区甚至可以追溯到始新世[105]; 在澳大利亚北部McArthur盆地,Lee和Brocks[106]发现了距今16亿年前沉积物中即有具有不同C40骨架的22种类胡萝卜素的存在; 在南极,Hodgson等[107]重建了距今30ka的色素记录,并发现类胡萝卜素的降解可以达到百万年。如此长的时间尺度,色素会产生降解,因此利用色素的降解产物SCEs可以很好地研究过去的浮游植物群落,用于指示硅藻、 绿藻、 甲藻的变化[107]。贝加尔湖的沉积物研究中含有迄今为止最长的湖泊沉积色素记录,该湖记录了上新世至更新世期间(4.5~1.3Ma)藻类的信息,并发现降解产物SCEs指示的甲藻与绿藻的含量与当时利用氧同位素重建的温度记录以及利用硅藻壳体重建的硅藻含量可以相互对应[108]。因此,埋藏在第四纪湖泊沉积物中的色素,可以用来重建湖泊系统过去的变化。
3.1 重建浮游植物群落组成与生产力历史变化中的应用沉积色素丰度可以用来推断上层水体的初级生产力。由于色素具有明显的分类学特征,因此它可以表征不同浮游植物群落组成及其随时间的变化[34, 109]。McGowan等[34]通过研究英格兰的Windermere湖泊的沉积色素,认为色素可以用于重建浮游植物群落,其重建的浮游植物群落包含硅藻(Fucoxanthin和Diatoxanthin色素)、 绿藻(Chlorophyll b和Lutein色素)、 隐藻(Alloxanthin)、 蓝藻(Zeaxanthin和Echinenone色素)、 总藻(Chlorophyll a、 Pheophytin a和β-carotene色素)和色素保存程度的指标(Chlorophyll a︰Pheophytin a),认为气候变化和人类活动是影响Windermere湖藻类群落组成变化的主要原因。Moorhouse等[109]在McGowan研究的基础上,细化了蓝藻群落的变化,即蓝藻1(Canthaxanthin和Echinenone色素)、 蓝藻2(Aphanizophyll和Zeaxanthin色素),利用重建的浮游群落结构发现Windermere湖浮游植物的变化除了受人类和气候的影响外,同时也受湖泊流域的影响,继而提出湖泊流域是影响湖泊生态系统的另一重要因素。该观点也在近些年的湖泊沉积色素研究中得到广泛的关注[59]。
在研究湖泊生产力时,虽然生物硅(BSi)也可以作为生产力指标,但由于其主要来源为硅藻,而硅藻的生产力并不能代表整个湖泊的状况,因而在重建湖泊生产力时存在局限性[110]。来源于水生浮游植物的叶绿素a以及α、 β胡萝卜素可以更好地反应湖泊生产力。Michelutti等[110]在研究6个北极湖泊初级生产力时发现,叶绿素a可以很好地指示湖泊初级生产力的变化,并发现所有记录中叶绿素a的增加与气候变暖相对应,可能原因是气候变暖使浮游植物和植物的生长季延长,栖息地环境得到改变以及营养物质的增加,从而引起群落结构变化。
3.2 重建水生生态系统食物网中的应用色素指示浮游植物群落的另一个重要意义在于可以描述湖泊食物网结构的变化[35, 79, 111]。湖泊沉积物中很难保存鱼等大型浮游动物的信息,因而利用沉积色素可以间接反映浮游动物的捕食情况并恢复湖泊中浮游动物的数量[35],在湖泊古生态研究中得到了重视。早期在美国密歇根的湖泊研究中发现,不同种类的鱼(鳟鱼、 鲤鱼及鲈鱼)存在3个明显的变化,导致初级生产者浮游植物产生相应的变化[79]。这主要因为浮游动物在水中捕食浮游植物时,当形体较大的捕食者被形体较小的捕食者替代后,沉积物中的大部分色素所指示的浮游植物含量上升。当形体较大的捕食者重新主导食物链时,总的浮游植物含量下降,这说明捕食者的形体大小也会影响浮游植物的生长。Leavitt等[111]在1994年利用沉积色素记录研究鱼与无脊椎动物和浮游植物之间的关系发现,放入湖中的鱼通过减少大型无脊椎浮游动物,进而促进浮游植物初级生产力的提高。因此,利用湖泊沉积色素可以间接反映浮游动物的情况,进而将其应用于湖泊食物网的重建研究中。
3.3 重建湖泊水文条件的应用湖泊水位的变化会直接影响浮游植物的生产力,因而利用沉积色素恢复的浮游植物生产力的高低可以用于记录湖泊水位的变化。当湖泊水位升高,加速了氮、 磷等营养物质流入湖中,导致浮游植物的生产力开始提高和水质的下降[112]。此外,色素也被用于估计洪水频率的变化,McGowan等[113]在2011年利用沉积物色素研究加拿大61个湖泊的生产力与洪水之间的关系,结果发现洪水频率低的年份,湖泊生产力高; 相反,洪水频率高的年份,由于营养物质被稀释等原因造成湖泊生产力降低。
在封闭的湖泊中,湖泊受到水文变化主要是盐度的变化,色素也被用作判断盐湖中降水与蒸发的关系,进而重建过去盐度的变化[114, 115]。在加拿大西部湖泊的沉积色素研究中发现,随着盐度增加,代表绿藻与蓝藻的色素(叶黄素和玉米黄素,即Lutein-Zeaxanthin)和硅藻的色素(硅藻黄素,即Diatoxanthin)逐渐替代了具有多重指示意义的岩藻黄素(Fucoxanthin)[114]。由于盐度的变化经常伴随着湖泊水位的变化,因此封闭湖泊中的沉积色素往往会记录着对二者共同作用的响应信号; 此外,在半对流型湖泊中,由于常年分层且底部水温较低,使得其成为保存浮游植物色素的理想环境,因此利用厌氧细菌色素,可以用于研究半对流型湖泊过去水文环境的变化[115]。格陵兰西部的半对流型盐湖由于冬季较少的淡水注入导致湖泊盐度增高而分层,这种环境促使厌氧的紫色硫细菌(指示色素为奥克酮; Okenone),通过重建奥克酮的含量有助于恢复过去湖泊水位和盐度[115]。
3.4 重建湖泊酸化及富营养化程度中的应用沉积色素中的叶绿素a以及酸化产物脱镁叶绿素a也被用来重建湖泊酸度[42, 116]。叶绿素a(最大吸收波长为450nm)酸化脱去环中的Mg原子形成脱镁叶绿素a(最大吸收波长为410nm),脱镁叶绿素a与叶绿素a的比值不仅可以用于反映沉积物中色素的保存情况,还可以定量重建湖水过去的pH值[42]。Guilizzoni等[42]在阿尔卑斯山的21个湖泊表层沉积物中,利用90%丙酮提取出的色素发现,吸收波长430nm的色素与吸收波长410nm的色素的比值可以与贫营养湖中的湖水pH建立转换函数,并对湖泊酸化程度进行研究; 此外,湖泊酸化会导致湖水中溶解有机碳(DOC)含量下降,促使湖水透明度升高。加拿大湖泊酸化过程的研究中发现[116],浮游植物对溶解有机碳的损失和酸碱度的变化具有明显响应,酸化可以导致深水中的岩藻黄素(Fucoxanthin)增加6倍,主要因为适度的酸化会降低DOC水平,使湖水透明,更多的光照可以进入湖泊中,从而促进底栖生物的生产力。
利用沉积色素与湖泊透明度关系,并根据透明度恢复湖泊过去富营养化记录也被广泛应用于湖泊色素研究[35, 117~119]。利用沉积色素重建的过去浮游植物记录显示,浮游植物生产力增加与湖泊富营养化显著相关[35]。此外,湖泊富营养化也伴随着蓝藻的增加,因而利用蓝藻标志色素重建蓝藻群落结构可以研究湖泊过去富营养化的程度。 近期,Heather等[118]利用加拿大南部10个浅湖的沉积色素记录,通过沉积色素重建的总浮游植物生物量(标志色素为β-carotene和Pheophytin a)、 蓝藻(标志色素Echinenone)和紫色硫细菌(指示色素为Okenone)研究了该地区过去150年以来湖泊富营养化的历史。Taranu等[119]利用指示蓝藻沉积色素Myxoxanthophyll,并结合湖泊监测数据定量重建了近年来蓝藻的变化趋势,发现富营养化是近年来蓝藻增加的主要驱动力。
3.5 指示气候环境事件及大气污染物的沉降近些年来,随着人口的不断增长、 大量化石燃料的燃烧、 人类生产和生活活动日益频繁以及全球气候的变化,湖泊生态环境产生巨大的变化[120],生长在湖泊中的浮游植物对其具有快速地响应,使得浮游植物可以作为追踪气候事件和大气污染物沉降的良好指标[59, 120-121]。Bjerring等[33]通过利用色素沉积记录和微体化石等指标结合主成分分析和冗余分析定量重建8.2ka气候事件,并认为一些研究中丢失的信息可以通过色素进行补充,沉积色素对气候变化的更敏感,并且它的组成也受物理因素影响(湖泊形状等),更有助于环境事件的研究; 北半球的湖泊沉积物中记录着工业革命以来空气中氮沉降的不断增加[120]; Hu等[59]利用湖泊沉积色素重建了青藏高原Shade湖与Moon湖过去150年的初级生产者的变化,结果表明空气中的氮沉降以及湖泊流域的变化是导致湖泊初级生产者变化的主要原因; 在美国科罗拉多州的落基山脉国家公园中,湖泊沉积色素同位素同样记录着湖泊浮游生物对空气中的氮沉降的响应[121],绿素中 δ15N 显著的下降且绿素的 δ15N 与沉积物中的 δ15N 趋势相同,表明该湖泊自1950年以来空气中氮同位素的沉降明显促进了湖泊浮游植物的生长。
4 展望与问题 4.1 沉积色素代用指标潜力巨大与其他生物标志化合物的研究相比,沉积色素在重建湖泊过去浮游植物群落结构等方面具有一定的潜力。沉积色素的特征主要体现在以下几个方面。
(1) 指示性,色素含量与湖泊浮游植物生物量显著相关,并且特征色素含量与其指示的浮游植物生物量也具有很好的相关性,因此可被用于研究湖泊初级生产者的群落结构及其对环境变化的响应(例如富营养化、 酸化、 气候变化、 食物网交互作用、 人类活动等)。
(2) 唯一性,每一个湖泊都可能含有独特的藻类组合以及控制该组合的影响因素(影响的重要性依次为: 藻类生产力>湖泊流域和理化特征>食物网影响),因而反映其组合变化的沉积色素也具有独特性,可以明确地指示湖泊过去生态系统变化。
(3) 高效性,自动化的分析技术的发展促进沉积色素在湖泊生态系统中的应用。利用HPLC分析的沉积色素可达百种,且提取与分析过程等较其他生物标志化合物更为简捷。
4.2 应用时需注意的问题利用沉积色素定量研究古生态系统历史变化仍存在一些问题,即对于沉积色素定量过程中其含量的“校正”,应从以下几个因素考虑:
(1) 沉积过程受多个因子的影响产生不同程度的降解。色素沉降到沉积物的过程中降解主要是由光、 氧、 微生物分解和动物捕食等因素引起,因此在利用色素定量重建湖泊系统过去变化时,应当对其降解过程有充分的了解。例如,利用易降解的岩藻黄素(Fucoxanthin),其重建过去硅藻等藻类群落结构时会发现,该色素往往只存在于沉积物顶部的几厘米处,这并不意味着在沉积物下部以前不含有岩藻黄素,而是因为沉积物下部的岩藻黄素随着时间增长基本已被降解为岩藻黄醇等其他降解产物[67, 80]。因此,利用沉积色素重建过去浮游植物群落结构时,需要了解该湖泊内部色素的降解机制,避免重建群落结构的失真。
(2) 理想的“校正”过程是利用连续、 高分辨率的浮游植物信息与沉积色素进行对比。由于色素组合具有反映该湖泊群落结构的唯一性,因此利用湖泊特征色素的现代过程研究可以更清楚的解释过去沉积色素与浮游植物群落结构的关系[32]。
(3) 不可忽视的食物网关系。水生生态系统中食草动物的增加会明显减少水体中色素沉降过程的光氧化作用,相反地,食草动物的减少虽然会造成色素的光氧化大幅度增加,但同时也会促进浮游植物的生长,甚至可以弥补光氧化对色素沉降造成的损失[122]。动物含有多种捕食机制(捕食或滤食)、 对藻类个体大小的偏好和粪便的汇聚方式(小球式或分散式)等,这些过程都会影响沉积物中色素与上层水体浮游植物的关系,然而这个过程经常被研究者所忽视,这对色素重建群落结构的准确性产生很大的影响。
(4) 色素与其他生物以及地球化学指标结合使用。湖泊生态系统的变化不仅会影响生物的组成,同时湖泊中的地球化学指标也会随之发生变化[123]。将湖泊色素与生物硅、 DNA等生物指标以及总有机碳、 总氮、 碳氮比和碳、 氮稳定同位素等其他地球化学标志物结合使用[124~127],更有利于研究湖泊物理化学等过程与生产力和浮游植物沉降之间的关系,以及气候变化。
致谢: 真诚感谢审稿专家和编辑部老师建设性的修改意见。
| 1 |
Carpenter S R, Lathrop R C. Probabilistic estimate of a threshold for eutrophication[J].
Ecosystems,2008, 11 (4) : 601~613.
( 0) 0)
|
| 2 |
Kauppila P, Weckstrm K, Vaalgamaa S, et al. Tracing pollution and recovery using sediments in an urban estuary, northern Baltic Sea:Are we far from ecological reference conditions?[J].
Marine Ecology Progress,2005, 290 (1) : 35~53.
( 0) 0)
|
| 3 |
范佳伟, 肖举乐, 温锐林, 等. 内蒙古达里湖全新世有机碳氮同位素记录与环境演变[J].
第四纪研究,2015, 35 (4) : 856~870.
Fan Jiawei, Xiao Jule, Wen Ruilin, et al. Holocene environment variations recorded by stable carbon and isotopes of sedimentary organic matter from Dali Lake in Inner Mongolia[J]. Quaternary Sciences,2015, 35 (4) : 856~870. (  0) 0)
|
| 4 |
李渊, 强明瑞, 王刚刚, 等. 晚冰期以来共和盆地更尕海碎屑物质输入过程与气候变化[J].
第四纪研究,2015, 35 (1) : 160~171.
Li Yuan, Qiang Mingrui, Wang Ganggang, et al. Processes of exogenous detrital input to Genggahai Lake and changes in the Gonghe basin since the Late Glacial[J]. Quaternary Sciences,2015, 35 (1) : 160~171. (  0) 0)
|
| 5 |
王自翔, 王永莉, 孟培, 等. 泸沽湖沉积物中的铁元素和有机分子记录及其古气候/环境意义[J].
第四纪研究,2015, 35 (1) : 131~142.
Wang Zixiang, Wang Yongli, Meng Pei, et al. Iron and n-alkanes records and their environmental significance Lugu Lake, southeastern Tibetan Plateau[J]. Quaternary Sciences,2015, 35 (1) : 131~142. (  0) 0)
|
| 6 |
Battarbee R W. Palaeolimnological approaches to climate change, with special regard to the biological record[J].
Quaternary Science Reviews,2000, 19 (1) : 107~124.
( 0) 0)
|
| 7 |
Cornwell J C, Conley D J, Owens M. A sediment chronology of the eutrophication of Chesapeake Bay[J].
Estuaries and Coasts,1996, 19 (2) : 488~499.
( 0) 0)
|
| 8 |
Leavitt P R, Cumming B F, Smol J P, et al. Climatic control of ultraviolet radiation effects on lakes[J].
Limnology and Oceanography,2003, 48 (5) : 2062~2069.
( 0) 0)
|
| 9 |
Stabell B. Diatoms and lake acidity:Reconstructing pH from siliceous algal remains in lake sediments[J].
Aquatic Botany,1987, 29 (1) : 97~98.
( 0) 0)
|
| 10 |
张恩楼, 曹艳敏, 刘恩峰, 等. 近150年来湖北太白湖摇蚊记录与湖泊营养演化[J].
第四纪研究,2010, 30 (6) : 1156~1161.
( 0) 0)
|
| 11 |
Hofmann W. Cladocerans and chironomids as indicators of lake level changes in north temperate lakes[J].
Journal of Paleolimnology,1998, 19 (1) : 55~62.
( 0) 0)
|
| 12 |
Zou Yafei, Yan Yao, Zhang Jiaoyang, et al. The relationship between water depth and diatom biodiversity of Yunlong Lake, Yunnan Province[J].
Quaternary Sciences,2015, 35 (4) : 988~996.
( 0) 0)
|
| 13 |
Zhang Enlou, Cao Yanmin, Liu Enfeng, et al. Chironomid assemblage and trophic level of Taibai Lake in the middle reaches of the Yangtze River over the past 150 years[J].
Quaternary Sciences,2010, 30 (6) : 1156~1161.
( 0) 0)
|
| 14 |
张家武, 王君兰, 郭小燕, 等. 博斯腾湖全新世岩芯沉积物碳酸盐氧同位素气候意义[J].
第四纪研究,2010, 30 (6) : 1078~1087.
Zhang Jiawu, Wang Junlan, Guo Xiaoyan, et al. Paleoclimatic significance of oxygen isotope composition of carbonates from a sediment core at Bosten Lake, Xinjiang, China[J]. Quaternary Sciences,2010, 30 (6) : 1078~1087. (  0) 0)
|
| 15 |
Mischke S, Bossneck U, Diekmann B, et al. Quantitative relationship between water-depth and sub-fossil ostracod assemblages in Lake Donggi Cona, Qinghai Province, China[J].
Journal of Paleolimnology,2010, 43 (3) : 589~608.
( 0) 0)
|
| 16 |
Li Q, Lu H Y, Zhu L P, et al. Pollen-inferred climate changes and vertical shifts of alpine vegetation belts on the northern slope of the Nyainqentanglha Mountains(central Tibetan Plateau)since 8.4 kyr BP[J].
The Holocene,2011, 21 (6) : 939~950.
( 0) 0)
|
| 17 |
郑茜, 张虎才, 明庆忠. 泸沽湖记录的西南季风区15000a B.P. 以来植被与气候变化[J].
第四纪研究,2014, 34 (6) : 1314~1326.
Zheng Qian, Zhang Hucai, Ming Qingzhong, et al. Vegetational and environmental changes since 15ka B.P. recorded by Lake Lugu in the southwest monsoon domain region[J]. Quaternary Sciences,2014, 34 (6) : 1314~1326. (  0) 0)
|
| 18 |
Hou J, D'Andrea W J, MacDonald D, et al. Hydrogen isotopic variability in leaf waxes among terrestrial and aquatic plants around Blood Pond, Massachusetts(USA)[J].
Organic Geochemistry,2007, 38 (6) : 977~984.
( 0) 0)
|
| 19 |
Toney J L, Leavitt P R, Huang Y. Alkenones are common in prairie lakes of interior Canada[J].
Organic Geochemistry,2011, 42 (7) : 707~712.
( 0) 0)
|
| 20 |
宋木, 刘卫国, 郑卓, 等. 西北干旱区湖泊沉积物中长链烯酮的古环境意义[J].
第四纪研究,2013, 33 (6) : 1199~1210.
Song Mu, Liu Weiguo, Zheng Zhuo, et al. Paleoenvironmental implications of long chain alkenones in arid regions, Northwestern China[J]. Quaternary Sciences,2013, 33 (6) : 1199~1210. (  0) 0)
|
| 21 |
Günther F, Thiele A, Gleixner G, et al. Distribution of bacterial and archaeal ether lipids in soils and surface sediments of Tibetan lakes:Implications for GDGT-based proxies in saline high mountain lakes[J].
Organic Geochemistry,2014, 67 (1) : 19~30.
( 0) 0)
|
| 22 |
汪亘, 王永莉, 孟培, 等. 东北地区五大连池湖相沉积物正构烷烃和单体碳同位素特征及其古植被意义[J].
第四纪研究,2015, 35 (4) : 890~900.
Wang Gen, Wang Yongli, Meng Pei, et al. Chemical and compound-specific carbon isotopic characteristics of n-alkanes in the Qingshi lacustrine sediments, Wudalianchi, Northeast China, and their paleovegetation significances[J]. Quaternary Sciences,2015, 35 (4) : 890~900. (  0) 0)
|
| 23 |
崔琳琳, 王旭, 沈吉, 等. 末次盛冰期以来泸沽湖沉积记录的正构烷烃分布特征和单体碳同位素组成及其古植被意义[J].
第四纪研究,2015, 35 (4) : 901~912.
Cui Linlin, Wang Xu, Shen Ji, et al. Changes in distribution and compound-specific carbon isotope compositions of n-alkanes as recorded in Lugu Lake sediments from Southwestern China since Last Glacial Maximum and implications for paleovegetation evolution[J]. Quaternary Sciences,2015, 35 (4) : 901~912. (  0) 0)
|
| 24 |
匡欢传, 周浩达, 胡建芳, 等. 末次盛冰期和全新世大暖期湖光岩玛珥湖沉积记录的正构烷烃和单体稳定碳同位素分布特征及其古植被意义[J].
第四纪研究,2013, 33 (6) : 1222~1233.
Kuang Huanchuan, Zhou Haoda, Hu Jianfang, et al. Variations of n-alkanes and compound-specific carbon isotopes in sediments from Huguangyan Maar Lake during the Last Glacial Maximum and Holocene Optimum:Implications for paleovegetation[J]. Quaternary Sciences,2013, 33 (6) : 1222~1233. doi: 10.1016/j.quascirev.2015.01.023 (  0) 0)
|
| 25 |
Günther F, Witt R, Schouten S, et al. Quaternary ecological responses and impacts of the Indian Ocean summer monsoon at Nam Co, southern Tibetan Plateau[J].
Quaternary Science Reviews,2015, 112 : 66~77.
( 0) 0)
|
| 26 |
Hall R I, Leavitt P R, Smol J P, et al. Comparison of diatoms, fossil pigments and historical records as measures of lake eutrophication[J].
Freshwater Biology,1997, 38 (2) : 401~417.
( 0) 0)
|
| 27 |
McGowan S, Ryves D B, Anderson N J. Holocene records of effective precipitation in West Greenland[J].
The Holocene,2003, 13 (2) : 239~249.
( 0) 0)
|
| 28 |
Leavitt P R, Hodgson D A.
Sedimentary pigments. In:Birks H J B, Lotter A F, Juggins S et al.eds. Tracking Environmental Change Using Lake Sediments. Volume 3:Terrestrial, Algal, and Siliceous Indicators[M]. Dordrecht: Kluwer Academic Publishers, 2001 : 295 ~325.
( 0) 0)
|
| 29 |
Jeffrey S W, Wright S W, Zapata M.
Microalgal classes and their signature pigments. In:Roy S, Llewellyn C A, Egeland E S et al.eds. Phytoplankton Pigments:Characterization, Chemotaxonomy and Applications in Oceanography[M]. New York: Cambridge University Press, 2011 : 3 ~45.
( 0) 0)
|
| 30 |
Wright S W, Jeffrey S.
Pigment markers for phytoplankton production. In:Volkman J K ed. Marine Organic Matter:Biomarkers, Isotopes and DNA[M]. Berlin: Springer-Verlag, 2006 : 71 ~104.
( 0) 0)
|
| 31 |
Cuddington K, Leavitt P R. An individual-based model of pigment flux in lakes:Implications for organic biogeochemistry and paleoecology[J].
Canadian Journal of Fisheries and Aquatic Sciences,1999, 56 (10) : 1964~1977.
( 0) 0)
|
| 32 |
Leavitt P R. A review of factors that regulate carotenoid and chlorophyll deposition and fossil pigment abundance[J].
Journal of Paleolimnology,1993, 9 (2) : 109~127.
( 0) 0)
|
| 33 |
Bjerring R, Olsen J, Jeppesen E, et al. Climate-driven changes in water level:A decadal scale multi-proxy study recording the 8.2-ka event and ecosystem responses in Lake Sarup(Denmark)[J].
Journal of Paleolimnology,2013, 49 (2) : 267~285.
( 0) 0)
|
| 34 |
McGowan S, Barker P, Haworth E Y, et al. Humans and climate as drivers of algal community change in Windermere since 1850[J].
Freshwater Biology,2012, 57 (2) : 260~277.
( 0) 0)
|
| 35 |
McGowan S, Leavitt P R, Hall R I, et al. Controls of algal abundance and community composition during ecosystem state change[J].
Ecology,2005, 86 (8) : 2200~2211.
( 0) 0)
|
| 36 |
Massaferro M M, Massaferro J, Ross G R, et al. Late Pleistocene and Early Holocene ecological response of Lake El Trébol(Patagonia, Argentina)to environmental changes[J].
Journal of Paleolimnology,1999, 22 (2) : 137~148.
( 0) 0)
|
| 37 |
Rusak J A, Leavitt P R, McGowan S, et al. Millennial-scale relationships of diatom species richness and production in two prairie lakes[J].
Limnology and Oceanography,2004, 49 (4) : 1290~1299.
( 0) 0)
|
| 38 |
Hodgson D A, Wright S W, Tyler P A, et al. Analysis of fossil pigments from algae and bacteria in meromictic Lake Fidler, Tasmania, and its application to lake management[J].
Journal of Paleolimnology,1998, 19 (1) : 1~22.
( 0) 0)
|
| 39 |
Squier A H, Hodgson D A, Keely B J. Sedimentary pigments as markers for environmental change in an Antarctic lake[J].
Organic Geochemistry,2002, 33 (12) : 1655~1665.
( 0) 0)
|
| 40 |
Leavitt P R, Vinebrooke R D, Donald D B, et al. Past ultraviolet radiation environments in lakes derived from fossil pigments[J].
Nature,1997, 388 (6641) : 457~459.
( 0) 0)
|
| 41 |
Lami A, Marchetto A, Guilizzoni P, et al.
Paleolimnological Records of Carotenoids and Carbonaceous Particles in Sediments of Some Lakes in Southern Alps[M]. Netherland: Springer Netherlands, 1994 : 57 ~64.
( 0) 0)
|
| 42 |
Guilizzoni P, Lami A, Marchetto A. Plant pigment ratios from lake-sediments as indicators of recent acidification in alpine lakes[J].
Limnology and Oceanography,1992, 37 (7) : 1565~1569.
( 0) 0)
|
| 43 |
Kauppila P, Weckström K, Vaalgamaa S, et al. Tracing pollution and recovery using sediments in an urban estuary, northern Baltic Sea:Are we far from ecological reference conditions?[J].
Marine Ecology Progress,2005, 290 (1) : 35~53.
( 0) 0)
|
| 44 |
Chen X, Suzanne M G, Xu L, et al. Effects of hydrological regulation and anthropogenic pollutants on Dongting Lake in the Yangtze floodplain[J].
Ecohydrology,2015 .
doi: 10.1002/eco.1637 ( 0) 0)
|
| 45 |
Cottingham K L, Rusak J A, Leavitt P R. Increased ecosystem variability and reduced predictability following fertilisation:Evidence from palaeolimnology[J].
Ecology Letters,2002, 3 (4) : 340~348.
( 0) 0)
|
| 46 |
Lami A, Turner S, Musazzi S, et al. Sedimentary evidence for recent increases in production in Tibetan Plateau lakes[J].
Hydrobiologia,2010, 648 (1) : 175~187.
( 0) 0)
|
| 47 |
陈传红, 汪敬忠, 朱迟, 等. 近200a来泸沽湖沉积物色素记录与区域气候变化的关系[J].
湖泊科学,2012, 24 (5) : 780~788.
Chen Chuanhong, Wang Jingzhong, Zhu Chi, et al. Relationship between the sediment pigment records of Lake Lugu and the regional climate change over the last 200a[J]. Journal of Lake Sciences,2012, 24 (5) : 780~788. (  0) 0)
|
| 48 |
贾沁贤, 黄玉瑶, 高玉荣. 青海尕海盐湖初级生产力特点[J].
应用与环境生物学报,1999, 5 (5) : 483~486.
Jia Qinxian, Huang Yuyao, Gao Yurong. The primary productivity in the Gahai Salt Lake, Qinghai[J]. Chinese Journal of Applied and Environmental Biology,1999, 5 (5) : 483~486. (  0) 0)
|
| 49 |
宋磊, 强明瑞, 郎丽丽, 等. 16ka BP 共和盆地更尕海湖泊生产力演化历史[J].
科学通报,2012, 57 (20) : 2595~2605.
Song Lei, Qiang Mingrui, Lang Lili, et al. Changes in palaeoproductivity of Genggahai Lake over the past 16ka in the Gonghe basin, northeastern Qinghai-Tibetan Plateau[J]. Chinese Science Bulletin,2012, 57 (20) : 2595~2605. (  0) 0)
|
| 50 |
薛滨, 潘红玺, 夏威岚, 等. 历史时期希门错湖泊沉积色素记录的古环境变化[J].
湖泊科学,1997, 9 (4) : 295~299.
Xue Bin, Pan Hongxi, Xia Weilan, et al. Palaeoenvironmental reconstruction of Ximen Cuo in historical period inferred from pigment record[J]. Journal of Lake Sciences,1997, 9 (4) : 295~299. (  0) 0)
|
| 51 |
郑柏颖, 张恩楼, 高光. 近百年来新疆博斯腾湖初级生产力的变化[J].
湖泊科学,2012, 24 (3) : 466~473.
Zheng Boying, Zhang Enlou, Gao Guang. The change of primary productivity of Lake Bosten in Xinjiang over the past 100a[J]. Journal of Lake Sciences,2012, 24 (3) : 466~473. (  0) 0)
|
| 52 |
申慧彦, 李世杰, 舒卫先. 湖泊沉积物中色素的研究及其环境指示意义[J].
海洋地质与第四纪地质,2007, 3 (3) : 37~42.
Shen Huiyan, Li Shijie, Shu Weixian. Pigments in the lake sediments:Environmental indicator[J]. Marine Geology & Quaternary Geology,2007, 3 (3) : 37~42. (  0) 0)
|
| 53 |
吴敬禄, 蒋雪中, 夏威岚, 等. 云南程海近500年来湖泊初始生产力的演化[J].
海洋地质与第四纪地质,2002, 22 (2) : 95~98.
Wu Jinglu, Jiang Xuezhong, Xia Weilan, et al. Climate and primary productivity over the last 500 years of the Chenghai Lake, Yunnan[J]. Marine Geology & Quaternary Geology,2002, 22 (2) : 95~98. (  0) 0)
|
| 54 |
Chen G, Shi H, Tao J, et al. Industrial arsenic contamination causes catastrophic changes in freshwater ecosystems[J].
Scientific Reports,2015, 5 .
doi: 10.1038/srep17419 ( 0) 0)
|
| 55 |
Eskins K, Scholfield C R, Dutton H J. High-performance liquid chromatography of plant pigments[J].
Journal of Chromatography,1977, 135 (1) : 217~220.
( 0) 0)
|
| 56 |
Züllig H. On the use of carotenoid stratigraphy in lake sediments for detecting past developments of phytoplankton[J].
Limnology and Oceanography,1981, 26 (5) : 970~976.
( 0) 0)
|
| 57 |
Sanger J E. Fossil pigments in paleoecology and paleolimnology[J].
Palaeogeography, Palaeoclimatology, Palaeoecology,1988, 62 (88) : 343~359.
( 0) 0)
|
| 58 |
Wright S W, Shearer J D. Rapid extraction and high-performance liquid chromatography of chlorophylls and carotenoids from marine phytoplankton[J].
Journal of Chromatography A,1984, 294 : 281~295.
( 0) 0)
|
| 59 |
Hu Z, Anderson N J, Yang X, et al. Catchment-mediated atmospheric nitrogen deposition drives ecological change in two alpine lakes in SE Tibet[J].
Global Change Biology,2014, 20 (5) : 1614~1628.
( 0) 0)
|
| 60 |
Furlong E T, Carpenter R. Pigment preservation and remineralization in oxic coastal marine sediments[J].
Geochimica et Cosmochimica Acta,1988, 52 (1) : 87~99.
( 0) 0)
|
| 61 |
Hurley J P, Armstrong D E. Fluxes and transformations of aquatic pigments in Lake Mendota, Wisconsin[J].
Limnology and Oceanography,1990, 35 (2) : 384~398.
( 0) 0)
|
| 62 |
Hurley J P, Armstrong D E. Pigment preservation in lake sediments——A comparison sedimentary environments in Trout Lake, Wisconsin[J].
Canadian Journal of Fisheries and Aquatic Sciences,1991, 48 (3) : 472~486.
( 0) 0)
|
| 63 |
Porra R, Pfündel E, Engel N.
Metabolism and function of photosynthetic pigments. In:Jeffrey S W, Mantoura R F C, Wright S W eds. Phytoplankton Pigments in Oceanography:Guidelines to Modern Methods.[M]. Paris: UNESCO Publishing, 1997 : 85 ~126.
( 0) 0)
|
| 64 |
Jeffrey S W, Vesk M.
Introduction to marine phytoplankton and their pigment signatures. In:Jeffrey S W, Mantoura R F C, Wright S W eds. Phytoplankton Pigments in Oceanography:Guidelines to Modern Methods.[M]. Paris: UNESCO Publishing, 1997 : 37 ~84.
( 0) 0)
|
| 65 |
Repeta D J. Carotenoid diagenesis in recent marine sediments:Ⅱ. Degradation of fucoxanthin to loliolide.[J].
Geochimica et Cosmochimica Acta,1989, 53 (3) : 699~707.
( 0) 0)
|
| 66 |
Hopmans E C, Schouten S, Rijpstra W I C, et al. Identification of carotenals in sediments[J].
Organic Geochemistry,2005, 36 (3) : 485~495.
( 0) 0)
|
| 67 |
Repeta D J, Gagosian R B. Transformation reactions and recycling of carotenoids and chlorins in the Peru upwelling region(15°S, 75°W)[J].
Geochimica et Cosmochimica Acta,1984, 48 (48) : 1265~1277.
( 0) 0)
|
| 68 |
Squier A H, Hodgson D A, Keely B J. A critical assessment of the analysis and distributions of scytonemin and related UV screening pigments in sediments[J].
Organic Geochemistry,2004, 35 (s11-12) : 1221~1228.
( 0) 0)
|
| 69 |
Verleyen E, Hodgson D A, Sabbe K, et al. Late Holocene changes in ultraviolet radiation penetration recorded in an East Antarctic lake[J].
Journal of Paleolimnology,2005, 34 (2) : 191~202.
( 0) 0)
|
| 70 |
Helbling E W, Zaratti F, Sala L O, et al. Mycosporine-like amino acids protect the copepod Boeckella titicacae(Harding)against high levels of solar UVR[J].
Journal of Plankton Research,2002, 24 (3) : 225~234.
( 0) 0)
|
| 71 |
Tartarotti B, Baffico G, Temporetti P, et al. Mycosporine-like amino acids in planktonic organisms living under different UV exposure conditions in Patagonian lakes[J].
Journal of Plankton Research,2004, 26 (7) : 753~762.
( 0) 0)
|
| 72 |
Carreto J I, Carignan M O, Daleo G, et al. Occurrence of mycosporine-like amino acids in the red-tide dinoflagellate Alexandrium excavatum:UV-photoprotective compounds?[J].
Journal of Plankton Research,1990, 12 (5) : 909~921.
( 0) 0)
|
| 73 |
Ingalls A E, Whitehead K, Bridoux M C. Tinted windows:The presence of the UV absorbing compounds called mycosporine-like amino acids embedded in the frustules of marine diatoms[J].
Geochimica et Cosmochimica Acta,2010, 74 (1) : 104~115.
( 0) 0)
|
| 74 |
Mackey M D, Mackey D J, Higgins H W, et al. CHEMTAX user's manual:A program for estimating class abundances from chemical markers-application to HPLC measurements of phytoplankton pigments[J].
Marine Ecology Progress,1996, 144 (1) : 265~283.
( 0) 0)
|
| 75 |
Latasa M. Improving estimations of phytoplankton class abundances using CHEMTAX[J].
Marine Ecology Progress,2007, 329 (1) : 13~21.
( 0) 0)
|
| 76 |
Van den Meersche Karel, Soetaert Karline, Middelburg J J. A Bayesian compositional estimator for microbial taxonomy based on biomarkers[J].
Limnology and Oceanography: Methods,2008, 6 (3) : 190~199.
( 0) 0)
|
| 77 |
Browne J L.
Comparison of Chemotaxonomic Methods for the Determination of Periphyton Community Composition[M]. Florida: The Master Thesis of Florida Atlantic University, 2010 : 57 ~61.
( 0) 0)
|
| 78 |
Mary G, Perrott P S, Edmondson W T. Oscillaxanthin in the sediment of Lake Washington[J].
Limnology and Oceanography,1969, 14 (3) : 317~326.
( 0) 0)
|
| 79 |
Leavitt P R, Carpenter S R, Kitchell J F. Whole-lake experiments:The annual record of fossil pigments and zooplankton[J].
Limnology and Oceanography,1989, 34 (4) : 700~717.
( 0) 0)
|
| 80 |
Leavitt P R, Findlay D L. Comparison of fossil pigments with 20 years of phytoplankton data from eutrophic lake 227, experimental lakes area, Ontario[J].
Canadian Journal of Fisheries and Aquatic Sciences,1994, 51 (10) : 2286~2299.
( 0) 0)
|
| 81 |
Hall R I, Leavitt P R, Roberto Q, et al. Effects of agriculture, urbanization, and climate on water quality in the Northern Great Plains[J].
Limnology and Oceanography,1999, 44 (3) : 739~756.
( 0) 0)
|
| 82 |
Bianchi T S, Engelhaupt E, Mckee B A, et al. Do sediments from coastal sites accurately reflect time trends in water column phytoplankton?A test from Himmerfjärden Bay(Baltic Sea proper)[J].
Limnology and Oceanography,2002, 47 (5) : 1537~1544.
( 0) 0)
|
| 83 |
Bunting L, Leavitt P R, Gibson C E, et al. Degradation of water quality in Lough Neagh, Northern Ireland, by diffuse nitrogen flux from a phosphorus-rich catchment[J].
Limnology and Oceanography,2007, 52 (1) : 354~369.
( 0) 0)
|
| 84 |
Teresa B, Catalan J. Factors influencing the variability of pigments in surface sediments of mountain lakes[J].
Freshwater Biology,2007, 52 (7) : 1365~1379.
( 0) 0)
|
| 85 |
Guilizzoni P, Lami A.
Paleolimnology:Use of algal pigments as indicators. In:Bitton G ed. The Encyclopedia of Environmental Microbiology[M]. New York: John Wiley & Sons, 2003 : 2306 ~2317.
( 0) 0)
|
| 86 |
Fox D L. Biochemical fossils[J].
Science,1944, 100 (2589) : 111~113.
( 0) 0)
|
| 87 |
Daley R J. Experimental characterizaiton of lacustrine chlorophyll diagenesis.Ⅱ. Bacterial, viral and herbivore grazing effects[J].
Archiv fur Hydrobiologie,1973, 72 : 409~439.
( 0) 0)
|
| 88 |
Daley R J, Brown S R. Experimental characterization of lacustrine chlorophyll diagenesis.Ⅰ. Physiological and environmental effects[J].
Archiv fur Hydrobiologie,1973, 72 : 277~304.
( 0) 0)
|
| 89 |
Head E, Harris L R. Chlorophyll and carotenoid transformation and destruction by Calanus spp. grazing on diatoms[J].
Marine Ecology Progress,,1992, 86 (3) : 229~238.
( 0) 0)
|
| 90 |
Mayzaud P, Razouls S. Degradation of gut pigment during feeding by a subantarctic copepod:Importance of feeding history and digestive acclimation[J].
Limnology and Oceanography,1992, 37 (2) : 393~404.
( 0) 0)
|
| 91 |
Cary S C, Lovette J T, Perl P J, et al. A microencapsulation technique for introducing pure compounds in zooplankton diets[J].
Limnology and Oceanography,1992, 37 (2) : 404~413.
( 0) 0)
|
| 92 |
Leavitt P R, Brown S R. Effects of grazing by Daphnia on algal carotenoids:Implications for paleolimnology[J].
Journal of Paleolimnology,1988, 1 (3) : 201~213.
( 0) 0)
|
| 93 |
Berner R A. An idealized model of dissolved sulfate distribution in recent sediments[J].
Geochimica et Cosmochimica Acta,1964, 28 (9) : 1497~1503.
( 0) 0)
|
| 94 |
Chen N, Bianchi T S, Bland J M. Implications for the role of pre-versus post-depositional transformation of chlorophyll-a in the lower Mississippi River and Louisiana shelf[J].
Marine Chemistry,2003, 81 (1) : 37~55.
( 0) 0)
|
| 95 |
Westrich J T, Berner R A. Role of sedimentary organic matter in bacterial sulfate reduction:The G model tested[J].
Limnology and Oceanography,1984, 29 (2) : 236~249.
( 0) 0)
|
| 96 |
Li D, Yao P, Bianchi T S, et al. Historical reconstruction of organic carbon inputs to the East China Sea inner shelf:Implications for anthropogenic activities and regional climate variability[J].
The Holocene,2015, 25 (12) : 1869~1881.
( 0) 0)
|
| 97 |
Middelburg J J. A simple rate model for organic-matter decomposition in marine sediments[J].
Geochimica et Cosmochimica Acta,1989, 53 (7) : 1577~1581.
( 0) 0)
|
| 98 |
Sachs J P, Repeta D J, Goericke R. Nitrogen and carbon isotopic ratios of chlorophyll from marine phytoplankton[J].
Geochimica et Cosmochimica Acta,1999, 63 (9) : 1431~1441.
( 0) 0)
|
| 99 |
Higgins M B, Robinson R S, Casciotti K L, et al. A method for determining the nitrogen isotopic composition of porphyrins[J].
Analytical Chemistry,2009, 81 (1) : 184~192.
( 0) 0)
|
| 100 |
Chikaraishi Y, Kashiyama Y, Ogawa N O, et al. A compound-specific isotope method for measuring the stable nitrogen isotopic composition of tetrapyrroles[J].
Organic Geochemistry,2008, 39 (5) : 510~520.
( 0) 0)
|
| 101 |
Tyler J, Kashiyama Y, Ohkouchi N, et al. Tracking aquatic change using chlorin-specific carbon and nitrogen isotopes:The Last Glacial-Interglacial transition at Lake Suigetsu, Japan[J].
Geochemistry, Geophysics, Geosystems,2010, 11 (9) : 633~650.
( 0) 0)
|
| 102 |
Tani Y, Kurihara K, Nara F, et al. Temporal changes in the phytoplankton community of the southern basin of Lake Baikal over the last 24000 years recorded by photosynthetic pigments in a sediment core[J].
Organic Geochemistry,2002, 33 (12) : 1621~1634.
( 0) 0)
|
| 103 |
Chondrogianni C, Ariztegui D, Rolph T, et al. Millennial to interannual climate variability in the Mediterranean during the Last Glacial Maximum[J].
Quaternary International,2004, 122 (1) : 31~41.
( 0) 0)
|
| 104 |
Hodgson D A, McMinn A, Kirkup H, et al. Colonization, succession, and extinction of marine floras during a glacial cycle:A case study from the Windmill Islands(East Antarctica)using biomarkers[J].
Paleoceanography,2003, 18 (3) .
doi: 10.1029/2002PA000775 ( 0) 0)
|
| 105 |
Murphy S M, McCormick A, Eglinton G. Perhydro-beta-carotene in the Green River Shale[J].
Science,1967, 157 (3792) .
doi: 10.1126/science.157.3792.1040 ( 0) 0)
|
| 106 |
Lee C, Brocks J J. Identification of carotene breakdown products in the 1.64 billion year old Barney Creek Formation, McArthur Basin, Northern Australia[J].
Organic Geochemistry,2011, 42 (4) : 425~430.
( 0) 0)
|
| 107 |
Hodgson D A, Andrew M M, Helen K, et al. Colonization, succession, and extinction of marine floras during a glacial cycle:A case study from the Windmill Islands(East Antarctica)using biomarkers[J].
Paleoceanography,2003, 18 (3) : 12~1.
( 0) 0)
|
| 108 |
Tani Y, Nara F, Soma Y, et al. Phytoplankton assemblage in the Plio-Pleistocene record of Lake Baikal as indicated by sedimentary steryl chlorin esters[J].
Quaternary International,2009, 205 (1) : 126~136.
( 0) 0)
|
| 109 |
Moorhouse H L, McGowan S, Jones M D, et al. Contrasting effects of nutrients and climate on algal communities in two lakes in the Windermere catchment since the late 19th century[J].
Freshwater Biology,2014, 59 (12) : 2605~2620.
( 0) 0)
|
| 110 |
Michelutti N, Wolfe A P, Vinebrooke R D, et al. Recent primary production increases in arctic lakes[J].
Geophysical Research Letters,2005, 32 (19) : 307~323.
( 0) 0)
|
| 111 |
Leavitt P R, Schindler D E, Paul A J, et al. Fossil pigment records of phytoplankton in trout-stocked alpine lakes[J].
Canadian Journal of Fisheries and Aquatic Sciences,1994, 51 (11) : 2411~2423.
( 0) 0)
|
| 112 |
Hambright K D, Tamar Z, Werner E, et al. Exploitation and destabilization of a warm, freshwater ecosystem through engineered hydrological change[J].
Ecological Applications,2008, 18 (7) : 1591~1603.
( 0) 0)
|
| 113 |
McGowan S, Leavitt P R, Hall R I, et al. Interdecadal declines in flood frequency increase primary production in lakes of a northern river delta[J].
Global Change Biology,2011, 17 (2) : 1212~1224.
( 0) 0)
|
| 114 |
Vinebrooke R D, Hall R I, Leavitt P R, et al. Fossil pigments as indicators of phototrophic response to salinity and climatic change in lakes of Western Canada[J].
Canadian Journal of Fisheries and Aquatic Sciences,1998, 55 (3) : 668~681.
( 0) 0)
|
| 115 |
McGowan S, Juhler R K, Anderson N J. Autotrophic response to lake age, conductivity and temperature in two West Greenland lakes[J].
Journal of Paleolimnology,2008, 39 (3) : 301~317.
( 0) 0)
|
| 116 |
Leavitt P R, Findlay D L, Hall R I, et al. Algal responses to dissolved organic carbon loss and pH decline during whole-lake acidification:Evidence from paleolimnology[J].
Limnology and Oceanography,1999, 44 (3part2) : 757~773.
( 0) 0)
|
| 117 |
Scheffer M, Carpenter S, Foley J A, et al. Catastrophic shifts in ecosystems[J].
Nature,2001, 413 (6856) : 591~596.
( 0) 0)
|
| 118 |
Heather M, Leavitt P R, Jackson L J. Asynchronous onset of eutrophication among shallow prairie lakes of the Northern Great Plains, Alberta, Canada[J].
Global Change Biology,2016, 22 (1) : 271~283.
( 0) 0)
|
| 119 |
Taranu Z E, Irene G E, Leavitt P R, et al. Acceleration of cyanobacterial dominance in north temperate-subarctic lakes during the Anthropocene[J].
Ecology Letters,2015, 18 (4) : 375~384.
( 0) 0)
|
| 120 |
Holtgrieve G W, Schindler D E, Hobbs W O, et al. A coherent signature of anthropogenic nitrogen deposition to remote watersheds of the Northern Hemisphere[J].
Science,2011, 334 (6062) : 1545~1548.
( 0) 0)
|
| 121 |
Enders S K, Mark P, Silvio P, et al. Compound-specific stable isotopes of organic compounds from lake sediments track recent environmental changes in an alpine ecosystem, Rocky Mountain National Park, Colorado[J].
Limnology and Oceanography,2007, 53 (4) : 1468~1478.
( 0) 0)
|
| 122 |
Leavitt P R, Sanford P R, Carpenter S R, et al.
Annual fossil records of food-web manipulation In:Carpenter S R, KitcheIl J F eds. The Trophic Cascade in Lake Ecosystems[M]. New York: Cambridge University Press, 1993 : 278 ~309.
( 0) 0)
|
| 123 |
Smol J P. [J].
Sediments:An ecosystem's memory. In:Smol J P ed. Pollution of Lakes and Rivers.,2008 : 22~29.
( 0) 0)
|
| 124 |
孙伟伟, 沈吉, 张恩楼, 等. 日本大沼湖沉积物碳氮比值、 有机碳同位素特征及其近400年的古气候环境意义[J].
第四纪研究,2014, 34 (6) : 1306~1313.
Sun Weiwei, Shen Ji, Zhang Enlou, et al. Characteristics of organic stable carbon isotope and C/N ration of sediments in Lake Onuma, Japan and their environmental implicationd for the last 400 years[J]. Quaternary Sciences,2014, 34 (6) : 1306~1313. (  0) 0)
|
| 125 |
赵丽媛, 鹿化煜, 张恩楼, 等. 敦煌伊塘湖沉积物有机碳同位素揭示的末次盛冰期以来湖面变化[J].
第四纪研究,2015, 35 (1) : 172~179.
Zhao Liyuan, Lu Huayu, Zhang Enlou, et al. Lake-level and paleoenvironment variations in Yitang Lake(Northwestern China)during the past 23ka revealed by stable carbon isotopic composition of organic matter of lacustrine sediments[J]. Quaternary Sciences,2015, 35 (1) : 172~179. (  0) 0)
|
| 126 |
刘亚生, 常凤琴, 张虎才, 等. 云南腾冲青海湖泊沉积物物化参数的特点、 环境意义及末次冰消期以来气候环境变化[J].
第四纪研究,2015, 35 (4) : 922~933.
Liu Yasheng, Chang Fengqin, Zhang Hucai, et al. Environmental significance of physicochemical parameters of sediment and climate changes since the Late Glacial at Qinghai Lake of Tengchong County, Yunnan Province[J]. Quaternary Sciences,2015, 35 (4) : 922~933. (  0) 0)
|
| 127 |
孙博亚, 岳乐平, 赖忠平, 等. 14ka B.P. 以来巴里坤湖区有机碳同位素记录及古气候变化研究[J].
第四纪研究,2014, 34 (2) : 418~424.
Sun Boya, Yue Leping, Lai Zhongping, et al. Paleoclimate changes recorded by sediment organic carbon isotopes of Lake Barkol since 14ka B.P.[J]. Quaternary Sciences,2014, 34 (2) : 418~424. (  0) 0)
|
②. University of Chinese Academy of Sciences, Beijing 100049;
③. Second Institute of Oceanography, State Oceanic Administration (SOA), Hangzhou 310012;
④. Key Laboratory of Marine Ecosystem and Biogeochemistry, State Oceanic Administration(SOA), Hangzhou 310012)
Abstract
Lake ecosystem is one of the most important component of terrestrial ecosystem on the Earth. Lakes provide essential ecological services, such as drinking water, tourism and aesthetics to humans. However, it remains unclear that how the lake ecosystems would change under the current global change pressure. It is extremely important to understand how the lake ecosystems respond to climate change as well as human activities, which would be very helpful for predicting their future changes. In order to do this, it requires longer dataset than instrumental measurements and observation. Lake sediments contain valuable information on past changes in climate, environment, and ecosystems, which could be used to investigate the influence of climate and human activities on lake ecosystems. Sedimentary pigments have been proposed as useful proxy indicators for algae and bacterial populations. Pigments were biosynthesized by phytoplankton, photosynthetic bacteria and aquatic plants and were preserved long after the end of their life cycles, which could be used to study past changes in primary productivity, phytoplankton community. Recently, a number of pigments could be better separated by reversed-phase High Pressure Liquid Chromatography. Pigments degrade in both water column and sediments. Despite losses during deposition, such as exposure to light, oxygen and zooplankton grazing, sedimentary pigments have been shown to be well correlated with changes in phytoplankton abundance and community through time, so long as there is little change in lake regions. Sedimentary pigments could be used to study changes in phytoplankton community, climatic and other environmental changes, lake stratification and redox, UV radiation, trophic sate, acidification and food-web in lakes. Pigments are also used to investigate anthropogenic influence on lake ecosystem. In this paper, we reviewed the complexity of pigments from production to sediment burial, mathematical techniques for analysis of pigment data(using CHEMTAX software and R software with BCE package)and various decay models. We suggest that sedimentary pigments could work as valuable tools to study past changes in phytoplankton community. 2016, Vol.36
2016, Vol.36
