② 福建省湿润亚热带山地生态重点实验室——省部共建国家重点实验室 培育基地, 福州 350007;
③ Department of Environment and Geography, Macquarie University, Sydney NSW 2109, Australia)
1 引言
20世纪70年代Blakemore[1]首次正式报道了趋磁细菌(magnetotactic bacteria,简称MTB),在光学显微镜下水体环境中趋磁细菌沿外界磁场定向排列和游动,称之为趋磁性[2]。部分趋磁细菌沿磁力线向两个方向游动[3],属于轴向趋磁性(axial magnetotaxis),大部分趋磁细菌沿磁场向一个方向游动,属于极向趋磁性(polar magnetotaxis)[4]。对于极向趋磁细菌,游动方向与磁北方向一致的称之为趋北磁菌(north-seeking,简称NS),主要分布在北半球,而游动方向与磁北方向相反的称之为趋南磁菌(south-seeking,简称SS)[5, 6],主要分布在南半球,在赤道区域NS和SS比例接近[7]。趋磁细菌的趋磁性得益于其体内生物控制合成的纳米级的单畴磁性颗粒(磁铁矿或胶黄铁矿),称之为磁小体(magnetosomes),地质时期保存下来的磁小体称为化石磁小体(magnetofossils)[8, 9]。磁小体通常以单个或多个链排列,以此使磁矩最大化,磁小体链也是辨别沉积物中磁性颗粒生物成因的重要标志[10, 11]。趋磁细菌独特的趋磁性和磁小体特征使其在地球物理学、 磁学、 地理学和生物学等领域都有广泛的研究[11, 12, 13, 14]。
因为死的趋磁细菌同样沿磁场定向排列,但不游动,一般认为趋磁性只是使趋磁细菌被动地沿磁场排列,并不能感知磁场[15]。趋磁细菌在地球磁场强度范围内(25-65μT)水体环境中沿磁力线近乎完全排列[16, 17],由于沿磁场的定向排列,趋磁细菌寻找最佳生存环境的路径由三维立体模式变为沿磁场方向的一维模式,与非趋磁细菌相比降低了能量消耗,使其更有效地到达有利生存环境,被认为是趋磁性的基本优势[18]。此趋磁性优势依赖趋磁细菌沿地磁场相对较高的排列程度,但是目前对沉积物中趋磁细菌沿地磁场的排列程度还没有具体的实验数据支持。另外,趋磁细菌及化石磁小体已被证实在现代和地质时期广泛存在[11, 13]。化石磁小体具有独特的单畴颗粒大小[19],是记录古地磁信息的理想载体[16, 20],对现代沉积物中趋磁细菌沿磁场排列程度的认识是化石磁小体在古地磁研究应用中的基础。
与其他微生物相似,趋磁细菌游动受鞭毛驱动,具有化学趋向性(趋化性)。趋磁细菌通过鞭毛感知周围化学环境[21, 22],从而调整转动方向(顺时针或逆时针),确定游动方向。滴液中氧气浓度很快饱和,整体环境均一,不存在稳定的化学梯度,鞭毛感知均一的周围环境,只沿固定方向转动,因此极向趋磁细菌在滴液中只表现单一的游动方向[3],即NS与磁北方向相同,而SS与磁北方向相反。受趋化性影响,趋磁细菌因周围化学环境的变化而发生NS与SS的转变。极向趋磁性培养菌Magnetococus marinus(MC-1)在氧气浓度相对高的区域表现为NS,在氧气浓度低的区域表现为SS[3],但是使MC-1变换极性的氧气浓度阈值未知。然而,非培养趋磁细菌从饱和氧气环境到无氧环境中并未被观察到游动方向变化[23],可能对于非培养趋磁细菌这种氧气浓度阈值并不存在。趋磁细菌趋化性并不限于氧气条件,部分趋磁细菌因光[24, 25]、 氧化还原电位[26, 27]以及温度[24]等影响也会发生游动方向的变化。另外,趋磁细菌在沉积物中的分布与特定的化学条件(如pH、 S2-、 NO-3、 NH+4、 PO3-4、 Fe2+等)也没有显著的相关性[28, 29, 30, 31, 32],可能在自然沉积物中各化学条件之间相互作用,趋化性表现为一个整体,而不是某个或某些化学条件,因此对趋磁细菌趋化性的认识需要立足于沉积物环境。
自然界除少数趋磁细菌出现在富营养化的水体环境中[30],大部分主要生活在淡水或咸水环境的现代沉积物中[33]。与水体环境相比,沉积物环境对趋磁细菌的影响主要表现在两方面: 一方面是物理机械力影响,趋磁细菌在沉积物中受周围沉积物颗粒制约,从而不能自由沿磁场转动和游动,可能导致沿磁场排列程度降低,从而降低趋磁性优势; 另一方面是沉积物的化学环境使趋化性更为复杂,趋磁细菌因各种化学梯度的变化改变其游动方向(即NS与SS转变)。趋磁细菌在沉积物内的游动可以理解为趋磁性和趋化性综合作用的结果,游动的时间效率反映趋磁性优势,游动的方向反映趋化性影响。研究沉积物环境中趋磁性和趋化性面临的实际问题是,无法直接观察沉积物中的趋磁细菌,只有借助于间接方法。本研究介绍脉冲磁场方法在研究沉积物环境中趋磁细菌趋磁性和趋化性的应用,脉冲磁场方法曾用于获得单个趋磁细菌的剩磁和剩磁矫顽力[34, 35],也可用于改变趋磁细菌极性,实现NS与SS的转变[36]。除了个别特定环境中大量SS出现在北半球[26],北半球沉积物中以NS为主,本研究沉积物中NS与SS比例可达1000:1或不存在SS[16],我们利用脉冲磁场方法将部分NS转变成SS(以下称为脉冲SS),以脉冲SS为“示踪体”即可推断趋磁细菌在沉积物中沿磁场的排列程度和趋磁性与趋化性的相互作用。实验结果一方面可以验证水体环境中对趋磁细菌的认识是否适用于沉积物环境,另一方面为研究自然环境中趋磁细菌奠定基础。
2 材料与方法德国南部基姆湖(Chiemsee)(47°52′23″N,12°24′25″E) 含有丰富的趋磁细菌[37, 38],地磁场强度47μT,磁倾角 49°,趋磁细菌沿磁场总体向下游动。取湖底上部约20cm 沉积物,将其转移至实验室内数个30×20×20cm 玻璃缸内,充分搅匀后室温条件下沉积物重新分层,约一个月后沉积物趋于稳定,趋磁细菌主要出现在沉积物上部30mm 深度范围[39],其中以杆菌Candidatus Magnetobacterium bavaricum (以下简称MB)[40, 41]为优势种群,本文实验以MB为研究对象。MB包含有多条由子弹头状磁小体组成的磁小体链,平均磁矩为11.7×10-15Am2[16],沿磁北方向游动(NS),未观察到SS MB,表现为典型的极向趋磁性。趋磁细菌的镜下观察在仪器趋磁细菌磁性测量系统(Bacteriodrome)中进行[39],它主要由光学显微镜和两组亥姆霍兹(Helmholtz)线圈构成,在趋磁细菌观测区域形成均匀磁场B。脉冲磁场P由电容器控制一组亥姆霍兹线圈生成,单次脉冲在50微秒内磁场强度达到110mT。脉冲线圈置于外磁场线圈之内,使P与B可以保持任意角度。趋磁细菌沿B定向排列,当P与趋磁细菌磁矩 m 角度θ>90°时,脉冲磁场可以反转趋磁细菌磁矩[34],使趋磁细菌游动方向反转,实现NS向SS的转变。
水体环境中将NS转变为SS过程见示意图1a-1d。首先利用趋磁性使NS沿外界磁场B 完全排列和游动,其中磁小体链磁矩m沿磁力线排列(图1a); 此时对NS施加反方向强且持续时间短的脉冲磁场P,由于脉冲时间很短,磁矩m被瞬间反转(图1b)而趋磁细菌本身来不及随脉冲磁场旋转; 脉冲磁场P消失后,磁矩m仍要沿外界磁场B排列使磁菌发生180°旋转(图1c)。整个过程中鞭毛转动方向(顺时针或逆时针)并没有改变,趋磁细菌受鞭毛驱动便沿着与初始相反方向游动而变成了SS(图1d)。将外界磁场B与脉冲磁场P保持 0°-180°不同的角度,则会得到不同比例的SS(SS%=100%×SS/(NS+SS))。
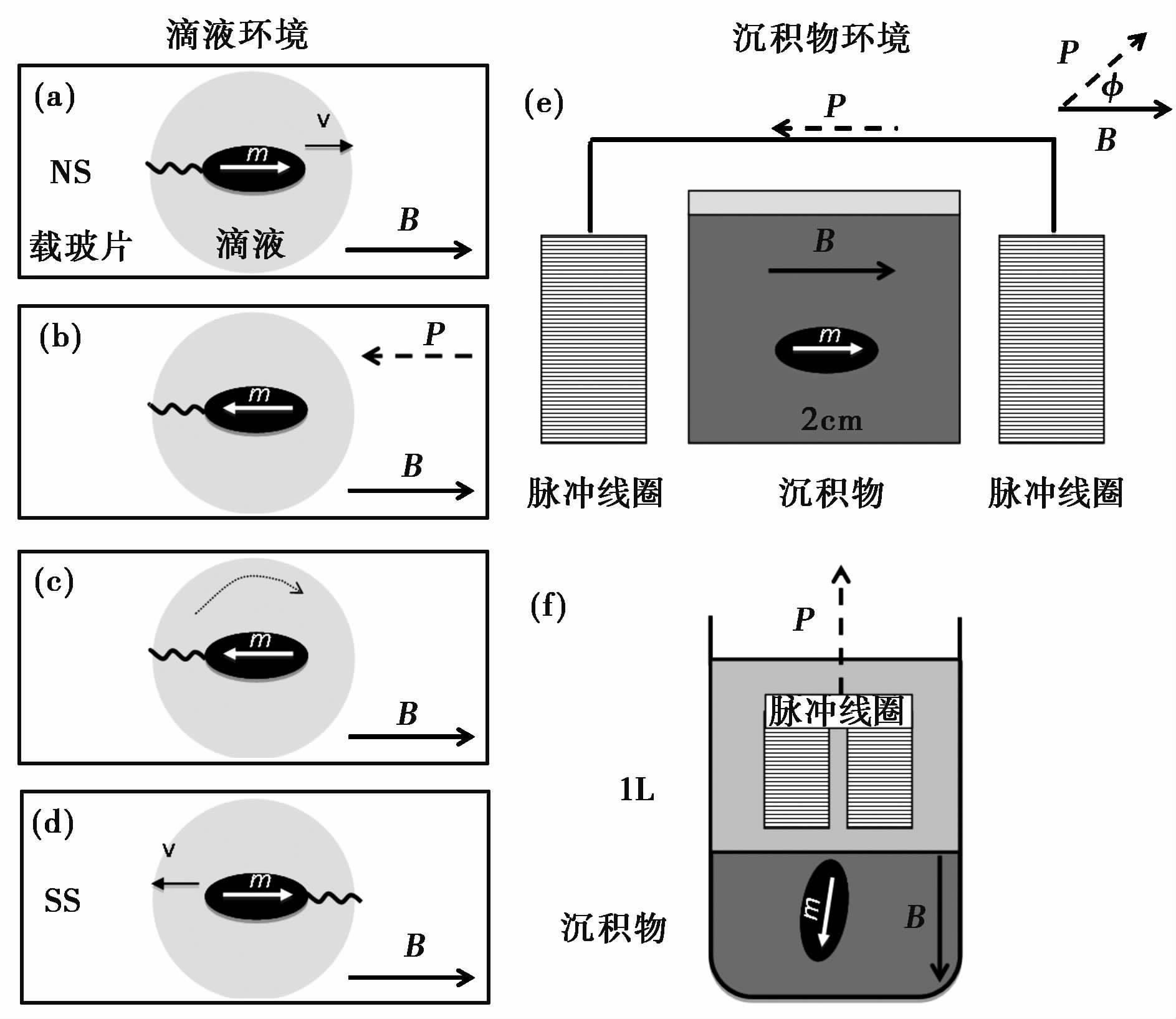
|
图1 脉冲磁场将水体环境(a-d)和沉积物环境中(e,f)NS转变为SS示意图 (a)滴液中NS磁矩m沿外界磁场B排列和游动(速度v); (b)施加反方向的脉冲磁场P,磁矩m被瞬间反转而趋磁细菌本身来不及随脉冲磁场转动;(c)脉冲磁场P消失后,磁矩m便旋转并沿磁场B排列;(d)由于鞭毛转动方向未变,趋磁细菌便沿着与磁场B相反方向游动,转变成了SS;(e)沉积物方体(2×2×2cm)置于脉冲线圈之间,脉冲磁场P与外界磁场B方向相反或保持一定角度Φ,施加脉冲磁场后部分NS转变为SS;(f)与(e)同,只是将脉冲线圈置于沉积物 (1L玻璃烧杯)上部,多次施加脉冲磁场后SS%可达50% Fig.1 Sketchs to demonstrate how pulsed magnetic field to convert NS into SS in water drop assays(a-d) and sediments environments(e,f),respectively. (a)A NS cell(magnetic moment m)is aligned and migrates(velocity v)along magnetic field B. (b)Given a pulsed magnetic field P in opposite direction to B,the magnetic moment m is instantly reversed before the cell is oriented by P. (c)After pulse,magnetic moment m and the cell rotates to re-align along B. (d)Due to unchanged flagella rotation,the cell swims in opposite direction as SS. (e)Sediment cube(2×2×2cm)containing MTB is placed between pulse Helmholtz coils,where the pulsed field P is kept at angel Φ or 180° with external magnetic field m. After pulse,part of NS cells are converted into SS. (f)Same as (e) except that pulse coils are placed over sediment in a glass beaker (1L). SS% is expected to be 50% after several times of pulse applications |
将沉积物环境中NS转变为SS过程与水体环境中相似,只是将脉冲磁场作用于沉积物,由于初始沉积物中没有SS,因此施加脉冲磁场后观察到的SS就是脉冲SS。根据实验需要,沉积物分两种情形: 沉积物方体(2×2×2cm)(图1e)和玻璃烧杯(1L)中沉积物(图1f),分别用于分析沉积物环境中趋磁细菌沿磁场的排列和趋化性作用。将脉冲线圈紧贴沉积物使脉冲磁场方向P与外界磁场B方向相反或保持一定角度Φ,施加脉冲磁场后从中取样,用水稀释制成滴液(图1a),显微镜下滴液两端分别数取NS和SS数量,并计算SS%。脉冲SS与南半球的SS有相同的游动特征,这些被标记的SS将作为“示踪”来分析沉积物环境中趋磁细菌趋磁性和趋化性特征。
3 脉冲磁场方法分析沉积物中MB沿磁场的排列程度水体环境中趋磁细菌游动受沉积物颗粒影响小,沿磁场的排列遵循Langevin法则[15, 17],见图2。趋磁细菌沿外界磁场的排列程度受其自身磁矩大小和外场强度影响,磁矩大的趋磁细菌(如MB)在弱磁场中(如5μT)即可以达到高的排列程度(cosθ=0.9),而磁矩小的趋磁细菌(如图2球菌)达到同样的排列程度需要磁场强度约50μT,自然界大部分趋磁细菌在地磁场范围内(25-65μT)沿磁场的排列程度达到>0.8[17]。沉积物中趋磁细菌沿磁场的排列程度无法直接观察,以下以MB为例利用脉冲磁场方法间接分析其在沉积物环境中的排列程度。
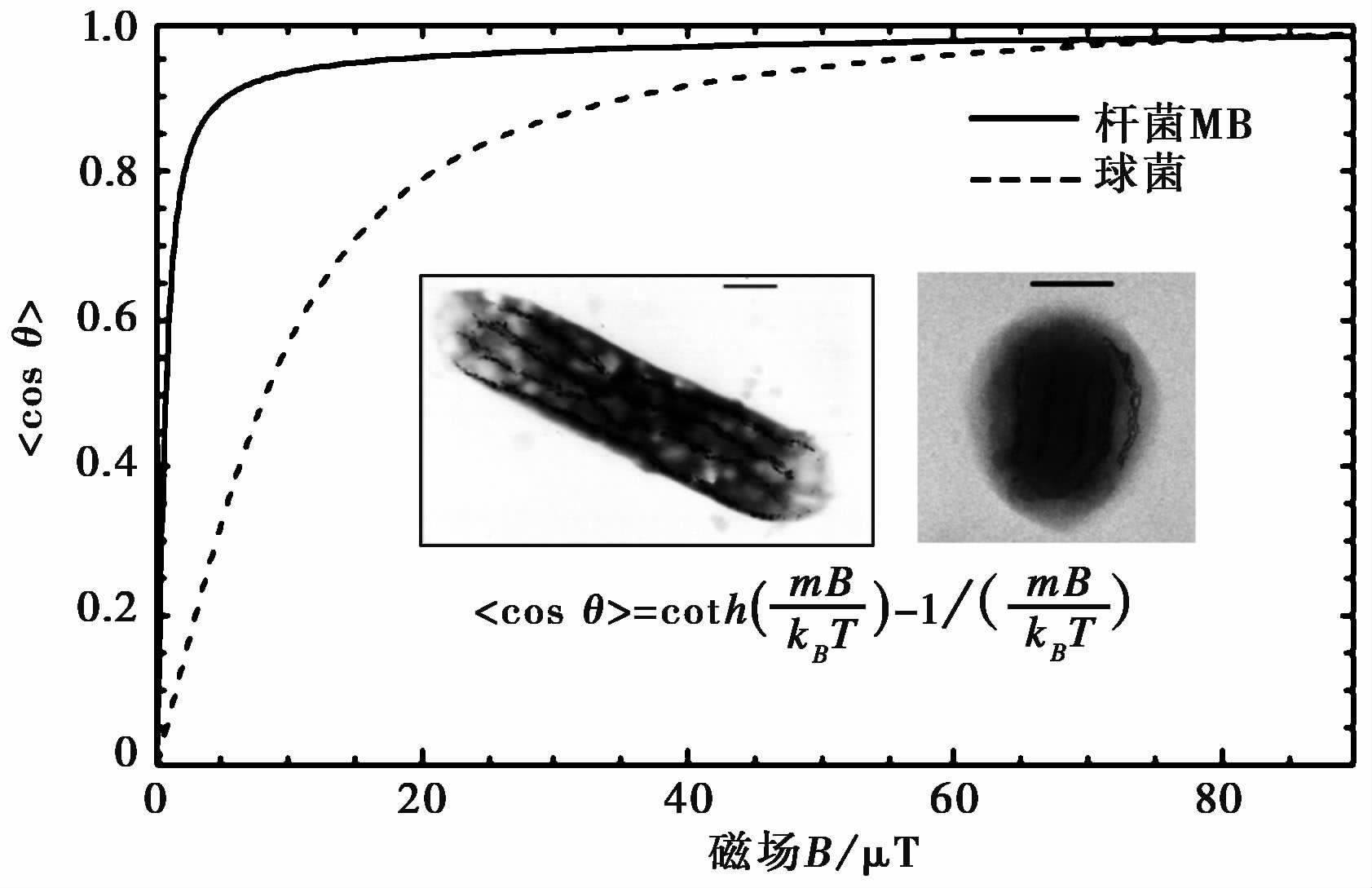
|
图2 两类趋磁细菌——杆菌MB(内插图)和球菌(内插图)在水体环境中沿外界磁场B的排列程度(cosθ)遵循Langevin方程(内插方程)[16] 其中m是趋磁细菌磁距,KB是玻尔兹曼常数1.38×10-23 J/K,T为温度,θ 是m和B的夹角,内插图标尺为1μm Fig.2 Magnetic alignment(cosθ)of MB and ovoid coccus(inserts)in water,which obey Langevin law(inserted equation)[16]. m denotes magnetic moment of magnetotactic bacteria. KB doneotes Boltzmann constant 1.38×10-23 J/K. T denotes temperature,and θ denotes angle between m and B.Inserted scale bar denotes 1μm |
利用脉冲磁场分析沉积物环境中MB沿外磁场的排列程度的实验主要分两部分: 已知排列程度的水体环境和未知排列程度的沉积物环境。首先,将含有趋磁细菌MB的滴液(40μL)置于水平磁场B(0.86mT)中,MB沿B完全排列(排列程度100%),如图1a。使B与脉冲磁场方向P 保持特定角度Φ(0°、 12.6°、 45°、 60°、 90°、 120°、 135°、 167.4°以及 180°,角度选择和间隔可以根据需要调整),理论上只有当Φ>90°时才有可能将NS转变为SS。由于Φ(90°-180°) 受脉冲磁场强度、 脉冲持续时间、 磁菌磁矩和磁小体链各向异性等影响,即使同一类型趋磁细菌(如MB)在体积和磁矩上也存在明显的个体差异,因此每次脉冲磁场后只有部分NS转变为SS。施加脉冲磁场后,NS和SS游向相反方向,在滴液两端直接数得NS与SS数量并计算SS%,用不同的滴液重复上述步骤得到不同Φ对应的SS%平均值,最终获得滴液环境中SS%随角度Φ的变化,见图3。

|
图3 施加脉冲磁场后趋磁细菌MB在水体和沉积物中SS%与Φ关系对比 误差线为标准偏差,Φ为外界磁场B与脉冲磁场P夹角,水体中MB沿磁场完全排列(100%),沉积物中MB 沿磁场排列程度近似模型3.2% Fig.3 SS% variation with Φ in water and sediment environments for MB. Error bar represents standard deviation of cell counts. Φ is the angel between external magnetic field and pulsed magnetic field. MB are fully aligned(100%)in water,while MB alignment in sediment is consistent with modeled 3.2% |
其次,沉积物方体(2×2×2cm)中MB沿水平磁场B(0.86mT)排列程度未知。图1e,将沉积物方体置于水平磁场B中,持续约20分钟以使MB沿磁场排列。使水平磁场B与脉冲磁场P保持角度Φ(0°、 12.6°、 45°、 60°、 90°、 120°、 135°、 167.4°以及 180°,角度选择和间隔可以根据需要调整),每次施加脉冲磁场后随机取其中3个相同样品分别制成滴液(40μL),在显微镜下直接数得NS和SS数量并计算SS%,为了统计上的代表性,对6个同样沉积物方体重复上述实验步骤,最终获得沉积物中SS%与Φ关系,见图3。
图3中,显微镜下观察到水体环境中MB沿外界磁场排列近似100%,SS出现在Φ>120°而不是理论上的Φ>90°,可能与脉冲持续时间相对较长有关。SS%随Φ(Φ>120°) 急骤增大,Φ=180°时,B与P方向相反,所有NS转变为SS。但是,与水体环境中不同,虽然沉积物环境中 SS%随Φ略有上升,但总体变化较小,Φ=0时,B与P方向相同,如果MB沿磁场排列程度较高,例如与水体环境相似,应该很少有SS出现,SS%接近于零,而实际SS%=13%。Φ=180°时,B与P方向相反,同样,如果MB沿磁场排列程度较高,应该大部分NS被转变成SS,而实际SS%=48%。因为当MB沿磁场方向完全随机排列时SS%不随Φ变化,沉积物中SS%随Φ变化较小说明MB沿外界磁场排列程度较低。
沉积物中MB沿磁场排列程度可以通过模型定量化估算,磁矩m与外界磁场B 夹角θ符合概率分布函数Von Mises-Fisher 分布,F(θ,κ)= ,其中κ=mB/(KBT),其中KB是玻尔兹曼常数1.38×10-23 J/K,T为温度。以水体中SS%与Φ关系为基础得到一系列不同的排列程度模型,与图3沉积物中的SS%曲线对比,沉积物中MB排列程度与模型排列程度3.2%最接近,模型分析详见文献[16]。如果沉积物中MB沿磁场方向排列遵循Langevin方程(图2),MB沿地磁场(平均50μT)的排列程度<1%。即使将实验误差考虑在内,同样可以认为MB在沉积物中沿磁场排列程度非常低。MB在沉积物中的低排列程度可能主要受控于其本身与沉积物颗粒间的机械力作用,显微镜下观察到当MB游动过程中遇到沉积物颗粒时,会暂时偏离沿磁场排列,从而绕过沉积物颗粒,也观察到MB游动过程中因沉积物颗粒制约而无法沿磁场排列。沉积物中空隙度更低,MB受周围沉积物颗粒局限可能导致无法沿磁场达到较高的排列程度。据此,可以推断在相对疏松沉积物中体积较小的趋磁细菌沿磁场的排列程度可能稍高,但都远远低于水体环境中。
,其中κ=mB/(KBT),其中KB是玻尔兹曼常数1.38×10-23 J/K,T为温度。以水体中SS%与Φ关系为基础得到一系列不同的排列程度模型,与图3沉积物中的SS%曲线对比,沉积物中MB排列程度与模型排列程度3.2%最接近,模型分析详见文献[16]。如果沉积物中MB沿磁场方向排列遵循Langevin方程(图2),MB沿地磁场(平均50μT)的排列程度<1%。即使将实验误差考虑在内,同样可以认为MB在沉积物中沿磁场排列程度非常低。MB在沉积物中的低排列程度可能主要受控于其本身与沉积物颗粒间的机械力作用,显微镜下观察到当MB游动过程中遇到沉积物颗粒时,会暂时偏离沿磁场排列,从而绕过沉积物颗粒,也观察到MB游动过程中因沉积物颗粒制约而无法沿磁场排列。沉积物中空隙度更低,MB受周围沉积物颗粒局限可能导致无法沿磁场达到较高的排列程度。据此,可以推断在相对疏松沉积物中体积较小的趋磁细菌沿磁场的排列程度可能稍高,但都远远低于水体环境中。
MB在沉积物中的低排列程度也得到了岩石磁学数据的支持。将沉积物方体在稳定地磁场环境(强度47μT,磁倾角 49°) 中缓慢变干,沉积物在变干的过程中,趋磁细菌死亡,磁小体沿地磁场的排列得以固定,趋磁细菌获得天然剩磁NRM,NRM与饱和等温剩磁(Mrs,1T磁场中获得)比值NRM/Mrs可以近似地作为磁小体沿地磁场的排列程度,结果NRM/Mrs=0.73%,与深海沉积物中化石磁小体的NRM/Mrs(为10-3)一致[42, 43, 44]。结果说明现代沉积物中部分趋磁细菌沿地磁场的排列在其死后和固结过程中可能仍保存较好,记录了其沉积过程中地磁场方向信息[16],是趋磁细菌或磁小体在古地磁研究应用的基础。
4 脉冲磁场方法分析MB在沉积物中的趋化性如引言所述,趋磁细菌游动方向受趋化性决定。受趋化性影响,趋磁细菌在沉积物中形成一定特征的垂直分布,垂直分布的变化反映趋磁细菌在沉积物中的游动。沉积物中化学环境复杂,即使同一沉积物中趋磁细菌时空分布差异也较大,毛学刚等[39]在实验室内对同一沉积物长期(约一年半)大量(共88个剖面)实际观测,获得了NS MB在沉积物中的平均垂直分布。MB主要分布在沉积物上部25mm深度范围内,此深度以下很少观察到MB,同时表现出MB典型的双峰分布特征[28, 40]: 分别在约5mm 和15mm 深度。虽然不同沉积物中趋磁细菌数量存在差异,但其垂直分布特征可以对比,本文即以此平均垂直分布为参照(图4 虚曲线),实验中将脉冲SS在特定磁场条件中的垂直分布与MB平均垂直分布对比,分析趋磁细菌在沉积物内的游动和趋化性特征。因为MB主要出现在<25mm深度,将<25mm深度认为是其有利生存环境,而>25mm深度为其不利生存环境。根据趋磁-趋化性原理[3],脉冲SS在<25mm表现为SS,游动方向与磁北方向相反,而在>25mm深度表现为NS,沿磁北方向游动。在此利用脉冲SS作为”示踪”,将脉冲SS置于有利或不利生存环境,在不同的磁场条件下通过脉冲SS在沉积物中的游动,分析趋磁细菌如何利用趋磁-趋化性从不利的生存环境(>25mm深度)到达有利的生存环境(<25mm深度)。

|
图4 不同磁场条件下脉冲SS垂直方向上的移动及其垂直分布 子图左侧为沉积物(M1-M4)中趋磁细菌所处层位和磁场环境,沉积物分为上下两部分:NS部分和脉冲SS部分(虚线为两层分界,25mm 或28mm),磁场B指向上、 指向下或水平方向; 子图右侧是对应条件下14天后SS MB的垂直分布(误差为MB数量算术平均值),水平点线为上下两部分沉积物分界线,虚曲线为地磁场(N)环境下NS MB平均分布[39] Fig.4 Vertical migration and vertical distributions of pulsed SS in various magnetic field directions in sediment microcosms(M1-M4). The left-hand side of each subfigure is MB location and magnetic field conditions. Sediment microcosm comprises of two parts:NS and pulsed reversed SS,where the boundary(dashed line)is at depth 25mm or 28mm. The magnetic field is set to point upward,downward and horizontally. The right-hand side is vertical distribution(error bar is square root of cell counts)of SS MB in corresponding conditions after 14 days. Horizontal dotted line denotes the boundary of the two parts,and dashed curve denotes NS MB mean vertical distribution in Earth magnetic field(N)obtained in another microcosm[39] |
沉积物置于1L玻璃烧杯中,由含有脉冲SS和原始NS的两部分沉积物组成,沉积物中皆以MB为主。采用图1f方法制备脉冲SS,首先准备下部沉积物(脉冲SS或NS)并使其沉积稳定,其上保持5-8cm水深,然后使另一部分稀释过的沉积物(NS或脉冲SS)缓缓沉积,由于水的缓冲作用,后期沉积物沉积过程中对下部沉积物扰动较小,两部分沉积物形成明显的界线,界线在25mm 或28mm深度。实验分为4种情形: 分别为脉冲SS位于<25mm深度,磁场指向上; 脉冲SS位于>25mm深度,磁场指向上; 脉冲SS位于>25mm深度,磁场指向下; 脉冲SS位于>25mm深度,磁场方向水平,其中磁场强度与当地地磁场强度近似,为48μT。为了避免采样过程中对沉积物环境扰动,进而影响结果的准确性,我们进行了控制实验,控制实验与目标实验设置相同,控制实验主要定性监测沉积物中是否出现SS、 何时出现SS和SS%的相对变化等,监测间隔从开始的2-4小时到后来的每天。这里需要考虑的是,一定时间后观察到的脉冲SS变化来自于初始的趋磁细菌,还是经过数次分裂繁殖后的趋磁细菌,即考虑趋磁细菌的分裂周期。目前对趋磁细菌分裂繁殖周期的认识仅限于培养菌[45, 46],由于培养液中具有趋磁细菌所需的充沛的生长条件,趋磁细菌分裂可在数小时完成[47, 48]。沉积物中生长条件远不及培养液环境,非培养趋磁细菌分裂繁殖周期较长,目前还没有见到对自然环境中非培养菌分裂周期的报道。根据毛学刚等[39]观察MB从近零磁场到地磁场数量变化推断,自然沉积物中MB的平均生长周期可能大于一个月或更长。但是,本文实验目的是检验MB受趋化性影响引起的游动方向变化,关键在于检测“示踪体”脉冲SS在沉积物中分布的变化,况且脉冲SS与可能新生成的SS都有相同的游动特征,因此我们更关注其在沉积物中分布的变化。根据控制实验观测,沉积物中脉冲SS垂直分布在14天左右基本稳定,鉴于此,我们在14天后对目标实验进行泥柱剖面采样,按2mm间隔切分并稀释成滴液,在显微镜下直接数得脉冲SS数量,进而获得脉冲SS的垂直分布。
图4a中脉冲SS位于<25mm深度,磁场方向指向上,相对于脉冲SS,这样就构置了与南半球自然SS相同的磁场和化学环境[5, 6]。14天后脉冲SS在沉积物上部的垂直分布与北半球地磁场中NS MB(图4虚曲线)有相似的垂直分布特征,脉冲SS表现出双峰特征,分别在4mm 和14mm深度形成峰值,在深度25mm以下MB较少,且此垂直分布特征在接下来至少两个月内保持稳定。此结果可以用现有趋磁-趋化理论解释[18],因为脉冲SS处于其适宜的生存环境(<25mm深度),且磁场方向指向上,与南半球SS相似,在趋磁性和趋化性作用下,SS游向沉积物并稳定于此适宜环境,没有观察到明显的垂直移动。然而,并不能确定MB在其适宜环境内部(<25mm范围)没有垂直移动,MB典型的双峰分部可能是其垂直移动的反映[39]。结果还进一步证实脉冲SS与南半球自然SS可能具有相似的趋磁-趋化性,也说明以脉冲SS作为“示踪”研究沉积物环境中趋磁细菌趋磁性和趋化性的可靠性。
沉积物环境中趋磁-趋化性的作用在于使趋磁细菌更有效地到达其适宜环境(如<25mm深度),在图4b-4d实验中将脉冲SS置于>25mm深度(非适宜环境),并分别在向上磁场、 向下磁场和水平磁场。由于沉积物上部没有SS,一定时间后出现在上部沉积物中的SS即为脉冲SS。在图4b实验中,第三天在沉积物表层(<5mm深度)已经观测到少量脉冲SS,14天后脉冲SS已全部出现在<25mm范围(图4b),其垂直分布特征与平均垂直分布相似,两峰值分别出现在6mm 和14mm深度,25mm深度以下脉冲SS很少。如果脉冲SS在>25mm 深度仍保持SS游动特征,即逆磁场方向而向下游动,那么不可能在上部沉积物中观察到脉冲SS。合理的解释是,脉冲SS在>25mm 深度表现为NS游动特征而沿磁场向上游动,说明受趋化性影响脉冲SS在下部沉积物中转变成NS,印证了趋磁-趋化性原理[3]。
图4c实验与图4b相似,差别在于磁场方向向下,脉冲SS处于不利的磁场条件和不利的化学环境。14天后获得40mm 深度脉冲SS垂直分布(图4c),脉冲SS主要集中在下部沉积物,只有少部分(31%)出现在界线上部5mm深度,32天后脉冲SS降为207,界线上部占20%。根据趋磁-趋化原理[3],脉冲SS在此环境中表现为NS而向下游动,会继续处于不利环境而无法生存,这是脉冲SS数量减少的主要原因。少部分脉冲SS到达两层沉积物界限之上可以排除扰动的影响,可能说明部分MB在特定条件下有改变其极性的内在能力,即在此环境中部分脉冲SS仍表现为SS而向上游动。毛学刚等[39]观察到MB在长期(6个月)近零磁场中数量降低,但并不消失,可能说明MB有更强的环境适应能力。
图4d实验中脉冲SS处于>28mm深度的不利化学环境,处于水平磁场之中。14天后在沉积物上部检测到脉冲SS,其垂直分布见图4d,脉冲SS数量明显下降,并且沿磁场方向的沉积物两侧并没有观察到脉冲SS的富集。此实验中,水平磁场并不对趋磁细菌的垂直移动产生贡献,脉冲SS出现在<28mm深度说明其移动主要受垂直方向上趋化性的影响。但是与向上磁场相比(图4b),脉冲SS到达有利生存环境的时间更长并伴随数量骤减,说明失去趋磁性贡献后MB利用趋化性的效率明显降低,体现了趋磁性优势在于使趋磁细菌更有效地到达最佳生存环境。
此部分实验相对直观地展示了沉积物中趋磁细菌在不同磁场环境中的移动,反映了沉积物环境中趋磁性和趋化性作用,一方面证实了趋化性决定趋磁细菌游动方向,即不同化学环境条件下SS与NS之间的转换; 另一方面证实了趋磁性的优势在于使趋磁细菌更有效地到达最佳生存环境。
5 结论与展望本文介绍了脉冲磁场方法在研究沉积物环境中趋磁细菌趋磁性和趋化性的应用,利用脉冲磁场反转NS趋磁细菌极性,以反转的SS为“示踪体”,较为直观地展示了沉积物环境中的趋磁细菌沿磁场的排列程度和游动,证实了沉积物环境中: 趋磁细菌沿磁场排列程度低; 趋磁细菌游动方向受趋化性决定,不同化学环境条件下实现NS与SS转变; 趋磁性的优势在于使趋磁细菌更有效地到达最佳生存环境。
脉冲磁场反转趋磁细菌极性的方法易于操作,可行性强,实验结果有利于更好地理解沉积物环境中趋磁细菌或化石磁小体等关键问题。趋磁细菌和化石磁小体已被证实在现代和地质时期广泛存在[11, 13],是记录古地磁信息的理想载体[16, 20, 49],以化石磁小体沿地磁场的排列为基础可检验有机(化石磁小体)和无机(碎屑成因)磁性颗粒记录地磁场信息的一致性[16]。地质时期最早的疑似化石磁小体可追溯到30多亿年前[50],趋磁细菌在地质时期也必将经历磁场的多次倒转,趋磁细菌如何演化从而适应磁场变化还不清楚,本文实验(图4c)显示部分SS MB在倒转磁场和不利生存条件下仍能生存下来,可能说明MB这种较老的趋磁细菌[40]有很强的适应能力。以本文实验为基础,可利用脉冲磁场方法研究不同类型的趋磁细菌在趋磁性和趋化性上可能存在的差异[39, 51]。NS和SS分别主要出现在北半球和南半球,在赤道附近两者比例相似,其极性可能受磁场影响,另一方面,趋磁细菌也因化学条件变化实现NS和SS之间的转变,本文实验方法可能为研究趋磁细菌极性的决定因素有所启发。现代沉积物中趋磁细菌主要分布在上部数厘米[23],其分布受氧化-还原电位、 有机质、 氧气浓度多种环境要素的影响[23, 27, 28, 52],本文将趋化性作为整体考虑,可为研究趋磁细菌与环境要素之间关系提供参考。
致谢 感谢奥地利气象与地球动力研究中心 Ramon Egli和慕尼黑大学地球物理系Nikolai Petersen 教授实验过程中的指导和讨论; 感谢审稿老师提出的宝贵意见。
| 1 | Blakemore R P. Magnetotactic bacteria. Science, 1975, 190(4212):377-379 |
| 2 | Blakemore R P. Magnetotactic bacteria. Annual Review of Biophysics, 1982, 36(1):217-238 |
| 3 | Frankel R B, Bazylinski D A, Johnson M S et al. Magneto-aerotaxis in marine coccoid bacteria. Biophysical Journal, 1997, 73(2):994-1000 |
| 4 | Frankel R B, Bazylinski D A. Magnetosomes and magneto-aerotaxis. Contributions to Microbiology, 2009, 16:182-193 |
| 5 | Blakemore R P, Frankel R B, Kalmijn A J. South-seeking magnetotactic bacteria in the southern hemisphere. Nature, 1980, 286:384-385 |
| 6 | Kirschvink J L. South seeking magnetotactic bacteria. The Journal of Experimental Biology, 1980, 86(1):345-347 |
| 7 | Frankel R B, Blakemore R P, Torres de Araujo F F et al. Magnetotactic bacteria at the geomagnetic Equator. Science, 1981, 212(4):1269-1270 |
| 8 | Kind J, Gehring A U, Winklhofer M et al. Combined use of magnetometry and spectroscopy for identifying magnetofossils in sediments. Geochemistry, Geophysics, Geosystems, 2011, 12(8):Q08008 |
| 9 | Li J, Wu W, Liu Q et al. Magnetic anisotropy, magnetostatic interactions and identification of magnetofossils. Geochemistry, Geophysics, Geosystems, 2012, 13(10):Q10Z51 |
| 10 | Egli R, Chen A P, Winklhofer M et al. Detection of noninteracting single domain particles using first-order reversal curve diagrams. Geochemistry, Geophysics, Geosystems, 2010, 11(1):Q01Z11 |
| 11 | Roberts A P, Chang L, Heslop D et al. Searching for single domain magnetite in the "pseudo-single-domain" sedimentary haystack:Implications of biogenic magnetite preservation for sediment magnetism and relative paleointensity determinations. Journal of Geophysics Research, 2012, 117(B8):B08104 |
| 12 | Faivre D, Schüler D. Magnetotactic bacteria and magnetosomes. Chemical Reviews, 2008, 108(11):4875-4898 |
| 13 | Kopp R E, Kirschvink J L. The identification and biogeochemical interpretation of fossil magnetotactic bacteria. Earth-Science Reviews, 2008, 86:42-61 |
| 14 | Lin W, Bazylinski D A, Xiao T et al. Life with compass:Diversity and biogeography of magnetotactic bacteria. Environmental Microbiology, 2013, 16(9):2646-2658 |
| 15 | Esquivel D M S, De Barros H G P. Motion of magnetotactic microorganisms. Journal of Experimental Biology, 1986, 121(1):153-163 |
| 16 | Mao X, Egli R, Petersen N et al. Magnetotaxis and acquisition of detrital remanent magnetization by magnetotactic bacteria in natural sediment:First experimental results and theory. Geochemistry, Geophysics, Geosystems, 2014, 15(1):255-283 |
| 17 | Frankel R B. Magnetic guidance of organisms. Annual Review of Biophysics and Bioengineering, 1984, 13(1):85-103 |
| 18 | Bazylinski D A, Frankel R B. Magnetosome formation in prokaryotes. Nature Review Microbiology, 2004, 2(3):217-230 |
| 19 | Petersen N, von Dobeneck T, Vali H. Fossil bacterial magnetite in deep-sea sediments from the South Atlantic Ocean. Nature, 1986, 320(6063):611-615 |
| 20 | Paterson G A, Wang Y, Pan Y. The fidelity of paleomagnetic records carried by magnetosome chains. Earth and Planetary Science Letters, 2013, 383:82-91 |
| 21 | Larsen S H, W. Reader R, Kopt E N et al. Change in direction of flagellar rotation is the basis of the chemotactic response in Escherichia coli. Nature, 1974, 249:74-77 |
| 22 | Zhang W J, Santini C L, Bernadac A et al. Complex spatial organization and flagellin composition of flagellar propeller from marine magnetotactic ovoid strain MO-1. Journal of Molecular Biology, 2012, 416(4):558-570 |
| 23 | 毛学刚, 刘秀铭. 沉积物中非培养趋磁细菌与氧气关系初探. 科学通报, 2015, 60(1):88~96 Mao Xuegang, Liu Xiuming. An initial study of the influences of oxygen conditions on wild-type magnetotactic bacteria in sediment. Chinese Science Bulletin, 2015, 60(1):88~96 |
| 24 | Chen C, Ma Q, Jiang W et al. Phototaxis in the magnetotactic bacterium Magnetospirillum magneticum strain AMB-1 is independent of magnetic fields. Applied Microbiology and Biotechnology, 2011, 90(1):269-275 |
| 25 | Shapiro O H, Hatzenpichler R, Buckley D H et al. Multicellular photo-magnetotactic bacteria. Environmental Microbiology Reports, 2011, 3(2):233-238 |
| 26 | Simmons S L, Bazylinski D A, Edwards K J. South-seeking magnetotactic bacteria in the Northern Hemisphere. Science, 2006, 311(5759):371-374 |
| 27 | Zhang W J, Chen C, Li Y et al. Configuration of redox gradient determines magnetotactic polarity of the marine bacteria MO-1. Environmental Microbiology Reports, 2010, 2(5):646-650 |
| 28 | Jogler C, Niebler M, Lin W et al. Cultivation-independent characterization of "Candidatus Magnetobacterium bavaricum" via ultrastructural, geochemical, ecological and metagenomic methods. Environmental Microbiology, 2010, 12(9):2466-2478 |
| 29 | Kim B Y, Kodama K P, Moeller R E. Bacterial magnetite produced in water column dominates lake sediment mineral magnetism:Lake Ely, USA. Geophysical Journal International, 2005, 163(1):26~37 |
| 30 | Moskowitz B M, Bazylinski D A, Egli R et al. Magnetic properties of marine magnetotactic bacteria in a seasonally stratified coastal pond(Salt Pond, MA, USA). Geophysical Journal International, 2008, 174(1):75~92 |
| 31 | Simmons S L, Sievert S M, Frankel R B et al. Spatiotemporal distribution of marine magnetotactic bacteria in a seasonally stratified coastal salt pond. Applied Environmental Microbiology, 2004, 70(10):6230-6239 |
| 32 | Wang Y, Lin W, Li J et al. High diversity of magnetotactic deltaproteobacteria in a freshwater niche. Applied and Environmental Microbiology, 2013, 79(8):2813-2817 |
| 33 | 林巍, 潘永信. 趋磁细菌多样性及其环境意义. 第四纪研究, 2012, 32(4):567~575 Lin Wei, Pan Yongxin. Diversity of magnetotactic bacteria and its implications for environment. Quaternary Sciences, 2012, 32(4):567~575 |
| 34 | Hanzlik M, Winklhofer M, Petersen N. Pulsed-field-remanence measurements on individual magnetotactic bacteria. Journal of Magnetism and Magnetic Materials, 2002, 248:258-267 |
| 35 | Penninga I, de Waard H, Moskowitz B M et al. Remanence measurements on individual magnetotactic bacteria using a pulsed magnetic field. Journal of Magnetism and Magnetic Materials, 1995, 149(3):279-286 |
| 36 | Kalmijn A J. Biophysics of geomagnetic field detection. IEEE Transactions on Magnetics, 1981, 17(1):1113-1124 |
| 37 | 刘植, 刘秀铭, 李平原等. 德国 Chiemsee湖磁性细菌干湖泥的磁学性质. 第四纪研究, 2012, 32(4):820~824 Liu Zhi, Liu Xiuming, Li Pingyuan et al. The magnetic properties of the bacterial sediments in Lake Chiemsee, Germany. Quaternary Sciences, 2012, 32(4):820~824 |
| 38 | Pan Y, Petersen N, Winklhofer M et al. Rock magnetic properties of uncultured magnetotactic bacteria. Earth and Planetary Science Letters, 2005, 237:311-325 |
| 39 | 毛学刚, 刘秀铭, Egli Ramon等. 沉积物中趋磁细菌趋磁性优势的实验研究. 第四纪研究, 2014, 34(3):474~490 Mao Xuegang, Liu Xiuming, Egli Ramon et al. An experimental study of magnetotaxis advantages of magnetotactic bacteria in sediment. Quaternary Sciences, 2014, 34(3):474~490 |
| 40 | Spring S, Amann R, Ludwig W et al. Dominating role of an unusual magnetotactic bacterium in the microaerobic zone of a freshwater sediment. Applied and Environmental Microbiology, 1993, 59(8):2397-2403 |
| 41 | Hanzlik M, Winklhofer M, Petersen N. Spatial arrangement of chains of magnetosomes in magnetotactic bacteria. Earth and Planetary Science Letters, 1996, 145(1):125-134 |
| 42 | Bishop S, Egli R. Discovery prospects for a supernova signature of biogenic origin. Icarus, 2011, 212(2):960-962 |
| 43 | Yamazaki T, Yamamoto Y, Acton G et al. Rock-magnetic artifacts on long-term relative paleointensity variations in sediments. Geochemistry, Geophysics, Geosystems, 2013, 14(1):29-43 |
| 44 | Mcneill D F, Kirschvink J L. Early dolomitization of platform carbonates and the prservation of magnetic polarity. Journal of Geophysical Research, 1993, 98(B5):7977-7986 |
| 45 | Greene S E, Komeili A. Biogenesis and subcellular organization of the magnetosome organelles of magnetotactic bacteria. Current Opinion in Cell Biology, 2012, 24:490-495 |
| 46 | Lin W, Pan Y. Snapping magnetosome chains by asymmetric cell division in magnetotactic bacteria. Molecular Microbiology, 2011, 82(6):1301-1304 |
| 47 | Staniland S S, Moisescu C, Benning L G. Cell division in magnetotactic bacteria splits magnetosome chain in half. Journal of Basic Microbiology, 2010, 50(4):392-396 |
| 48 | Yang C D, Takeyama H, Tanaka T et al. Effects of growth medium composition, iron sources and atmospheric oxygen concentrations on production of luciferase-bacterial magnetic particle complex by a recombinant Magnetospirillum magneticum AMB-1. Enzyme and Microbial Technology, 2001, 29(1):13-19 |
| 49 | Larrasoa à J C, Liu Q, Hu P et al. Paleomagnetic and paleoenvironmental implications of magnetofossil occurrences in Late Miocene marine sediments from the Guadalquivir basin, SW Spain. Frontiers in Microbiology, 2014, 5(71):1-15 |
| 50 | Chang S B R, Kirschvink J L. Magnetofossils, the magnetization of sediments, and the evolution of magnetite biomineralization. Annual Reviews of Earth Planet Science, 1989, 17:169-195 |
| 51 | Lefèvre C T, Bennet M, Landau L et al. Diversity of magneto-aerotactic behaviors and oxygen sensing mechanisms in cultured magnetotactic bacteria. Biophysical Journal, 2014, 107(2):527-538 |
| 52 | Yamazaki T, Kawahata H. Organic carbon flux controls the morphology of magnetofossils in marine sediments. Geology, 1998, 26(12):1064-1066 |
② Key Laboratory for Subtropical Mountain Ecology(Ministry of Science and Technology and Fujian Province Funded), Fuzhou 350007;
③ Department of Environment and Geography, Macquarie University, Sydney NSW 2109, Australia)
Abstract
Magnetotactic bacteria(MTB) in water drop assays can be conveniently observed under optical microscope, i.e. MTB are aligned by magnetic field and migrate along field lines.The current knowledge about MTB and magnetotaxis are basically attributed to the observations in water under optical microscope.However, MTB mainly live in sediment, which differs a lot from water environment in physical and chemical conditions.Lacking knowledge of MTB in sediment hinders one's profound understanding of magnetotactic advantages, chemotaxis and paleomagnetic implication.The challenge of studying MTB in sediment is that MTB are impossible to be directly observed.Herein we proposed the application of pulsed magnetic field in studying MTB magnetotaxis and chemotaxis in sediment environments.MTB, more specifically rod-shaped Candidatus Magnetobacterium bavaricum(MB) collected from lake Chimsee in south of Germany, are north-seeking(NS) cells by swimming parallel to external magnetic field B(0.86mT).The NS cells aligned with B were imposed by a strong(maximum 110mT) and short(50ms) pulsed magnetic field P in opposite direction to B. Consequently NS were converted to SS(termed pulsed SS), swimming in opposite direction with NS.These pulsed SS cells were treated as tracers in initially SS-exclusive sediment for the purpose to investigate magnetotaxis(i.e. MB alignment) and chemotaxis(i.e. MB migration) in sediment.
In the first experiment, water drop assays and sediment cube with NS MB were respectively imposed by P at the angle Φ(0°~180°) with B. After each pulse, SS% defined as 100%×SS/(NS+SS) was obtained by respectively counting NS and SS numbers in two sides of the water drop assay.The variations of SS% versus Φ were modeled with Von-Mises Fisher distribution, which gave a best-fit alignment degree 3.2% for MB in sediment.Provided MB obeyed Langevin law, MB alignment in present geomagnetic field(e.g. 50μT) was expected as low as <1%, much lower than that in water(>90%).MTB low alignment degree was supported by rock magnetic measurements(e.g.NRM/Mrs=10-3) and conformed applications of MTB or magnetofossils in paleomagnetism.
In the second experiment, pulsed SS were placed in different configurations of chemical conditions, i.e. favorable(<25mm depth) or unfavorable(>25mm depth) conditions, and magnetic field settings, i.e. magnetic field pointing upward, downward or horizontal.Pulsed SS vertical migration was derived from change of vertical distribution.It was demonstrated that pulsed SS altered swimming polarity according to chemical conditions(i.e. chemotaxis) by switching between NS and SS states.In addition, results intuitively confirmed magnetotactic advantage:Effectively facilitating MTB to reach optimal living condition.These results verified the theory of magneto-chemotaxis in sediment environment.
 2016, Vol.36
2016, Vol.36

