1 引言
浮游有孔虫作为古海洋、 古气候研究的重要替代性指标,在重建地层年龄框架[1, 2, 3, 4]、 恢复古海水温度、 盐度[5, 6, 7]以及pH值[8]等方面应用广泛。了解现代浮游有孔虫的生态属性及其壳体地球化学参数是其古海洋学应用的基础,但是,南海目前所用的参数或公式很多还是基于其他海区的研究。为了更准确地用古海洋指标反映当地的环境变化,势必要在南海获得自己的相关参数,浮游有孔虫的现代调查正好能够为我们提供包括其生活水深、 季节分布、 壳体化学性质等重要信息[9]。
现代浮游有孔虫与海洋环境关系的研究,主要有4种途径: 实验室培养、 沉积物捕获器、 泵水取样、 浮游拖网取样。通过捕获浮游有孔虫在实验室培养,可以定量的研究不同环境参数,如温盐、 光照、 营养盐等对浮游有孔虫生长的影响。如Spero和Lea[10]通过改变光照条件,发现Globigerinoides sacculifer随光照强度增加,其壳体变得大而重。但是实验室的环境与海洋环境还是有很大差别,还需要借助现场观测数据来验证。沉积物捕获器可以获得连续时间序列的浮游有孔虫,研究浮游有孔虫的季节、 年际变化[11, 12, 13]。但是其捕获的浮游有孔虫基本上是死亡个体,也有可能是海流带来的,再者,捕获器不能反映各浮游有孔虫的生活水深。泵水取样只能取得某一特定水层的浮游有孔虫。浮游生物拖网,特别是最近广泛用于海洋生态研究的多通道连续浮游生物拖网,可以根据自身研究目的设定不同水深层位,获得设定水深的浮游有孔虫样品,这样就能直接观测到浮游有孔虫在水体中的垂直分布。
大西洋、 印度洋做过生物拖网的相关工作[14, 15]。而在南海、 甚至整个西太平洋的拖网研究都不多[16, 17, 18, 19],很多关于浮游有孔虫生活水深的常识来自于其他海区的拖网研究。本次研究尝试利用南海北部浮游有孔虫的垂直拖网样品,结合实测温盐资料及后期实验室测得的代表性属种壳体的氧碳同位素信息,来共同探讨南海北部春、 秋季浮游有孔虫的垂直分布情况,及其与海洋环境的关系,进而为南海古海洋研究提供参数依据。
2 材料和方法 2.1 材料来源和处理方法本次研究的材料来源于国家自然科学基金委组织的2013年4月南海北部春季开放航次(搭乘中国海洋大学“东方红2号”,共3个站位)和2013年10月南海北部秋季开放航次(搭乘中国科学院南海研究所“实验3号”,共10个站位)。在这13个站位中,利用德国HYDRO-BIOS公司生产的MultiNet中型浮游生物分层拖网取得样品。该拖网网口面积0.25m2,网径100μm。到达采样站位后,通过绞车将生物拖网下放到250m水深以下,分别采集0~50m、 50~100m、 100~150m、 150~200m和200~250m水层中的浮游有孔虫。采样之前进行随船温盐深测量仪(CTD)的现场数据采集,采样站位信息见表 1。
| 表 1 采样站位信息 Table 1 Locations,dates,and water depth of plankton tow sampling |
将不同层位采集得到的样品装入不同的广口塑料盒,在船上实验室立刻加入无水乙醇,防止浮游有孔虫原生质分解对壳体化学性质的影响。并加入虎红进行染色,以区分浮游有孔虫活体和死亡的浮游有孔虫壳体[20]。处理好的样品放入冰箱低温保存(2~4℃)。返回实验室后,将样品用2mm孔径大小的网筛过筛,去掉虾皮等较大体型生物的壳体,再用150μm标准筛过筛,经烘箱烘干后将染成红色的浮游有孔虫壳体挑出备用。
本次工作对所有样品进行了浮游有孔虫属种统计分析,部分样品挑出做氧、 碳稳定同位素测试。分析样品在15%浓度的H2O2溶液中浸泡20分钟,然后用甲醇冲洗,去除壳体中的有机质。样品的预处理和测试均在同济大学海洋地质国家重点实验室完成,采用MAT253稳定同位素质谱仪和Kiel IV碳酸盐进样装置测试,分析精度和实验流程详见相关文献[21]。
2.2 碳酸钙壳体δ18Oc估算碳酸钙生物壳体的氧同位素 δ18O可以作为“地质测温计”的前提是其壳体随着温度的变化始终与海水保持同位素平衡[1]。假设海水碳酸盐物质与海水同位素始终保持平衡,其碳酸钙氧同位素(δ18Oc)可以根据海水温盐信息估算出来,从而可以用来判断不同属种浮游有孔虫壳体与海水同位素的关系。
现代海水盐度(S)和海水氧同位素(δ18Osw)有这样的关系[22]:
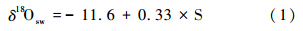
据前人资料[23, 24],海水碳酸盐物质与海水达到平衡时的氧同位素值 δ18Oc与海水温度T之间有如下关系:
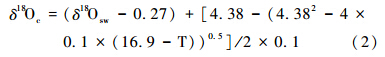
那么,根据(1)和(2)可以推算出碳酸钙壳体 δ18Oc和海水温度、 盐度的关系式:
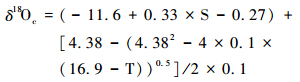
而研究站位的海水盐度S和温度T数据可以在随船实测的CTD得到。这样,在0~250m水层中,我们估算了13个水层的 δ18Oc,包括10m、 20m、 40m、 60m、 80m、 100m、 120m、 140m、 160m、 180m、 200m、 220m和240m 水层。
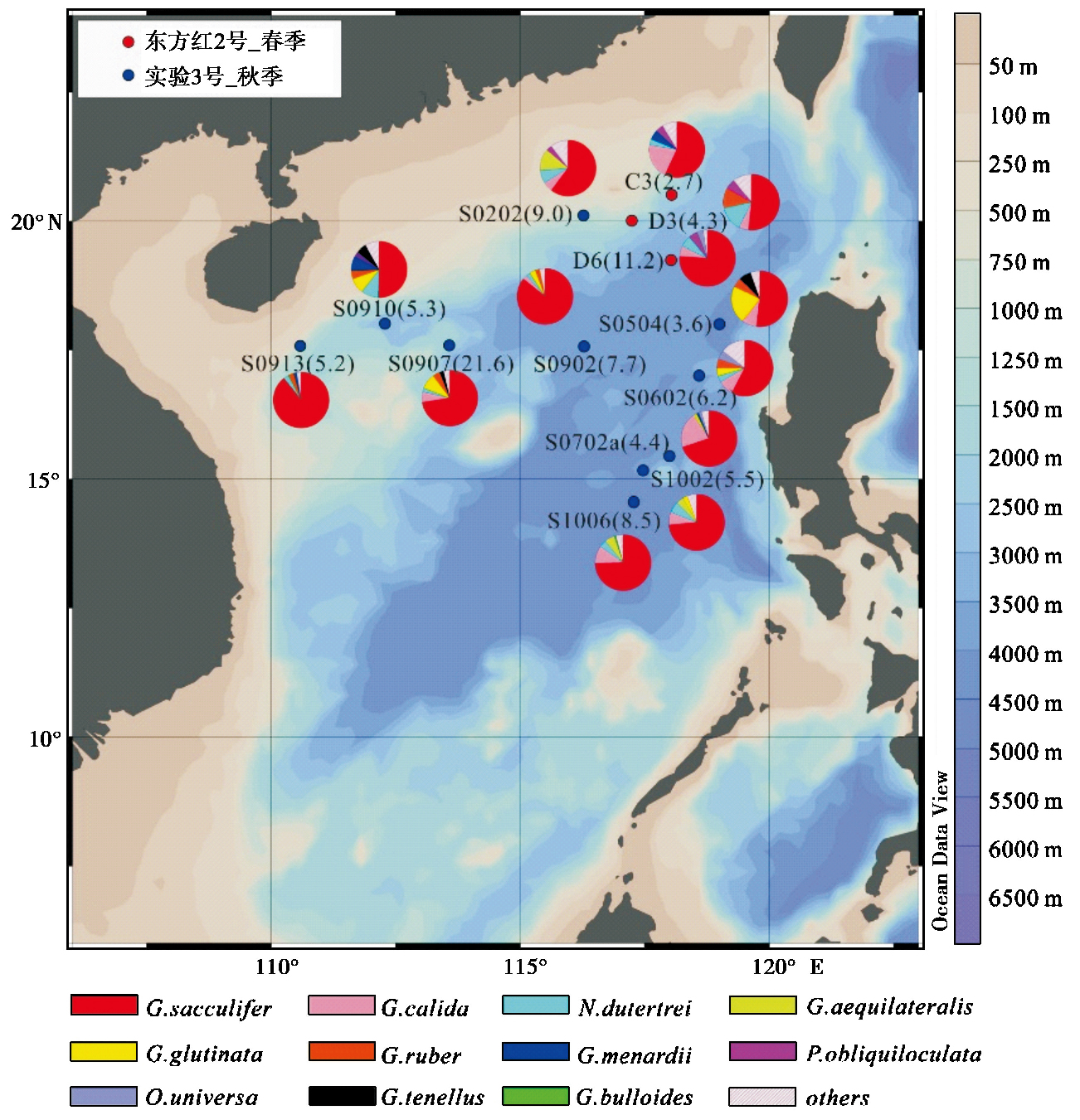
3 结果 3.1 浮游有孔虫群的总体特征对南海北部13个站位65个拖网样品进行属种鉴定[25, 26]后,共发现浮游有孔虫22种。其中春季优势属种有Globigerinoides sacculifer、 Globigerina calida、 Neogloboquadrina dutertrei、 Pulleniatina obliquiloculata和Globigerinoides ruber; 秋季优势属种有G.sacculifer、 G. calida、 N.dutertrei、 Globigerinita glutinata、 G. ruber 和Globigerinella aequilateralis。此外,Globorotalia menardii、 Orbulina universa、 Globigerinoides tenellus和Globigerina bulloides在个别站位有一定的百分含量(图 1); 零星出现的有Globigerinoides conglobatus、 Hastigerina pelagica、 Globorotalia scitula等。其中Globigerinoides sacculifer又包括有袋型的G. sacculifer(w)和无袋型的G. sacculifer(wo)两种生长形态。
|
图 1 浮游生物拖网采样站位及各站位浮游有孔虫主要属种的百分含量 图中红色圆点是春季航次拖网采样站位,蓝色圆点是秋季航次拖网采样站位,饼图指示各属种丰度 Fig. 1 Plankton tow sampling locations and abundance of dominant planktonic foraminiferal species. Red dots indicate sampling locations of spring cruise,blue dots indicate autumn cruise,pie graphs describe abundance of dominant planktonic foraminiferal species |
各站位简单分异度在10~19之间,与向荣等[19]在南海北部的研究大体相同。春季3个站位(图 1中红色圆点)与秋季10个站位(图 1中蓝色圆点)的简单分异度差别不大。
根据统计的浮游有孔虫数量,结合浮游拖网流量计计算的采样水体体积,得出各站位浮游有孔虫的丰度(单位: 枚/m3)。如图 1所示,各站位浮游有孔虫的丰度在2.0~21.6枚/m3(图 1括号内数字)。大多数站位的浮游有孔虫丰度为个位数,只有D6和S0907两个站位丰度较高。南海北部浮游有孔虫丰度分布整体呈现西北高、 东南低的格局。
图 2是各站位不同水深层位总的浮游有孔虫丰度随海水温盐的垂直变化。图 2垂直虚线左边的6个站位位于混合层较深(大于等于50m)的海区; 虚线右边7个站位混合层相对浅(小于50m)。可以看出,浮游有孔虫主要生活在0~50m水层,只有S0202、 S1002和C3这3个站位浮游有孔虫较高丰度出现在50~100m水层。另外,随混合层厚度加深(虚线左边),如S0202、 S0702a和S1002站位,浮游有孔虫生活在100m水层以下所占比例变大。

|
图 2 各站位浮游有孔虫丰度随水深的垂直变化关系 温度和盐度数据来自随船CTD实测 Fig. 2 Vertical distributions of total living planktonic foraminifera with water depth. Temperature and salinity data are from CTD detection system |
本次研究站位的优势种中,表层水(0~50m)种有G. sacculifer和G. ruber,次表层水(50~100m)种有G. calida、 N.dutertrei、 G. aequilateralis 和P.obliquiloculata。 其中P.obliquiloculata仅在春季站位显示出丰度较高,秋季时丰度较低。表层水种G. ruber、 G. sacculifer 和次表层水种 N.dutertrei、 P.obliquiloculata是古海洋学替代性指标中经常用到的种类,有必要详细分析这几个种在水层中的垂直分布特征。
3.2.1 表层水优势种G. ruber和G. sacculifer垂直分布本次调查中,G. ruber作为优势种的站位主要集中在吕宋海峡和吕宋岛西北部,丰度最大的站位为春季D3站位,此外秋季南海西北海区丰度也较高(图 1橙色比例)。图 3展示了G. ruber作为优势种的7个站位其丰度随水深的垂直变化,可以看出G. ruber作为表层水种,在南海0~250m水层都有分布,除了S0910站位之外,在0~50m水层中含量最高。从随船CTD实测的温度和盐度数据来看,G. ruber偏于生活在水温24℃以上、 盐度33.0~34.0psu范围的水体中。

|
图 3 表层水优势种G. ruber在各站位的垂直分布 温度和盐度数据来自随船CTD实测 Fig. 3 Vertical distribution of G. ruber with water depth. Temperature and salinity data are from CTD detection system |
从前文图 1可以看出,表层水种G. sacculifer是所有站位浮游有孔虫中丰度最高的种,在各站位含量均超过50%以上。与另一表层水种G. ruber类似,G. sacculifer在0~250m水层都有出现,但主要丰度集中在0~50m水层,只在S0202和S1002站位,50~100m水层的G. sacculifer丰度甚至超过了0~50m水层中的丰度,有可能是混合层厚度的变化影响了其垂直分布(图 4),相比G. ruber而言,G. sacculifer适宜的生活水温更高一些,盐度则相差不多。
结合图 1和图 4来看,G. sacculifer秋季各站位百分含量相较春季高,同时,在秋季各站位中,除S0202、 S1002和S0702a站位外,G. sacculifer在0~50m水层的比例占压倒性优势,说明相对于春季来说,秋季G. sacculifer生活水深变浅的趋势。此外,统计中将G. sacculifer分成有袋型和无袋型两种生长形态,分别记为G. sacculifer(w)和G. sacculifer(wo)。这两种形态的G. sacculifer生活水深大致相当,但是不论春季还是秋季站位,无袋型的G. sacculifer(wo)数量要远远超过有袋型的G. sacculifer(w)。

|
图 4 表层水优势种G. sacculifer在各站位的垂直分布 温度和盐度数据来自随船CTD实测 Fig. 4 Vertical distribution of G. sacculifer with water depth. Temperature and salinity data are from CTD detection system |
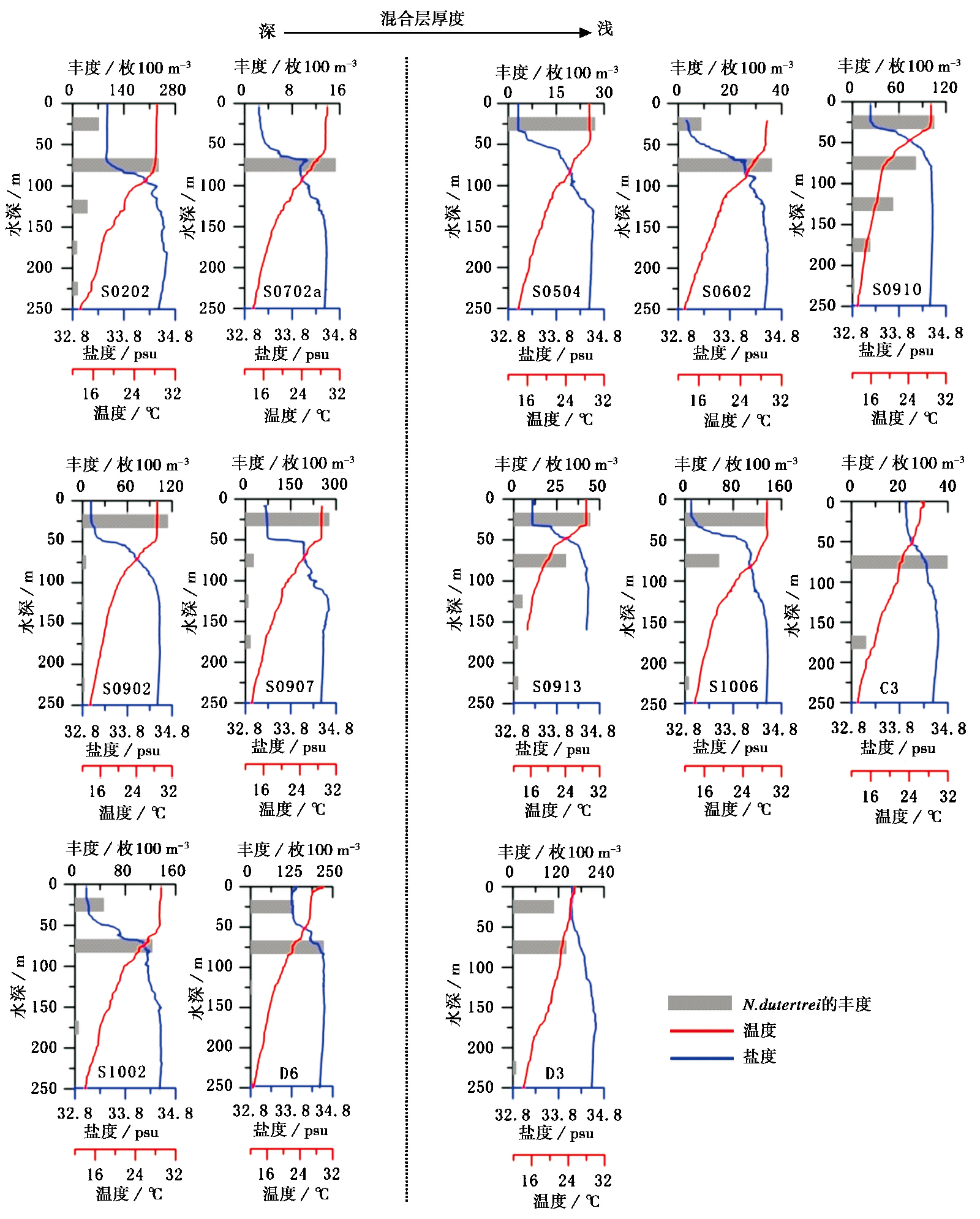
在次表层水的浮游有孔虫中,N.dutertrei和 P.obliquiloculata 的丰度要明显高于其他属种(图 1)。从图 5可以看出,N.dutertrei在0~250m水层都有分布,主要生活在0~100m水层中,并且丰度在温度、 盐度发生跃变的温跃层附近达到最大,随船CTD数据显示,该种的生活水温范围是20℃以上的较暖水团,盐度在33.0~34.4psu之间。
每100立方米水体中N.dutertrei丰度大于100枚的站位有S0202、S0902、 S0907、 S0910、 S1002、 S1006、 D3和D6。其中,3个春季站位中就有2个站位(D3和D6)的N.dutertrei丰度大于100枚/100m3,且3个站位中N.dutertrei丰度最大值都出现在50~100m水层中(图 5)。剩余10个秋季站位中有6个站位的N.dutertrei丰度大于100枚/100m3,这6个站位中只有S0202和S1002两个站位N.dutertrei的丰度最大值出现在50~100m,其余4个站位的高值都出现在0~50m水层(图 5),说明秋季时N.dutertrei更偏向于在表层水中生活。
|
图 5 次表层水优势种N.dutertrei在各站位的垂直分布 温度和盐度数据来自随船CTD实测 Fig. 5 Vertical distribution of N.dutertrei with water depth. Temperature and salinity data are from CTD detection system |
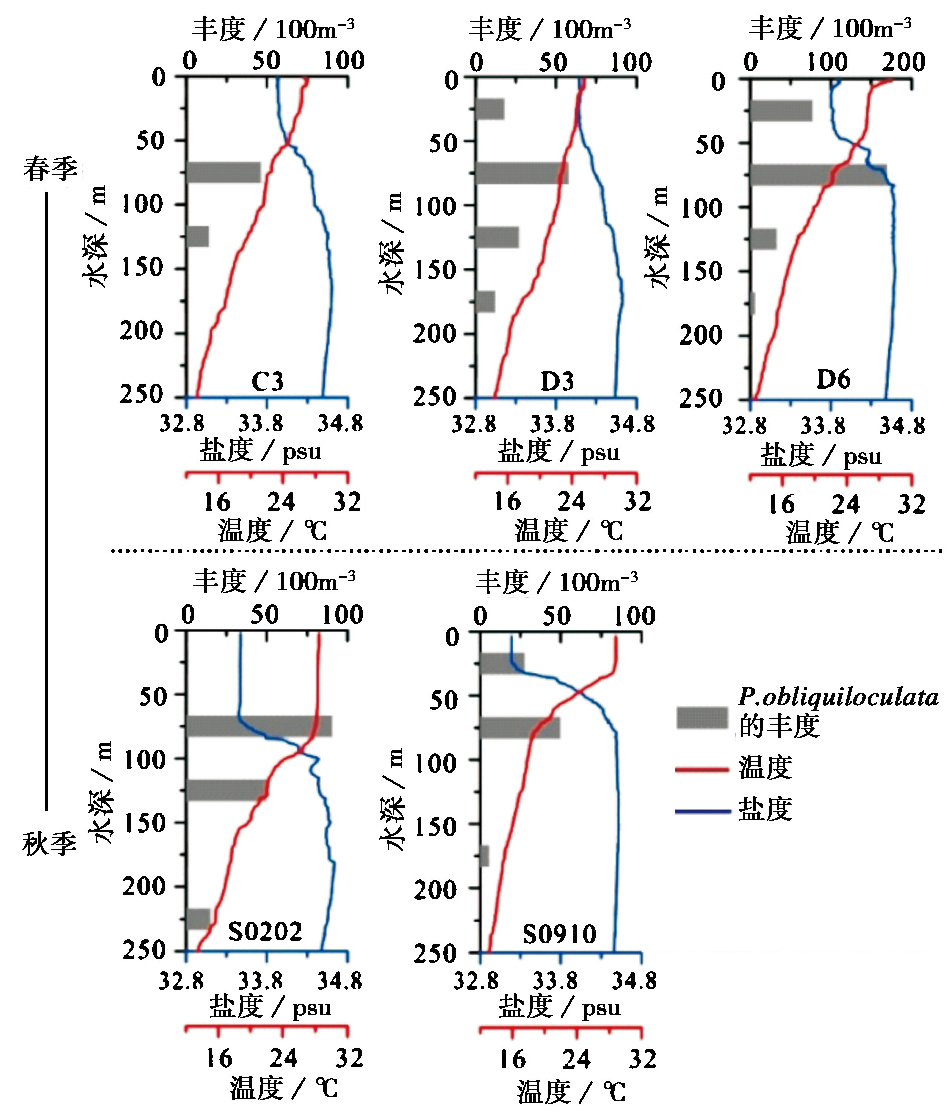
次表层水另一优势种P.obliquiloculata是一种适应于高温、 高盐水的浮游有孔虫[5, 27, 28, 29]。图 1中,P.obliquiloculata只在春季站位C3、 D3和D6中丰度较高,C3站位P.obliquiloculata百分含量达到4.5%,D3是5.9%,D6是5.4%; 秋季站位只有S0910和S0202站位P.obliquiloculata百分含量可达3.2%,而其他站位的P.obliquiloculata只有零星几个。
春季3个站位中,P.obliquiloculata都主要分布在次表层50~100m水层(图 6)。秋季站位S0202,P.obliquiloculata主要分布在50~150m,S0910站位,P.obliquiloculata主要分布在0~100m,P.obliquiloculata在这两个站位的分布层位不一,但是其生活水层温盐范围基本一致,温度范围在20~29℃,盐度范围在33.2~34.4psu。
|
图 6 次表层水优势种P.obliquiloculata在各站位的垂直分布 温度和盐度数据来自随船CTD实测 Fig. 6 Vertical distribution of P.obliquiloculata with water depth. Temperature and salinity data are from CTD detection system |
图 7是浮游有孔虫表层、 次表层水优势种的壳体稳定氧碳同位素 δ18O、 δ13C及估算的碳酸钙氧同位素 δ18Oc随水深的变化(稳定同位素测试结果均以国际标准PDB换算)。浮游有孔虫G. ruber、 G. sacculifer(wo)、 G. sacculifer(w)、 N.dutertrei和P.obliquiloculata壳体的 δ18O分别在-3.26‰~-2.73‰、-3.57‰~-0.28‰、-3.00‰~-1.57‰、-2.44‰~-1.19‰和-2.56‰~-0.76‰之间变化,平均值分别是-3.08‰、-2.68‰、-2.62‰、-1.86‰和-1.52‰,表现出表层水种的氧同位素偏轻、 次表层水种的偏重,与它们的生活水层完全一致。此外,一般来说,δ18Oc随水深的增加有逐渐增大的趋势,也就是说理论上碳酸钙壳体在成壳过程中与周围海水达到氧同位素平衡,因而随水深变大壳体氧同位素将变重。表层水种G.ruber和G. sacculifer(包括有袋型和无袋型的)壳体的 δ18O在0~200m水层中都在-3‰左右变化,不仅幅度小(分别是0.53‰和0.80‰),而且随水深增加变化不大,说明其壳体主要在表层水中形成;

|
图 7 浮游有孔虫 δ18O、 δ13C和 δ18Oc随水深的变化 Fig. 7 Planktonic foraminiferal shell δ18O,δ13C and δ18Oc changes with water depth |
次表层水种N.dutertrei和P.obliquiloculata的 δ18O变化幅度较大,分别是1.25‰和1.80‰,尤其是随生活水深的增大,其壳体氧同位素都有不同程度的变重,说明次表层水种在表层水和次表层水中都可以发生成壳作用,但以次表层水的变化为主。
浮游有孔虫碳同位素有如下特征:G. ruber、 G. sacculifer(wo)、 G. sacculifer(w)、 N.dutertrei和P.obliquiloculata的δ13C分别在-0.29‰~0.07‰、 0.05‰~1.34‰、 0.67‰~1.72‰、 0.09‰~0.79‰和-0.54‰~-0.25‰之间变化,平均值分别是-0.06‰、 0.71‰、 1.02‰、 0.45‰和-0.40‰,也就是说,随着浮游有孔虫生活水深增大,壳体δ13C表现为先增大后减小,与上层水体中叶绿素含量的变化相应。其中,N.dutertrei的丰度和δ13C最大值带与上层水体叶绿素含量的最大值带接近。此外,有袋型的G. sacculifer(w)壳体δ13C要大于无袋型G. sacculifer(wo)壳体的δ13C,显示出不同形态的G. sacculifer在生命效应上可能存在差异。
4 讨论 4.1 浮游有孔虫的生活水深研究表明南海北部各站位浮游有孔虫的丰度主要呈现西北高、 东南低的特点,与向荣等[19]的研究一致。由于南海北部陆坡区受河流带来的陆源营养元素的影响,表层初级生产力较高,保障了浮游有孔虫生长所需的食物来源。另外,南海现代的表层环流受季风控制明显,强烈的季风会在某些海区(如吕宋岛的西北部[30]、 海南岛的东南部[31])产生上升流,深层丰富的营养盐被带到表层,从而直接影响到海洋生物的含量和分布[32]。因此,南海北部浮游有孔虫的总体分布体现了初级生产力的控制作用[33, 34]。
浮游有孔虫主要是生活在水深100m之上的水层,大多数站位0~50m水层中的浮游有孔虫丰度最大,只有少数站位如C3、 S0202和S1002在50~100m次表层水层中的浮游有孔虫丰度最大(图 2)。浮游有孔虫在0~50m水层丰度最大,首先是光照的影响,其次是温度的控制。浮游有孔虫表层水种由于共生藻类的需求,在南海一般生活在真光层的水深110m以浅[35],而次表层水种一般壳体厚重、 没有共生藻类,可以生活在真光层以下。在某些站位,浮游有孔虫主要生活在50~100m水层,可能是叶绿素等营养物最大值位于这一层位有关[36]。此外,南海各种中小尺度的波,形成各种暖涡、 冷涡,也会对有孔虫的含量、 垂直分布产生影响[19]。另外,靠近巴士海峡的站位可能会受到黑潮的影响[37]。因此,光照、 温度、 营养物质、 水团等因素的变化都可能对浮游有孔虫的垂直分布产生影响。
Bé和Tolderlund[14]研究认为G. ruber是生活在50m水层以浅的,本次的研究结果支持这一结论,尽管G. ruber在南海也可以生活在50~100m水层(如S0910站位,见图 3)。Kuroyanagi和Kawahata[17]以及万随等[18]分别在日本周围海域和赤道西太平洋研究发现,G. ruber生活水深甚至要比G. sacculifer的更深,说明G. ruber在其生命周期中,受到环境因子的改变时会发生垂向迁移,显示出G. ruber生活空间的扩张。但是,在南海大多数站位中,G. ruber主要还是生活在表层水中(见图 3),其参数主要反映表层海水的性质。
G. sacculifer在南海北部一年四季都丰富,并且是绝对的优势种[19, 34, 38]。G. sacculifer主要生活在0~50m站位,也有2个站位(S0202和S1002)的生活水层变深至50~100m(见图 4)。G. sacculifer的生活水深会随温跃层厚度的变化而变化: 秋季海表温度高,上层海洋分层明显,混合层厚度小,G. sacculifer的生活水深浅; 春季海表温度低,分层不明显,混合层厚度大,G. sacculifer的生活水深就变深。这些说明了G. sacculifer能够指示表层海水性质,但是其垂直生活空间要大于G. ruber,反映表层海水性质时可能没有G. ruber那么“精确”。
Fairbanks等[39]研究认为N.dutertrei在温跃层相对深时丰度达到最大。Wejnert等[40]研究瓜伊马斯盆地和加利福尼亚湾浮游有孔虫的季节和年际变化以及种间差异时,发现N.dutertrei和P.obliquiloculata生活温度范围很窄,只在温跃层附近较多,并且不同季节随温跃层深度的变化,其生活水深也相应变化。我们研究发现,次表层水种N.dutertrei在南海主要生活在0~100m水层(见图 5),P.obliquiloculata主要生活在50~100m水层(见图 6),两者略有差异。特别是,N.dutertrei和G. sacculifer表现出类似的特性,生活空间随混合层变化而发生迁移,这与Field[41]的研究结果一致。但是,P.obliquiloculata生活水深稳定,基本在温跃层上部温度很窄的范围,不随混合层厚度改变而变化,这一点与Wejnert等[40]的研究结果又不同。实际上,在南海和东海,P.obliquiloculata是一个黑潮指示种[27],在南海北部主要出现在冬季[38],春、 秋季站位,特别是秋季站位很少见。因此,本次研究表明,P.obliquiloculata生活水深稳定,能指示次表层海水的性质。
4.2 浮游有孔虫的氧、 碳同位素一般来说随水深的增加,浮游有孔虫壳体 δ18O会随之偏正[11, 42]。本次拖网样品中,G. ruber、 G. sacculifer(wo)、 G. sacculifer(w)、 N.dutertrei和 P.obliquiloculata壳体的 δ18O平均值分别是-3.08‰、-2.68‰、 -2.62‰、-1.86‰和-1.52‰,反映了它们在水体中的分布依次变深。表层种G. ruber和G. sacculifer的 δ18O变化幅度小,而次表层种N.dutertrei和P.obliquiloculata的 δ18O变化幅度大(见图 6),可能是因为次表层水种在其生命周期中从表层水下沉到次表层水的过程中都发生成壳作用,其垂直生活空间广于表层水种。从图 6中还可以看出,表层水种G. ruber和G. sacculifer的 δ18O值在估算的海水碳酸钙氧同位素 δ18Oc左侧、 偏负,而次表层水种N.dutertrei和P.obliquiloculata的 δ18O值在 δ18Oc右侧、 偏正,说明表层水种的成壳作用主要发生在表层水层中,虽然之后生活水深可达到次表层水,但壳体氧同位素反映的还是较稳定的表层水温度信息,而次表层水种的成壳作用发生在表层水和次表层水中,壳体的钙化温度表现出垂直水温变化范围较大。
一般来说随水深的增加,浮游有孔虫壳体 δ18C 会随之偏正[10]。本次拖网样品G. ruber、 G. sacculifer(wo)、 G. sacculifer(w)、 N.dutertrei和 P.obliquiloculata的δ13C平均值分别是-0.06‰、 0.71‰、 1.02‰、 0.45‰和-0.40‰,并没有像 δ18O那样,与水深的增加呈线性关系。这是因为,反映初级生产力的叶绿素并不出现在海水表层,从海水表层到叶绿素最大值,初级生产力随水深而增加,浮游有孔虫 δ18C 随水深也增加; 从叶绿素最大值再往深处,初级生产力随水深而减小,浮游有孔虫 δ18C 随水深也减少。所以,浮游有孔虫 δ18C 与初级生产力有关,可以反映水体碳同位素和营养物梯度的变化[42, 43/a>]。
总体来说,浮游有孔虫壳体氧同位素主要受控于温度较多,能反应垂直水体的温度梯度变化,而碳同位素变化比较复杂,除了与生产力有关之外,还会受到区域性的其他因素影响[12, 42, 43]。除此之外,同一属种不同水深的同位素固然会有差异,但即使是在同一水层中,同一属种不同壳径的浮游有孔虫同位素也同样存在差异[44],因此,在运用浮游有孔虫壳体地球化学测试进行古环境与古海洋记录重建时,需要特别注意选择标准壳径以便于减少误差[45]。
5 结论通过分析南海北部春、 秋季浮游生物垂直拖网样品中的浮游有孔虫属种,结合优势种壳体的氧碳同位素分析,探讨了南海现代浮游有孔虫的垂直分布特征,得出以下结论:
(1)南海北部春季优势种有G. sacculifer、 G. calida、 N.dutertrei、 P.obliquiloculata 和G. ruber; 秋季优势属种有G. sacculifer、 G. calida、 N.dutertrei、 G. glutinata、 G. ruber和 G. aequilateralis。
(2)表层水优势种G. ruber和G. sacculifer主要生活在0~50m水层,并且秋季站位丰度高于春季站位,说明G. ruber和G. sacculifer更适宜生活在温度相对高的季节; 次表层水优势种N.dutertrei主要生活在0~100m水层,P.obliquiloculata主要生活在50~150m水层,相较秋季,P.obliquiloculata春季站位丰度较高。
(3)随着温跃层变化,浮游有孔虫表层水种和次表层水种的相对含量发生变化,同时G. sacculifer和N.dutertrei的生活水深也发生迁移。
(4)优势种G.ruber、 G.sacculifer(wo)、 G.sacculifer(w)、 N.dutertrei和P.obliquiloculata壳体的 δ18O平均值分别是-3.08‰、-2.68‰、-2.62‰、-1.86‰和-1.52‰,壳体 δ18O随着其生活水深逐渐增大; 而壳体的δ13C平均值分别是-0.06‰、 0.71‰、 1.02‰、 0.45‰和-0.40‰,呈现先增大后减小的特征。表层水种G. ruber和G. sacculifer与次表层水种 N.dutertrei和P.obliquiloculata壳体的 δ18O变化规律指示了上层水体垂向温度梯度和温跃层深度的变化,而壳体δ13C变化特征则反映了上层水体中叶绿素等营养物质的垂向变化。
致谢 感谢国家自然科学基金委开放航次提供工作平台和共享数据; 感谢同济大学海洋地质国家重点实验室成鑫荣老师在同位素测试方面的帮助。
| 1 | Emiliani C. Pleistocene temperatures. The Journal of Geology, 1955,63(6):538~578 |
| 2 | Heinrich H. Origin and consequences of cyclic ice rafting in the northeast Atlantic Ocean during the past 130,000 years. Quaternary Research, 1988,29(2):142~152 |
| 3 | Shackleton N J, Berger A, Peltier W R. An alternative astronomical calibration of the Lower Pleistocene timescale based on ODP Site 677.Transactions of the Royal Society of Edinburgh:Earth Sciences, 1990,81(4):251~261 |
| 4 | Dansgaard W, Johnsen S J, Clausen H B et al. Evidence for general instability of past climate from a 250-kyrice-core record. Nature, 1993,364(6434):218~220 |
| 5 | Thompson P R. Planktonic foraminifera in the western north Pacific during the past 150000 years:Comparison of modern and fossil assemblages.Palaeogeography, Palaeoclimatology, Palaeoecology, 1981,35:241~279 |
| 6 | Pflaumann U, Duprat J, Pujol C et al. SIMMAX:A modern analog technique to deduce Atlantic sea surface temperatures from planktonic foraminifera in deep-sea sediments. Paleoceanography, 1996,11(1):15~35 |
| 7 | Lea D W, Pak D K, Spero H J. Climate impact of Late Quaternary equatorial Pacific sea surface temperature variations. Science, 2000,289(5485):1719~1724 |
| 8 | Yu J M, Elderfield H, Hönisch B. B/Ca in planktonic foraminifera as a proxy for surface seawater pH. Paleoceanography, 2007,22(2):PA2202, doi:10.1029/2006PA001347 |
| 9 | 刘芳, 向荣. 现代浮游有孔虫生态研究进展. 微体古生物学报, 2010,27(4):366~375 Liu Fang, Xiang Rong. Advances in the study of modern planktonic foraminifera. Acta Micropalaeontologica Sinica, 2010,27(4):366~375 |
| 10 | Spero H J, Lea D W. Intraspecific stable isotope variability in the planktic foraminifera Globigerinoides sacculifer:Results from laboratory experiments. Marine Micropaleontology, 1993,22(3):221~234 |
| 11 | 成鑫荣, 陈荣华, 翦知湣等. 南海中部沉积物捕集器中浮游有孔虫的稳定同位素分析. 海洋地质与第四纪地质, 2002,22(4):73~78 Cheng Xinrong, Chen Ronghua, Jian Zhimin et al. Preliminary report on the stable isotopic change of planktonic foraminifers from the sediment traps in the central South China Sea. Marine Geology & Quaternary Geology, 2002,22(4):73~78 |
| 12 | Wan Sui, Jian Zhimin, Cheng Xinrong et al. Seasonal variations in planktonic foraminiferal flux and the chemical properties of their shells in the southern South China Sea. Science China:Earth Sciences, 2010,53(8):1176~1187 |
| 13 | Lin H L, Sheu D D D, Yang Y et al. Stable isotopes in modern planktonic foraminifera:Sediment trap and plankton tow results from the South China Sea. Marine Micropaleontology, 2011,79(1):15~23 |
| 14 | Bé A W H, Tolderlund D S. Distribution and ecology of living planktonic foraminifera in surface waters of the Atlantic and Indian Oceans. In:Funnell B M, Riedel W R eds. The Micro-palaeontology of Oceans. London:Cambridge University Press, 1971. 105~149 |
| 15 | Wyrtki K. Oceanographic Atlas of the International Indian Ocean Expedition. Washington D. C.:National Science Foundation Publication, 1971. 1~531 |
| 16 | 徐学东, 宇田理重, 土桥正也等. 西北太平洋黑潮主轴区浮游有孔虫的垂直分布及其古海洋学意义, 第四纪研究, 1999,(6):502~510 Xu Xuedong, Rie UDA, Masaya Tsuchihashi et al. Vertical distribution of planktonic foraminifers in Kuroshio area of NW Pacific and its paleoceanographic implications. Quaternary Sciences, 1999,(6):502~510 |
| 17 | Kuroyanagi A, Kawahata H. Vertical distribution of living planktonic foraminifera in the seas around Japan. Marine Micropaleontology, 2004,53(1):173~196 |
| 18 | 万随, 翦知湣, 成鑫荣. 赤道西太平洋冬季浮游有孔虫分布与壳体同位素特征. 第四纪研究, 2011,31(2):284~291 Wan Sui, Jian Zhimin, Cheng Xinrong. Distribution of winter living planktonic foraminifers and characteristics to their shell's stable isotopic in the western equatorial Pacific. Quaternary Sciences, 2011,31(2):284~291 |
| 19 | 向荣, 陈木宏, 张兰兰等. 南海北部秋季活体浮游有孔虫的组成与分布. 地球科学——中国地质大学学报, 2010,35(1):1~10 Xiang Rong, Chen Muhong, Zhang Lanlan et al. Compositions and distribution of living planktonic foraminifera in autumn waters of the northern South China Sea. Earth Science——Journal of China University of Geosciences, 2010,35(1):1~10 |
| 20 | Rathburn A E, Levin L A, Held Z et al. Benthic foraminifera associated with cold methane seeps on the northern California margin:Ecology and stable isotopic composition. Marine Micropaleontology, 2000,38(3):247~266 |
| 21 | Cheng X R, Huang B Q, Jian Z M et al. Foraminiferal isotopic evidence for monsoonal activity in the South China Sea:A present-LGM comparison. Marine Micropaleontology, 2005,54(1):125~139 |
| 22 | Lin I T, Wang C H, Lin S. Seasonal variations of oxygen isotopic compositions in the Pingtung coastal waters of Taiwan. Western Pacific Earth Sciences, 2003,3(1):21~32 |
| 23 | O'Neil J R, Clayton R N, Mayeda T K. Oxygen isotope fractionation in divalent metal carbonates. The Journal of Chemical Physics, 1969,51(12):5547~5558 |
| 24 | Shackleton N J. Attainment of isotopic equilibrium between ocean water and the benthonic foraminifera genus Uvigerina:Isotopic changes in the ocean during the last glacial. In:Labeyrie J ed. Méthodes Quantitatives Détude des Variations du Climat au Cours du Pléistocène. France, Paris:Colloques International du Centre National du Recherche Scientifique, 1974. 203~210 |
| 25 | Bé A W H. An ecological, zoogeographic and taxonomic review of recent planktonic foraminifera. In:Ramsay A T S ed. Oceanic Micropaleontology. London:Academic Press Inc, 1977.1~100 |
| 26 | Hemleben C, Spindler M, Erson O R. Modern Planktonic Foraminifera. Now York:Springer Verlag, 1989. 1~363 |
| 27 | Pflaumann U, Jian Z M. Modern distribution patterns of planktonic foraminifera in the South China Sea and western Pacific:A new transfer technique to estimate regional sea-surface temperatures. Marine Geology, 1999,156(1):41~83 |
| 28 | Jian Z M, Wang P, Saito Y et al. Holocene variability of the Kuroshio current in the Okinawa Trough, northwestern Pacific Ocean. Earth and Planetary Science Letters, 2000,184(1):305~319 |
| 29 | An Yang, Jian Zhimin. Pulleniatina Minimum Event during the last deglaciation in the southern South China Sea. Chinese Science Bulletin, 2009,54(23):4514~4519 |
| 30 | Shaw P T, Chao S Y. Surface circulation in the South China Sea.Deep Sea Research Part Ⅰ:Oceanographic Research Papers, 1994,41(11):1663~1683 |
| 31 | 于文泉. 南海北部上升流的初步探讨. 海洋科学, 1987,6(11):7~10 Yu Wenquan. A prelininary approach of the upwelling for the northern South China Sea. Marine Sciences, 1987,6(11):7~10 |
| 32 | Jennerjahn T C, Liebezeit G, Kempe S et al. Particle flux in the northern South China Sea. In:Jin Xianglong, Kudrass H R, Pautot Guy eds. Marine Geology and Geophysics of the South China Sea. Beijing:China Ocean Press, 1992. 228~235 |
| 33 | 涂霞, 郑范, 陈木宏. 南海中、北部的浮游有孔虫. 热带海洋学报, 1988,1(1):28~38 Tu Xia, Zheng Fan, Chen Muhong. Planktonic foraminifera of the central and northern areas of South China Sea. Journal of Tropic Oceanology, 1988,1(1):28~38 |
| 34 | 陈荣华, 翦知湣, 郑玉龙等. 南海中部浮游有孔虫通量的季节变化. 同济大学学报:自然科学版, 2000,28(1):73~77 Chen Ronghua, Jian Zhimin, Zheng Yulong et al. Seasonal variations of the planktonic foraminifera flux in the central South China Sea. Journal of Tongji University:Natural Science, 2000,28(1):73~77 |
| 35 | Shang S, Lee Z, Wei G. Characterization of MODIS-derived euphotic zone depth:Results for the China Sea. Remote Sensing of Environment, 2011,115(1):180~186 |
| 36 | 宫响. 南海北部次表层叶绿素最大值特征的理论分析及数值模拟研究. 青岛:中国海洋大学博士学位论文, 2012. 1~164 Gong Xiang. Analytical and Numerical Study on Subsurface Chlorophyll Maximum in the Northern South China Sea. Qingdao:The Ph.D Dissertation of Ocean University of China, 2012. 1~164. |
| 37 | 蒲书箴, 于惠苓, 蒋松年. 巴士海峡和南海东北部黑潮分支. 热带海洋学报, 1992,11(2):1~8 Pu Shuzhen, Yu Huiling, Jiang Songnian. Branchings of Kuroshio into Bashi channel and the South China Sea. Jounral of Tropic Oceanology, 1992,11(2):1~8 |
| 38 | Lin H L, Hsieh H Y. Seasonal variations of modern planktonic foraminifera in the South China Sea.Deep-Sea Research Part Ⅱ:Topical Studies in Oceanography, 2007,54(14):1634~1644 |
| 39 | Fairbanks R G, Sverdlove M, Free R et al. Vertical distribution and isotopic fractionation of living planktonic foraminifera from the Panama basin. Nature, 1982,298(5877):841~844 |
| 40 | Wejnert K E, Pride C J, Thunell R C. The oxygen isotope composition of planktonic foraminifera from the Guaymas Basin, Gulf of California:Seasonal, annual, and interspecies variability. Marine Micropaleontology, 2010,74(1):29~37 |
| 41 | Field D B. Variability in vertical distributions of planktonic foraminifera in the California Current:Relationships to vertical ocean structure. Paleoceanography, 2004,19(2):285~288 |
| 42 | 向荣, 陈木宏, 成鑫荣等. 南海南部水体和沉积物中的浮游有孔虫氧碳同位素分析. 热带海洋学报, 2009,28(3):59~66 Xiang Rong, Chen Muhong, Cheng Xinrong et al. A preliminary study of oxygen and carbon isotopic changes of planktonic foraminifera fron surface sediments and plankton tow samples in southern South China Sea. Journal of Tropical Oceanography, 2009,28(3):59~66 |
| 43 | 王小华, 陈荣华, 赵庆英等. 2009~2010年南海北部浮游有孔虫通量和稳定同位素季节变化及其对东亚季风的响应. 海洋地质与第四纪地质, 2014,34(1):103~115 Wang Xiaohua, Chen Ronghua, Zhao Qingying et al. The influence of East Asian monsoon on seasonal variations in planktonic foraminiferal flux and stable isotope in the northern South China Sea during 2009~2010. Marine Geology & Quaternary Geology, 2014,34(1):103~115 |
| 44 | 徐建. 壳体大小对浮游有孔虫生物地球化学记录的影响. 矿物岩石地球化学通报, 2010,29(2):109~118 Xu Jian. Effect of shell size on planktonic foraminiferal biogeochemical records. Bulletin of Mineralogy, Petrology and Geochemistry, 2010,29(2):109~118 |
| 45 | 安佰正, 李铁刚, 孙晗杰等. 浮游有孔虫标准化壳体重量测试方法及在西太平洋的应用. 地球科学——中国地质大学学报, 2015,40(5):881~889 An Baizheng, Li Tiegang, Sun Hanjie et al. Application of planktonic foraminifera size-normalized shell weight in the Western Pacific. Earth Science——Journal of China University of Geosciences, 2015,40(5):881~889 |
Abstract
In this study, 65 plankton tow samples were collected and analyzed from 13 sites in the northern South China Sea during the 2013 open cruises of the National Natural Science Foundation of China. Totally 22 planktonic foraminiferal species were identified in the samples and most are tropical warm water species with few cold water species. Sea surface water dwelling species Globigerinoides ruber and Globigerinoides sacculifer mainly live in the upper 0~50m water layer, while sub-surface water dwelling species such as Neogloboquadrina dutertrei and Pulleniatina obliquiloculata live in the 0~100m and 50~150m water layer respectively. The changes of thermocline depth significantly influence the vertical distribution of G. sacculifer and N.dutertrei. When the thermocline became deeper, both of the two species migrated downward, vice versa. The average δ18O values of G. ruber, G. sacculifer(wo), G. sacculifer(w), N.dutertrei, P.obliquiloculata are -3.08‰,-2.68‰,-2.62‰,-1.86‰ and -1.52‰ respectively, which change along with the increase of living water depth and mainly reflect the vertical temperature gradient in the upper water column. The average δ13C of these species are -0.06‰, 0.71‰, 1.02‰, 0.45‰ and -0.40‰ respectively, displaying the trend that the values increase firstly with the water depth and then decrease later, which may be related to the vertical changes of nutrients such as chlorophyll in the upper ocean. Therefore, the δ18O and δ13C differences between surface water and sub-surface water dwelling planktonic foraminiferal species can be used to indicate the variations of thermocline and nutrientcline depth.
 2015, Vol.35
2015, Vol.35

