文章信息
- 陈德鑫, 李智敏, 李高锋, 张茂林, 张东岩, 闫养希
- CHEN De-xin, LI Zhi-min, LI Gao-feng, ZHANG Mao-lin, ZHANG Dong-yan, YAN Yang-xi
- Mg2+掺杂对Li1.2Mn0.6Ni0.2O2正极材料性能的影响
- Influence of Mg2+ doping on properties of Li1.2Mn0.6Ni0.2O2 cathode materials
- 材料工程, 2020, 48(10): 157-162
- Journal of Materials Engineering, 2020, 48(10): 157-162.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.000660
-
文章历史
- 收稿日期: 2019-07-15
- 修订日期: 2020-05-30
锂离子二次电池具有高容量密度、高输出电压、绿色环保等优点,在便携式电子产品、电动汽车以及电力储能等方面已实现大规模应用[1-2]。目前,LiCoO2,LiMn2O4,LiFePO4等商业化锂电池正极材料的放电比容量远低于负极材料,制约着锂离子电池性能的进一步提高[3-4]。近年来发展了多种类型的正极材料,其中层状结构的Li1.2Mn0.6Ni0.2O2(LMNO)在0.1 C下的比容量可达298.5 mAh/g,具有满足未来市场需求的巨大潜力[5]。但是目前仍存在首次不可逆容量大、循环稳定性和倍率性能差以及电压衰减等问题[6-8]。为此,研究者做了大量改性工作,主要包括表面包覆、离子掺杂、形貌控制及表面酸处理等。
研究表明,通过离子掺杂可以有效提高LMNO层状结构有序性和稳定性,从而解决其首次库仑效率低及循环稳定性和倍率性能差等问题。例如Li等[9]采用Ba4+掺杂使得LMNO正极材料的首次库仑效率从59.85%提高到67.32%。能够掺杂改性层状正极材料的金属离子还包括Y3+,Mo6+,Zr4+,Sn4+,K+,Mg2+等[10-14]。在这些离子中,对LMNO材料而言,半径较小的Mg2+更容易替代其晶体结构Li层中的Ni2+,减小Li+/Ni2+混排。并且,若Mg2+存在于Li层中,可减小富锂正极材料在深度脱锂情况下O2--O2-层间的排斥力,抑制其晶格畸变甚至相变,从而提升LMNO正极材料的循环稳定性[14]。因此,研究Mg2+掺杂如何影响LMNO晶体结构稳定性以及其电化学性能具有重要的意义。
综上所述,本实验采用燃烧合成法,制备形貌可控的Mg2+掺杂LMNO正极材料,研究Mg2+掺杂对LMNO物相结构以及电化学性能的影响,并讨论其改性作用机理。
1 实验材料与方法 1.1 正极材料制备与表征称取摩尔比为1.2:(0.6-x/2):(0.2-x/2)的硝酸锂(LiNO3)、乙酸锰(Mn(CH3COO)2·4H2O)和乙酸镍(Ni(CH3COO)2·4H2O),将其溶于200 mL乙醇溶液中,超声分散至完全溶解;按一定的摩尔比x(x=0,0.02,0.04,0.06)分别加入硝酸镁(Mg(NO3)2·4H2O)并分散均匀,然后逐滴加入一定量的聚乙二醇400,在80 ℃下磁力搅拌至形成黏稠状凝胶液体,置入氧化铝坩埚中,在箱式电阻炉中以5 ℃/min速率升温至500 ℃发生燃烧反应,再升温至900 ℃煅烧19 h,随炉冷却后制得Mg2+掺杂的LMNO正极材料粉体。在本研究中,将x=0,0.02,0.04和0.06的掺杂样品分别标记为LMNO,LMNO-2,LMNO-4和LMNO-6。
采用Bruker D8 Advance型X射线衍射仪,对所制备粉体进行物相结构分析;采用JSM-7500型场发射扫描电子显微镜(FESEM)观察所制备样品的表面形貌和粒径大小;采用inVia型拉曼光谱分析仪研究掺杂对LMNO微观结构的影响。
1.2 电池组装和电化学性能测试以N-甲基-2-吡咯烷酮(NMP)为溶剂,将制得的正极材料与乙炔黑、PVDF按80:10:10质量比加入行星式球磨机中混合均匀,经过涂布、干燥和裁片后制得正极极片。将其在氩气保护的手套箱中,组装成CR2016型扣式电池。其中,负极为锂片,隔膜为Celgard2300微孔聚丙烯膜,电解液为1 mol·L-1的LiPF6/(EC+DMC)。采用武汉蓝电电池测试系统(CH2001A)对组装的电池进行室温下的充放电性能测试,测试电压区间为2.0~4.8 V;采用CHI660D型电化学工作站对其进行CV测试,扫描速率为1 mV/s。
2 结果与分析 2.1 物相结构和形貌表征图 1为所制备的不同Mg2+掺杂量改性LMNO粉体的XRD图谱。可以看出,所有样品均具有六方层状结构(空间群R3m)的特征衍射峰。另外,在2θ=20°~25°之间的两个衍射峰是由LMNO晶体过渡金属层中Li和Mn形成的LiMn6超晶格所致,属于C/2m空间群。图中未发现含镁化合物的杂质峰,但是随着Mg2+掺杂量的增加,样品(006/102)及(018/110)峰的劈裂程度逐渐减小,说明其层状结构有序性降低[15]。这可能是由于Mg2+(0.072 nm)与Li+(0.076 nm)半径相近,随着Mg2+掺杂量的增多,其在替代Mn及Ni原子的同时,出现在Li层间的量也随之增大,从而导致LMNO晶体中阳离子混排加重,层状结构有序性降低。

|
图 1 不同Mg2+掺杂量LMNO正极材料的XRD图谱 Fig. 1 XRD patterns of LMNO cathode materials with different Mg2+ contents |
表 1为对图 1 XRD图谱精修所获得的晶格参数数据。可以看出,随着Mg2+掺杂量的增加,LMNO晶体c轴值呈增大趋势。这是因为Mg2+(0.072 nm)半径比Mn4+(0.053 nm)及Ni2+(0.069 nm)的半径大,当Mg2+掺杂量增加时,较多的Mg2+引起c值的增大。显然,较大的c值有利于Li+的脱嵌,能够提高LMNO材料的倍率性能。表中结果还显示,Mg2+掺杂引起LMNO晶体(003)及(104)晶面的衍射峰积分强度比值I(003)/I(104)减小,说明所制备材料的晶格畸变加剧,层状有序性降低[16]。因此,Mg2+掺杂容易出现在Li层中造成阳离子混排。但是,如前所述,Mg2+在Li层中的出现可以抑制LMNO正极材料在深度脱锂情况下O2--O2-层之间产生的排斥力,抑制其晶相演变,进而提高该材料的循环稳定性。
| Sample | a/nm | c/nm | c/a | I(003)/I(104) |
| LMNO | 0.28579 | 1.42522 | 4.9899 | 1.22 |
| LMNO-2 | 0.28532 | 1.426202 | 4.9879 | 1.16 |
| LMNO-4 | 0.286055 | 1.426662 | 4.9873 | 1.10 |
| LMNO-6 | 0.28524 | 1.422487 | 4.9870 | 1.07 |
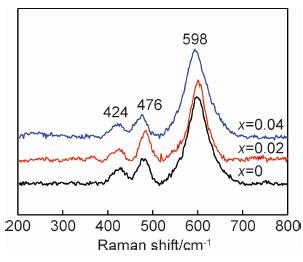
图 2为所制备样品LMNO, LMNO-2及LMNO-4的拉曼光谱图。结果显示,所有样品均具有3个明显的特征峰,分别位于424,476 cm-1和598 cm-1,这与文献[17]的报道一致。其中,处在424 cm-1较低波数的峰与LMNO正极材料中Li2MnO3相相对应[18]。图中未发现由于Mg2+掺杂引起的新特征峰,但是,随着Mg2+掺杂量的增加,LMNO-4样品位于598 cm-1的特征峰向小波数方向偏移了4 cm-1,说明较多Mg2+掺杂对LMNO晶体结构造成的畸变加剧,致使该特征峰有较大的偏移[19]。
|
图 2 不同Mg2+掺杂量LMNO正极材料的拉曼光谱图 Fig. 2 Raman spectra of LMNO cathode materials with different Mg2+ contents |
图 3为不同Mg2+掺杂量样品的FESEM照片。可以看出,所制备样品粉体发育良好,形貌呈类球形,具有较窄的粒度分布。随着Mg2+掺杂量的增加,颗粒平均粒径减小,当Mg2+掺杂量为0.06时,粉体颗粒的平均粒径约为200 nm。因此,结合XRD结果可知,通过燃烧法可以制备出较小粒径和良好形貌的高纯度LMNO粉体,有利于正极材料的涂布工艺以及循环稳定性和倍率性能。

|
图 3 不同Mg2+掺杂量LMNO正极材料的FESEM照片 (a)LMNO; (b)LMNO-2;(c)LMNO-4;(d)LMNO-6 Fig. 3 FESEM images of LMNO cathode materials with different Mg2+ contents (a)LMNO; (b)LMNO-2;(c)LMNO-4;(d)LMNO-6 |
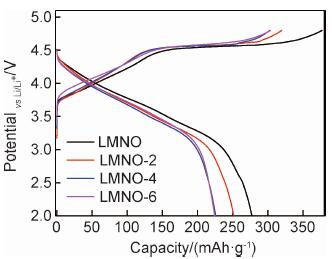
图 4为所组装不同Mg2+掺杂量电池样品在C/20倍率下的首次充放电曲线。可以看出,在首次充电过程中,所有样品均出现了4.5 V的特征平台,该平台对应LMNO正极材料Li2MnO3组分中O2-的不可逆逸出[20]。LMNO,LMNO-2,LMNO-4及LMNO-6样品的首次放电比容量分别为277.2,251.5,225.7 mAh/g和224.4 mAh/g,相应的库仑效率分别为73.5%,78.8%,74.6%和73.9%。随着Mg2+掺杂量的增加,样品的首次充放电比容量逐渐减小,这是由于非活性的Mg2+取代LMNO中活性Ni2+所致。但是,适量的Mg2+掺杂,例如2%的含量,对LMNO正极材料的首次库仑效率具有明显的提高。
|
图 4 不同Mg2+掺杂量样品在C/20倍率下的首次充放电曲线 Fig. 4 First charge and discharge curves of the samples with different Mg2+ contents at C/20 |
图 5(a)为不同Mg2+掺杂量电池样品在1 C倍率下循环200次的放电比容量曲线。结果显示,通过Mg2+掺杂,LMNO正极材料的循环稳定性被显著提高。LMNO,LMNO-2,LMNO-4及LMNO-6样品的初始放电比容量依次为174.3,171.8,178.6 mAh/g和138.2 mAh/g。循环200次后,各样品的容量保持率分别为80.2%,90.3%,86.1%和108.5%。通过对比发现,当Mg2+含量低于4%时,其对LMNO材料在1 C倍率下的比容量无明显影响,但是明显提高了该材料的循环稳定性。另外,循环200次后,LMNO-6样品在1 C倍率下的比容量从首次的138.2 mAh/g提高150.0 mAh/g。这是因为相对较多的Mg2+出现在Li层,开始时阻碍了Li+的脱出,随着循环次数的增加,其阻碍作用减弱,导致其比容量反而微量增长。由Mg2+较大的离子半径可知,Mg2+掺杂能够增大晶格参数c,使Li+的扩散通道扩大,在充放电过程中更容易进行脱嵌。又由于其出现在Li层中,能够提高过度脱锂情况下LMNO结构的稳定性,因此,通过Mg2+掺杂,可有效提高LMNO材料的循环稳定性。

|
图 5 不同Mg2+掺杂量样品的电化学性能 (a)1 C倍率下循环放电容量; (b)倍率容量 Fig. 5 Electrochemical performance of the samples with different Mg2+ contents (a)cycle discharge capacity at 1 C; (b)rate capacity |
图 5(b)为不同Mg2+掺杂量电池样品在C/10,C/5,C/2,1 C,2 C和5 C倍率下分别循环5次的放电比容量。可以看出,当充放电倍率小于1 C时,LMNO-2及LMNO-4样品的放电容量与LMNO样品无明显差别,而LMNO-6样品的容量却明显较差。随着充放电倍率进一步增大,纯相LMNO样品的倍率性能明显衰减,说明Mg2+掺杂对LMNO高倍率性能具有明显的提升作用。在2 C倍率下,LMNO-2及LMNO-4样品放电比容量分别为150.9 mAh/g和155.1 mAh/g,5 C倍率时仍可达111.8 mAh/g和126.2 mAh/g,表现出良好的高倍率性能。并且,当样品又恢复至C/5倍率测试时,其性能与初始测试结果几乎无差异,进一步说明了Mg2+掺杂能够稳定LMNO材料的结构。
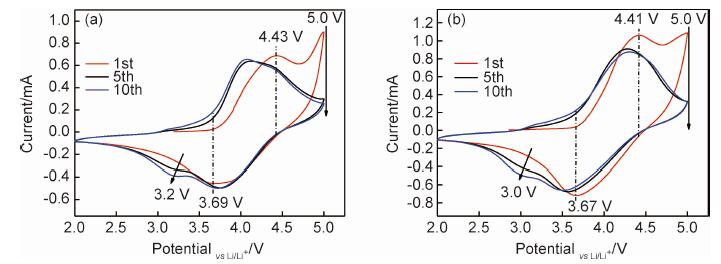
图 6为LMNO和LMNO-2样品的CV曲线。结果显示,未掺杂和掺杂样品的首次充电过程中均存在两个氧化峰,其中,处于4.5 V以下的氧化峰对应于LMNO正极材料中Ni2+到Ni4+的氧化,而大于4.5 V的氧化峰对应于LMNO正极材料Li2MnO3组分中O2-的不可逆逸出,其会导致该材料在首次充放电中产生大的不可逆容量。对比LMNO与LMNO-2样品的首次充放电曲线,可以发现,LMNO-2样品在首次充电过程中的高电压氧化峰明显减弱,说明当电压大于4.5 V时产生的O2-不可逆逸出减弱。因此,结合图 4结果可知,Mg2+掺杂稳定了LMNO晶体结构,从而提升了其首次库仑效率。
|
图 6 LMNO (a)和LMNO-2 (b)样品的CV曲线 Fig. 6 CV curves of LMNO (a) and LMNO-2 (b) samples |
图 6结果还显示,随着循环次数的增加,在放电电压3.2 V处,未掺杂样品又出现新的还原峰,其峰值随着循环次数的增加而增强。该还原峰被认为是由于样品在循环过程中Mn4+被还原为Mn3+所致;而其随循环的进行逐渐增强反映了LMNO材料发生了层状结构向尖晶石结构的渐变[21]。显然,这会导致LMNO结构稳定性变差。但是,通过Mg2+掺杂,样品在3.2 V的还原峰明显向左偏移,表明层状结构向尖晶石结构相转变的难度增加,有利于结构的稳定性。
3 结论(1) 采用燃烧合成法,成功制备了Mg2+掺杂的LMNO正极材料粉体。所制备样品具有良好的六方层状结构,粉体颗粒呈类球形形貌,且粒径分布范围窄。
(2) Mg2+掺杂能够明显提高LMNO材料的首次库仑效率、循环稳定性和高倍率容量。当Mg2+掺杂量为2%时,LMNO电池样品具有良好的电化学性能,其首次库仑效率为78.8%,在1 C倍率下的放电比容量为171.8 mAh/g,循环200次后的容量保持率高达90.3%;同时,在5 C倍率下的放电比容量仍保持为111.8 mAh/g。
(3) 通过Mg2+掺杂,能够扩大LMNO晶体的层间距,并增强其结构稳定性,从而大幅度提高了该材料的电化学性能。
| [1] |
董鹏, 张英杰, 刘嘉铭, 等. 纳米磷酸铁包覆锂离子电池正极材料LiNi0.5Co0.2Mn0.3O2的制备及其电化学性能[J]. 材料工程, 2017, 45(11): 49-57. DOND P, ZHANG Y J, LIU J M, et al. Fabrication and electrochemical performance of LiNi0.5Co0.2Mn0.3O2 coated with nano FePO4 as cathode material for lithium-ion batteries[J]. Journal of Materials Engineering, 2017, 45(11): 49-57. |
| [2] |
CROY J R, ABOUIMRANE A, ZHANG Z. Next-generation lithium-ion batteries: the promise of near-term advancements[J]. Mrs Bulletin, 2014, 39(5): 407-415. DOI:10.1557/mrs.2014.84 |
| [3] |
ANDRE D, KIM S J, LAMP P, et al. Future generations of cathode materials: an automotive industry perspective[J]. Journal of Materials Chemistry:A, 2015, 3(13): 6709-6732. DOI:10.1039/C5TA00361J |
| [4] |
MENG X B, YANG X Q, SUN X L. Emerging applications of atomic layer deposition for lithium-ion battery studies[J]. Advanced Materials, 2012, 24(27): 3589-3615. DOI:10.1002/adma.201200397 |
| [5] |
LI Y, BAI Y, BI X, et al. An effectively activated hierarchical nano-microspherical Li1.2Ni0.2Mn0.6O2 cathode for long-life and high-rate lithium-ion batteries[J]. Chemsuschem, 2016, 9(7): 728-735. DOI:10.1002/cssc.201501548 |
| [6] |
HOSONO E, SAITO T, HOSHINO J, et al. Synthesis of LiNi0.5Mn1.5O4 and 0.5Li2MnO3-0.5LiNi1/3Co1/3Mn1/3O2 hollow nanowires by electrospinning[J]. Crystengcomm, 2013, 15(14): 2592-2597. DOI:10.1039/c3ce26972h |
| [7] |
SUN Y, LEE M J, YOON C S, et al. The role of AlF3 coatings in improving electrochemical cycling of Li-enriched nickel-manganese oxide electrodes for Li-ion batteries[J]. Advanced Materials, 2012, 24(9): 1192-1196. DOI:10.1002/adma.201104106 |
| [8] |
LIU B, ZHANG Q, HE S C, et al. Improved electrochemical properties of Li1.2Ni0.18Mn0.59Co0.03O2 by surface modification with LiCoPO4[J]. Electrochimica Acta, 2011, 56(19): 6748-6751. DOI:10.1016/j.electacta.2011.05.071 |
| [9] |
LI J F, ZHAN C, LU J, et al. Improve first-cycle efficiency and rate performance of layered-layered Li1.2Mn0.6Ni0.2O2 using oxygen stabilizing dopant[J]. 2015, 7(29): 16040-16045.
|
| [10] |
ZANG Y, DING C X, WANG X C, et al. Molybdenum-doped lithium-rich layered-structured cathode material Li1.2Ni0.2Mn0.6O2 with high specific capacity and improved rate performance[J]. Electrochimica Acta, 2016, 6(36): 30194-30198. |
| [11] |
HE Z, WANG Z, CHEN H, et al. Electrochemical performance of zirconium doped lithium rich layered Li1.2Mn0.54 Ni0.13Co0.13O2 oxide with porous hollow structure[J]. Journal of Power Sources, 2015, 299: 334-341. DOI:10.1016/j.jpowsour.2015.09.025 |
| [12] |
ZHOU L, LI J, HUANG L S, et al. Sn-doped Li1.2Mn0.54Ni0.13Co0.13O2 cathode materials for lithium-ion batteries with enhanced electrochemical performance[J]. Journal of Solid State Electrochemistry, 2017, 21(12): 3467-3477. DOI:10.1007/s10008-017-3688-y |
| [13] |
LI Q, LI G S, FU C C, et al. K+-doped Li1.2Mn0.54Co0.13Ni0.13O2: a novel cathode material with an enhanced cycling stability for lithium-ion batteries[[J]. ACS Applied Materials & Interfaces, 2014, 6(13): 10330-10341. |
| [14] |
WANG D, HUANG Y, HUO Z Q, et al. Synthesize and electrochemical characterization of Mg-doped Li-rich layered Li[Li0.2Ni0.2Mn0.6]O2 cathode materia[J]. Electrochimica Acta, 2013, 107: 461-466. DOI:10.1016/j.electacta.2013.05.145 |
| [15] |
YAN W W, LIU Y N, GUO S W, et al. Effect of defects on decay of voltage and capacity for Li[Li0.15Ni0.2Mn0.6]O2 cathode material[J]. ACS Applied Materials & Interfaces, 2016, 8(19): 12118-12126. |
| [16] |
JIN X, XU Q J, LIU H M, et al. Excellent rate capability of Mg doped Li[Li0.2Ni0.13Co0.13Mn0.54]O2 cathode material for lithium-ion battery[J]. Electrochimica Acta, 2014, 136: 19-26. DOI:10.1016/j.electacta.2014.05.043 |
| [17] |
SHOJAN J, CHITTURI V R, SOLER J, et al. High energy xLi2MnO3-(1-x)LiNi2/3Co1/6Mn1/6O2 composite cathode for advanced Li-ion batteries[J]. Journal of Power Sources, 2015, 274: 440-450. DOI:10.1016/j.jpowsour.2014.10.032 |
| [18] |
ZHANG L Q, TAKADA K, OHTA N, et al. Layered (1-x-y)LiNi1/2Mn1/2O2·xLi[Li1/3Mn2/3O2]·yLiCoO2 (0≤x=y≤0.3 and x+y=0.5) cathode materials[J]. Journal of Electrochemical Society, 2015, 152(1): A171-A178. DOI:10.1149/1.1829416 |
| [19] |
NAYAK P K, GRINCLAT J, LEVI M, et al. Effect of Fe in suppressing the discharge voltage decay of high capacity Li-rich cathodes for Li-ion batteries[J]. Journal of Solid State Electrochemistry, 2015, 19(9): 2781-2792. DOI:10.1007/s10008-015-2790-2 |
| [20] |
OH P, MYEONG S, CHO W, et al. Superior long-term energy retention and volumetric energy density for Li-rich cathode materials[J]. Nano Letters, 2014, 14(10): 5965-5972. DOI:10.1021/nl502980k |
| [21] |
LIU C, WANG Z Y, SHI C S, et al. Nanostructured hybrid layered-spinel cathode material synthesized by hydrothermal method for lithium-ion batteries[J]. 2014, 6(11): 8363-8368.
|
 2020, Vol. 48
2020, Vol. 48


