文章信息
- 孙昊, 贾凯波, 赵凤光, 张羊换, 任慧平
- SUN Hao, JIA Kai-bo, ZHAO Feng-guang, ZHANG Yang-huan, REN Hui-ping
- Mg22Y2Ni10Cu2储氢合金的放氢性能
- Dehydrogenation properties of Mg22Y2Ni10Cu2 hydrogen storage alloy
- 材料工程, 2020, 48(9): 100-106
- Journal of Materials Engineering, 2020, 48(9): 100-106.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.000684
-
文章历史
- 收稿日期: 2019-07-22
- 修订日期: 2020-05-13
Mg2Ni合金是一种具有广阔的应用前景的储氢合金,它不但具有高的储氢密度(气态储氢为3.6%,质量分数,下同),同时还具有丰富的资源和低廉的价格[1-2],然而其吸放氢性能虽然与纯Mg相比有所提升,但是距离实际应用尚有一定差距,特别是在放氢性能方面,如所需温度仍然较高,动力学性能依然较差等[3]。为了能够进一步提高Mg2Ni合金的储氢性能,研究者们采用机械合金化[4]、快淬[5]、氢燃烧[6]等制备方法,或者是采用改变化学成分的方法,如元素替代[7]、增加过渡族元素[8]、添加催化剂[9]等来提高合金的吸放氢性能。上述方法的应用都起到了良好的改善性能的作用。如Song等[10]用少量的稀土钇替代Mg2Ni合金中部分Mg元素后,快淬态的新合金的动力学性能得到明显改善,同时还提高了吸氢量。Si[11]和Hsu等[12]的研究结果表明,铜对镍的取代促进了Mg2NiH4的脱氢。其中Si等[11]的研究结果还表明,铜替代部分镍后,合金的脱氢的焓变由64.4 kJ/mol降低到59.8 kJ/mol,脱氢起始温度由525 K降低到504 K。基于以上研究可以发现,Y对Mg的替代或者是Cu对Ni的替代成为改善Mg2Ni型储氢合金放氢性能最为有效的方法之一,但在加入Y和Cu后,关于Mg2Ni型储氢合金的放氢过程和放氢机制尚需进一步研究。
鉴于此,本工作通过在冶炼过程中向Mg2Ni合金中加入少量Y和Cu元素,制备了元素组成为Mg22Y2Ni10Cu2的合金铸锭,研究了元素替代后Mg2Ni型储氢合金相组成及吸氢相的放氢次序和放氢机制。
1 实验材料与方法 1.1 实验材料在0.04 MPa的氦气保护下,采用中频感应炉制备了Mg22Y2Ni10Cu2合金铸锭,其化学成分(质量分数/%)为Mg 39.9, Ni 40.2, Cu 8.6, Y 11.3。之后,在真空手套箱中将铸锭破碎成200目的粉末备用。
1.2 样品的结构表征粉末样品的相结构采用X射线衍射仪(XRD,Panalytical X’pert ProPowder)进行表征,Cu靶,扫描速率为1 (°)/min。形貌特征则通过场发射扫描电镜(SEM,Sigma500)进行观察,并借助透射电子显微镜(TEM,JEM-2100F)对放氢后的样品进行了高分辨观察及其选区衍射分析。
1.3 合金的吸放氢性能测试合金在3 MPa氢压,573 K温度下,在自动的Sieverts设备上完成吸氢。放氢测试采用两种办法:一是将吸氢后合金借助高压型差示扫描量热仪(DSC 204 HP)以3, 5, 10, 20 K/min速率升温到673 K,其中对5 K/min速率下的样品分别加热到453,483,558,578 K。另一种是借助Sieverts设备,在1×10-4 MPa氢压力条件下,分别在553,573,593,613 K 4个温度下等温放氢。
2 结果与分析 2.1 铸态合金的相组成与组织形貌图 1为铸态合金的X射线衍射图谱。可以看出,合金是由3种相组成,分别为主相Mg2Ni, YMgNi4和少量的Mg。需要注意的是,Cu未出现在XRD的结果中,结合文献[11],认为铜元素被全部用来替代了镍元素,使Mg2Ni相成为含铜的Mg2(Ni, Cu)相。

|
图 1 铸态合金的XRD图谱 Fig. 1 XRD patterns of as-cast alloy |
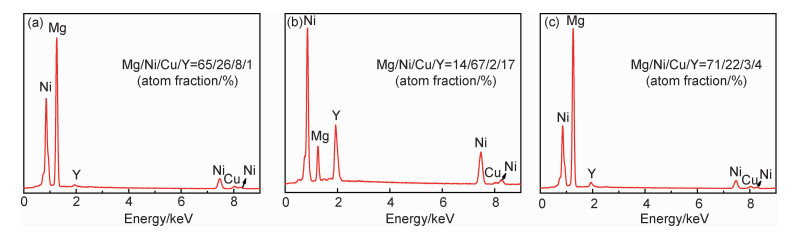
图 2为铸态合金的扫描电镜形貌及其粉态的背散射照片,同时对背散射照片中具有不同背底的区域做了能谱分析(见图 3)。图 2中合金的基体具有清晰的片层状结构特征,且具有相同位向的片层区大小不一,片层区交界处参差不齐,同时在基体上还分布着具有尖锐棱角的白色组织。借助图 2中的插图能够发现,在背散射的情况下,合金具有灰色、白色和深灰色3种组织,结合能谱结果及Mg-Ni-Y的三元相图[13]可知,合金结晶时首先形成的是亮白色的YMgNi4相,之后以先共析的方式形成灰色的组织Mg2(Ni, Cu),同时,此相中Cu/Ni为8/26=0.31远大于合金的成分配比(0.20),这主要是因为先生成YMgNi4相消耗了过多的Ni,影响了Mg2Ni相结晶时的成分起伏,此时只能用更多的Cu原子来替代Ni原子完成结晶,而过多的Cu替代了Ni必然会对合金吸放氢性能产生影响。除了这两种组织之外,还有部分深灰色的Mg2Ni+Mg的共晶组织。形貌分析的结果与XRD的结果是一致的。

|
图 2 铸态合金的SEM形貌及其背散射照片 Fig. 2 SEM morphology and backscatter photo of as-cast alloy |
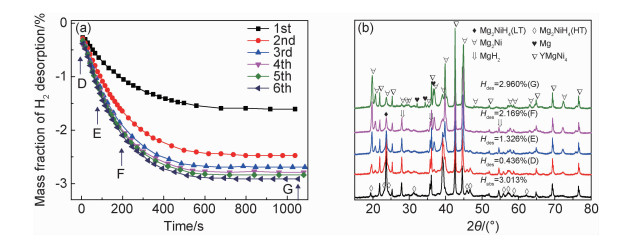
为了使合金具备较好的吸放氢性能,合金在正常吸放氢前,需要通过反复吸放氢的方法破坏合金表面的氧化膜,并在合金内部建立氢原子的扩散通道,使合金活化。图 4(a)为合金活化时的放氢曲线,随着放氢次数的增加,放氢量和速率增加,在前6次放氢时,每次达到最大放氢量90%时所用的时间分别为446, 418, 360, 354, 342 s和336 s。放氢速率较大的原因主要包括两方面:首先与合金中部分Ni被Cu取代有关,Si等[11]认为Cu的取代量低于Cu/Ni=0.1时,合金吸氢后形成稳定性较低的Mg2(Ni, Cu)H4相,故其放氢更加容易,动力学性能较好。其次是Y的添加,细化了晶粒,增加了晶界数量,同时形成了新相YMgNi4[14],造成了组织疏松,这些缺陷的增加为氢扩散提供了良好的通道,使合金具有较大的放氢速率。
|
图 4 合金活化时的6次放氢曲线(a)及第6次放氢时不同阶段的XRD图谱(b) Fig. 4 Six dehydrogenation curves (a) during alloy activation and XRD patterns (b) of different stages during the sixth dehydrogenation |
为了分析合金在放氢过程中相的转变,对不同放氢阶段的样品进行了XRD测试,如图 4(b)所示。可以看出,此时Mg2Ni吸氢后全部转变为两种结构的Mg2NiH4相,Mg转变为MgH2相,但YMgNi4相没有发生变化。放氢时,随着放氢量的逐渐增加,Mg2NiH4衍射峰强度逐渐弱化,而与此同时Mg2Ni峰在显著增加。但MgH2相在放氢达到2.169%之前保持稳定,直到放氢结束后才消失,出现了Mg单质。上述分析表明,合金在放氢过程中,首先放氢的是Mg2NiH4相,而MgH2相放氢较晚。
2.3 等温放氢的机制与放氢动力学为了分析氢化物脱氢时的机理变化,将不同温度下的放氢动力学曲线,借助成核和生长过程的速率方程(1)(Avrami-Erofeev equation)[15]进行了拟合,结果如图 5(a)及表 1所示。
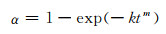
|
(1) |
|
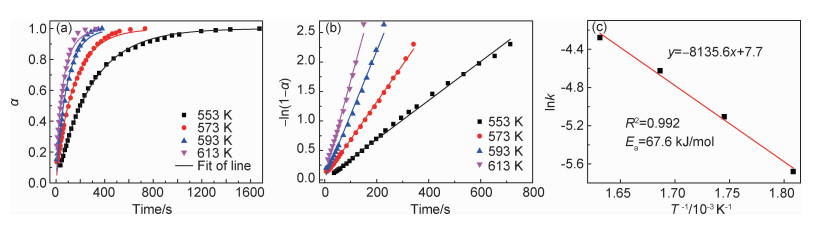
图 5 合金在不同温度下放氢曲线拟合及活化能计算 (a)放氢曲线的拟合;(b)-ln(1-α)与时间关系的线性拟合;(c)活化能计算 Fig. 5 Fitting of hydrogen desorption curves and calculation of activation energy of alloy at different temperatures (a)fitting of dehydrogenation curves; (b)linear fitting of the relationship between -ln(1-α) and time; (c)calculation of activation energy |
式中:α为反应速率,即反应物与总物质的比率;k和m为常数;t为反应时间。
表 1中的拟合结果显示,拟合的参数R2值均大于0.98,表明4个温度下放氢曲线均符合Avrami-Erofeev公式,也说明氢化物的放氢过程是以随机成核和随后生长的机理完成,与Ouyang等[16]描述的其他金属氢化物类似。另外,4个温度的m值随着温度的升高呈现出略微下降的趋势,但均在1附近,说明在553~613 K之间,温度变化对氢化物的脱氢机理影响较小,但随温度升高,能量的增加有利于晶核形成和随后的长大速率,使m值有所减小。
当m=1时,Avrami-Erofeev方程经过推导可以变化为
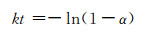
|
(2) |
依据此公式,绘制了氢化物在553, 573, 593, 613 K 4个温度下,放氢时的-ln (1-α)与时间t的对应曲线,发现每条曲线都具有较好的线性化,如图 5(b)所示,其线性化时对应的斜率即为该温度下的k值,根据4个温度各自对应的k值,利用Arrhenius定律[17]确定活化能,如式(3)所示:
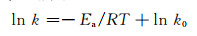
|
(3) |
因此,合金放氢的活化能可通过ln k和1/T对比图(见图 5(c))而获得Ea=67.6 kJ/mol,该值低于文献[18]中Mg2NiH4的放氢活化能。性能的改善得益于合金特殊的组织结构与相组成,首先通过图 2可见合金基体为片层状组织,而且不同位向的片层区间交错生长,这种结构中的晶体缺陷易于氢原子的快速扩散。同时YMgNi4相多具有不规则的外形,且含有大量的尖锐棱角,这也可以在晶体内部形成缺陷,为氢原子扩散提供通道。另外,Y的加入可以细化晶粒,而Cu对Ni的替代造成Mg2(Ni, Cu)H4相稳定性降低。为了进一步分析合金性能改善的原因,对放氢后的样品进行了扫描电镜及透射电镜观察,如图 6所示。通过放氢后的背散射照片(图 6(a))可以看出,合金放氢后的组织是由多个颜色深浅不一的颗粒团聚在一起组成,这种松散的团聚体能够为氢扩散提供通道。在这些团聚体中,白色的小颗粒是一种属于Laves相的金属间化合物(YMgNi4相),具有较高的硬度,该相在经历反复吸放氢时,虽未直接参与吸放氢,但却限制了主相吸放氢时的晶体膨胀和收缩,合金中形成了内应力,造成材料开裂,晶粒逐渐细化,乃至产生大量的纳米晶,进而提高了合金的动力学性能。图 6(b)~(d)也证实了放氢后的合金中存在大量的具有纳米晶结构的物相。从图 6(b)可明显看出合金中存在大量深浅不一、长度或者直径不超过20 nm的颗粒物,表明有不同的纳米级物相分散分布。而从图 6(c), (d)中则发现了Mg2Ni相以及YMgNi4相的纳米晶,特别是从图 6(d)中还发现了YH3和YH2相,推测这是微量Y溶入基体后,经过吸氢形成的,文献报道[19]称这类氢化物对合金的吸放氢具有催化作用。上述原因使合金的放氢性能得到提高。

|
图 6 放氢后样品的SEM和TEM图 (a)SEM背散射图;(b)TEM形貌;(c)高分辨图谱及选区衍射;(d)高分辨图谱 Fig. 6 SEM and TEM images of samples after dehydrogenation (a)SEM backscattering image; (b)TEM morphology; (c)HRTEM image and SAED; (d)HRTEM image |
图 7(a)为吸氢合金以5 K/min的速率升温到不同温度的DSC曲线。图中升温到673 K的曲线显示出有两个明显的吸热峰,其峰位分别为512 K和605.3 K。加热目标为483 K和558 K的两条曲线,在升温段都只有一个吸热峰,其中558 K的峰位也在512 K的位置上。由于设备的热惰性,加热目标的483 K会继续升温到522.2 K,并在513.7 K时出现了一个小的吸热峰,这可能是升温速率降低导致此吸热峰位比512 K约高1.7 K。结合文献报道[20],认为升温时每条曲线的第一个峰都是LT-Mg2NiH4相向HT-Mg2NiH4相的晶型转变点。在降温过程中,升温目标不同的DSC曲线,降温段处表现也不同。加热目标分别为483 K和558 K的两条降温曲线在约505 K时,均出现了一个小的放热峰(图 7(a)中插图),该峰则是由HT-Mg2NiH4相向LT-Mg2NiH4相的晶型改变而造成的,升温时的512 K与降温时的505 K是相互对应的转变点,两者之所以出现7 K的差值,则是由相转变发生时必须有过热度或者过冷度而造成的。加热目标为579 K和673 K,所对应的曲线经历了第2个放热峰,在降温过程中,曲线较为平滑,没有明显的峰出现,说明峰位为605.3 K的放热峰是由HT-Mg2NiH4相的放氢造成的。在5 K/min加热速率下,氢化物在580.8 K时开始放氢,放氢峰对应最高点为605.3 K。
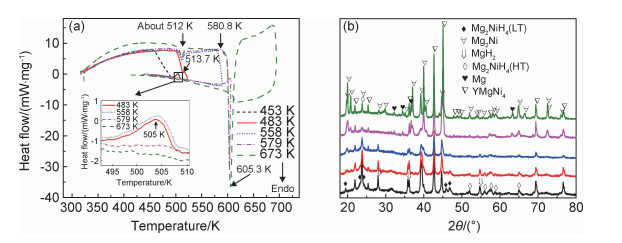
|
图 7 5 K/min升温速率下样品的DSC(a)及对应的XRD图谱(b) Fig. 7 DSC (a) and corresponding XRD patterns (b) of samples at 5 K/min heating rate |
为了研究上述DSC测试过程中合金的放氢与相转变,将不同加热目标的样品均进行了XRD测试,结果见图 7(b)。加热到453 K的合金没有发现任何吸放热峰,表明材料没有相变发生,所以此时的XRD结果与吸氢后的样品一致,衍射峰中包括高低温的Mg2NiH4相、MgH2相和YMgNi4相。当加热目标为483 K(实际达到522.2 K)时,升温曲线虽出现了第1个吸热峰,但此时样品的XRD图谱与453 K时的大致相同,这也证明第1个吸热峰就是Mg2NiH4相的晶型转变。当加热到558 K时,XRD图谱发生了改变,有一定量的Mg2Ni相出现,这主要是因为实际加热温度达到了589.2 K,超过了合金氢化物开始放氢的580.8 K,使部分Mg2NiH4相放氢,导致合金中有一定量的Mg2Ni生成,此时未发现Mg相,说明MgH2相还没有放氢。当加热目标为579 K时,DSC曲线的放氢峰很不完整,但在降温曲线中,也没有发现放热峰,说明到此温度下绝大部分Mg2NiH4相已参与了放氢,同时有Mg相峰,说明MgH2相也已放氢。当加热目标为673 K时,合金完成了全部的放氢过程,衍射峰也表明合金中Mg2NiH4相已经全部转变为Mg2Ni相。同时可以看出与579 K的样品存在明显不同,Mg相峰明显增加,说明在放氢后期,两种氢化物一起放氢,这与动力学测试时等温放氢的情况类似,Mg2NiH4相首先开始放氢是得益于Mg2NiH4相的动力学性能优于MgH2相,同时MgH2相的存在起到了一定的催化作用[21],加快了Mg2NiH4相的放氢,当Mg2NiH4相放氢到后期时,合金中建立了较多的氢扩散通道,为MgH2相放氢创造了条件,同时MgH2相放氢前也已生成,MgH2相开始与Mg2NiH4相一起放氢。
将合金分别以3, 5, 10, 20 K/min的加热速率对饱和吸氢材料进行DSC测试,结果如图 8(a)所示。同样可以发现无论升温速率如何,合金也会在约512 K时出现放热峰,如前所述,该峰为低温晶型向高温晶型转变的相变点。同时利用Kissinger方程[22]计算此时的活化能,如式(4)所示:
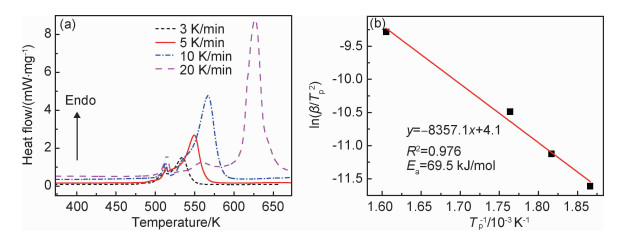
|
图 8 不同升温速率下合金的DSC(a)及对应的活化能(b) Fig. 8 DSC (a) and corresponding activation energy (b) of alloy at different heating rates |

|
(4) |
式中:β为加热速率;Tp为峰值温度;Ea为放氢活化能;R为标准气体常数。β与Tp的对应关系如图 8(b)所示。可见ln(β/Tp2)与1/Tp具有良好的线性关系,其中斜率为Ea/R。通过Kissinger方程计算得到合金的放氢活化能为69.5 kJ/mol,与上述Arrhenius方法获得的值非常接近。
3 结论(1) 铸态合金基体为片层状组织,其相组成为主相Mg2(Ni, Cu), YMgNi4以及少量Mg,其中Mg2(Ni, Cu)中Cu/Ni为0.31,高于合金中的成分配比。
(2) 553, 573, 593, 613 K 4个温度下放氢曲线均符合Avrami-Erofeev公式,说明氢化物的放氢过程是以随机成核和随后生长的机理完成,通过拟合参数m值的变化,发现温度变化对氢化物的脱氢机制影响较小,但随温度升高,晶核形成和随后的长大速率都加快,使m值有所减小。
(3) 无论是等温加热还是变温加热,氢化物都是Mg2NiH4相先放氢,MgH2相后放氢,且在两种情况下的活化能非常接近,分别为67.6 kJ/mol和69.5 kJ/mol。
| [1] |
FU H, WU W S, DOU Y, et al. Hydrogen diffusion kinetics and structural integrity of superhigh pressure Mg-5wt%Ni alloys with dendrite interface[J]. Journal of Power Sources, 2016, 320: 212-221. DOI:10.1016/j.jpowsour.2016.04.045 |
| [2] |
OH S, KIM M, EOM K, et al. Design of Mg-Ni alloys for fast hydrogen generation from seawater and their application in polymer electrolyte membrane fuel cells[J]. International Journal of Hydrogen Energy, 2016, 41(10): 5296-5303. DOI:10.1016/j.ijhydene.2016.01.067 |
| [3] |
孙昊, 冯佃臣, 任慧平, 等. 球磨Mg22Y2Ni10Cu2+x%Ni复合材料储氢性能研究[J]. 稀有金属, 2018, 42(1): 14-20. SUN H, FENG D C, REN H P, et al. Hydrogen storage properties of Mg22Y2Ni10Cu2 +x% Ni composite prepared by ball milling[J]. Chinese Journal of Rare Metals, 2018, 42(1): 14-20. |
| [4] |
伟伟, 田晓, 特古斯, 等. 机械合金化MlNi3.55Co0.75Mn0.4Al0.3/Mg复合储氢合金的相结构和电化学性能[J]. 稀土, 2015, 36(1): 69-73. WEI W, TIAN X, TE G S, et al. Phase structure and electrochemical properties of MlNi3.55Co0.75Mn0.4Al0.3/Mg composite alloys prepared by mechanical alloying[J]. Chinese Rare Earths, 2015, 36(1): 69-73. |
| [5] |
张云龙, 李金山, 张铁邦, 等. 熔体快淬Zr0.9Ti0.1V2.2合金的微结构与储氢性能[J]. 稀有金属材料与工程, 2015, 44(6): 1465-1468. ZHANG Y L, LI J S, ZHANG T B, et al. Microstructure and hydrogen storage properties of melt-spun Zr0.9Ti0.1V2.2[J]. Rare Metal Materials and Engineering, 2015, 44(6): 1465-1468. |
| [6] |
GU H, ZHU Y F, LI L Q. Hydrogen storage properties of Mg-Ni-Cu prepared by hydriding combustion synthesis and mechanical milling (HCS + MM)[J]. International Journal of Hydrogen Energy, 2009, 34(6): 2654-2660. DOI:10.1016/j.ijhydene.2009.01.068 |
| [7] |
张羊换, 杨泰, 吴征洋, 等. RE(RE=Nd, Sm, Pr)部分替代A2B7型合金电化学贮氢性能的影响[J]. 稀有金属, 2015, 39(1): 1-10. ZHANG Y H, YANG T, WU Z Y, et al. Electrochemical hydrogen storage performance of A2B7-type electrode alloys with partial substitution of RE (RE=Nd, Sm, Pr) for La[J]. Chinese Journal of Rare Metals, 2015, 39(1): 1-10. |
| [8] |
LV Y J, ZHANG B, WU Y. Effect of Ni content on microstructural evolution and hydrogen storage properties of Mg-xNi-3La (x=5, 10, 15, 20 at.%) alloys[J]. Journal of Alloys and Compounds, 2015, 641: 176-180. DOI:10.1016/j.jallcom.2015.04.074 |
| [9] |
HOU X J, HU R, ZHANG T B, et al. Hydrogenation thermodynamics of melt-spun magnesium rich Mg-Ni nanocrystalline alloys with the addition of multiwalled carbon nanotubes and TiF3[J]. Journal of Power Sources, 2016, 306: 437-447. DOI:10.1016/j.jpowsour.2015.12.050 |
| [10] |
SONG W J, LI J S, ZHANG T B, et al. Microstructure and tailoring hydrogenation performance of Y-doped Mg2Ni alloys[J]. Journal of Power Sources, 2014, 245: 808-815. DOI:10.1016/j.jpowsour.2013.07.049 |
| [11] |
SI T Z, MA Y, LI Y T, et al. Solid solution of Cu in Mg2NiH4 and its destabilized effect on hydrogen desorption[J]. Materials Chemistry and Physics, 2017, 193: 1-6. DOI:10.1016/j.matchemphys.2017.02.004 |
| [12] |
HSU F K, HSU C W, CHANG J K, et al. Structure and hydrogen storage properties of Mg2Cu1-xNix(x=0-1) alloys[J]. International Journal of Hydrogen Energy, 2010, 35(24): 13247-13254. DOI:10.1016/j.ijhydene.2010.09.034 |
| [13] |
MEZBAHUL-ISLAM M, MAMOUN M. A critical thermodynamic assessment of the Mg-Ni, Ni-Y binary and Mg-Ni-Y ternary systems[J]. Calphad, 2009, 33: 478-486. DOI:10.1016/j.calphad.2009.01.001 |
| [14] |
SUN H, FENG D C, ZHANG Y H, et al. Gas hydrogen absorption and electrochemical properties of Mg24Ni10Cu2 alloys improved by Y substitution, ball milling and Ni addition[J]. International Journal of Hydrogen Energy, 2019, 44: 5382-5388. DOI:10.1016/j.ijhydene.2018.08.156 |
| [15] |
ZHU M, GAO Y, CHE X Z, et al. Hydriding kinetics of nano-phase composite hydrogen storage alloys prepared by mechanical alloying of Mg and MmNi5-x(CoAlMn)x[J]. Journal of Alloys and Compounds, 2002, 330: 708-713. |
| [16] |
OUYANG L Z, DONG H W, ZHU M. Mg3Mm compound based hydrogen storage materials[J]. Journal of Alloys and Compounds, 2007, 446/447: 124-128. DOI:10.1016/j.jallcom.2007.02.160 |
| [17] |
YUAN Z M, YANG T, BU W G, et al. Structure, hydrogen storage kinetics and thermodynamics of Mg-base Sm5Mg41 alloy[J]. International Journal of Hydrogen Energy, 2016, 41(14): 5994-6003. DOI:10.1016/j.ijhydene.2016.02.108 |
| [18] |
张国芳, 翟亭亭, 胡锋, 等. 纳米CuO催化剂晶粒尺寸对Mg2Ni基复合材料储氢性能的影响[J]. 材料工程, 2018, 46(7): 151-156. ZHANG G F, ZHAI T T, HU F, et al. Effect of different sizes of nano CuO catalysts on hydrogen storage properties of Mg2Ni based composites[J]. Journal of Materials Engineering, 2018, 46(7): 151-156. DOI:10.11868/j.issn.1001-4381.2017.001333 |
| [19] |
WU Z W, LI Y T, ZHANG Q A. Catalytic effect of nanostructured Mg2Ni and YH2/YH3 on hydrogen absorption-desorption kinetics of the Mg-Cu-H system[J]. Journal of Alloys and Compounds, 2016, 685: 639-646. DOI:10.1016/j.jallcom.2016.05.346 |
| [20] |
ZHANG J, ZHOU D W, HE L P, et al. First-principles investigation of Mg2Ni phase and high/low temperature Mg2NiH4 complex hydrides[J]. Journal of Physics and Chemistry of Solids, 2009, 70: 32-39. DOI:10.1016/j.jpcs.2008.09.018 |
| [21] |
CHITSAZKHOYI L, RAYGAN S, POURABDOLI M. Mechanical milling of Mg, Ni and Y powder mixture and investigating the effects of produced nanostructured MgNi4Y on hydrogen desorption properties of MgH2[J]. International Journal of Hydrogen Energy, 2013, 38(16): 6687-6693. DOI:10.1016/j.ijhydene.2013.03.075 |
| [22] |
ZHANG Y H, LI Y Q, SHANG H W, et al. Hydrogen storage performance of the as-milled Y-Mg-Ni alloy catalyzed by CeO2[J]. International Journal of Hydrogen Energy, 2018, 43(3): 1643-1650. DOI:10.1016/j.ijhydene.2017.11.112 |
 2020, Vol. 48
2020, Vol. 48