文章信息
- 马开心, 刘琪, 白甜, 路子杰, 于黎楠, 莫琛, 赵孔银, 刘亚
- MA Kai-xin, LIU Qi, BAI Tian, LU Zi-jie, YU Li-nan, MO Chen, ZHAO Kong-yin, LIU Ya
- 聚酯无纺布支撑CaAlg/CaSiO3@SiO2的制备及其对Pb2+的吸附
- Preparation of polyester nonwovens supported CaAlg/CaSiO3@SiO2 and its adsorption for Pb2+
- 材料工程, 2020, 48(9): 86-92
- Journal of Materials Engineering, 2020, 48(9): 86-92.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.001024
-
文章历史
- 收稿日期: 2019-11-13
- 修订日期: 2020-05-13
2. 天津工业大学 纺织科学与工程学院, 天津 300387
2. School of Textile Science and Engineering, Tianjin Polytechnic University, Tianjin 300387, China
机械制造、化工、矿冶、电子、仪表等工业在生产过程中产生的重金属废水,是对水体污染最严重和对人类健康危害最大的工业废水之一[1]。经过多年的研究与发展,已形成多种重金属处理技术,其中包含化学沉淀法[2-3]、电化学法[4-5]、氧化还原法[6-7]、膜分离法[8-9]、离子交换法[10-11]和吸附法[12-13]。吸附法是应用多孔性吸附材料去除废水中重金属的一种方法,因其低廉的价格受到广泛关注[14]。纤维材料由于其比表面积大、机械强度高且可以被制成各种需要的形状等优点被应用于吸附重金属离子。
其中,聚酯无纺布综合性能优良,且其生产工艺简单,价格低廉。Niu等[15]制备了一种新型壳聚糖改性聚对苯二甲酸乙二醇酯(PET)纤维复合吸附材料,用于吸附水体中的重金属离子,如Pb2+,Cr2+等。海藻酸钙是一种很好的重金属吸附材料,陈宏等[16]通过动态柱实验发现海藻酸钙对Cr2+,Cd2+,Pb2+的脱除率达到80%~90%,且海藻酸钙材料还可多次重复使用[17],实验中通过对材料5次吸附5次脱出后再进行吸附,去除率仍可达到85%以上。但海藻酸钙吸附材料一般以微球或微囊的形态使用,其在水体中易溶胀、难回收,且由于微球、微囊的尺寸较大,重金属离子达到饱和吸附的速率较慢。之前的研究中将海藻酸钠与硅酸钙共混,经过钙离子交联制备了硅酸钙-海藻酸钙复合水凝胶膜,并观测了其形貌[18]。硅酸钙的加入提高了海藻酸钙水凝胶的力学性能,显著降低了其溶胀。但是硅酸钙-海藻酸钙复合水凝胶膜在吸附过程中操作不便,且由于膜的厚度较大,重金属达到平衡吸附的时间长,膜在投放回收过程中容易被破坏,材料难以实际应用。
本工作将海藻酸钠与硅酸钠一起溶解于水中,经钙离子交联,稀盐酸处理,制备表面含介孔二氧化硅的聚对苯二甲酸乙二醇酯纤维支撑硅酸钙/海藻酸钙(PET-s-CaAlg/CaSiO3@SiO2)复合材料。通过扫描电子显微镜、红外光谱对材料进行表征,研究了材料在不同条件下对Pb2+的吸附性能。该吸附材料可改善海藻酸钙水凝胶在吸附过程中存在的难回收、吸附时间过长、海藻酸钙水凝胶易溶胀等问题。
1 实验材料与方法 1.1 实验材料试剂:海藻酸钠(SA,分析纯,Sigma公司);硅酸钠(分析纯,天津江天化工有限公司);硝酸铅(分析纯,天津市风船化学试剂科技有限公司);PET无纺布(济南润成新材料有限公司);盐酸(分析纯,天津市风船化学试剂科技有限公司);无水氯化钙(分析纯,上海麦克林生物有限公司)。
1.2 PET-s-CaAlg/CaSiO3@SiO2复合材料的制备图 1为PET-s-CaAlg/CaSiO3@SiO2复合材料的制备和吸附铅离子示意图。将同等质量的PET无纺布剪成片状,分别浸泡在5.0%(质量分数,下同)硅酸钠,0,0.5%,1.0%,1.5%,2.0%的海藻酸钠混合水溶液中0.5 h,取出后用滤纸除去PET无纺布表面的过量溶液,然后将其浸泡在5.0%的氯化钙水溶液中交联2 h。之后再浸泡在过量的pH=3.0的盐酸水溶液中2 h,最后用去离子水清洗至表面无盐酸残留,在80 ℃条件下,真空干燥24 h。按参考文献[17]中的方法计算纤维的增重率,为了数据的一致性,将纤维增重率在15%~30%的PET-s-CaAlg/CaSiO3@SiO2复合材料进行表征和铅离子吸附的实验。

|
图 1 PET-s-CaAlg/CaSiO3@SiO2的制备和吸附铅离子示意图 Fig. 1 Schematic representation for the preparation and Pb2+ adsorption of PET-s-CaAlg/CaSiO3@SiO2 |
(1) 3D超景深光学显微镜分析。将湿态的PET-s-CaAlg/CaSiO3@SiO2复合材料,用载玻片和盖玻片将样品固定在样品台上,在VHX-1000型3D超景深显微镜上观察其湿态的表面形貌。
(2) SEM分析。将PET-s-CaAlg/CaSiO3@SiO2复合材料干燥后,用导电胶将样品粘在样品台上,真空喷金,在Gemini SEM500型热场发射扫描电子显微镜上观察其表面形貌。
(3) 红外光谱分析。将PET材料和PET-s-CaAlg/CaSiO3@SiO2样品干燥后,用傅里叶变换红外光谱(FT-IR)分析样品的官能团组成。
(4) 多点BET法比表面积分析。将PET和PET-s-CaAlg/CaSiO3@SiO2样品放入Autosorb-iQ比表面积测试仪,在温度-196 ℃条件下,进行氮气吸附测定。测试前,样品在105 ℃下脱气4 h,以去除样品表面吸附的气体与杂质,比表面积采用多点BET法计算。
(5) TEM分析。将PET-s-CaAlg/CaSiO3@SiO2复合材料干燥后,用刀片刮下CaAlg/CaSiO3@SiO2粉末,采用Fei-Tecnai G2 F30透射电镜对CaAlg/CaSiO3@SiO2粉末进行形貌观测。
1.3.2 PET-s-CaAlg/CaSiO3@SiO2吸附性能测试将PET-s-CaAlg/CaSiO3@SiO2完全浸泡于20 mL的100 mg/L的Pb2+溶液中,变化初始海藻酸钠浓度、硅酸钠浓度、温度和pH,研究材料对Pb2+的吸附性能。用LK4600D重金属检测仪测量重金属离子的浓度,按照公式(1)计算材料对Pb2+的吸附量:
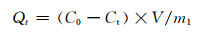
|
(1) |
式中:Qt为t时刻Pb2+在复合材料上的吸附量,mg/g;C0为溶液的初始浓度,mg/mL;Ct为t时刻溶液的浓度,mg/mL;V为溶液的体积,mL;m1为吸附剂的质量,g。
2 结果与讨论 2.1 PET-s-CaAlg/CaSiO3@SiO2的表征 2.1.1 PET-s-CaAlg/CaSiO3@SiO2的形貌图 2为PET-s-CaAlg/CaSiO3@SiO2复合材料和PET纤维的光学显微镜图,SEM图和TEM图。对比PET纤维及湿态下的PET-s-CaAlg/CaSiO3@SiO2复合材料(图 2(a),(b)),可看到PET-s-CaAlg/CaSiO3@SiO2复合材料表面有明显的CaAlg/CaSiO3@SiO2覆盖层。经过pH=3.0的盐酸处理后,在该复合材料表面形成了150~200 nm大小的介孔SiO2(如图 2(e)中箭头所示),这与文献报道一致[19],其原理为,通过盐酸处理,CaSiO3@SiO2分子中的Ca2+被两个H+取代,生成两个HO-,使硅酸钙的分子链被打开,形成硅羟基[20-21]。通过对该复合材料的TEM分析(图 2(f))也可以发现,介孔SiO2的直径在150~200 nm。

|
图 2 PET-s-CaAlg/CaSiO3@SiO2复合材料和PET纤维的光学显微镜图、SEM和TEM图 (a)PET的光学显微镜图;(b)PET-s-CaAlg/CaSiO3@SiO2的光学显微镜图;(c)PET的SEM图;(d),(e) PET-s-CaAlg/CaSiO3@SiO2不同放大倍数的SEM图;(f)PET-s-CaAlg/CaSiO3@SiO2的TEM图 Fig. 2 Optical microscope, SEM and TEM images of PET-s-CaAlg/CaSiO3 @ SiO2 composite and PET fiber (a)optical images of PET; (b)optical images of PET-s-CaAlg/CaSiO3@SiO2; (c)SEM images of PET; (d), (e)SEM images of PET-s-CaAlg/CaSiO3@SiO2 in different magnification; (f)TEM images of PET-s-CaAlg/CaSiO3@SiO2 |
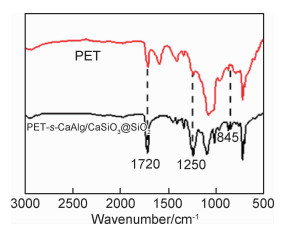
图 3为PET和PET-s-CaAlg/CaSiO3@SiO2复合材料的红外光谱图。PET-s-CaAlg/CaSiO3@SiO2复合材料在1500~1750 cm-1处的红外吸收峰是由CaAlg上的—COO—的对称伸缩振动引起的;在1250 cm-1处的红外吸收峰是CaAlg上的仲羟基弯曲振动吸收峰,表明CaAlg黏附到了PET无纺布上。在845 cm-1处是CaSiO3@SiO2上的Si—OH的伸缩振动峰,表明CaSiO3@SiO2成功地黏附到了PET无纺布上。
|
图 3 PET和PET-s-CaAlg/CaSiO3@SiO2的红外谱图 Fig. 3 Fourier transform infrared spectroscopy of PET and PET-s-CaAlg/CaSiO3@SiO2 |
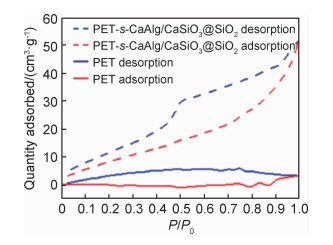
图 4为PET和PET-s-CaAlg/CaSiO3@SiO2复合材料的氮气吸附-脱附曲线。经多点BET法计算结果显示,PET-s-CaAlg/CaSiO3@SiO2复合材料的比表面积为41.259 m2·g-1,而PET纤维的比表面积仅为0.809 m2·g-1。经过盐酸处理的材料比表面积显著增加,这有利于其对Pb2+的吸附。
|
图 4 PET和PET-s-CaAlg/CaSiO3@SiO2的N2吸附-脱附曲线 Fig. 4 N2 adsorption and desorption curves of PET and PET-s-CaAlg/CaSiO3@SiO2 |
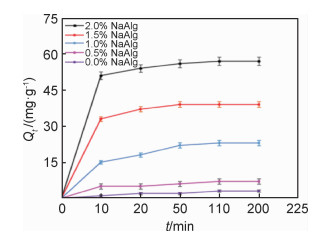
图 5为不同海藻酸钠浓度制备的PET-s-CaAlg/CaSiO3@SiO2对100 mg/L硝酸铅溶液的吸附量随时间变化的曲线。图 6为硅酸钠浓度与PET-s-CaAlg/CaSiO3@SiO2吸附容量的关系曲线。如图 5所示,随着溶液中海藻酸钠浓度的升高,对铅离子的吸附容量逐渐升高,而当海藻酸钠浓度达到2.0%时,溶液十分黏稠,再增加海藻酸钠的浓度导致PET无纺布上黏附的材料太厚,不利于钙离子交联等后续操作。
|
图 5 Pb2+的吸附量与NaAlg浓度的关系 Fig. 5 Relationship between the adsorption amount of Pb2+ and the concentration of NaAlg |

|
图 6 Pb2+的吸附量与Na2SiO3浓度的关系 Fig. 6 Relationship between the adsorption amount of Pb2+ and the concentration of Na2SiO3 |
随着硅酸钠浓度的升高,材料对于铅离子的吸附容量先逐渐升高后逐渐降低,当硅酸钠浓度为5.0%时达到最佳吸附状态。硅酸钠含量提高,可以有效地改善海藻酸钙的强度[18]。但当硅酸钠含量超过5.0%后,可以推测硅酸钠与钙离子反应生成的硅酸钙逐渐覆盖海藻酸钙,使得Pb2+与海藻酸钙难以接触,导致Pb2+吸附量的降低。所以本工作采用2.0%海藻酸钠和5.0%的硅酸钠制备吸附材料进行后续的Pb2+吸附研究。
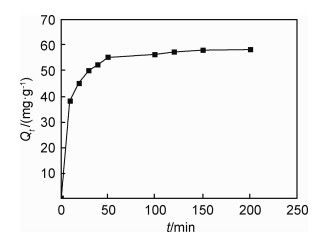
2.3 Pb2+的吸附动力学图 7显示了PET-s-CaAlg/CaSiO3@SiO2复合材料在温度为25 ℃,pH为6时,对Pb2+的吸附量随吸附时间的变化曲线。在吸附的初始时段,PET-s-CaAlg/CaSiO3@SiO2复合材料对于Pb2+吸附速率很大,但随着吸附时间增加,吸附速率开始降低。当达到50 min左右时,基本达到吸附平衡,此时吸附量为58.33 mg/g。为了研究吸附过程中的动力学规律,分别采用Lagergren一级动力学模型和二级动力学模型对Pb2+在PET-s-CaAlg/CaSiO3@SiO2复合材料上的吸附过程进行拟合。
|
图 7 Pb2+的吸附量随时间变化曲线 Fig. 7 Curve of Pb2+ adsorption capacity with time |
Lagergren一级动力学方程表达式为[22]:
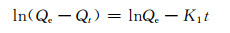
|
(2) |
Lagergren二级动力学方程表达式为:
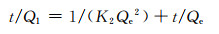
|
(3) |
式中:Qe,Qt分别为平衡时和t时刻时Pb2+在复合材料上的吸附量,mg/g;t为吸附时间,h;K1为一级速率常数,h-1;K2为二级吸附速率常数,h·mg/g;R为相关系数。
一级动力学和二级动力学模型均可对吸附动力学进行解释,但拟合模型的残差值R2不同。Pb2+的一级动力学模型拟合的残差值R2为0.9325,二级动力学模型拟合的残差值R2为0.9990。可见Pb2+的吸附过程更符合二级动力学模型。
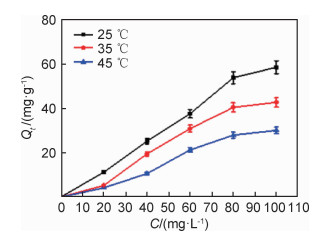
2.4 温度对吸附的影响图 8为PET-s-CaAlg/CaSiO3@SiO2复合材料对Pb2+的吸附量随温度变化的曲线。从图中可以看出PET-s-CaAlg/CaSiO3@SiO2复合材料对于Pb2+的吸附随着温度升高而降低。通常情况下吸附过程为放热过程,低温有利于吸附的进行[23]。
|
图 8 Pb2+吸附量随Pb2+浓度变化曲线 Fig. 8 Curves of Pb2+ adsorption capacity with Pb2+ concentrations |
从图 8中可以看出溶液的初始浓度越大,吸附平衡容量越高。为了研究吸附过程中的热力学规律,分别采用Langumuir热力学模型及Freundich热力学模型在温度为25 ℃时对Pb2+在PET-s-CaAlg/CaSiO3@SiO2复合材料上的吸附过程进行拟合。
Langumuir方程表达式为[22]:
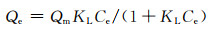
|
(4) |
Freundich方程表达式为:
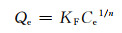
|
(5) |
式中:Qe为吸附平衡时的吸附量,mg/g;Qm为吸附剂质量,g;KL为吸附平衡常数;Ce为重金属离子浓度,mg/L;KF和n是Freundich常数。
Langumuir模型和Freundich模型均可对吸附热力学进行解释,但拟合模型的残差值R2不同。Pb2+的Langumuir模型拟合的残差值R2为0.8086,Freundich模型拟合的残差值R2为0.9661。可见Pb2+的吸附过程更符合Freundich模型。
2.6 pH值对Pb2+吸附的影响图 9为Pb2+的吸附量随pH变化的曲线。由图可知,PET-s-CaAlg/CaSiO3@SiO2对Pb2+的吸附量受pH值的影响较大。在0 < pH<4.0时,吸附量随着pH值增加大幅度增加;而当4.0 < pH<7.0,吸附量基本达到峰值。而当pH>7.0时,会析出氢氧化铅白色沉淀。当pH处于4.0~6.0时,PET-s-CaAlg/CaSiO3@SiO2复合材料对于Pb2+吸附效果最佳。表 1为本工作的材料与文献中材料对Pb2+的吸附量对比,可见本工作的材料具有较高的吸附量。

|
图 9 Pb2+的吸附量随pH变化曲线 Fig. 9 Variation curve of Pb2+ adsorption capacity with pH values |
本工作制备的PET-s-CaAlg/CaSiO3@SiO2复合材料除了吸附重金属离子,还可以同时吸附内分泌干扰物,对引起水中富营养化的氮磷也有去除效果。因此,该材料在水处理和环境保护领域有重要的应用前景。
3 结论(1) 在PET纤维上涂覆海藻酸钠和磷酸氢二铵的混合水溶液,利用钙离子交联的方法制备海藻酸钙/硅酸钙,经过盐酸处理,制备了PET-s-CaAlg/CaSiO3@SiO2复合材料。该复合材料制备过程中没有使用有机溶剂,不需要高温条件,对环境无污染。
(2) SEM及TEM表征可以明显地反映材料表面出现150~200 nm大小的介孔SiO2,红外光谱分析表明该材料表面形成了Si—OH结构。BET测试结果显示材料的比表面积为41.259 m2·g-1,相较于PET纤维显著增加。
(3) PET-CaAlg/CaSiO3@SiO2复合材料对于Pb2+吸附效果良好,在吸附动力学上符合准二级动力学方程。当吸附达到饱和时,其吸附容量为58.33 mg/g。Pb2+的吸附在低温以及体系处于弱酸性(pH=4.0~6.0)时能达到最佳状态。
| [1] |
XIAO Q, ZONG Y T, LU S G. Assessment of heavy metal pollution and human health risk in urban soils of steel industrial city (Anshan), Liaoning, Northeast China[J]. Ecotoxicology & Environmental Safety, 2015, 120: 377-385. |
| [2] |
GONZALEZ M, MARIAJESUS, RODRIGUEZ, et al. Recovery of heavy metals from metal industry waste waters by chemical precipitation and nanofiltration[J]. Desalination, 2006, 200(1): 742-744. |
| [3] |
FU F, XIE L, TANG B, et al. Application of a novel strategy-advanced fenton-chemical precipitation to the treatment of strong stability chelated heavy metal containing wastewater[J]. Chemical Engineering Journal, 2012, 189/190: 283-287. DOI:10.1016/j.cej.2012.02.073 |
| [4] |
TRAN T K, LEU H J, CHIU K F, et al. Electrochemical treatment of heavy metal-containing wastewater with the removal of COD and heavy metal ions:electrochemical treatment of heavy metal containing wastewater[J]. Journal of the Chinese Chemical Society, 2017, 64(5): 493-502. DOI:10.1002/jccs.201600266 |
| [5] |
KARAMI H. Heavy metal removal from water by magnetite nanorods[J]. Chemical Engineering Journal, 2013, 219(3): 209-216. |
| [6] |
HE X S, XI B D, ZHANG Z Y, et al. Composition, removal, redox, and metal complexation properties of dissolved organic nitrogen in composting leachates[J]. Journal of Hazardous Materials, 2015, 283(227): 227-233. |
| [7] |
KELDERMAN P, OSMAN A A. Effect of redox potential on heavy metal binding forms in polluted canal sediments in Delft (The Netherlands)[J]. Water Research, 2007, 41(18): 4250-4261. |
| [8] |
MAVROV V, ERWE T, BLOCHER C, et al. Study of new integrated processes combining adsorption, membrane separation and flotation for heavy metal removal from wastewater[J]. Desalination, 2003, 157(1): 97-104. |
| [9] |
BLOCHER C, DORDA J, MAVROV V, et al. Hybrid flotation-membrane filtration process for the removal of heavy metal ions from wastewater[J]. Water Research, 2003, 37(16): 4018-4026. DOI:10.1016/S0043-1354(03)00314-2 |
| [10] |
PLAZINSKI W, RUDZINSKI W. Modeling the effect of surface heterogeneity in equilibrium of heavy metal ion biosorption by using the ion exchange model[J]. Environmental Science & Technology, 2009, 43(19): 7465-7471. |
| [11] |
DABROWSKI A, HUBICKI Z, PODKOSCIELNY P, et al. Selective removal of the heavy metal ions from waters and industrial wastewaters by ion-exchange method[J]. Chemosphere, 2004, 56(2): 91-106. DOI:10.1016/j.chemosphere.2004.03.006 |
| [12] |
NASCIMENTO M, SOARES P S M, SOUZA V P D. Adsorption of heavy metal cations using coal fly ash modified by hydrothermal method[J]. Fuel, 2009, 88(9): 1714-1719. DOI:10.1016/j.fuel.2009.01.007 |
| [13] |
CAO C Y, QU J, YAN W S, et al. Low-cost synthesis of flowerlike α-Fe2O3 nanostructures for heavy metal ion removal:adsorption property and mechanism[J]. Langmuir the Acs Journal of Surfaces & Colloids, 2012, 28(9): 4573-4579. DOI:10.1021/la300097y |
| [14] |
王艳春, 曾效舒, 敖志强, 等. 热还原石墨烯的制备及其对重金属Pb2+的吸附性[J]. 材料工程, 2017, 45(10): 6-11. WANG Y C, ZENG X S, AO Z Q, et al. Preparation of graphene via thermal reduction and its adsorption capacity for heavymetal Pb2+[J]. Journal of Materials Engineering, 2017, 45(10): 6-11. |
| [15] |
NIU Y, YING D, LI K, et al. Adsorption of heavy-metal ions from aqueous solution onto chitosan-modified polyethylene terephthalate (PET)[J]. Research on Chemical Intermediates, 2017, 43(7): 4213-4225. DOI:10.1007/s11164-017-2866-y |
| [16] |
陈宏, 刘旭, 李亚男, 等. 应用海藻酸钠脱除重金属研究进展[J]. 化学通报, 2017, 80(3): 241-245. CHEN H, LIU X, LI Y N, et al. Research progress in the removal of heavy metals by sodium alginate[J]. Chemistry, 2017, 80(3): 241-245. |
| [17] |
樊亚男, 赵孔银, 魏俊富, 等. 基于不同载体的染料表面印迹复合微球及其识别性能[J]. 功能材料, 2013, 44(13): 1521-1524. FAN Y N, ZHAO K Y, WEI J F, et al. Dye surface imprinted composite microspheres based on diifferent carriers and their recognition[J]. Journal of Functional Materials, 2013, 44(13): 1521-1524. |
| [18] |
陈俊, 张代军, 张天骄, 等. 溶液静电纺丝制备热塑性聚酰亚胺超细纤维无纺布[J]. 材料工程, 2018, 46(2): 41-49. CHEN J, ZHANG D J, ZHANG T J, et al. Preparation of thermoplastic polyimide ultrafine fiber nonwovens by electrospinning[J]. Journal of Materials Engineering, 2018, 46(2): 41-49. |
| [19] |
刘东, 赵孔银, 宋欢语, 等. 硅酸钙-海藻酸钙复合水凝胶膜的制备及表征[J]. 复合材料学报, 2017, 34(11): 2401-2406. LIU D, ZHAO K Y, SONG H Y, et al. Preparation and characterization of calciumsilicate-calcium alginate composite hydrogel film[J]. Acta Materiae Compositae Sinica, 2017, 34(11): 2401-2406. |
| [20] |
WANG X, ZHAO K, YANG B, et al. Adsorption of dibutyl phthalate in aqueous solution by mesoporous calcium silicate grafted non-woven polypropylene[J]. Chemical Engineering Journal, 2016, 306: 452-459. DOI:10.1016/j.cej.2016.07.076 |
| [21] |
ZHAO K Y, CHEN T, LI D Y, et al. Preparation and characterization of mesoporous calcium silicate grafted polypropylene non-woven fabric[J]. Materials Letters, 2015, 141: 110-113. DOI:10.1016/j.matlet.2014.11.055 |
| [22] |
ZHAO K Y, WANG X H, CHEN T, et al. Bisphenol A adsorption properties of mesoporous CaSiO3@SiO2 grafted nonwoven polypropylene fiber[J]. Industrial & Engineering Chemistry Research, 2017, 56: 2549-2556. |
| [23] |
张珊. SiO2/海藻酸钙-黄原胶互穿网络微球去除水体中Pb2+[D].上海: 上海交通大学, 2013. ZHANG S. SiO2/calcium alginate-xanthan gum interpenetrating network microspheres for removal of Pb2+[D]. Shanghai: Shanghai Jiao Tong University, 2013. |
| [24] |
PEPE F, ZHANG S, XU F, et al. Silica modified calcium alginate-xanthan gum hybrid bead composites for the removal and recovery of Pb(Ⅱ) from aqueous solution[J]. The Chemical Engineering Journal, 2013, 234: 33-42. DOI:10.1016/j.cej.2013.08.102 |
| [25] |
FANG X, LI J, LI X, et al. Internal pore decoration with polydopamine nanoparticle on polymeric ultrafiltration membrane for enhanced heavy metal removal[J]. Chemical Engineering Journal, 2017, 314: 38-49. DOI:10.1016/j.cej.2016.12.125 |
| [26] |
WANG J, HUANG T, ZHANG L, et al. Dopamine crosslinked graphene oxide membrane for simultaneous removal of organic pollutants and trace heavy metals from aqueous solution[J]. Environmental Technology, 2017, 39(23): 1-28. |
| [27] |
周慧杰, 杨慧敏, 王硕, 等. 镍改性硅藻土对废水中Pb(Ⅱ)吸附性能的研究[J]. 内蒙古科技大学学报, 2019, 38(2): 109-112. ZHOU H J, YANG H M, WANG S, et al. The Ni modification of diatomite and its influence on the Pb (Ⅱ) adsorption performance in waste water[J]. Journal of Inner Mongolia University of Science and Technology, 2019, 38(2): 109-112. |
 2020, Vol. 48
2020, Vol. 48


