文章信息
- 邹漫, 陈叶青
- ZOU Man, CHEN Ye-qing
- 碳点在生物诊疗中的应用
- Application of carbon dots in biological diagnosis and treatment
- 材料工程, 2020, 48(9): 59-68
- Journal of Materials Engineering, 2020, 48(9): 59-68.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.000747
-
文章历史
- 收稿日期: 2019-08-12
- 修订日期: 2020-05-05
碳点一般指尺寸小于10 nm具有准球形的结构,能稳定发光的一种纳米碳[1]。由于它优良的荧光特性,又被叫作荧光碳点。20世纪初研究者在制备碳纳米管的过程中偶然发现一种新型的碳纳米级材料,这种材料即为碳点,因其具有优良的光学性能和医学特性受到众多科研人员的关注,比如:制备简单、吸附能力强、良好的水溶性和生物相容性、荧光性能稳定、荧光寿命长、易功能化等优点在生物医学领域有着重大的应用前景。传统的有机荧光团虽然在生物传感、生物成像等领域也有应用,但由于重金属的存在会对生物产生毒性以至于应用受到限制。荧光碳点首先因其不含有毒金属元素,是一种绿色环保的纳米级材料,可以在生物科学领域拓展更加广泛的发展空间。其次,碳点因具有强的抗光漂白性、无闪烁、低生物毒性,应用于生物标记和生物成像;因具有荧光淬灭效应,应用于生物传感;因具有红外吸收、光热效应和光敏化特性,应用于光热治疗和光动力治疗技术;因具有良好的物理化学性能可用于发光材料,如:激光、LED等。
近年来,研究者通过对碳点的深入研究,发现了碳点的优异的性能,随之合成方法也发现了很多。比如:从材料的角度,一般采用自上而下法和自下而上法两大类方法进行碳点的制备[2]。自上而下制备法是通过对较大的碳结构元素进行裂解,获取较小的纳米级碳颗粒,这种制备方法下的碳点基础主要为石墨类。自下而上制备法是通过对分子级的碳前体进行聚合,获取纳米级的碳颗粒。自上而下方法包括:电弧放电[3],特点是制备的碳点粒径不规则,含氧量充足,结构中含有永久荧光,不需进一步植入荧光;激光消融[4-7],特点是碳点产率低,粒径不均匀,纯度低;电化学氧化法[8],特点是能够精准控制纳米颗粒合成,成本低,产量高。自下而上方法包括:燃烧法[9],特点是不需要钝化就发荧光;模板法[10-11],特点是碳点大小可控制,减少碳点团聚得到的碳点粒径均匀,结构杂质少,方便后期的表面修饰,碳点的荧光量子产率也较高;水热法[12-13],特点是通过选择不同种类碳源,制备过程并不需要对碳点进行氧化和钝化就能使基础材料在反应釜中高效率反应,获得具有高荧光量子产率的碳点,制备流程简便,操作方式易于控制,可在工业模式下生产;另外,对空气成分敏感的碳前体可以在密闭的反应釜中进行聚合,还可以防止有毒物质的挥发。除上述方法外,还有热解、微波、超声法等。目前对于碳点的制备大多以自下而上方法为主。
通常情况下能够自行放射荧光的碳点其粒径一般在10 nm范围内。Sun等[4]最早对这一碳点特性进行研究并作出解释,他们认为碳点表面存在对光源的折射角度与折射面,具有一定的能量蓄积能力,对其光照后会产生光生电子-空穴的复合形式辐射。由于碳点表面具有能量蓄积功能,对于碳点的表面积需求也就有了更高的要求,而体积大的碳点蓄积能量的表面积较小,导致荧光放射不明显。还有其他的研究观点认为,碳点在未进行表面钝化修饰的情况下所表现的荧光特性微弱甚至不会发出荧光。通过多种方法对荧光碳点进行制备,最终获取的碳点会携带不同种类的表面官能团或其他基链,但是经过对不同制备方法下的碳点进行研究,结果表明,荧光碳点表面有大量C=C,C—O以及O—C=O等具有sp2杂化的独立碳位点[14-16],弥补了表面官能团的差异性,这些碳位点也被认为是碳点荧光激发的化学结构组成部分。虽然光致发光和电化学发光是碳点的主要发光特性[17],但荧光特性是碳点最突出的性能。荧光碳点是当外界给予碳点一定的能量,使它从低能量状态跃迁到高能量状态即从基态到激发态,之后碳点需要恢复到原来的稳定状态即从激发态到基态,此时能量以光的形式释放出来就产生了荧光。不同方法制备得到的碳点的发光机理不尽相同,能够表现碳点发光原理的主要有分子态发光、缺陷态的发光(表面缺陷态、边缘态、杂原子掺杂等)和碳核本征态的发光(量子尺寸效应)等[18-20]。本文首先对碳点的制备、发光机理进行了简单概述,接着对碳点在生物中的诊疗进行了主要阐述,最后对碳点进行了总结和展望。
1 碳点的生物应用在荧光碳点可大量制备的基础上,利用其优越的光学特性和物理性质在材料学、化学、生物医学等领域都有不可替代的研究和应用价值。目前,荧光碳点在荧光油墨、光催化剂、LED器件等方面已经应用成功;作为优良的新型荧光材料由于其具有良好的光稳定性、生物相容性、低毒性等特性在生物和医学影像等领域具有突出的优势。例如,在体外应用中,碳点对各种细胞系没有致命毒性,被认为是安全的;在体内生物医学应用中,由于荧光碳点表面多种官能团的存在,利用官能团进行药物靶向设计,可用于提升药物治疗的精准性。
1.1 生物传感器生物传感器是以固定化的生物材料作为敏感元件,与其他电子元件结合所构成的一类传感器。碳点生物传感器领域的应用在以下几个方面:
(1) 检测体内化合物生理水平,比如用来测定体内血糖的水平。Shen等[21]应用一步法合成的碳点对人体中的血清血糖进行检测,为了凸显检测效果以苯基硼酸为检测原料,减少血清中其他物质对检测结果的干扰,检测值在9~900 μmol/L之间,其检测机理改善了传统血糖检测中利用的氧化还原反应法,并且与传统方法相比检测精度提高了。Shan等[22]和Shen等[21]都利用一步法制备基于碳点的葡萄糖检测探针,两组检测试剂的检测极值分别为8.0 μmol·L-1和1.5 μmol·L-1,均在正常的适用度之中。Shen等[21]用苯硼酸内部的苯环结构作为碳点原料,在苯环覆盖的表层结构上形成一层荧光碳点粒子群,在此表面上,苯环与葡萄糖发生碰撞,消灭荧光特性,利用此原理可以通过碳点中荧光的发光强度来检测葡萄糖含量。由于该探针的灵敏程度得到较大程度的提升,能够精准地识别结构链上方的类似多余物质,进而清除其他无关物质对检测的影响。
(2) 检测酶的活性。Wei等[23]以聚乙烯吡咯烷酮(PVP)作为制备荧光碳点的原料,研究发现H2O2/Fe溶液能够大幅度地减弱碳点荧光强度。利用此原理,以碳点为载体制备荧光探针用于检测H2O2浓度。碳点荧光检测值随H2O2的浓度变化而变化,检测极值为0.1 μmol·L-1,反应机理为H2 O2与Fe2+在溶液中发生了Fenton反应,生成了OH-,OH-浓度影响着碳点荧光强度。根据同一原理,Wei等又以该碳点为载体制备荧光探针用于检测在胆碱酶(Chox)存在下溶液中胆碱(Ch)浓度,及在乙酰胆碱脂(AChE)的存在下检测乙酰胆碱(ACh)的浓度。Ch和ACh的检测极值分别为0.1 μmol·L-1和0.5 μmol·L-1,线性变化范围为0.1~40 μmol·L-1和0.5~60 μmol·L-1。此法同样适用于检测被相应的酶水解后产生H2O2的其他物质。反之,当底物浓度一定时此生物传感器也可以用于检测酶的活性。
(3) 检测肿瘤标志物癌胚抗原(CEA)。制备的碳点表面含有大量的羧基,能够较高强度地利用π-π叠加作用附着在ssDNA适配体中,使碳点荧光减弱。在制备过程中加入癌胚抗原时,适配体与癌胚抗原特异性结合而减弱羧基吸附强度离开碳点表面成为游离状态,确定了碳点对荧光恢复检测的范围在0.5~1.0 ng/mL内,检测极值为0.3 ng/mL。其可以通过荧光“通过-闭合-通过”免标记检测肿瘤标志物癌胚抗原(CEA)是否存在细胞之中[24]。
此外,由于碳点具有良好的灵敏度、良好的荧光性能和荧光猝灭效应,也可以用于核苷酸检测、多巴胺、细胞内pH的检测和生物成像,因为核酸检测具有极高的敏感性,甚至能够判断检测内容中的单个碱基匹配位置[4]。
1.2 生物成像传统的碳点由于荧光量子产率比较低和具有生物毒性在生物成像方面受到限制,如今通过对碳点表面基团进行修饰提高了碳点的荧光量子产率,并且相比于传统的碳点来说细胞受到的生物毒性限制较小,具有更好的生物相容性,更加适用于生物成像。生物成像有体外细胞成像、体内肿瘤成像和细菌成像等。Sun等[4]最先发现碳点生物的成像潜力并进行研究,通过共聚焦显微镜观察碳点标记的大肠杆菌ATCC 25922细胞,发现碳点逐渐被Caco-2细胞摄取。
(1) 对于细胞成像,Cao等[5]初次尝试用碳点标记乳腺癌细胞(MCF-7),利用双光子荧光显微镜观察到乳腺癌细胞质中含有明亮的荧光点,证明碳点已经进入细胞中。Chen等[25]用2-叠氮咪唑为荧光原料,在低温的环境下用不同波长进行激发操作,可合成蓝绿色、蓝色和青绿色的荧光碳点,并且具有生物相容性好等优点,被成功应用于多色细胞成像。李迎运等[26]制备了最大发射峰位于近红外区域的碳点探针,能够对生物组织的碳点位置标记更深、损伤更小;由于其细胞毒性较低,所以适用于深部细胞成像。
(2) 对于活体成像,Michalet等[27]将碳量子点注入白鼠活体细胞内,利用不同波长的激发光进行实验,可以采集到活体成像,但是碳点在此方面还不是很成熟。首先,由于目前的关键技术得不到具体实现,例如碳点的制造成本高、生物体内的环境感染等,导致了应用碳点在活体内成像的研究成果屈指可数。此外在活体成像方面的工作尚未全面展开,主要原因在于碳点引入活体细胞机制、结合部位及其与活体细胞间的相互作用规律等问题尚不明确[28]。
(3) 对于细菌成像,细菌感染是人类健康的最大杀手之一[29-30],细菌感染病理的诊断和抗菌防控治疗的研究成效与临床治疗息息相关。特别是随着抗菌药物的不断应用,细菌的抗药性与耐药性逐渐增加[31-32],对新菌感染病理的诊断和抗菌药物的研发越显重要。目前,常用的细菌种类鉴定方法主要是利用细菌菌体繁殖培育以及多聚酶链式反应(PCR)的分子生物学手段[33]。一般情况下还可以利用荧光材料(如碘化丙锭)或半导体量子点鉴定细菌类别,但是因为这两种方法的鉴定准确度较低、试错成本较高、光稳定性差等,不做专业的实际应用。由于碳点荧光性能稳定、易修饰、较低的生物毒性、良好生物相容性的优点,在细菌成像研究中显示出巨大的优势。Nandi等[34]研究发现细菌细胞膜表面两亲性碳点(amphiphilic carbon dots)的烃链基功能团与两性离子磷脂具有较高相容性,容易附着在细菌细胞膜上,增加细菌初始荧光,以达到最大可用结合位点。通过设置一定的荧光阈值,使细菌细胞及胞内细胞器彩色显微成像,从而利用荧光检测细菌细胞。碳点的荧光强度和光谱位置取决于细菌种类,因此在混合细菌种群的情况下,荧光碳点可作为区分细菌的一种工具,进一步可作为荧光探针标记细菌细胞分裂的“极点”,使其生理过程可视化。另外Kasibabu等[35]用无花果番木瓜汁作为碳源,经一步水热法合成了一种发射峰在461 nm处量子产率为7%的荧光碳点。枯草芽孢杆菌和棘孢曲霉经过荧光碳点10 h 36.5 ℃环境培养基培养,再使用不同的激发波长,通过激光共聚焦显微观察到枯草芽孢杆菌和棘孢曲霉的成像中具有绿色和红色荧光。表明荧光碳点可以对枯草芽孢杆菌和棘孢曲霉进行成像,其可应用于细菌和真菌生物学成像且非常有价值。
除此之外,碳点生物成像相对于CT成像和PET成像,具有无辐射的特点,保障了技术人员的操作安全;相对于磁共振成像,可以针对体内装有金属装置的患者进行成像,而磁共振成像技术在实现的过程中会影响到金属装置的正常运行。综上所述,对碳点生物成像研究能够有效地扩展医学辅助技术范围,可作为多领域的重点研究课题之一[36]。
(4) 对于体内肿瘤光学影像,肿瘤医治与控制已经成为医学领域的重点难点,严重威胁着人类的健康,世界卫生组织通过数据分析,肿瘤可能已经成为人类致死原因的第一罪魁祸首。依据目前的医疗手段和人们的健康意识,人们并无法在第一时间诊断肿瘤,当利用传统的诊断手段发现肿瘤时,往往已经错过了最佳的治疗阶段,为肿瘤类疾病的治疗带来极大的困难。碳点表面含有大量的含氧官能团,能够吸附多种类型的金属离子,利用此特点可以向碳点表面释放大量的金属离子合成核磁造影剂,释放的金属离子可以为Cu2+,Fe3+,Mn4+等。碳点融入血管中具有较高的通透性和滞留效应,肿瘤中的血液流动时会引导碳点进入肿瘤内部,利用此特性可以显著提高对比剂的靶向效应[37]。选取水热处理法将柠檬酸、乙二胺和氯化钆三种物质混合后,可以得到一种不同类型的钆-碳量子点。在其表面引入RGD肽作为靶向分子,经过大量的实验证明,钆-碳量子点能够精准地进入到脑胶质瘤细胞中,再通过靶向分子向光学仪器反射实现成像。Ben课题组[38]利用柠檬酸为碳点基础,采用熔盐法大量地将靶向分子、荧光分子与碳点基础物质结构相容,作为进入肿瘤细胞的载体,并在其表面吸附一定量的Gd3+作为靶向负载,经过大量的实验数据,验证了这种类型的核磁造影剂能够有效地提升成像效率,是一种良好的碳点核磁造影剂。实验过程中发现,附着Gd3+的碳点仍旧可以利用自身的荧光物质体现出荧光特性,因此Ben课题组进一步研究钆-碳量子点的潜在特性,在荧光成像的基础上还可以进行核磁共振成像,为生物医学领域临床治疗提供更精准的成像技术,活体光学影像、肿瘤光学影像、细菌类型检测都需要利用荧光碳点继续深入地探究此领域,但是因为技术手段的限制,导致一些问题还无法解决:1)紫外光以及短波长可见光对生物组织有损伤和穿透能力比较差。只有近红外光波长能够稳定控制在650~900 nm范围内才能有效穿透深层生物组织。因此,未来的研究方向应当向红光和近红外荧光碳点方面逐渐扩展,分析荧光碳点发光机理,为制备近红外不同区段的高能量粒子效率的荧光碳点起理论指导的作用。在肿瘤诊疗一体化中荧光碳点技术的应用还不成熟,荧光碳点在肿瘤内的光热转化还无法达到理想状态,在肿瘤内的制氧量也有待提升[37]。2)荧光碳点的粒径统一为10 nm,在生物体内的分布运转缺乏灵活性,无法大量地聚集在病体细胞内部,导致病体细胞组织所呈现的影像与现实状态还有一定的差异,细胞边缘的虚化效果更为明显。因此,具有灵活特性肿瘤靶向性荧光碳点的设计是至关重要的。3)荧光碳点的粒径尺度和表面性质致使其体内生物半衰期缩短,进而影响了影像清晰度,所以希望通过对荧光碳点表面进行修饰来延长体内生物半衰期。此外,由于荧光碳点在生物医学、光学影像等领域发挥了其医学特性与光学特性,因此荧光碳点在未来的研究应用过程中会发挥更加重要的作用。
(5) 碳点作为荧光探针,具有快速、安全、灵敏度高等特点,因此广泛应用于生物成像,已经证实大肠杆菌、MCF-7细胞、小鼠P-19细胞、Caco-2细胞等都能够接受碳点进入并标记[14, 39-41]。生物体内的一些化学物质、酶、生物大分子等对生物体的生命活动均有重要的影响,因此,碳点作为生物荧光探针,已经成为细胞成像的重要研究对象[5, 39],共焦显微镜可以观察到碳点的所在位置,与传统的同位素标记法和普通荧光分子法相比,碳点进入细胞的速度更快且对于目标标记有着较高的灵敏性,还能长时间稳定地存在。目前,针对生物体内的化学与生物物质的检测与成像,科研工作者已经开发出了一系列的方法,比如高效液相色谱、电子自旋共振、核磁共振成像等。虽然这些方法也能获得一些结果,但是由于依赖于昂贵的仪器以及耗时太长,它们的应用受到了一定的限制。对比这些检测与成像的方法,基于荧光的生物探针因为灵敏度高、速度快、无破坏性等优点受到了广泛的关注,荧光生物探针在检测、诊疗和成像等领域都有着突出的表现。
除此之外,由于碳点本身为纳米材料,容易实现在体系中的分散,因此也常被应用于食品中各类金属离子、阴离子、小分子的传感检测,具有选择性好、灵敏度高的优点[42]。进行荧光碳点的生物传感以及生物成像方面的研究最终是为了更好地应用于疾病的诊断治疗,更好地造福人类。
1.3 诊断治疗荧光碳点具备较强的物化特征,能够广泛应用于治疗药物包载和疾病诊断领域中,即以碳点为中心构建载药系统并与其光学反应特性相结合组成诊断与治疗共进的全功能性药物供给系统。利用共价键连接治疗药物与碳点达到承载、控制、释放与检测药物的多重目的[43]。
1.3.1 药物传递当今,研究药物在靶向给药和在病变部位控制释放方面具有重要意义。碳点的尺寸小使得其更易于被细胞摄取,且具有的生物相容性及低毒性几乎不会对细胞产生不利影响。此外,碳点内部为整体π共轭核构造,内部连接部分为表面官能团,可与药物粒子进行连接,并实现剩余部分的组装,完成承载药物、控制药物稀释及疾病诊断与治疗研究,减少药物副作用带来的影响,提升肿瘤抗击性能。但是怎样使化学药物丰富地聚集在发病部位并使之达到治疗的目的是疾病治疗中的关键性问题,特别是对于不溶性和水溶性差的化学药物。纳米材料载药系统的引入能够使药物在病灶部位定点释放,在其他部位不会出现该药物的靶向治疗,这样就把药物对正常部位的伤害降低到最小甚至不会伤害其他正常部位,有利于提高药物的治疗效率。
碳点由于易于改性和低毒性,非常有利于在体内应用。最重要的是,出色的荧光特性使碳点成为理想的药物输送载体。Thakur等[44]选取水溶质加热的同时获取碳点,结合碳点与盐酸环丙沙星分子执行对偶共轭操作,构建碳点-环丙沙星内部对偶共轭链,实验效果在酵母菌研究中得到体现,利用共轭作用在酵母菌群内部反射影像,提升抗菌素在细胞内的含量,可证明是碳点把环丙沙星带到细菌细胞群中。Zheng等[39]选择抗癌药物,将碳点覆盖在其表面—NH2中,验证碳点能够提升药物治疗的效力。碳纳米点负载抗癌药阿霉素(DOX)也被广泛报道[40-41, 45-46]。Qu等[41]通过高温热解法制备表面负电性的发光碳纳米点,研究其表面正电覆盖的介孔硅纳米粒子的电能结合作用,将DOX存储在介孔硅纳米粒子内部。得到纳米复合物同时利用细胞内机制溶酶体吞噬HeLa细胞,并结合形成荧光影像。承担阿霉素的复合物逐渐解体于酸性环境下,同时其细胞内部受力释放药物,增强药物内部细胞的毒性。碳点的药物传递功能对于癌症的治疗也具有重要意义。Dong等[47]选取酸碱中和放热操作方式在6 min之内获得了磷、氮混合内空构造绿色荧光发散碳纳米点,结合DOX组建成复合物,调整HepG2细胞与荷瘤小鼠活体的联系,并在其中构建反射影像,同时稀释药物,防止有害细胞的繁殖。Cui课题组[48]将覆盖PEG化的石墨烯量子点与细胞穿膜肽相结合,同时调配系统药物承载内部系统,连接DOX空间,提供碳纳米点,控制DOX,并制造荧光共振能量转移(FRET)复合物。利用TAT肽可靶向核孔复合物检验体外细胞研究,扩展药物的核内输运通道,保证药物运输的通畅。集中反应FRET信号获取的受体间距离情况,并根据被作用群的荧光变化程度时刻监控此时的药物稀释状况。
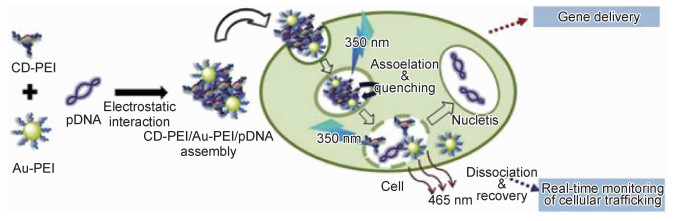
1.3.2 基因传递推动基因治疗技术应用在基因转移疾病、病毒性传染疾病以及恶性病毒治疗领域中。在核酸传递的过程中,由于病毒载体存在安全隐患,其规模生产受到一定的阻碍,因此,非病毒基因载体得到强力应用。碳纳米点能够结合核酸进行静电反应形成复合状态物质,完成基因传递操作[49-52]。Kim等[52]选用覆盖PEI的碳纳米点(CD-PEI)同步覆盖PEI的金纳米粒子并结合pRNA组建三元纳米组装体。匹配Au-PEI与CD-PEI内部中心条件并实施动态荧光淬灭同时达到系统完善目的,转变碳点荧光强度,同时推导组装体组成以及消亡步骤。细胞实验验证了CD-PEI/ Au-PEI/pR-NA的毒性较低,但其DNA转染能力较高,根据荧光研究实时监测组装体组合/消亡以及转化的流程,清除pRNA的荧光标记(图 1)。Lebeau课题组[51]选用柠檬酸和bPEI作为原始操作构造碳纳米点(CD),同时提取不同pH下的碳纳米点。碳纳米点能够连接pDNA和siRNA,利用非入侵式的肺部给药系统达到活体实验操作目的,通过GL67A通道高速运输DNA,且携带的毒性更低。选取基因载体达到外源基因体外细胞转移传染研究操作,实时传输活体基因,供给非病毒载体实现基因治疗。
传统的治疗方式无法对癌症的早期进行诊断而延误病情,光疗技术的引进为癌症患者带来了佳音。
光疗包括光动力和光热治疗。光动力疗法通过给予系统或局部光敏剂后,在固定波长激光发射与大气中氧气的共同作用下,生成单线态氧以及其他活性氧混合物,致使肿瘤细胞消亡;光热疗法通过内部光转化外层结构光数据,实现数据内部热能连发传递,增强部分细胞温度进而狙杀细胞群。光疗技术可以认为是传统治疗法之后出现的最有发展性的方法[53]。光诊疗剂能够在发射光的刺激下形成荧光影像,与荧光声波影像或利用光学热成像等诊断方法将光动力和光热等治疗方法相结合,获得优秀的诊断结果和治疗效果。目前,光诊疗剂主要是纳米金、碳纳米管、石墨烯、IGG等有机荧光及聚合物纳米材料等[54]。Ge课题组[55]将聚噻吩苯丙酸作为前发射体,选取水溶液传导热能技术制得碳点,在波长为350~600 nm的光激发条件下达到近红外荧光成像目的,在671 nm波长下能实现成像与治疗的作用。
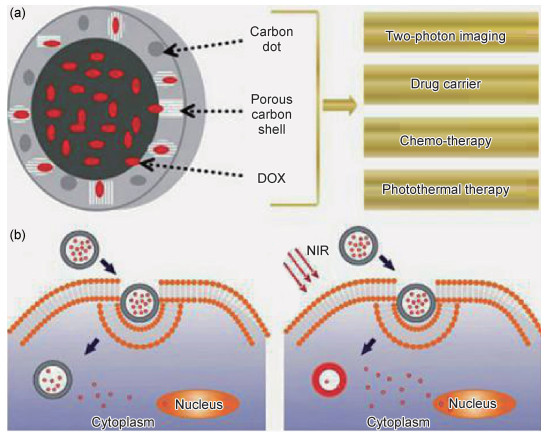
2002年Pharma Netics公司初步构想诊疗一体化操作,并推断纳米技术发展,细胞症状诊断一体化得到验证[56]。Ruan等[57]根据碳点的荧光性质将其应用于肿瘤诊断中。选用甘氨酸调制具备较为稳固的血清与较为低的毒性碳点。在细胞体外部,C6胶质瘤细胞将反映出较为依赖操作时间以及实验环境中的细胞液浓度。在细胞体内部,碳点的非侵入性胶质瘤成像技术可调节荧光分布,由此验证了碳点聚集于胶质瘤中,很少出现在正常脑组织中,该现象表明该碳点具有较高性能的应用胶质瘤特质,碳点达到肿瘤治疗研究的目的。Bechet等[58]研究证实了碳点能够进行光动力治疗。光源转化在实验中被用来治疗表面肿瘤,它能够固定肿瘤组织的位置并实现数量集聚操作,选择固定波长的光源照射,调整单线态氧。已有研究证实碳点对MCF-7和MDA-MB-231癌症细胞具有细胞强抑制特性[59]。该现象起始于碳点能够生成大量的活性氧,促使其作为前景性较高的光敏剂而存在。但在操作中需注意碳点在细胞中的聚合以及吞噬依赖于表面基团和给药途径。在利用光热转移情况下,Zhou等[60]选取荧光纳米碳点构建尺寸为100 nm左右的复合分子物质FPC-NC的多孔碳纳米胶囊,获得细胞内部DU145信息,取得分子荧光成像。FPC-NC的搭建抗癌药物桥,实现内部转化,在DU145细胞中,承担DOX的FPC-NC利用试剂调节,选取近红外光热转化实现药物转变,FPC-NC-DOX复合物可实现近红外光射,并根据碳点光热结构达到治疗效果,以实现杀死DU145细胞的目的(图 2)。
最近,碳点在光诊疗剂应用研究领域取得了较大的进展。Ge等[61]以噻吩季铵盐衍生物为碳源的功能前驱物组装成不同的红色荧光发射碳点。在研究中,表层结构中覆盖负电荷,被覆盖的碳点具备荧光、光声、光热成像和光热治疗的特殊性能。剩余表层覆盖正电荷粒子的水溶性近红外发射荧光碳点,可以在光射条件下利用多重态敏化操作方式生成大量的活性氧(1O2)[53]。此种异于常规的碳点除了应用于光类毒性细胞诊断、细菌消除等领域之外,也能够应用于光催化与光源电子信息等领域。
1.3.4 抗菌应用现有阶段,临床中利用抗菌药物治疗细菌性感染疾病的方法较为常见[62]。生物膜的基本成分是磷脂。生物膜的净电荷主要基于其磷脂的化学结构。细胞膜内部的磷脂酰甘油与心磷脂以及磷脂酰丝氨酸具有较高的电力负载性能,这些成分存在于许多病原菌中,复合成分掌控细胞膜的粒子电荷负载性质。因此,在原核与真核细胞中存在细胞膜电化学梯度的差异。一般情况下,细菌细胞膜的负电性更强,其具有较高比例的阴离子(磷脂酰甘油和心磷脂)[63]。带正电荷的极性面帮助分子与生物膜结合,通过与带负电荷的头部基团的磷脂发挥静电相互作用,促进其抗菌活性[64]。
此外,脂多糖和脂磷壁酸分别是革兰阴性和革兰阳性菌细胞壁的主要成分,两者均带负电荷[65]。革兰阴性菌的外膜上带负电荷的脂多糖可与带正电荷基团相互作用,从而破坏外膜结构。肽聚糖是细菌细胞壁的主要成分,且带有负电荷,可通过破坏肽聚糖结构或抑制其合成,损伤细胞壁,从而杀伤细菌。革兰阳性菌缺乏脂多糖,但其表面有肽聚糖存在。这一机制在研制荧光碳点时具有重要的指导意义,意味着荧光碳点本身或者可以通过在其表面功能化带正电荷,从而在抗菌应用研究领域发挥潜力。
生物膜以其原生形态存在于口腔内部微生物中,生物膜中心平稳结构被破除的同时将产生致病菌感染口腔内部的情况,造成龋病及牙周病[66],这些口腔疾病的产生与发展以及不同口腔病原菌的固定生长都与生物膜的结构有关[67]。在口腔医学领域中,牙龈卟啉单胞菌是牙周炎的关键致病菌。为研究荧光碳点对牙龈卟啉单胞菌的抗菌作用,Liu等[68]以甲硝唑为前体,通过一步水热法合成荧光碳点,研究其对牙龈卟啉单胞菌的选择性抗菌活性。将浓度相异的发射荧光碳点结合牙龈卟啉单胞菌共同存放于培养基中观察一天,检测不同时刻的细菌溶液的光密度值。实验结果表明1.25 μg·mL-1荧光碳点能够有效控制71.7%的牙龈卟啉单胞菌的内部生殖,随着浓度的增加,其控制作用逐渐增强。该种现象表明荧光碳点能够对牙龈卟啉单胞菌产生一定的病菌抵抗抑制性。荧光碳点同时能够被选作药物释放存储载体,应用于抗菌药物研究中。Thakur等[44]利用微波法将阿拉伯胶结合制备了荧光碳点,作为环丙沙星载体,其实验显示的结合率在90%之上。通过分析药物释放曲线可以得出,此碳点药物承载实体能够在一天中不间断地释放药物,并且对于两种革兰阳性菌(金黄色葡萄球菌和枯草芽孢杆菌)以及两种革兰阴性菌(大肠埃希菌和铜绿假单胞菌)的应用中展现出较优的病菌抵抗抑制性。碳点不仅仅用于口腔治疗,在神经疾病和精神疾病也有涉及。
2 其他碳点技术在发光材料、食品检测和环境监测等领域发挥着关键作用,Guo等[69]利用热熔器将富含环氧基的聚苯乙烯微球分解,炼制多色荧光碳点。荧光碳点分别在200,300 ℃和400 ℃的条件下在单波长紫外反射下分别发出蓝色、橙色和白色荧光,产生的高数量荧光量子可制作发蓝光、橙光和白光的LED器件。汞离子作为一种强毒性的重金属离子,对于人体神经中枢系统、消化系统及内脏具有较为严重的危害性,因此,应重视对汞的检测。Goncalves等[70]通过建立碳点光纤传感器探测水溶液基质中的汞离子。利用激光刻蚀碳靶获取无荧光发射现象的碳纳米颗粒,选用聚乙二醇(PEG200)和N-乙酰-L-半胱氨酸(NAC)调制能发射蓝色荧光的碳点粒子,覆盖溶胶-凝胶膜,确保碳点处于固定的位置中。选取Hg2+与碳点进行化学反应,组建为状态统一的无荧光反应复合物,取得具有猝灭常数为1.3×105 mol/L的静态猝灭碳点,达到检测水中Hg2+的荧光传感状况的目的。
3 结论与展望随着碳点的优良理化性质在21世纪被逐渐发现,必然会促使其获得广泛的应用研究。碳点在生物领域由于其低生物毒性、荧光稳定性、抗光漂白性、荧光淬灭等性能被用于生物成像、生物传感、药物传递和抗菌应用等。正因如此,碳点同时具备较好的疾病诊治潜力,包括对肿瘤诊疗、神经疾病诊疗、口腔疾病诊疗和其他疾病的诊疗。即便碳点在生物医学方面具有许多优良的性能,但是同样地在应用中也存在许多问题需要我们进一步去克服解决,例如:首先,碳点在细胞成像应用方面,根据多个实例分析,碳点经过细胞的内吞作用转移至细胞内,但真实转化情况有待进一步探究,利用细胞获得碳点的操作步骤仍处于持续探索阶段;其次,碳点虽然对于红光区或近红外区发光的体内成像和疾病的诊疗具有较大的疗效,但由于其自身限制,该段区域的碳点荧光度较低,碳点的红光区或近红外区的荧光发射操作需要科研人员进一步研究和提升;最后,我们应该让碳点的优势发挥到最大,使其广泛应用于疾病的靶向治疗。碳点利用不同的物化反应指定靶向分子结合状态,组成具备高速、敏捷、精准等优点的碳点基探针,辅以性能新颖的光学成像技术,时刻监控细胞与生物体内分子的运动状态,也可以利用荧光碳点快速解析重大传染病的传染源,不少研究领域利用碳点技术揭示自然生态生命活动规律,为疾病的发生、诊断、治疗研究提供新技术新方法。荧光碳点具有很多优于其他荧光纳米材料的优良性质,作为新兴的纳米材料依旧具有意想不到的开发潜能,随着碳点的优势被不同领域的研究者认识和挖掘,在不远的将来荧光碳点会对生物医药领域产生深刻的影响。除上述领域应用外,碳点的研究逐步应用于绿色领域,如绿色有机能源与生态化学的研究。我们有理由相信碳点未来在生物医学上的应用前景会更加广阔。
| [1] |
刘文, 李婷婷, 张冰, 等. 基于绿色天然物质合成荧光碳点及其性质和应用综述[J]. 材料导报, 2019, 33(2): 402-409. LIU W, LI T T, ZHANG B, et al. A summary of synthesis of fluorescent carbon dots based on green natural matter and its properties and applications[J]. Materials Reports, 2019, 33(2): 402-409. |
| [2] |
ZHU S, SONG Y, ZHAO X, et al. The photoluminescence mechanism in carbon dots (graphene quantum dots, carbon nanodots and polymer dots):current state and future perspective[J]. Nano Res, 2015, 8: 355-381. DOI:10.1007/s12274-014-0644-3 |
| [3] |
XU X, RAY R, GU Y. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J]. Journal of the American Chemical Society, 2015, 126(40): 12736. |
| [4] |
SUN Y P, ZHOU B, LIN Y. Quantum-sized carbon dots for bright and colorful photoluminescence[J]. Journal of the American Chemical Society, 2006, 128(24): 7756-7757. DOI:10.1021/ja062677d |
| [5] |
CAO L, WANG X, MEZIANI M J, et al. Carbon dots for multiphoton bioimaging[J]. Journal of the American Chemical Society, 2007, 129(37): 11318. DOI:10.1021/ja073527l |
| [6] |
HU S L, NIU K Y, SUN J, et al. One-step synthesis of fluorescent carbon nanoparticles by laser irradiation[J]. Journal of Materials Chemistry, 2009, 19(4): 484-488. |
| [7] |
YANG S T, WANG X, WANG H, et al. Carbon dots as nontoxic and high-performance fluorescence imaging agents[J]. Journal of Physical Chemistry C, 2009, 113(42): 18110. DOI:10.1021/jp9085969 |
| [8] |
MING H, MA Z, LIU Y, et al. Large scale electrochemical synthesis of high quality carbon nanodots and their photocatalytic property[J]. Dalton Trans, 2012, 41(31): 9526-9531. DOI:10.1039/c2dt30985h |
| [9] |
VINCI J C, COLON L A. Fractionation of carbon-based nanomaterials by anion-exchange HPLC[J]. Analytical Chemistry, 2012, 84(2): 1178-1183. |
| [10] |
LIU R, WU D, LIU S, et al. An aqueous route to multicolor photoluminescent carbon dots using silica spheres as carriers[J]. Angew Chem Int Ed Engl, 2010, 48(25): 4598-4601. |
| [11] |
ZONG J, ZHU Y, YANG X. Synthesis of photoluminescent carbogenic dots using mesoporous silica spheres as nanoreactors[J]. Chemical Communications, 2010, 47(2): 764-766. |
| [12] |
SHA Y, LOU J, BAI S. Hydrothermal synthesis of nitrogen-containing carbon nanodots as the high-efficient sensor for copper(Ⅱ) ions[J]. Materials Research Bulletin, 2013, 48(4): 1728-1731. DOI:10.1016/j.materresbull.2012.12.010 |
| [13] |
LIU S, TIAN J, LEI W. Hydrothermal treatment of grass:a low-cost, green route to nitrogen-doped, carbon-rich, photoluminescent polymer nanodots as an effective fluorescent sensing platform for label-free detection of Cu(Ⅱ) ions[J]. Advanced Materials, 2012, 24(15): 2037-2041. DOI:10.1002/adma.201200164 |
| [14] |
WANG L, ZHU S J, WANG H Y. Common origin of green luminescence in carbon nanodots and graphene quantum dots[J]. ACS Nano, 2014, 8: 2541-2547. DOI:10.1021/nn500368m |
| [15] |
YANG Z C, WANG M, YONG A M. Intrinsically fluorescent carbon dots with tunable emission derived from hydrothermal treatment of glucose in the presence of monopotassium phosphate[J]. Chem Commun (Camb), 2011, 47: 11615-11617. DOI:10.1039/c1cc14860e |
| [16] |
TAO H Q, YANG K, MA Z. In vivo NIR fluorescence imaging, biodistribution, and toxicology of photoluminescent carbon dots produced from carbon nanotubes and graphite[J]. Small, 2012, 8: 281-290. DOI:10.1002/smll.201101706 |
| [17] |
HU X, ZHANG X C, ZHAO Z, et al. The biological effects and environmental application of fluorescent carbon dots[J]. Scientia Sinica Chimica, 2016, 46(7): 665-676. DOI:10.1360/N032015-00183 |
| [18] |
ZHU S, WANG L, ZHOU N, et al. The crosslink enhanced emission (CEE) in non-conjugated polymer dots:from the photoluminescence mechanism to the cellular uptake mechanism and internalization[J]. Chemical Communications, 2014, 50(89): 13845-13848. DOI:10.1039/C4CC05806B |
| [19] |
DONG Y, PANG H, YANG H B, et al. Carbon-based dots co-doped with nitrogen and sulfur for high quantum yield and excitation-independent emission[J]. Angew Chem Int Ed Engl, 2013, 52(30): 7800-7804. DOI:10.1002/anie.201301114 |
| [20] |
YUAN Y H, LIU Z X, LI R S, et al. Synthesis of nitrogen-doping carbon dots with different photoluminescence properties by controlling the surface states[J]. Nanoscale, 2016, 8(12): 6770-6776. DOI:10.1039/C6NR00402D |
| [21] |
SHEN P F, XIA Y S. Synthesis-modification integration:one-step fabrication of boronic acid functionalized carbon dots for fluorescent blood sugar sensing[J]. Anal Chem, 2014, 86: 5323-5329. DOI:10.1021/ac5001338 |
| [22] |
SHAN X Y, CHAI L J, MA J J. B-doped carbon quantum dots as a sensitive fluorescence probe for hydrogen peroxide and glucose detection[J]. Analyst, 2014, 139: 2322-2325. DOI:10.1039/C3AN02222F |
| [23] |
WEI J, REN J, LIU J. An eco-friendly, simple, and sensitive fluorescence biosensor for the detection of choline and acetylcholine based on C-dots and the Fenton reaction[J]. Biosensors & Bioelectronics, 2014, 52(4): 304-309. |
| [24] |
LI H, ZHANG Y, WANG L. Nucleic acid detection using carbon nanoparticles as a fluorescent sensing platform[J]. Chem Commun, 2010, 47: 961-963. |
| [25] |
CHEN X X, JIN Q Q, WU L Z, et al. Synthesis and unique photoluminescene properties of nitrogen-rich quantum dots and their applications[J]. Angewandte Chemie, 2014, 53(1): 12542-12548. |
| [26] |
李迎运.新型近红外荧光分子探针的设计合成及其在细胞成像中的应用[D].合肥: 中国科学技术大学, 2017. LI Y Y.Design and synthesis of novel near infrared fluorescent molecular probes and their applications in cell imaging[D]. Hefei: University of Science and Technology of China, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10358-1017073406.htm |
| [27] |
MICHALET X, PINAUD F F, BENTOLILA L A, et al. Qu antumdots for live cells, in vivo imaging, and diagnostics[J]. Science, 2005, 307(5709): 538-544. DOI:10.1126/science.1104274 |
| [28] |
李亚丽, 郭靖, 宋娟, 等. 荧光碳点探针的合成、性质及其在生物成像中的应用[J]. 影像科学与光化学, 2019, 37(1): 46-56. LI Y L, GUO J, SONG J, et al. Synthesis, properties of fluorescent carbon point probes and their applications in bioimaging[J]. Imaging Science and Photochemisty, 2019, 37(1): 46-56. |
| [29] |
LEVY S B, MARSHALL B. Antibacterial resistance worldwide:causes, challenges and responses[J]. Nat Med, 2004, 10(Suppl): 122-129. |
| [30] |
GAO W W, THAMPHIWATANA S, ANGSANTIKUL P. Nanoparticle approaches against bacterial infections[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2014, 6(6): 532-547. DOI:10.1002/wnan.1282 |
| [31] |
RODRIGUEZ-ROJAS A, RODRIGUEZ-BELTRAN J, COUCE A. Antibiotics and antibiotic resistance:a bitter fight against evolution[J]. Int J Med Microbiol, 2013, 303(6/7): 293-297. |
| [32] |
BAI Y, WANG S J. YIN X. Factors associated with doctors' knowledge on antibiotic use in China[J]. Sci Rep, 2016, 6: 23429. DOI:10.1038/srep23429 |
| [33] |
CHAMPION M M, WILLIAMS E A, KENNEDY G M. Direct detection of bacterial protein secretion using whole colony proteomics[J]. Mol Cell Proteomics, 2012, 11(9): 596-604. DOI:10.1074/mcp.M112.017533 |
| [34] |
NANDI S, RITENBERG M, JELINEK R. Bacterial detection with amphiphilic carbon dots[J]. Analyst, 2015, 140(12): 4232-4237. DOI:10.1039/C5AN00471C |
| [35] |
KASIBABU B S, D'SOUZA SL, JHA S. Imaging of bacterial and fungal cells using fluorescent carbon dots prepared from carica papaya juice[J]. J Fluoresc, 2015, 25(4): 803-810. DOI:10.1007/s10895-015-1595-0 |
| [36] |
李婷, 张晓强, 张李冬, 等. 碳点的生物成像研究进展[J]. 现代生物医学进展, 2016, 16(24): 4798-4800. LI T, ZHANG X Q, ZHANG L D, et al. Progress in biological imaging of carbon dots[J]. Progress in Modern Biomedicine, 2016, 16(24): 4798-4800. |
| [37] |
XU Y, JIA X H, YIN X B. Carbon quantum dot-stabilized gadolinium nanoprobe prepared via a one-pot hydrothermal approach for magnetic resonance and fluorescence dual-modality bioimaging[J]. Analytical Chemistry, 2014, 86(24): 12122. DOI:10.1021/ac503002c |
| [38] |
LI L, LU C, LI S. A high-yield and versatile method for the synthesis of carbon dots for bioimaging applications[J]. Journal of Materials Chemistry B, 2017, 5(10): 1935-1942. DOI:10.1039/C6TB03003C |
| [39] |
ZHENG M, LIU S, LI J. Integrating oxaliplatin with highly luminescent carbon dots:an unprecedented theranostic agent for personalized medicine[J]. Advanced Materials, 2014, 26(21): 3554-3560. DOI:10.1002/adma.201306192 |
| [40] |
WANG Q, HUANG X, LONG Y. Hollow luminescent carbon dots for drug delivery[J]. Carbon, 2013, 59(4): 192-199. |
| [41] |
ZHOU L, LI Z, LIU Z. Luminescent carbon dot-gated nanovehicles for pH-triggered intracellular controlled release and imaging[J]. Langmuir, 2013, 29(21): 6396-6403. DOI:10.1021/la400479n |
| [42] |
徐龙华, 方国臻, 王硕. 碳点荧光探针在食品检测中的应用[J]. 食品研究与开发, 2017(12): 202-206. XU L H, FANG G Z, WANG S. Application of carbon dot fluorescent probe in food detection[J]. Food Research and Development, 2017(12): 202-206. |
| [43] |
KUMAR V, TOFFOLI G, RIZZOLIO F. Fluorescent carbon nanoparticles in medicine for cancer therapy[J]. ACS Med Chem Lett, 2013, 4: 1012-1013. DOI:10.1021/ml400394a |
| [44] |
THAKUR M, PANDEY S, MEWADA A. Antibiotic conjugated fluorescent carbon dots as a theranostic agent for controlled drug release, bioimaging, and enhanced antimicrobial activity[J]. Journal of Drug Delivery, 2014, 2014, 282193. |
| [45] |
MEWADA A, PANDEY S, THAKUR M. Swarming carbon dots for folic acid mediated delivery of doxorubicin and biological imaging[J]. Journal of Materials Chemistry B, 2014, 2(6): 698-705. DOI:10.1039/C3TB21436B |
| [46] |
WANG C, WU C, ZHOU X. Enhancing cell nucleus accumulation and DNA cleavage activity of anti-cancer drug via graphene quantum dots[J]. Scientific Reports, 2013, 3: 2852. DOI:10.1038/srep02852 |
| [47] |
GONG X, ZHANG Q, GAO Y. Phosphorus and nitrogen dual-doped hollow carbon dot as a nanocarrier for doxorubicin delivery and biological imaging[J]. ACS Applied Materials & Interfaces, 2016, 8(18): 11288. |
| [48] |
CHEN H, WANG Z, ZONG S. A graphene quantum dot-based FRET system for nuclear-targeted and real-time monitoring of drug delivery[J]. Nanoscale, 2015, 7(37): 15477-15486. DOI:10.1039/C5NR03454J |
| [49] |
WANG L, WANG X, BHIRDE A. Carbon-dot-based two-photon visible nanocarriers for safe and highly efficient delivery of siRNA and DNA[J]. Advanced Healthcare Materials, 2014, 3(8): 1203. DOI:10.1002/adhm.201300611 |
| [50] |
LIU C, ZHANG P, ZHAI X. Nano-carrier for gene delivery and bioimaging based on carbon dots with PEI-passivation enhanced fluorescence[J]. Biomaterials, 2012, 33(13): 3604-3613. DOI:10.1016/j.biomaterials.2012.01.052 |
| [51] |
PIERRAT P, WANG R, KERESELIDZE D. Efficient in vitro and in vivo pulmonary delivery of nucleic acid by carbon dot-based nanocarriers[J]. Biomaterials, 2015, 51: 290-302. DOI:10.1016/j.biomaterials.2015.02.017 |
| [52] |
KIM J, PARK J, KIM H, et al. Transfection and intracellular trafficking properties of carbon dot-gold nanoparticle molecular assembly conjugated with PEI-pDNA[J]. Biomaterials, 2013, 34(29): 7168-7180. DOI:10.1016/j.biomaterials.2013.05.072 |
| [53] |
GE J, LAN M, ZHOU B. A graphene quantum dot photodynamic therapy agent with high singlet oxygen generation[J]. Nature Communications, 2014, 5: 4596. DOI:10.1038/ncomms5596 |
| [54] |
HU S H, CHEN Y W, HUNG W T. Quantum-dot-tagged reduced graphene oxide nanocomposites for bright fluorescence bioimaging and photothermal therapy monitored in situ[J]. Advanced Materials, 2012, 24(13): 1748-1754. DOI:10.1002/adma.201104070 |
| [55] |
BARRETO J A, O'MALLEY W, KUBEIL M. Nanomaterials:applications in cancer imaging and therapy[J]. Advanced Materials, 2011, 23(12): 18-40. DOI:10.1002/adma.201100140 |
| [56] |
HANNAH A, LUKE G, WILSON K. Indocyanine green-loaded photoacoustic nanodroplets:dual contrast nanoconstructs for enhanced photoacoustic and ultrasound imaging[J]. ACS Nano, 2014, 8(1): 250-259. DOI:10.1021/nn403527r |
| [57] |
RUAN S, QIAN J, SHEN S. A simple one-step method to prepare fluorescent carbon dots and their potential application in non-invasive glioma imaging[J]. Nanoscale, 2014, 6(17): 10040-10047. DOI:10.1039/C4NR02657H |
| [58] |
BECHET D, COULEAUD P, FROCHOT C. Nanoparticles as vehicles for delivery of photodynamic therapy agents[J]. Trends in Biotechnology, 2008, 26(11): 612-621. DOI:10.1016/j.tibtech.2008.07.007 |
| [59] |
HSU P C, CHEN P C, OU C M. Extremely high inhibition activity of photoluminescent carbon nanodots toward cancer cells[J]. Journal of Materials Chemistry B, 2013, 1(13): 1774-1781. DOI:10.1039/c3tb00545c |
| [60] |
JAKUBOWICZ A. Fluorescent porous carbon nanocapsules for two-photon imaging, NIR/pH dual-responsive drug carrier, and photothermal therapy[J]. Biomaterials, 2015, 53(5): 117-126. |
| [61] |
GE J, JIA Q, LIU W. Red-emissive carbon dots for fluorescent, photoacoustic, and thermal theranostics in living mice[J]. Advanced Materials, 2015, 27(28): 4169-4177. DOI:10.1002/adma.201500323 |
| [62] |
O'BRIEN-SIMPSON N M, HOLDEN J A, LENZO J C, et al. A therapeutic Porphyromonas gingivalis gingipain vaccine induces neutralising IgG1 antibodies that protect against experimental periodontitis[J]. NPJ Vaccines, 2016, 1(1): 16022. |
| [63] |
YEAMAN M R, YOUNT N Y. Mechanisms of antimicrobial peptide action and resistance[J]. Pharmacol Rev, 2003, 55: 27-55. DOI:10.1124/pr.55.1.2 |
| [64] |
ZHANG S K, SONG J W, GONG F. Design of an α-helical antimicrobial peptide with improved cell-selective and potent anti-biofilm activity[J]. Scientific Reports, 2016, 6(1): 27394. DOI:10.1038/srep27394 |
| [65] |
HAN H M, GOPAL R, PARK Y. Design and membrane-disruption mechanism of charge-enriched AMPs exhibiting cell selectivity, high-salt resistance, and anti-biofilm properties[J]. Amino Acids, 2016, 48(2): 505-522. DOI:10.1007/s00726-015-2104-0 |
| [66] |
KILIAN M, CHAPPLE I L C, HANNIG M. The oral microbiome-an update for oral healthcare professionals[J]. British Dental Journal, 2016, 221(10): 657-666. DOI:10.1038/sj.bdj.2016.865 |
| [67] |
HIEKE C, KRIEBEL K, ENGELMANN R. Human dental stem cells suppress PMN activity after infection with the periodontopathogens Prevotella intermedia and Tannerella forsythia[J]. Scientific Reports, 2016, 6(1): 39096. DOI:10.1038/srep39096 |
| [68] |
LIU J, LU S, TANG Q. One-step hydrothermal synthesis of photoluminescent carbon nanodots with selective antibacterial activity against porphyromonas gingivalis[J]. Nanoscale, 2017, 9(21): 7135. DOI:10.1039/C7NR02128C |
| [69] |
GUO X, WANG C F, YU Z Y. Facile access to versatile fluorescent carbon dots toward light-emitting diodes[J]. Chemical Communications, 2012, 48(21): 2692-2694. DOI:10.1039/c2cc17769b |
| [70] |
GONÇALVES H M R, DUARTE A J, ESTEVES DASILVA J C G. Optical fiber sensor for Hg(Ⅱ) based on carbon dots[J]. Biosensors and Bioelectronics, 2010, 26(4): 1302-1306. DOI:10.1016/j.bios.2010.07.018 |
 2020, Vol. 48
2020, Vol. 48