文章信息
- 郑俊生, 秦楠, 郭鑫, 金黎明, Zheng Jim P
- ZHENG Jun-sheng, QIN Nan, GUO Xin, JIN Li-ming, Zheng Jim P
- 高比能超级电容器:电极材料、电解质和能量密度限制原理
- High energy density supercapacitors: electrode material, electrolyte and energy density limitation principle
- 材料工程, 2020, 48(9): 47-58
- Journal of Materials Engineering, 2020, 48(9): 47-58.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.000721
-
文章历史
- 收稿日期: 2019-08-01
- 修订日期: 2019-12-09
2. 同济大学 汽车学院, 上海 201804;
3. 佛罗里达州立大学, 佛罗里达 32310
2. School of Automotive Studies, Tongji University, Shanghai 201804, China;
3. Florida State University, Florida 32310, USA
化学电源[1-2]是一种直接将化学能转变成电能的器件,典型的化学电源包括铅酸电池、镍氢电池和锂离子电池等。在现代社会的发展中,化学电源在工业、农业、交通运输业、通讯、文化教育等方面被广泛使用,已经成为了人们生产生活中不可或缺的一部分。近些年来,随着信息技术的发展和人们生活方式的转变,人们对于化学电源提出了更高的要求,不断推进化学电源技术的不断进步。近几年来,在国家政策推动下,新能源领域发展迅猛。相比于过去的十几年,国内锂离子电池产业在产能上有了大幅的增加,并且技术上也取得了前所未有的创新和突破。但是,在锂离子电池产业迅速扩张的背后,化学电源技术却存在相当严重的发展不平衡。政策向以锂离子电池为代表的高能量密度电源器件倾斜,而忽略了功率型电源器件(如超级电容器)的发展。目前,国内企业的能量型器件产品在国际上已经颇具竞争力,但是从市场格局来看,国内企业在功率型电源器件方面仍然远远落后于国外的企业,如Maxwell,JSR等。然而超级电容器在轨道交通、混合动力汽车、国防军事、医疗、港口运输、风力发电等领域有着不可替代的作用,目前国内这些领域所应用的超级电容器产品严重依赖于进口,国内的产品缺乏竞争力,因此我国亟须发展高性能的超级电容器。
图 1为超级电容器的技术发展路线图。可以看出超级电容器的发展目标是不断提高其能量密度。超级电容器的能量密度和比电容和工作电压的二次方成正比,所以,比电容和工作电压是能量密度的关键影响因素,并且工作电压是影响超级电容器能量密度发展至关重要的因素。大量研究从研制新电极材料、新电解液以及新电容器体系来提高超级电容器的能量密度。从水系超级电容器到锂离子电容器,工作电压由1.0 V提升至大约4.0 V,能量密度也从1 Wh·kg-1提升至大约20 Wh·kg-1。但是,距离应用在车用电源等领域的标准还有一定距离。根据2017年美国汽车研究委员会(USCAR)公布的混合动力汽车的48 V启停电源发展目标,需要电源的能量密度应大于25 Wh·kg-1,并且功率密度大于0.6 kW·kg-1,而目前研发出的器件仍有一定差距。如何在保持原有倍率、寿命等性能下,进一步提升器件的能量密度成为研究的热点。

|
图 1 超级电容器技术储能路线图 Fig. 1 Roadmap of supercapacitor technology energy storage |
本文根据超级电容器储能特点,论述了超级电容器的能量限制原理及提升方向。首先介绍了目前超级电容器工作原理以及在电极材料和电解液方面的研究发展,然后指出超级电容器能量密度的限制原因和影响因素,并总结了提升超级电容器能量密度的工作方向。
1 超级电容器的工作原理超级电容器的历史可追溯到1879年Helmholtz提出双电层理论,指出施加电压后,电极与电解液界面发生电荷分离,产生双电层,为超级电容器确立了理论基础[3]。1957年Becker采用高表面积碳材料作为电极制成了双电层电容器,从而把较小的电容器用于储能元件,使双电层电容器的产品化有了突破。1966年标准石油公司(SOHIO)获得了在双层界面中储能装置的专利授权。20世纪70年代,NEC公司开始生产应用于电动汽车启动系统的超级电容器(supercapacitor)。之后,超级电容器逐渐得到大规模应用。
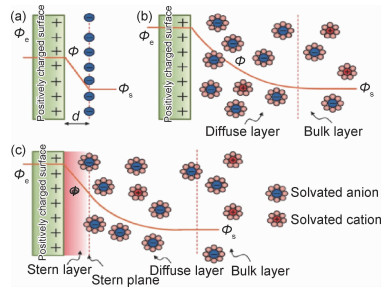
双电层电容器(electrochemical double layer capacitors, EDLCs)[4]是最常见、也是应用最为广泛的超级电容器,它通过电极/电解质界面上产生可逆电化学双电层电容(非法拉第过程)进行储能,其中电荷累积在电极活性物质表面上,带相反电荷的离子排列在电解质侧[4]。最早描述界面双电层的模型是经典Helmholtz双电层模型[3],如图 2(a)所示[5]。该模型中,电极表面聚集着与电极电荷电量相等且电性相反的电解液离子,形成类似平板电容器的双电层。由于双电层电容器的电极材料比表面积(S)很大,而且由于双电层的有效厚度(d)在纳米级别,因此,根据平板电容器电容计算公式(如式(1)所示),双电层电容器的比电容远高于电解电容器。

|
(1) |
式中:εr为电解质介电常数; ε0为真空介电常数; S为电极比表面积; d为双电层的有效厚度。
但Helmholtz双电层模型没有考虑离子扩散等因素在双电层形成中的影响(图 2(a))。在Helmholtz紧密双电层模型基础上,Chapman[6]和Gouy[7]提出GC扩散双电层模型,指出电极表面至电解液本体之间存在一个电势逐渐降低的离子扩散层,如图 2(b)所示[5]。Chapman提出了德拜长度(LD,式(2))用于测量扩散层厚度。并提出电容C的定量计算公式。根据式(3),该模型中电容近似抛物线分布。

|
(2) |
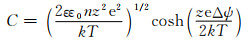
|
(3) |
式中:ε为介电常数; k为玻尔兹曼常数; n为每m3中阳离子或阴离子的数目;z为形式电荷; Δψ为分散层电势。
1924年,Stern又提出了一种双电层模型[8],其综合了Helmholtz紧密双电层模型与GC扩散双电层模型,指出两层的电容对双电层总电容的影响相同,更真实地描述了实际结构,如图 2(c)所示[5]。即总电容C与Helmholtz电容(CH)和GC扩散层电容(CGC)的关系为:
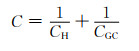
|
(4) |
因此整体电容受控于CH与CGC中较小者。
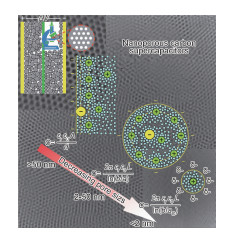
但是活性炭的比电容受孔径尺寸以及分布影响,而上述模型没有体现出孔径对电容的影响。因此,Huang等[9]开始从描述真实多孔碳/电解液的界面来研究双电层结构。其假设多孔碳的孔形状为圆柱形,提出了带电双层柱电容器模型(electric double-cylinder capacitor, EDCC)和电线芯圆柱电容器模型(electric wire-in-cylinder capacitor, EWCC)模型,这两种模型分别适用于介孔和微孔结构的双电层,能很好地描述真实多孔碳|电解液界面双电层结构,如图 3所示。对应于3种不同孔径,电容的计算公式为:

|
(5) |
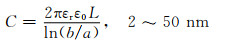
|
(6) |
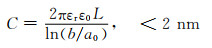
|
(7) |
式中:A为电极比表面积; d为双电层的有效厚度(德拜长度); L为孔长度; b和a为外筒和内筒的半径; a0为反离子的有效尺寸(即离子周围的电子密度范围)。
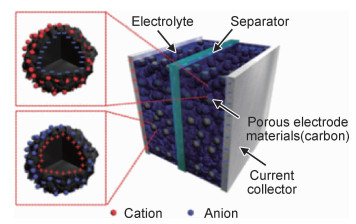
如图 4所示,双电层电容器结构由两个相同的电容电极组成,通过吸附/脱附反应进行储能[10]。整个器件可看作正负极两个电容的串联,因此整体电容可根据式(8)计算:
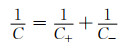
|
(8) |
对于对称双电层电容器,正负极使用同种材料(C+=C-),因此整体电容为C=C+/2= C-/2。
为了便于比较不同材料的性能,通常使用比容量Csp (F·g-1)衡量。即
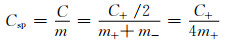
|
(9) |
式中m为活性物质总质量或电极总质量。
双电层电容器的能量密度E(Wh·kg-1)与功率密度P(W·kg-1)可根据式(10),(11)计算。

|
(10) |
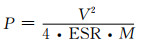
|
(11) |
式中:C为器件总容量; V为器件工作最大电压; M为器件总质量; ESR为器件等效串联电阻。由于双电层电容器的能量存储过程不涉及任何的氧化还原反应,即电容器在能量存储时不受化学反应速率的限制[1]。因此,这种能量存储机制可以快速地存储和释放能量,即器件具有非常好的功率及寿命性能。然而,受限于表面电荷物理吸脱附存储机制只能储存有限电荷,双电层电容器的能量密度较低,大约为6~7 Wh·kg-1,远远低于成熟的锂离子电池(≈250 Wh·kg-1),因此如何提升能量密度,是超级电容器研究中始终存在的热点课题。
Conway等[11]最先提出了法拉第赝电容器的理论,其通过电极材料表面或近表面快速的氧化还原反应存储能量,故赝电容器的容量一般要远远大于传统的双电层电容器,从而较大幅度提高了超级电容器的能量密度。由于赝电容器快速的电荷转移过程,因此其具有与双电层电容器类似的循环伏安测试曲线以及恒电流放电曲线[12]。但是,随着材料纳米化发展,部分锂离子电池材料随着材料尺寸不断减小,其比表面积增大,离子扩散路径缩短,在循环伏安测试以及恒电流测试中,也展现出和传统赝电容相似的曲线,具有一定的赝电容特征如LiCoO2[13],Ni(OH)2[14]等,这类特性被称作外部赝电容性(extrinsic pseudocapacitance)。赝电容的定义得到了进一步发展。Dunn等[13]结合Conway的研究,对赝电容机理重新分类为3种:(1)欠电位沉积(金属离子在其氧化还原电位以上时,形成吸收单层[15]); (2)氧化还原赝电容;(3)插层赝电容。而且总结了赝电容材料的电化学特征为:(1)循环伏安测试为矩形形状或宽峰,峰值间电压分离小; (2)倾斜的恒流充放电曲线; (3)奈奎斯特图为相位角90°或更小的垂直线[13]。根据反应原理,赝电容材料可以分为嵌入/脱嵌型(如TiO2, Nb2O5, MoOx)、合金化/去合金化型(如金属锡Sn)、转化型(如金属氧化物、金属硫化物)等类型。但由于赝电容材料结构、稳定性和价格方面等原因综合影响,其应用也受到了一定的限制。
近年来,研究者提出了一种新型超级电容器器件,称为混合型电容器,或非对称电容器[2, 16],它的一个电极采用双电层电容器材料,另一电极采用电池型材料[17-18]或赝电容材料,一方面提升了器件的比电容,另一方面较大幅度提高体系的工作电压,因而能大幅度提升能量密度。
2 超级电容器材料研究方向 2.1 电极材料根据双电层电容器依靠离子吸/脱附形成的双电层储能的原理,应用于电极的材料应具有高比表面积、良好的导电性和高化学稳定性等特征,从而满足双电层形成时离子吸附的巨大表面条件。碳材料具备上述特征,是一种适合的材料。活性炭(AC)具有大于2000 m2·g-1的大比表面积,其在水性和有机电解液中分别可以提供200 F·g-1和100 F·g-1的电容,因此是最早也是应用规模最大的碳材料。通常,碳材料在电极/电解质界面处的电荷累积能力随着比表面积增大而增加。但是,还必须考虑孔的形状/表面官能团和导电性等结构影响。由于活性炭材料的孔径分布范围很大,国际纯粹与应用化学联合会(IUPAC)根据孔径尺寸将孔分为:大孔(macropores,大于50 nm)、介孔(mesopores,2~50 nm之间)和微孔(micropores,小于2 nm)。其中和离子尺寸相近的孔,如孔径小于0.5 nm的微孔几乎不易接触电解质离子,因此比电容并不总是随着材料比表面积线性增加。例如在微孔孔道中,离子迁移会急剧减慢,双电层电容器的能量和功率密度受到限制[19]。而且,高表面积或大孔体积限制了高功率或能量密度,并且非常大的孔隙率直接转化为低体积密度,导致体积功率和能量性能表现不佳[20]。因此,大量学者已经制备了高比电容AC,它可以通过以下方法实现更高的离子扩散速率:
(1) 调节活性炭材料的孔径分布[21]。Yoshida等[22]通过无溶剂途径合成了有序介孔碳,其中形成直径为6.2 nm的直孔通道,材料比表面积可达1520 m2·g-1,具有优异的双电层电容器特性。Yang等[23]通过控制间苯二酚和甲醛的缩聚反应中的聚合时间,获得可控孔径的碳气凝胶,满足双电层电容器高电流密度工作下,离子传递所需的孔径要求。
(2) 电解质离子尺寸的匹配策略[24]。Urita等[25]研究了溶剂化离子和去溶剂化离子在碳材料孔中渗透的比例对电容的影响,并指出具有蠕虫状表面和从溶剂化离子到溶剂分子的孔径分级多孔结构是理想的电极结构。上述方法有效地提升了器件的比容量,从而提高了能量密度。
Conway[26]指出可用于双电层超级电容器电极的碳材料必须具有3个特性:比表面积超过1000 m2·g-1、良好的颗粒内和颗粒间导电性、以及碳材料孔内空间出色的电解质亲和性。根据上述特性要求,新型碳材料也被应用于超级电容器电极材料。活性炭纤维相比于活性炭,具有优异的孔道分布,有利于电解液的浸润和电荷的吸附,因而更适宜用于电极材料。Lo等[27]利用静电纺丝技术制得了碳纳米纤维,在PAN/PAN-co-PB质量比为90:10时,比电容达到170.2 F·g-1,并且在2000个循环后仍有100%的能量保持率,表现出良好的循环稳定性。碳纳米管(CNT)由于高导电性及稳定性也被用于超级电容器活性材料,但由于其比表面积较低,造成碳纳米管的比电容很低[28],限制了其广泛应用。因此,大量工作通过酸/碱处理等表面改性或构建高度有序的阵列排列来增加碳纳米管的比表面积[29-30]。作为一种具有高导电率和电荷传输效率的二维材料,石墨烯也受到了广泛关注。但是由于石墨烯片层之间较强的作用力,导致材料容易团聚。因此对石墨烯材料的研究集中在石墨烯表面引入反应性基团等表面改性,提高石墨烯分子的分散力,降低团聚的可能性。Chang等[31]利用液体钠与二氧化碳气体制成石墨烯,反应同时生成的Na2CO3纳米颗粒附着在石墨烯表面,抑制了石墨烯的团聚。最近一种二维过渡金属碳化物(MXenes)引起关注,这种材料具有高比表面积和高电导率的特点。但是,和石墨烯类似,MXenes也存在材料易团聚的问题。在众多研究中,一个有效的方法是制作MXenes和石墨烯复合材料,相互抑制团聚[32]。此外,大量学者通过表面掺杂来改善碳基材料电容性能。目前研究的热点是在碳骨架上引入氮杂原子。含氮原子可以产生或增加氧化还原反应[33],从而增加了碳基材料比电容,提升能量密度,结合进一步比表面积和孔径改良,相应的超级电容器也表现出优良的性能。
除了上述具有大比表面积和优良孔径分布的碳材料之外,具有赝电容性能的材料也被应用于超级电容器中,通过引入赝电容反应,增加器件总体比电容来提升能量密度。赝电容器的电极材料主要有两类,一类为过渡金属氧化物,例如RuO2,MnO2,Co3O4[34]等。由于RuO2具有较高的理论比电容(1400~2000 F·g-1),反应可逆性好以及导电性好等优势,使得它成为近几十年来研究最多的赝电容材料[35]。对于RuO2赝电容器,其比电容和电导率受含水量影响显著。研究表明,x=0.5时,在150 ℃退火温度下,RuO2·xH2O可达到最高的比电容,目前制备的已达800 F·g-1 [36]。然而3个因素阻碍了其商业化的发展:(1)氧化物在频繁的充放电过程中容易剥落;(2)金属钌(Ru)成本过高限制了活性物质载量从而限制了比电容;(3)难以同时实现RuO2·xH2O的高比容量和高电导率[37]。为解决以上问题,当前主要的做法是构建RuO2基的纳米复合材料。例如,混合金属氧化物纳米复合材料、混合导电聚合物纳米复合材料、多孔活性炭纳米复合材料、CNT纳米复合材料、混合石墨烯复合材料等[38]。由于RuO2高成本、资源稀缺和毒性问题,同样具有高赝电容性能(理论比电容1380 F·g-1)、廉价环保且储量非常丰富的MnO2材料也被研究学者们广泛研究[39-40]。然而,较差的导电子性和导离子性阻碍了实际应用[41],为提高MnO2性能,Guo等[42]归纳了当前的处理策略并总结为5种方式:导电物包覆、金属掺杂、缺陷工程、构建单/多层结构和异质节配置。第二类为导电聚合物,如聚苯胺(PANI)[43-44],聚吡咯(PPy)[45-46],聚噻吩(PTh)[47-48]及其衍生物,他们都被广泛研究并用于赝电容器。在非水系电解液中,这些赝电容器电压可达3.0 V,并且具有非常高的比电容。但是受限于材料本身的固有缺陷,这些导电聚合物通常循环性能都比较差。
2.2 电解质电解质是超级电容器的重要组成部分,它提供了构建双电层的离子,影响双电层的电容性能,并且电解质的分解电压限制了超级电容器的工作电压,因此电解质是超级电容器能量密度的一个重要影响因素。研究人员已经开发了多种类型的电解质,根据溶剂的性质,可以分为水系电解质、有机电解质和离子液体。在实际应用中,选择何种电解质根据两个关键因素决定[5]:(1)电化学稳定窗口;(2)离子电导率。电化学稳定窗口决定了电容器器件最高能达到的工作电压,离子电导率会影响动力学特征,决定了电容器的倍率特性。3种类型电解质特点不同,实际应用的范围和特点也各异。
水系电解质可以分为酸性、中性和碱性3种类型,如H2SO4,Na2SO4和KOH等。他们虽然有较大的离子电导率(可达到1 S·cm-1),有更多的离子可供吸/脱附形成双电层,但是其溶剂为水,而水的分解电压(1.23 V)限制了水系超级电容器的工作电压,传统对称性超级电容器电压通常只有1 V,限制了能量密度提升[49],如图 5所示。
有机电解质由有机溶剂和导电盐组成,可以提供3.5 V的电压窗口,因而有机系超级电容器可以在较高的电压下工作,有更大的能量密度,但是其离子电导率低于水系电解质。目前超级电容器常用的为基于乙腈(AN)或碳酸亚丙酯(PC)溶剂的有机电解质[50]。乙腈(AN)比其他溶剂可以溶解更多的盐,但其对环境有害。相比之下,基于碳酸亚丙酯(PC)的电解质不仅对环境友好,而且还可提供宽电压窗口,宽范围的工作温度和良好的导电性[51]。因此,有机电解质TEABF4/PC已被广泛用于双电层电容器研究。值得注意的是,电解质和电极材料的匹配对性能影响很大,一方面电解质离子的尺寸和电极材料的孔径需匹配[52],否则会导致填入小孔径的电解质溶剂不能传递离子,降低能量密度。另一方面,电极材料表面官能团和电解质分解电压需匹配,Naoi等[53]研究了活性炭电极双电层电容器在不同电压下的副反应,指出了在不同电位下电解质溶剂分子与活性炭表面不同官能团发生的副反应,例如阳极电位在3.3 V时,发生电极材料表面羧基的氧化以及苯酚和酮的氧化。这些因素限制了双电层电容器的稳定工作电压及能量密度。
为了进一步提升电解质的电化学稳定窗口,离子液体受到了极大的关注。离子液体具有高的稳定性,因为离子液体不需要溶剂,所以电解质具有非常低的蒸气压,降低了环境蒸发并且降低了爆炸的风险。离子液体在高温下有良好的稳定性以及比有机电解质更宽的电化学稳定窗口[54-55]。但是,离子液体的电导率通常低于有机电解质[56],使其组装的超级电容器倍率性能降低。应用于超级电容器的离子液体主要由吡咯烷鎓、咪唑鎓或脂肪族季铵盐和PF6-,BF4-,TFSI-或FSI-等阴离子偶联组成。根据电极材料设计或选择合适的离子液体,有望实现超级电容器能量密度的进一步提升。
3 超级电容器能量密度限制原理超级电容器的能量密度可以表述为:E=1/2CV2(其中C为器件的比电容,V为器件的工作电压)。通过增加电极材料比电容理论上能同幅度增大能量密度,但是超级电容器实际能量密度却增长缓慢。这是因为对于超级电容器目前常用的电解质,其可提供的离子数目有限,例如常用的电解质1 mol·l-1 ET4NBF4或1 mol·l-1 LiPF6的离子浓度为6×1020 ion·cm-2,换算为容量只有22.3 mAh·g-1(或26.8 mAh·cm-2),和大容量的电容材料的离子浓度需求不匹配。但在评估超级电容器能量密度时,研究者往往只考虑了电极材料比电容,却没有考虑电解质离子浓度的影响。
本课题组[57] 探讨了电解质和电极材料对消耗电 解质型对称超级电容器能量密度的限制,得出基于电 极材料的比电容、电解质离子浓度和工作电压的超级 电容器能量密度计算公式:

|
(12) |
其中:Cp为电极材料的比电容; V为电容器的工作电压; c0为电解质的盐浓度; F是法拉第常数(96484 C·mol-1); α是非单位常数并且小于1。图 6显示了α=1/2时电解质不同盐浓度的电容器的能量密度与比电容之间的关系。α=1/2意味着,当电容器完全充电时,电解质中一半的盐浓度用于对电容器充电。因此,超级电容器能量密度不仅取决于比电容(Cp·V),还取决于盐浓度。进一步分析可以得到当电极材料的容量在100 F ·g-1 ·V以上时,超级电容器能量密度主要受限于电解液的浓度,单纯提升电极的容量对器件的能量密度影响不大。
根据超级电容器能量密度计算公式及相关限制因素的分析,未来高能量密度超级电容器可以从两方面发展。一方面电极材料的比电容尚有一定的空间,可以继续研制高比电容材料,组装高比电容超级电容器。另一方面,寻找更有效的方法提升超级电容器的工作电压。因此,对应于以上两个发展方向,具体可以从以下形式进一步研究。
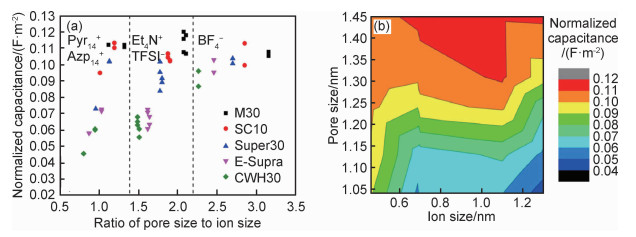
4.1 电极方面提高电极比电容可以增加器件比电容,从而提高能量密度。超级电容器的电容一方面可以从电极材料的电容提升,包括对现有材料的表面改性、掺杂等方法和研发新型电极材料。值得注意的是,器件的电容受电极材料孔径和电解质离子形状及尺寸匹配的影响。Noked等[58]从实验和仿真的角度研究了离子形状对于电极材料中离子吸附的影响。对于孔径小于0.7 nm的碳,平面溶剂化离子如NO3-,被吸附在狭缝形孔中,而球形溶剂化离子如Cl-被排除在外。Pohlmann等[24]系统研究了孔径尺寸和离子尺寸不同配比下,器件比电容的变化,如图 7所示。在孔径大于1.3 nm能产生较大比电容,并且较小尺寸的离子相对于较大尺寸的离子能产生更大比电容。但是,比电容最大值不是在最大孔径和最小离子尺寸组合得到,而是在孔径尺寸大于1.3 nm和离子尺寸约1.1 nm时得到。因此,构建超级电容器器件,要合理选择电极材料和电解质离子的协同配比。
另一方面可以使用双电层电容器材料和赝电容器材料构建非对称超级电容器,来提升器件比电容。根据电容计算公式:
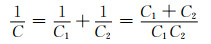
|
(13) |

|
(14) |

|
(15) |
式中:C为电容器件比电容; C1, C2分别为两电极的比电容。由于赝电容电极比电容(式(15)中C2)远大于双电层电极材料比电容(式(15)中C1),因此器件的比电容是对称型电容器的2倍。从而实现通过提升单个电极的比电容,实现器件整体比电容的提升。如使用MnO2[59-60], RuO2[61]等材料与多孔碳材料组装非对称电容器,可得到高工作电位、高比容量以及高能量密度的超级电容器,满足更多实际使用场景。
4.2 电解质方面开发利用高电化学稳定电压电解质,可扩宽器件的工作电压范围,进一步提升其能量密度。通常,离子液体的稳定电位区间最高,有机系电解质其次,而水系电解质的稳定电位区间最低。离子液体虽然具有高的稳定电位区间,但是其黏度较高、离子电导率较低,导致其等效串联电阻较大,循环稳定性较差[24]。Qian等[62]研发了一种在1-乙基-3-甲基咪唑四氟硼酸盐(EMIMBF4)中添加γ-丁内酯(GBL)的双元电解质,可以达到3.7 V的稳定电位区间,并且具有可达-70 ℃的超宽温度范围。近期,计算机分析技术也被应用于电解质开发。Schütter等[63]对4000余种腈类电解质系统地应用计算筛选方法,通过快速预测大量化合物的性质,合理地寻找新的超级电容器电解质材料,并且进行实验和验证。这种方法可以避免耗时的“试错”实验,有助于合理快速地研发高电化学电位区间电解质。
4.3 超级电容器结构方面 4.3.1 优化对电解质稳定区间的应用超级电容器使用的电解质存在分解电压,在电极电位超出稳定电位窗口界限后,会发生电解质溶剂分子分解等副反应,因此限制了器件的工作电压。对于水系超级电容器,水的分解电位为电位窗口的主要限制因素[49]。对于有机超级电容器,溶质分子和碳基材料表面官能团的反应电位为电位窗口的主要限制因素[53]。
由于超级电容器正负极副反应机理不同,因此稳定电位窗口的上下电位界限相对于超级电容器开路电压是非对称的,如图 8所示,实际充放电中存在没有利用的稳定电位区间。Chae等[64]研制了水系容量非对称碳基超级电容器,他们通过正负极容量的配比,拓展利用负极未利用的电位区间,可将水系超级电容器工作电压提升至1.90 V,能量密度提升了38%,并且10000圈循环后容量保持率超过85%。Lu等[49]开发了一种有效的表面电荷控制策略,可控地调节电极的工作电位范围,实现了中性电解质超级电容器的工作电压从1.4 V扩大到1.8 V,其能量密度达到之前的两倍。类似的,在现有电极材料和电解质的前提下,通过器件结构上的调控,改变电极电位变化过程来提升能量密度值得进一步研究。

|
图 8 通过电极电容的不均衡调节正负极电位窗口,增加工作电压[64](a)和通过表面电荷修饰改变开路电压,可控调节电极的工作电压范围[49](b)的示意图 Fig. 8 Sketch map of adjusting the potential window of positive and negative electrodes by imbalance of electrode capacitance, and increasing the operating voltage[64](a), as well as changing the open circuit voltage by surface charge modification, and controlling the operating voltage range of the electrode[49](b) |
对于有机系超级电容器,不同施加电压下,正负极所发生的反应也不同。Naoi等[53]利用H桥电池系统研究了有机系超级电容器正负极在不同施加电压下,产生的气体如图 9所示。有机系超级电容器同样存在正负极电极电位未利用的区间。在充放电过程中,会存在图 9(b),(c)两种情况,电解质未利用的电位区间分别在正极或负极侧。根据充放电过程中的电荷守恒以及离子守恒,存在以下关系:
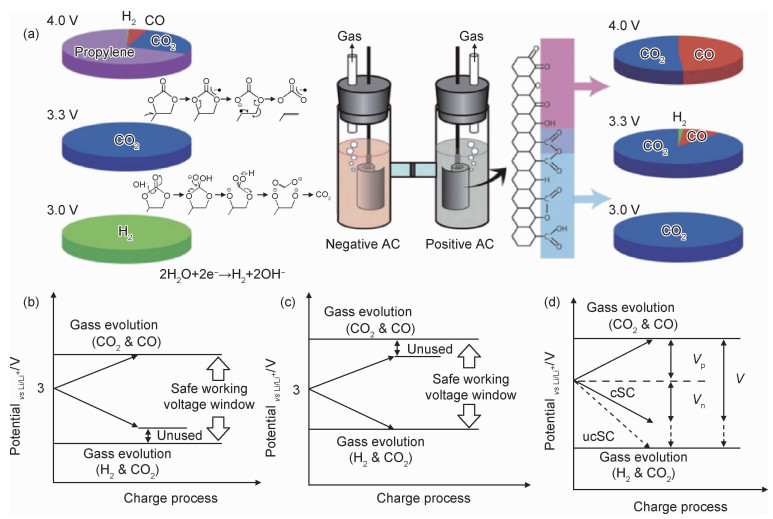
|
图 9 未完全利用稳定电位区间的有机碳基超级电容器示例及改进方法示意图 (a)EDLC在施加不同电压时释放气体示意图[53];(b)正极电位先达到稳定电位区间界限的对称超级电容器;(c)负极电位先达到稳定电位区间界限的对称超级电容器;(d)完全利用稳定电位区间的非对称超级电容器 Fig. 9 Examples of organic carbon-based supercapacitors which do not fully utilize the safe working voltage window and schematicdiagram of the improved method (a)schematic diagram of gas evolution from an EDLC cell upon over-voltage application[53]; (b)a symmetric supercapacitor in which the positive electrode potential first reaches the limit of safe working voltage window; (c)a symmetric supercapacitor in which the negative electrode potential first reaches the limit of safe working voltage window; (d)an unbalanced supercapacitor with fully used safe working voltage |

|
(16) |
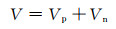
|
(17) |
式中:m, C, V分别为正极(下标为p)和负极(下标为n)的活性物质质量、比电容和工作电位范围。根据式(16),正负极活性物质质量比与正负极工作电位范围比成反比。因此,可以设计正负极采用相同材料,但质量比不同的超级电容器,来充分利用全部电解质的稳定电位区间[65-67]。
4.3.2 减少器件对电解液的消耗目前,超级电容器能量密度主要受电解质的限制。原因是在充电和放电过程中需要消耗电解质。因此,研究低电解质消耗或无电解质消耗的超级电容器,可以突破电解质的限制并大幅度增加能量密度。本课题组[68]提出了一种电化学电容器,它由电池/双电层电容器(负极为预嵌锂电池型材料电极,正极为双电层电容器材料电极, 通过正极开路电位控制,预嵌的锂可补偿电解液消耗)或赝电容器/赝电容器(离子插入型-RuO2·xH2O电极)组成。由于克服了消耗电解质的特性,这种不对称电容器的理论能量密度可达到60 Wh·kg-1。
锂离子超级电容器是一种基于传统的锂离子有机电解液,正极采用活性炭(AC)电极,负极采用石墨负极的新型超级电容器。在充放电过程中,电池电极(石墨)发生法拉第反应,Li+嵌入和脱出;电容电极(活性炭)发生非法拉第反应,离子在电极表面进行吸附/脱附。如图 10所示,由于正负电极采用不同材料,造成了两者电压窗口完全不同,其中负极的工作电位基本上维持在0.1 V(vs Li/Li+)左右,正极的工作电位随着时间呈线性变化,这种正负极工作电压区间的不对称性使得锂离子超级电容器件本身具有更加宽的电压窗口区间[16],从而大幅度提升了能量密度。
超级电容器是一种功率型储能系统,具有高功率密度和长循环寿命,但其能量密度低,限制了进一步应用。本文总结了超级电容器电极材料和电解质的研究进展。对于电极材料,众多研究致力于优化孔结构、掺杂氮等杂原子和开发新型碳材料,来增加电极的比电容。对于电解质,业界研究热点为制备高化学稳定电位区间的电解质,来提升超级电容器的工作电压,从而增加能量密度。其中电极材料和电解质的匹配问题需要关注:(1)在充放电过程中,在特定电压下,电极材料表面官能团会导致电解质溶剂分解,限制最大工作电压;(2)电极材料孔径尺寸和离子尺寸需要匹配。研究证明,在电极材料孔径尺寸大于1.3 nm和离子尺寸约1.1 nm区间内,可以得到比电容的最大值。但是由于能量存储机制,即充电/放电期间电解质中的离子被消耗,导致电解质离子浓度和电极材料比电容共同影响超级电容器能量密度。因此一味地提升比电容,不能有效提升器件能量密度。有研究得出了电极材料的比电容、电解质离子浓度和工作电压的能量密度计算公式,并且表明当前超级电容器能量密度主要受限于电解液的浓度。因此,高能量密度超级电容器可以通过应用高电化学稳定电位区间电解质、充分利用现有电解质电化学稳定电位区间、减少充放电过程中电解质消耗如开发锂离子电容器来实现。
| [1] |
SIMON P, GOGOTSI Y. Materials for electrochemical capacitors[J]. Nature Materials, 2008, 7(11): 845-854. DOI:10.1038/nmat2297 |
| [2] |
WANG Y, SONG Y, XIA Y. Electrochemical capacitors:mechanism, materials, systems, characterization and applications[J]. Chem Soc Rev, 2016, 45(21): 5925-5950. DOI:10.1039/C5CS00580A |
| [3] |
HELMHOLTZ H. Studien über electrische Grenzschichten[J]. Annalen der Physik, 1879, 243(7): 337-382. DOI:10.1002/andp.18792430702 |
| [4] |
ZHANG L L, ZHAO X S. Carbon-based materials as supercapacitor electrodes[J]. Chem Soc Rev, 2009, 38(9): 2520-2531. DOI:10.1039/b813846j |
| [5] |
BEGUIN F, PRESSER V, BALDUCCI A, et al. Carbons and electrolytes for advanced supercapacitors[J]. Advanced Materials, 2014, 26(14): 2219-2251, 2283. DOI:10.1002/adma.201304137 |
| [6] |
CHAPMAN D L. A contribution to the theory of electrocapillarity[J]. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 2010, 25(148): 475-481. |
| [7] |
GOUY M. Sur la constitution de la charge électrique à la surface d'un électrolyte[J]. J Phys Theor Appl, 1910, 9(1): 457-468. DOI:10.1051/jphystap:019100090045700 |
| [8] |
STERN O. Zur theorie der elektrolytischen doppelschicht[J]. Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie, 1924, 30(21/22): 508-516. |
| [9] |
HUANG J, SUMPTER B G, MEUNIER V. A universal model for nanoporous carbon supercapacitors applicable to diverse pore regimes, carbon materials, and electrolytes[J]. Chemistry, 2008, 14(22): 6614-6626. DOI:10.1002/chem.200800639 |
| [10] |
ZHONG C, DENG Y, HU W, et al. A review of electrolyte materials and compositions for electrochemical supercapacitors[J]. Chemical Society Reviews, 2015, 44(21): 7484-7539. DOI:10.1039/C5CS00303B |
| [11] |
CONWAY B E, BIRSS V, WOJTOWICZ J. The role and utilization of pseudocapacitance for energy storage by supercapacitors[J]. Journal of Power Sources, 1997, 66(1): 1-14. |
| [12] |
JIANG Y, LIU J. Definitions of pseudocapacitive materials:a brief review[J]. Energy & Environmental Materials, 2019, 2(1): 30-37. |
| [13] |
AUGUSTYN V, SIMON P, DUNN B. Pseudocapacitive oxide materials for high-rate electrochemical energy storage[J]. Energy and Environmental Science, 2014, 7(5): 1597-1614. DOI:10.1039/c3ee44164d |
| [14] |
LI H B, YU M H, WANG F X, et al. Amorphous nickel hydroxide nanospheres with ultrahigh capacitance and energy density as electrochemical pseudocapacitor materials[J]. Nature Communications, 2013, 4: 1-7. |
| [15] |
HERRERO E, BULLER L J, ABRUÑA H D. Underpotential deposition at single crystal surfaces of Au, Pt, Ag and other materials[J]. Chemical Reviews, 2001, 101(7): 1897-1930. DOI:10.1021/cr9600363 |
| [16] |
NAOI K, ISHIMOTO S, MIYAMOTO J, et al. Second generation 'nanohybrid supercapacitor':evolution of capacitive energy storage devices[J]. Energy & Environmental Science, 2012, 5(11): 9363. |
| [17] |
JIN L, GONG R, ZHANG W, et al. Toward high energy-density and long cycling-lifespan lithium ion capacitors:a 3D carbon modified low-potential Li2TiSiO5 anode coupled with a lignin-derived activated carbon cathode[J]. Journal of Materials Chemistry:A, 2019, 7(14): 8234-8244. DOI:10.1039/C8TA12000E |
| [18] |
JIN L, GONG R, ZHENG J, et al. Fabrication of dual-modified carbon network enabling improved electronic and ionic conductivities for fast and durable Li2TiSiO5 anodes[J]. Chem Electro Chem, 2019, 6: 3020-3029. |
| [19] |
LIU H J, WANG J, WANG C X, et al. Ordered hierarchical mesoporous/microporous carbon derived from mesoporous titanium-carbide/carbon composites and its electrochemical performance in supercapacitor[J]. Advanced Energy Materials, 2011, 1(6): 1101-1108. DOI:10.1002/aenm.201100255 |
| [20] |
PRESSER V, ZHANG L, NIU J J, et al. Flexible nano-felts of carbide-derived carbon with ultra-high power handling capability[J]. Advanced Energy Materials, 2011, 1(3): 423-430. DOI:10.1002/aenm.201100047 |
| [21] |
ZHOU H, ZHU S, HIBINO M, et al. Electrochemical capacitance of self-ordered mesoporous carbon[J]. Journal of Power Sources, 2003, 122(2): 219-223. DOI:10.1016/S0378-7753(03)00439-7 |
| [22] |
YOSHIDA N, HIROTA Y, UCHIDA Y, et al. Solvent-free synthesis and KOH activation of mesoporous carbons using resorcinol/Pluronic F127/hexamethylenetetramine mixture and their application to EDLC[J]. Microporous and Mesoporous Materials, 2018, 272: 217-221. DOI:10.1016/j.micromeso.2018.06.028 |
| [23] |
YANG I, KIM S G, KWON S H, et al. Pore size-controlled carbon aerogels for EDLC electrodes in organic electrolytes[J]. Current Applied Physics, 2016, 16(6): 665-672. DOI:10.1016/j.cap.2016.03.019 |
| [24] |
POHLMANN S, RAMIREZ-CASTRO C, BALDUCCI A. The influence of conductive salt ion selection on EDLC electrolyte characteristics and carbon-electrolyte interaction[J]. Journal of the Electrochemical Society, 2015, 162(5): A5020-A5030. DOI:10.1149/2.0041505jes |
| [25] |
URITA K, URITA C, FUJITA K, et al. The ideal porous structure of EDLC carbon electrodes with extremely high capacitance[J]. Nanoscale, 2017, 9(40): 15643-15649. DOI:10.1039/C7NR05307J |
| [26] |
CONWAY B E. Electrochemical supercapacitors:scientific fundamentals and technological applications[M]. New York: Kluwer Acadamicl/Plenum Publisher, 1999.
|
| [27] |
HSU Y H, LAI C C, HO C L, et al. Preparation of interconnected carbon nanofibers as electrodes for supercapacitors[J]. Electrochimica Acta, 2014, 12(7): 369-376. |
| [28] |
FRACKOWIAK E, GAUTIER S, GAUCHER H, et al. Electrochemical storage of lithium in multiwalled carbon nanotubes[J]. Carbon, 1999, 37(1): 61-69. |
| [29] |
FRACKOWIAK E, DELPEUX S, JUREWICZ K, et al. Enhanced capacitance of carbon nanotubes through chemical activation[J]. Chemical Physics Letters, 2002, 361(1): 35-41. |
| [30] |
FUTABA D N, HATA K, YAMADA T, et al. Shape-engineerable and highly densely packed single-walled carbon nanotubes and their application as super-capacitor electrodes[J]. Nature Materials, 2006, 5(12): 987-994. DOI:10.1038/nmat1782 |
| [31] |
CHANG L, STACCHIOLA D J, HU Y H. An ideal electrode material, 3D surface-microporous graphene for supercapacitors with ultrahigh areal capacitance[J]. ACS Appl Mater Interfaces, 2017, 9(29): 24655-24661. DOI:10.1021/acsami.7b07381 |
| [32] |
YAN J, REN C E, MALESKI K, et al. Flexible MXene/graphene films for ultrafast supercapacitors with outstanding volumetric capacitance[J]. Advanced Functional Materials, 2017, 27(30): 1701264. DOI:10.1002/adfm.201701264 |
| [33] |
YANG X, WU D, CHEN X, et al. Nitrogen-enriched nanocarbons with a 3-D continuous mesopore structure from polyacrylonitrile for supercapacitor application[J]. Journal of Physical Chemistry:C, 2010, 114(18): 8581-8586. DOI:10.1021/jp101255d |
| [34] |
GOPALAKRISHNAN M, SRIKESH G, MOHAN A, et al. In situ synthesis of Co3O4/graphite nanocomposite for high-performance supercapacitor electrode applications[J]. Applied Surface Science, 2017, 40(3): 578-583. |
| [35] |
ZHENG J P, CYGAN P J, JOW T R. Hydrous ruthenium oxide as an electrode material for electrochemical capacitors[J]. Journal of the Electrochemical Society, 1995, 142(8): 2699-2703. DOI:10.1149/1.2050077 |
| [36] |
KRAUSE P P T, CAMUKA H, LEICHTWEISS T, et al. Temperature-induced transformation of electrochemically formed hydrous RuO2 layers over Ru(0001) model electrodes[J]. Nanoscale, 2016, 8(29): 13944-13953. DOI:10.1039/C6NR00732E |
| [37] |
MAJUMDAR D. An overview on ruthenium oxide composites-challenging material for energy storage applications[J]. Material Science Research India, 2018, 15(1): 30-40. |
| [38] |
MAJUMDAR D, MAIYALAGAN T, JIANG Z. Recent progress in ruthenium oxide-based composites for supercapacitor applications[J]. Chem Electro Chem, 2019, 6(17): 4343-4372. |
| [39] |
LEE H Y, GOODENOUGH J B. Supercapacitor behavior with KCl electrolyte[J]. Journal of Solid State Chemistry, 1999, 144(1): 220-223. DOI:10.1006/jssc.1998.8128 |
| [40] |
ZHU Q, LIU K, ZHOU J, et al. Design of a unique 3D-nanostructure to make MnO2 work as supercapacitor material in acid environment[J]. Chemical Engineering Journal, 2017, 321: 554-563. DOI:10.1016/j.cej.2017.03.147 |
| [41] |
YU N, YIN H, ZHANG W, et al. High-performance fiber-shaped all-solid-state asymmetric supercapacitors based on ultrathin MnO2 nanosheet/carbon fiber cathodes for wearable electronics[J]. Advanced Energy Materials, 2016, 6(2): 1-9. |
| [42] |
GUO W, YU C, LI S, et al. Strategies and insights towards the intrinsic capacitive properties of MnO2 for supercapacitors:challenges and perspectives[J]. Nano Energy, 2019, 57: 459-472. DOI:10.1016/j.nanoen.2018.12.015 |
| [43] |
DONG L, LIANG G, XU C, et al. Stacking up layers of polyaniline/carbon nanotube networks inside papers as highly flexible electrodes with large areal capacitance and superior rate capability[J]. Journal of Materials Chemistry:A, 2017, 5(37): 19934-19942. DOI:10.1039/C7TA06135H |
| [44] |
MA Y, HOU C, ZHANG H, et al. Morphology-dependent electrochemical supercapacitors in multi-dimensional polyaniline nanostructures[J]. Journal of Materials Chemistry:A, 2017, 5(27): 14041-14052. DOI:10.1039/C7TA03279J |
| [45] |
ZANG L, LIU Q, QIU J, et al. Design and fabrication of an all-solid-state polymer supercapacitor with highly mechanical flexibility based on polypyrrole hydrogel[J]. ACS Appl Mater Interfaces, 2017, 9(39): 33941-33947. DOI:10.1021/acsami.7b10321 |
| [46] |
HERRMANN S, AYDEMIR N, NÄGELE F, et al. Enhanced capacitive energy storage in polyoxometalate-doped polypyrrole[J]. Advanced Functional Materials, 2017, 27(25): 1700881. DOI:10.1002/adfm.201700881 |
| [47] |
AMBADE R B, AMBADE S B, SHRESTHA N K, et al. Controlled growth of polythiophene nanofibers in TiO2 nanotube arrays for supercapacitor applications[J]. Journal of Materials Chemistry:A, 2017, 5(1): 172-180. |
| [48] |
YI Z, BETTINI L G, TOMASELLO G, et al. Flexible conducting polymer transistors with supercapacitor function[J]. Journal of Polymer Science Part B, 2017, 55(1): 96-103. DOI:10.1002/polb.24244 |
| [49] |
YU M, LIN D, FENG H, et al. Boosting the energy density of carbon-based aqueous supercapacitors by optimizing the surface charge[J]. Angewandte Chemie International Edition, 2017, 56(20): 5454-5459. DOI:10.1002/anie.201701737 |
| [50] |
NAOI K. 'Nanohybrid capacitor':the next generation electrochemical capacitors[J]. Fuel Cells, 2010, 10(5): 825-833. DOI:10.1002/fuce.201000041 |
| [51] |
UE M. Mobility and ionic association of lithium and quaternary ammonium salts in propylene carbonate and γ-butyrolactone[J]. Journal of the Electrochemical Society, 1994, 141(12): 3336-3342. DOI:10.1149/1.2059336 |
| [52] |
XU K, DING M S, JOW T R. Quaternary onium salts as nonaqueous electrolytes for electrochemical capacitors[J]. Journal of the Electrochemical Society, 2001, 148(3): A267-A274. |
| [53] |
ISHIMOTO S, ASAKAWA Y, SHINYA M, et al. Degradation responses of activated-carbon-based EDLCs for higher voltage operation and their factors[J]. Journal of the Electrochemical Society, 2009, 156(7): A563. DOI:10.1149/1.3126423 |
| [54] |
MASTRAGOSTINO M, SOAVI F. Strategies for high-performance supercapacitors for HEV[J]. Journal of Power Sources, 2007, 174(1): 89-93. |
| [55] |
WEINGARTH D, NOH H, FOELSKE-SCHMITZ A, et al. A reliable determination method of stability limits for electrochemical double layer capacitors[J]. Electrochimica Acta, 2013, 103: 119-124. DOI:10.1016/j.electacta.2013.04.057 |
| [56] |
NANBU N, EBINA T, UNO H, et al. Physical and electrochemical properties of quaternary ammonium bis(oxalato)borates and their application to electric double-layer capacitors[J]. Electrochimica Acta, 2006, 52(4): 1763-1770. DOI:10.1016/j.electacta.2006.03.105 |
| [57] |
ZHENG J P, HUANG J, JOW T R. The limitations of energy density for electrochemical capacitors[J]. Journal of the Electrochemical Society, 1997, 144(6): 2026-2031. DOI:10.1149/1.1837738 |
| [58] |
NOKED M, AVRAHAM E, BOHADANA Y, et al. Development of anion stereoselective, activated carbon molecular sieve electrodes prepared by chemical vapor deposition[J]. Journal of Physical Chemistry:C, 2009, 113(17): 7316-7321. DOI:10.1021/jp811283b |
| [59] |
LI X, WANG Z, GUO L, et al. Manganese oxide/hierarchical porous carbon nanocomposite from oily sludge for high-performance asymmetric supercapacitors[J]. Electrochimica Acta, 2018, 265: 71-77. DOI:10.1016/j.electacta.2018.01.156 |
| [60] |
LI Y, YU N, YAN P, et al. Fabrication of manganese dioxide nanoplates anchoring on biomass-derived cross-linked carbon nanosheets for high-performance asymmetric supercapacitors[J]. Journal of Power Sources, 2015, 300: 309-317. DOI:10.1016/j.jpowsour.2015.09.077 |
| [61] |
AHUJA P, UJJAIN S K, KANOJIA R. Electrochemical behaviour of manganese & ruthenium mixed oxide@reduced graphene oxide nanoribbon composite in symmetric and asymmetric supercapacitor[J]. Applied Surface Science, 2018, 427: 102-111. DOI:10.1016/j.apsusc.2017.08.028 |
| [62] |
TIAN J, CUI C, XIE Q, et al. EMIMBF4-GBL binary electrolyte working at -70℃ and 3.7 V for a high performance graphene-based capacitor[J]. Journal of Materials Chemistry:A, 2018, 6(8): 3593-3601. DOI:10.1039/C7TA10474J |
| [63] |
SCHÜTTER C, HUSCH T, KORTH M, et al. Toward new solvents for EDLCs:from computational screening to electrochemical validation[J]. Journal of Physical Chemistry:C, 2015, 119(24): 13413-13424. DOI:10.1021/acs.jpcc.5b02113 |
| [64] |
CHAE J H, CHEN G Z. 1.9V aqueous carbon-carbon supercapacitors with unequal electrode capacitances[J]. Electrochimica Acta, 2012, 86: 248-254. DOI:10.1016/j.electacta.2012.07.033 |
| [65] |
LAZZARI M, SOAVI F, MASTRAGOSTINO M. High voltage, asymmetric EDLCs based on xerogel carbon and hydrophobic IL electrolytes[J]. Journal of Power Sources, 2008, 178(1): 490-496. DOI:10.1016/j.jpowsour.2007.12.029 |
| [66] |
CERICOLA D, KÖTZ R, WOKAUN A. Effect of electrode mass ratio on aging of activated carbon based supercapacitors utilizing organic electrolytes[J]. Journal of Power Sources, 2011, 196(6): 3114-3118. DOI:10.1016/j.jpowsour.2010.11.157 |
| [67] |
BRANDT A, ISKEN P, LEX-BALDUCCI A, et al. Adiponitrile-based electrochemical double layer capacitor[J]. Journal of Power Sources, 2012, 204: 213-219. DOI:10.1016/j.jpowsour.2011.12.025 |
| [68] |
ZHENG J P. High energy density electrochemical capacitors without consumption of electrolyte[J]. Journal of the Electrochemical Society, 2009, 156(7): A500. DOI:10.1149/1.3121564 |
 2020, Vol. 48
2020, Vol. 48