文章信息
- 杜春燕, 赵晖, 赵海涛
- DU Chun-yan, ZHAO Hui, ZHAO Hai-tao
- 纯钛表面载银微弧氧化陶瓷膜的制备及性能
- Preparation and properties of Ag-carrying micro-arc oxidation ceramic film on pure titanium surface
- 材料工程, 2020, 48(8): 157-162
- Journal of Materials Engineering, 2020, 48(8): 157-162.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.000214
-
文章历史
- 收稿日期: 2019-03-10
- 修订日期: 2020-03-23
生物医用钛及钛合金以其良好的生物相容性、机加工性能、高比强度及弹性模量低等优点,成为种植体、关节假体和手术器械等医用器械的首选材料[1-2]。钛合金表面虽具有一层自然生成的有一定耐蚀性的氧化层,但在人体生理腐蚀环境中,纳米级厚度的氧化膜极易受力剥落,使得钛及钛合金在人体环境中耐腐蚀性能显著下降,不仅会导致有害物质进入人体,产生直接或间接的有害影响,还会造成种植体力学性能降低,出现过早断裂等失效行为[3]。同时,钛本身没有抗菌能力,钛表面细菌感染成为阻碍其临床应用的主要问题。因而,寻找有效的方法赋予钛植入体表面抗菌能力或形成抗菌层,对于防止细菌在钛植入体上附着感染和确保临床成功至关重要。研究发现,赋予植入体表面抗菌性能或形成抗菌层可通过钛合金表面处理得到。提高医用钛表面抗菌性的方式主要有两种:一是在钛植入体表面涂层装载庆大霉素和万古霉素等抗菌药物[4]。李宝娥[5]获得的含庆大霉素的硅灰石涂层对金黄色葡萄球菌表现出良好的杀菌性。Stigter等[6]在钛基微弧氧化陶瓷层中添加一定量的庆大霉素,该陶瓷层对金黄色葡萄球菌和大肠杆菌都展现出良好的杀菌作用,且无明显的细胞毒性。二是涂层上负载具有抗菌效果的有机或无机抗菌剂,如双氯苯环胍己烷、银、锌和铜等。微弧氧化(micro-arc oxidation,MAO),是一种工艺简单、高效、绿色环保的新型表面处理技术[7]。微弧氧化制备的多孔膜层,由于多通孔及半通孔的存在,虽然可以在初期有助于细胞的长入与组织的嵌合,但同时其多孔结构也为细菌的滋生提供了温床。因此,将微弧氧化陶瓷膜与抗菌剂结合可将两者的优点更好发挥。报道称,在钛基微弧氧化陶瓷层中加载双氯苯环胍己烷有机抗菌剂,取得良好的抗菌效果,研究表明,还可以通过控制陶瓷层微观结构控制双氯苯环胍己烷释放量[8-9]。科研人员对微弧氧化沉积Cu-TiO2膜的抗菌性和耐蚀性进行了研究,发现Cu-TiO2涂层具有良好的抗菌活性,随着膜层中Cu浓度的增加,抗菌率逐渐升高[10-13]。Zhang等[14]利用微氧化技术在钛表面制备了一种具有较好耐蚀性的Zn沉积TiO2抗菌涂层。Fu等[15]在表面粗糙的生物医学NiTi合金上制备含Ag的TiO2膜,结果表明,Ag的掺杂降低了接触角,提高了NiTi样品的表面亲水性。Ag一直被认为是一种有效的抗菌材料,并且对细胞具有低毒性[16-19],就安全性和抗菌性综合考虑,各种具有抗菌功能的金属离子中,银离子是较佳的抗菌金属离子。Song等[20]尝试将含银溶液加入到微弧氧化电解液中,但容易导致电解液导电率过大,增大电流强度,使电解液温度过高,反应剧烈,并明显影响膜层质量。同时,电解液成分的改变使许多因素处于不可控状态,难以确保某一种或几种元素选择性地进入膜层。因此,需要变换研究思路,预先制备微弧氧化陶瓷膜,再采用一定工艺方法将Ag引入膜层中。
本工作将微弧氧化和水热法相结合,在纯钛表面制备具有一定厚度且均匀的微弧氧化陶瓷膜层,再将硝酸银溶液作为水热处理溶液,在水热反应釜中制备了载银微弧氧化陶瓷膜层,并对微弧氧化陶瓷膜层的表面形貌、相组成、化学成分、亲水性、耐蚀性和抗菌性进行了分析。
1 实验 1.1 膜层制备实验材料采用尺寸为25 mm×25 mm×1 mm的纯钛TA2,化学成分(质量分数/%,下同)为Fe 0.3,Si 0.15,余量为Ti。先后用400#,600#,800#,1000#,1200#砂纸打磨,并用丙酮超声清洗,蒸馏水清洗、干燥。微弧氧化处理采用WHD-30型多功能微弧氧化设备。采用先恒流后恒压双向模式制备微弧氧化陶瓷膜,即先在恒流模式下,将正向电流由1 A逐渐调节至10 A,负向电流由1 A调节至4 A,待正向电压升高至520 V改为恒压模式,恒压模式下正向电压为520 V,负向电压为-90 V,占空比为30%,处理时间为15 min。电解液为NaH2PO4 0.1 mol/L,NaOH 0.05 mol/L,钛作为阳极,不锈钢作为阴极。
经过微弧氧化处理后的试样,采用水热处理制备得到载银微弧氧化陶瓷膜层。使用硝酸银溶液作为水热处理溶液,实验在水热反应釜中进行,反应釜是以聚四氟乙烯为内衬,釜体材料为不锈钢的高压釜。配制20 mmol/L的硝酸银溶液作为反应介质,将试样浸入溶液中,水热处理温度为200 ℃,处理时间为12 h。水热处理完成后,用去离子水清洗并干燥。
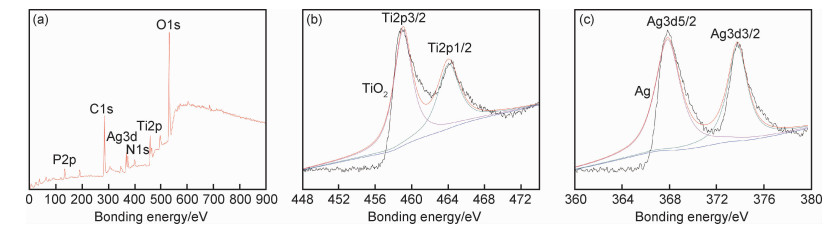
1.2 表征与性能测试采用配有能谱仪(EDS)的S-3400N型扫描电子显微镜表征膜层的表面形貌及元素组成;利用Ultima IV型掠射角X射线衍射(XRD)对膜层进行物相分析;通过具有单色Al-Kα辐射的Thermo X射线光电子能谱(XPS)鉴定元素的化学状态;通过液滴法测试钛表面的亲水性,测试在室温下进行,在HARKE-SPCA接触角分析仪上测量,液体采用去离子水,用摄像模式表征液体在试样表面的润湿性,每组试样选3个不同的位置测试接触角,并取平均值;使用Chi660e电化学工作站测试膜层的耐腐蚀性能,测试选用标准三电极体系,即待测样品作为工作电极,铂片作为辅助电极,饱和甘汞作为参比电极。测试在室温下进行,腐蚀溶液选用模拟人工体液(simulated body fluid,SBF)。选用ATCC 8739大肠杆菌用作实验菌株进行抗菌实验,配置相应的菌液,取0.4 mL的实验菌液滴到每个试样片上,每组选择3个平行样品,检测在37 ℃培养24 h后的活细胞数,通过式(1)计算样品的抗菌率[21]。
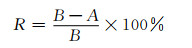
|
(1) |
式中:R为抗菌率;A为24 h培养后的样品上的菌落数;B为接种于样品表面的初始菌落数。
2 结果及分析 2.1 涂层的表面形貌与元素分析图 1为微弧氧化处理所得的微弧氧化陶瓷膜层及水热处理后得到的载银微弧氧化陶瓷膜层的SEM图。对比可知,水热处理后得到的膜层表面形貌以传统微弧氧化火山状多孔结构为主,且膜层的孔径及孔隙率与微弧氧化陶瓷膜相比,变化不大。放大倍数观察(图 1(b)),发现微弧氧化微孔周围及微孔里均有纳米级的颗粒存在。对膜层表面进行EDS分析(图 2),可知微弧氧化陶瓷膜元素主要有Ti,P和O,其中Ti元素来源于钛基体,O元素和P元素来源于电解液(图 2(a))。水热处理得到的微弧氧化陶瓷膜的元素主要有Ti,O,P和Ag等,其中Ti元素来源于钛基体,O,P和Ag来源于电解液,Ag的存在是由于水热处理过程中,AgNO3受热分解为Ag沉积在微弧氧化膜上。由EDS分析可知,经过水热处理后,得到的膜层表面的颗粒是纳米Ag颗粒,且Ag的存在并没有对膜层表面形貌造成明显影响,对膜层基体结构没有造成破坏,在保持膜层原有形貌的同时,Ag以纳米尺寸的颗粒嵌入在微弧氧化陶瓷膜表面。

|
图 1 微弧氧化陶瓷膜(a)与载银微弧氧化陶瓷膜(b)的表面形貌 Fig. 1 Surface morphologies of micro-arc oxidation ceramic film(a) and Ag-carrying micro-arc oxidation ceramic film(b) |
|
图 2 膜层元素分析 (a)微弧氧化陶瓷膜;(b)载银微弧氧化陶瓷膜 Fig. 2 Analysis of membrane elements (a)MAO ceramic film; (b)Ag-carrying micro-arc oxidation ceramic film |
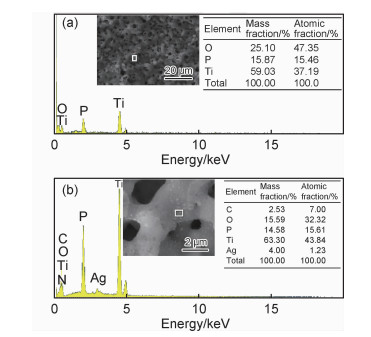
图 3为纯钛,微弧氧化陶瓷膜及载银微弧氧化陶瓷膜的XRD谱图。微弧氧化陶瓷膜表面钛的主要存在形式是钛和二氧化钛,经过水热处理后得到的膜层表面除了钛及TiO2衍射峰外,出现了新的衍射峰,分析可知为Ag的衍射峰,未见Ag化合物衍射峰的存在。因此,经水热处理后得到的膜层出现了新相Ag,且以单质的形式存在。
|
图 3 膜层的XRD谱图 Fig. 3 X-ray diffraction patterns of the films |
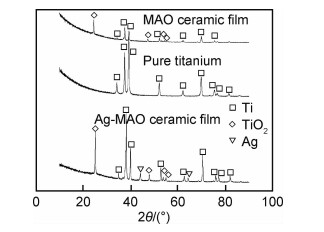
图 4为载银微弧氧化陶瓷膜的XPS全谱图和Ti2p,Ag3d的XPS谱图。由图 4(a)可以看出,膜层表面的主要成分为Ti,O,P和Ag,与图 2(b)的EDS能谱结果一致。图 4(b)和图 4(c)分别为Ti和Ag的光谱图。Ti的2p谱图中,位于458.5 eV和464.35 eV处的峰对应着Ti4+的Ti2p3/2和Ti2p1/2的结合能,即TiO2中的Ti4+。在Ag的3d谱图中,位于367.85 eV和373.75 eV处的峰对应于Ag的Ag3d5/2和Ag3d3/2的结合能,即单质Ag,这与XRD分析结果相同。
|
图 4 载银微弧氧化陶瓷膜的XPS全谱图(a)和Ti2p(b),Ag3d(c)谱图 Fig. 4 XPS survey of Ag-carrying micro-arc oxidation ceramic film(a) and XPS spectra of Ti2p(b), Ag3d(c) |
生物医用金属材料植入人体后,其表面首先与组织液、血液等相互接触,因此研究其表面的亲水性十分必要。接触角能够反映样品表面的亲水能力。表 1为纯钛基体,微弧氧化膜及载银微弧氧化膜的接触角测试结果,每组试样取3个点进行测试,取平均值。图 5为各组试样编号为1的点的接触角测试图片。由表 1可知,纯钛基体的接触角为79.0°,MAO膜层的接触角为57.0°,较纯钛提高了27.8%,说明微弧氧化处理后钛表面的亲水性得到提高。这是因为接触角与材料的表面能有关,表面能越高越容易被润湿,材料表面粗糙度及表面物相的变化,都能引起表面能改变。微弧氧化陶瓷膜为多孔陶瓷膜,使得材料表面自由能增加,从而接触角减小;根据Borgs等[22]对润湿性的研究,接触角在90°以下时,材料表面粗糙度越大,接触角越小,陶瓷膜层增加了表面粗糙度,提高了亲水性;同时,结合XRD谱图中有TiO2衍射峰,TiO2易于与水中的H+结合形成Ti—OH基团,基团表面特殊的化学性质,能增大钛表面的润湿性,使接触角降低。因此,微弧氧化陶瓷膜有利于亲水性的提高。载银MAO膜层的接触角约为18.1°,较纯钛提高了77.0%,较微弧氧化提高了68.2%,银的引入明显提高了亲水性。这是因为银沉积在膜层表面,使膜层表面粗糙度进一步增大,表面能也增加,使得接触角进一步减小,从而提高了亲水性。
| Sample | Contact angle/(°) | |||
| Point 1 | Point 2 | Point 3 | Average | |
| Pure titanium | 79.2 | 79.1 | 78.8 | 79.0 |
| MAO ceramic film | 57.7 | 57.1 | 56.2 | 57.0 |
| Ag-MAO ceramic film | 18.8 | 18.8 | 16.8 | 18.1 |

|
图 5 各样品编号为1的点的表面接触角照片 (a)纯钛;(b)微弧氧化陶瓷膜;(c)载银微弧氧化陶瓷膜 Fig. 5 Contact angle photos of the point 1 on each sample surface (a)pure titanium; (b)MAO ceramic film; (c)Ag-carrying micro-arc oxidation ceramic film |
图 6为纯钛基体、MAO膜层及载银MAO膜层在SBF中的动电位极化曲线。通过塔菲尔外推法对样品的极化曲线进行拟合,得到自腐蚀电位(Ecorr)及自腐蚀电流密度(Icorr)。纯钛腐蚀电位为-0.71 V,微弧氧化腐蚀电位为-0.58 V,水热镀银的微弧氧化膜腐蚀电位为-0.27 V,自腐蚀电位正移,说明载银微弧氧化膜的化学稳定性较好,腐蚀倾向性小。纯钛腐蚀电流密度为1.341×10-6 A/cm2,微弧氧化试件腐蚀电流密度为9.698×10-7 A/cm2,水热镀银后膜层的腐蚀电流密度为6.245×10-6 A/cm2。微弧氧化后的腐蚀电流密度减小,但减小不明显,水热镀银后膜层腐蚀电流密度反而增大,与基体的腐蚀电流在一个数量级,腐蚀速率较微弧氧化和基体大。微弧氧化陶瓷膜和水热镀银的微弧氧化膜在模拟体液中有好的耐腐蚀性,主要原因是表面形成的耐蚀氧化物陶瓷膜。
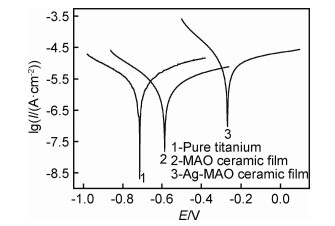
|
图 6 膜层极化曲线 Fig. 6 Polarization curves of the films |
表 2为纯钛空白样品,MAO样品,载银微弧氧化样品大肠杆菌菌落数和抗菌率。纯钛对照样品的抗菌率为0,MAO样品的抗菌率为32.2%,载银微弧氧化样品的抗菌率接近100%,具有较高的抗菌性能。微弧氧化试样具有一定抗菌率,主要是因为膜层存在结晶锐钛矿型TiO2,可以减少细菌对样品的黏附,从而降低细菌数量[23]。Ag是影响膜层抗菌性的主要因素,载银的微弧氧化陶瓷膜中Ag颗粒释放出Ag+,细菌的带负电的细胞蛋白吸引带正电荷的Ag+,Ag+攻击细菌的细胞壁和细胞膜,进入细胞内,并与细胞体内蛋白酶上的—SH发生反应,使蛋白酶固化,从而丧失活性,遗传物质被破坏,细菌因失去呼吸和分裂的能力而死亡。杀死细菌后,Ag+从细菌中释放出来,并与其他细菌接触,进行反复灭菌,达到持久的杀菌效果[24-26]。
| Sample | Colony number/cfu | Antibacterial rate/% |
| Pure titanium | 2.14×107 | 0 |
| MAO ceramic film | 1.45×107 | 32.2 |
| Ag-carrying MAO ceramic film | <10 | >99.9 |
(1) 采用两步法将微弧氧化与水热处理相结合,制备了载银微弧氧化陶瓷膜层,其表面形貌与传统的微弧氧化陶瓷膜一样,为火山多孔结构,且膜层的孔径及孔隙率与微弧氧化陶瓷膜相比,变化不大,微孔周围均匀分布着纳米级Ag颗粒。载银微弧氧化膜的表面主要为TiO2和纳米Ag颗粒。
(2) 银的引入,明显提高了膜层的亲水性。与纯钛及微弧氧化处理后的膜层相比,载银微弧氧化陶瓷膜的亲水性分别提高了77.0%和68.2%。
(3) 载银微弧氧化陶瓷膜自腐蚀电位较纯钛及微弧氧化陶瓷膜分别提高了0.44 V和0.31 V,腐蚀倾向性更小。载银微弧氧化陶瓷膜的腐蚀电流密度与纯钛基体在一个数量级,较纯钛及微弧氧化陶瓷膜有一定增大。
(4) 载银微弧氧化陶瓷膜的菌落数最少,微弧氧化膜的抗菌率为32.2%,载银微弧氧化膜的抗菌率大于99.9%,即载银微弧氧化膜的抗菌率最高,因此具有优异的抗菌性。
| [1] |
LONG M, RACK H J. Titanium alloys in total joint replacement-a materials science perspective[J]. Biomaterials, 1998, 19(18): 1621-1639. |
| [2] |
BLOYCE P A, QI P Y, DONG H, et al. Surface modification of titanium alloys for combined improvements in corrosion and wear resistance[J]. Surface and Coating Technology, 1998, 107(2/3): 125-132. |
| [3] |
BARRI S, MISCHLER S, LADOLT D. Electrochemical effects on the fretting corrosion behaviour of Ti6Al4V in 0.9% sodium chloride solution[J]. Wear, 2005, 259(1): 282-291. |
| [4] |
王烨, 阚全程, 余祖江. 慢性病毒性肝炎患者抗生素应用的最新进展[J]. 河南医学研究, 2011, 20(2): 250-253. WANG Y, KAN Q C, YU Z J. The recent advances in the application of antibiotic for patients with chronic virus hepatitis[J]. Henan Medical Research, 2011, 20(2): 250-253. |
| [5] |
李宝娥.表面抗菌生物活性涂层的制备和表征[D].上海: 中国科学院上海硅酸盐研究所, 2008. LI B E. Preparation and characterization of surface antibacterial bioactive coating[D]. Shanghai: Shanghai Institute of Silicate, Chinese Academy of Sciences, 2008. |
| [6] |
STIGTER M, BEZEMER J, DEGROOT K, et al. Incorporation of different antibiotics into carbonated hydroxyapatite coatings on titanium implants, release and antibiotic efficacy[J]. Journal of Controlled Release, 2004, 99(1): 127-137. |
| [7] |
宋仁国. 微弧氧化技术的发展及其应用[J]. 材料工程, 2019, 47(3): 50-62. SONG R G. Development and applications of micro-arc oxidation technology[J]. Journal of Materials Engineering, 2019, 47(3): 50-62. |
| [8] |
KOZLOVSKY A, ARTZI Z, MOSES O, et al. Interaction of chlorhexidine with smooth and rough types of titanium surfaces[J]. Journal of Periodontology, 2006, 77(7): 1194-1200. |
| [9] |
BARBOUR M E, O'SULLIVAN D J, JAGGER D C. Chlorhexidine adsorption to anatase and rutile titanium dioxide[J]. Colloids & Surfaces a Physicochemical & Engineering Aspects, 2007, 307(1): 116-120. |
| [10] |
WU H B, ZHANG X Y, GENG Z H, et al. Preparation, antibacterial effects and corrosion resistant of porous Cu-TiO2 coatings[J]. Applied Surface Science, 2014, 308(20): 43-49. |
| [11] |
BAGHRICHE O, RTIMI S, PULGARIN C, et al. Innovative TiO2/Cu nano surfaces inactivating bacteria in the minute range under low-intensity actinic light[J]. ACS Applied Materials & Interfaces, 2012, 4(10): 5234-5240. |
| [12] |
WU H B. Preparation and properties research of Cu-bearing anti-bacterial coatings on titanium[J]. Taiyuan:Taiyuan University of Technology, 2015. |
| [13] |
YAO X, ZHANG X, WU H, et al. Microstructure and antibacterial properties of Cu-doped TiO2 coating on titanium by micro-arc oxidation[J]. Applied Surface Science, 2014, 292(1): 944-947. |
| [14] |
ZHANG X, WANG H, LI J, et al. Corrosion behavior of Zn-incorporated antibacterial TiO2 porous coating on titanium[J]. Ceramics International, 2016, 42(15): 17095-17100. |
| [15] |
FU T, SHEN Y, ALAJMI Z, et al. Sol-gel derived Ag-containing TiO2 films on surface roughened biomedical NiTi alloy[J]. Ceramics International, 2014, 40(8): 12423-12429. |
| [16] |
YU B, LEUNG K M, GUO Q, et al. Synthesis of Ag-TiO2 composite nano thin film for antimicrobial application[J]. Nanotechnology, 2011, 22(11): 115603. |
| [17] |
YETIM T. Corrosion behavior of Ag-doped TiO2 coatings on commercially pure titanium in simulated body fluid solution[J]. Journal of Bionic Engineering, 2016, 13(3): 397-405. |
| [18] |
PISZCZEK P, MUCHEWICZ Z, RADTKE A, et al. CVD of TiO2 and TiO2/Ag antimicrobial layers:deposition from the hexanuclear μ-oxo Ti(Ⅳ)complex as a precursor, and the characterization[J]. Surface & Coatings Technology, 2013, 222(6): 38-43. |
| [19] |
HOU X G, MA H Y, LIU F, et al. Synthesis of Ag ion-implanted TiO2 thin films for antibacterial application and photocataly-tic performance[J]. Journal of Hazardous Materials, 2015, 299(15): 59-66. |
| [20] |
SONG W H, RYU H S, HONG S H. Antibacterial properties of Ag(or Pt)-containing calcium phosphate coatings formed by micro-arc oxidation[J]. Journal of Biomedical Materials Research:A, 2008, 88: 242-246. |
| [21] |
夏金兰, 王春, 刘新星. 抗菌剂及抗菌机理[J]. 中南大学学报(自然科学版), 2004, 35(1): 31-38. XIA J L, WANG C, LIU X X. Research on antimicrobial agents and their mechanisms of actions[J]. J Cent South Univ(Science and Technology), 2004, 35(1): 31-38. |
| [22] |
BORGS C, DE C J, KOTECKY R, et al. Does the roughness of the substrate enhance wetting[J]. Physical Review Letters, 1995, 74(12): 2292. |
| [23] |
GIORDANO C, VISAI L, PEDEFERRI M P, et al. Antibacterial treatments on titanium for implantology[J]. Biomedicine & Pharmacotherapy, 2006, 60(8): 472. |
| [24] |
刘焕亮, 王慧杰, 袭著. 纳米银的抗菌原理及生物安全性研究进展[J]. 环境与健康杂志, 2009, 26(8): 736-739. LIU H L, WANG H J, XI Z. Progress in research on antibacterial mechanism and biological safety of silver nanoparticles[J]. Journal of Environment and Health, 2009, 26(8): 736-739. |
| [25] |
SHRIVASTAVA S, BERA T, ROY A, et al. Characterization of enhanced antibacterial effects of novel silver nanoparticles[J]. Nanotechnology, 2007, 18(22): 8131-8136. |
| [26] |
YAMANAKA M, HARA K, KUDO J, et al. Bactericidal actions of a silver ion solution on Escherichia coli, studied by energy-filtering transmission electron microscopy and proteomic analysis[J]. Applied and Environmental Microbiology, 2005, 71(11): 7589-7593. |
 2020, Vol. 48
2020, Vol. 48


