文章信息
- 王楠, 齐新, 彭思侃, 陈翔, 王晨, 戴圣龙, 燕绍九
- WANG Nan, QI Xin, PENG Si-kan, CHEN Xiang, WANG Chen, DAI Sheng-long, YAN Shao-jiu
- Mn2O3/Fe2O3/少层石墨烯/硫锂硫电池正极材料的制备及其电化学性能
- Synthesis and electrochemical performance of Mn2O3/Fe2O3/few layers graphene/ sulfur cathode for lithium-sulfur batteries
- 材料工程, 2020, 48(8): 110-118
- Journal of Materials Engineering, 2020, 48(8): 110-118.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.000246
-
文章历史
- 收稿日期: 2019-03-19
- 修订日期: 2020-05-08
2. 北京石墨烯技术研究院有限公司, 北京 100094
2. Beijing Graphene Institute of Technology, Beijing 100094, China
因具有高理论比容量(1675 mAh·g-1)和高能量密度(2600 Wh·kg-1),锂硫电池作为极具前景的储能器件引起人们的高度关注[1-2]。锂硫电池在电动汽车、3C产品及其他可再生能源储存方面都极具应用前景。另外,硫作为地球储量最丰富的元素之一具有环境友好性和低廉的价格。然而,锂硫电池的实际应用受到以下两个主要因素的影响:(1)硫及其放电产物(Li2S/Li2S2)导电性差,降低了硫作为锂硫电池活性物质的利用率,同时也严重影响锂硫电池的倍率性能;(2)锂硫电池充放电过程中产生的多硫化物易溶解于电解液,从而产生穿梭效应以及Li2S/Li2S2的严重偏析,最终导致电池容量的迅速衰减[3-4]。过去的几十年里,为解决这些问题,最常见的方法是将碳材料作为硫载体。因碳材料具有高电导率和大比表面积,以碳材料作为硫载体能够提高硫的利用率,同时也能通过物理相互作用在一定程度上起到固定多硫化物的作用。至今,有多种碳材料被用作锂硫电池的硫载体,例如介孔碳[5],中空多孔碳[6],碳纳米管[7]和石墨烯[8]等。但是,由于碳材料表面是非极性的,无法对极性的多硫化物起到有效的锚固作用,导致在锂硫电池长周期循环过程中经常出现容量严重衰减现象。
最近,研究表明金属氧化物(包括TiO2[9],Ti4O7[10],MnO2[11],Mn2O3[12],Al2O3[13],Fe2O3[14],VO2[15],V2O5[16])与多硫化物之间存在强烈的化学相互作用,能够有效固定多硫化物,进而提高锂硫电池的循环稳定性。然而,由于金属氧化物多是绝缘体或半导体,其导电性远低于碳材料。锂硫电池正极材料中添加金属氧化物将降低硫的利用率,影响电池的倍率性能。一种有效的方法是将金属氧化物与高导电性的碳材料结合形成金属氧化物/碳复合材料,这种复合材料兼具高导电性和化学吸附能力。据报道,Fe2O3不仅能够与多硫化物产生强烈的相互作用,同时还能有效促进多硫化物的进一步转化,从而提高锂硫电池的循环稳定性[14]。以Fe2O3/石墨烯复合材料作为硫载体的锂硫电池展现出高倍率性能,5 C倍率下,1000次循环后,其每圈的容量衰减率仅为0.049%[14]。另外,Mn2O3作为多硫化物锚固体也被应用于锂硫电池中。研究表明,Mn2O3能有效抑制穿梭效应,0.5 C倍率下,200圈循环后,其容量保持率高达78.6%[12]。受上述研究结果启发,通过构建双金属氧化物/高导电石墨烯复合材料作为高性能锂硫电池硫载体可以提升锂硫电池电化学性能。
本工作以MnCl2-FeCl3-插层石墨(MnCl2-FeCl3-GIC)为前驱体,制备出一种Mn2O3/Fe2O3/少层石墨烯/硫(Mn2O3/Fe2O3/FLG/S)锂硫电池正极材料。对其成分、结构、孔经分布、比表面积以及电极材料的比容量、倍率性能和循环性能等电化学性能进行测试与对比,分析了材料结构对电化学性能的影响。该锂硫电池正极材料中,双金属氧化物由石墨烯层间及表面的MnCl2-FeCl3经高温氧化得到,这既使得双金属氧化物均匀分散在少层石墨烯表面,又有效防止石墨烯片的团聚,从而构成高电导率的三维导电网络。这将有利于提高锂硫电池的容量和循环稳定性。通过这种简单易行的方法制备得到的Mn2O3/Fe2O3/FLG/S复合材料可作为高性能锂硫电池的正极材料。
1 实验材料与方法 1.1 1阶MnCl2-FeCl3-GIC制备1阶MnCl2-FeCl3-GIC采用熔盐法插层反应制备。按照2:3:5的比例称取300目天然鳞片石墨、无水氯化锰和无水氯化铁,并密封于不锈钢反应釜中。将不锈钢反应釜置于马弗炉中,450 ℃加热24 h,升温速率为10 ℃/min。反应结束后,用稀盐酸洗去粉末表面的氧化物,再使用真空抽滤装置对样品进行清洗。最后,将样品置于鼓风干燥箱中,80 ℃烘干6 h得到样品。
1.2 MnCl2-FeCl3-FLG制备称取100 mg的1阶MnCl2-FeCl3-GIC,置于100 mL H2O2溶液中反应2 h,反应产物经超声振荡30 min。随后采用真空抽滤装置清洗样品。最后,将样品置于鼓风干燥箱中,80 ℃烘干6 h得到样品。
1.3 Mn2O3/Fe2O3/FLG制备称取两份相同质量的MnCl2-FeCl3-FLG置于刚玉舟中,待马弗炉温度升至500 ℃时,将刚玉舟放入炉中,分别进行30 min和60 min退火处理,得到双金属氧化物-少层石墨烯,分别标记为Mn2O3/Fe2O3/FLG30和Mn2O3/Fe2O3/FLG60。
1.4 MnCl2-FeCl3-FLG/S与Mn2O3/Fe2O3/FLG/S制备称取一定量的MnCl2-FeCl3-FLG,Mn2O3/Fe2O3/FLG30和Mn2O3/Fe2O3/FLG60,分别与升华硫按照1:3的比例混合。将混合物分别装入不锈钢反应釜中,置于鼓风干燥箱中,155 ℃加热12 h,得到MnCl2-FeCl3-FLG/S,Mn2O3/Fe2O3/FLG30/S和Mn2O3/ Fe2O3/FLG60/S样品。
1.5 材料表征扫描电镜为FEI Nova Nano SEM450,工作电压为15 kV;透射电镜为FEI Tecnai G2 F30,加速电压为100 kV,并配有高分辨附件;X射线衍射仪为Bruker D8 advance Cu Kα(30 kV, 30 mA, λ=15.406 nm);拉曼光谱仪为HORIBA LabRAM HR800;热重分析仪为NETZSCH,铝坩埚。
1.6 电极制作及组装电极制备过程如下:(1)按照8:1:1比例称取适量硫基复合材料、导电添加剂(HS 100)和黏结剂(PVDF),以适量N-甲基吡咯烷酮(NMP)为溶剂制成正极浆料,磁力搅拌,以使浆料中各物质混合均匀。(2)采用刮刀法将正极浆料均匀涂布在涂炭铝箔集流体上,随后置于红外灯下烘干,再转移至真空烘干箱中60 ℃下干燥12 h以去除正极材料中残余水分。(3)将正极片切成直径14 mm的圆片,称取极片质量。
锂硫电池组装过程如下:锂硫电池的组装在手套箱中进行,手套箱中水分含量低于10-6,氧气含量低于10-6。采用2016型纽扣电池壳,直径14 mm金属锂片及直径16 mm CelgardⓇ 2325隔膜作为电池组件。电解液成分为1.0 mol/L LiTFSI/DOL:DME(1:1)/1.0%(质量分数,下同) LiNO3。将上述组件叠加在一起,同时使用移液枪滴加适量电解液,控制电解液/硫比例保持在12 μL·mg-1左右。
1.7 电化学性能测试采用CHI1000C多通道恒电位仪对锂硫电池进行循环伏安测试。由于电解液中已添加LiNO3,电位扫描窗口选定为1.7~2.8 V,以避免循环过程中LiNO3发生分解。测试温度为25 ℃,扫描速率为0.1 mV·s-1。
纽扣电池充放电测试在CT2001A型电池测试系统上完成。测试温度为25 ℃,充放电截止电压范围为1.7~2.8 V,充放电电流根据实际需要选定。
2 结果与分析 2.1 组织结构表征图 1为少层石墨烯制备过程中各阶段产物的SEM照片及其形貌变化。天然鳞片石墨呈现完整、密实及规则的片层排列(图 1(a))。高温插层阶段(熔盐法),气态FeCl3分子扩散到石墨片层间,石墨片层间距变大,同时少量MnCl2分子也扩散到石墨片层间,得到MnCl2和FeCl3共插层石墨(MnCl2-FeCl3-GIC),石墨片层间距显著增大,更易于剥离(图 1(b))。为实现石墨片层的有效剥离,采用层间催化剥离法制备少层石墨烯(MnCl2-FeCl3-FLG)。层间催化法的原理是以FeCl3为催化剂,H2O2既作为还原剂又作为氧化剂,反应过程中持续产生的氧气通过体积膨胀实现石墨片层剥离[17]。经膨胀剥离的石墨片层间距进一步增大,导致层间范德华力大大降低(图 1(c))。经超声振荡,石墨片层间范德华力被破坏,石墨片层完全分离,得到MnCl2-FeCl3-FLG,其片径尺寸约为几个微米(图 1(d))。

|
图 1 石墨烯制备过程不同阶段产物的SEM照片 (a)天然鳞片石墨;(b)1阶MnCl2-FeCl3-GIC;(c)经层间催化剥离后的MnCl2-FeCl3-FLG;(d)进一步超声剥离后的MnCl2-FeCl3-FLG Fig. 1 SEM images of products during graphene preparation (a)natural graphite; (b)stage-1 MnCl2-FeCl3-GIC; (c)MnCl2-FeCl3-FLG by interlayer catalytic exfoliation; (d)MnCl2-FeCl3-FLG by further ultrasonication |
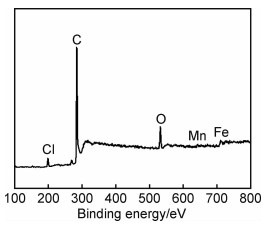
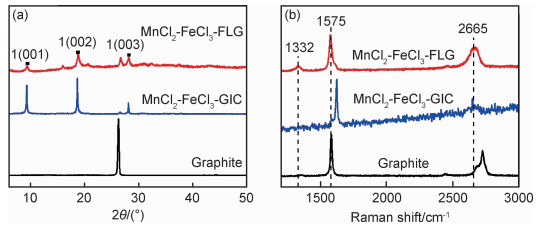
采用XPS谱图表征MnCl2-FeCl3-FLG复合材料表面存在的元素及其含量。MnCl2-FeCl3-FLG的XPS总谱表明,主要元素C,Cl,O,Mn,Fe均共存于MnCl2-FeCl3-FLG中(图 2)。其中,C1s(248.8 eV),Cl2p(198.8 eV),O1s(532.45 eV),Mn2p(641.9 eV)及Fe2p(710.9 eV)的原子分数分别为86.88%,2.81%,8.58%,0.51%及1.23%。氧元素的存在可能是制备过程中残留的氧气与碳反应引入的。为进一步研究MnCl2-FeCl3-FLG制备过程中各阶段产物的结构信息,采用XRD和Raman光谱表征材料的结构特征(图 3)。如图 3(a)所示,从天然鳞片石墨的XRD谱图中可以看出,位于26.4°的(002)峰是石墨典型的XRD特征峰,该峰在插层反应后转化为9.3°(001),18.6°(002)和28.1°(003)3个1阶MnCl2-FeCl3-GIC特征峰[18-19]。根据布拉格定律可计算出MnCl2-FeCl3-GIC中碳原子层间距由天然石墨的0.34 nm增大至0.95 nm,该结果与SEM照片中观察到的结果相一致。与石墨和1阶MnCl2-FeCl3-GIC特征峰相比,MnCl2-FeCl3-FLG的3个1阶特征峰仍然保留,位置不变,但是峰强明显减弱,说明剥离过程中MnCl2和FeCl3部分析出,但是1阶结构仍然保留。此外,在MnCl2-FeCl3-FLG的X射线衍射谱中还存在少量其他阶插层石墨的特征峰,这可能是由剥离过程中部分插层化合物MnCl2-FeCl3析出,少量石墨片之间发生堆叠造成的。
|
图 2 MnCl2-FeCl3-FLG的XPS总谱 Fig. 2 XPS survey of MnCl2-FeCl3-FLG |
|
图 3 天然鳞片石墨,1阶MnCl2-FeCl3-GIC和MnCl2-FeCl3-FLG的X射线衍射图(a)及Raman光谱(b) Fig. 3 XRD patterns(a) and Raman spectra(b) of natural graphite, stage-1 MnCl2-FeCl3-GIC and MnCl2-FeCl3-FLG |
如图 3(b)所示,3种产物的拉曼光谱中均存在微弱的D峰,说明石墨片层插层和剥离过程并没有在碳原子层表面造成大量缺陷[20-21]。根据文献[22]报道,石墨的拉曼G峰位于1575 cm-1附近。插层反应得到的1阶插层化合物中,G峰位置偏移至1622 cm-1处,G峰的偏移是由碳原子与插层化合物MnCl2-FeCl3发生电荷转移造成的[22-23]。催化剥离后,大部分插层氯化物析出,G峰位置重新回到1575 cm-1处。此外,碳材料的2D峰是由双振动拉曼散射造成的,其峰位置的变化对应石墨中碳原子层数的变化[24]。与石墨的2D峰位置相比,MnCl2-FeCl3-GIC和MnCl2-FeCl3-FLG的2D峰均向低波数方向移动,这表明插层和剥离处理后,石墨的层数在逐渐减少。
为制备Mn2O3/Fe2O3/FLG,对MnCl2-FeCl3-FLG进行退火处理,将金属氯化物转化为金属氧化物。为对比正极材料中不同氧化物含量对锂硫电池电化学性能的影响,对MnCl2-FeCl3-FLG复合材料进行30 min和60 min退火处理,分别标记为Mn2O3/Fe2O3/FLG30和Mn2O3/Fe2O3/FLG60。从不同退火处理时间下得到的Mn2O3/Fe2O3/FLG30和Mn2O3/Fe2O3/FLG60扫描照片同样可以看出,随着热处理时间的增加,复合材料中金属氧化物颗粒尺寸和占比均有所增加(图 4)。对比表 1中两种复合材料各元素的含量,可定量地分析退火时间对复合材料中金属氧化物质量分数的变化规律。退火处理过程中,由于高温氧化,部分少层石墨烯被烧蚀,片径尺寸变小。

|
图 4 不同退火处理时间的Mn2O3/Fe2O3/FLG SEM照片 (a)30 min;(b)60 min Fig. 4 SEM images of Mn2O3/Fe2O3/FLG with different annealing time (a)30 min; (b)60 min |
| Composites | C | Mn | Fe | O | S | Cl |
| Mn2O3/Fe2O3/FLG30/S | 28.64 | 1.51 | 3.32 | 6.93 | 58.16 | 1.42 |
| Mn2O3/Fe2O3/FLG60/S | 20.19 | 6.51 | 9.05 | 20.19 | 49.63 | 3.73 |
图 5为两种复合材料的透射照片,可以看出Mn2O3/Fe2O3/FLG30复合材料中金属氧化物均匀分布在少层石墨烯表面,且颗粒尺寸较小,这些特点将有利于增强金属氧化物对多硫化物的固定效果。此外,与Mn2O3/Fe2O3/FLG60复合材料相比,Mn2O3/Fe2O3/FLG30复合材料中少层石墨烯片径尺寸更大,这有利于形成三维导电网络,提高电极导电性。同时,该透射结果与前述扫描结果一致,再次证明退火时间增加,会使金属氧化物颗粒变大,石墨烯片径尺寸变小。利用Mn2O3/Fe2O3/FLG30的透射照片研究经退火处理后生成的金属氧化物状态及石墨烯的层数。如图 5(a-2)所示,石墨烯片约为4~5层,其晶格条纹间距约为0.34 nm,与石墨碳原子片层间距相一致,所得产物为少层石墨烯。进一步测量石墨烯表面的金属化合物晶格条纹间距为0.27 nm和0.368 nm,分别与Mn2O3的(222)晶面(JCPDS No. 76-0150)和Fe2O3的(012)晶面(JCPDS No. 87-1166)相一致(图 5(b-2))。结果表明,经插层、催化剥离及退火处理后所得产物为少层石墨烯片上负载双金属氧化物Mn2O3和Fe2O3的复合材料。

|
图 5 不同退火处理时间的Mn2O3/Fe2O3/FLG透射照片1-低倍;2-高倍 (a)30 min;(b)60 min Fig. 5 TEM images of Mn2O3/Fe2O3/FLG with different annealing time 1-low magnification; 2-high magnification (a)30 min; (b)60 min |
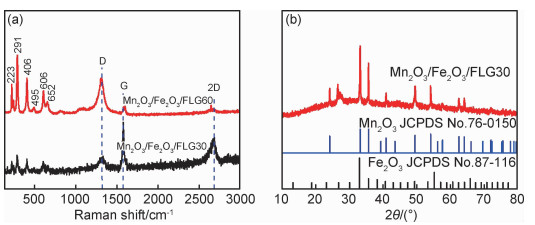
利用Raman光谱和X射线衍射谱进一步研究复合材料中少层石墨烯及双金属氧化物的结构。从图 6(a)的拉曼光谱中可以看出,100~1000 cm-1波数范围内出现的拉曼峰主要对应于双金属氧化物的振动峰。位于223,291,406,606 cm-1的拉曼峰对应于Fe2O3 [25],位于652 cm-1的拉曼峰对应于Mn2O3 [26],该结果说明双金属氧化物中Fe2O3的含量多于Mn2O3。此外,Mn2O3/Fe2O3/FLG60复合材料拉曼光谱中ID/IG=3.16远远大于复合材料Mn2O3/Fe2O3/FLG30拉曼光谱中ID/IG=0.39,这说明长时间退火处理会造成石墨烯被氧化,缺陷增多[21]。石墨烯表面缺陷增多会导致其电导率下降,从而降低电极材料的比容量。另外,图 6(b)中复合材料Mn2O3/Fe2O3/FLG30的XRD衍射峰分别与Mn2O3(JCPDS No.76-0150)和Fe2O3(JCPDS No.87-1166)的标准衍射峰相对应,印证了样品中金属氧化物Mn2O3和Fe2O3的存在。
|
图 6 Mn2O3/Fe2O3/FLG30和Mn2O3/Fe2O3/FLG60的拉曼图谱(a)及Mn2O3/Fe2O3/FLG30的X射线衍射图(b) Fig. 6 Raman spectra of Mn2O3/Fe2O3/FLG30 and Mn2O3/Fe2O3/FLG60(a) and XRD patterns of Mn2O3/Fe2O3/FLG30(b) |
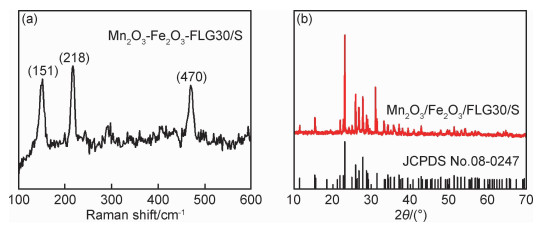
为得到Mn2O3/Fe2O3/FLG/S复合材料,采用熔化扩散法将硫颗粒与Mn2O3/Fe2O3/FLG复合。以Mn2O3/Fe2O3/FLG30/S复合材料为例表征硫在复合材料中的结构。Mn2O3/Fe2O3/FLG30/S的Raman光谱显示,位于151,218,470 cm-1的3个主峰对应于硫的拉曼峰。同时,XRD结果表明,复合材料Mn2O3/Fe2O3/FLG30/S中的硫与正交硫具有相同的结构(图 7)。采用热重分析确定Mn2O3/Fe2O3/FLG复合材料中金属氧化物的含量以及Mn2O3/Fe2O3/FLG/S复合材料中硫含量,结果显示,复合材料Mn2O3/Fe2O3/FLG30中双金属氧化物总质量分数为29.6%,而复合材料Mn2O3/Fe2O3/FLG60中双金属氧化物总质量分数为44.9%(图 8(a))。由Mn2O3/Fe2O3/FLG30/S与Mn2O3/Fe2O3/FLG60/S的TG结果可知,两种复合材料中硫含量均约为74.8%(图 8(b))。此外,利用能谱结果定性分析复合材料中金属氧化物所占质量比的变化规律。对比Mn2O3/Fe2O3/FLG30/S和Mn2O3/Fe2O3/FLG60/S两种复合材料中各元素质量分数可知,C元素质量分数降低,Mn,Fe和O元素的质量分数均有所增加,说明随着热处理时间的增加,两种金属氧化物的含量均有所增加。该结果与上述Mn2O3/Fe2O3/FLG复合材料的扫描和透射结果相互印证。
|
图 7 Mn2O3/Fe2O3/FLG30/S的拉曼图谱(a)及Mn2O3/Fe2O3/FLG30/S的X射线衍射图(b) Fig. 7 Raman spectra of Mn2O3/Fe2O3/FLG30/S(a) and XRD pattern of Mn2O3/Fe2O3/FLG30/S(b) |

|
图 8 Mn2O3/Fe2O3/FLG30,Mn2O3/Fe2O3/FLG60(a)及Mn2O3/Fe2O3/FLG30/S,Mn2O3/Fe2O3/FLG60/S(b)热重分析曲线 Fig. 8 TG curves of Mn2O3/Fe2O3/FLG30, Mn2O3/Fe2O3/FLG60(a) and Mn2O3/Fe2O3/FLG30/S, Mn2O3/Fe2O3/FLG60/S(b) |
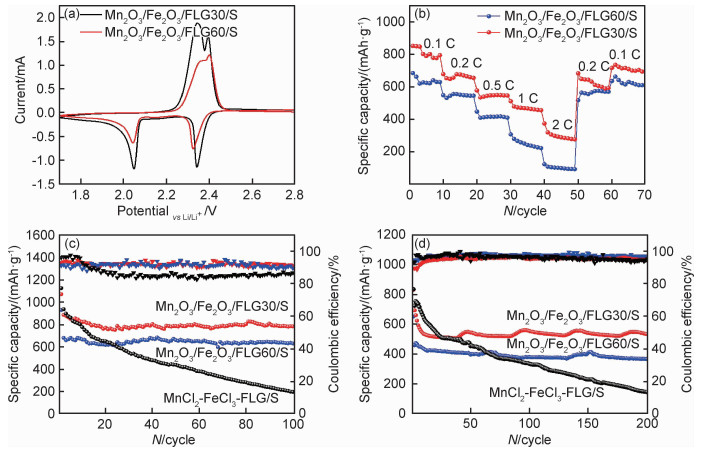
通过复合材料Mn2O3/Fe2O3/FLG30/S和Mn2O3/Fe2O3/FLG60/S的CV、倍率性能和循环性能评价两种正极材料的电化学性能。图 9(a)所示为两种电极的第1圈CV曲线,扫描速率为0.1 mV·s-1,电压范围1.7~2.8 V。从Mn2O3/Fe2O3/FLG30/S电极的CV曲线中可以观察到位于2.34 V和2.05 V附近两个典型的还原反应峰,以及位于2.35 V和2.4 V附近两个氧化反应峰。其中,2.34 V附近的还原反应峰与S8转变为高阶多硫化物(Li2Sx,x≥4)的过程对应,2.05 V附近的还原峰与高阶多硫化物进一步被还原为低阶多硫化物(Li2Sx,x≤4)或Li2S的过程对应[27]。2.35 V附近的氧化峰与多硫化物(Li2Sx,x≥2)的形成有关,2.4 V附近的氧化峰与S8的形成有关[28]。与Mn2O3/Fe2O3/FLG30/S电极的CV曲线相比,Mn2O3/Fe2O3/FLG60/S电极的CV曲线的面积变小,说明其初始容量减少。另外,还原过程所对应的峰值电压向低电压方向偏移,氧化过程对应的峰值电压向高电压方向偏移,发生电极极化。这些结果均说明,Mn2O3/Fe2O3/FLG60/S电极内部电阻增大,正极材料的电导率降低。这与氧化物含量增加以及石墨烯片径尺寸变小,未形成有效的三维导电网络,导致电极电导率下降有关。
|
图 9 MnCl2-FeCl3-FLG/S,Mn2O3/Fe2O3/FLG30/S和Mn2O3/Fe2O3/FLG60/S电极的电化学性能 (a)CV曲线;(b)倍率性能;(c)0.1 C倍率下的循环性能;(d)1 C倍率下的循环性能 Fig. 9 Electrochemical performance of MnCl2-FeCl3-FLG/S, Mn2O3/Fe2O3/FLG30/S and Mn2O3/Fe2O3/FLG60/S electrodes (a)CV curve; (b)C-rate performance; (c)cycling performance at 0.1 C rate; (d)cycling performance at 1 C rate |
通过不同倍率下的循环性能评价两个电极的倍率性能。放电倍率从0.1 C增加至2 C,再恢复至0.2 C和0.1 C,每个倍率下循环10圈(图 9(b))。对于Mn2O3/Fe2O3/FLG30/S电极,在0.1,0.2,0.5,1 C和2 C倍率下的放电比容量分别为853.5,680.1,579,480 mAh·g-1和375.6 mAh·g-1。而当放电倍率返回至0.2 C和0.1 C后,其比容量又恢复到684 mAh·g-1和717.5 mAh·g-1,这说明Mn2O3/Fe2O3/FLG30/S电极具有高导电和导离子特性,同时也具有高电化学反应速率。Mn2O3/Fe2O3/FLG30复合材料中,由于金属氧化物均匀分布在碳原子层间或表面,有利于大尺寸石墨烯之间形成高导电性的三维导电网络,从而提高电极材料电导率,获得高倍率性能。相反,对于Mn2O3/Fe2O3/FLG60/S电极,其在不同倍率下的放电比容量远低于Mn2O3/Fe2O3/FLG30/S电极的放电比容量。这与Mn2O3/Fe2O3/FLG60中石墨烯片径尺寸过小,表面缺陷增加,金属氧化物颗粒过大,未形成有效三维导电网络,从而导致Mn2O3/Fe2O3/FLG60复合材料电导率降低有关。
图 9(c), (d)所示为Mn2O3/Fe2O3/FLG30/S,Mn2O3/Fe2O3/FLG60/S和MnCl2-FeCl3-FLG/S 3个电极的循环性能曲线。为体现金属氧化物对循环过程中多硫化物迁移效应的抑制作用,以MnCl2-FeCl3-FLG/S复合材料为正极材料,作为对比电极(硫含量约为75%)。3个电极在0.1 C(1 C=1675 mA·g-1)倍率下的循环性能如图 9(c)所示。对于Mn2O3/Fe2O3/FLG30/S电极,第1圈在0.05 C倍率下充放电,放电比容量为1071.3 mAh·g-1,说明活性物质硫的利用率达64%。0.1 C倍率下,初始放电比容量为886.3 mAh·g-1,100圈充放电循环后其比容量仍能达到780.8 mAh·g-1,容量保持率高达88.1%,库仑效率约为90%。对于Mn2O3/Fe2O3/FLG60/S电极,0.05 C倍率下放电比容量为929.1 mAh·g-1,活性物质利用率约为55.5%,其活性物质利用率远低于Mn2O3/Fe2O3/FLG30/S电极,这一结果与CV曲线结果相一致。0.1 C倍率下,初始放电比容量为680.8 mAh·g-1,100圈充放电循环后其比容量为622.8 mAh·g-1,容量保持率为91.5%,库仑效率大于90%。对于MnCl2-FeCl3-FLG/S电极,其在0.1 C倍率下的初始放电容量为936.2 mAh·g-1,略高于Mn2O3/Fe2O3/FLG30/S和Mn2O3/Fe2O3/FLG60/S电极的初始放电容量886.3 mAh·g-1和680.8 mAh·g-1,这是因为金属氧化物导电性差的缘故。但是,MnCl2-FeCl3-FLG/S电极在后续循环过程中的放电比容量迅速下降,100圈循环后其容量保持率仅为20.5%,远低于Mn2O3/Fe2O3/FLG30/S和Mn2O3/Fe2O3/FLG60/S电极的容量保持率88.1%和91.5%。另外,其库仑效率也迅速降低至约80%,说明MnCl2-FeCl3-FLG/S电极在循环过程中出现严重的多硫化物溶解和迁移效应。值得注意的是,与MnCl2-FeCl3-FLG/S电极的容量保持率相比,Mn2O3/Fe2O3/FLG30/S和Mn2O3/Fe2O3/FLG60/S电极在低倍率(0.1 C)下都表现出高容量保持率,这表明双金属氧化物Mn2O3和Fe2O3在充放电过程中有效的固定多硫化物,抑制迁移效应的发生。另外,Mn2O3/Fe2O3/FLG30/S和Mn2O3/Fe2O3/FLG60/S电极的容量保持率相比,Mn2O3/Fe2O3/FLG60/S电极展现出更高的容量保持率,这说明增加金属氧化物含量可增强其对多硫化物的固定效果。然而,与Mn2O3/Fe2O3/FLG30/S电极相比,Mn2O3/Fe2O3/FLG60/S电极的放电比容量过低,其初始比容量仅约为前者初始比容量的78.6%,说明金属氧化物含量增加,会降低电极的电导率,从而降低电极的比容量。
三个电极在高倍率下的循环性能如图 9(d)所示。对于Mn2O3/Fe2O3/FLG30/S电极,1 C倍率下,其初始比容量达到692.2 mAh·g-1,200圈充放电循环后其比容量仍能达到532.5 mAh·g-1,容量保持率达76.9%,库仑效率约为95%。对于Mn2O3/Fe2O3/FLG60/S电极,其初始比容量458.2 mAh·g-1,200圈循环后容量为365.5 mAh·g-1,容量保持率为79.8%,库仑效率约93%。与Mn2O3/Fe2O3/FLG30/S电极相比,初始容量仅为前者的66.2%。对于MnCl2-FeCl3-FLG/S电极,1 C放电倍率下,该电极的初始放电容量为723.4 mAh·g-1,略高于Mn2O3/Fe2O3/FLG30/S和Mn2O3/Fe2O3/FLG60/S电极的初始放电容量692.2 mAh·g-1和458.2 mAh·g-1,该电极在后续的循环过程中也出现严重的容量衰减问题,200圈循环后其容量保持率仅为15.9%,远低于Mn2O3/Fe2O3/FLG30/S和Mn2O3/Fe2O3/FLG60/S电极的容量保持率76.9%和79.8%,其库仑效率也在后续的循环过程中出现下降(图 9(d))。MnCl2-FeCl3-FLG/S, Mn2O3/Fe2O3/FLG30/S和Mn2O3/Fe2O3/FLG60/S电极在高倍率(1 C)下循环性能呈现的规律与低倍率(0.1 C)相一致,再次说明金属氧化物能有效固定多硫化物,抑制迁移效应。但是,过高的金属氧化物含量会降低电极电导率,从而降低电极容量的发挥。
3 结论(1) Mn2O3/Fe2O3/FLG30复合材料中高品质石墨烯与金属氧化物颗粒紧密结合并形成有效的三维导电网络,使得电极电导率提高,进而提高锂硫电池的比容量。
(2) 金属氧化物能有效固定多硫化物,抑制迁移效应,从而提高锂硫电池循环稳定性。Mn2O3/Fe2O3/FLG30/S电极的倍率性能及循环性能均优于Mn2O3/Fe2O3/FLG60/S电极。0.1 C倍率下,Mn2O3/Fe2O3/FLG30/S电极初始容量为886.3 mAh·g-1,100圈循环后,容量保持率高达88.1%;1 C倍率下,初始容量达692.2 mAh·g-1,200圈长周期循环后,容量保持率为76.9%。
| [1] |
FANG X, PENG H. A revolution in electrodes:recent progress in rechargeable lithium-sulfur batteries[J]. Small, 2015, 11(13): 1488-1511. DOI:10.1002/smll.201402354 |
| [2] |
KANG W, DENG N, JU J, et al. A review of recent developments in rechargeable lithium-sulfur batteries[J]. Nanoscale, 2016, 8(37): 16541-16588. DOI:10.1039/C6NR04923K |
| [3] |
LI C, XI Z, GUO D, et al. Chemical immobilization effect on lithium polysulfides for lithium-sulfur batteries[J]. Small, 2018, 14(4): 1701986. DOI:10.1002/smll.201701986 |
| [4] |
LIU D, ZHANG C, ZHOU G, et al. Catalytic effects in lithium-sulfur batteries:promoted sulfur transformation and reduced shuttle effect[J]. Adv Sci, 2018, 5(1): 1700270. DOI:10.1002/advs.201700270 |
| [5] |
JI X, LEE K T, NAZAR L F. A highly ordered nanostructured carbon-sulphur cathode for lithium-sulphur batteries[J]. Nat Mater, 2009, 8(6): 500-506. DOI:10.1038/nmat2460 |
| [6] |
JAYAPRAKASH N, SHEN J, MOGANTY S S, et al. Porous hollow carbon@sulfur composites for high-power lithium-sulfur batteries[J]. Angew Chem Int Ed Engl, 2011, 50(26): 5904-5908. DOI:10.1002/anie.201100637 |
| [7] |
GUO J, XU Y, WANG C. Sulfur-impregnated disordered carbon nanotubes cathode for lithium-sulfur batteries[J]. Nano Lett, 2011, 11(10): 4288-4294. DOI:10.1021/nl202297p |
| [8] |
WANG H, YANG Y, LIANG Y, et al. Graphene-wrapped sulfur particles as a rechargeable lithium-sulfur battery cathode material with high capacity and cycling stability[J]. Nano Lett, 2011, 11(7): 2644-2647. DOI:10.1021/nl200658a |
| [9] |
WEI S Z, LI W, CHA J J, et al. Sulphur-TiO2 yolk-shell nanoarchitecture with internal void space for long-cycle lithium-sulphur batteries[J]. Nat Commun, 2013, 4: 1331. DOI:10.1038/ncomms2327 |
| [10] |
PANG Q, KUNDU D, CUISINIER M, et al. Surface-enhanced redox chemistry of polysulphides on a metallic and polar host for lithium-sulphur batteries[J]. Nat Commun, 2014, 5: 4759. |
| [11] |
LIANG X, HART C, PANG Q, et al. A highly efficient polysulfide mediator for lithium-sulfur batteries[J]. Nat Commun, 2015, 6: 5682. DOI:10.1038/ncomms6682 |
| [12] |
YU Q, LUO R, BAI X, et al. Rational design of double-confined Mn2O3/S@Al2O3 nanocube cathodes for lithium-sulfur batteries[J]. Journal of Solid State Electrochemistry, 2017, 22(3): 849-858. |
| [13] |
HAN X, XU Y, CHEN X, et al. Reactivation of dissolved polysulfides in Li-S batteries based on atomic layer deposition of Al2O3 in nanoporous carbon cloth[J]. Nano Energy, 2013, 2(6): 1197-1206. DOI:10.1016/j.nanoen.2013.05.003 |
| [14] |
ZHENG C, NIU S, LV W, et al. Propelling polysulfides transformation for high-rate and long-life lithium-sulfur batteries[J]. Nano Energy, 2017, 33: 306-312. DOI:10.1016/j.nanoen.2017.01.040 |
| [15] |
SONG Y, ZHAO W, KONG L, et al. Synchronous immobilization and conversion of polysulfides on a VO2-VN binary host targeting high sulfur load Li-S batteries[J]. Energy & Environmental Science, 2018, 11(9): 2620-2630. |
| [16] |
CARTER R, OAKES L, MURALIDHARAN N, et al. Polysulfide anchoring mechanism revealed by atomic layer deposition of V2O5 and sulfur-filled carbon nanotubes for lithium-sulfur batteries[J]. ACS Appl Mater Interfaces, 2017, 9(8): 7185-7192. DOI:10.1021/acsami.6b16155 |
| [17] |
GENG X, GUO Y, LI D, et al. Interlayer catalytic exfoliation realizing scalable production of large-size pristine few-layer graphene[J]. Sci Rep, 2013, 3: 1134. DOI:10.1038/srep01134 |
| [18] |
QI X, ZHANG H B, XU J, et al. Highly efficient high-pressure homogenization approach for scalable production of high-quality graphene sheets and sandwich-structured alpha-Fe2O3/graphene hybrids for high-performance lithium-ion batteries[J]. ACS Appl Mater Interfaces, 2017, 9(12): 11025-11034. DOI:10.1021/acsami.7b00808 |
| [19] |
WANG L, ZHU Y, GUO C, et al. Ferric chloride-graphite intercalation compounds as anode materials for Li-ion batteries[J]. Chem Sus Chem, 2014, 7(1): 87-91. DOI:10.1002/cssc.201300874 |
| [20] |
AHMED M M M, IMAE T, HILL J P, et al. Defect-free exfoliation of graphene at ultra-high temperature[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2018, 538: 127-132. |
| [21] |
PENG F, MENG F, GUO Y, et al. Intercalating hybrids of sandwich-like Fe3O4-graphite:synthesis and their synergistic enhancement of microwave absorption[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(12): 16744-16753. |
| [22] |
SHIN H J, KIM S M, YOON S M, et al. Tailoring electronic structures of carbon nanotubes by solvent with electron-donating and-withdrawing groups[J]. J Am Chem Soc, 2008, 130(6): 2062-2066. DOI:10.1021/ja710036e |
| [23] |
ZHAN D, SUN L, NI Z H, et al. FeCl3-based few-layer graphene intercalation compounds:single linear dispersion electronic band structure and strong charge transfer doping[J]. Advanced Functional Materials, 2010, 20(20): 3504-3509. DOI:10.1002/adfm.201000641 |
| [24] |
FERRARI A C, MEYER J C, SCARDACI V, et al. Raman spectrum of graphene and graphene layers[J]. Phys Rev Lett, 2006, 97(18): 187401. DOI:10.1103/PhysRevLett.97.187401 |
| [25] |
CAO H, WANG G, ZHANG L, et al. Shape and magnetic properties of single-crystalline hematite (α-Fe2O3) nanocrystals[J]. Chem Phys Chem, 2006, 7(9): 1897-1901. DOI:10.1002/cphc.200600130 |
| [26] |
JAVED Q, WANG F P, RAFIQUE M Y, et al. Diameter-controlled synthesis of alpha-Mn2O3 nanorods and nanowires with enhanced surface morphology and optical properties[J]. Nanotechnology, 2012, 23(41): 415603. DOI:10.1088/0957-4484/23/41/415603 |
| [27] |
ZHANG L, HUANG H, YIN H, et al. Sulfur synchronously electrodeposited onto exfoliated graphene sheets as a cathode material for advanced lithium-sulfur batteries[J]. Journal of Materials Chemistry A, 2015(32): 16513-16519. |
| [28] |
LI Z, LI C, GE X, et al. Reduced graphene oxide wrapped MOFs-derived cobalt-doped porous carbon polyhedrons as sulfur immobilizers as cathodes for high performance lithium sulfur batteries[J]. Nano Energy, 2016, 23: 15-26. DOI:10.1016/j.nanoen.2016.02.049 |
 2020, Vol. 48
2020, Vol. 48


