文章信息
- 郭建强, 李炯利, 梁佳丰, 李岳, 朱巧思, 王旭东
- GUO Jian-qiang, LI Jiong-li, LIANG Jia-feng, LI Yue, ZHU Qiao-si, WANG Xu-dong
- 氧化石墨烯的化学还原方法与机理研究进展
- Research progress in methods and mechanisms of chemical reduction graphene oxide
- 材料工程, 2020, 48(7): 24-35
- Journal of Materials Engineering, 2020, 48(7): 24-35.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.000915
-
文章历史
- 收稿日期: 2019-10-08
- 修订日期: 2020-02-20
2. 北京石墨烯技术研究院有限公司, 北京 100094;
3. 北京市石墨烯及应用工程技术研究中心, 北京 100095
2. Beijing Institute of Graphene Technology, Beijing 100094, China;
3. Beijing Engineering Research Centre of Graphene Application, Beijing 100095, China
石墨烯是一种由共轭sp2杂化碳原子组成的二维纳米材料,2004年由曼彻斯特大学Andre Geim和Konstantin Novoselov首次发现[1]。单层石墨烯表现出极其优异的力学性能、导电性能、导热性能、载流子迁移率、光学性能及阻隔性等,迅速引起了国内外的研究热潮[2-5]。
石墨烯的制备方法可以分为自下而上和自上而下两大类。自下而上是指用甲烷和乙醇等从原子水平构筑石墨烯的结构,以化学气相沉积法为代表;自上而下是基于石墨的层状结构,通过不同的剥离方法得到单层或者少层的石墨烯,以液相剥离、电化学剥离、石墨氧化还原法为代表。
由于氧化还原法具有高产率、低成本、便于化学改性等优点,被广泛应用于复合材料、涂层、涂料、油墨、储能等领域[6-7]。石墨烯几乎完全由sp2杂化碳原子组成,氧化石墨烯除sp2杂化区域外还含有大量sp3杂化区域、含氧基团和缺陷[8],在力学性能、电学性能、导热性能、表面性质等方面都完全不同于石墨烯。目前已经有数十种还原剂被用于化学还原氧化石墨烯,从最常用的水合肼、HI、维生素C到绿茶、蛋白质,绝大部分还原机理尚不明确[9-10],也没有通用的还原机理被提出。
氧化石墨烯的还原是各种含氧基团消除,同时C=C双键形成,石墨烯共轭结构部分恢复的过程[11]。还原过程中部分碳原子由sp3杂化变为sp2杂化,物理性质发生重大改变,是石墨烯材料领域的关键基础问题之一。本文介绍了氧化石墨烯的制备方法与结构,并按照关键反应基团归纳总结了各种还原方法,分析了多种还原机理。
1 氧化石墨烯的制备氧化石墨已经被研究100多年,而氧化石墨烯的概念是2004年石墨烯发现后才提出的,二者在碳原子层数上不同,在化学性质上几乎是一样的。1859年,牛津大学的Brodie教授首次制备出了氧化石墨:将石墨、三倍量的氯酸钾和过量的发烟硝酸混合,经过多次氧化后,得到了氧含量为37.11%(质量分数,下同)的氧化石墨。由于产物不溶于酸,只能分散在水或者碱溶液中,Brodie将制备的氧化石墨称为“石墨酸(graphic acid)”[12]。1898年,Staudenmaier改进了制备方法,分批加入氯酸钾以代替Brodie法中多次氧化的步骤[13]。1937年,Hofmann将该方法中的发烟硝酸替换为普通硝酸[14]。1958年,Hummers进一步改进,先将石墨与浓硫酸和硝酸钠混合,再分批次加入氧化剂高锰酸钾,这种方法避免了硝酸的使用[15]。Hummers法安全性更高,同时能获得更高的氧化率,因此逐渐成为制备氧化石墨的主流方法。随着石墨烯概念的提出,改进的Hummers法被广泛用以制备氧化石墨烯,但是这种方法仍然可能过度放热,具有一定的安全隐患,也会产生有毒NOx副产物。2010年,Tour团队将反应体系中的硫酸部分替代为更为温和的磷酸,不再使用硝酸钠,并将反应温度调低到35~40 ℃,这一改进避免了制备过程中大量放热和有毒NOx气体的产生,大幅度提高了氧化石墨烯制备的安全性[16]。
虽然制备氧化石墨烯的方法不断改进,其基本原理是一样的,都是采用强氧化剂在强酸作用下破坏石墨的共轭结构,形成大量含氧基团,再将氧化石墨剥离为单层或者少层的氧化石墨烯。以改进的Hummers法为例,氧化石墨烯的制备分为三个阶段:第一步是石墨与氧化性酸接触,形成酸插层石墨化合物,边缘开始氧化反应;第二步是氧化剂替代酸扩散到石墨层间,进行深度氧化,是氧化石墨烯形成的控速步骤;第三步是氧化石墨烯的剥离、共价硫酸盐水解为硫酸[17]。其中第二步是决定石墨氧化程度及氧化石墨烯化学结构的关键步骤,本质是烯烃的氧化。若C=C双键氧化程度较低,只有双键中的π键断裂,还保留一个C—C单键,会形成C—OH,C—O—C等基团;若双键氧化反应剧烈,则C=C完全断裂,形成C=O双键,表现为醛、酮、羧基,也可能形成CO2离去,在氧化石墨稀表面形成孔洞[18-19]。
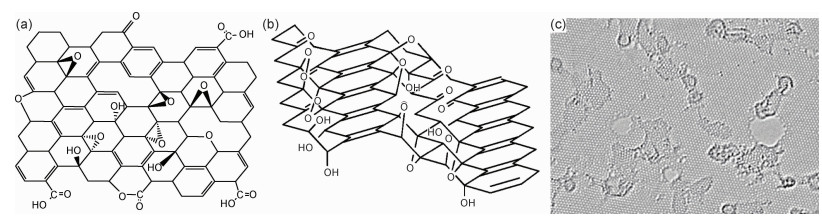
2 氧化石墨烯的结构氧化石墨烯由碳、氧、氢三种元素组成,没有精确的化学计量比,碳/氧元素质量比(C/O比)在1.5到2.5之间[20]。氧化石墨烯的化学结构与制备方法和氧化程度有关,不是完全确定的,至今仍有一些关于氧化石墨烯化学结构的争论。针对氧化石墨(烯)的结构,曾提出过一系列模型,其中Lerf-Klinowski模型[8](图 1(a))和Szabo-Dekany模型[21](图 1(b))能够较好地解释氧化石墨烯的结构与性质,得到了广泛认可。氧化石墨烯中含有羟基、环氧基、羰基、羧基四种主要含氧基团,还含有少量酯、醚、酚[22],羟基和环氧基主要分布在氧化石墨的片层内部,而羰基和羧基主要存在于边缘[8]。Gómez-Navarro等[23]采用高分辨透射电镜直接观察到了氧化石墨烯的精细结构,确认氧化石墨烯由两种不同的区域组成,如图 1(c)所示,一种是未被氧化的sp2杂化区域;一种是被氧化的区域,由六元脂肪环组成,碳原子为sp3杂化。Gao等[24]通过13C魔角旋转核磁共振技术分析了氧化石墨烯的化学结构,发现氧化石墨烯的含氧基团以羟基和环氧基为主,羧基和羰基含量较低,存在少量五元及六元内酯环,还存在部分五元环和七元环畸形缺陷。Gómez-Navarro与Erickson等几乎同时在高分辨透射电镜下发现了氧化石墨烯纳米片中存在纳米尺度的孔洞[25]。
石墨烯优异的力学、导电、导热等性能源于sp2杂化碳原子的大面积周期性共轭结构,含氧官能团以及破损孔洞的出现,严重破坏了这种大共轭结构,因此氧化石墨烯的性能远不如石墨烯[26-27]。
化学还原氧化石墨的方法早在50多年前就已经有报道,1963年出版的《无机化学制备手册》中就记录了肼、羟胺、HI、铁离子和锡离子等对氧化石墨的还原[28]。后来这些方法都被应用到氧化石墨烯的还原中。从2007年Ruoff团队[29]使用水合肼还原氧化石墨烯开始,已经有几十种还原剂被陆续开发出来[9, 11]。但是大部分都缺乏机理支撑,氧化石墨烯的化学还原机理尚不明确。
本文根据还原剂关键官能团的种类梳理了氧化石墨烯的化学还原方法,逐一分析了还原机理。
3.1 肼(N2H4)肼是工业中常用的还原剂。Ruoff团队率先提出了通过还原氧化石墨烯制备石墨烯的理念,并使用水合肼将氧化石墨烯还原。随着还原进行,氧化石墨烯逐渐由棕色变为黑色;含氧基团被消除导致石墨烯疏水性增加,还原后石墨烯易于团聚;以碳/氧元素质量比(C/O比)为指标确认了还原程度,C/O比从2.7提高到10.3,导电率达到2420 S/m[29]。C/O比和导电率从此成为衡量氧化石墨烯还原程度的重要指标,水合肼也成为其他还原剂的重要参照物。水合肼还原操作简单、还原程度高,但是还原后石墨烯发生团聚,这大大限制了它的应用。Li等[30]通过控制水合肼添加量,使用氨水调节pH,使氧化石墨烯还原后也能保持稳定分散,打破了还原必然导致石墨烯聚沉的认知。该研究从胶体角度阐述了氧化石墨烯还原过程中的一系列现象,指出氧化石墨烯还原产物的稳定性与表面电荷密度直接相关,取决于胶体颗粒浓度、pH以及电解质浓度等因素。通过三个方面的改进可以促进水合肼还原石墨烯稳定分散:(1)使用浓度在0.5mg/mL以下的氧化石墨烯分散液;(2)使用氨水将pH调节到10左右(使用氨水调节pH的方法被广泛借鉴);(3)无论还原剂还是氨水,在氧化石墨烯胶体溶液中又是电解质,都不能过量使用。
Ruoff团队提出的肼还原氧化石墨烯机理如图 2[29]所示:首先肼通过亲核反应将环氧基团打开,肼分子接到氧化石墨烯上;氮原子的孤对电子进攻羟基形成C—N—C三元环中间体;三元环并不稳定,肼分子离去,形成双键。该反应机理尚未得到广泛认可,有两处存在争议:(1)羟基能否被肼取代;(2)虽然C—N—C三元环不稳定容易开环,但是两个C—N键都断裂需要的能量太高。Gao等[31]通过密度泛函理论(density functional theory, DFT)检验了上述反应路径,计算结果显示环氧基团很容易被肼进攻而开环,但是羟基消除并形成双键的反应路径活化能太高,不能发生;羰基和羧基也难以被肼还原。值得注意的是,环氧开环形成羟基并不会造成氧原子的减少,也没有直接形成C=C双键,所以环氧的减少与氧化石墨烯的还原并不直接相关。
氧化石墨烯的肼类还原剂还有二甲基肼[32]、苯肼和对甲基磺酰肼[33]等。肼类化学物是一类高效还原剂,但是毒性大、成本较高,限制了它们的应用。
3.2 碱性化合物2008年,Zhang团队[34]使用NaOH和KOH对氧化石墨烯进行还原,指出强碱性物质均对氧化石墨烯具有还原能力。NaOH,KOH等作为还原剂具有无毒、操作简单等优点,随着浓度上升,还原反应可以在室温发生,但是还原程度不高,不能还原羰基、羧基等官能团。NaOH,KOH作为还原剂在反应机理方面非常具有启发意义:与N2H4、HI、维生素C等强还原剂不同,NaOH和KOH并不是传统意义上的还原剂;NaOH和KOH还原的本质是氢氧根离子对氧化石墨烯中环氧基、羟基等基团的还原;氢氧根离子结构简单,反而能够检验各种反应机理的适用性。该研究表明碱性试剂均对氧化石墨烯具有还原能力,也包括N2H4、NH3、胺类等碱性化合物。很多还原方法都使用了NaOH, NH3提供碱性环境,增强还原能力。
3.3 含氨基化合物 3.3.1 羟胺(NH2OH)Guo团队[35]报道了以NH2OH·HCl和氨水还原氧化石墨烯的反应,还原产物C/O比可达9.7,电导率可达1122 S/m。使用羟胺还原后石墨烯溶液呈碱性,可以形成稳定的分散液。该团队提出的羟胺还原机理与Ruoff等提出的N2H4还原氧化石墨烯反应机理相近:NH2OH通过亲核加成反应打开环氧形成一个羟基,随后一个质子转移到羟基上,羟基离去形成羟基二甲亚胺(C—N—C三元环)中间体,然后该中间体分解,得到最终还原产物。
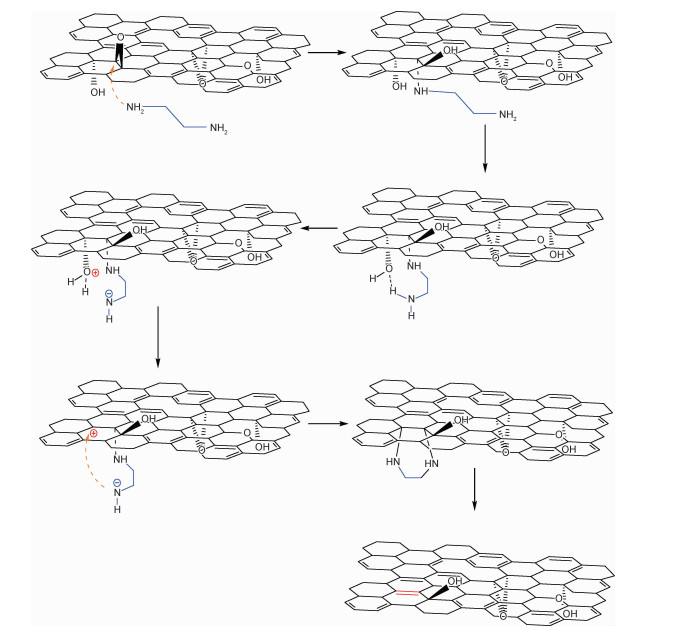
3.3.2 胺类乙二胺、对苯二胺、苄胺、尿素、吡咯、乌洛托品等胺类化合物都可以作为氧化石墨烯的还原剂使用[36-42]。以乙二胺为例,据Xiao团队[42]报道,在不使用稳定剂的情况下,乙二胺可以还原氧化石墨烯并维持稳定分散,二胺类还原剂一个氨基能够连接到氧化石墨烯上,另一个氨基可以接枝其他分子,便于进一步应用;还原后有N原子掺杂到氧化石墨烯上,C/O比为7.87,电导率为220 S/m。Xiao团队还对比了乙二胺和正丁胺的还原能力,认为二元胺的还原性能要好于一元胺。该研究提出的反应机理如图 3[42]所示:乙二胺通过亲核加成反应打开环氧,连接到氧化石墨烯上,同时形成一个羟基;乙二胺与同侧的其他羟基形成哌嗪中间体,然后哌嗪离去,形成C=C双键。该机理要求环氧与羟基必须成对存在,且处于氧化石墨烯的两侧,否则不能被还原。该机理中哌嗪六元环张力很小,比较稳定,最后一步哌嗪环中两个C—N单键的断裂缺乏足够驱动力。
3.3.3 氨基酸氨基酸是一类绿色环保的氧化石墨烯还原剂,2009年,Zhang团队[43]使用维生素C和色氨酸一起还原氧化石墨烯。2011年,Guo团队[44]单独使用氨基酸(半胱氨酸)对氧化石墨烯进行了还原。随后,甘氨酸[45]、赖氨酸[46]、天冬氨酸[47]、缬氨酸[47]、丙氨酸[48]、谷胱甘肽[49]等陆续被开发出来。由于色氨酸含有富电子的芳香结构、半胱氨酸含有巯基,它们对氧化石墨烯的还原不能表明氨基酸类物质作为还原剂的普适性。2014年,Tran等[47]研究了结构简单,不含芳香环、巯基的天冬氨酸和缬氨酸对氧化石墨烯的还原,证实了氨基酸类化合物普遍具有还原氧化石墨烯的能力。Tran等提出氨基酸的还原机理如图 4[47]所示:氨基亲核进攻环氧并将其打开,形成一个羟基;然后另一个氨基酸取代羟基;最终两个氨基以R—NH—NH—R的形式消除,形成新的双键。该机理第三步存在争议,两个C—NHR单键需要很高的活化能才能断裂使该反应完成。
氨基酸类还原剂的优势是绿色无毒(低毒),它们的还原能力整体弱于N2H4,其中甘氨酸的还原能力最好,C/O比可以达到11.14。氨基酸还原氧化石墨烯后,会有3%~4%的氮原子留在石墨烯结构中,这一点与N2H4、NH3、多巴胺[50]、胺类等含氮化合物相似。
3.4 HIHI, HBr, HCl等对氧化石墨具有一定的还原性,它们的还原能力与亲核性正相关,亲核性的强弱顺序是I->Br->Cl-[28],2010年,Ruoff团队[51]首先报道了HI对于氧化石墨烯的还原,还原可以在HI溶液中进行,也可以在HI蒸气中发生,溶液的还原效果优于蒸气。HI的还原能力不弱于N2H4,还原后C/O比达到11.5,电导率可达30400 S/m,还原后有少量I-和I2单质存在于石墨烯结构中。Cheng团队[52]几乎同时报道了HI对氧化石墨烯的还原,还原后C/O比达到12,电导率达到29800 S/m。HI作为还原剂有3个优点:(1)还原能力强,还原后不破坏氧化石墨烯膜、气凝胶等宏观结构;(2)还原形式多样,可以使用蒸气还原,也可以使用溶液还原;(3)C—I单键键能低,容易断裂,有利于减少杂原子的残余量。该团队提出的还原机理如图 5[52]所示:酸性条件下环氧基和羟基都会被质子化,在I-进攻下,环氧基团开环形成羟基;羟基质子化后被I-取代,由于C—I单键结合较弱,随之断裂消除形成C=C双键。C—I单键断裂形成C=C双键的详细机理尚不明确。
3.5 含硫化合物 3.5.1 无机硫化物Bangal团队[53]报道了Na2SO3,Na2S,Na2S2O3,SOCl2,SO2等无机硫化物对氧化石墨烯的还原,还原反应在DMAc/H2O溶剂中发生,还原产物会负载少量硫元素。其中SOCl2还原能力最好,C/O比达到8.48,但是反应放热比较严重。NaHSO3作为还原剂C/O比例可以达到7.89,虽然不同硫化物还原后碳氧比差别比较大,但是它们的还原产物电导率相近,NaHSO3还原石墨烯的电导率为6500 S/m,相同方法下超过N2H4还原石墨烯的5100 S/m。该研究认为Na2SO3, Na2S, Na2S2O3, SOCl2, SO2等硫化物均是通过解离出HSO3-将氧化石墨烯还原。如图 6[53]所示,HSO3-通过取代反应和热消除将环氧基还原形成C=C双键,该研究未提出羟基消除的反应机理。Zhao团队[54]通过DFT模拟了硫化物还原GO的过程,在HSO3-阴离子的作用下,羟基和环氧基都易于被还原;而羰基和羧基不容易被还原。
3.5.2 硫脲硫脲是一种工业中常用的强还原剂,常用于纺织印刷、造纸、皮革处理等行业。硫脲在碱性环境中可以产生尿素及NaHSO3,表现出还原性,将羰基还原为醇[55]。Pumera团队[56]使用硫脲/NaOH还原氧化石墨烯,还原后的石墨烯C/O可达14.5,不能在水中形成稳定分散液。Fugetsu团队[57]报道了类似的还原反应,使用胆酸钠作为稳定剂,可以得到稳定的分散液,还原后C/O比为5.89,电导率为3205 S/m。该研究还对比了硫脲与维生素C、连二亚硫酸钠的还原效果,硫脲的还原效果超过二者。Guo团队[58]使用NH3代替NaOH为硫脲提供碱性环境,对氧化石墨烯进行还原,还原时间可以缩短为1 h,还原后C/O比为6,电导率为290 S/m。
3.5.3 硫醇硫醇的核心基团巯基(—SH)具有还原性及强亲核性,能通过亲核加成反应打开环氧,并将氧化石墨烯还原。Pumera团队[59]报道了乙硫醇-氯化铝体系对氧化石墨烯中羟基的还原,还原后石墨烯C/O比为4.71,电导率提升较少。2018年,Pentzer团队[60]专门研究了酸碱环境中乙硫醇与氧化石墨烯的反应,乙硫醇在酸碱性环境中表现出不同的还原性:碱性环境中,氧化石墨烯被巯基功能化,伴随着轻度还原;在强酸性环境中,巯基功能化几乎没有发生,氧化石墨烯被高度还原,酸碱环境中巯基与氧化石墨烯的反应机理尚不清楚。硫化物还原剂本身或其还原副产物往往具有刺激气味,如乙硫醇具有极强烈的臭味,硫脲、无机硫化物溶于水容易释放具有臭鸡蛋气味的毒性H2S气体,这客观上影响了硫化物还原剂的应用范围。但是硫化物还原氧化石墨烯操作均比较简单,还原后会有部分S元素以类噻吩结构掺杂在石墨烯中,还原产物电导率较高,在电催化、储能材料、传感器等领域中有较大应用潜力。
3.6 含羟基化合物 3.6.1 醇类Bielawski团队[61]发现醇类,如甲醇、乙醇、异丙醇、正丁醇都能还原氧化石墨烯。其中正丁醇还原能力最强,还原产物C/O比可达30:1,电导率为4600 S/m。
抗坏血酸(维生素C)是一种多羟基化合物。Zhang团队[43]将维生素C和色氨酸联用作为氧化石墨烯的还原剂。其中维生素C作为还原剂,色氨酸作为稳定剂通过π-π共轭吸附到氧化石墨烯表面。色氨酸能够与还原后残余的羧基一起维持石墨烯表面的电荷密度,使还原后石墨烯稳定分散。该研究提出的还原机理为SN2亲核取代反应与热还原,如图 7[43]所示:维生素C中的五元环有吸电子能力,增加了羟基酸性,质子电离形成烷氧基阴离子;阴离子进攻环氧基或羟基,形成一个中间体,中间体通过热消除分解形成C=C。Guo团队[62]仅用维生素C对氧化石墨烯进行还原,反应需要48 h,产物电导率为800 S/m,在水溶液中能保持稳定分散。而Tascon团队[63]报道了NH3协同维生素C对氧化石墨烯的还原,还原后可以稳定分散于DMF,NMP等常见有机溶剂中,C/O比为12.5,电导率为7700 S/m。维生素C还原能力强,安全无毒,是目前应用最多的还原方法之一。
糖类化学结构中含有多个羟基,也可以作为氧化石墨烯的还原剂使用。Dong团队[64]报道了葡萄糖、果糖、蔗糖与氨水协同还原氧化石墨烯的反应,NH3的存在可以显著加快反应速度、提高还原程度,还原后分散液可以稳定存在一个月以上。Chen团队[65]报道了甘蔗提取物对氧化石墨烯的还原,其核心成分是葡萄糖和蔗糖。
3.6.2 酚类酚具有很强的还原性,化合物中酚羟基越多还原性越强。Yao团队[66]首先报道了对苯二酚对氧化石墨烯的还原,还原后石墨烯分散液可以稳定存在数小时。没食子酸(3, 4, 5-三羟基苯甲酸)是一种多元酚,也是一种食品工业中常用的抗氧化剂。Xiao团队[67]使用没食子酸/NH3体系还原氧化石墨烯,反应可以在室温发生,还原后的石墨烯可以分散于去离子水、DMF、NMP、DMSO、甲醇等多种溶剂中。Yin团队[68]使用绿茶还原了氧化石墨烯,绿茶含有丰富的多酚类化合物,具有较强的还原能力。通过茶多酚还原的氧化石墨烯可以稳定分散于甲醇、乙醇、丙酮、DMF、NMP、DMAc和DMSO等极性溶剂中。多酚类物质的还原能力弱于N2H4,HI等强还原剂,还原后多酚类物质仍会附着在石墨烯表面,其优点在于绿色低毒,还原产物能够在多种溶剂中稳定分散,便于进一步制备石墨烯材料。
3.7 金属氢化物硼氢化钠(NaBH4)是一种常用还原剂,BH4-可以电离成H-和BH3,H-有很强的碱性和亲核性。与NaOH, KOH等普通强碱不同,NaBH4还可以将羰基还原为羟基。NaBH4既可以单独使用[69],也可以与其他方法配合使用[70]。Kamat团队[71]首先报道了NaBH4对于氧化石墨烯的还原,氧化石墨烯使用十八烷基胺改性后,还原产物可以分散于四氢呋喃。2017年,Olsson团队[72]研究了硼氢化钠还原氧化石墨烯的过程,认为硼氢化钠先快速还原羟基、环氧等C—O单键,后逐渐还原羰基和羧基等C=O双键,C—O单键的还原会使石墨烯电导率快速上升,C=O双键还原后才会达到电导率的上限。作为NaBH4的衍生物,NaBH(OAc)3, NaBH3(CN)[73]和NH3BH3[74]也被用于氧化石墨烯的还原。
氢化铝锂(LiAlH4)的Al—H键弱于B—H键,更容易解离出H-,其还原能力比NaBH4更强,除羰基外,还能还原羧基和酯基。Pumera团队[75]对比了LiAlH4,NaBH4和N2H4三种还原剂对氧化石墨烯的还原能力:还原后三者的C/O比分别为12, 9.5, 11.5,三种还原产物的碳原子sp2杂化比例分别为70%, 68%, 69%,该研究认为LiAlH4的还原能力超过了N2H4。值得一提的是,NaBH4和LiAlH4只能将C=O还原为C—OH,还原表现为加氢,并没有将氧元素消除,也没有产生新的C=C双键,二者对C=O双键的还原并没有直接恢复石墨烯的共轭结构。Guan团队[76]采用LiAlH4和乙硫醇-氯化铝两步还原,先用LiAlH4将羰基、羧基、环氧基转化为羟基,再用乙硫醇-氯化铝将羟基还原,得到了高度还原的石墨烯,还原效果超过单独使用水合肼还原或者1050 ℃热还原。
NaBH4和LiAlH4还原能力强,除环氧和羟基外还能还原羰基和羧基,还原产物中不会有N, S, I等杂原子残留;但是金属氢化物容易水解,影响了它们的还原效率,限制了其大规模应用。
3.8 低价态活泼金属低价态活泼金属易失去自由电子而价态升高,表现出还原性。由于铝的标准还原电位大于NaBH4和肼,Fan等[77]首次将铝粉(10 μm)作为氧化石墨烯的还原剂使用。盐酸提供酸性环境,室温反应半小时即可完成还原,还原产物C/O比可达18.6,电导率可达2100 S/m。该团队随后报道了铁粉(10 μm)/盐酸体系对氧化石墨烯的室温还原[78],还原产物C/O比为7.9,热稳定性高(600 ℃时失重仅7%),电导率可达2300 S/m。Huang团队[79]报道了锌/盐酸体系室温下对氧化石墨烯的还原,还原产物C/O比为8.2,电导率为650 S/m。Panigrahi团队[80]报道了锌/硫酸体系对氧化石墨烯的还原,还原产物C/O比可达21.2,电导率可达3416 S/m。Kumar等[81]报道了氯化亚锡/盐酸体系对氧化石墨烯的还原,还原后C/O比为7.6,锡离子由二价变为四价。
Chung团队[82]提出铝/酸体系对氧化石墨烯的还原能力来自于二者反应产生的初生氢(原子氢),初生氢具有极高的还原性。该团队使用铝箔和盐酸对氧化石墨烯进行还原,还原产物C/O比为21.11,电导率可达12500 S/m。根据该理论,初生氢可以由镁、铝、铁、锌等活泼金属与酸产生,也可以由两性金属(铝和锌)与强碱产生,该团队报道了铝/氢氧化钠和锌/氢氧化钠体系对氧化石墨烯的还原。这与Wang团队[83]报道的锌粉/氨水体系对氧化石墨烯的还原一致,后者认为初生氢由锌与NH4+反应产生。
Li团队[84]报道了金属钠/液氨体系对氧化石墨烯的还原,金属钠在液氨中解离出溶剂化电子,通过伯奇还原反应还原氧化石墨烯,还原产物C/O比可达16.61。Pumera团队[85]系统研究了不同碱金属和质子源对氧化石墨烯的还原反应。常规还原剂通过除去含氧基团、恢复共轭结构实现氧化石墨烯的还原,而伯奇还原会增加氢原子,将部分苯环加氢还原为非共轭二烯,在这个过程中石墨烯的共轭结构是减少的。
3.9 其他还原方法除以上还原方法外,还可以使用希瓦氏菌[86]、大肠杆菌[87]、酵母(还原型辅酶Ⅱ)[88]、牛血清白蛋白[89]、褪黑激素[90]、椰子水[91]、玫瑰水[92]、胡萝卜汁[93]、石榴汁[94]、咖啡酸[95]、蘑菇提取物[96]、香芋叶和橙子皮提取物[97]等生物质材料还原氧化石墨烯。以上还原方法难以达到N2H4、HI、维生素C等强还原剂的还原效果,还原产物中有残留物,需要额外处理才能除去;在还原机理方面,由于并非单一成分小分子,难以分析反应原理,本质上起作用的还是其中的氨基酸、维生素、有机酸等基础物质。
4 还原原理分析氧化石墨烯的还原剂有碱性物质如N2H4、NaOH、NaBH4、胺类,也有酸性化合物如HI、维生素C、氨基酸等,其共同特点是都含有亲核基团,能够打开环氧基。碱性物质一般具有较强亲核性,往往随着碱性增强还原效果会变好。酸性还原剂的亲核性则取决于其电离程度,能够完全电离的还原剂如HI,受酸性影响较小;弱电解质如氨基酸,调低pH会促进氨基离子化,降低其亲核性,加入NH3调控pH到弱碱性能够提高还原能力,也有助于还原产物分散。
在数十种还原方法中,活泼金属对各种含氧基团的还原可以通过初生氢和伯奇还原机理解释。而最常用的各种化合物还原剂,如N2H4、NaOH、HI、氨基酸、乙二胺等尚缺乏确切的理论支撑。氧化石墨烯的四种主要含氧基团为羟基、环氧基、羰基、羧基,只有NaBH4,LiAlH4等少数几种还原剂涉及了羰基和羧基的还原,将C=O还原为CH2OH,还原体现在氢原子增加而不是氧原子消除,没有产生新的C=C,实质上没有促成石墨烯共轭结构的恢复。大部分还原剂只能还原羟基和环氧基,以肼对氧化石墨烯的还原为例(见图 2),环氧基开环后肼分子连接到石墨烯上,并形成一个羟基,这个过程中环氧转化为羟基,氧的价态没有降低、含量也没有减少,也没有形成C=C双键,所以环氧开环也并不直接导致氧化石墨烯的还原。环氧基、羰基、羧基三者都可以被还原剂转化为羟基,转化的过程不会直接导致氧化石墨烯还原。
综上,我们认为氧化石墨烯化学还原的核心是:羟基(包括由环氧、羰基、羧基转化形成的羟基)还原,同时形成新的C=C双键的过程。考虑到羟基在酸碱环境中表现出完全不同的反应活性,将还原剂分为酸性亲核试剂和碱性亲核试剂两大类,分别研究其还原机理是比较合适的思路。
现有的还原机理侧重对环氧基还原反应的理论解释,关于羟基的研究较少,对C=C形成的关键步骤缺乏详细的机理描述。由于无法提出合理的反应路径,很多研究工作将C=C的形成归结于热消除反应,这与实验事实不符,水合肼、维生素C、HI、硫化物等还原剂都能在室温下将氧化石墨烯还原。
5 结束语自2004年至今已经发展出数十种化学还原氧化石墨烯的方法。考虑到还原效果、可操作性、还原后分散稳定性等因素,水合肼、HI、维生素C、氨基酸、胺类是常用的还原方法,多种还原方法联用、化学还原与热还原联用是提高还原效果的有效途径。对开发新型还原剂而言,一个好的还原剂首先应具备较强的亲核性,以打开环氧、羰基、羧基等基团,其次应该具有消除羟基并形成碳碳双键的能力。氧化石墨烯的化学还原机理是石墨烯材料领域的关键基础问题之一,但是氧化石墨烯的无定型结构严重阻碍了机理方面的实验研究,目前多是以密度泛函理论进行理论验证。现有的反应机理往往局限于个例,并不广泛适用,也得不到理论计算的支持。考虑到羟基在酸碱环境中表现出完全不同的反应活性,酸碱环境下羟基如何消除同时形成碳碳双键是研究氧化石墨烯化学还原机理的核心问题。
| [1] |
NOVOSELOV K S, GEIM A K, MOROZOV S V, et al. Electric field effect in atomically thin carbon films[J]. Science, 2004, 306(5696): 666-669. DOI:10.1126/science.1102896 |
| [2] |
AVOURIS P, DIMITRAKOPOULOS C. Graphene:synthesis and applications[J]. Materials Today, 2012, 15(3): 86-97. DOI:10.1016/S1369-7021(12)70044-5 |
| [3] |
MOHAN V B, LAU K T, HUI D, et al. Graphene-based materials and their composites:a review on production, applications and product limitations[J]. Composites:Part B, 2018, 142: 200-220. DOI:10.1016/j.compositesb.2018.01.013 |
| [4] |
YANG Z F, TIAN J R, YIN Z F, et al. Carbon nanotube-and graphene-based nanomaterials and applications in high-voltage supercapacitor:a review[J]. Carbon, 2019, 141: 467-480. DOI:10.1016/j.carbon.2018.10.010 |
| [5] |
GEIM A K, NOVOSELOV K S. The rise of graphene[J]. Nature Materials, 2007, 6(3): 183-191. |
| [6] |
SUN D J, LUO Y F, DEBLIQUY M, et al. Graphene-enhanced metal oxide gas sensors at room temperature:a review[J]. Beilstein Journal of Nanotechnology, 2018, 9: 2832-2844. DOI:10.3762/bjnano.9.264 |
| [7] |
BEITOLLAHI H, SAFAEI M, TAJIK S. Application of graphene and graphene oxide for modification of electrochemical sensors and biosensors:a review[J]. International Journal of Nano Dimension, 2019, 10(2): 125-140. |
| [8] |
LERF A, HE H, FORSTER M, et al. Structure of graphite oxide revisited[J]. The Journal of Physical Chemistry:B, 1998, 102(23): 4477-4482. DOI:10.1021/jp9731821 |
| [9] |
CHUA C K, PUMERA M. Chemical reduction of graphene oxide:a synthetic chemistry viewpoint[J]. Chemical Society Reviews, 2014, 43(1): 291-312. |
| [10] |
DE SILVA K K H, HUANG H H, JOSHI R K, et al. Chemical reduction of graphene oxide using green reductants[J]. Carbon, 2017, 119: 190-199. DOI:10.1016/j.carbon.2017.04.025 |
| [11] |
PEI S F, CHENG H M. The reduction of graphene oxide[J]. Carbon, 2012, 50(9): 3210-3228. DOI:10.1016/j.carbon.2011.11.010 |
| [12] |
BRODIE B C. On the atomic weight of graphite[M]. London: Philosophical Transactions of the Royal Society of London, 1859: 249-259.
|
| [13] |
STAUDENMAIER L. Method for the preparation of graphitic acid[J]. Ber Dtsch Chem Ges, 1898, 31: 1481-1487. DOI:10.1002/cber.18980310237 |
| [14] |
HOFMANN U, KÖNIG E. Untersuchungen über graphitoxyd[J]. Zeitschrift für Anorganische und Allgemeine Chemie, 1937, 234(4): 311-336. |
| [15] |
HUMMERS Jr W S, OFFEMAN R E. Preparation of graphitic oxide[J]. Journal of the American Chemical Society, 1958, 80(6): 1334-1339. |
| [16] |
MARCANO D C, KOSYNKIN D V, BERLIN J M, et al. Improved synthesis of graphene oxide[J]. ACS Nano, 2010, 4(8): 4806-4814. DOI:10.1021/nn1006368 |
| [17] |
DIMIEV A M, TOUR J M. Mechanism of graphene oxide formation[J]. ACS Nano, 2014, 8(3): 3060-3068. DOI:10.1021/nn500606a |
| [18] |
DIMIEV A, KOSYNKIN D V, ALEMANY L B, et al. Pristine graphite oxide[J]. Journal of the American Chemical Society, 2012, 134(5): 2815-2822. DOI:10.1021/ja211531y |
| [19] |
KANG J H, KIM T, CHOI J, et al. Hidden second oxidation step of Hummers method[J]. Chemistry of Materials, 2016, 28(3): 756-764. DOI:10.1021/acs.chemmater.5b03700 |
| [20] |
KRISHNAMOORTHY K, VEERAPANDIAN M, YUN K, et al. The chemical and structural analysis of graphene oxide with different degrees of oxidation[J]. Carbon, 2013, 53: 38-49. DOI:10.1016/j.carbon.2012.10.013 |
| [21] |
SZABÓ T, BERKESI O, FORGÓ P, et al. Evolution of surface functional groups in a series of progressively oxidized graphite oxides[J]. Chemistry of Materials, 2006, 18(11): 2740-2749. DOI:10.1021/cm060258+ |
| [22] |
VOIRY D, YANG J, KUPFERBERG J, et al. High-quality graphene via microwave reduction of solution-exfoliated graphene oxide[J]. Science, 2016, 353(6306): 1413-1416. DOI:10.1126/science.aah3398 |
| [23] |
GÓMEZ-NAVARRO C, MEYER J C, SUNDARAM R S, et al. Atomic structure of reduced graphene oxide[J]. Nano Letters, 2010, 10(4): 1144-1148. DOI:10.1021/nl9031617 |
| [24] |
GAO W, ALEMANY L B, CI L, et al. New insights into the structure and reduction of graphite oxide[J]. Nature Chemistry, 2009, 1(5): 403. DOI:10.1038/nchem.281 |
| [25] |
ERICKSON K, ERNI R, LEE Z, et al. Determination of the local chemical structure of graphene oxide and reduced graphene oxide[J]. Advanced Materials, 2010, 22(40): 4467-4472. DOI:10.1002/adma.201000732 |
| [26] |
ZHU Y W, MURALI S, CAI W W, et al. Graphene and graphene oxide:synthesis, properties, and applications[J]. Advanced Materials, 2010, 22(35): 3906-3924. DOI:10.1002/adma.201001068 |
| [27] |
MAHANTA N K, ABRAMSON A R. Thermal conductivity of graphene and graphene oxide nanoplatelets[C]//13th InterSociety Conference on Thermal and Thermomechanical Phenomena in Electronic Systems, 2012: 1-6.
|
| [28] |
FEHER F. Handbook of preparative inorganic chemistry[M]. NY: Academic Press, 1963: 418.
|
| [29] |
STANKOVICH S, DIKIN D A, PINER R D, et al. Synthesis of graphene-based nanosheets via chemical reduction of exfoliated graphite oxide[J]. Carbon, 2007, 45(7): 1558-1565. DOI:10.1016/j.carbon.2007.02.034 |
| [30] |
LI D, MVLLER M B, GILJE S, et al. Processable aqueous dispersions of graphene nanosheets[J]. Nature Nanotechnology, 2008, 3: 101. DOI:10.1038/nnano.2007.451 |
| [31] |
GAO X F, JANG J, NAGASE S. Hydrazine and thermal reduction of graphene oxide:reaction mechanisms, product structures, and reaction design[J]. Journal of Physical Chemistry:C, 2010, 114(2): 832-842. |
| [32] |
STANKOVICH S, DIKIN D A, DOMMETT G H, et al. Graphene-based composite materials[J]. Nature, 2006, 442(7100): 282. DOI:10.1038/nature04969 |
| [33] |
YUN J M, YEO J S, KIM J, et al. Solution-processable reduced graphene oxide as a novel alternative to PEDOT:PSS hole transport layers for highly efficient and stable polymer solar cells[J]. Advanced Materials, 2011, 23(42): 4923-4928. DOI:10.1002/adma.201102207 |
| [34] |
FAN X B, PENG W C, LI Y, et al. Deoxygenation of exfoliated graphite oxide under alkaline conditions:a green route to graphene preparation[J]. Advanced Materials, 2008, 20(23): 4490-4493. DOI:10.1002/adma.200801306 |
| [35] |
ZHOU X, ZHANG J, WU H, et al. Reducing graphene oxide via hydroxylamine:a simple and efficient route to graphene[J]. Journal of Physical Chemistry:C, 2011, 115(24): 11957-11961. DOI:10.1021/jp202575j |
| [36] |
LIU S, TIAN J, WANG L, et al. A method for the production of reduced graphene oxide using benzylamine as a reducing and stabilizing agent and its subsequent decoration with Ag nanoparticles for enzymeless hydrogen peroxide detection[J]. Carbon, 2011, 49(10): 3158-3164. DOI:10.1016/j.carbon.2011.03.036 |
| [37] |
AMARNATH C A, HONG C E, KIM N H, et al. Efficient synthesis of graphene sheets using pyrrole as a reducing agent[J]. Carbon, 2011, 49(11): 3497-3502. DOI:10.1016/j.carbon.2011.04.048 |
| [38] |
CHEN Y, ZHANG X, YU P, et al. Stable dispersions of graphene and highly conducting graphene films:a new approach to creating colloids of graphene monolayers[J]. Chemical Communications, 2009, 30: 4527-4529. |
| [39] |
LEI Z, LU L, ZHAO X. The electrocapacitive properties of graphene oxide reduced by urea[J]. Energy & Environmental Science, 2012, 5(4): 6391-6399. |
| [40] |
SU P, GUO H L, TIAN L, et al. An efficient method of producing stable graphene suspensions with less toxicity using dimethyl ketoxime[J]. Carbon, 2012, 50(15): 5351-5358. DOI:10.1016/j.carbon.2012.07.001 |
| [41] |
SHEN X, JIANG L, JI Z, et al. Stable aqueous dispersions of graphene prepared with hexamethylenetetramine as a reductant[J]. Journal of Colloid and Interface Science, 2011, 354(2): 493-497. DOI:10.1016/j.jcis.2010.11.037 |
| [42] |
CHE J, SHEN L, XIAO Y. A new approach to fabricate graphene nanosheets in organic medium:combination of reduction and dispersion[J]. Journal of Materials Chemistry, 2010, 20(9): 1722-1727. DOI:10.1039/b922667b |
| [43] |
GAO J, LIU F, LIU Y L, et al. Environment-friendly method to produce graphene that employs vitamin C and amino acid[J]. Chemistry of Materials, 2010, 22(7): 2213-2218. DOI:10.1021/cm902635j |
| [44] |
CHEN D, LI L, GUO L. An environment-friendly preparation of reduced graphene oxide nanosheets via amino acid[J]. Nanotechnology, 2011, 22(32): 325601. DOI:10.1088/0957-4484/22/32/325601 |
| [45] |
BOSE S, KUILA T, MISHRA A K, et al. Dual role of glycine as a chemical functionalizer and a reducing agent in the preparation of graphene:an environmentally friendly method[J]. Journal of Materials Chemistry, 2012, 22(19): 9696-9703. DOI:10.1039/c2jm00011c |
| [46] |
MA J, WANG X, LIU Y, et al. Reduction of graphene oxide with l-lysine to prepare reduced graphene oxide stabilized with polysaccharide polyelectrolyte[J]. Journal of Materials Chemistry:A, 2013, 1(6): 2192-2201. DOI:10.1039/C2TA00340F |
| [47] |
TRAN D N H, KABIRI S, LOSIC D. A green approach for the reduction of graphene oxide nanosheets using non-aromatic amino acids[J]. Carbon, 2014, 76: 193-202. DOI:10.1016/j.carbon.2014.04.067 |
| [48] |
WANG J, SALIHI E C, ŠILLER L. Green reduction of graphene oxide using alanine[J]. Materials Science and Engineering:C, 2017, 72: 1-6. DOI:10.1016/j.msec.2016.11.017 |
| [49] |
PHAM T A, KIM J S, KIM J S, et al. One-step reduction of graphene oxide with L-glutathione[J]. Colloids and Surfaces:A, 2011, 384(1/3): 543-548. |
| [50] |
XU L Q, YANG W J, NEOH K G, et al. Dopamine-induced reduction and functionalization of graphene oxide nanosheets[J]. Macromolecules, 2010, 43(20): 8336-8339. DOI:10.1021/ma101526k |
| [51] |
MOON I K, LEE J, RUOFF R S, et al. Reduced graphene oxide by chemical graphitization[J]. Nature Communications, 2010, 1: 6. DOI:10.1038/ncomms1004 |
| [52] |
PEI S, ZHAO J, DU J, et al. Direct reduction of graphene oxide films into highly conductive and flexible graphene films by hydrohalic acids[J]. Carbon, 2010, 48(15): 4466-4474. DOI:10.1016/j.carbon.2010.08.006 |
| [53] |
CHEN W, YAN L, BANGAL P R. Chemical reduction of graphene oxide to graphene by sulfur-containing compounds[J]. Journal of Physical Chemistry:C, 2010, 114(47): 19885-19890. DOI:10.1021/jp107131v |
| [54] |
SU Y, GAO X, ZHAO J. Reaction mechanisms of graphene oxide chemical reduction by sulfur-containing compounds[J]. Carbon, 2014, 67: 146-155. DOI:10.1016/j.carbon.2013.09.073 |
| [55] |
NAKAGAWA K, MINAMI K. Reduction of organic compounds with thiourea dioxide Ⅰ reduction of ketones to secondary alcohols[J]. Tetrahedron Letters, 1972, 13(5): 343-346. DOI:10.1016/S0040-4039(01)84320-3 |
| [56] |
CHUA C K, AMBROSI A, PUMERA M. Graphene oxide reduction by standard industrial reducing agent:thiourea dioxide[J]. Journal of Materials Chemistry, 2012, 22: 11054-11061. DOI:10.1039/c2jm16054d |
| [57] |
WANG Y, SUN L, FUGETSU B. Thiourea dioxide as a green reductant for the mass production of solution-based graphene[J]. Bulletin of the Chemical Society of Japan, 2012, 85(12): 1339-1344. DOI:10.1246/bcsj.20120174 |
| [58] |
MA Q, SONG J, JIN C, et al. A rapid and easy approach for the reduction of graphene oxide by formamidinesulfinic acid[J]. Carbon, 2013, 54: 36-41. DOI:10.1016/j.carbon.2012.10.067 |
| [59] |
CHUA C K, PUMERA M. Selective removal of hydroxyl groups from graphene oxide[J]. Chemistry-A European Journal, 2013, 19(6): 2005-2011. DOI:10.1002/chem.201204002 |
| [60] |
MELLON M, MANGADLAO J, ADVINCULA R, et al. The pH dependent reactions of graphene oxide with small molecule thiols[J]. RSC Advances, 2018, 8(33): 18388-18395. DOI:10.1039/C8RA03300E |
| [61] |
DREYER D R, MURALI S, ZHU Y, et al. Reduction of graphite oxide using alcohols[J]. Journal of Materials Chemistry, 2011, 21(10): 3443-3447. DOI:10.1039/C0JM02704A |
| [62] |
ZHANG J, YANG H, SHEN G, et al. Reduction of graphene oxide via L-ascorbic acid[J]. Chemical Communications, 2010, 46(7): 1112-1114. DOI:10.1039/B917705A |
| [63] |
FERNANDEZ-MERINO M J, GUARDIA L, PAREDES J I, et al. Vitamin C is an ideal substitute for hydrazine in the reduction of graphene oxide suspensions[J]. Journal of Physical Chemistry:C, 2010, 114(14): 6426-6432. DOI:10.1021/jp100603h |
| [64] |
ZHU C, GUO S, FANG Y, et al. Reducing sugar:new functional molecules for the green synthesis of graphene nanosheets[J]. ACS Nano, 2010, 4(4): 2429-2437. DOI:10.1021/nn1002387 |
| [65] |
LI B, JIN X, LIN J, et al. Green reduction of graphene oxide by sugarcane bagasse extract and its application for the removal of cadmium in aqueous solution[J]. Journal of Cleaner Production, 2018, 189: 128-134. DOI:10.1016/j.jclepro.2018.04.018 |
| [66] |
WANG G, YANG J, PARK J, et al. Facile synthesis and characterization of graphene nanosheets[J]. The Journal of Physical Chemistry:C, 2008, 112(22): 8192-8195. DOI:10.1021/jp710931h |
| [67] |
LI J, XIAO G, CHEN C, et al. Superior dispersions of reduced graphene oxide synthesized by using gallic acid as a reductant and stabilizer[J]. Journal of Materials Chemistry:A, 2013, 1(4): 1481-1487. DOI:10.1039/C2TA00638C |
| [68] |
WANG Y, SHI Z, YIN J. Facile synthesis of soluble graphene via a green reduction of graphene oxide in tea solution and its biocomposites[J]. ACS Applied Materials & Interfaces, 2011, 3(4): 1127-1133. |
| [69] |
SHIN H J, KIM K K, BENAYAD A, et al. Efficient reduction of graphite oxide by sodium borohydride and its effect on electrical conductance[J]. Advanced Functional Materials, 2009, 19(12): 1987-1992. DOI:10.1002/adfm.200900167 |
| [70] |
SI Y, SAMULSKI E T. Synthesis of water soluble graphene[J]. Nano Letters, 2008, 8(6): 1679-1682. DOI:10.1021/nl080604h |
| [71] |
MUSZYNSKI R, SEGER B, KAMAT P V. Decorating graphene sheets with gold nanoparticles[J]. Journal of Physical Chemistry:C, 2008, 112(14): 5263-5266. DOI:10.1021/jp800977b |
| [72] |
GUEX L G, SACCHI B, PEUVOT K F, et al. Experimental review:chemical reduction of graphene oxide (GO) to reduced graphene oxide (rGO) by aqueous chemistry[J]. Nanoscale, 2017, 9(27): 9562-9571. DOI:10.1039/C7NR02943H |
| [73] |
CHUA C K, PUMERA M. Reduction of graphene oxide with substituted borohydrides[J]. Journal of Materials Chemistry:A, 2013, 1(5): 1892-1898. DOI:10.1039/C2TA00665K |
| [74] |
PHAM V H, HUR S H, KIM E J, et al. Highly efficient reduction of graphene oxide using ammonia borane[J]. Chemical Communications, 2013, 49(59): 6665-6667. DOI:10.1039/c3cc43503b |
| [75] |
AMBROSI A, CHUA C K, BONANNI A, et al. Lithium aluminum hydride as reducing agent for chemically reduced graphene oxides[J]. Chemistry of Materials, 2012, 24(12): 2292-2298. DOI:10.1021/cm300382b |
| [76] |
KANG S S, ZHUANG J Y, KANG S H, et al. Synthesis of high-quality graphene with enhanced electrochemical properties by two-step reduction method[J]. Ceramics International, 2019, 45(18): 23954-23965. DOI:10.1016/j.ceramint.2019.08.097 |
| [77] |
FAN Z, WANG K, WEI T, et al. An environmentally friendly and efficient route for the reduction of graphene oxide by aluminum powder[J]. Carbon, 2010, 48(5): 1686-1689. DOI:10.1016/j.carbon.2009.12.063 |
| [78] |
FAN Z J, KAI W, YAN J, et al. Facile synthesis of graphene nanosheets via Fe reduction of exfoliated graphite oxide[J]. ACS Nano, 2010, 5(1): 191-198. |
| [79] |
LIU P, HUANG Y, WANG L. A facile synthesis of reduced graphene oxide with Zn powder under acidic condition[J]. Materials Letters, 2013, 91: 125-128. DOI:10.1016/j.matlet.2012.09.085 |
| [80] |
DEY R S, HAJRA S, SAHU R K, et al. A rapid room temperature chemical route for the synthesis of graphene:metal-mediated reduction of graphene oxide[J]. Chemical Communications, 2012, 48(12): 1787-1789. DOI:10.1039/c2cc16031e |
| [81] |
KUMAR N A, GAMBARELLI S, DUCLAIROIR F, et al. Synthesis of high quality reduced graphene oxide nanosheets free of paramagnetic metallic impurities[J]. Journal of Materials Chemistry:A, 2013, 1(8): 2789-2794. DOI:10.1039/C2TA01036D |
| [82] |
PHAM V H, PHAM H D, DANG T T, et al. Chemical reduction of an aqueous suspension of graphene oxide by nascent hydrogen[J]. Journal of Materials Chemistry, 2012, 22(21): 10530-10536. DOI:10.1039/c2jm30562c |
| [83] |
LIU Y, LI Y, ZHONG M, et al. A green and ultrafast approach to the synthesis of scalable graphene nanosheets with Zn powder for electrochemical energy storage[J]. Journal of Materials Chemistry, 2011, 21(39): 15449-15455. DOI:10.1039/c1jm12599k |
| [84] |
FENG H, CHENG R, ZHAO X, et al. A low-temperature method to produce highly reduced graphene oxide[J]. Nature Communications, 2013, 4: 1539. DOI:10.1038/ncomms2555 |
| [85] |
ENG A Y S, SOFER Z, HUBER Š, et al. Hydrogenated graphenes by Birch reduction:influence of electron and proton sources on hydrogenation efficiency, magnetism, and electrochemistry[J]. Chemistry-A European Journal, 2015, 21(47): 16828-16838. DOI:10.1002/chem.201503219 |
| [86] |
SALAS E C, SUN Z, LÜTTGE A, et al. Reduction of graphene oxide via bacterial respiration[J]. ACS Nano, 2010, 4(8): 4852-4856. DOI:10.1021/nn101081t |
| [87] |
AKHAVAN O, GHADERI E. Escherichia coli bacteria reduce graphene oxide to bactericidal graphene in a self-limiting manner[J]. Carbon, 2012, 50(5): 1853-1860. DOI:10.1016/j.carbon.2011.12.035 |
| [88] |
KHANRA P, KUILA T, KIM N H, et al. Simultaneous bio-functionalization and reduction of graphene oxide by baker's yeast[J]. Chemical Engineering Journal, 2012, 183: 526-533. DOI:10.1016/j.cej.2011.12.075 |
| [89] |
LIU J, FU S, YUAN B, et al. Toward a universal "adhesive nanosheet" for the assembly of multiple nanoparticles based on a protein-induced reduction/decoration of graphene oxide[J]. Journal of the American Chemical Society, 2010, 132(21): 7279-7281. DOI:10.1021/ja100938r |
| [90] |
ESFANDIAR A, AKHAVAN O, IRAJIZAD A. Melatonin as a powerful bio-antioxidant for reduction of graphene oxide[J]. Journal of Materials Chemistry, 2011, 21(29): 10907-10914. DOI:10.1039/c1jm10151j |
| [91] |
KARTICK B, SRIVASTAVA S. Green synthesis of graphene[J]. Journal of Nanoscience and Nanotechnology, 2013, 13(6): 4320-4324. DOI:10.1166/jnn.2013.7461 |
| [92] |
HAGHIGHI B, TABRIZI M A. Green-synthesis of reduced graphene oxide nanosheets using rose water and a survey on their characteristics and applications[J]. RSC Advances, 2013, 3(32): 13365-13371. DOI:10.1039/c3ra40856f |
| [93] |
KUILA T, BOSE S, KHANRA P, et al. A green approach for the reduction of graphene oxide by wild carrot root[J]. Carbon, 2012, 50(3): 914-921. DOI:10.1016/j.carbon.2011.09.053 |
| [94] |
TAVAKOLI F, SALAVATI-NIASARI M, MOHANDES F. Green synthesis and characterization of graphene nanosheets[J]. Materials Research Bulletin, 2015, 63: 51-57. DOI:10.1016/j.materresbull.2014.11.045 |
| [95] |
BO Z, SHUAI X, MAO S, et al. Green preparation of reduced graphene oxide for sensing and energy storage applications[J]. Scientific Reports, 2014, 4: 4684. |
| [96] |
MUTHOOSAMY K, BAI R G, ABUBAKAR I B, et al. Exceedingly biocompatible and thin-layered reduced graphene oxide nanosheets using an eco-friendly mushroom extract strategy[J]. International Journal of Nanomedicine, 2015, 10: 1505-1519. |
| [97] |
THAKUR S, KARAK N. Green reduction of graphene oxide by aqueous phytoextracts[J]. Carbon, 2012, 50(14): 5331-5339. DOI:10.1016/j.carbon.2012.07.023 |
 2020, Vol. 48
2020, Vol. 48