文章信息
- 杜歌, 魏莉, 刘自双, 武继民, 陈子浩, 田丰
- DU Ge, WEI Li, LIU Zi-shuang, WU Ji-min, CHEN Zi-hao, TIAN Feng
- γ辐射和EDC/NHS改性对胶原壳聚糖支架性能的影响
- Effects of γ-irradiation and EDC/NHS modification on property of collagen-chitosan scaffolds
- 材料工程, 2020, 48(5): 106-111
- Journal of Materials Engineering, 2020, 48(5): 106-111.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2018.001498
-
文章历史
- 收稿日期: 2018-12-27
- 修订日期: 2019-12-10
2. 军事科学院 卫勤保障技术研究所, 天津 300161;
3. 中国人民解放军总医院 第六医学中心 航海航空医学中心, 北京 100048
2. Institute of Health Service Support Technology, Academy of Military Sciences, Tianjin 300161, China;
3. Aviation and Nautical Medical Center, the Sixth Medical Center of PLA General Hospital, Beijing 100048, China
组织工程结合支架、生长因子和细胞进行软骨的缺损修复,其中,支架能为细胞提供生长和分泌胞外基质的场所。现今,支架所用的材料包括天然材料和合成材料。天然材料有胶原蛋白、纤维蛋白、壳聚糖、海藻酸、蚕丝蛋白和软骨源性基质等,合成材料有聚乙二醇、聚羟烷基酯、聚乙烯醇等[1]。胶原是细胞外基质(extra cellular matrix, ECM)的主要成分,能够保持软骨细胞的三维表型和黏多糖的生成[2],其缺点是力学性能较差且降解太快。壳聚糖是自然界唯一的碱性多糖,具有很好的力学性能和生物相容性,而且壳聚糖及其衍生物有一定的抗菌和抗氧化能力。此外,壳聚糖和胶原能形成分子水平稳定的混合物[3],因此,胶原与壳聚糖混合支架在组织工程中被广泛应用。然而,胶原和壳聚糖的单纯混合仍有缺点,例如体内降解过快、力学性能不足等,需要将各种交联方法应用到支架中以提高其稳定性和力学性能。物理交联方法有干热、紫外、电子束和γ辐射。其中,干热交联易破坏胶原结构;紫外交联能量太低,不足以穿透整个支架[4];电子束能量也不足以穿透厚样本[5];γ辐射是新近应用于胶原交联的方法,穿透能力强,能均匀诱发交联[6-7],但交联伴随降解。Zhang等[8]用不同剂量的γ辐射交联胶原,发现25 kGy下得到的胶原有更好的生物相容性和力学性能。此外,壳聚糖在γ辐射下能降解为低分子量的链段[9]。常用的化学交联剂有戊二醛、EDC、京尼平、原花青素、双铨纤维素等。戊二醛由于毒性高已很少应用于胶原的交联;EDC和京尼平由于低毒性和高交联度而被广泛使用[10-11]。
本工作设计了11组壳聚糖质量分数(壳聚糖:胶原)为0%~50%的胶原壳聚糖支架。根据交联方法设置3个平行实验组:EDC/NHS组,γ辐射组和对照组。采用SEM和FTIR分别检测支架的孔径和交联情况,同时测定各组支架的吸水率(S)、孔隙率(P)、Ⅰ型胶原酶降解速率(D)和力学性能,以此评估胶原的性能,通过体外细胞培养检测支架的毒性和生物相容性。
1 实验材料与方法 1.1 主要试剂及原料壳聚糖(脱乙酰度90%),购自济南海得贝海洋生物工程有限公司;Ⅰ型胶原,实验室自制;Ⅰ型胶原酶(125 unit/mg),购自美国sigma公司;EDC和NHS,购自上海晶纯生化科技股份有限公司。
1.2 胶原壳聚糖支架的制备分别制备质量浓度为2%的胶原和壳聚糖凝胶,以5%梯度混合两种凝胶,制备11组壳聚糖质量分数为0%~50%的胶原壳聚糖混合凝胶。将不同含量的胶原壳聚糖混合物转移到6孔板,每种混合凝胶分3个组:γ辐射组(γ-ray),EDC/NHS组(EDC)和对照组(Non)。对照组直接冻干得到支架; γ辐射组凝胶置于60Co设备下, 以辐射强度20 Gy/min、辐射总剂量25 kGy照射,辐射在常温、常压下进行。辐照后的胶原用冷冻干燥机冻干,制得物理交联多孔支架; EDC/NHS组凝胶置于-20 ℃下10 h,冻干制得支架。干燥环境下测定支架的质量,在每克支架中加入EDC 1.720 g,NHS 1.032 g,MES缓冲液215 mL,37 ℃反应4 h。交联后的支架用Na2HPO4溶液(0.1 mol/L, 2 h),NaCl溶液(4 mol/L, 4次, 24 h),去离子水(5次,24 h)洗去交联剂。最后,将支架置于冷冻干燥机中冻干,得到化学交联多孔支架。以组合壳聚糖质量分数对3组不同支架定义名称,如γ-ray组,EDC组和Non组中壳聚糖质量分数为25%的支架分别为γ-ray-Chi25%, EDC-Chi25%, Non-Chi25%。
1.3 形态学观察和FTIR检测扫描电镜(SEM, 1530VP, LEO)观察不同组支架的表面形态。观察之前,支架浸没液氮后立即掰断获得横截面,然后进行表面喷金,得到样品。将干燥样本与溴化钾粉末混合、研磨,放入压缩机压缩得到薄片,进行FTIR光谱分析,频率为500~4000 nm-1。
1.4 吸水率、孔隙率、降解率和力学性能检测为获得更准确的数据,本实验用虹吸作用除去支架表面水分。首先,测得干胶原质量为m0,然后将胶原置于37 ℃磷酸盐缓冲液(PBS)中4 h,迅速取出支架,置于虹吸管30 s后测得支架质量为m。吸水率为:S=[(m-m0)/m0]×100%。
称量干支架的质量为W0,随后将支架置于纯酒精中,负压吸引排除支架内的空气,称量支架的质量为W1。然后,将支架放入装有3 mL酒精的容器中,记录支架放入后的总体积为V1。支架孔隙率为:P=[(W1-W0)/ ρ]/(V1-3),其中ρ为酒精的密度。
每组支架制成直径6 mm、高5 mm的样本。将支架置于含400 μg/mL Ⅰ型胶原酶, pH=7.4, 37 ℃的PBS中,每天更换溶液。在反应开始后的4, 8, 12, 24, 48, 96, 144, 240 h分别取出一组加入200 μL 0.25 mol/L乙二胺四乙酸溶液终止降解,接着用去离子水清洗(3次,20 min),冻干后称取质量mt。降解率为:D=(m0/mt)×100%。
采用INSTRON 5865力学测试机进行力学性能测试。测量支架的横纵弹性模量,研究交联对支架力学性能的影响。将样品统一制成直径5 mm、高8 mm的小块,每种样品准备3个。置于PBS 24 h后,将样本放在力学测试机上以30%·min-1形变速率分别进行横向和纵向的压缩。每个样品的预加载为0.1 N。
1.5 统计学分析计量数据以平均数加减标准差表示,使用SPSS 19.0和Origin 9.0对数据进行单因素分析和方差分析。概率P < 0.05有统计学意义。
2 结果与分析 2.1 交联后支架分子结构分析γ辐射下,水分子吸收辐射能量后能释放多种活性粒子,包括O2-,·OH,·H和eaq-等,胶原分子在这些活性粒子的作用下产生互相交联[10], 壳聚糖在γ辐射下降解为低分子量的产物,且壳聚糖占比越高支架颜色越黄。Yoksan等[9]研究发现,γ辐射后壳聚糖的降解只发生在非晶区,导致降解后的壳聚糖分子量在105~106数量级,且γ辐射后产生的电子集中在糖苷键,断裂C1—O,得到2个低分子量的壳聚糖。图 1为γ辐射支架结构。由图 1(a)可知,3350, 1660, 1552, 1082, 656 cm-1峰分别表示N—H拉伸,C=O拉伸, N=H弯曲,C—O—C拉伸,C—OH面外弯曲。3350, 1552 cm-1处峰值的变化说明胶原在γ辐射下发生改变。1660, 1082, 656 cm-1处峰值在γ辐射组的降低说明壳聚糖C—O—C断裂产生低分子量壳聚糖,且碳环的断裂预示着低分子量壳聚糖与胶原反应的可能性(图 1(b))。

|
图 1 γ辐射支架结构分析 (a)壳聚糖质量分数50%时γ辐射组和对照组的FTIR光谱图;(b)壳聚糖与胶原可能的交联反应 Fig. 1 Structure analysis of γ-irradiation scaffolds (a)FTIR spectra of Non and γ-ray with 50% chitosan amount; (b)proposed reaction between collagen and chitosan |
EDC/NHS交联剂能连接壳聚糖或胶原上的氨基与天冬氨酸或谷氨酸残基上的羧基,而交联剂本身不复合进支架。
2.2 胶原形态学观察图 2为Non组,γ-ray组和EDC组含不同质量分数(0%, 25%, 50%)壳聚糖时支架的SEM图。可以看出,3组支架都有不同程度的交联。相对来说,EDC组交联程度最高,γ-ray组交联程度最低,原因可能是辐射过程中胶原与壳聚糖降解导致;且壳聚糖质量分数不同,交联程度也不同,壳聚糖质量分数为25%的支架明显比0%,50%的支架交联程度高,说明制作胶原壳聚糖支架时,壳聚糖质量分数在25%左右最适宜细胞黏附。观察孔径发现,γ-ray组中壳聚糖的有无直接影响孔径的大小,而Non组和EDC组,随壳聚糖质量分数增高孔径增大;从孔径均匀度来看,壳聚糖质量分数在25%时支架孔径最均匀,且EDC组均匀度最高(表 1)。壳聚糖的加入使γ辐射过程中胶原支架发生根本性改变,壳聚糖质量分数为25%时胶原壳聚糖支架交联后的效果较好。

|
图 2 Non组(1),γ-ray组(2)和EDC组(3)不同壳聚糖质量分数时支架的SEM图 (a)0%;(b)25%;(c)50% Fig. 2 SEM images of Non(1), γ-ray(2) and EDC groups(3) scaffolds with different chitosan ratios (a)0%;(b)25%;(c)50% |
| Non group/μm | γ-ray group/μm | EDC group/μm | ||||||||
| 0% | 25% | 50% | 0% | 25% | 50% | 0% | 25% | 50% | ||
| 98.6±9.9 | 123.5±32.1 | 143.4±27.3 | 824.9±103.1 | 112.3±14.2 | 157.6±21.9 | 68.1±14.7 | 118.6±7.2 | 146.2±20.1 | ||
SEM结果表明壳聚糖质量分数为25%时交联最好,因此对壳聚糖质量分数25%时各种交联支架做FTIR检测。图 3为Non组,γ-ray组和EDC组的FTIR谱图。胶原中有9种酰胺键,为酰胺A, B和酰胺Ⅰ-Ⅶ,谱图中最常检测的是酰胺Ⅱ, Ⅲ[12]。2931, 1403 cm-1峰分别表示壳聚糖分子链上的CH2和C—O拉伸,3354, 3080, 1660, 1556, 1238 cm-1峰分别表示胶原分子上酰胺A的N—H拉伸、酰胺B的C=O拉伸、酰胺Ⅰ的N—H弯曲、酰胺Ⅱ的C—N拉伸、酰胺Ⅲ的N—H拉伸。可以看出,随着交联方式从空白到物理交联再到化学交联,红外光谱吸收峰逐渐升高,如3354 cm-1和1660 cm-1处。EDC组在1238, 1556, 1660 cm-1处的峰值要高于γ-ray组和Non组的峰值。这几个位点是胶原与壳聚糖交联产生酰胺键的位点,而EDC/NHS化学交联度高于γ辐射物理交联[13],说明交联度越高,酰胺键越多。此外也检测了与壳聚糖相关的基团。2931, 1403 cm-1分别代表壳聚糖CH2拉伸和CH2—OH中的C—O拉伸[14],EDC/NHS组的峰值高于γ-ray组。
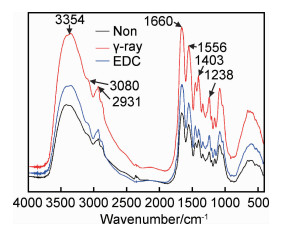
|
图 3 25%壳聚糖时3组支架的FTIR谱图 Fig. 3 FTIR spectra of three groups scaffolds with 25%chitosan amount |
为了明确壳聚糖的最佳质量分数,本实验取EDC组、γ-ray组、Non组支架的11个壳聚糖质量分数(0%~50%)进行吸水率、孔隙率和力学性能分析,同时检测0%, 25%, 50%壳聚糖时支架降解率。图 4和表 2分别为3组支架的吸水率、孔隙率、横向和纵向弹性模量与不同质量分数壳聚糖的关系曲线及相关数据。

|
图 4 Non组,γ-ray组和EDC组在不同壳聚糖质量分数时的支架性能参数 (a)吸水率;(b)孔隙率;(c)横向弹性模量;(d)纵向弹性模量 Fig. 4 Property parameters of Non, γ-ray and EDC groups scaffolds with different chitosan ratios (a)swelling ratio; (b)porosity; (c)transverse modulus; (d)longitudinal modulus |
| Group | Swelling ratio/% | Porosity/% | Transverse modulus/kPa | Longitudinal modulus/kPa |
| Non | 18.45±3.74 | 0.94±0.38 | 32.96±9.5 | 48.50±11.83 |
| γ-ray | 12.90±4.26 | 0.72±0.18 | 17.94±6.18 | 24.19±9.35 |
| EDC | 21.39±4.37 | 0.87±0.43 | 40.02±22.41 | 54.54±17.18 |
图 4(a)为不同壳聚糖质量分数与吸水率的变化曲线。可以看到,EDC/NHS改性后的吸水率好于对照组和γ辐射组,且组间对比差异显著(Non & γ-ray,Non & EDC和γ-ray & EDC组间进行比较,概率P值分别为0.011,0.013和0.001);壳聚糖质量分数为25%时各组吸水率最高。由于吸水率的大小与物质的亲水性和支架的微结构有关[2],而胶原与壳聚糖都是亲水物质,而且由图 4可以看到,γ辐射后支架的孔隙率和力学性能明显比对照组差,说明γ辐射后支架的微结构遭到破坏。图 4(b)为孔隙率随壳聚糖质量分数的变化曲线。可知3组的孔隙率为:Non组>EDC组>γ-ray组,且差异有统计学意义(Non & γ-ray,Non & EDC和γ-ray & EDC组间进行比较,P值分别为0.004,0.002和0.03),且壳聚糖质量分数为25%时孔隙率最高。研究表明,交联会降低物质的亲水性,从而引起吸水率和孔隙率的下降。EDC/NHS改性后吸水率增加,而孔隙率降低,原因可能是EDC/NHS改性能增强支架的微结构,而降低物质的亲水性。
由于支架置于身体内常受到挤压,因此本实验使用力学测试机压缩湿润的支架来模拟体内环境[15]。图 4(c),(d)为支架的横纵弹性模量随壳聚糖质量分数的变化曲线。可知,γ辐射后支架的力学性能呈稳定的下降趋势,横向稳定在18 kPa左右,纵向稳定在24 kPa左右;EDC/NHS改性不会使横向和纵向弹性模量产生显著性变化(横向弹性模量中Non & γ-ray,Non & EDC和γ-ray & EDC组间进行比较,P值分别为0,1和0.026;纵向弹性模量中Non & γ-ray,Non & EDC和γ-ray & EDC组间进行比较,P值分别为0.001,0.132和0)。通过比较Non,γ-ray和EDC各组内的横向和纵向弹性模量,发现两者有显著差异(Non组,γ-ray组和EDC组的P值分别为0.018,0.036和0.001),且纵向弹性模量大于横向弹性模量,说明化学交联和物理交联并不是单方向交联,支架具有很好的取向性,能够更好地促进细胞生长,从而修复受损组织。
图 5为3种不同壳聚糖质量分数时Non组, γ-ray组和EDC组支架在Ⅰ型胶原酶作用不同时间的降解率。可知,γ-ray组降解速率明显比Non组和EDC组高。25%质量分数组降解最慢,且最稳定,其原因可能是胶原酶降解三螺旋胶原甘氨酸和亮氨酸间的化学键,而过多的壳聚糖会阻碍胶原酶接触到化学键[16]。EDC组降解最慢,10天后依然有75%的支架,满足支架植入体内的时间要求。
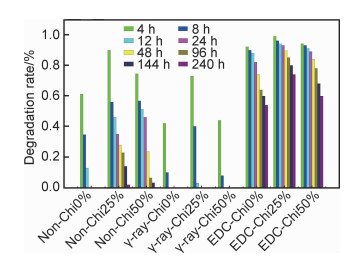
|
图 5 3种不同壳聚糖质量分数时Non组, γ-ray组和EDC组支架在Ⅰ型胶原酶作用不同时间的降解率 Fig. 5 Degradation rate of Non, γ-ray and EDC groups with three chitosan amounts after digestion in collagenase type Ⅰ for different time |
(1)γ辐射能够一定程度上交联胶原壳聚糖支架,但辐射对支架的破坏作用大于交联作用。
(2) EDC/NHS交联能很好地改善胶原壳聚糖支架的性能,其吸水率、孔隙率、降解率、力学性能均优于γ辐射支架,但会降低支架的亲水性。
(3) 壳聚糖的加入明显改善支架性能,壳聚糖质量分数为25%时,EDC/NHS改性后得到最佳的胶原壳聚糖支架。
| [1] |
YE K, RAED F, MOULTON S E, et al. Bioengineering of articular cartilage:past, present and future[J]. Regenerative Medicine, 2013, 8(3): 333-349. DOI:10.2217/rme.13.28 |
| [2] |
YAN L P, WANG Y J, LI R, et al. Genipin-cross-linked collagen/chitosan biomimetic scaffolds for articular cartilage tissue engineering applications[J]. Journal of Biomedical Materials Research Part A, 2010, 95(2): 465-475. |
| [3] |
SIONKOWSKA A, WISNIEWSKI M, SKOPINSKA J, et al. Molecular interactions in collagen and chitosan blends[J]. Biomaterials, 2004, 25(5): 795-801. DOI:10.1016/S0142-9612(03)00595-7 |
| [4] |
AKHTAR S. Evaluation of hydrogels for bio-printing applications[J]. Journal of Biomedical Materials Research Part A, 2013, 101(1): 272-284. |
| [5] |
SAENGTHONG S, PIROONPAN T, TANGTHONG T, et al. Fabrication of microporous chitosan/silk fibroin as a scaffold material using electron beam[J]. Macromolecular Research, 2014, 22(7): 717-724. DOI:10.1007/s13233-014-2103-0 |
| [6] |
CATALDO F, URSINI O, LILLA E, et al. Radiation-induced crosslinking of collagen gelatin into a stable hydrogel[J]. Journal of Radioanalytical & Nuclear Chemistry, 2008, 275(275): 125-131. |
| [7] |
ZHANG Y Q, ZHANG X M, XU L, et al. Radiation cross-linked collagen/dextran dermal scaffolds:effects of dextran on cross-linking and degradation[J]. Journal of Biomaterials Science Polymer Edition, 2015, 26(3): 162-180. DOI:10.1080/09205063.2014.985023 |
| [8] |
ZHANG X, XU L, HUANG X, et al. Structural study and preli-minary biological evaluation on the collagen hydrogel crosslinked by γ-irradiation[J]. Journal of Biomedical Materials Research Part A, 2012, 100(11): 2960-2969. |
| [9] |
YOKSAN R, AKASHI M, MIYATA M, et al. Optimal γ-ray dose and irradiation conditions for producing low-molecular-weight chitosan that retains its chemical structure[J]. Radiation Research, 2004, 161(4): 471-480. DOI:10.1667/RR3125 |
| [10] |
CHIONO V, PULIERI E, VOZZI G, et al. Genipin-crosslinked chitosan/gelatin blends for biomedical applications[J]. Journal of Materials Science Materials in Medicine, 2008, 19(2): 889-898. DOI:10.1007/s10856-007-3212-5 |
| [11] |
MADHAVAN K, BELCHENKO D, MOTTA A, et al. Evaluation of composition and crosslinking effects on collagen-based composite constructs[J]. Acta Biomaterialia, 2009, 6(4): 1413-1422. |
| [12] |
STUART B H. Infrared spectroscopy:fundamentals and applications[J]. Experimental Thermodynamics, 2004, 41(4): 325-385. |
| [13] |
LEE C R, GRODZINSKY A J, SPECTOR M. The effects of cross-linking of collagen-glycosaminoglycan scaffolds on compressive stiffness, chondrocyte-mediated contraction and biosynthesis[J]. Biomaterials, 2001, 22(23): 3145-3154. DOI:10.1016/S0142-9612(01)00067-9 |
| [14] |
SHANMUGASUNDARAM N, RAVICHANDRAN P, REDDY P N, et al. Collagen-chitosan polymeric scaffolds for the in vitro culture of human epidermoid carcinoma cells[J]. Biomaterials, 2001, 22(14): 1943-1951. DOI:10.1016/S0142-9612(00)00220-9 |
| [15] |
MURUGAN R, RAMAKRISHNA S. Design strategies of tissue engineering scaffolds with controlled fiber orientation[J]. Tissue Engineering, 2007, 13(8): 1845-1866. DOI:10.1089/ten.2006.0078 |
| [16] |
WANG Z, MA Y S, MU C Z. Preparation and biological characteristics of collagen-chitosan composite scaffold:proportion of chitosan and collagen[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2010, 14(29): 5367-5370. |
 2020, Vol. 48
2020, Vol. 48


