文章信息
- 李进, 候冰娜, 韩超越, 倪凯, 赵梓年, 李征征
- LI Jin, HOU Bing-na, HAN Chao-yue, NI Kai, ZHAO Zi-nian, LI Zheng-zheng
- 可注射乙酰化乙二醇壳聚糖/泊洛沙姆复合水凝胶的制备及药物缓释研究
- Preparation of injectable N-acetyl glycol chitosan/poloxamer composite hydrogel for drug release
- 材料工程, 2020, 48(5): 83-90
- Journal of Materials Engineering, 2020, 48(5): 83-90.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.001004
-
文章历史
- 收稿日期: 2019-11-05
- 修订日期: 2019-12-04
2. 天津科技大学 天津市制浆造纸重点实验室, 天津 300457;
3. 复旦大学 聚合物分子工程国家重点实验室, 上海 200433;
4. 天津科技大学 天津市海洋资源与化学重点实验室, 天津 300457
2. Tianjin Key Laboratory of Pulp and Paper, Tianjin University of Science & Technology, Tianjin 300457, China;
3. State Key Laboratory of Molecular Engineering of Polymers, Fudan University, Shanghai 200433, China;
4. Tianjin Key Laboratory of Marine Resources and Chemistry, Tianjin University of Science & Technology, Tianjin 300457, China
水凝胶是由亲水聚合物组成的三维网状结构,具有良好的生物相容性,因而在生物医用领域得到了广泛应用[1-4]。温敏性水凝胶由于其能够响应温度变化而发生体积相变或溶胶-凝胶转变,在室温下为具有良好流动性的液体,而当温度升高至接近体温时则转变为水凝胶[2]。近年来,对温敏性水凝胶作为原位形成可注射凝胶体系的研究受到广泛关注[5-7]。温敏性可注射水凝胶由于独特的温敏性溶胶-凝胶转变行为,使其在注射前实现对药物或细胞的封装,而在注射位点迅速形成凝胶,达到局部给药的效果[8-10],因而在药物缓释载体及组织工程支架等领域得到广泛应用[11-12]。
泊洛沙姆(poloxamer)是一种聚氧乙烯-聚氧丙烯-聚氧乙烯(PEO-PPO-PEO)三嵌段共聚物,其化学式为HO[CH2CH2O]x[CH2CH3]CH2O]y[CH2CH2O]xOH,y>14。当泊洛沙姆达到临界凝胶温度时,在水溶液中,泊洛沙姆链上疏水性PPO嵌段脱水,PEG遇水膨胀,从而形成了以PPO为疏水内核,PEG为亲水外核的球状胶束,当温度升高,加剧了胶束的缠结和堆砌,从而发生溶胶-凝胶转变行为[13-14]。泊洛沙姆这种独特的疏水内核-亲水外核的结构特点,可应用于药物载体,亲水性药物分布在胶束外的自由溶剂中,而疏水性药物则被包裹在胶束内部[14]。PPO-PEO-PPO三嵌段结构具有可逆的溶胶-凝胶转变特性,在注射给药方面有很大的应用前景[15-16]。然而,在实际应用中,泊洛沙姆也存在着一些问题,如泊洛沙姆的温敏性是有局限性的,其对浓度有很大的依赖性,当浓度为15.0%(质量分数, 下同)~30.0%时才能够形成凝胶。泊洛沙姆水凝胶药物释放时间较短(1~2天),难以达到药物缓释效果,使得泊洛沙姆407在药物载体中的应用受到一定限制[17-19]。
乙酰化乙二醇壳聚糖(GC)是由乙二醇壳聚糖通过N-乙酰化反应制得的一种温敏性高分子。乙酰化乙二醇壳聚糖溶液具有热可逆温敏性溶胶-凝胶转变行为,通过控制乙酰化乙二醇壳聚糖的乙酰度和溶液浓度,能够使溶胶-凝胶转变温度处于室温至体温(25~37 ℃)之间。前期研究表明乙酰化乙二醇壳聚糖的溶胶-凝胶转变浓度较低(4%~7%),具有高度孔隙化且孔隙之间相互连通的三维结构,并对抗癌药物吉西他滨具有缓释作用,载药凝胶的释药时间可达3~5天[20]。
本研究为降低泊洛沙姆温敏水凝胶的溶胶-凝胶转变浓度,以乙酰化乙二醇壳聚糖(GC,乙酰度为89.90%)与泊洛沙姆407(P407)制备复合温敏水凝胶,考察了不同质量比对GC/P407复合水凝胶性能的影响。采用傅里叶红外光谱(FT-IR)、试管倒置法、扫描电子显微镜(SEM)和旋转流变仪对GC/P407复合水凝胶结构特征、温敏性、微观形貌和动态黏弹性进行表征,并考察了GC/P407的质量比对其溶胶-凝胶转变温度及溶胀性质的影响。以吉西他滨为模型药物,采用紫外-可见分光(UV-vis)光度计,对GC/P407水凝胶在37 ℃下的体外药物释放性能进行了测试。
1 实验材料与方法 1.1 试剂与仪器乙二醇壳聚糖购于和光制药工业株式会社,纯度为60%,聚合度>400;乙酸酐(Ac2O)购于西亚试剂公司,纯度为99.5%;无水甲醇购于天津博迪化工股份有限公司,纯度>99.5%;吉西他滨,纯度>99%,购于上海阿拉丁生物科技有限公司。泊洛沙姆407购于德国巴斯夫有限公司,分析纯。
1.2 实验过程称取0.3 g乙二醇壳聚糖粉末于烧杯中,加入45 mL去离子水,磁力搅拌至粉末完全溶解。加入45 mL无水甲醇,磁力搅拌15~20 min后,按照乙酸酐与乙二醇壳聚糖上氨基摩尔比移取一定量的乙酸酐,并在磁力搅拌下,缓慢滴加到烧杯中,反应24 h后,将溶液倒入渗析袋中,用大量去离子水渗析2天,经冷冻干燥后,得到白色絮状的乙酰化乙二醇壳聚糖产物[20]。
GC/P407复合水凝胶制备的具体步骤为:称取一定质量比(0.3:1,0.5:1,0.7:1,1.0:1)的GC和泊洛沙姆407于血清瓶中,加入1 mL去离子水,用漩涡振荡器振荡5~10 min,在4 ℃下溶解1天,制得GC/P407复合水凝胶样品。
1.3 测试与性能表征采用MAGNA560型傅里叶红外光谱仪对GC/P407复合水凝胶样品进行红外光谱测定,样品用KBr压片,波数范围为400~4000 cm-1,扫描32次,分辨率为4 cm-1。采用JSM-7000F型场致发射扫描电子显微镜观察GC/P407复合水凝胶的微观形貌。GC/P407复合水凝胶进行液氮淬冷,制成切片,冷冻干燥24 h后进行喷金处理。
通过RS6000旋转流变仪测试GC/P407复合水凝胶的动态黏弹性。将水凝胶样品放置于行板之间,调节板间距为1.0 mm。设定温度为37 ℃,测定储能模量(G′)和损耗模量(G″)随时间(0~1000 s)和频率(0~10 Hz)的变化关系;测定G′和G″随温度(5~45 ℃)变化关系,测试条件为频率1 Hz,应变0.1%,G′与G″曲线的交点则为溶胶-凝胶温度转变点。
通过Mini-1024型紫外-可见分光光度计(UV-vis)测试GC/P407复合水凝胶对抗癌药物吉西他滨的体外药物释放性能。在4 ℃下,将GC/P407和吉西他滨溶于PBS溶液中。在5 mL的试管中配制1 mL的GC/P407溶液,吉西他滨的最终浓度为10 mg/mL,在37 ℃保持30 min,制得GC/P407载药凝胶。将每个试管中的载药凝胶顶部缓慢滴加3 mL PBS后,置于37 ℃的恒温水浴摇床中进行培养,振荡速度为20 r/min,经过一定时间后,将3 mL PBS移除,并加入等体积的新鲜PBS来补偿释放介质。释放介质中药物浓度和累积释放量可通过吉西他滨标准曲线计算,其中标准曲线通过Mini-1024型紫外-可见分光光度计绘制。
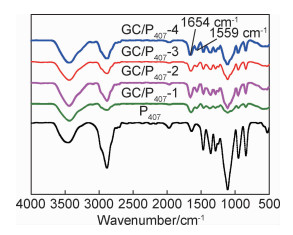
2 结果与分析 2.1 GC/P407复合水凝胶的制备与表征以泊洛沙姆407为基底,固定P407浓度为6%,分别加入不同量的GC制备GC/P407复合水凝胶,并测试溶胶-凝胶转变温度,配方如表 1所示。图 1为泊洛沙姆407和不同质量比(0.3:1,0.5:1,0.7:1,1.0:1)的GC/P407复合水凝胶样品的红外光谱图。结果表明,与泊洛沙姆407谱图相比,GC/P407样品在1654, 1559 cm-1处分别出现酰胺基上羰基和N—H的弯曲振动峰,说明成功制得GC/P407复合水凝胶。
| Sample | Mass ratio | T/℃ |
| GC/P407-1 | 0.3:1 | 39.1 |
| GC/P407-2 | 0.5:1 | 37.6 |
| GC/P407-3 | 0.7:1 | 34.3 |
| GC/P407-4 | 1.0:1 | 28.5 |
|
图 1 不同质量比GC/P407的复合水凝胶样品的红外光谱图 Fig. 1 FT-IR spectra of GC/P407 composite hydrogel with different mass ratio |
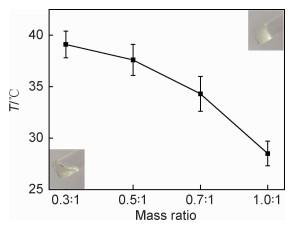
通过试管倒置法测定了不同配比的GC/P407复合水凝胶的溶胶-凝胶转变温度。图 2为GC/P407复合水凝胶的溶胶-凝胶化转变温度随GC/P407的质量比变化关系。浓度为6%纯泊洛沙姆407样品未出现溶胶-凝胶转变,GC/P407复合水凝胶的溶胶-凝胶转变温度为28.5~39.1 ℃之间,样品GC/P407(0.3:1,0.5:1,0.7:1,1.0:1)凝胶化温度分别为39.1,37.6,34.3,28.5 ℃。结果表明,随着GC与P407的质量比增加,溶胶-凝胶转变温度降低。通过控制GC的加入量使GC/P407复合水凝胶的溶胶-凝胶化转变温度控制在25~37 ℃之间,有利于其应用在药物缓释载体。此外,当温度由体温降至室温时,凝胶状的GC/P407复合水凝胶会重新转变为溶胶状态,这一现象说明GC/P407的溶胶-凝胶转变行为具有热可逆性。
|
图 2 管反转法测定的GC/P407的溶胶-凝胶转变相图 Fig. 2 Sol-gel transition phase diagram of GC/P407 measured by tube inverting method |
图 3为不同质量比的GC/P407复合水凝胶的微观形貌。GC/P407复合水凝胶具有高度孔隙化且孔隙之间相互连通的结构特点,且孔径在10~60 μm范围内。其中样品GC/P407(0.3:1,0.5:1,0.7:1,1.0:1)的孔径范围分别为42~60 μm,40~58 μm,33~52 μm,10~34 μm,随着GC/P407质量比的增加,孔径逐渐缩小。随着GC的加入,GC的疏水基团乙酰基增多,在温度升高时,GC/P407复合水凝胶的疏水作用增强,进而使交联密度增加,导致了孔径逐渐缩小。结果说明,通过控制GC/P407的质量比能够实现对孔径的调节。GC/P407复合水凝胶具有多孔隙网状结构,在药物缓释载体及组织工程支架方面具有潜在的应用价值。

|
图 3 比例为0.3:1(a),0.5:1(b),0.7:1(c)和1.0:1(d)的GC/P407复合水凝胶的FE-SEM图 Fig. 3 FE-SEM images of GC/P407 composite hydrogel with different ratio 0.3:1(a), 0.5:1(b), 0.7:1(c) and 1.0:1(d) |
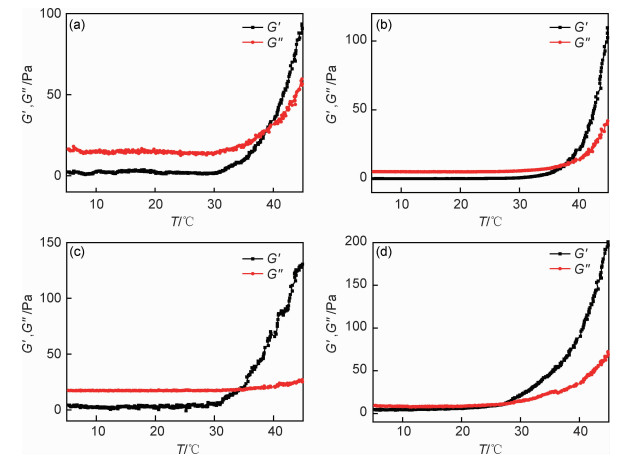
通过流变学研究确定GC/P407复合水凝胶的黏弹性与温度的关系。图 4为GC/P407复合水凝胶的储能模量(G′)和损耗模量(G″)随温度的变化曲线。不同质量比(0.3:1,0.5:1,0.7:1,1.0:1)的GC/P407复合水凝胶的Tgel值分别为39.1,37.6,34.3, 28.5 ℃。在初始温度范围(低于Tgel),G′低于G″,表明GC/P407没有发生溶胶-凝胶转变。随着温度升高超过Tgel,GC/P407的G′迅速增加,导致在特定温度Tgel下与G″交叉,表明GC/P407发生溶胶-凝胶相变。由于GC的添加,增强了GC/P407的疏水相互作用,GC/P407复合水凝胶比泊洛沙姆407水凝胶在更低的浓度下表现出温敏性溶胶-凝胶转变。随着GC量的增加,溶胶-凝胶转变温度逐渐降低。通过控制GC添加量能够控制GC/P407水凝胶的溶胶-凝胶转变温度,降低泊洛沙姆407在体温下的溶胶-凝胶转变浓度。与其他温敏水凝胶体系相比,乙酰化乙二醇壳聚糖和泊洛沙姆本身具有温度敏感性,不需要引入其他化学添加剂(如交联剂,盐等),更适合在生物医学领域的应用。
|
图 4 比例为0.3:1(a),0.5:1(b),0.7:1(c)和1.0:1(d)的GC/P407复合水凝胶的温度依赖性流变行为 Fig. 4 Temperature dependent rheological behavior of GC/P407 composite hydrogel with different ratio 0.3:1(a), 0.5:1(b), 0.7:1(c) and 1.0:1(d) |
图 5为不同质量比(0.3:1,0.5:1,0.7:1,1.0:1)的GC/P407水溶液在37 ℃下的时间依赖性流变行为,其凝胶时间分别在941,826,493, 382 s。随着GC量的增加,GC/P407水溶液在37℃下表现出更快的溶胶-凝胶转变。由于随着GC的加入,GC的疏水基团乙酰基增多,GC/P407复合水凝胶的疏水作用增强,导致溶胶-凝胶转变加快。

|
图 5 比例为0.3:1(a),0.5:1(b),0.7:1(c)和1.0:1(d)的GC/P407复合水凝胶的时间依赖性流变行为 Fig. 5 Time dependent rheological behavior of GC/P407 composite hydrogel with different ratio 0.3:1(a), 0.5:1(b), 0.7:1(c) and 1.0:1(d) |
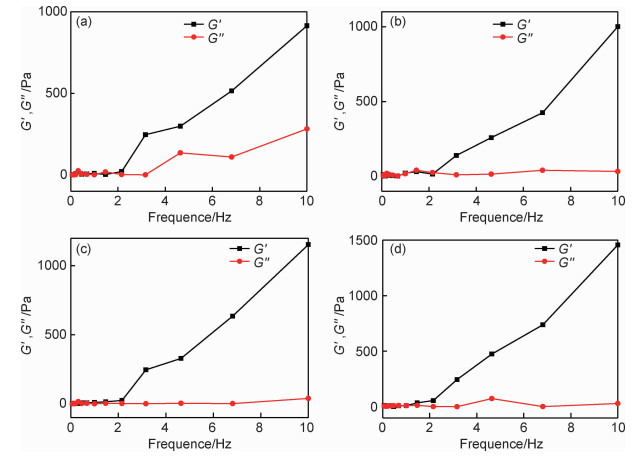
采用流变仪研究了GC/P407复合水凝胶的力学性能。图 6为GC/P407复合水凝胶的G′和G″随频率的变化曲线。不同质量比(0.3:1,0.5:1,0.7:1,1.0:1)的GC/P407复合水凝胶的最高G′值分别为914.254,1001.037,1153.395, 1456.414 Pa。GC/P407水凝胶(1.0:1)的G′值高于其他组分水凝胶的G′值,随着GC含量增加,在温度升高时GC/P407的疏水相互作用增强,具有较高的交联密度。因此,GC的加入可以提高泊洛沙姆水凝胶的机械强度,并扩展其在生物医学领域的应用[21]。
|
图 6 比例为0.3:1(a),0.5:1(b),0.7:1(c)和1.0:1(d)的GC/P407复合水凝胶的频率依赖性流变行为 Fig. 6 Frequency dependent rheological behavior GC/P407 composite hydrogel with different ratio 0.3:1(a), 0.5:1(b), 0.7:1(c) and 1.0:1(d) |
图 7为GC/P407复合水凝胶在37 ℃下溶胀行为随时间的变化曲线。不同质量比(0.3:1,0.5:1,0.7:1,1.0:1)的GC/P407复合水凝胶的最高溶胀率分别为1.34,1.26,1.19,1.15,即GC/P407复合水凝胶的溶胀率取决于GC添加量。GC/P407水凝胶(1.0:1)的溶胀率低于其他组分水凝胶,这是由于GC含量较高,疏水基团乙酰基增多使得聚合物疏水相互作用增强,交联密度增加。GC/P407复合水凝胶的溶胀平衡时间分别为8,11,14 h和14 h。结果表明,GC的质量比越高,当温度升高时,GC/P407复合水凝胶的疏水相互作用越强,交联密度越高,吸水速度越慢,溶胀率越低[22]。
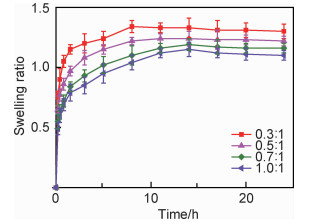
|
图 7 GC/P407复合水凝胶的溶胀性能 Fig. 7 Swelling properties of GC/P407composite hydrogel |
将吉西他滨作为模型药物载入GC/P407复合水凝胶中进行体外累积药物释放率研究。图 8为GC/P407复合水凝胶在37 ℃下的吉西他滨体外释放随时间的变化曲线。累积药物释放率Ar可通过式(1)[23]计算:
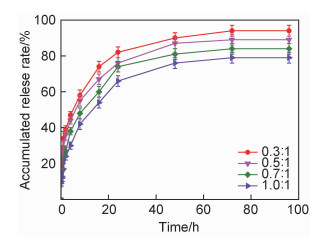
|
图 8 GC/P407复合水凝胶的体外药物释放性能 Fig. 8 In vitro release profiles of GC/P407 composite hydrogel |

|
(1) |
式中:V0为释放介质的总体积;ct为某测量点的PBS中吉西他滨的浓度;V为每次所取PBS的体积;t为测试药物释放次数;c为每次取PBS的浓度;n为表征释放机制的释放指数;m为GC/P407复合水凝胶的载药量。
如图 8所示,在初始阶段,GC/P407复合水凝胶发生一定程度的突释,且累积药物释放率小于20%,有助于初期抑制肿瘤的生长。随着释放时间的延长,药物释放速率逐渐减慢,曲线斜率接近零,表明GC/P407复合水凝胶的药物释放达到平衡。在释放初期,药物在载药凝胶表面和释放介质之间的浓度梯度较大,进而导致突释现象的出现。随着时间的延长,GC/P407复合水凝胶内部的药物向外扩散,载药凝胶和释放介质中药物的浓度梯度逐渐降低,使得药物释放速率减缓。GC/P407复合水凝胶的药物释放可达72 h,表明GC/P407复合水凝胶在药物释放中具有缓释作用,可作为一种新型抗癌药物释放载体。
2.7 药物释放动力学通过绘制累积吉西他滨释放量与时间的关系图并将实验释放数据拟合到下面的幂律方程中确定指数来分析药物释放动力学[24]。
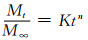
|
(2) |
式中:Mt和M∞分别是在时间t和平衡时释放药物的累积量;K是与水凝胶基质和药物性质有关的速率常数;n是表征释放机制的释放指数。
根据n的数值,分为4种释放模式:(1)n=0.5的值表明Fickian或Case Ⅰ释放行为;(2)n=1的值是指non-Fickian或Case Ⅱ释放方式,形态突然变化,其药物载体具有突释行为;(3)如果0.5 < n < 1,则释放行为异常,其载体结构松弛;(4)n < 值表示pseudo-Fickian释放行为,其中释放曲线类似于Fickian曲线,但最终平衡非常缓慢[24]。
如表 2所示,所有水凝胶释放中的n值在0.29至0.46的范围内,显示出Pseudo-Fickian机制,这表明吉西他滨通过扩散方式释放。
| Hydrogel composition | k | n | R2 | Transport mechanism |
| GC/P407-1 | 0.31 | 0.46 | 0.993 | Pseudo-Fickian |
| GC/P407-2 | 0.27 | 0.37 | 0.991 | Pseudo-Fickian |
| GC/P407-3 | 0.25 | 0.30 | 0.991 | Pseudo-Fickian |
| GC/P407-4 | 0.24 | 0.29 | 0.992 | Pseudo-Fickian |
(1) 将GC与泊洛沙姆407复合制备GC/P407复合水凝胶,GC/P407复合水凝胶能够降低泊洛沙姆407在体温下的成胶浓度,使溶胶-凝胶转变温度处于室温与体温(25~37 ℃)之间。
(2) 随着GC质量比的增大,GC/P407复合水凝胶的凝胶化时间缩短为382 s。GC/P407复合水凝胶具有高度孔隙化的三维结构,其孔径大小处于10~60 μm范围内,且表现出较高的力学性能(1.46 kPa)。
(3) GC/P407复合水凝胶对抗癌药物吉西他滨具有缓释作用,载药凝胶的释药时间可达72 h。因此,GC/P407复合水凝胶在可注射药物缓释载体方面具有很好的应用前景。
| [1] |
SADIA A, SHAISTA K, ATIF I, et al. Controlled release of Montelukast sodium from pH-sensitive injectable hydrogels[J]. Int J Biol Macromol, 2015, 80: 240-245. DOI:10.1016/j.ijbiomac.2015.06.044 |
| [2] |
SIVASHANMUGAM A, RAJENDRAN A K, PRIYA M V, et al. An overview of injectable polymeric hydrogels for tissue engineering[J]. Eur Polym J, 2015, 72: 543-565. DOI:10.1016/j.eurpolymj.2015.05.014 |
| [3] |
CONG T H, NGUYEN M K, LEE D S. Biodegradable pH/temperature-sensitive oligo(β-amino ester urethane) hydrogels for controlled release of doxorubicin[J]. Acta Biomater, 2011, 7: 3123-3130. DOI:10.1016/j.actbio.2011.05.004 |
| [4] |
NGUYEN Q V, DAI P H, PARK J H, et al. Injectable polymeric hydrogels for the delivery of therapeutic agents:a review[J]. Eur Polym J, 2015, 72: 602-619. DOI:10.1016/j.eurpolymj.2015.03.016 |
| [5] |
SYTZE J B, KRISTEL W M B, PIETER J D, et al. Hydrogels in a historical perspective:from simple networks to smart materials[J]. J Control Release, 2014, 190: 254-273. DOI:10.1016/j.jconrel.2014.03.052 |
| [6] |
NIELS M B S, EMILIA B, MATHEW P, et al. Injectable microgel-hydrogel composites for prolonged small-molecule drug delivery[J]. Acta Biomater, 2014, 10: 4143-4155. DOI:10.1016/j.actbio.2014.05.035 |
| [7] |
PAUL Z E, GARY W L, HUA W, et al. A functionalized, injectable hydrogel for localized drug delivery with tunable thermosensitivity:synthesis and characterization of physical and toxicological properties[J]. J Control Release, 2015, 208: 76-84. DOI:10.1016/j.jconrel.2015.03.003 |
| [8] |
LIN C, ZHAO P, LI F, et al. Thermosensitive in situ-forming dextran-pluronic hydrogels through Michael addition[J]. Mater Sci Eng:C, 2010, 30: 1236-1244. DOI:10.1016/j.msec.2010.07.004 |
| [9] |
PAN Z, SUN H, XIE B, et al. Therapeutic effects of gefitinib-encapsulated thermosensitive injectable hydrogel in intervertebral disc degeneration[J]. Biomaterials, 2018, 160: 56-68. DOI:10.1016/j.biomaterials.2018.01.016 |
| [10] |
MONIER M, AYAD D M, WEI Y, et al. Preparation of cross-linked chitosan/glyoxal molecularly imprinted resin for efficient chiral resolution of aspartic acid isomers[J]. Biochem Eng J, 2010, 51: 140-146. DOI:10.1016/j.bej.2010.06.007 |
| [11] |
GAO G, JIANG Y W, JIA H R, et al. Copper oxide nanoparticles induce enhanced radiosensitizing effect via destructive autophagy[J]. Biomaterials, 2019, 188: 83-95. DOI:10.1016/j.biomaterials.2018.09.045 |
| [12] |
LIU X, YANG Y, NIU X, et al. An in situ photocrosslinkable platelet rich plasma-complexed hydrogel glue with growth factor controlled release ability to promote cartilage defect repair[J]. Acta Biomater, 2017, 62: 179-187. DOI:10.1016/j.actbio.2017.05.023 |
| [13] |
LEE CK, CHOI JS, KIM IS, et al. Decanoic acid-modified glycol chitosan hydrogels containing tightly adsorbed palmityl-acylated exendin-4 as a long-acting sustained-release anti-diabetic system[J]. Acta Biomater, 2014, 10: 812-820. DOI:10.1016/j.actbio.2013.10.009 |
| [14] |
LI M, LIU X, TAN L, et al. Noninvasive rapid bacteria-killingan-dacceleration of wound healing through photothermal/photodynamic/copper ion synergistic action of a hybrid hydrogel[J]. Biomater Sci, 2018, 6(8): 2110-2121. DOI:10.1039/C8BM00499D |
| [15] |
JIANG X, LIU H, ZHOU G, et al. Two-dimensional black phosphorus:synthesis, modification, properties, andapplications[J]. J Controlled Release, 2017, 259: 161-162. |
| [16] |
CHYTIL P, SIROVA M, KUDLACOVA J, et al. Bloodstream stability predetermines the antitumor efficacy of micellar polymer-doxorubicin drug conjugates with pH-triggered drug release[J]. Mol Pharm, 2018, 15(9): 3654-3663. DOI:10.1021/acs.molpharmaceut.8b00156 |
| [17] |
ELIE Z, SHREYAR, ROBERTRG, et al. Chitosan-based scaffolds for the support of smooth muscle constructs in intestinal tissue engineering[J]. Biomaterials, 2012, 33: 4810-4817. DOI:10.1016/j.biomaterials.2012.03.051 |
| [18] |
CHO I S, CHO M.O, LI Z, et al. Synthesis and characterization of a new photo-crosslinkable glycol chitosan thermogel for biomedical applications[J]. Carbohydr Polym, 2016, 144: 59-67. DOI:10.1016/j.carbpol.2016.02.029 |
| [19] |
LUO C, XU G, WANG X, et al. Self-reinforcement and protein sustained delivery of hyaluronan hydrogel by tailoring a dually cross-linked network[J]. Mater Sci Eng:C, 2015, 46: 316-324. DOI:10.1016/j.msec.2014.10.066 |
| [20] |
李征征, 徐子扬, 高留意, 等. 温敏性乙二醇壳聚糖水凝胶的制备及药物缓释性能[J]. 高等学校化学学报, 2016, 37(12): 2299-2305. LI Z Z, XU Z Y, GAO L Y, et al. Preparation and characterization of thermo-sensitive N-acetyl glycol chitosanhydrogel for sustained drug release[J]. Chem J Chinese Universities, 2016, 37(12): 2299-2305. DOI:10.7503/cjcu20160513 |
| [21] |
CHEN C, DONG A, YANG J, et al. Preparation and properties of an injectable thermo-sensitive double crosslinking hydrogel based on thiolated chitosan/beta-glycerophosphate[J]. J Mater Sci, 2015, 47(5): 2509-2517. |
| [22] |
XU G K, FENG X Q, LI B, et al. Controlled release and assembly of drug nanoparticles via pH-responsive polymeric micelles:a theoretical study[J]. J Phys Chem:B, 2012, 116(20): 6003-6009. DOI:10.1021/jp3007816 |
| [23] |
HAIDER H, YANG CH, ZHENG WJ, et al. Exceptionally tough and notch-insensitive magnetic hydrogels[J]. Soft Matter, 2015, 11: 8253-8261. DOI:10.1039/C5SM01487E |
| [24] |
FRANSON N M, PEPPAS N A. Influence of copolymer composition on non-fickian water transport through glassy copolymers[J]. J Appl Polym Sci, 1983, 28(4): 1299-131. DOI:10.1002/app.1983.070280404 |
 2020, Vol. 48
2020, Vol. 48


