文章信息
- 李亚, 邓运来, 张劲, 田爱琴, 张勇
- LI Ya, DENG Yun-lai, ZHANG Jin, TIAN Ai-qin, ZHANG Yong
- 7050铝合金第二相溶解行为
- Dissolution behavior of second phases in 7050 aluminum alloy
- 材料工程, 2020, 48(4): 116-122
- Journal of Materials Engineering, 2020, 48(4): 116-122.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.000742
-
文章历史
- 收稿日期: 2019-08-09
- 修订日期: 2019-11-13
2. 中南大学 轻质高强结构材料重点实验室, 长沙 410083;
3. 中南大学 轻合金研究院, 长沙 410083;
4. 中南大学 高性能复杂制造国家重点实验室, 长沙 410083;
5. 中车青岛四方机车车辆股份有限公司, 山东 青岛 266111
2. Science and Technology on High Strength Structural Materials Laboratory, Central South University, Changsha 410083, China;
3. Light Alloy Research Institute, Central South University, Changsha 410083, China;
4. State Key Laboratory of High Performance Complex Manufacturing, Central South University, Changsha 410083, China;
5. CRRC Qingdao Sifang Co., Ltd., Qingdao 266111, Shandong, China
高强铝合金Al-Zn-Mg-Cu中第二相的形态与分布对其力学性能和耐蚀性能有重要影响。均匀化过程遗留的粗大相一般通过轧制使其破裂,然后通过固溶处理使相内的原子扩散进入基体中形成过饱和固溶体,最后经时效阶段析出均匀分布且尺寸合适的第二相,获得力学性能和耐蚀性能优异的产品。溶解是材料固溶处理工艺中最主要的相变过程,其程度越高,强化元素的过饱和度就越高,时效阶段相的析出驱动力就越大,可析出的数量就越多,时效铝合金的强度和韧性等与时效析出行为相关的性能就越好[1]。Al-Zn-Mg-Cu合金中的S相、含Fe相为合金中的粗大相,在时效铝合金中,这些粗大相会作为变形过程中裂纹的萌生点,并且在经历腐蚀后会脱落留下腐蚀坑,从而显著降低铝合金的力学性能和耐蚀性能。为了获得更高的过饱和度,在固溶过程中应尽可能地使η相、T相和S相溶解到基体中去,同时考虑到再结晶程度和工程中的成本问题,一般不会使粗大相完全溶解。因此,为了使性能和成本最优化,量化和模型化研究第二相在固溶阶段的溶解行为具有重要的工程应用价值。
溶解的本质是原子扩散运动。近年来,大量学者[2-5]采用铝合金相变过程中原子热运动速率的定量化、模型化来研究原子的运动机制。以菲克扩散定律为扩散型相变的基础理论[4-6],Whelan[7]提出了第二相溶解的体扩散动力学模型,该模型是目前最常用的基础模型。但第二相的初始半径及其周围浓度分布的复杂性决定了表征其溶解速率的偏微分方程没有解析解,而且溶解不是仅有扩散控制,第二相也不能单一独立地研究,应当在有限矩阵中数量庞大的第二相彼此之间的作用基础上来研究第二相的溶解行为[8]。Readey and Cooper指出,球状相的溶解并不是从二维的相界面开始,而是从第二相的中心点开始,但是体扩散控制的模型并没有考虑原子从第二相内部脱离的过程[9]。张蓉等[10]通过研究界面反应对过共晶Al-Si合金中初晶硅溶解速率的影响,所建立的溶解动力学模型能较好地预测初晶硅的溶解过程。由于初晶硅的半径很大,界面曲率较小,因此并未考虑曲率对Al-Si溶体溶解速率的影响,但7050铝合金中可溶相的半径一般小于5 μm,所以曲率对7050铝合金可溶相溶解的影响不可忽略。
因此,本工作研究了第二相的形貌与分布情况及其在固溶过程中的溶解行为,并结合体扩散、曲率、界面反应建立了η(MgZn2)相、T(Al2Mg3Zn3)相和S(Al2CuMg)相溶解动力学模型。通过MATLAB软件求解动力学模型的数值解,进而得出了第二相在固溶过程中其半径随时间的变化规律,并通过模型来计算第二相完全溶解或溶解到一定尺寸下所需要的时间,最后通过实验对溶解动力学模型进行验证,期望对工程应用提供理论指导。
1 实验材料与方法实验材料为中南大学轻合金基地差温轧制后的7050铝合金板材,其厚度为80 mm。实验样品从板材表面切取,样品尺寸约为5 mm×5 mm×5 mm,其化学成分如表 1所示。试样第二相的溶解温度在2010 V4.4E DSC设备中检测,加热速率为10 K/min。试样的固溶在箱式电阻炉中进行,固溶温度为470 ℃,固溶时间为0, 5, 10…60 min。固溶不同时间后试样微观组织在MA10扫描电子显微镜中原位拍摄。第二相的半径(取半长轴半径和短长轴半径的平均值)使用Image J软件测量,其结果取3次测量数值的平均值。溶解动力学模型的求解使用MATLAB软件ode113解法。第二相半径随时间的变化趋势使用Origin软件绘制。
| Si | Fe | Zn | Cu | Mg | Cr | Ti | Mn | Al |
| 0.076 | 0.085 | 6.41 | 2.25 | 2.08 | 0.010 | 0.039 | 0.002 | Bal |
轧制态试样组织的SEM图如图 1所示,可以看出,热轧后板材中的第二相粒子沿轧向分布,其形貌和尺寸多样。图 1中1~5相点能谱的检测结果如表 2所示。其中尺寸细小、弥散分布且数量庞大的小相(如位置1和5所示),其半径为0.01~0.5 μm;圆形小相(如位置1所示)中Zn:Mg≈2:1(部分Zn原子被Mg原子取代,原子比,下同),即为η(MgZn2)相;类三角形相(如图中位置5所示)中Al:Cu:Mg≈2:3:3,即为T(Al2Mg3Zn3)相;还有粗大棒状相(如位置3和4所示),其半径为3~5 μm,Al:Cu:Mg≈2:1:1,即为S(Al2CuMg)相;还有内部组织呈沟壑状的长棒状相(如位置2所示),其半径为5~10 μm,Al:Cu:Fe≈7:2:1,即为含Fe相Al7Cu2Fe。结合图 1和表 2还可以看出,细小弥散相均为η相和T相,粗大相为S相和含Fe相。
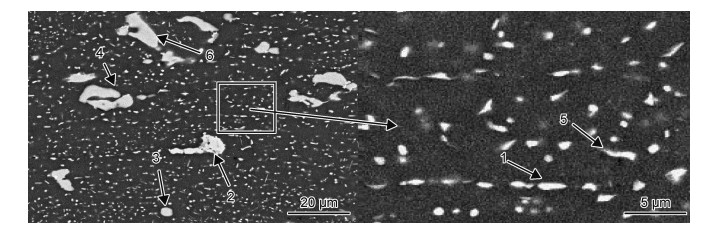
|
图 1 轧制态试样SEM图 Fig. 1 SEM images of rolled sample |
| Phase point | Morphology | Al | Zn | Mg | Cu | Fe | Phase |
| 1 | Circular dispersive | 89.68 | 4.23 | 3.74 | 2.35 | - | η(MgZn2) |
| 2 | Interior crisscross | 71.78 | - | - | 19.42 | 8.80 | Al7Cu2Fe |
| 3 | Round coarseness | 55.58 | 1.83 | 21.26 | 21.33 | - | S(Al2CuMg) |
| 4 | Rod coarseness | 52.12 | 3.22 | 22.82 | 21.84 | - | S(Al2CuMg) |
| 5 | Quasi-triangle | 25.16 | 35.54 | 37.52 | 1.78 | - | T(Al2Mg3Zn3) |
7050铝合金轧制态样品差示扫描量热法检测的结果如图 2所示。可见,该曲线有4个吸热峰(A, B, C, D)。由文献[11-12]可知,A峰温度为425~450 ℃,是η和T相的溶解峰;B峰温度为450~480 ℃,为S相溶解过程;C峰温度为483~505 ℃,为过烧峰;D峰温度为500~530 ℃,为含Fe相的溶解峰。从图 2还可以看出,η,T相溶解温度最低;S相温度稍高;低熔点相在483 ℃开始过烧,因此在确定固溶制度时,温度不能高于483 ℃;含Fe相的溶解温度要高于过烧温度,因此实际固溶过程中不考虑含Fe相的溶解。
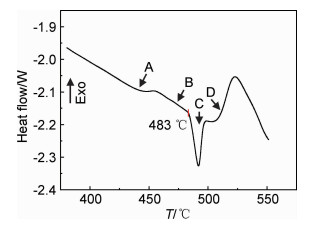
|
图 2 7050铝合金轧制态DSC曲线 Fig. 2 DSC curve of as-rolled 7050 aluminum alloy |
图 3为试样在470 ℃固溶不同时间后的SEM图,可以看出,板材中细小弥散的η相和T相在固溶5 min后就可以全部溶解。这主要是因为η相的溶解温度为425~450 ℃,所以其在470 ℃固溶时,原子热运动剧烈,扩散速率快,扩散时间较短。固溶60 min后S相部分溶解,这是因为S相溶解温度为450~480 ℃,随着470 ℃保温时Cu和Mg原子陆续溶入基体,相半径随着保温时间的延长单调减小,体积较小的S相(如图 3中位置A所示)在固溶30 min后就完全溶解;体积稍大的S相(如图 3中位置B所示)在固溶45 min后完全溶解;体积较大的S相(如图 3中位置C所示)在固溶60 min后还没有完全溶解。而含Fe相(如图 3中位置D所示)在固溶过程中不发生溶解的原因是含Fe相Al7Cu2Fe的溶解温度为500~530 ℃。

|
图 3 固溶不同时间后试样的SEM图 (a)固溶前;(b)5 min; (c)15 min; (d)30 min; (e)45 min; (f)60 min Fig. 3 SEM images of sample after solid solution for different time (a)before solid solution; (b)5 min; (c)15 min; (d)30 min; (e)45 min; (f)60 min |
为了进一步得到在固溶过程中第二相的半径随时间的变化规律则需要建立溶解动力学模型,通过求解模型的解获得第二相在任意时刻的溶解速率。目前最常用的体扩散控制的溶解动力学模型如式(1)所示,相的半径R和时间t均处在方程式分母上,所以当两者数值非常小时,其微分方程的结果会急剧增大,这个增速溶解的过程在开始溶解和接近完全溶解时的阶段非常明显。之后通过引入新的变量CI(R)代替式(2)中的CI来研究曲率对溶解的影响,结果如式(3)所示[13]。代入式(4)中数据可知,β≈10-8,即式(3)中CI(R)的值略大于CI(∞)。表明析出相界面从二维平面到曲率球面,界面的原子浓度升高,浓度梯度增大,原子迁移速率加快,因此第二相的溶解速率得到提高,在第二相的最后溶解阶段,曲率增大,溶解速率加快。但是由于β值很小,因此曲率对第二相溶解速率的影响也较小。
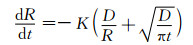
|
(1) |
式中:R为第二相半径;t为溶解时间;K为形状因子;D为原子扩散系数。
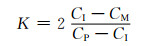
|
(2) |
式中:CI为第二相与基体之间的界面处的原子浓度;CM为原子在基体中的浓度;CP为原子在第二相中的浓度。
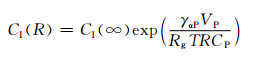
|
(3) |
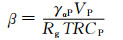
|
(4) |
式中:CI(R)为曲率作用下第二相与基体之间的原子浓度;CI(∞)为静态扩散下第二相与基体之间界面上的原子浓度;γαP为第二相与基体间的界面能;VP为第二相摩尔体积;Rg为气体常数;β为曲率对界面处原子浓度的影响因子。

|
(5) |
式中:ΔC为界面反应对第二相和基体间的界面处原子浓度差值,数值为正值,数值的大小取决于在第二相溶解过程中原子的分离机制。为了便于计算,本实验采用原子在第二相中均匀分离的机制。
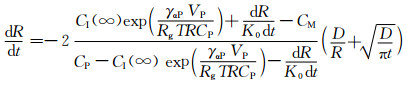
|
(6) |
式中:K0为原子在第二相中均匀分离时的动力学常数。
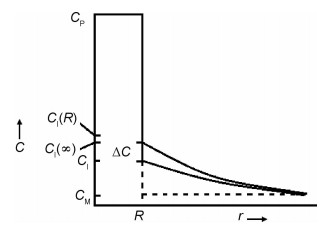
在第二相生长过程中,Cahn等研究了大量的分子和原子结合与分离机制,引入了新的变量,即界面反应使第二相和基体间的界面处原子浓度偏离的数值[14]。结果表明在界面发生的这种结合与生长过程会减缓原子从第二相进入到基体中的速度,并使界面处的实际原子浓度CI低于稳态扩散下的原子浓度CI(R),因此减小了界面处原子浓度梯度,延缓了第二相的溶解速率,且这个延缓过程非常明显,即界面反应大幅度降低了第二相的溶解速率。本工作综合考虑体扩散、曲率和界面反应的影响得出第二相界面上实际原子浓度如式(5)所示,其实际原子浓度低于静态扩散过程中稳定值CI(∞)。实际原子浓度由第二相的中心到无穷远处的分布如图 4所示。结合体扩散、曲率、界面反应共同作用下求出第二相的溶解速率,其结果如式(6)所示,该式表示溶解过程中第二相半径与初始半径的比值随时间变化的规律。其中温度影响的是原子扩散系数,将不同温度下的扩散系数代入式(6)即可得到不同温度下的溶解动力学模型。但式(6)没有解析解,可以通过MATLAB软件来求取数值解。MATLAB中求微分方程数值解的函数有7个:ode45, ode23, ode113, ode15s, ode23s, ode23t, ode23tb。对于非刚性微分方程,有ode23, ode45和ode113等3种解法。由于第二相半径R也是溶解动力学模型中的自变量,所以需要将每一个时间点计算出来的R值作为下一个时间点的R0来计算新的R值,因此本实验不采用Runge-Kutta算法(ode12和ode45),而采用多部迭代的方法(ode113)求取数值解。
|
图 4 原子浓度一维分布图 Fig. 4 Diagram of one-dimensional distribution of atomic concentration |
η(MgZn2)相的溶解本质上是Mg和Zn原子的扩散。由文献[14-16]可知,470 ℃下Mg原子在铝基体中的扩散系数为7.44×10-14 m2/s,Zn原子在铝基体中的扩散系数为1.18×10-14 m2/s。显然,Zn原子扩散得慢一些,由于溶解速率受扩散速率最慢的原子运动控制,且Mg和Zn原子浓度相差不大,所以采用Zn原子的扩散速率作为η(MgZn2)相的溶解速率。通过Mg-Zn二元相图可得,基体中η相界面周围Zn原子质量分数为:CI≈0.43;η相中Zn原子质量分数为:CP=0.84;由表 1可得合金中Zn原子质量分数为:CM=0.064。并且由于第二相的溶解时间与其初始半径有关,初始半径越大,则其完全溶解的时间越长,因此本实验选取尺寸最大的η相(图 1中位置1所示)来计算合金中所有η相溶解所需要的时间。
将上述数据代入式(6)即可得到η相溶解动力学模型。然后通过MATLAB软件多部迭代的方法求得其数值解,结果如图 5(a)中黑色线条所示。可以看出,η(MgZn2)相溶解过程中相半径随时间变化成正比,其完全溶解需要108 s左右,即η相不到2 min就可以完全溶解。同样的方法可以计算出SEM结果中尺寸最大的T相(如图 1中位置5所示)的溶解动力学模型,其数值解结果如图 5(a)中红色线条所示,结果表明,在溶解过程中T相的半径和时间成正比,其完全溶解只需要115 s左右,即T相不到2 min就可以完全溶解。选取SEM结果中尺寸最大的S相(如图 1中位置6所示)来计算其完全溶解所需要的时间,其数值解结果如图 5(b)所示,可见合金中所有的S相溶解需要170 min左右。S相的溶解动力学曲线中间阶段是一条直线,即在固溶过程中的主要阶段,S相的半径和时间成正比。但开始溶解和最后的溶解阶段曲线倾斜程度增大,即相的溶解速率明显加快,并且最终溶解阶段要比开始溶解的速率大一些。这是因为半径R和时间t在式(6)中均处在分母位置,当R和t的数值非常小时,则式(6)的结果(第二相溶解速率)非常大。在开始阶段的加速是由式(6)分母中时间t非常小导致的,而最终溶解阶段的加速则是由于式(6)分母中第二相的半径R已经趋近无穷小。并且由于相半径非常小时,曲率造成的加速溶解过程也非常明显,二者共同作用下S相溶解的最后阶段速率明显加快。由图 5还可以看出,第二相在固溶溶解过程中相的半径与时间成正比,而时效析出过程中相的半径与时间的开方成正比,因此不能简单地认为固溶溶解是时效析出的逆过程。

|
图 5 第二相溶解动力学模型曲线 (a)η相和T相;(b)S相 Fig. 5 Dissolution kinetics model curves of second phases (a)η phase and T phase; (b)S phase |
由图 5(b)中S相溶解动力学曲线可知,S相在470 ℃下固溶170 min后完全溶解。可以通过下述实验来验证其正确性。图 6为试样在470 ℃固溶170 min前后的原位SEM图,可以看出,轧制态的试样在固溶170 min后S相完全溶解,初步验证了图 5(b)中S相溶解动力学模型的准确性。然后通过测量原位拍摄SEM图中不同时间段的相的半径值与溶解动力学模型的预测结果进行对比来验证溶解动力学模型的准确度。因为η相和T相溶解速率较快,而含Fe相不溶,所以采用S相来验证溶解动力学模型的准确度。为了提高实验的准确度,选取最接近球形的S相(图 1中的位置A)来进行溶解动力学模型的验证。将S相溶解动力学模型的预测结果与原位SEM中S相半径实测结果进行对比,并通过Origin绘图,结果如图 7所示,其中黑色线条为S相的溶解动力学模型曲线,红色点为S相在实际固溶过程中的实测值。可见,测量值紧密地分布在模型曲线附近。通过计算S相实测值和溶解动力学曲线的拟合度指标可得:RNew≈0.914>0.9,因此可以认为结合体扩散、界面曲率、界面反应共同作用下的S相溶解动力学模型与其实际溶解过程相吻合,能够用来预测实际固溶过程中第二相的溶解行为。

|
图 6 S相在470 ℃/170 min固溶前后SEM图 (a)固溶前;(b)固溶170 min后 Fig. 6 SEM images of S phase before (a) and after (b) solid solution at 470 ℃/170 min |

|
图 7 S相溶解动力学模型 Fig. 7 Dissolution kinetics model of S phase |
溶解过程中,原子并不是简单地从第二相的界面扩散到周围基体中,而是从第二相体积内部脱离并迁移到界面,然后穿过界面到基体中去,因此只考虑扩散控制的原子迁移具有局限性。原子在第二相体积内部点阵中从脱离,之后迁移到界面,再通过界面到基体中,这是一个完整的第二相溶解过程,每一步都影响着最终的溶解速率。因此,综合考虑体扩散、界面曲率和界面反应的溶解动力学模型能较好地预估第二相溶解速率。
本实验方法也可应用于均匀化、回复、再结晶、时效等热处理过程中,将热处理过程的微观组织演变从微观上进行量化分析,对制定热处理制度具有重要的指导意义。
3 结论(1) 在7050铝合金常规固溶温度(470 ℃)条件下,热轧态试样中η相和T相在2 min内即可完全溶解,S相保温较长的时间(约170 min)才能完全溶解,含Fe相不发生溶解。
(2) 在体扩散控制溶解动力学基础上,引入曲率和界面反应对原子迁移速率的作用,建立的η,T和S相的溶解动力学模型结果表明,曲率对溶解行为影响较小,界面反应会大幅度降低溶解速率。
(3) 7050铝合金固溶过程中第二相溶解的动力学模型预测结果与实测结果较吻合,能够为优化Al-Zn-Mg-Cu合金的固溶工艺提供指导作用。
| [1] |
张新明, 吴泽政, 刘胜胆, 等. 固溶处理对7A55铝合金局部腐蚀性能的影响[J]. 材料工程, 2014(4): 26-33. ZHANG X M, WU Z Z, LIU S D, et al. Influence of solution heat treatment on localized corrosion of 7A55 aluminum alloy[J]. Journal of Materials Engineering, 2014(4): 26-33. DOI:10.3969/j.issn.1001-4381.2014.04.005 |
| [2] |
YANG Y, LI T R, JIA T, et al. Precipitation kinetics of complex precipitate in multicomponent systems[J]. Journal of Iron and Steel Research, International, 2018, 25(10): 1086-1093. DOI:10.1007/s42243-018-0147-7 |
| [3] |
XU F S, GUO X B, WU P F, et al. Morphology development and kinetics of plate or rod shaped precipitates in aluminum alloys[J]. Rare Metal Materials and Engineering, 2017, 46(4): 876-881. DOI:10.1016/S1875-5372(17)30115-7 |
| [4] |
FILBET F, SHU C W. Discontinuous Galerkin methods for a kinetic model of self-organized dynamics[J]. Mathematical Models and Methods in Applied Sciences, 2018, 28(6): 1171-1197. DOI:10.1142/S0218202518500318 |
| [5] |
KANG L, CUI Y J, ZHAO G, et al. Precipitation kinetics analysis of the cooling process following the solid solution treatment of 7B50 aluminum alloy[J]. Materials Science Forum, 2017, 898: 213-222. DOI:10.4028/www.scientific.net/MSF.898.213 |
| [6] |
KONGTHEP J, JUIJERM P. Kinetics of precipitation hardening phase in aluminium alloy AA6110[J]. Materials Science and Technology, 2014, 30(14): 1815-1819. DOI:10.1179/1743284713Y.0000000488 |
| [7] |
WHELAN M J. On the kinetics of precipitate dissolution[J]. Metal Science Journal, 1969, 3(1): 95-97. |
| [8] |
CHA B, GALBRAITH S C, LIU H, et al. A thermodynamic balance model for liquid film drying kinetics of a tablet film coating and drying process[J]. AAPS Pharm SciTech, 2019, 20(5): 209. DOI:10.1208/s12249-019-1398-8 |
| [9] |
LANG P, WOJCIK T, POVODEN-KARADENIZ E, et al. Thermo-kinetic prediction of metastable and stable phase precipitation in Al-Zn-Mg series aluminum alloys during non-isothermal DSC analysis[J]. Journal of Alloys and Compounds, 2014, 609: 129-136. DOI:10.1016/j.jallcom.2014.04.119 |
| [10] |
张蓉, 曹秋芳, 庞述先, 等. Al-Si过共晶合金中初生硅的溶解动力学[J]. 中国有色金属学报, 2000, 10(1): 89-91. ZHANG R, CAO Q F, PANG S X, et al. Dissolution kinetics of primary silicon for hypereutectic Al-Si alloy[J]. The Chinese Journal of Nonferrous Metals, 2000, 10(1): 89-91. DOI:10.3321/j.issn:1004-0609.2000.01.020 |
| [11] |
杨金龙, 邓运来, 祁小红, 等. 过饱和7050铝合金固溶体中第二相粒子的析出动力学[J]. 中南大学学报(自然科学版), 2012, 43(7): 2528-2533. YANG J L, DENG Y L, QI X H, et al. Precipitation kinetics of second-phase particles in supersaturated solid solution of 7050 aluminum alloy[J]. Journal of Central South University (Science and Technology), 2012, 43(7): 2528-2533. |
| [12] |
MILKEREIT B, BECK M, REICH M, et al. Precipitation kinetics of an aluminum alloy during Newtonian cooling simulated in a differential scanning calorimeter[J]. Thermochimica Acta, 2011, 522(1/2): 86-95. |
| [13] |
BJØRNEKLETT B I, GRONGA Ø, MYHR O R, et al. Additivity and isokinetic behaviour in relation to particle dissolution[J]. Acta Materialia, 1998, 46(17): 6257-6266. DOI:10.1016/S1359-6454(98)00260-2 |
| [14] |
KAMMERER C C, KULKARNI N S, WARMACK B, et al. Interdiffusion in ternary magnesium solid solutions of aluminum and zinc[J]. Journal of Phase Equilibria and Diffusion, 2016, 37(1): 65-74. DOI:10.1007/s11669-015-0438-7 |
| [15] |
HILL O F, BRICE J C. The composition of crystals of bismuth silicon oxide[J]. Journal of Materials Science, 1974, 9(8): 1252-1254. DOI:10.1007/BF00551838 |
| [16] |
崔森林.Al合金扩散系数及微结构演变的模拟[D].长沙: 中南大学, 2012: 125. CUI S L.Simulation of diffusion coefficients and microstructure evaluation in Al alloys[D].Changsha: Central South University, 2012: 125. http://cdmd.cnki.com.cn/Article/CDMD-10533-1012475390.htm |
 2020, Vol. 48
2020, Vol. 48


