文章信息
- 候冰娜, 沈惠玲, 李进, 谢旺强, 李征征
- HOU Bing-na, SHEN Hui-ling, LI Jin, XIE Wang-qiang, LI Zheng-zheng
- 基于动态化学键构建自愈合高分子水凝胶
- Self-healing polymer hydrogel based on dynamic chemical bonds
- 材料工程, 2020, 48(4): 73-82
- Journal of Materials Engineering, 2020, 48(4): 73-82.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.000698
-
文章历史
- 收稿日期: 2019-07-26
- 修订日期: 2019-11-26
2. 复旦大学 聚合物分子工程国家重点实验室, 上海 200433;
3. 天津科技大学 天津市海洋资源与化学重点实验室, 天津 300457;
4. 天津科技大学 天津市制浆造纸重点实验室, 天津 300457
2. State Key Laboratory of Molecular Engineering of Polymers, Fudan University, Shanghai 200433, China;
3. Tianjin Key Laboratory of Marine Resources and Chemistry, Tianjin University of Science and Technology, Tianjin 300457, China;
4. Tianjin Key Laboratory of Pulp and Paper, Tianjin University of Science and Technology, Tianjin 300457, China
水凝胶是一种能够保持大量水分和生物流体的高分子凝胶,是由亲水性高分子通过化学或物理交联作用而形成的具有三维网络结构的软材料[1-3]。水凝胶的合成方法灵活、种类多样,除此之外,水凝胶具有极高的含水量、优异的柔软性和独特的生物相容性,在生物医学领域有着广泛应用。水凝胶能够制成隐形眼镜、牙科黏合剂[4]或烧伤涂敷物[5-6],也能够用于药物递送系统传递药物[7-8]。然而传统的水凝胶在使用过程中易被损坏,因此在近年来研究者着力开发具有可调节结构的自愈合水凝胶,提高水凝胶的耐久性和可靠性。
自然界的生物体普遍拥有修复自身损伤的特征,称之为自修复特征。自修复是指生物体或物质在损伤后能够恢复其原始特性的能力。根据生物体的这一特性,人们希望能够开发出具有自愈合能力的高分子水凝胶,从而延长高分子水凝胶的使用寿命。最初的自愈合水凝胶是通过包覆愈合剂,在受到损伤后释放愈合剂从而修复损伤[9-11]。但这种自愈合水凝胶通常只能实现一两次自修复,无法多次修复损伤,限制了该自愈合水凝胶的应用。目前的研究则更多集中在利用材料本身的物理化学结构,设计出具有动态结构的水凝胶来实现水凝胶的自修复[12]。通过分子之间的可逆非共价键和可逆共价键来实现自修复[13],水凝胶受到损伤后,被破坏的可逆化学键重新反应形成新的交联网络,并且自修复后的水凝胶可以保持其原始的机械和流变性质[14]。基于可逆非共价键的自愈合水凝胶通过金属-配体相互作用[15-16]、主-客体相互作用[17-18]、疏水相互作用[19-20]和离子相互作用[21]等相互作用形成物理交联,通常基于可逆非共价键的自愈合水凝胶同时存在多种非共价相互作用。基于可逆共价键的自愈合水凝胶通过硼酸酯键[22-23]、二硫键[24]、亚胺键[25-27]和酰腙键[28-30]等化学键形成化学交联。基于可逆非共价键的自愈合水凝胶力学性能较弱,而基于动态化学键交联的水凝胶具有较高的机械强度,但通常需要通过外部刺激来实现自愈合,例如通过pH、光、电、温度的刺激。因此,基于动态非共价键和共价键的双网络水凝胶被广泛研究,该水凝胶兼有物理交联和化学交联,具有优异的力学性能和自修复性能,在3D打印及药物递送载体领域具有重要的应用前景。
自愈合水凝胶在生物医学领域具有巨大的前景,含有生物大分子(如脂质体[31]、肽[32]、核酸[33]和多糖[34])的自愈合水凝胶已被应用到细胞培养[35-36],组织工程[37-38]和药物递送中。自愈合水凝胶必须是无毒、无危害的,并且在使用过程中不会被过早的降解。除此之外,自愈合水凝胶需要能够快速地响应损伤实现重复自修复。自愈合水凝胶具有剪切稀化特性,能够用于可注射系统,在注射过程中被破坏的水凝胶能够通过自愈合恢复其力学性能,延长使用时间。如图 1所示,本文介绍了几种基于可逆非共价键和可逆共价键的自愈合水凝胶,涉及的可逆非共价键包括氢键相互作用、金属配位相互作用、亲疏水相互作用、主-客体相互作用和离子相互作用,可逆共价键包括亚胺键/酰腙键、硼酸酯键和二硫键。

|
图 1 自愈合机制示意图 Fig. 1 Schematic diagram of the self-healing mechanism |
自愈合水凝胶具有良好的生物相容性和较长的使用寿命,受到外界的广泛关注。基于可逆非共价键作用的自愈合水凝胶是由非共价键作用构成物理交联点而形成三维网络结构的凝胶。常用的非共价键作用包括氢键作用、金属配位作用、疏水相互作用、主客体相互作用和离子相互作用。动态非共价键作用构建的水凝胶有很好的自愈合能力,合成方法简单,但机械强度一般较差,所以通常水凝胶中含有多种非共价键相互作用来提高其机械强度。本文介绍了几种常用的非共价键相互作用。
1.1 氢键相互作用氢键作用是一种常见的物理相互作用,其比共价键和离子键弱得多。当氢原子与高电负性原子(例如N,O或F)键合时,氢原子带正电荷,高电负性原子带负电荷。通过氢(氢供体)和高电负性原子(氢受体)之间的静电相互作用,使不同的聚合物链之间形成可逆交联,因此氢键作用在自愈合水凝胶中得到了广泛的应用。由于氢键作用本身较弱,而水凝胶体系中大量存在的水也会影响聚合物链间氢键的形成,使得以氢键为主体交联的水凝胶机械强度较弱,应用受到一定限制。
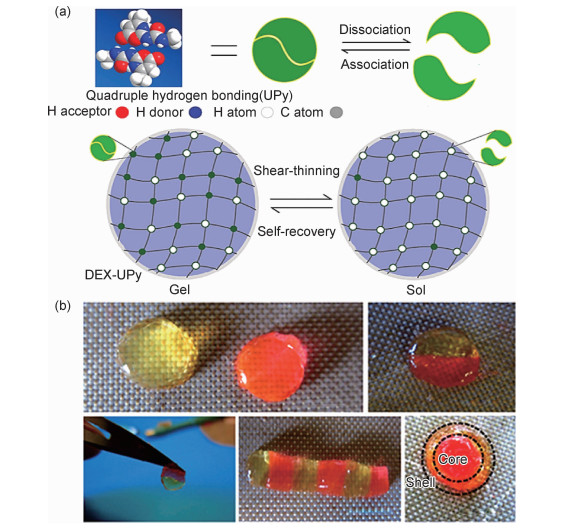
Hou等通过含有四重氢键的脲基嘧啶酮(UPy)与多官能团的葡聚糖(DEX)共聚,得到侧链带有UPy基团的高分子[39]。如图 2(a)所示,UPy分子间存在多重氢键作用,当DEX-Upy分子链上的UPy基团密度足够高时,氢键作用增强,DEX-UPy交联形成具有三维网络结构的水凝胶。如图 2(b)所示,将DEX-UPy水凝胶用罗丹明染色,取染色后的水凝胶(粉红色)与原始水凝胶(浅黄色)拼接在一起,几分钟后DEX-UPy水凝胶结合为一个整体,表明DEX-UPy水凝胶具有自修复的能力。研究还发现DEX-Upy能够在较高温度(约70 ℃)下溶解在水中,并在室温下形成稳定的水凝胶,表明DEX-Upy水凝胶可以应用到可注射水凝胶体系中。此外,UPy基团能够与不同单体共聚合成水凝胶,如聚乙二醇(PEG),并赋予这些高分子水凝胶自愈性,获得一种UPy基团修饰高分子制备多重氢键自修复材料的普适方法。
Varghese等以丙烯酰基-6-氨基己酸(A6ACA)为基体,N,N′-亚甲基双丙烯酰胺(MBA)为交联剂,合成了一种能够在水性环境中永久交联的自修复水凝胶[40]。水凝胶通过侧链上羧基间的氢键作用来实现水凝胶的自愈合,且在不同的pH环境下该愈合过程是可逆的。两段水凝胶相互接触并被置于酸性溶液(pH < 3)中,一段时间后两段水凝胶结合为一体。愈合后的水凝胶仍能够表现出良好的机械强度,在反复拉伸作用下仍能够保持一定的形状,且愈合界面不被破坏。将愈合后的水凝胶置于碱性环境(pH>12)中,水凝胶又能够恢复为两段。该水凝胶在pH调节下能够在很短的时间内通过氢键作用实现可逆的自修复。
Zhang等使用冻融法合成了一种聚乙烯醇水凝胶(PVA水凝胶),通过相邻分子链上羟基间的氢键实现自修复[41]。合成的PVA水凝胶具有高机械强度,在室温下能够自修复,并且不需要任何外部刺激。如图 3所示,两个切断的PVA水凝胶相互接触,12 h后界面消失,48 h后PVA水凝胶恢复到72%拉伸应力。PVA水凝胶接触面的分子链扩散并重新形成氢键,实现了无外部刺激的自修复行为。然而,在形成链内或链间氢键时PVA容易发生羟基重排导致PVA水凝胶在1 h后才能实现自修复。此外,戊二醛交联的聚乙烯醇/壳聚糖(PVA/CS)水凝胶也能够实现自修复,这是因为PVA链和壳聚糖链在界面处能够自发地扩散产生分子间氢键。

|
图 3 PVA水凝胶的自修复行为[41] (a)原始水凝胶和罗丹明B染色水凝胶;(b)原始水凝胶和染色水凝胶各一半;(c)两半水凝胶室温下接触12 h,无外部刺激;(d)水凝胶愈合能够弯曲;(e)自愈合水凝胶可以拉伸至约100% Fig. 3 Photographs showing the self-healing behavior of PVA hydrogel[41] (a)two pieces of original hydrogel with and without rhodamine B for coloration; (b)two halves of the original hydrogels cut from the middle; (c)self-healed hydrogel upon bringing the two separate halves in contact for 12 h in air at room temperature without any external stimulus; (d)bending of the self-healed hydrogel; (e)stretching of the self-healed hydrogel to about 100% extension |
此外,氢键常常被用以辅助自愈,配合其他交联作用制备具有一定力学强度的自修复水凝胶。Hisashi等通过无机黏土聚合合成了透明状纳米复合水凝胶[42]。37 ℃下,该纳米复合水凝胶的切口,在48 h后能够实现自愈合。进一步提高温度(80 ℃),观察发现纳米复合水凝胶的切口在20 min后消失,表明升高温度能够提高纳米复合水凝胶的自愈合速率。纳米复合水凝胶中高分子链与黏土片层间的氢键作用使水凝胶具有了自修复性能,温度的升高加快了高分子链的扩散,提高了氢键的形成速度。
1.2 金属配位相互作用具有空轨道(d,f)的过渡金属离子,如Fe3+, Zn2+, Cu2+,可以与有孤对电子的基团,如—COOH, —NH2, —OH,产生很强的配位作用。金属配位相互作用中的金属离子与配体的选择范围很广,在外界刺激下能够很快响应,并且具有一定的可调控性,被广泛用于合成自修复材料。
聚丙烯酸(PAA)含有大量羧基能够与多价金属离子配位,被广泛用于合成动态自愈合水凝胶。Wang等通过聚丙烯酸(PAA)、季铵化纤维素(QCE)和聚乙烯醇(PVA)的共聚反应,制备了高强度抗菌自愈合水凝胶(PAA-g-QCE/PVA)[43]。PAA-g-QCE/PVA水凝胶的羧基(COO—)与三价铁离子(Fe3+)形成可逆金属配位相互作用,充当体系的物理交联点,当水凝胶损伤后,破损处的羧基和三价铁离子间能够重新产生金属配位相互作用形成新的物理交联点,实现自修复。PAA-g-QCE/PVA水凝胶中还存在氨基与羧基的氢键作用,起辅助愈合的作用,能够提高PAA-g-QCE/PVA水凝胶的自修复能力。此外,范德华力和分子的纠缠,也有助于PAA-g-QCE/PVA水凝胶自修复。在室温下,破损的PAA-g-QCE/PVA水凝胶静置16 h,水凝胶的裂痕几乎完全消失,新的水凝胶能够弯曲和拉伸而不破裂,表现出良好的自修复能力。此外,不同组成的PAA-g-QCE/PVA水凝胶的自修复效率均可达到60%,并且随着自愈时间的延长,样品的断裂伸长率恢复值增高。
杨倩等也通过聚丙烯酸与金属离子间的配位相互作用,采用“一锅法”制备了三价铁离子交联的琼脂-聚丙烯酸水凝胶(Fe3+/Agar-PAAc)[44]。Fe3+/Agar-PAAc水凝胶中的Fe3+作为“流动相”能够在界面处扩散,重新与羧基形成金属配位络合键,从而修复聚丙烯酸的交联点,实现水凝胶的自愈合。将破坏后的Fe3+/Agar-PAAc水凝胶浸泡在Fe3+溶液中,30 min后水凝胶达到100%的修复率。自然环境下放置48 h,Fe3+/Agar-PAAc水凝胶能够实现自愈合,且力学性能优良。Shi等通过双膦酸盐修饰的透明质酸(HA-BP)与载药硅酸镁纳米颗粒(MgSiO3 NPs)间的金属配位相互作用合成了HA-BP/MgSiO3 NPs自愈合水凝胶[45]。HA-BP/MgSiO3 NPs水凝胶通过磷酸基团与硅酸镁纳米颗粒间的金属配位形成物理交联点,水凝胶受到损伤后,能够重新形成金属配位的交联点,实现水凝胶自愈合。此外,透明质酸水凝胶的硅酸镁纳米颗粒能够承载药物,实现了该水凝胶在药物递送领域的应用。
1.3 亲疏水相互作用疏水相互作用是指疏水表面或疏水物在水性介质中发生聚集。疏水结构易于聚集,在受到破坏时,能够迅速重新聚集。胶束共聚合是一种亲水性单体与少量疏水单体共聚形成胶束的方法。胶束疏水缔合的重排是水凝胶自修复机制的基础,基于这点,将稳定的疏水结构掺入水凝胶中,设计合成了基于亲疏水相互作用的自愈合水凝胶。
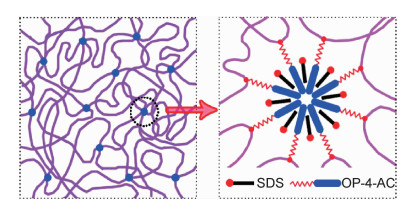
Jiang等通过丙烯酰胺(AM)和少量辛基酚聚氧乙烯醚丙烯酸酯(OP-4-AC)在十二烷基硫酸钠(SDS)水溶液中的胶束共聚成功制备了疏水缔合水凝胶(HA凝胶)[46]。如图 4所示,疏水单体OP-4-AC沿聚丙烯酰胺主链分布,并与SDS形成多个胶束,这些胶束充当了HA凝胶的物理交联点。当HA凝胶样品被切成两半时,切割面处的胶束解离,SDS取向排列形成单层分子膜,随着时间的延长,SDS重新与切割面处的疏水基团OP-4-AC结合形成新的胶束,完成HA凝胶的自修复。HA凝胶在自修复3天后显示出约70%的愈合率,且愈合后的HA凝胶的伸长率和拉伸强度远低于原始HA凝胶试样。Deniz等通过n-烷基(甲基)丙烯酸酯与丙烯酰胺的接枝共聚合成了疏水基团修饰的聚丙烯酰胺,聚丙烯酰胺的疏水基团n-烷基(甲基)丙烯酸酯与十二烷基硫酸钠(SDS)经胶束共聚合制备了自修复水凝胶[47]。n-烷基(甲基)丙烯酸酯与十二烷基硫酸钠形成的胶束充当水凝胶的物理交联点,在水凝胶的损伤处能够重新形成胶束,使水凝胶重新交联为三维网络结构。n-烷基(甲基)丙烯酸酯的烷基链长度会影响水凝胶的自愈能力,n=18的水凝胶的自愈能力最强。此外,n-烷基甲基丙烯酸酯修饰的水凝胶的自愈能力强于n-烷基丙烯酸酯修饰的水凝胶。
主-客体相互作用是指结构不同但尺寸相匹配的大分子单体间的氢键、π-π键、范德华力和疏水作用。环糊精(CD)是最早发现对有机分子具有包含作用的主体,能够和多种客体分子形成包合化合物。
Harada等报道了一种基于超分子主-客体相互作用的自修复水凝胶,由β-环糊精(主体)和金刚烷(客体)单体的络合物与丙烯酰胺共聚制得[48]。在受到损伤后,该水凝胶通过β-环糊精和金刚烷之间的主-客体相互作用实现自修复。室温下,该自修复水凝胶在切割处接触24 h后其力学性能能够完全恢复,表现出优异的自修复性能。Wang等设计了一种新型“三臂”主-客体超分子单体(HGSM),通过紫外光引发光交联合成自修复水凝胶[49]。异氰酸酯丙烯酸乙酯修饰的β-环糊精(β-CD-AOI2,主体)包覆双键修饰的1-溴代金刚烷(A-TEG-Ad,客体)形成“三臂”HGSM,HGSM在紫外光照射下交联为HGSMs水凝胶。Wang等研究发现将切割的两片HGSMs水凝胶紧密接触60 min后能够重新变成完整的水凝胶。此外,在切割面处涂抹大量金刚烷溶液的HGSMs水凝胶无法完成自修复。这是因为受到破坏的HGSMs水凝胶在损伤界面接触时,游离的主体分子(β-CD)和客体分子(Ad)能够相互识别并重新形成主-客体包含复合物,快速实现自愈合,而金刚烷溶液则抑制了主体分子和客体分子间的重组。基于HGSMs水凝胶的自修复性能能够注射合成耳状水凝胶。Rodell等基于主客体相互作用合成了以透明质酸(HA)为基体的自修复水凝胶[50]。如图 5所示,肽链修饰的金刚烷(Ad)和透明质酸的反应物作为客体,与环糊精(CD)修饰的透明质酸通过主-客体相互作用自组装为超分子水凝胶。超分子水凝胶通过环糊精与金刚烷之间自发的主-客体相互作用实现瞬时的自修复。此外,肽链赋予了超分子水凝胶降解性,超分子水凝胶在基质金属蛋白酶水解作用下能够降解,提高了超分子水凝胶在生物医学领域的竞争力。
离子相互作用是指带相反电荷的离子之间的可逆静电相互作用。通过带电聚合物链与带相反电荷的聚合物链或离子间的离子键能够合成具有三维网络的自修复水凝胶。
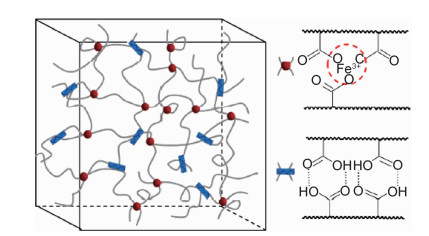
Liu等通过硝酸铁和丙烯酸之间的原位自由基聚合合成了PAA-Fe3+水凝胶[51]。如图 6所示,Fe3+与羧基间的离子相互作用构成PAA-Fe3+水凝胶的物理交联点,PAA-Fe3+水凝胶通过可逆离子相互作用实现自修复。此外,PAA-Fe3+水凝胶的羧基间还存在氢键作用,起到辅助愈合的作用。研究表明,温度、愈合时间以及铁离子浓度都会影响到PAA-Fe3+水凝胶的愈合效率。提高温度和铁离子浓度会加快聚合物链和铁离子在界面处的扩散速率,而愈合时间的延长会使分子链和铁离子的扩散更加充分,促进PAA-Fe3+水凝胶的自愈合。Guo等报道了一种铁离子交联的超分子聚丙烯酸水凝胶(KCl-Fe3+/PAA),通过离子键和氢键实现KCl-Fe3+/PAA水凝胶的自愈合[52]。三价铁离子与氧离子间的离子键构成了KCl-Fe3+/PAA水凝胶的物理交联点,并通过离子键的可逆断开和结合实现自修复。KCl-Fe3+/PAA水凝胶在12 h后开始愈合,存在愈合界面;24 h后,KCl-Fe3+/PAA水凝胶完全愈合,愈合界面消失。此外,KCl-Fe3+/PAA水凝胶还具有良好的力学性能和出色的导电性能,能够作为柔性超级电容器使用。
与非共价键交联的水凝胶相比,基于可逆共价键的自愈合水凝胶具有更好的力学性能,但对愈合环境有着更高的要求。基于可逆共价键的自愈合水凝胶通过共价键间的可逆反应实现自修复,常用的动态共价键有亚胺键/酰腙键、硼酸酯键和二硫键等。
2.1 亚胺键/酰腙键亚胺键是由伯胺和活性羰基(如醛基、酮基)的可逆缩合反应生成的,也称为席夫碱键(Schiff base)。利用席夫碱键的动态平衡,能够制备自愈合水凝胶。酰腙键是由酰肼和醛基反应生成的一种亚胺键,其稳定性要优于一般的亚胺键。
Gao等合成了一种基于天然聚合物硫酸软骨素和壳聚糖的可注射水凝胶[53]。通过硫酸软骨素多醛(CSMA)的醛基与N-琥珀酰-壳聚糖(SC)的氨基间的动态席夫碱反应合成了一种自愈合水凝胶。该水凝胶在无外界刺激下2 h内就能够自愈合,且愈合后的水凝胶具有较强的力学性能。Wei等通过N-羧乙基壳聚糖(CEC)和己二酸二酰肼(ADH)修饰的海藻酸钠(OSA)间的动态反应,合成了一种新型生物相容的多糖基自愈合水凝胶(CEC-l-OSA-1-ADH水凝胶)[54]。己二酸二酰肼与海藻酸钠之间以酰腙键相连,N-羧乙基壳聚糖与海藻酸钠之间以亚胺键相连,共同构成了水凝胶的三维网络结构。酰腙键只能在酸性环境中进行可逆反应(pH 4.0~6.0),在中性环境中动态反应显著减慢,而亚胺键比酰腙键更加活跃,能够在中性环境中进行可逆反应,酰腙键和亚胺键的共存使CEC-1-OSA-1-ADH水凝胶表现出优异的自修复行为。CEC-1-OSA-1-ADH水凝胶的愈合效率高达95%,在无任何外部刺激下也显示出优异的自修复能力。此外,CEC-1-OSA-1-ADH水凝胶表现出良好的细胞相容性,在生物医学领域具有巨大的应用潜力。Qiao等通过二苯甲醛改性的聚乙二醇(PEG-CHO)和己二酸二酰肼改性的海藻酸盐(ALG-ADH)间的可逆反应合成了一种自修复海藻酸盐水凝胶[55]。PEG-CHO的醛基和ALG-ADH的酰肼反应形成酰腙键,动态酰腙键被破坏后能够自发的重新形成,赋予了水凝胶自修复特性。该水凝胶经过自修复后,保留了原始拉伸模量的84.4%。通过水凝胶的自修复显微图像明显能够看出6 h后海藻酸盐水凝胶的愈合界面消失而海藻酸钙水凝胶的界面仍然存在,表明合成的海藻酸盐水凝胶具有自修复性能。
2.2 硼酸酯键硼酸酯键的动态可逆反应赋予了水凝胶自修复性能,并能够响应多种刺激,如温度、pH等。然而,基于硼酸酯键的自修复水凝胶的制备方法一般比较复杂,常常需要引入复杂的化学修饰,极大地限制了自修复水凝胶的使用,所以基于硼酸酯键的自修复水凝胶的合成实例较少。
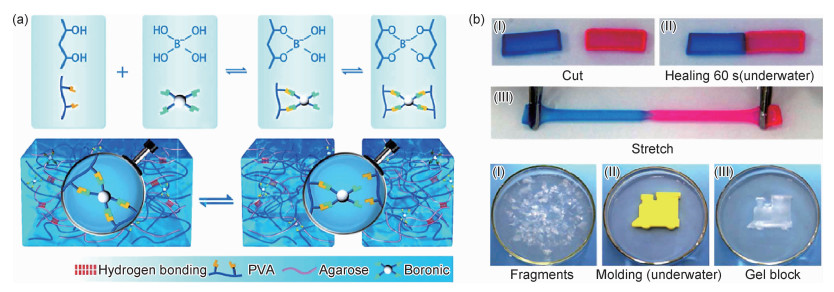
Chen等报道了一种新型琼脂糖/PVA双网络水凝胶[56]。如图 7(a)所示,第一网络是琼脂糖间氢键形成的物理交联网络,第二网络是聚乙烯醇的动态硼酸酯键构成的交联网络动态硼酸酯键赋予了琼脂糖/PVA双网络水凝胶自修复的能力,而氢键不仅起到辅助水凝胶自修复的作用,同时提高了琼脂糖/PVA双网络水凝胶的强度、韧性和稳定性[57-58]。如图 7(b)所示,测试了水凝胶在水中的自修复性能。结果表明,琼脂糖/PVA双网络水凝胶在水中能够快速(60 s)自愈合,具有非常好的愈合能力。Chen等进一步研究了琼脂糖含量对水凝胶的自愈性的影响,发现随着琼脂糖含量的增加,水凝胶几乎可以达到100%自愈,表明氢键确实起到了辅助愈合的作用。Lv等通过两种天然物质刺槐豆胶(LBG)和吉兰糖胶(Gg)制备了自修复刺槐豆胶/吉兰糖胶双网络水凝胶[59]。刺槐豆胶/吉兰糖胶双网络水凝胶具有温度敏感性和pH敏感性。在酸性环境中,刺槐豆胶/吉兰糖胶双网络水凝胶的硼酸酯键断裂,而在碱性环境中硼酸酯键又重新形成。当温度升高时,刺槐豆胶/吉兰糖胶双网络水凝胶的硼酸酯键和氢键断裂。刺槐豆胶/吉兰糖胶双网络水凝胶具有独特的温敏性、pH敏感性和自愈性,在生物医学领域显示出强大的潜力。
二硫键的交换平衡普遍存在于生物体中,这对维持蛋白质的三级结构和细胞内的氧化还原电位有很重要的作用[60]。二硫键在光、热或机械力作用下会发生裂解,但在合适的温度和pH环境下能够与硫醇实现快速交换[61-64],为制备自愈合水凝胶提供了可能。
Barcan等报道了一种通过水溶性三嵌段共聚物和二硫醇交联合成的自愈合水凝胶[65]。三嵌段共聚物是由含有二硫杂环戊烷侧链的环状碳酸酯通过开环聚合生成的,侧链二硫杂环戊烷与二硫醇间的二硫键交换使得二硫杂环戊烷发生开环反应,从而使水凝胶表现出自修复行为。Barcan等对合成的水凝胶进行了动态阶梯应变测试,当水凝胶承受的应变从1%增大到800%时,储能模量G′从2300 Pa下降到65 Pa,而应变恢复至1%后储能模量又能快速恢复到原始值,表明该水凝胶具有良好的自修复能力。Deng等基于二硫键和酰腙键合成了一种具有环境适应性的自修复水凝胶[66]。通过醛封端的三臂式聚环氧乙烷与二硫代二丙酸二酰肼的反应合成了HG1G2水凝胶,利用两种动态共价键实现了水凝胶的自修复。HG1G2水凝胶能够通过酸性(pH=3~6)条件下酰腙键的反应或碱性(pH=9)条件下二硫键的交换自修复,但两种动态共价键在中性条件下都不能发生可逆反应,因此HG1G2水凝胶在pH=7条件下不能自修复。
3 结束语本文介绍了基于可逆非共价键和可逆共价键的自愈合水凝胶的合成机理,其中常用的可逆非共价键包括氢键相互作用、金属配位相互作用、亲疏水相互作用、主-客体相互作用和离子相互作用,可逆共价键包括亚胺键/酰腙键、硼酸酯键和二硫键。自愈合水凝胶受到损伤后,通过可逆非共价键或可逆共价键能够重新反应,形成新的交联点,实现水凝胶的自修复。非共价键交联的自愈合水凝胶能够在多种环境下愈合,但一般力学性能较差。动态共价键结合的自愈合水凝胶具有更好的力学性能,但对自修复环境要求较高。
自愈合水凝胶的开发处于起步阶段,在评判自修复性能方面的手段比较少,大部分通过测量在拉伸剪切力作用下自愈合水凝胶的机械强度的变化或通过肉眼观察来判断水凝胶的愈合情况。与常规水凝胶相比,自愈合水凝胶具有更长的使用寿命和稳定的力学性能,在未来有良好的发展前景,但也存在一些挑战。在自愈合水凝胶的应用中,其自愈能力和机械强度是至关重要的,但这两个属性通常是无法同时拥有的。因此,基于可逆非共价键和可逆共价键结合的双网络自愈合水凝胶受到广泛关注,研究开发具有高机械强度的自修复水凝胶将是未来的发展趋势。此外,如何简化自修复水凝胶的制备方法以及提高水凝胶的愈合效率也是未来的研究重点。
| [1] |
ASHRAF S, PARK H K, PARK H, et al. Snapshot of phase transition in thermoresponsive hydrogel PNIPAM:role in drug delivery and tissue engineering[J]. Macromolecular Research, 2016, 24(4): 297-304. |
| [2] |
LI J, GU J, WANG B, et al. Activation of dopamine D1 receptors regulates dendritic morphogenesis through Rac1 and RhoA in prefrontal cortex neurons[J]. Molecular Neurobiology, 2015, 51(3): 1024-1037. |
| [3] |
KIM K, BAE B, KANG Y J, et al. Natural polypeptide-based supramolecular nanogels for stable noncovalent encapsulation[J]. Biomacromolecules, 2013, 14(10): 3515-3522. |
| [4] |
MICHELSEN V B, MOE G, JENSEN E, et al. Quantitative analysis of TEGDMA and HEMA eluted into saliva from two dental composites by use of GC/MS and tailor-made internal standards[J]. Dental Materials, 2008, 24(6): 724-731. |
| [5] |
SACCO P, SECHI A, TREVISAN A, et al. A silver complex of hyaluronan-lipoate (SHLS12):synthesis, characterization and biological properties[J]. Carbohydrate Polymers, 2016, 136: 418-426. |
| [6] |
董建成, 葛孝栋, 王清清, 等. 阳离子光敏抗菌型水凝胶的制备及性能表征[J]. 材料工程, 2019, 47(2): 60-65. DONG J C, GE X D, WANG Q Q, et al. Preparation and property characterization of cationic photoantimicrobial hydrogel[J]. Journal of Materials Engineering, 2019, 47(2): 60-65. |
| [7] |
SUTAR P B, MISHRA R K, PAL K, et al. Development of pH sensitive polyacrylamide grafted pectin hydrogel for controlled drug delivery system[J]. Journal of Materials Science Materials in Medicine, 2008, 19(6): 2247-2253. |
| [8] |
ASSAF S M, ABUL-HAIJA Y M, FARES M M. Versatile pectin grafted poly (N-isopropylacrylamide); modulated targeted drug release[J]. Journal of Macromolecular Science:Part A, 2011, 48(6): 493-502. |
| [9] |
TOOHEY K S, SOTTOS N R, LEWIS J A, et al. Self-healing materials with microvascular networks[J]. Nature Materials, 2007, 6(8): 581-585. |
| [10] |
HAMILTON A R, SOTTOS N R, WHITE S R. Self-healing of internal damage in synthetic vascular materials[J]. Advanced Materials, 2010, 22(45): 5159-5163. |
| [11] |
PATRICK J F, HART K R, KRULL B P, et al. Self-healing:continuous self-healing life cycle in vascularized structural composites[J]. Advanced Materials, 2014, 26(25): 4302-4308. |
| [12] |
张亚玲, 杨斌, 许亮鑫, 等. 基于动态化学的自愈性水凝胶及其在生物医用材料中的应用研究展望[J]. 化学学报, 2013, 71(4): 485-492. ZHANG Y L, YANG B, XU L X, et al. Self-healing hydrogels based on dynamic chemistry and their bio-medical applications[J]. Acta Chimica Sinica, 2013, 71(4): 485-492. |
| [13] |
BLAISZIKl B J, KRAMER S L B, OLUGEBEFOLA S C, et al. Self-healing polymers and composites[J]. Annual Review of Materials Research, 2010, 40(5): 179-211. |
| [14] |
BROCHU A B W, CRAIG S L, REICHERT W M. Self-healing biomaterials[J]. Journal of Biomedical Materials Research Part A, 2011, 96A(2): 492-506. |
| [15] |
SAHA S, BACHL J, KUNDU T, et al. Amino acid-based multiresponsive low-molecular weight metallohydrogels with load-bearing and rapid self-healing abilities[J]. Chemical Communications, 2014, 50(23): 3004-3006. |
| [16] |
HUSSAIN I, SAYED S M, LIU S, et al. Glycogen-based self-healing hydrogels with ultra-stretchable, flexible, and enhanced mechanical properties via sacrificial bond interactions[J]. International Journal of Biological Macromolecules, 2018, 117: 648-658. |
| [17] |
CAO J, MENG L, ZHENG S, et al. Self-healing supramolecular hydrogels fabricated by cucurbit uril-enhanced π-π interaction[J]. International Journal of Polymeric Materials and Polymeric Biomaterials, 2016, 65(10): 537-542. |
| [18] |
CAI T, HUO S, WANG T, et al. Self-healable tough supramolecular hydrogels crosslinked by poly-cyclodextrin through host-guest interaction[J]. Carbohydrate Polymers, 2018, 193: 54-61. |
| [19] |
TUNCABOYLU D C, SARI M, OPPERMANN W, et al. Tough and self-healing hydrogels formed via hydrophobic interactions[J]. Macromolecules, 2011, 44(12): 4997-5005. |
| [20] |
JIANG G, LIU C, LIU X, et al. Self-healing mechanism and mechanical behavior of hydrophobic association hydrogels with high mechanical strength[J]. Journal of Macromolecular Science:Part A, 2010, 47(4): 335-342. |
| [21] |
YUAN N, XU L, XU B, et al. Chitosan derivative-based self-healable hydrogels with enhanced mechanical properties by high-density dynamic ionic interactions[J]. Carbohydrate Polymers, 2018, 193: 259-267. |
| [22] |
DENG C C, BROOKS W L A, ABBOUD K A, et al. Boronic acid-based hydrogels undergo self-healing at neutral and acidic pH[J]. ACS Macro Letters, 2015, 4(2): 220-224. |
| [23] |
CASH J J, KUBO T, BAPAT A P, et al. Room-temperature self-healing polymers based on dynamic-covalent boronic esters[J]. Macromolecules, 2015, 48(7): 2098-2106. |
| [24] |
CANADELL J, GOOSSENS H, KLUMPERMAN B. Self-healing materials based on disulfide links[J]. Macromolecules, 2011, 44(8): 2536-2541. |
| [25] |
CHENG C, ZHANG X, MENG Y, et al. Multiresponsive and biocompatible self-healing hydrogel:its facile synthesis in water, characterization and properties[J]. Soft Matter, 2017, 13(16): 3003-3012. |
| [26] |
LIU J, ZHANG X, CHEN X, et al. Stimuli-responsive dendronized polymeric hydrogels through schiff-base chemistry showing remarkable topological effects[J]. Polymer Chemistry, 2018, 9(10): 378-387. |
| [27] |
XU C, ZHAN W, TANG X, et al. Self-healing chitosan/vanillin hydrogels based on schiff-base bond/hydrogen bond hybrid linkages[J]. Polymer Testing, 2018, 66: 155-163. |
| [28] |
张鸿鑫, 鲁路, 李立华, 等. 海藻酸动态共价交联水凝胶的制备及其自愈合性能[J]. 高分子学报, 2016(3): 368-374. ZHANG H X, LU L, LI L H, et al. Alginate-based self-healing and pH-responsive hydrogels formed by dynamic covalent bonding[J]. Acta Polymerica Sinica, 2016(3): 368-374. |
| [29] |
NEAL J, MOZHDEHI D, GUAN Z. Enhancing mechanical performance of a covalent self-healing material by sacrificial non-covalent bonds[J]. Journal of the American Chemical Society, 2015, 137(14): 4846-4850. |
| [30] |
KUHL N, BODE S, HAGER M D, et al. Self-healing polymers based on reversible covalent bonds[J]. 2015, 25: 3295-3352.
|
| [31] |
RAO Z, INOUE M, MATSUDA M, et al. Quick self-healing and thermo-reversible liposome gel[J]. Colloids and Surfaces:B, 2011, 82(1): 196-202. |
| [32] |
NOWAK A P, BREEDVELD V, PAKSTIS L, et al. Rapidly recovering hydrogel scaffolds from self-assembling diblock copolypeptide amphiphiles[J]. Nature, 2002, 417(6887): 424-428. |
| [33] |
LI J, MO L, LU C H, et al. Functional nucleic acid based hydrogels for bioanalytical and biomedical applications[J]. Chemical Society Reviews, 2016, 45(5): 1410-1431. |
| [34] |
SUN J Y, ZHAO X, ILLEPERUMA W R, et al. Highly stretchable and tough hydrogels[J]. Nature, 2012, 489(7414): 133-136. |
| [35] |
HIDHLEY C B, RODELL C B, BURDICK J A. Direct 3D printing of shear-thinning hydrogels into self-healing hydrogels[J]. Advanced Materials, 2015, 27(34): 5075-5079. |
| [36] |
RODELL C B, KAMINSKI A L, BURDICK J A. Rational design of network properties in guest-host assembled and shear-thinning hyaluronic acid hydrogels[J]. Biomacromolecules, 2013, 14(11): 4125-4134. |
| [37] |
KANG H W, LEE S J, KO I K, et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity[J]. Nature Biotechnology, 2016, 34(3): 312-319. |
| [38] |
GAHARWAR A K, AVERY R K, ASSMANN A, et al. Shear-thinning nanocomposite hydrogels for the treatment of hemorrhage[J]. ACS Nano, 2014, 8(10): 9833-9842. |
| [39] |
HOU S, WANG X, PARK S, et al. Rapid self-integrating, injectable hydrogel for tissue complex regeneration[J]. Advanced Healthcare Materials, 2015, 4(10): 1491-1495. |
| [40] |
AMEYA P, CHAO Z, BEDRI A, et al. Rapid self-healing hydrogels[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(12): 4383-4388. |
| [41] |
HARAGUCHI K, UYAMA K, TANIMOTO H. Self-healing in nanocomposite hydrogels[J]. Macromol Rapid Commun, 2011, 32(16): 1253-1258. |
| [42] |
ZHANG H, XIA H, ZHAO Y. Poly (vinyl alcohol) hydrogel han autonomously self-heal[J]. ACS Macro Letters, 2012, 1(11): 1233-1236. |
| [43] |
WANG Y, WANG Z, WU K, et al. Synthesis of cellulose-based double-network hydrogels demonstrating high strength, self-healing, and antibacterial properties[J]. Carbohydrate Polymers, 2017, 168: 112-120. |
| [44] |
杨倩, 李学锋, 龙世军, 等. 多价金属离子增强琼脂-聚丙烯酸复合双网络水凝胶及其自修复性能[J]. 复合材料学报, 2017, 34(7): 1416-1422. YANG Q, LI X F, LONG S J, et al. Self-healing properties of various multivalent cations reinforced agar-polyacrylic acid composite double network hydrogels[J]. Acta Materiae Compositae Sinica, 2017, 34(7): 1416-1422. |
| [45] |
SHI L, HAN Y, HILBORN J, et al. "Smart" drug loaded nanoparticle delivery from a self-healing hydrogel enabled by dynamic magnesium-biopolymer chemistry[J]. Chemical Communications, 2016, 52(74): 11151-11154. |
| [46] |
JIANG G, LIU C, LIU X, et al. Network structure and compositional effects on tensile mechanical properties of hydrophobic association hydrogels with high mechanical strength[J]. Polymer, 2010, 51(6): 1507-1515. |
| [47] |
TUNCABOYLU D C, ARGUN A, SAHIN M, et al. Structure optimization of self-healing hydrogels formed via hydrophobic interactions[J]. Polymer, 2012, 53(24): 5513-5522. |
| [48] |
TAKASHIMA Y, HATANAKA S, OTSUBO M, et al. Expansion-contraction of photoresponsive artificial muscle regulated by host-guest interactions[J]. Nature Communications, 2012, 3(1): 1270-1277. |
| [49] |
WANG Z, REN Y, ZHU Y, et al. A novel rapidly self-healing host-guest supramolecular hydrogel with high mechanical strength and excellent biocompatibility[J]. Angewandte Chemie International Edition, 2018, 57(29): 9008-9012. |
| [50] |
RODELL C B, WADE R J, PURCELL B P, et al. Selective proteolytic degradation of guest-host assembled, injectable hyaluronic acid hydrogels[J]. ACS Biomaterials Science and Engineering, 2015, 1(4): 277-286. |
| [51] |
LIU X, ZHONG M, SHI F, et al. Multi-bond network hydrogels with robust mechanical and self-healable properties[J]. Polymer Science, 2017, 35(10): 1253-1267. |
| [52] |
GUO Y, ZHOU X, TANG Q, et al. Self-healable and easy-recyclable supramolecular hydrogel electrolyte for flexible supercapacitors[J]. J Mater Chem:A, 2016, 4: 8769-8776. |
| [53] |
LU S, GAO C, XU X, et al. Injectable and self-healing carbohydrate-based hydrogel for cell encapsulation[J]. ACS Applied Materials and Interfaces, 2015, 7(23): 13029-13037. |
| [54] |
WEI Z, YANG J H, LIU Z Q, et al. Novel biocompatible polysaccharide-based self-healing hydrogel[J]. Advanced Functional Materials, 2015, 25(9): 1352-1359. |
| [55] |
QIAO L, LIU C, LIU C, et al. Self-healing alginate hydrogel based on dynamic acylhydrazone and multiple hydrogen bonds[J]. Journal of Materials Science, 2019, 160: 246-253. |
| [56] |
CHEN W P, HAO D Z, HAO W J, et al. Hydrogel with ultra-fast self-healing property both in air and underwater[J]. ACS Applied Materials and Interfaces, 2017, 10(1): 1258-1265. |
| [57] |
CHEN Q, ZHU L, ZHAO C, et al. A robust, one-pot synthesis of highly mechanical and recoverable double network hydrogels using thermoreversible sol-gel polysaccharide[J]. Advanced Materials, 2013, 25(30): 4171-4176. |
| [58] |
ZHU P, HU M, DENG Y, et al. One-pot fabrication of a novel agar-polyacrylamide/graphene oxide nanocomposite double network hydrogel with high mechanical properties[J]. Advanced Engineering Materials, 2016, 18(10): 1799-1807. |
| [59] |
LV Y, PAN Z, SONG C, et al. Locust bean gum/gellan gum double-network hydrogels with superior self-healing and pH-driven shape-memory properties[J]. Soft Matter, 2019, 15(30): 6171-6179. |
| [60] |
KEMP M, GO Y M, JONES D P. Nonequilibrium thermodynamics of thiol/disulfide redox systems:a perspective on redox systems biology[J]. Free Radical Biology and Medicine, 2008, 44(6): 921-937. |
| [61] |
BLACK S P, SANDERS J K, STEFANKIEWICZ A R. Disulfide exchange:exposing supramolecular reactivity through dynamic covalent chemistry[J]. Chemical Society Reviews, 2014, 43(6): 1861-1872. |
| [62] |
BANG E K, LISTA M, SFORAZZINI G, et al. Poly(disulfide)s[J]. Chemical Science, 2012, 3(6): 1752-1763. |
| [63] |
MICHAL B T, JAYE C A, SPENCER E J, et al. Inherently photohealable and thermal shape-memory polydisulfide networks[J]. ACS Macro Letters, 2013, 2(8): 694-699. |
| [64] |
YOON J A, KAMADA J, KOYNOV K, et al. Self-healing polymer films based on thiol-disulfide exchange reactions and self-healing kinetics measured using atomic force microscopy[J]. Macromolecules, 2012, 45(1): 142-149. |
| [65] |
BARCAN G A, ZHANG X, WAYMOUTH R M. Structurally dynamic hydrogels derived from 1, 2-dithiolanes[J]. Journal of the American Chemical Society, 2015, 137(17): 5650-5653. |
| [66] |
DENG G, LI F, YU H, et al. Dynamic hydrogels with an environmental adaptive self-healing ability and dual responsive sol-gel transitions[J]. ACS Macro Letters, 2012, 1(2): 275-279. |
 2020, Vol. 48
2020, Vol. 48