文章信息
- 蔺佳明, 赵桃林, 王育华
- LIN Jia-ming, ZHAO Tao-lin, WANG Yu-hua
- Li2ZrO3包覆锂离子电池正极材料Li[Li0.2Ni0.2Mn0.6]O2的制备及其电化学性能
- Fabrication and electrochemical performance of Li[Li0.2Ni0.2Mn0.6]O2 coated with Li2ZrO3 as cathode material for lithium-ion batteries
- 材料工程, 2020, 48(3): 112-120
- Journal of Materials Engineering, 2020, 48(3): 112-120.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.000190
-
文章历史
- 收稿日期: 2019-03-04
- 修订日期: 2019-12-30
作为新型绿色电源,锂离子电池[1-2]具有工作电压高、能量密度高、安全性能好、循环寿命长、自放电率低、无记忆效应和环保无污染等优点,在便携式电子产品(笔记本电脑、移动电话、摄录机等)等领域占据主导地位,并逐步向大型动力电源(电网调峰、大规模储电等)和交通动力电源(电动汽车、混合电动汽车等)等领域拓展[3]。
高性能正极材料的研发是发展高性能锂离子电池的关键与基础。传统正极材料(LiCoO2[4], LiMn2O4[5], LiFePO4[6], LiNi1/3Co1/3Mn1/3O2[7]等)的质量比容量大都低于200 mAh·g-1,已经不能满足人们对二次电池高能量和高功率的需求。层状富锂锰基正极材料[8]的表达式可表示为Li[LixM1-x]O2或xLi2MnO3·(1-x)LiMO2(M=Co,Fe,Ni1/2Mn1/2等,0≤x≤1),是由R3m结构的LiMO2组分与C2/m结构的Li2MnO3组分构成[9-10]。该类正极材料具有特殊的充放电机制,特殊点在于其首次充电过程中存在的两个不同平台且存在不可逆的首圈容量损失,放电比容量较高(大于250 mAh·g-1)、热稳定性良好、充放电电压范围较宽、价格低廉、对环境友好,被认为是当前商业化LiCoO2材料很有前景的替代品。但其仍然存在一些问题,例如,首次不可逆容量损失较高以及较低的库仑效率[11]。首次不可逆容量损失与该类材料的特殊充放电机制有关。首次充电时,富锂材料中的Li+以Li2O的形式从Li2MnO3相中脱出,同时氧空位消失,发生晶体结构的转变,导致可插入Li+的活性位点减少,而放电时这部分Li+无法再全部回嵌到原有的晶格,从而造成较高的首次不可逆容量损失和较低的首次库仑效率[12]。另外,随着循环次数的增加,材料表面发生由层状向尖晶石相的结构转变[13],电极/电解液界面副反应逐渐增加,使电极表面的SEI膜逐渐增厚,电极极化和电池阻抗逐渐增大,从而导致较大的容量损失和较快的电压下降现象。
电极材料表面不仅作为Li+嵌入/脱出的主体,也是电极和电解质之间的接触面,因此,优化层状富锂锰基氧化物颗粒的表面非常重要。表面包覆层可稳定电极/电解液界面,保护电极材料表面不受电解液中HF酸的腐蚀,通过降低氧离子的活性抑制氧损失,以有效地保留更多的氧空位,也可改善材料表面的离子或电子导电性,抑制晶体表面层状相向尖晶石相的结构转变,最终有效缓解电压衰减问题,降低首次不可逆容量损失,提升材料的循环稳定性和倍率性能[14-17]。
锂离子导体具有高电导率、高电化学稳定性和较好的锂离子传导率,可以有效提高材料表面的电子和离子传导速率、稳定电极/电解液界面、减少表面副反应,对材料循环稳定性、倍率性能的提升具有显著效果[18-19]。目前,关于锂离子导体包覆富锂锰基正极材料Li[Li0.2Ni0.2Mn0.6]O2的研究较少,包覆层的选用多为传统材料,如苏银利等[20]通过利用非活性氧化物ZrO2包覆富锂材料Li[Li0.2Ni0.2Mn0.6]O2,阻止了正极材料与电解液的直接接触,提高了材料循环稳定性,包覆量为5%(质量分数,下同)的复合材料5 C倍率下放电比容量达到71 mAh·g-1,说明ZrO2包覆层抑制了高倍率下SEI膜的产生,改善了电荷转移反应动力学,提升了材料电化学性能。但此种包覆层材料是锂离子传导的绝缘体,不利于锂离子的扩散和正极材料界面间的电荷转移。Sun等[21]运用AlF3包覆改性富锂材料Li[Li0.19Ni0.16Co0.08Mn0.57]O2,通过XRD,SEM,电化学性能测试等手段研究得出,AlF3包覆层会使材料内部的层状结构向尖晶石相转变,使得首次充电过程中4.5 V平台的容量减少,即不可逆容量损失减少,最终提高了该材料的首次库仑效率,但此类包覆层材料是锂离子传导的绝缘体,不利于锂离子的扩散和正极材料界面间的电荷转移,虽然可以通过影响本体材料结构优化性能,但其改性效果仍不理想。
综上所述,本工作采用具有三维锂离子通道的锂离子导体Li2ZrO3作为表面包覆层材料,针对富锂锰基正极材料倍率性能和循环性能较差的问题,包覆改性富锂锰基正极材料Li[Li0.2Ni0.2Mn0.6]O2,研究不同包覆量Li2ZrO3对本体材料结构、形貌和电化学性能的影响,并探究包覆对材料电化学性能改善的内在机理。
1 实验 1.1 材料合成采用溶胶-凝胶法制备本体材料Li[Li0.2Ni0.2Mn0.6]O2。称取6.49 g CH3COOLi·H2O, 21.12 g柠檬酸溶解于50 mL去离子水,记为溶液A;称取2.54 g Ni(CH3COO)2·4H2O, 7.43 g Mn(CH3COO)2·4H2O溶解于50 mL去离子水中,记为溶液B;将溶液A放置磁力搅拌机进行匀速搅拌,然后将B溶液用一次性滴管逐滴加入,记为溶液C,用氨水调节溶液C的pH值为7~8,80 ℃水浴搅拌至形成凝胶,将凝胶放入鼓风干燥箱,4 ℃·min-1升温至250 ℃干燥4 h,产物为黑色蓬松固体。
将黑色固体用研钵研磨后放入马弗炉,4 ℃·min-1升温至400 ℃保温4 h进行预烧结,取出后进行研磨均匀。再放入马弗炉中4 ℃·min-1升温至900 ℃,保温反应8 h,随炉冷却至室温,取出目标产物,即Li[Li0.2Ni0.2Mn0.6]O2。
包覆过程:Zr(NO3)4·5H2O和C2H3LiO2·2H2O按照比例为1:2的摩尔比溶于乙醇中,形成澄清溶液,超声处理30 min,然后加入适当比例的Li[Li0.2Ni0.2Mn0.6]O2,70 ℃水浴搅拌至溶剂完全蒸发,然后放入马弗炉中以5 ℃·min-1的速率升温至650 ℃煅烧5 h,最后自然冷却至室温,得到包覆后材料,通过调节Li[Li0.2Ni0.2Mn0.6]O2和Zr(NO3)4·5H2O的比例控制包覆量为0%,1%,3%,5%,分别记作Zr0,Zr1,Zr3,Zr5。
1.2 材料表征采用D8ADVANCE型号的X射线衍射仪(XRD),分析材料的物相和晶体结构,用CuKα靶为辐射源,步长为0.02°,扫描范围(2θ)为10°~90°。采用INSPECT 850型扫描电子显微镜(SEM)实现对制备材料的表面形貌、颗粒大小的观察,加速电压为5 kV;采用SEM设备配置的EDS能谱仪(Xflash 6130)分析样品中的元素含量和分布状况。采用JEM-2100型透射电子显微镜,观测制备材料微小区域的精细结构,点分辨率为0.23 nm,晶格分辨率为0.14 nm,加速电压为80~200 kV。
1.3 电化学测试将制备得到的电极材料、导电剂(乙炔黑)和溶解在甲基吡咯烷酮(NMP)中的聚偏氟乙烯(PVDF)按质量比8:1:1的比例在玛瑙研钵中研磨使其混合均匀,之后将得到的浆料通过刮刀涂覆在铝箔上,在真空干燥箱80 ℃干燥一夜,用切片机对得到的电极片进行切片,制得直径11 mm的圆形电极片;将制备得到的电极片作为工作电极,金属锂片作为对电极,1 mol·L-1 LiPF6为电解液,Celgard2400为隔膜,在氩气手套箱中组装成CR2025型纽扣电池,最后用液压封口机将电池压实扣紧,在干燥器中陈化待测。
采用Land-CT2001A对电池进行恒流充放电循环测试,测试电压为2~4.8 V,采用0.1 C倍率(1 C=200 mA·g-1)对电池进行活化得到首次充放电曲线后,在0.5 C倍率下循环100周以观测电池的循环性能;采用CHI660E型电化学工作站进行循环伏安测试,初始电位为电池的开路电压,扫描高压范围为2~4.8 V,终止电压为2 V,扫描速率为0.2 mV·s-1,扫描段数为6段(3圈);使用CHI660E型电化学工作站进行阻抗测试,初始电位为电池的开路电压,测试频率范围为0.01~105 Hz,频率高于100 Hz时的扫描方式为F-T。
2 结果与讨论 2.1 XRD分析不同包覆比例样品的XRD图谱如图 1所示。4种样品均出现了富锂材料的衍射峰,且都为α-NaFeO2层状结构,R3m空间群,且较强的衍射强度说明了各材料的结晶度较高。Li2MnO3物相中的超晶格点阵衍射引起了20°~25°的衍射弱峰,属于C/2m空间群,对称性较低。另外,没有发现Li2ZrO3的特征峰,可能是由于包覆比例相对含量较低。同时,(018)/(110)和(006)/(102)这两组衍射峰的分裂情况可以显示材料层状结构的好坏。本工作所制备的样品中两组峰的分裂明显,这说明所制备材料的层状结构良好。另外,与包覆前样品相比较,包覆后样品的XRD图谱没有发生明显改变,这说明Li2ZrO3包覆层的引入不会改变富锂材料的晶体构型。
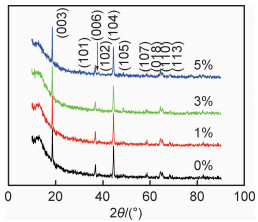
|
图 1 包覆前后材料的XRD对比图 Fig. 1 XRD patterns of the samples before and after coating |
图 2是4个样品Zr0,Zr1,Zr3,Zr5的SEM图。如图 2所示,不同样品的粒径尺寸和分布状态没有明显差别,颗粒均呈现为不规则的多面体状,粒径约为180 nm,并存在轻微的团聚现象;不同的是,未包覆样品Zr0颗粒的表面光滑清晰,包覆后3个样品Zr1,Zr3,Zr5的颗粒表面相对粗糙,且粗糙程度随包覆量的增加而变得明显。因此,推测富锂材料表面成功包覆上了Li2ZrO3。当包覆量为1%时,样品Zr1表面看不到颗粒状物质,包覆量增加至5%时,样品Zr5表面出现明显的纳米颗粒,推测可能是Li2ZrO3晶粒,且Li2ZrO3晶粒在材料表面分布比较均匀。

|
图 2 不同包覆比例样品的SEM图 (a)Zr0;(b)Zr1;(c)Zr3;(d)Zr5 Fig. 2 SEM images of Li[Li0.2Ni0.2Mn0.6]O2 with different coating ratios (a)Zr0;(b)Zr1;(c)Zr3;(d)Zr5 |
图 3(a)中的EDS点扫描图显示了Zr1材料中包含所预期的所有元素。图 3(b)中也展示了各个元素的原子分数,其中Zr元素的原子分数为0.26%,对应于Li2ZrO3包覆量为1%时的Zr原子分数,这说明Zr1样品的包覆比例控制良好;如图 3(c)~(f)所示,面扫描图像显示出样品中各个元素的分布状况均匀一致,尤其是,Zr元素分布均匀说明了包覆层均匀分布在样品表面。

|
图 3 样品Zr1的SEM图(a), EDS谱图(b), 以及O(c), Mn(d), Ni(e)和Zr(f)元素映射图 Fig. 3 SEM image(a), EDS spectrum(b) of sample Zrl, and elemental mappings of O(c), Mn(d), Ni(e), Zr(f) |
图 4是不同包覆比例样品Zr0,Zr1,Zr3,Zr5的TEM对比图。如图 4(a)所示,Zr0样品的颗粒表面光滑无杂质、边界清晰,而包覆后的3个样品Zr1,Zr3,Zr5的表面明显出现包覆层物质Li2ZrO3。Zr1和Zr3样品表面呈现纳米尺度的均匀包覆层,厚度分别为3.0 nm和5.5 nm。而当包覆量达到5%时,Zr5样品表面覆盖层分布不再呈现均匀分布,开始出现粒径约为20 nm的Li2ZrO3晶粒,这可能是晶体生长动力学导致的,由于Li2ZrO3与Li[Li0.2Ni0.2Mn0.6]O2同为金属氧化物,物理性质相似,在液态时二者有一定的浸润性,但由于表面张力的原因,Li2ZrO3同时也有自发收缩的趋势。在Li2ZrO3含量较少时,Li2ZrO3层厚度较薄,浸润性占了主导地位,使得Li2ZrO3平铺并包覆在了Li[Li0.2Ni0.2Mn0.6]O2的表面。当Li2ZrO3含量较大时,随着薄膜厚度的增加,表面张力占了主导地位,使得Li2ZrO3在Li[Li0.2Ni0.2Mn0.6]O2颗粒表面收缩团聚成小颗粒。包覆层物质Li2ZrO3具有良好的热稳定性和锂离子传导性,故材料表面均匀一致的Li2ZrO3包覆层可以阻止电极材料与电解液的直接接触,抑制表面副反应的发生,增强材料的结构稳定性,最终提高材料循环稳定性。当包覆层过厚或者分布不均匀时,可能阻碍Li+在电极和电解液之间的扩散以及电子的传输,也不利于材料结构保持稳定,导致电化学性能下降,所以适当的包覆形式和厚度变得尤为重要。
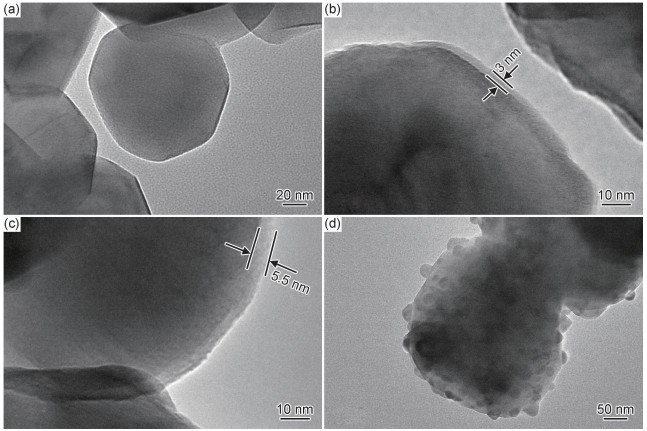
|
图 4 不同包覆量样品的TEM对比图 (a)Zr0;(b)Zr1;(c)Zr3;(d)Zr5 Fig. 4 TEM images of the samples with different coating ratios (a)Zr0;(b)Zr1;(c)Zr3;(d)Zr5 |
不同包覆比例的4种样品在0.1 C倍率下首次充放电曲线如图 5所示。4个样品的首次充电曲线都是由两部分组成:4.5 V以下的斜坡对应着Li+从富锂材料的锂层中脱出,脱出的过程伴随Ni2+被氧化为Ni4+;4.5 V左右的平台对应于Li2MnO3相的激活,Li和O以Li2O的形式脱出,并产生O2[22],这是富锂正极材料的特征充电曲线。首次放电过程中,O2释放产生的空位被过渡金属离子占据,使脱出的Li+不能全部回嵌到正极材料中,这导致了较高的不可逆容量损失,也是电池首次库仑效率较低的原因,包覆层的引入可能会缓解这一问题。
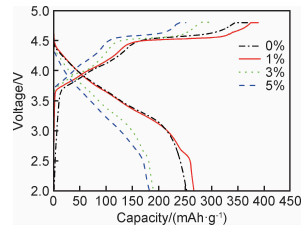
|
图 5 不同包覆量样品的首次充放电曲线 Fig. 5 First charge and discharge curves of samples with different coverage |
如表 1所示,Zr0,Zr1,Zr3,Zr5在0.1 C下的首次放电比容量分别为251.7,271.5,191.3 mAh·g-1和182.3 mAh·g-1。Zr1样品的首次放电比容量、库仑效率提高,首次不可逆容量损失较少,但Zr3和Zr5样品的首次放电比容量均明显降低。这可能是由于适当厚度的Li2ZrO3包覆层可以阻断电解液与正极材料的直接接触,减少副反应发生,提高比容量,还能够阻止过渡金属离子占据Li+回嵌的空位,从而减少首次不可逆容量的损失。但是,由于Li2ZrO3包覆层不具备电化学活性,其含量过多时会阻碍电荷转移和Li+的传递,导致电化学性能下降,Zr3和Zr5样品的电化学性能较差可以印证这一结论,Zr3的包覆层较厚可能会阻碍Li+的传递和Li2MnO3的激活而影响电化学性能,使库仑效率降低,Zr5首次库仑效率偏高是因为过量的包覆层物质阻碍了电解液与活性物质表面正常的电化学反应,减少了首次充电比容量,从而引起库仑效率的增加,但其并没有实质性意义。
| Coating ratio/% | Charge specific capacity/(mAh·g-1) | Discharge specific capacity/(mAh·g-1) | Loss specific capacity/(mAh·g-1) | Coulomb efficiency/% |
| 0 | 359.1 | 251.7 | 107.4 | 70.1 |
| 1 | 375.1 | 271.5 | 103.6 | 72.4 |
| 3 | 298.0 | 191.3 | 106.7 | 64.2 |
| 5 | 252.9 | 182.3 | 70.6 | 72.0 |
图 6为不同包覆比例下4个样品在0.5 C倍率下第5周次和第50周次的充放电曲线对比图。4个样品经过50周次循环后,充放电曲线保持状态良好,如图 6所示,Zr0,Zr1,Zr5样品比容量都出现了衰减,但Zr3样品50周次循环后放电比容量略大于第5周次,这是因为Zr3样品包覆层物质过多阻碍了Li2MnO3的激活,在后续电池充放循环中,富锂相逐渐被激活,抵消了部分容量损失导致。
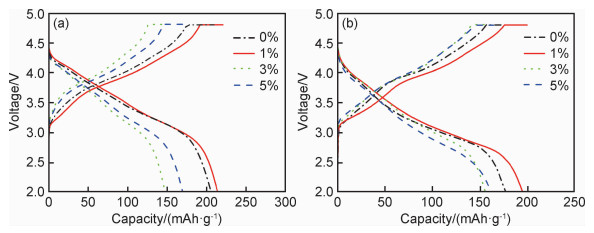
|
图 6 不同包覆量样品在不同循环周次后的充放电曲线 (a)5周次; (b)50周次 Fig. 6 Charge-discharge curves of the samples with different coating ratios at different cycles (a)5 cycles; (b)50 cycles |
4个样品在0.5 C倍率下充放电100周次的循环性能图见图 7。前两周次放电比容量较高,这是由于首周次未完全活化,第2周次充电过程中未被激活的Li2MnO3提供了额外容量。样品Zr0, Zr1, Zr3, Zr5在0.5 C倍率下第3周次的放电比容量分别为176.4,214.0,152.2 mAh·g-1和166.3 mAh·g-1。经过100周次循环后未包覆样品Zr0循环后的放电比容量为112.3 mAh·g-1,容量保持率为63.7%。而Zr1的放电比容量为191.5 mAh·g-1,容量保持率为89.5%,相较于包覆前样品其循环性能有了较大提升,这得益于Li2ZrO3包覆层防止了电解液与正极材料的直接接触,减少了表面副反应的发生,避免了较厚SEI膜的产生,减小了电荷转移阻抗,同时核壳结构的均匀包覆层结构可以在循环过程中对晶粒产生支撑作用,防止循环过程中锂离子脱嵌引起的层状结构破坏,保证了材料的结构稳定性。并且,包覆层可以阻止表面的过渡金属离子占据锂离子的脱出位置,从而提高了容量保持率。而当包覆量较高时(如Zr3和Zr5),较厚的包覆层会阻碍锂离子在电极和电解液之间的扩散和电子的传输,从而导致材料的电化学性能恶化。
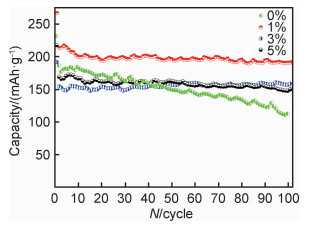
|
图 7 不同包覆比例样品0.5 C倍率下的循环性能 Fig. 7 Cycling performance of the samples with different coating ratios at 0.5 C |
图 8为4个样品在不同倍率(0.1 C,0.5 C,2 C,5 C)下进行循环的倍率性能图。所有样品的放电比容量随着放电倍率的升高而降低,这是由于电流增加导致电池内部极化增大。未包覆样品Zr0在低倍率循环时,显示出较高的放电比容量,0.1 C时放电比容量为225 mAh·g-1,0.2 C时放电比容量为180 mAh·g-1;随着放电倍率的增大,Zr0样品容量衰减严重,在2 C倍率下放电比容量不足50 mAh·g-1,这是因为高倍率下电极和电解液之间会产生较厚的SEI膜,增加了电荷转移阻抗。而包覆后样品高倍率下的性能明显提升,性能最优异的Zr1样品在5 C倍率下放电比容量仍有75 mAh·g-1,当再回到0.1 C充放电时,所有样品都表现出较高的容量,说明材料的高倍率耐受性能良好。由此可知,适当厚度的Li2ZrO3包覆层能阻碍较厚SEI膜的产生,并且可以有效防止材料在高倍率下充放时层状结构的破坏,保持结构稳定性,从而提高材料的倍率性能。
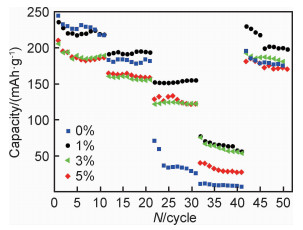
|
图 8 不同包覆比例样品的倍率性能 Fig. 8 Rate performance of the samples with different coating ratios |
如图 9中的循环伏安曲线所示,两种样品Zr0和Zr1在首次循环中均出现了两个氧化峰,4.25 V左右的氧化峰对应Ni2+氧化为Ni3+或Ni4+,4.8 V左右的峰对应Li2MnO3的激活,伴随Li2O的脱出,在后续循环中这个峰逐渐消失,说明Li2MnO3被完全激活。图中3.7 V附近的还原峰对应Ni4+还原为Ni2+的过程,而3.0 V附近的还原峰对应Mn4+还原为Mn3+的过程。通常,氧化峰和还原峰的电位差可以用于说明电化学反应的可逆性[23]。如图 9所示,未包覆样品前3周次的电位差分别为0.670,0.670 V和0.616 V,包覆后样品Zr1前3周的电位差分别为0.440,0.508 V和0.440 V。因此,包覆后样品的电位差明显低于未包覆样品,这说明Li2ZrO3包覆层可以降低电化学极化,提高电化学可逆性,这与包覆后样品Zr1的循环性能的良好表现相对应。
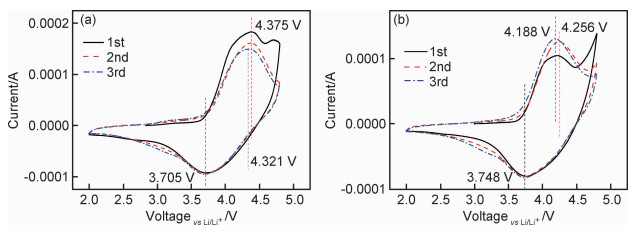
|
图 9 Zr0样品(a)和Zr1样品(b)在前3周次的循环伏安曲线 Fig. 9 Cyclic voltammetry curves of Zr0(a) and Zr1(b) for the first three cycles |
图 10为样品在循环前后的阻抗图,其中附有阻抗测试的等效电路图。低频率段的半圆弧代表电池的电荷转移阻抗,近似直线的高频段为锂离子在材料颗粒内部的扩散阻抗[24]。图 10(a)所示Zr1样品拥有最低的电荷转移阻抗,约为110 Ω,这是因为Li2ZrO3包覆层电导率较高。电荷转移阻抗的高低直接关系着材料的倍率性能,较低的阻抗说明材料具有较快的反应动力学,从而使材料的倍率性能良好,这与上述Zr1样品优异的倍率性能相印证。图 10(b)所示,在0.5 C下循环100周次后未包覆样品的电荷转移阻抗明显增大,约为600 Ω,而Zr1样品的阻抗提升不明显,这是因为循环过程中包覆层加强了材料的结构稳定性,与上述循环性能表现一致。
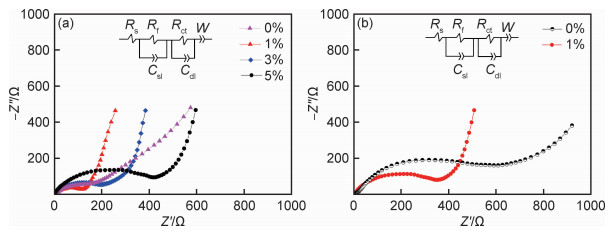
|
图 10 不同包覆比例样品的EIS阻抗图 (a)循环前;(b)0.5 C倍率100周次循环后 Fig. 10 EIS impedance spectra of the samples with different coating ratios (a)before cycling; (b)after cycling 100 cycles at 0.5 C |
(1) 将锂离子导体Li2ZrO3成功地包覆在富锂材料Li[Li0.2Ni0.2Mn0.6]O2表面,包覆层厚度随包覆比例的增大而增加。且包覆层的引入不会改变材料的晶体结构,不同包覆比例下包覆层的存在形态存在一定差别。
(2) 当包覆层为1%时,样品的电化学性能最好,首次放电比容量为271.5 mAh·g-1,库仑效率72.4%,首次容量损失减少;0.5 C循环100周次放电比容量为191.5 mAh·g-1,容量保持率89.5%,远高于未包覆样品的63.7%;5 C倍率下放电比容量提升明显,为75 mAh·g-1。但当包覆量更高时,会影响材料性能的发挥。通过优化电化学性能可知,最优包覆比例为1%。
(3) 均匀Li2ZrO3包覆层(厚度约为3 nm)可以在样品表面形成核壳结构,且不会阻碍Li+传递;会使样品层状结构更稳定,抑制循环过程中层状结构的转变;阻碍过渡金属进入材料内部,占据Li+的回嵌空位;减少表面副反应发生,阻止较厚SEI膜的生成。包覆后材料较优异的电化学性能得益于Li2ZrO3本身的高电导率、高锂离子传导率及其较好的电化学稳定性。
| [1] |
CHIANG Y M. Building a better battery[J]. Science, 2010, 330(6010): 1485-1486. DOI:10.1126/science.1198591 |
| [2] |
YOSHINO A. The birth of the lithium-ion battery[J]. Angewandte Chemie International Edition, 2012, 51: 5798-5800. DOI:10.1002/anie.201105006 |
| [3] |
THACKERAY M M, WOLVERTON C, ISAACS E D. Electrical energy storage for transportation-approaching the limits of, and going beyond, lithium-ion batteries[J]. Energy & Environmental Science, 2012, 5(7): 7854-7863. |
| [4] |
KALLURI S, YOON M, JO M, et al. Surface engineering strategies of layered LiCoO2 cathode material to realize high-energy and high-voltage Li-ion cells[J]. Advanced Energy Materials, 2016, 7(1): 1601507. |
| [5] |
SHAJU K M, BRUCE P G. A stoichiometric nano-LiMn2O4 spinel electrode exhibiting high power and stable cycling[J]. Chemistry Materials, 2008, 20(17): 5557-5562. DOI:10.1021/cm8010925 |
| [6] |
DELMAS C, MACCARIO M, CROGUENNEC L, et al. Lithium deintercalation in LiFePO4 nanoparticles via a domino-cascade model[J]. Nature Materials, 2008, 7(8): 665-671. DOI:10.1038/nmat2230 |
| [7] |
WU Y, CAO C, ZHU Y, et al. Cube-shaped hierarchical LiNi1/3Co1/3Mn1/3O2 with enhanced growth of nanocrystal planes as high-performance cathode materials for lithium-ion batteries[J]. Journal of Materials Chemistry A, 2015, 3: 15523-15528. DOI:10.1039/C5TA03225C |
| [8] |
XIE Y, SAUBANERE M, DOUBLET M L. Requirements for reversible extra-capacity in Li-rich layered oxides for Li-ion batteries[J]. Energy & Environmental Science, 2017, 10(1): 266-274. |
| [9] |
MANTHIRAM A, KNIGHT J C, et al. Nickel-rich and lithium-rich layered oxide cathodes:progress and perspectives[J]. Advanced Energy Materials, 2015, 6(1): 1501010. |
| [10] |
ZHENG J, MYEONG S, CHO W, et al. Li-and Mn-rich cathode materials:challenges to commercialization[J]. Advanced Energy Materials, 2016, 7(6): 1601284. |
| [11] |
YAN J, LIU X, LI B. Recent progress in Li-rich layered oxides as cathode materials for Li-ion batteries[J]. RSC Advanced, 2014, 4(108): 63268-63284. DOI:10.1039/C4RA12454E |
| [12] |
ARMSTRONG A R, HOLZAPFEL M, NOVAK P, et al. Demonstrating oxygen loss and associated structural reorganization in the lithium battery cathode Li[Ni0.2Li0.2Mn0.6]O2[J]. Journal of the American Chemical Society, 2006, 128(26): 8694-8698. DOI:10.1021/ja062027+ |
| [13] |
SATHIYA M, ABAKUMOV A M, FOIX D, et al. Origin of voltage decay in high-capacity layered oxide electrodes[J]. Nature Materials, 2015, 14(2): 230-238. DOI:10.1038/nmat4137 |
| [14] |
ZHANG J, ZHANG H, GAO R, et al. New insights into the modification mechanism of Li-rich Li1.2Mn0.6Ni0.2O2 coated by Li2ZrO3[J]. Physical Chemistry Chemical Physics, 2016, 18(19): 13322. DOI:10.1039/C6CP01366J |
| [15] |
SONG L, JIAO L, XIAO Z, et al. Thermoeletrochemical study on LiNi0.8Co0.1Mn0.1O2 with in situ modification of Li2ZrO3[J]. Ionics, 2018(1): 1-11. |
| [16] |
HU G, ZHANG M, WU L, et al. Enhanced electrochemical performance of LiNi0.5Co0.2Mn0.3O2 cathodes produced via nanoscale coating of Li+-conductive Li2SnO3[J]. Electrochimica Acta, 2016, 213: 547-556. DOI:10.1016/j.electacta.2016.07.154 |
| [17] |
MO Y, HOU B, LI D, et al. Enhanced high-rate capability and high voltage cycleability of Li2TiO3-coated LiNi0.5Co0.2Mn0.3O2 cathode materials[J]. RSC Advanced, 2016, 6(91): 88713-88718. DOI:10.1039/C6RA20035D |
| [18] |
KANG S H, THACKERAY M M. Enhancing the rate capability of high capacity xLi2MnO3·(1-x)LiMO2(M=Mn, Ni, Co) electrodes by Li-Ni-PO4 treatment[J]. Electrochemistry Communications, 2009, 11(14): 748-751. |
| [19] |
QIAO Q Q, ZHANG H Z, LI G R, et al. Surface modification of Li-rich layered Li(Li0.17Ni0.25Mn0.58)O2 oxide with Li-Mn-PO4 as the cathode for lithium-ion batteries[J]. Journal of Materials Chemistry:A, 2013, 1(17): 5262-5268. DOI:10.1039/c3ta00028a |
| [20] |
苏银利, 王丹, 陈丽, 等. ZrO2包覆富锂正极材料Li[Li0.2Ni0.2Mn0.6]O2[J]. 化学工业与工程, 2015, 32(4): 30-33. SU Y L, WANG D, CHEN L, et al. ZrO2 coated Li rich cathode material Li[Li0.2Ni0.2Mn0.6]O2[J]. Chemical Industry and Engineering, 2015, 32(4): 30-33. DOI:10.3969/j.issn.1006-7906.2015.04.007 |
| [21] |
SUN Y K, LEE M J, YOON C S, et al. The role of AlF3 coatings in improving electrochemical cycling of Li-enriched nickel-manganese oxide electrodes for Li-ion batteries[J]. Advanced Materials, 2012, 24(9): 1192-1196. DOI:10.1002/adma.201104106 |
| [22] |
岳鹏. 锂离子电池用富锂锰基正极材料的研究进展[J]. 山东化工, 2016, 45(18): 35-37. YUE P. Research progress of lithium rich manganese based cathode materials for lithium ion batteries[J]. Shandong Chemical Industry, 2016, 45(18): 35-37. DOI:10.3969/j.issn.1008-021X.2016.18.013 |
| [23] |
LIANG H, WANG Z, GUO H, et al. Improvement in the electrochemical performance of LiNi0.8Co0.1Mn0.1O2 cathode material by Li2ZrO3 coating[J]. Applied Surface Science, 2017, 423: 1045-1053. DOI:10.1016/j.apsusc.2017.06.283 |
| [24] |
ZHANG S, GU H, TIAN T, et al. Insight into the synergistic effect mechanism between the Li2MO3 phase and the LiMO2 phase (M=Ni, Co, and Mn) in Li- and Mn-rich layered oxide cathode materials[J]. Electrochimica Acta, 2018, 266: 66-77. DOI:10.1016/j.electacta.2018.01.175 |
 2020, Vol. 48
2020, Vol. 48


