文章信息
- 毕明刚, 张纪梅, 郝帅帅, 谢博尧
- BI Ming-gang, ZHANG Ji-mei, HAO Shuai-shuai, XIE Bo-yao
- 硫醇保护的银簇制备及其荧光检测应用的进展
- Development of preparation of thiol-protected silver clusters and fluorescence detection applications
- 材料工程, 2020, 48(2): 11-21
- Journal of Materials Engineering, 2020, 48(2): 11-21.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.000038
-
文章历史
- 收稿日期: 2019-01-13
- 修订日期: 2019-11-11
2. 天津工业大学 中空纤维膜材料与膜过程国家重点实验室, 天津 300387
2. State Key Laboratory of Hollow Fiber Membrane Materials and Process, Tianjin Polytechnic University, Tianjin 300387, China
相比于肉眼可见的金属材料来说,当金属纳米材料的粒径在100 nm以下时,在物理性质和化学性质等方面会展现出不同的特性[1-4]。当贵金属的尺寸进一步减少到大约1~2 nm或者更小,下降到几个或几十个原子组成,其能带结构变得不连续而被分离成不同的等级[5]。金属纳米簇(metal nanoclusters)是粒径在2 nm以下的超小的金属纳米粒子。它们具有分立的电子能级和唯一的几何结构。与粒径在2 nm以上的金属纳米粒子(metal nanoparticles)相比,金属纳米簇展现出特有的物理化学性质[6]。同时,超小的金属纳米簇具有类分子特性、良好的分子结构[7-15]、量子化的电荷现象[16-20]、HOMO-LUMO电子轨道[16]、分子磁性[21-23]、分子手性[9, 24-26]以及较强的发光性能[27-28]等优异的特性。
在新兴的金属纳米簇家族中,银纳米簇(silver nanocluster,AgNCs),简称银簇,已经吸引了广泛的关注。因为银簇不仅仅具有金属纳米簇的物理化学性质,它本身还具有抗感染性等特殊的性质。近来的研究发现,粒径小于1 nm的银簇对大多数细菌来说,展现出极好的抗菌性能[29-30]。另外,银簇特有的生物相容性和超小的粒径等性质[31],对于荧光纳米探针的构建创造了一个良好的平台[32],同时也在生物医疗方面展现出巨大的发展潜力。
近来研究人员发现,硫醇保护的银簇具有均一的尺寸、精细的结构和较大的比表面积等优异的特点,这在其研究过程中非常重要。硫醇保护银簇的合成方法种类繁多,优势各异[33-34]。通过细致地调控合成过程中各种反应物的物料比,人们已经提出了自上而下法和自下而上法等用于制备银簇的方法。本文对硫醇保护的银簇制备方法及相关应用进行了介绍,提出了金属纳米簇今后的研究热点和发展方向。
1 硫醇保护的纳米银簇的合成方法比起硫醇保护的金簇,在室温下,硫醇保护的银簇在溶液中不稳定,因此硫醇保护的纳米银簇的合成更具有挑战性,特别是在合成均一的尺寸和大比表面积的银簇。已经有文献报道了一些制备高稳定性银簇的方法,其中大多数是涉及湿化学法和液态化学法,只有少数方法使用固态合成法。硫醇保护的银簇的合成方法能够分成两大种类:自上而下法和自下而上法。这两种方法在银纳米粒子合成的过程中得到了广泛的应用。在自下而上法(bottom-up)中,Ag+被硼氢化钠(NaBH4)等还原剂还原为Ag0,然后通过尺寸聚集并生长成为小尺寸的纳米银簇。相比之下,在自上而下法(top-down)的过程中,粒径较大的银纳米粒子被用作银前驱体,在刻蚀剂的存在下能够被刻蚀为较小尺寸的银簇。因此,如果对合成过程中的各种条件能够进行精确地控制,自上而下法和自下而上法都能够用于制备尺寸均一的银簇。
对于硫醇保护的银簇来说,在自上而下法和自下而上法中所用到的化学试剂有很大的不同。在自下而上法合成银簇的关键步骤是Ag+的还原过程,这个过程中对于形成优质的纳米银簇来说,优化反应过程的还原动力过程是非常关键的。相比之下,自上而下法合成银簇的关键步骤是粒径较大的银纳米粒子的刻蚀过程,在刻蚀的过程中需要适宜的反应条件,确保刻蚀反应进行。在这一部分,通过列举有代表性的实例,讨论相关化学试剂对银簇合成的影响。
1.1 自下而上合成法迄今为止,自下而上合成法在巯基保护的银簇制备过程中应用十分普遍。该方法能够精细地调控反应试剂的量,同时具有合成时间短以及制备过程简单等特点。在制备过程中,当硫醇配体存在时,Ag+会还原为Ag0。硫醇配体与银原子之间形成的“硫-银键”非常强,因而硫醇配体可以作为银簇的保护基团。然而,如果在反应过程中使用了还原性非常强的硼氢化钠等还原剂,那么反应过程中的还原动力过程并不能够很好地控制,易导致多分散银簇的形成。因此,为了获得小尺寸的银簇,在合成过程中需要根据实际情况,通过采用不同的合成方法(如两步合成法和一步合成法),对刻蚀过程和聚集过程进行严格的控制。下面分别介绍硫醇保护的银簇的合成过程中的两步合成法(1.1.1)和一步合成法(1.1.2)。
1.1.1 两步合成法在经典的两步合成法过程中,在第一步中,Ag+经过还原之后形成了多分散的银簇中间体;在第二步中,多分散的银簇中间体经过刻蚀形成了单分散的银纳米簇,这是两个步骤,涉及两种不同的反应体系。在第一步中,硫醇-Ag(Ⅰ)配合物被还原,形成银簇中间体。在第二步中,得到的银簇中间体,作为粒子聚集的前驱体,通过刻蚀过程,形成单分散的银簇。所以,高效的两步合成法对每一步所涉及的条件都必须进行精确地调控。目前,很多研究人员已经通过控制银簇中间体的形成过程以及后续的刻蚀过程,成功制备了优质的硫醇保护的银簇。
对银簇中间体的粒径和结构进行调控是合成优质的银簇的关键所在。银簇中间体一般是在强还原剂存在的情况下,由硫醇-Ag(Ⅰ)配合物发生还原反应得到的物质,也是进行第二步刻蚀过程时开始的物质。因此所得到的银簇中间体的粒径和结构能够影响后续尺寸聚集的步骤,最终会生成不同性质的纳米簇。据文献报道,已经有很多成功的方法来调控银纳米簇中间体的粒径和结构。
(1) 探究还原动力过程的方法对硫醇-Ag(Ⅰ)配合物产生的影响
制备硫醇-Ag(Ⅰ)配合物时的还原动力过程对于银簇中间体的粒径和结构的形成非常关键。硼氢化钠是一种与硫醇-Ag(Ⅰ)配合物发生反应的常用还原剂。虽然其还原性很强,但是因为反应太过剧烈,所以并不能够得到粒径和结构均一的银簇。因此,硼氢化钠参与的还原过程,经常会产生粒径不均一的银簇中间体。为了使所合成的银簇中间体相对一致,一种方法是减缓反应的还原动力过程,即通过改变反应条件以减弱硼氢化钠的还原性。Branham等[35]探究了一种以4-(叔丁基)苄基硫醇(4-tert-butylbenzyl mercaptan,BBT)为保护层的银簇,该反应以硼氢化钠为还原剂,在冰浴条件下进行。由于低温可以有助于银簇的形成,从而使反应变慢并且能够良好地控制反应的还原动力过程。通过这种方法,一种单分散的硫醇保护的Ag140已经成功合成。在另一方面,有些特殊的溶剂也可以用来减弱硼氢化钠的还原性。例如,Negishi等[36]以4-(叔丁基)苄基硫醇为保护剂,制备了一种粒径为2.1 nm的Ag280(SBB)120纳米簇。该实验以四氢呋喃为溶剂,在0 ℃条件下,生成银纳米簇。在该条件下,有机溶剂能够减弱硼氢化钠的还原作用,减缓反应速率,从而有助于形成Ag280(SBB)120纳米簇。另外,改变反应体系的pH值以及还原剂的浓度也是常见的调控硼氢化钠还原能力的方式。
据文献报道,在制备银簇的过程中,可以在同一种制备方法中对还原动力过程和硫醇-Ag(Ⅰ)配合物进行统一调节。“循环还原-分解法”就是一个很好的例子[29, 37]。很多文献用这种方法有效地调节了硫醇-Ag(Ⅰ)配合物的粒径和结构及其还原动力过程,最终得到了粒径均匀分布的硫醇保护的银簇。如图 1所示,Yuan等[38]在“循环还原-分解法”的过程中,第一步是将谷胱甘肽(glutathione, GSH)和硝酸银在水中进行混合,形成了多种尺寸的硫醇-Ag(Ⅰ)配合物。之后,把一定量的硼氢化钠溶解到氢氧化钠中,抑制了硼氢化钠的水解,减弱了其还原性,把硫醇-Ag(Ⅰ)配合物还原为银簇中间体。用该方法得到的银簇中间体是多分散的,并且在水中不稳定,其在氧气和硫醇等物质共存的体系下分解为一种新型硫醇-Ag(Ⅰ)配合物。此时形成的新型硫醇-Ag(Ⅰ)配合物不仅具有比较小的粒径分布,而且能够抵抗硼氢化钠的进一步还原。所以,该方法有利于在尺寸聚集过程中单分散的银簇的形成。
(2) 探究不同配体对硫醇-Ag(Ⅰ)配合物产生的影响
在两步合成法过程中,第二步的作用是使之前所制备的银簇中间体发生尺寸聚集过程以形成单分散的银簇。因此,对于制备优质的银簇来说,具备一个合适的刻蚀环境是非常有必要的。温和的刻蚀条件往往是制备良好的纳米簇的重要保证。有文献报道了一种可逆的相转移的制备银簇的方法,把多分散、不稳定的银簇中间体转化为单分散、稳定的银簇[39-41]。Yuan等[39]通过“循环还原-分解法”制备了谷胱甘肽保护的银簇,在水相中,通过硼氢化钠的还原,得到了银簇中间体。然后将带有负电荷基团的银簇中间体转移到溶有十六烷基三甲基溴化铵(cetyltrimethylammonium bromide, CTAB)的甲苯溶液中,得到了一种核壳结构的银簇中间体。在甲苯中,银簇中间体被包裹着的十六烷基三甲基溴化铵阳离子缓慢刻蚀,最终形成单分散的银簇。
1.1.2 一步合成法比起两步合成法,一步合成法更加简单,能够以更迅速的方式生成硫醇保护的银簇。在该方法中,硫醇-Ag(Ⅰ)配合物经过还原过程会形成银簇中间体,同时银簇中间体经过“尺寸聚集”和“刻蚀”过程会形成硫醇保护的银簇。这些反应过程在银簇的形成过程中非常重要,都需要进行精细的调控,以下介绍一些有效地调控反应条件的方法。
在硫醇保护的银簇的合成过程中,硼氢化钠是一种常用的还原剂。一般来说,硼氢化钠的还原性较强,如果不经过仔细调控,会形成多分散的银簇。同时,在硫醇-Ag(Ⅰ)配合物的还原过程中,会伴有其他副反应发生。因此,减弱硼氢化钠的还原能力有利于形成优质的银簇。下面介绍通过改变溶液的pH、还原剂浓度等方式来调节硼氢化钠还原性的方法。
(1) 改变溶液的pH值
根据上述所提到的反应条件,调整溶液的pH值是一种能够调控硼氢化钠还原性的有效的方式。据文献报道,Adhikari等[42]以新鲜配制的二氢硫辛酸(dihydrolipoic acid,DHLA)和硝酸银溶液为反应物,混合后搅拌1 min,再缓慢加入过量的稀硼氢化钠溶液,反应2 h,最终得到了一种橘黄色的银簇溶液。经过高分辨率质谱仪(high resolution mass spectral,HRMS)表征之后,可知该银簇是由4个银原子(Ag4)或5个银原子(Ag5)组成,其粒径为1~3 nm。同时,该银簇对于Hg2+的检测范围为10-8~10-5 mol·L-1,检测限达到了10-10 mol·L-1。Muhammed等[43]以聚乙二醇(polyethylene glycol,PEG)和硫辛酸(lipoic acid,LA)为配体,以浓度较低的硼氢化钠为还原剂,合成了发红光的银簇,并且在LA-PEG配体存在的条件下,银簇的荧光强度会比单独LA作为配体的银簇强5倍,而且,该实验体系也证明了低浓度的硼氢化钠有助于形成高质量的银簇。Abdulhalim等[44]利用5-巯基-2-硝基苯甲酸为保护剂,制备了一种在水相中非常稳定的Ag44(SR)30纳米簇,在制备过程中,引入少量的氢氧化钠能够减弱硼氢化钠的还原性,从而有效地形成了Ag44纳米簇。Desireddy等[45]利用对巯基苯甲酸(p-mercaptobenzoic acid,p-MBA)为配体,合成了一种Ag44纳米簇。该实验在水相中进行,把硝酸银和p-MBA进行混合,形成了硫醇-Ag(Ⅰ)配合物。调节溶液pH为9.0,使硫醇-Ag(Ⅰ)配合物能够分解为银簇。然后将溶液pH进一步调节为12.0,这样能够尽可能地保护新合成的银簇。最后,把硼氢化钠溶液滴加到溶液中,对硫醇-Ag(Ⅰ)配合物进行还原,从而形成可调控的Ag44纳米簇。
(2) 使用“温和型”还原剂
除了调整pH值来减弱硼氢化钠的还原性以外,其他一些可以减弱硼氢化钠还原性的方法是用较温和的还原剂来代替硼氢化钠。近来,有文献已经报道了一些“温和型”还原剂,甲酸就是其中之一。Chakraborty等[46]通过控制体系的温度来调控银簇的还原过程。他们将硝酸银和GSH混合于37 ℃水相中,搅拌5 min。然后升温至70 ℃, 再加入一定量的甲酸,保持恒温3 h,得到了红棕色的Ag75(SG)40纳米簇。该方法合成的银簇荧光性强,水溶性好,升高反应温度能够增加溶液中硫醇配体的刻蚀能力,在还原和刻蚀过程中实现平衡调控,有助于粒径均一的银簇的制备。
(3) 其他方法
除了上述提到的制备银簇的方法外,还有其他一些制备粒径均一的银簇的方法,例如光照、超声波降解等方法都能创造有利于银簇形成的环境。Rao等[34]通过一种固态合成法用硝酸银和硫代琥珀酸(mercaptosuccinic acid,H2MSA)制备了发红光的Ag9(H2MSA)7簇,而且该方法也可以用来合成Ag32NCs和Ag152NCs。Zhou等[47]以谷胱甘肽为稳定剂,在水相中通过超声法制备了发蓝光的AgNCs纳米簇,该银簇对S2-具有极好的选择性,检测限达到了2 nmol·L-1。Santiago等[48]利用一种电化学法制备了分别以十二烷基醇和四丁基氨为保护层的Ag5和Ag6的纳米簇,二者均可溶于水相和有机相,纳米粒子的大小可以由电流密度进行精确调控。另外,Chakraborty等[49]在有机相中,将谷胱甘肽和硝酸银置于光照条件下,使Ag+还原为银簇。这种方法包括质子诱导的还原过程、自催化成核过程和有序的生长过程。
1.2 自上而下法自上而下法(top-down)是将粒径较大的银纳米粒子用作银前驱体,在刻蚀剂的存在下能够被刻蚀为较小尺寸的银簇。因此具有均一粒径分布的硫醇保护的银簇可以通过自上而下法制得。相比于自下而上法,自上而下法会耗费一些时间并且收率较低。通过控制反应过程中的刻蚀时间、反应温度和刻蚀剂与银前躯体的摩尔比等条件,才能够顺利地解决制备过程中遇到的相关问题。另外,有效的自上而下过程可以看作是自下而上过程的一种补充。
在自上而下过程中,刻蚀过程是把银纳米粒子转化为银纳米簇的关键步骤。因此只有具备了一种相对温和的刻蚀环境,才能够在反应体系中制备出粒径均一、结构稳定的银簇。例如,Rao等[50]利用H2MSA和硝酸银,制备了一种Ag@H2MSA纳米粒子,通过一种界面刻蚀过程可以把硫醇保护的Ag@H2MSA纳米粒子刻蚀为Ag8(H2MSA)8和Ag7(H2MSA)7纳米簇。另外,Dhanalakshmi等[51]制备了粒径为30~70 nm的Ag@citrate纳米粒子,严格控制体系温度为70 ℃,以硫代琥珀酸为刻蚀剂,通过刻蚀柠檬酸盐保护的银纳米粒子从而合成了Ag38NCs。如果想要把较大的银纳米粒子刻蚀为较小的银纳米簇需要在苛刻的反应体系下才能够实现。Le等[52]合成了谷胱甘肽保护的银簇,在65 ℃的条件下分别反应了1,3,8 d,对体系进行不同时间的刻蚀过程,分别得到了发红光、黄光、蓝光的银簇,而且三者的发射波长分别为720,570,450 nm。
1.3 合成方法的总结近年来,在硫醇保护的银簇的合成、表征以及生物领域等方面已经取得了很大进展。一些高效的制备方法已经合成了具有均一粒径分布的硫醇保护的银簇。在自下而上的过程中,对于合成原料进行细微地调控,无论是一步法还是两步法,都可以制备优质的银簇。另外,近来的很多文献都提到了硫醇保护的银簇的形成机理。在制备的过程中,一些高分辨率的表征技术已经成为观测其结构的有力工具。而且,银簇特有的物理化学性质,已经激发了科研工作者探究它们在生物医药、新能源、环境保护和催化等方面的应用。在生物医药领域中,硫醇保护的银簇不仅仅可以作为一种新型的抗菌剂,而且在生物传感以及生物成像方面也可以作为一种发光探针,这些应用在过去的研究当中都已经得到了证实。因此,相比于其他的材料来说,硫醇保护的银簇显示出更加优越的性能。
尽管近年来在硫醇保护的银簇的发展过程中,人们已经取得了很多非凡的成就,但其进一步发展仍面临着一些挑战。例如,设计一种高纯度、精细化的银簇的合成方案比较困难,如果涉及的试剂与反应条件稍有不同,很可能制备出的产物是不发光的银纳米粒子而不是发光银簇。另外,关于银簇发光机理的研究开展较少。因此,在以后银簇的合成过程中,特别是在合成高纯度、强荧光性、粒径均一的硫醇保护的银簇时,需要科研人员进一步探究更成熟、更高效、更便捷的方法。另外,除了合成同种核壳结构的银簇的方法以外,不同种类的硫醇保护的银簇的合成方法也需要进行探究。所制备的银簇对于基础应用研究有很重要的实际意义。例如,不同的配体对银簇的理化性能有不同的作用,而且精细地调控银簇的比表面积对探究其实际应用是非常关键的。需要注意的是,高效的合成方法极大地依赖于硫醇保护的银簇的形成过程或形成机理,但是,在机理方面的研究目前来说比较匮乏。在深入理解硫醇保护的银簇的形成机理的同时,还需要在理论研究和实验探索等方面做出更多的努力。一些相关理论和实验在金簇的合成方面已经得到了证实[53-54],其中相关的技术和理论已经在银簇的相关领域得到了借鉴和采纳。
2 硫醇保护的银簇在荧光检测中的应用随着纳米科技和生物技术的进步,贵金属纳米簇在催化、生物检测、生物标记等领域的应用越来越广泛。在生物检测方面,贵金属纳米簇作为传感器可用于检测生物分子、金属阳离子、无机阴离子、食源性致病菌、蛋白质和DNA等。在这一部分重点介绍一下近年来硫醇保护的银簇在检测Cu2+,Hg2+,I-等离子以及半胱氨酸等小分子方面的进展。
2.1 检测Cu2+和Hg2+重金属离子的污染已经对人们的身体健康和生活环境造成了严重影响,所以人们对重金属离子的关注度已经越来越高[55]。Hg2+和Cu2+是广泛存在于水、土壤和食物中的常见的重金属离子[56]。Hg2+在人体内的积累,会造成很多严重的后果。例如,身体器官会严重损害,排泄系统紊乱,肌肉协调性丧失,记忆功能衰退等等。另一方面,Cu2+在许多基本的生命过程中起着重要作用,如代谢,生长和免疫系统发育等等。临床研究表明,Cu2+缺乏会引起各种疾病,但是Cu2+浓度过高,也会对人体组织带来严重的影响。例如,人体长期接触高浓度的Cu2+中会导致细胞毒性[57]和肝肾损伤。因此,发展一种简单、快速、高效、敏感的检测Hg2+和Cu2+的传感探针是非常迫切的。
迄今为止,原子吸收光谱[58]、等离子体质谱分析[59]、电传感[60]、比色分析[61-62]以及荧光检测等许多先进的检测手段已经用于检测Cu2+和Hg2+。在这些检测手段当中,荧光检测法以其高敏感性、简单性以及反应迅速等特点已经成为一项备受青睐的方法。传统的有机染料被广泛用作检测重金属离子的荧光探针[63-64]。然而,有机染料存在较小的斯托克位移、光漂白性、较短的荧光寿命等缺陷。近来,无机荧光纳米材料因其强发光性、光稳定性、大斯托克位移性已经受到了广泛科研人员的关注。例如,CdS, CdSe和ZnS等荧光量子点已经广泛用于荧光检测[65-66]。其中,CdS量子点已经成功用于检测Hg2+[65],这些方法非常灵敏,但是涉及了较为苛刻和复杂的合成过程。
近年来,荧光纳米材料已经取得了令人瞩目的发展,比较有代表性的是金纳米簇和银纳米簇。这些纳米簇具有极小的粒径,低毒性和强荧光特性,所以它们可以用于生物标记、生物成像、化学催化和离子传感器[56, 67-69]等方面。
近来,文献中有很多关于硫醇保护的银簇的报道,例如Ag7(DMSA)4[33], Ag7, 8(MSA)7[34, 39], Ag9(MSA)7[34], Ag9(SG)6[29], Ag15(SG)11[70], Ag16(SG)9[29], Ag31(SG)19[70], Ag32(SG)19[70-71], Ag44(SR)30[72-73], Ag75(SG)40[49], Ag152(PET)60[74]等银簇,它们的分子式都是通过质谱仪表征得出(其中DMSA, MSA, SG和PET分别为2, 3-二巯基琥珀酸、巯基琥珀酸、谷胱甘肽和2-苯乙硫醇,均为硫醇盐形式)。
Baksi等[75]采用“一锅法”合成了单分散、发红光的Ag11(SG)7纳米簇。通过计算建模和先进的表征技术测试了该银簇的结构序列,同时经过检测一系列的金属离子(As3+, As5+, Cd2+, Co3+, Cu2+, Fe3+, Hg2+, Pb2+和Zn2+),发现Cu2+和Hg2+能够明显猝灭该银簇的荧光,其检测限已低于饮用水中Cu2+,Hg2+的标准。在研究过程中,通过理论模型和先进表征手段的结合,这为探究硫醇保护的银簇的结构和应用开创了新的思路。
Zhang等[76]利用硝酸银、氯金酸和牛血清白蛋白(bovine serum albumin,BSA)制备了一种硫醇保护的双金属合金簇(Au/AgNCs),可以作为一种新型的荧光探针。通过简单的一锅法,在反应体系中调控Au/Ag的摩尔比,来调控合金簇的荧光强度。出人意料的是,当Au:Ag=25:6时,该合金簇发出很强的荧光。重要的是,通过探究该合金簇对15种金属离子(Ag+, Na+, Hg2+, Pb2+, Fe2+, Fe3+, Mg2+, Cu2+, Ca2+, Zn2+, Ni2+, Ba2+, Cr3+, K+和Co2+)的荧光猝灭响应,发现仅仅对Hg2+和Cu2+展现出明显的荧光猝灭效果。通过高分辨率电镜和光谱仪等先进的仪器系统地探究了合金簇与Hg2+,Cu2+之间的作用机理。该合金簇相对于单一的金簇来讲,不仅仅增强了其最大荧光强度,而且也提高了检测Cu2+和Hg2+的能力。同时该合金簇对于检测血液中的Cu2+和Hg2+也具有较高的敏感性和选择性。
Ding等[77]通过将谷胱甘肽和硝酸银置于0 ℃体系中,反应7 h之后,制备了一种水溶性良好的Ag14(SG)12纳米簇。借助高分辨质谱仪、指纹光谱分析仪(fingerprint spectroscopy)等先进仪器对Ag14(SG)12纳米簇进行了基本表征,同时基于时间-密度泛函理论(time-dependent density functional theory,TD-DFT)推测了Ag14(SG)12纳米簇的基本组成和空间结构。检测了牛血清白蛋白、多巴胺(dopamine)、甘氨酸(glycine)、木瓜蛋白酶(papain)、胃蛋白酶(pepsin)、胰蛋白酶(trypsin)和溶菌酶(lysozyme)等常见试剂对Ag14(SG)12纳米簇荧光强度的影响,结果表明,除了木瓜蛋白酶会对该银簇的荧光强度造成微弱的增强以外,其他试剂几乎都不会使该银簇的荧光强度增强,而向该银簇中加入溶菌酶后,该银簇的荧光强度大大增强(荧光强度变为原来的3倍),说明所合成的Ag14(SG)12纳米簇对溶菌酶具有较好的选择性。
2.2 检测I-众所周知,在人体生理活动中,碘离子(I-)可以起到至关重要的作用。其中I-在体内的含量与甲减、甲亢[78-79]等一系列疾病相关。在过去几十年中,许多科研人员已经采用离子色谱法[80],原子吸收光谱测定法,比色测定法和化学发光分析法等方法检测I-。不过,这些经典的检测方法一方面耗时,另一方面成本较高。因此,探索一种简单、快速、高选择性的分析方法对于检测I-具有重要意义。
众所周知,荧光检测法是一种广泛应用于生物成像和离子检测的分析方法。目前大多数荧光检测法都是通过利用有机材料来合成荧光探针,以达到检测的目的。近年来,人们越来越关注贵金属纳米簇在荧光检测和生物医学成像等方面的应用,由于它们有较强的荧光特性及良好的生物相容性,因此已经广泛用于检测一些小分子和常见离子。
Xie等[68]通过Hg2+猝灭AuNCs荧光的实验,实现了对于Hg2+的超灵敏检测,Sun等[81]也开发了一些使用AgNCs或Au/AgNCs来检测Hg2+或Cu2+的荧光传感器。另一方面,通过利用贵金属纳米簇的荧光特性来检测Cl-,I-等无机阴离子的研究应该投入更多的关注。目前大多数的荧光检测法都是以荧光猝灭理论为基础,针对检测过程中的特异性、灵敏度和最低检测限等方面存在的问题都应该努力寻找突破口。此外,荧光探针的最大荧光强度和特异性识别能力有待于提高,特别是一些具有蓝色荧光的荧光探针,它们在复杂环境下会受到其他蛋白质发光团的影响,进而影响了探针的特异性检测。
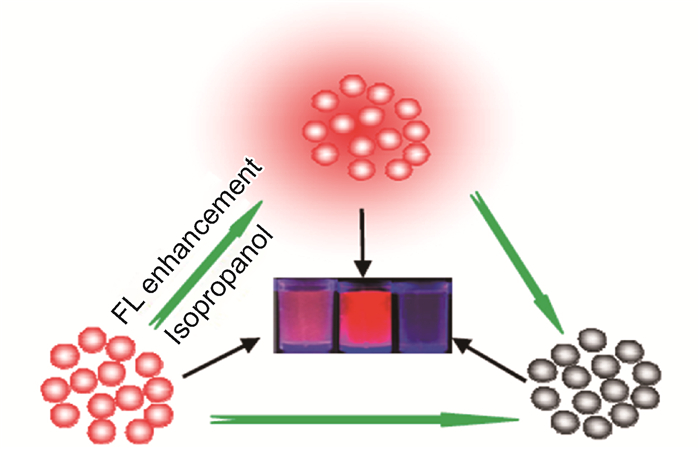
近年来人们越来越关注具有较高催化性能以及较强发光性能的银纳米材料的合成和应用[82]。然而,银簇在水中的不稳定性大大限制了其在特异性检测及生物传感等领域中的发展。因此,对于增强银簇在水中的稳定性而言,在其表面修饰一些功能集团是增强其稳定性及特异性识别能力的有效手段[81, 83-84]。科研人员在研究中发现,许多特殊溶剂的引入能够大大提高发光探针的发光性能和特异性识别能力[85]。例如,Feng等[86]总结了前人的研究,在体系中引入了异丙醇等有机试剂,将谷胱甘肽和硝酸银置于水相中,合成了分散性良好的银簇(如图 2所示)。图 2所示的机理图表明,当体系中存在异丙醇(isopropanol, IPA)时,银簇发红光的特性会急剧增强,经过I-的猝灭,其荧光强度会迅速减弱。同时实验还探究了正丙醇(n-propanol)、乙醇(ethanol)、乙二醇(ethyleneglycol)、甲醇(methanol)、水(water)等溶剂对银簇荧光强度(fluorescence intensity, FI)的影响。实验结果表明,该银簇的荧光强度因溶剂的种类而异(异丙醇>正丙醇>乙二醇>乙醇>甲醇>水)。同时该实验也对其他干扰离子(Cl-, HPO42-, H2PO4-, SO42-, Ac-, C2O42-, I-, CO32-, HCO32-, Br-, IO3-, NO3-, S2-和F-)的荧光猝灭实验进行了探究,结果发现,该银簇只对I-有特异性识别作用。已经有研究表明,尿液中I-的正常水平为0.79 μmol·L-1[87],在实际检测中,该银簇对尿液中I-的检测范围为0.010~10.0 μmol·L-1,并且最低检测限达到了7.50 nmol·L-1。在此基础上,科研人员应该进一步探究银簇在临床监测、生物传感与生物成像等方面的应用。
2.3 检测半胱氨酸等小分子半胱氨酸(cysteine,Cys)是一种生物体内常见的硫醇物质,在生物体内的代谢和排毒等生化反应中扮演了重要的角色[88-89]。Cys也被认可是一种潜在的神经毒素,可作为生物体内的一种标记物。例如,体内Cys缺乏会导致生长缓慢,头发脱色,水肿等疾病。因此,为了人们的身体健康,对于体内Cys的检测非常重要。传统的Cys检测是使用高分辨的分离技术,例如高效液相色谱,毛细管电泳耦合检测器等[90-91]。这些方法非常繁琐而且费时费力,因此研究一种快速、简单、廉价的Cys检测手段非常有实际意义。
目前,光学生物探针在检测Cys方面已经取得了有效的进展。一些具有光学活性的贵金属纳米材料因其具有优异的敏感性和选择性,从而在光学传感器的应用方面发挥了重要作用。现有两种纳米材料已经用于构建Cys探针, 一种是粒径在2~100 nm的纳米粒子,另一种是粒径小于2 nm的纳米簇。相比于粒径较大的纳米粒子而言,小粒径的纳米簇具有分立的能级和量化的电荷等特有性质。
Yuan等[92]报道了一种检测Cys的新型传感器,他们把谷胱甘肽和硝酸银混合到水中,通过剧烈搅拌,形成了“GSH-Ag(Ⅰ)配合物”,然后再加入硼氢化钠进行还原,从而得到了“谷胱甘肽保护的银簇(GSH-AgNCs)”(如图 3所示)。这主要是基于“GSH-Ag(Ⅰ)配合物”与“谷胱甘肽保护的银簇”之间的特定组合,从而实现了银簇对Cys的选择性和敏感性。该传感器的亮点是银簇受到了谷胱甘肽的保护。当把Cys添加到GSH-AgNCs体系时,其荧光猝灭效果非常明显,但是,当添加GSH以及其他的硫醇化合物时,其荧光强度几乎不变。所制备的GSH-AgNCs对Cys展现出极高敏感性,并且检测限低于3 nmol·L-1。通过电喷雾电离质谱(electrospray ionization mass spectrometry,ESI-MS)分析,提出该传感器检测Cys的机理:Cys可以穿透银簇的GSH保护层,将银簇分解,得到了硫醇-Ag配合物,导致了GSH-AgNCs发生荧光猝灭。然而,一些体积较大的硫醇配体,如BSA等大分子物质会被银簇的保护层屏蔽,不能与银簇表面的银原子发生作用,因此几乎不会对GSH-Ag NCs的荧光强度造成影响。
Chen等[93]以BSA和硝酸银为反应物,通过简单的湿法制备了BSA保护的银簇,再经过冻干进一步制得银簇粉末。该荧光探针能够快速检测Cys, Hcy(同型半胱氨酸)和GSH等物质。通过优化反应条件,得出Cys,Hcy和GSH的检测范围分别为2.0 × 10-6 ~9.0×10-5 mol·L-1,2.0×10-6~1.2×10-4 mol·L-1,1.0×10-5~8.0×10-5 mol·L-1, 同时,这三者的最低检测限分别为8.1×10-7 mol·L-1(Cys),1.0×10-6 mol·L-1(Hcy),1.1×10-6 mol·L-1(GSH)。该实验方法不仅能够用于人体血浆中Cys,Hcy和GSH等硫醇类物质的检测,而且加深了人们对于蛋白质和贵金属纳米簇之间作用机理的理解。
3 结束语本文总结了关于硫醇保护的银簇在合成方法、检测离子和检测小分子等方面的进展。近年来,贵金属纳米簇因其具有超小的粒径、良好的生物相容性、较长的荧光寿命、较强的组织穿透能力等特性而为人所熟知。尽管许多科研人员已经报道了贵金属纳米簇的一些特有属性,但其进一步发展依然面临许多挑战。
首先,比起半导体量子点以及有机染料来说,近来报道的贵金属纳米簇的量子产率较低。另外,在制备贵金属纳米簇的过程中,稍有不慎,产物的粒径就会有所差异。因此,研究者应该需要付出更多的努力来探寻高纯度、高量子产率、粒径均一的贵金属纳米簇的合成方法。同时对于贵金属纳米簇与重金属离子的反应机理及其自身的发光机理的理解是很重要的,这样可以进一步地推动合成更有意义的贵金属纳米簇。其次,尽管对于贵金属纳米簇的研究主要集中在金簇和银簇两个方面,但是考虑到金和银的价格比较昂贵,在不影响金属簇的基本功能的前提下,探究高纯度、多样性的合金簇或过渡金属纳米簇的合成越来越受到科研人员的青睐。最后,尽管许多文献已经报道了关于硫醇保护的银簇在生物成像方面的应用,但是对于银簇和生物分子之间的作用机理,应予以深入研究。另外,银簇在生物体内的安全性以及利用率等问题也需要进一步探究,这对于银簇未来的发展以及生命体的健康将有重要意义。
本文结合银簇的研究现状,介绍了硫醇保护的银簇的研究进展。随着技术的日新月异,开发高分辨率的分析仪器以及提升电子显微镜的成像水平,可以对银簇的结构进行更精细地表征,从而能够进一步了解银簇的物理性质和化学性质。基于硫醇保护的银簇的荧光传感材料的制备是未来热门的研究方向,这将有助于贵金属纳米簇在医疗诊断和生物传感等方面的发展。
| [1] |
DANIEL M C, ASTRUC D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology[J]. Chemical Reviews, 2004, 104(1): 293-346. DOI:10.1021/cr030698+ |
| [2] |
JAIN P K, LEE K S, EL-SAYED I H, et al. Calculated absorption and scattering properties of gold nanoparticles of different size, shape, and composition: applications in biological imaging and biomedicine[J]. Journal of Physical Chemistry B, 2006, 110(14): 7238-7248. DOI:10.1021/jp057170o |
| [3] |
KELLY K L, CORONADO E, ZHAO L L, et al. The optical properties of metal nanoparticles: the influence of size, shape, and dielectric environment[J]. Journal of Physical Chemistry B, 2003, 107(3): 668-677. DOI:10.1021/jp026731y |
| [4] |
DREADEN E C, ALKILANY A M, HUANG X, et al. The golden age: gold nanoparticles for biomedicine[J]. Chemical Society Reviews, 2012, 41(7): 2740-2779. DOI:10.1039/C1CS15237H |
| [5] |
李雨晴, 陈曦, 杨雪, 等. 纳米发光银簇的合成与应用研究进展[J]. 分析试验室, 2018, 37(9): 1096-1101. LI Y Q, CHEN X, YANG X, et al. Research progress in the synthesis and application of nano luminescent silver clusters[J]. Chinese Journal of Analysis Laboratory, 2018, 37(9): 1096-1101. |
| [6] |
刘颖, 陈春英. 纳米生物效应与安全性研究展望[J]. 科学通报, 2018, 63(35): 3825-3842. LIU Y, CHEN C Y. Prospect of nano biological effects and safety research[J]. Chinese Science Bulletin, 2018, 63(35): 3825-3842. |
| [7] |
HEAVEN M W, DASS A, WHITE P S, et al. Crystal structure of the gold nanoparticle [N(C8H17)4][ Au25(SCH2CH2Ph)18][J]. Journal of the American Chemical Society, 2008, 130(12): 3754-3755. DOI:10.1021/ja800561b |
| [8] |
ZENG C, QIAN H, LI T, et al. Total structure and electronic properties of the gold nanocrystal Au36(SR)24[J]. Angewandte Chemie-International Edition, 2012, 51(52): 13114-13118. DOI:10.1002/anie.201207098 |
| [9] |
QIAN H, ECKENHOFF W T, ZHU Y, et al. Total structure determination of thiolate-protected Au38 nanoparticles[J]. Journal of the American Chemical Society, 2010, 132(24): 8280-8281. DOI:10.1021/ja103592z |
| [10] |
QIAN H, ZHU M, WU Z, et al. Quantum sized gold nanoclusters with atomic precision[J]. Accounts of Chemical Research, 2012, 45(9): 1470-1479. DOI:10.1021/ar200331z |
| [11] |
AKOLA J, WALTER M, WHETTEN R L, et al. On the structure of thiolate-protected Au25[J]. Journal of the American Chemical Society, 2008, 130(12): 3756-3757. DOI:10.1021/ja800594p |
| [12] |
YUAN X, ZHANG B, LUO Z, et al. Balancing the rate of cluster growth and etching for gram-scale synthesis of thiolate-protected Au25 nanoclusters with atomic precision[J]. Angewandte Chemie-International Edition, 2014, 53(18): 4623-4627. DOI:10.1002/anie.201311177 |
| [13] |
DOU X, YUAN X, YAO Q, et al. Facile synthesis of water-soluble Au25-XAgX nanoclusters protected by mono- and bi-thiolate ligands[J]. Chemical Communications, 2014, 50(56): 7459-7462. DOI:10.1039/c4cc02261k |
| [14] |
YAO Q, YU Y, YUAN X, et al. Two-phase synthesis of small thiolate-protected Au15 and Au18 nanoclusters[J]. Small, 2013, 9(16): 2696-2701. DOI:10.1002/smll.201203112 |
| [15] |
YU Y, CHEN X, YAO Q, et al. Scalable and precise synthesis of thiolated Au10-12, Au15, Au18, and Au25 nanoclusters via pH controlled CO reduction[J]. Chemistry of Materials, 2013, 25(6): 946-952. DOI:10.1021/cm304098x |
| [16] |
MURRAY R W. Nanoelectrochemistry: metal nanoparticles, nanoelectrodes, and nanopores[J]. Chemical Reviews, 2008, 108(7): 2688-2720. DOI:10.1021/cr068077e |
| [17] |
CHEN S W, INGRAM R S, HOSTETLER M J, et al. Gold nanoelectrodes of varied size: transition to molecule-like charging[J]. Science, 1998, 280(5372): 2098-2101. DOI:10.1126/science.280.5372.2098 |
| [18] |
ANTONELLO S, ARRIGONI G, DAINESE T, et al. Electron transfer through 3d mono layers on Au25 clusters[J]. ACS Nano, 2014, 8(3): 2788-2795. DOI:10.1021/nn406504k |
| [19] |
VARNAVSKI O, RAMAKRISHNA G, KIM J, et al. Critical size for the observation of quantum confinement in optically excited gold clusters[J]. Journal of the American Chemical Society, 2010, 132(1): 16-17. DOI:10.1021/ja907984r |
| [20] |
RAMAKRISHNA G, VARNAVSKI O, KIM J, et al. Quantum-sized gold clusters as efficient two-photon absorbers[J]. Journal of the American Chemical Society, 2008, 130(15): 5032-5033. DOI:10.1021/ja800341v |
| [21] |
NEGISHI Y, TSUNOYAMA H, SUZUKI M, et al. X-ray magnetic circular dichroism of size-selected, thiolated gold clusters[J]. Journal of the American Chemical Society, 2006, 128(37): 12034-12035. DOI:10.1021/ja062815z |
| [22] |
ZHU M, AIKENS C M, HENDRICH M P, et al. Reversible switching of magnetism in thiolate-protected Au25 superatoms[J]. Journal of the American Chemical Society, 2009, 131(7): 2490-2492. DOI:10.1021/ja809157f |
| [23] |
ANTONELLO S, PERERA N V, RUZZI M, et al. Interplay of charge state, lability, and magnetism in the molecule-like Au25(SR)18 cluster[J]. Journal of the American Chemical Society, 2013, 135(41): 15585-15594. DOI:10.1021/ja407887d |
| [24] |
ZENG C, LI T, DAS A, et al. Chiral structure of thiolate-protected 28-gold-atom nanocluster determined by X-ray crystallography[J]. Journal of the American Chemical Society, 2013, 135(27): 10011-10013. DOI:10.1021/ja404058q |
| [25] |
ZHU M, QIAN H, MENG X, et al. Chiral Au25 nanospheres and nanorods: synthesis and insight into the origin of chirality[J]. Nano Letters, 2011, 11(9): 3963-3969. DOI:10.1021/nl202288j |
| [26] |
KNOPPE S, WONG O A, MALOLA S, et al. Chiral phase transfer and enantioenrichment of thiolate-protected Au102 clusters[J]. Journal of the American Chemical Society, 2014, 136(11): 4129-4132. DOI:10.1021/ja500809p |
| [27] |
YU Y, LUO Z, CHEVRIER D M, et al. Identification of a highly luminescent Au22(SG)18 nanocluster[J]. Journal of the American Chemical Society, 2014, 136(4): 1246-1249. DOI:10.1021/ja411643u |
| [28] |
GUIDEZ E B, AIKENS C M. Theoretical analysis of the optical excitation spectra of silver and gold nanowires[J]. Nanoscale, 2012, 4(14): 4190-4198. DOI:10.1039/c2nr30253e |
| [29] |
KIM J S, KUK E, YU K N, et al. Antimicrobial effects of silver nanoparticles[J]. Nanomedicine-Nanotechnology Biology and Medicine, 2007, 3(1): 95-101. DOI:10.1016/j.nano.2006.12.001 |
| [30] |
YUAN X, SETYAWATI M I, LEONG D T, et al. Ultrasmall Ag+-rich nanoclusters as highly efficient nanoreservoirs for bacterial killing[J]. Nano Research, 2014, 7(3): 301-307. DOI:10.1007/s12274-013-0395-6 |
| [31] |
孙欢欢, 卿太平, 步鸿昌, 等. 荧光金属纳米簇的合成及其在生物医学中的应用研究进展[J]. 分析测试学报, 2018, 37(10): 1119-1129. SUN H H, QING T P, BU H C, et al. Synthesis of fluorescent metal nanoclusters and their biomedical applications[J]. Journal of Instrumental Analysis, 2018, 37(10): 1119-1129. DOI:10.3969/j.issn.1004-4957.2018.10.002 |
| [32] |
XU H, SUSLICK K S. Water-soluble fluorescent silver nanoclusters[J]. Advanced Materials, 2010, 22(10): 1078-1082. DOI:10.1002/adma.200904199 |
| [33] |
WU Z, LANNI E, CHEN W, et al. High yield, large scale synthesis of thiolate-protected Ag7 clusters[J]. Journal of the American Chemical Society, 2009, 131(46): 16672-16674. DOI:10.1021/ja907627f |
| [34] |
RAO T U B, NATARAJU B, PRADEEP T. Ag9 quantum cluster through a solid-state route[J]. Journal of the American Chemical Society, 2010, 132(46): 16304-16307. DOI:10.1021/ja105495n |
| [35] |
BRANHAM M R, DOUGLAS A D, MILLS A J, et al. Arylthiolate-protected silver quantum dots[J]. Langmuir, 2006, 22(26): 11376-11383. DOI:10.1021/la062329p |
| [36] |
NEGISHI Y, ARAI R, NIIHORI Y, et al. Isolation and structural characterization of magic silver clusters protected by 4-(tert-butyl)benzyl mercaptan[J]. Chemical Communications, 2011, 47(20): 5693-5695. DOI:10.1039/c0cc05587e |
| [37] |
YUAN X, YAO Q, YU Y, et al. Traveling through the desalting column spontaneously transforms thiolated ag nanoclusters from non luminescent to highly luminescent[J]. Journal of Physical Chemistry Letters, 2013, 4(11): 1811-1815. DOI:10.1021/jz400807u |
| [38] |
YUAN X, SETYAWATI M I, TAN A S, et al. Highly luminescent silver nanoclusters with tunable emissions: cyclic reduction-decomposition synthesis and antimicrobial properties[J]. NPG Asia Materials, 2013, 5(39): 1-8. |
| [39] |
YUAN X, LUO Z, ZHANG Q, et al. Synthesis of highly fluorescent metal (Ag, Au, Pt, and Cu) nanoclusters by electrostatically induced reversible phase transfer[J]. ACS Nano, 2011, 5(11): 8800-8808. DOI:10.1021/nn202860s |
| [40] |
YUAN X, YEOW T J, ZHANG Q, et al. Highly luminescent Ag+ nanoclusters for Hg2+ ion detection[J]. Nanoscale, 2012, 4(6): 1968-1971. DOI:10.1039/c2nr11999d |
| [41] |
GUO W, YUAN J, WANG E. Oligonucleotide-stabilized Ag nanoclusters as novel fluorescence probes for the highly selective and sensitive detection of the Hg2+ ion[J]. Chemical Communications, 2009(23): 3395-3397. DOI:10.1039/b821518a |
| [42] |
ADHIKARI B, BANERJEE A. Facile synthesis of water-soluble fluorescent silver nanoclusters and Hg(Ⅱ) sensing[J]. Chemistry of Materials, 2010, 22(15): 4364-4371. DOI:10.1021/cm1001253 |
| [43] |
MUHAMMED M A H, ALDEEK F, PALUI G, et al. Growth of in situ functionalized luminescent silver nanoclusters by direct reduction and size focusing[J]. ACS Nano, 2012, 6(10): 8950-8961. DOI:10.1021/nn302954n |
| [44] |
ABDULHALIM L G, ASHRAF S, KATSIEV K, et al. A scalable synthesis of highly stable and water dispersible Ag44(SR)30 nanoclusters[J]. Journal of Materials Chemistry: A, 2013, 1(35): 10148-10154. DOI:10.1039/c3ta11785e |
| [45] |
DESIREDDY A, CONN B E, GUO J, et al. Ultrastable silver nanoparticles[J]. Nature, 2013, 501(7467): 399-402. DOI:10.1038/nature12523 |
| [46] |
CHAKRABORTY I, UDAYABHASKARARAO T, PRADEEP T. High temperature nucleation and growth of glutathione protected similar to Ag75 clusters[J]. Chemical Communications, 2012, 48(54): 6788-6790. DOI:10.1039/c2cc33099g |
| [47] |
ZHOU T, RONG M, CAI Z, et al. Sonochemical synthesis of highly fluorescent glutathione-stabilized Ag nanoclusters and S2- sensing[J]. Nanoscale, 2012, 4(14): 4103-4106. DOI:10.1039/c2nr30718a |
| [48] |
SANTIAGO G B, BLANCO M C, ARTURO L M. Single step electrochemical synthesis of hydrophilic/hydrophobic Ag5 and Ag6 blue luminescent clusters[J]. Nanoscale, 2012, 4(24): 7632-7635. DOI:10.1039/c2nr31994b |
| [49] |
CHAKRABORTY I, UDAYABHASKARARAO T, DEEPESH G K, et al. Sunlight mediated synthesis and antibacterial properties of monolayer protected silver clusters[J]. Journal of Materials Chemistry: B, 2013, 1(33): 4059-4064. DOI:10.1039/c3tb20603c |
| [50] |
RAO T U B, PRADEEP T. Luminescent Ag7 and Ag8 clusters by interfacial synthesis[J]. Angewandte Chemie-International Edition, 2010, 49(23): 3925-3929. DOI:10.1002/anie.200907120 |
| [51] |
DHANALAKSHMI L, UDAYABHASKARARAO T, PRAD-EEP T. Conversion of double layer charge-stabilized Ag@citrate colloids to thiol passivated luminescent quantum clusters[J]. Chemical Communications, 2012, 48(6): 859-861. DOI:10.1039/C1CC15604G |
| [52] |
LE G X, SPIES C, DAUM N, et al. Highly fluorescent silver nanoclusters stabilized by glutathione: a promising fluorescent label for bioimaging[J]. Nano Research, 2012, 5(6): 379-387. DOI:10.1007/s12274-012-0218-1 |
| [53] |
YU Y, LUO Z, YU Y, et al. Observation of cluster size growth in co-directed synthesis of Au25(SR)18 nanoclusters[J]. ACS Nano, 2012, 6(9): 7920-7927. DOI:10.1021/nn3023206 |
| [54] |
LUO Z, NACHAMMAI V, ZHANG B, et al. Toward understanding the growth mechanism: tracing all stable intermediate species from reduction of Au(Ⅰ)-thiolate complexes to evolution of Au25 nanoclusters[J]. Journal of the American Chemical Society, 2014, 136(30): 10577-10580. DOI:10.1021/ja505429f |
| [55] |
FU X, LOU T, CHEN Z, et al. "Turn-on" fluorescence detection of lead ions based on accelerated leaching of gold nanoparticles on the surface of graphene[J]. ACS Applied Materials & Interfaces, 2012, 4(2): 1080-1086. |
| [56] |
GUO C, IRUDAYARAJ J. Fluorescent Ag clusters via a protein-directed approach as a Hg(Ⅱ) ion sensor[J]. Analytical Chemistry, 2011, 83(8): 2883-2889. DOI:10.1021/ac1032403 |
| [57] |
LETELIER M E, LEPE A M, FAUNDEZ M, et al. Possible mechanisms underlying copper-induced damage in biological membranes leading to cellular toxicity[J]. Chemico-Biological Interactions, 2005, 151(2): 71-82. DOI:10.1016/j.cbi.2004.12.004 |
| [58] |
MATHUR R, BALARAM V, BABU S S. Determination of mercury in geological samples by cold vapour atomic absorption spectrometric technique[J]. Indian Journal of Chemistry Section A-Inorganic Bio-Inorganic Physical Theoretical & Analytical Chemistry, 2005, 44(8): 1619-1624. |
| [59] |
WU J, BOYLE E A. Low blank preconcentration technique for the determination of lead, copper, and cadmium in small-volume seawater samples by isotope dilution ICPMS[J]. Analytical Chemistry, 1997, 69(13): 2464-2470. DOI:10.1021/ac961204u |
| [60] |
ZHU Z, SU Y, LI J, et al. Highly sensitive electrochemical sensor for mercury(Ⅱ) ions by using a mercury-specific oligonucleotide probe and gold nanoparticle-based amplification[J]. Analytical Chemistry, 2009, 81(18): 7660-7666. DOI:10.1021/ac9010809 |
| [61] |
LIU D, QU W, CHEN W, et al. Highly sensitive, colorimetric detection of mercury(Ⅱ) in aqueous media by quaternary ammonium group-capped gold nanoparticles at room temperature[J]. Analytical Chemistry, 2010, 82(23): 9606-9610. DOI:10.1021/ac1021503 |
| [62] |
SUN Z, ZHANG N, SI Y, et al. High-throughput colorimetric assays for mercury(Ⅱ) in blood and wastewater based on the mercury-stimulated catalytic activity of small silver nanoparticles in a temperature-switchable gelatin matrix[J]. Chemical Communications, 2014, 50(65): 9196-9199. DOI:10.1039/C4CC03851G |
| [63] |
KLEIN G, KAUFMANN D, SCHURCH S, et al. A fluorescent metal sensor based on macrocyclic chelation[J]. Chemical Communications, 2001(6): 561-562. DOI:10.1039/b100535i |
| [64] |
BOIOCCHI M, FABBRIZZI L, LICCHELLI M, et al. A two-channel molecular dosimeter for the optical detection of copper(Ⅱ)[J]. Chemical Communications, 2003(15): 1812-1813. DOI:10.1039/B305456J |
| [65] |
KONESWARAN M, NARAYANASWAMY R. Mercaptoacetic acid capped CdS quantum dots as fluorescence single shot probe for mercury(Ⅱ)[J]. Sensors and Actuators: B, 2009, 139(1): 91-96. DOI:10.1016/j.snb.2008.09.011 |
| [66] |
CHAN Y-H, CHEN J, LIU Q, et al. Ultrasensitive copper(Ⅱ) detection using plasmon-enhanced and photo-brightened luminescence of CdSe quantum dots[J]. Analytical Chemistry, 2010, 82(9): 3671-3678. DOI:10.1021/ac902985p |
| [67] |
SU Y T, LAN G Y, CHEN W Y, et al. Detection of copper ions through recovery of the fluorescence of DNA-templated copper/silver nanoclusters in the presence of mercaptopropionic acid[J]. Analytical Chemistry, 2010, 82(20): 8566-8572. DOI:10.1021/ac101659d |
| [68] |
XIE J, ZHENG Y, YING J Y. Highly selective and ultrasensitive detection of Hg2+ based on fluorescence quenching of Au nanoclusters by Hg2+-Au+ interactions[J]. Chemical Communications, 2010, 46(6): 961-963. DOI:10.1039/B920748A |
| [69] |
LIU H, ZHANG X, WU X, et al. Rapid sonochemical synthesis of highly luminescent non-toxic Au NCs and Au@AgNCs and Cu (Ⅱ) sensing[J]. Chemical Communications, 2011, 47(14): 4237-4239. DOI:10.1039/c1cc00103e |
| [70] |
BERTORELLE F, HAMOUDA R, RAYANE D, et al. Synthesis, characterization and optical properties of low nuclearity liganded silver clusters: Ag31(SG)19 and Ag15(SG)11[J]. Nanoscale, 2013, 5(12): 5637-5643. DOI:10.1039/c3nr00677h |
| [71] |
UDAYABHASKARARAO T, BOOTHARAJU M S, PRAD-EEP T. Thiolate-protected Ag32 clusters: mass spectral studies of composition and insights into the Ag-thiolate structure from NMR[J]. Nanoscale, 2013, 5(19): 9404-9411. DOI:10.1039/c3nr03463a |
| [72] |
HARKNESS K M, TANG Y, DASS A, et al. Ag44(SR)304-: a silver-thiolate superatom complex[J]. Nanoscale, 2012, 4(14): 4269-4274. DOI:10.1039/c2nr30773a |
| [73] |
MATHEW A, NATARAJAN G, LEHTOVAARA L, et al. Supramolecular functionalization and concomitant enhancement in properties of Au25 clusters[J]. ACS Nano, 2014, 8(1): 139-152. DOI:10.1021/nn406219x |
| [74] |
CHAKRABORTY I, GOVINDARAJAN A, ERUSAPPAN J, et al. The superstable 25 kDa monolayer protected silver nanoparticle: measurements and interpretation as an icosahedral Ag152(SCH2CH2Ph)60 cluster[J]. Nano Letters, 2012, 12(11): 5861-5866. DOI:10.1021/nl303220x |
| [75] |
BAKSI A, BOOTHARAJU M S, CHEN X, et al. Ag11(SG)7: a new cluster identified by mass spectrometry and optical spectroscopy[J]. Journal of Physical Chemistry: C, 2014, 118(37): 21722-21729. DOI:10.1021/jp508124b |
| [76] |
ZHANG N, SI Y, SUN Z, et al. Rapid, selective, and ultrasensitive fluorimetric analysis of mercury and copper levels in blood using bimetallic gold-silver nanoclusters with "silver effect"-enhanced red fluorescence[J]. Analytical Chemistry, 2014, 86(23): 11714-11721. DOI:10.1021/ac503102g |
| [77] |
DING W, GUAN L, HAN J, et al. Fluorescence chemosensing of water-soluble Ag14 nanoclusters for lysozyme and Hg2+ ions[J]. Sensors and Actuators B-Chemical, 2017, 250: 364-371. DOI:10.1016/j.snb.2017.04.172 |
| [78] |
AZIZI F, HEDAYATI M, RAHMANI M, et al. Reappraisal of the risk of iodine-induced hyperthyroidism: an epidemiological population survey[J]. Journal of Endocrinological Investigation, 2005, 28(1): 23-29. |
| [79] |
CHOPRA R, KAUR P, SINGH K. A probe with aggregation induced emission characteristics for screening of iodide[J]. Dalton Transactions, 2015, 44(37): 16233-16237. DOI:10.1039/C5DT02185E |
| [80] |
WANG M H, HUANG Z P, LIU J W, et al. Iodide analysis by ion chromatography on a new stationary phase of polystyrene-divinylbenzene agglomerated with polymerized-epichlorohydrin-dimethylamine[J]. Chinese Chemical Letters, 2015, 26(8): 1026-1030. DOI:10.1016/j.cclet.2015.05.002 |
| [81] |
SUN Z, LI S, JIANG Y, et al. Silver nanoclusters with specific ion recognition modulated by ligand passivation toward fluorimetric and colorimetric copper analysis and biological imaging[J]. Scientific Reports, 2016, 6(1): 20553-20561. DOI:10.1038/srep20553 |
| [82] |
KANG X, CHEN S, JIN S, et al. Heteroatom effects on the optical and electrochemical properties of Ag25(SR)18 and its dopants[J]. Chemelectrochem, 2016, 3(8): 1261-1265. DOI:10.1002/celc.201600038 |
| [83] |
SONG X R, GOSWAMI N, YANG H H, et al. Functionalization of metal nanoclusters for biomedical applications[J]. Analyst, 2016, 141(11): 3126-3140. DOI:10.1039/C6AN00773B |
| [84] |
LI X G, ZHANG F, GAO Y, et al. Facile synthesis of red emitting 3-aminophenylboronic acid functionalized copper nanoclusters for rapid, selective and highly sensitive detection of glycoproteins[J]. Biosensors & Bioelectronics, 2016, 86: 270-276. |
| [85] |
GHORAI A, MONDAL J, CHOWDHURY S, et al. Solvent-dependent fluorescent-colorimetric probe for dual monitoring of Al3+ and Cu2+ in aqueous solution: an application to bio-imaging[J]. Dalton Transactions, 2016, 45(28): 11540-11553. DOI:10.1039/C6DT01795A |
| [86] |
FENG L, SUN Z, LIU H, et al. Silver nanoclusters with enhanced fluorescence and specific ion recognition capability triggered by alcohol solvents: a highly selective fluorimetric strategy for detecting iodide ions in urine[J]. Chemical Communications, 2017, 53(68): 9466-9469. DOI:10.1039/C7CC04924B |
| [87] |
HALDIMANN M, ZIMMERLI B, ALS C, et al. Direct determination of urinary iodine by inductively coupled plasma mass spectrometry using isotope dilution with iodine-129[J]. Clinical Chemistry, 1998, 44(4): 817-824. DOI:10.1093/clinchem/44.4.817 |
| [88] |
WEERAPANA E, WANG C, SIMON G M, et al. Quantitative reactivity profiling predicts functional cysteines in proteomes[J]. Nature, 2010, 468(7325): 790-795. DOI:10.1038/nature09472 |
| [89] |
REDDIE K G, CARROLL K S. Expanding the functional diversity of proteins through cysteine oxidation[J]. Current Opinion in Chemical Biology, 2008, 12(6): 746-754. DOI:10.1016/j.cbpa.2008.07.028 |
| [90] |
JIN W, WANG Y. Determination of cysteine by capillary zone electrophoresis with end-column amperometric detection at a gold/mercury amalgam microelectrode without deoxygenation[J]. Journal of chromatography: A, 1997, 769(2): 307-314. DOI:10.1016/S0021-9673(97)00015-0 |
| [91] |
CHWATKO G, BALD E. Determination of cysteine in human plasma by high-performance liquid chromatography and ultraviolet detection after pre-column derivatization with 2-chloro-1-methylpyridinium iodide[J]. Talanta, 2000, 52(3): 509-515. DOI:10.1016/S0039-9140(00)00394-5 |
| [92] |
YUAN X, TAY Y, DOU X, et al. Glutathione-protected silver nanoclusters as cysteine-selective fluorometric and colorimetric probe[J]. Analytical Chemistry, 2013, 85(3): 1913-1919. DOI:10.1021/ac3033678 |
| [93] |
CHEN Z, LU D, CAI Z, et al. Bovine serum albumin-confined silver nanoclusters as fluorometric probe for detection of biothiols[J]. Luminescence, 2014, 29(7): 722-727. DOI:10.1002/bio.2613 |
 2020, Vol. 48
2020, Vol. 48