文章信息
- 张平生, 辛勇, 曹传亮, 艾凡荣
- ZHANG Ping-sheng, XIN Yong, CAO Chuan-liang, AI Fan-rong
- 壳聚糖/羟基磷灰石表面修饰聚己内酯多孔骨支架的制备及性能
- Preparation and properties of polycaprolactone porous bone scaffold modified with chitosan/ hydroxyapatite on the surface
- 材料工程, 2019, 47(7): 64-70
- Journal of Materials Engineering, 2019, 47(7): 64-70.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2018.000452
-
文章历史
- 收稿日期: 2018-04-23
- 修订日期: 2018-10-12
2. 南昌航空大学 航空制造工程学院, 南昌 330063
2. School of Aeronautical Manufacturing Engineering, Nanchang Hangkong University, Nanchang 330063, China
骨组织工程为治疗由于创伤、感染及肿瘤造成的骨与软骨组织缺损提供了一种新的途径。支架材料是骨组织工程中的重要内容[1-2]。支架材料及其结构作为细胞生长的基质,是形成新组织的框架,是骨组织工程首先要解决的问题。支架的材料性质和结构直接影响细胞的黏附、增殖和分化等生物学特性[3]。理想的骨支架除了应具有良好的生物相容性外,还应具有多孔相贯的三维结构、较好的力学性能和良好的成骨性能[4-5]。
聚己内酯(PCL)是可生物降解高分子材料,它具有良好的生物相容性和较好的力学性能,另外由于其特殊的碳链结构使之具有很好的柔韧性和可加工性,被广泛用作生物降解性控释载体和骨组织工程[6-7],但它也存在亲水性差、生物活性不足等缺陷。因此很多学者通过与其他材料复合以改善其性能。羟基磷灰石(HA)是天然骨的主要成分,具有良好的生物相容性和生物活性,植入体内后可与人体自然骨形成牢固的化学键,是最具潜力的骨替代物,但其较脆,韧性差[8-10]。壳聚糖(chitosan, CS)是一种带正电荷的碱性多糖,具有良好的生物降解性、生物相容性和抗菌性能,且无毒、无刺激性[11-12]。由于其弱碱性,在复合材料中可以改善PCL的细胞黏附性且能中和PCL降解时产生的酸性物质。因此国内外学者结合各材料的性能和特质, 制成复合材料。Oliveira等[13]制备了新型HA/CS双层骨组织工程支架,并将山羊骨髓基质细胞种植到支架上,实验结果表明其复合材料支架具有较好的细胞黏附和增殖活性。Rogina等[14]用HA/CS表面修饰聚乳酸(PLA)骨支架,改善了支架的结晶度、酶降解性和生物相容性。黄琼瑜等[15]用Hake流变仪挤出成型制备了HA/PCL-CS复合材料,并对其生物活性和降解性能进行检测,结果表明其具有良好的生物活性和生物降解性,但是他们只是制备了复合片材,未制成三维多孔支架材料。林宗琼等[16]采用溶液共混相分离和离心注浆填充法制备纳米羟基磷灰石/聚己内酯-壳聚糖复合多孔支架,并对其组成元素、孔隙率和抗压强度进行了表征。类似的还有福建师范大学的一个发明专利[17],其公开了一种聚己内酯-壳聚糖网络/羟基磷灰石复合多孔支架材料的制备方法:将聚己内酯和冰醋酸混合制成聚己内酯冰醋酸溶液,加入壳聚糖粉末,倒入NaOH溶液中,固化成型后烘干,制得聚己内酯-壳聚糖多孔支架材料备用;纳米级羟基磷灰石加入到聚乙烯醇水溶液中,制成羟基磷灰石/聚乙烯醇浆料;将备用的聚己内酯-壳聚糖多孔支架材料放入离心管中,倒入羟基磷灰石/聚乙烯醇浆料进行3~5次注浆填充。他们制备的支架不仅具有良好的生物学性能,而且力学性能良好,但其支架的孔径较小,且孔与孔未能三维贯通,不利于细胞的生长、增殖和代谢。另外细胞主要附着在支架的表面进行生长、繁殖,支架表面的材料性能对细胞的影响比较大,内部的材料主要起支撑作用。因此,本研究采用分步法进行制备:先用选择性激光烧结制备多孔贯通的PCL骨支架,得到强度较好的骨支架框架;再对其表面进行修饰:把支架浸泡到原位合成HA的CS/HA的复合溶液,使HA和CS黏附到PCL支架的表面和孔内,改善支架表面的生物相容性和细胞增殖活性。最终得到具有良好生物性能和力学性能的PCL-CS/HA复合骨支架。
1 实验 1.1 原料聚己内酯:PCL,白色颗粒,直径约3~5mm,深圳市光华伟业实业有限公司;壳聚糖(医用级):chitosan, 缩写CS,白色粉末,100目,浙江金壳药业有限公司;冰乙酸:C2H4O2,分析纯,东莞市乔科化学有限公司;方解石:CaCO3,2500目;磷酸:H3PO4,分析纯,广东汕头市西陇化工股份有限公司;尿素:H2NCONH2,化学纯,广东台山市粤侨试剂塑料有限公司;乙醇:CH3CH2OH,分析纯,西陇科学股份有限公司;氢氧化钠:NaOH,分析纯,广东台山市粤侨试剂塑料有限公司。
1.2 实验方法和步骤将PCL颗粒放入深温冷冻粉碎机中粉碎,制得尺寸小于75μm的PCL粉末, 然后用选择性激光烧结技术制备PCL骨支架[18]。用冰乙酸配置36%醋酸500mL,加入6g壳聚糖制得1.2%(质量分数,下同)的壳聚糖溶液,再加入149.6gCaCO3得到30%的CaCO3-CS溶液。最后加入一定量的尿素磷酸盐,使得溶液的Ca/P值为1.67。在50℃的恒温下反应4d,同时缓慢搅拌,制得CS/HA悬浮液。同时配置500mL纯的1.2% CS溶液。用配好的96%乙醇清洗PCL骨支架,除去杂质,自然风干,浸泡到CS/HA悬浮液和CS溶液中2h,抽真空,压力为0.1MPa;取出支架低速离心30min,转速为1500r/min;将支架放入-18℃的冰箱中冷冻24h;取出支架浸泡到氢氧化钠和乙醇配置的凝胶介质中(NaOH,1mol/L;乙醇,96%;按体积比为1:1配置500mL),放入-18℃的冰箱中冷冻18h;取出支架放入乙醇溶液中-18℃冷冻12h;把支架放入新的乙醇溶液中常温浸泡24h;取出支架常温常压下风干, 其过程如图 1所示。得到PCL-CS/HA和PCL-CS复合支架。

|
图 1 PCL-CS/HA多孔骨支架制备流程 Fig. 1 Preparation process of PCL-CS/HA porous bone scaffold |
用D1 system多功能X射线衍射仪对PCL粉末、PCL-CS支架和PCL-CS/HA支架进行物相分析:步长为0.025°,观测角度范围5° < 2θ < 70°。
1.3.2 支架的形貌观察用Thermo Scientific 9801A-1UPS-SN扫描电镜观察支架表面修饰后的结构和形貌。
1.3.3 支架的力学性能测试采用CSS-44100电子万能试验机测量支架的压缩强度和杨氏模量,加载速率为0.5mm/min, 每组测量4个样品。
1.3.4 支架材料水接触角测试在常温下, 以水作为测试液滴, 采用KROSS GmbH Germany DO4010表面接触角仪测定支架表面的接触角。
1.3.5 体外细胞实验骨髓间充质干细胞(MMSC)的获取和培养:将大鼠麻醉、处死。用75%的乙醇浸泡8min,在无菌条件下剔出双侧股骨和胫骨,剪除两端后,将注射器插入骨髓腔,冲洗骨髓。收集冲洗液,离心,得到骨髓间充质干细胞(MMSC)。将MMSC接入培养瓶中,在37℃,5%CO2和100%湿度的培养箱中培养。
MMSC在支架浸泡液中的培养并定期检测其活细胞数量:将环氧乙烷消毒后的PCL,PCL-CS,PCL-CS/HA支架分别放入培养液中浸泡24h,然后将PCL,PCL-CS,PCL-CS/HA支架浸提液注入96孔培养板内,每孔100μL,每组5孔;同时注入一组培养液作为对照组;把MMSC细胞浓度调整为4×104个/mL,注入96孔细胞培养板中,每孔50μL;用同样的方法做4个96孔板并将它们放入保温箱中进行培养。在细胞培养的1,3,5,7天分别取出1板,注入CKK-8溶液,每孔10μL, 在保温箱中孵育2h后,用酶标仪在450nm波长下检测其吸光度OD值,测得每孔活细胞数。
2 结果与讨论 2.1 支架材料的物相分析利用XRD对PCL粉末、PCL-CS支架和PCL-CS/HA支架的物相组成进行表征(见图 2)。图 2中b线是PCL-CS支架的XRD衍射图, b线上2θ为21.5°,21.8°和23.7°的3个衍射峰对应PCL晶体的(110),(111)和(200)3个晶面。除此之外,在2θ为10.3°,19.7°出现强峰,在15.6°,21.7°出现弱峰,这与CS的XRD衍射图是一致的,且衍射峰比较平滑,是由于壳聚糖的氨基羟基分子氢键造成的结晶特点。图 2中c线是PCL-CS/HA支架的XRD衍射图,线上除了有PCL和CS的衍射峰外,在24.8°,31.7°,32.9°,34.1°,39.8°,46.7°,49.5°处出现7个衍射峰,分别对应HA的(002),(211),(300),(202),(310),(222)和(213)晶面,这与HA的标准衍射图(JCPD 09-0432)是一致的。说明原位复合生成了HA,复合支架中含有PCL,CS和HA。

|
图 2 PCL粉末、PCL-CS和PCL-CS/HA支架的XRD衍射图 Fig. 2 XRD patterns of PCL powder, PCL-CS and PCL-CS/HA scaffolds |
图 3(a),(d)分别是未进行表面修饰的PCL支架的正面和侧面。支架整体为20mm×20mm×10mm的长方体,中间有尺寸约为1.5mm×1.5mm三维相互贯通的方孔。既保证了支架具有较好的力学性能,又提供了便于细胞生长和繁殖的多孔相通的环境。图 3(b),(e)是PCL支架在用CS/HA表面修饰后的正面和侧面的形貌。从图中可以看出在PCL支架的表面形成了一层CS/HA凝胶且黏附紧密。图 3(c),(f)是PCL支架在用CS/HA表面修饰后其正面和侧面上孔的微观形貌。孔中的CS/HA在离心和冷冻的作用下紧紧地黏附在孔的表面并在孔中拉成了丝状,形成50~500μm且相互贯通的孔。这种相互贯通的孔系结构非常便于细胞的代谢和迁移,使支架具有良好的细胞相容性[19-21]。另外由于CS的高膨胀性,使得CS/HA凝胶具有较好的亲水性,有利于细胞的黏附。

|
图 3 支架表面修饰前后的形貌 (a),(d)支架表面修饰前的正面图、侧面图;(b),(e)支架表面修饰后的正面图、侧面图;(c),(f)支架表面修饰后正面和侧面上的孔的SEM图 Fig. 3 Morphologies of the scaffold before and after surface modification (a), (d)front and side maps of the surface of the scaffold before surface modification; (b), (e)front and side maps of the surface of the scaffold after surface modification; (c), (f)SEM images of the holes on the front and side of the scaffold after surface modification |
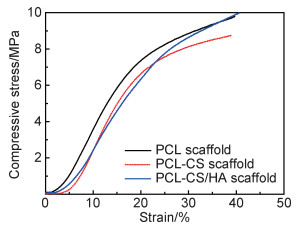
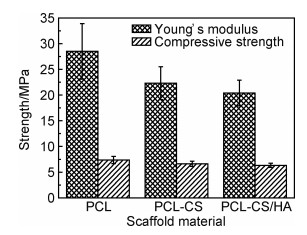
图 4为PCL, PCL-CS和PCL-CS/HA支架的应力应变曲线图,根据应力应变图计算出它们的杨氏模量分别为(28.5±5.4),(22.3±3.2), (20.4±2.5)MPa,取应变20%处的应力作为它们的压缩强度,其压缩强度分别为(7.4±0.7),(6.6±0.5)MPa和(6.3±0.4)MPa(见图 5)。PCL支架的杨氏模量和压缩强度最高,加入了CS和HA的支架略有降低。
|
图 4 支架的应力-应变曲线 Fig. 4 Stress-strain curves of the scaffolds |
|
图 5 支架的杨氏模量和压缩强度 Fig. 5 Young's modulus and compression strength of the scaffolds |
从图 3(e),(f)可看出CS凝胶与PCL支架界面的结合比较紧密,对支架的力学性能有一定的增强作用,但是其凝胶的强度较低,因此支架的抗压强度主要来源于选择性激光烧结的PCL框架,由于长时间的浸泡,侵蚀了少量的PCL,所以PCL-CS支架的压缩强度比PCL支架降低了10.8%。HA加入CS水凝胶后,使CS水凝胶与PCL支架的结合变差,所以PCL-CS/HA支架的压缩强度比PCL-CS支架又降低了4.5%,但是其压缩强度依然有6.3MPa,杨氏模量20.4MPa,达到松质骨的要求。人体松质骨抗压强度在4~12MPa,弹性模量在0.01~0.5GPa之间,PCL-CS/HA支架的压缩强度与人体松质骨的相匹配,能为新生组织提供支撑[22-25]。
2.4 支架材料的亲疏水性亲疏水性是影响材料能否与细胞发生良好结合的重要指标之一。材料表面水接触角的检测是观察材料亲水性的一个常用方法。Gogolewski等[26]研究结果显示材料表面对水的接触角为40°~60°时比较适合细胞在其上黏附和生长。通过测量发现:PCL,PCL-CS和PCL-CS/HA支架材料的水接触角分别是65°,45°,42°(图 6)。PCL-CS和PCL-CS/HA支架的水接触角比较接近,都优于PCL支架。这是因为壳聚糖和羟基磷灰石带有亲水基团氨基和羟基,二者都可与水分子形成氢键。而且氧的电负性更强,羟基与水分子形成的氢键也就更强,因此羟基的亲水性更强一些。结果表明用CS/HA表面修饰后的PCL支架的亲水性得到了一定的改善,更利于细胞的黏附和生长。

|
图 6 支架材料表面水接触角(a)PCL;(b)PCL-CS;(c)PCL-CS/HA Fig. 6 Water contact angle on the surface of the scaffolds (a)PCL; (b)PCL-CS; (c)PCL-CS/HA |
骨髓间充质干细胞在支架浸泡液中培养1,3,5,7d后的吸光度如图 7所示。浸泡1d时,各组活细胞数量差不多,3~5d增殖较快,5d后放缓。其中PCL-CS/HA支架组细胞增殖活性最高,其次PCL-CS支架组,PCL支架组增长最慢。实验结果表明,CS和HA的加入有效提升了支架的细胞增殖活性。

|
图 7 细胞在支架浸泡液中培养1,3,5,7天后的吸光度 Fig. 7 Absorbance value of cells in scaffold immersion solution for 1, 3, 5 and 7 days |
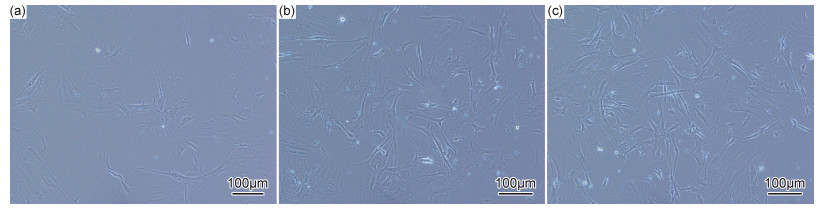
图 8是骨髓间充质干细胞在各种支架浸泡液中培养7d后在显微镜下的照片。从图 8(a)中可看到细胞在PCL支架浸泡液中培养7d后依然保持较好的状态。但是在PCL-CS和PCL-CS/HA支架浸泡液中细胞数量更多且更具活力(图 8(b),(c)),细胞形态为长梭形或卵圆形。可能是因为CS与生物分子相似,使细胞更有活力。另外羟基磷灰石与天然人骨磷灰石具有相似的结构,有良好的骨诱导性,有利于骨细胞的分化。结果表明,所有类型的支架对骨髓间充质干细胞都是无毒的,支架表面用CS/HA修饰后,促进了细胞的生长和增殖。
|
图 8 细胞在支架浸泡液中培养7天后的状态(a)PCL;(b)PCL-CS;(c)PCL-CS/HA Fig. 8 State of cell culture in scaffolds immersion solution for 7 days (a)PCL; (b)PCL-CS; (c)PCL-CS/HA |
(1) 通过选择性激光烧结制备了多孔互通的PCL骨支架框架,使支架具有较好的抗压性能;用原位合成的方法制备了CS/HA悬浮液,又通过真空浸泡、低速离心和冷冻凝胶的方法在PCL支架的表面和孔隙中形成CS/HA凝胶,制成更适合细胞生长和增殖的多孔PCL-CS/HA支架。
(2) XRD的检测显示了复合支架的材料成分,表明原位合成的方法生成了HA。复合支架的扫描电镜图片显示冷冻凝胶的方法形成了CS凝胶,并且与PCL支架表面黏附紧密。制成的PCL-CS/HA支架的力学性能比PCL支架略有降低,其杨氏模量和压缩强度分别为(20.4±2.5)MPa和(6.3±0.4)MPa,但是仍达到松质骨要求。
(3) 由于CS/HA有亲水基团氨基和羟基,因此经CS/HA表面修饰后的支架的表面水接触角由原来的65°减小为42°,改善了支架的亲水性。
(4) 体外细胞实验结果显示PCL-CS/HA浸泡液中细胞最具活性且增殖数量最多,表明CS和HA的加入有效提升了支架的细胞增殖活性。
| [1] | MITHOEFER K, MCADAMS T R, SCOPP J M, et al. Emerging options for treatment of articular cartilage injury in the athlete[J]. Clinics in Sports Medicine, 2009, 28 (1): 25–40. DOI: 10.1016/j.csm.2008.09.001 |
| [2] | VAN D P U, MATHIEU L, ZEITER S, et al. Augmentation of bone defect healing using a new biocomposite scaffold:an in vivo study in sheep[J]. Acta Biomaterialia, 2010, 6 (9): 3755–3762. DOI: 10.1016/j.actbio.2010.03.028 |
| [3] |
秦晓素, 黄洁, 郭华超, 等. 骨组织工程用硅胶/掺锶β-磷酸三钙/硫酸钙复合多孔支架的制备与性能研究[J].
材料工程, 2018, 46 (3): 34–40.
QIN X S, HUANG J, GUO H C, et al. Fabrication and properties of silica gel/calcium sulfate/strontium-doped β-tricalcium phosp-hate composite porous scaffolds for bone tissue engineering[J]. Journal of Materials Engineering, 2018, 46 (3): 34–40. |
| [4] | CUNNIFFE G M, VINARDELL T, MURPHY J M, et al. Porous decellularized tissue engineered hypertrophic cartilage as a scaffold for large bone defect healing[J]. Acta Biomaterialia, 2015, 23 : 82–90. DOI: 10.1016/j.actbio.2015.05.031 |
| [5] | SATHY B N, WATSON B M, KINARD L A, et al. Bone tissue engineering with multilayered scaffolds-part Ⅱ:combining vascularization with bone formation in critical-sized bone defect[J]. Tissue Engineering Part A, 2015, 21 (19/20): 2495–2503. |
| [6] | MAZZOLI A, FERRETTI C, GIGANTE A, et al. Selective laser sintering manufacturing of polycaprolactone bone scaffolds for applications in bone tissue engineering[J]. Rapid Prototyping Journal, 2015, 21 (4): 386–392. DOI: 10.1108/RPJ-04-2013-0040 |
| [7] | WILLIAMS J M, ADEWUNMI A, SCHEK R M, et al. Bone tissue engineering using polycaprolactone scaffolds fabricated via selective laser sintering[J]. Biomaterials, 2005, 26 (23): 4817–4827. DOI: 10.1016/j.biomaterials.2004.11.057 |
| [8] | ZHANG Y, VENUGOPAL J R, EL-TURKI A, et al. Electro-spun biomimetic nanocomposite nanofibers of hydroxyapatite/chitosan for bone tissue engineering[J]. Biomaterials, 2008, 29 (32): 4314–4322. DOI: 10.1016/j.biomaterials.2008.07.038 |
| [9] | QIAO Y, ZHAI Z, CHEN L, et al. Cytocompatible 3D chitosan/hydroxyapatite composites endowed with antibacterial properties:toward a self-sterilized bone tissue engineering scaffold[J]. Science bulletin, 2015, 60 (13): 1193–1202. DOI: 10.1007/s11434-015-0838-4 |
| [10] |
王朴, 杜继涛. 电流密度对水热电化学沉积HA涂层性能的影响[J].
材料工程, 2018, 46 (4): 58–65.
WANG P, DU J T. Effect of current density on properties of HA coating fabricated by hydrothermal-electrochemical deposition[J]. Journal of Materials Engineering, 2018, 46 (4): 58–65. |
| [11] | TOKATLI K, DEMIRDOVEN A. Characterization of two commercial chitosans[J]. Journal of Biotechnology, 2017, 256 : S65–S66. |
| [12] | SABER-SAMANDARI S, SABER-SAMANDARI S. Biocomp-atible nanocomposite scaffolds based on copolymer-grafted chitosan for bone tissue engineering with drug delivery capability[J]. Materials Science and Engineering:C, 2017, 75 : 721–732. DOI: 10.1016/j.msec.2017.02.112 |
| [13] | OLIVEIRA J M, RODRIGUES M T, SILVA S S, et al. Novel hydroxyapatite/chitosan bilayered scaffold for osteochondral tissue-engineering applications:scaffold design and its perform-ance when seeded with goat bone marrow stromal cells[J]. Biomaterials, 2006, 27 (36): 6123–6137. DOI: 10.1016/j.biomaterials.2006.07.034 |
| [14] | ROGINA A, PRIBOLSAN L, HANZEK A, et al. Macroporous poly (lactic acid) construct supporting the osteoinductive porous chitosan-based hydrogel for bone tissue engineering[J]. Poly-mer, 2016, 98 : 172–181. |
| [15] |
黄琼瑜, 余厚德, 肖秀峰, 等. 羟基磷灰石/聚己内酯-壳聚糖复合材料的制备与表征[J].
复合材料学报, 2009 (1): 24–30.
HUANG Q Y, SHE H D, XIAO X F, et al. Preparation and characterization of hydroxyapatite/polycaprolacton-chitosan com-posites[J]. Journal of Composite Materials, 2009 (1): 24–30. DOI: 10.3321/j.issn:1000-3851.2009.01.005 |
| [16] |
林宗琼, 肖秀峰, 佘厚德, 等. 纳米羟基磷灰石/聚己内酯-壳聚糖复合多孔支架材料的制备与表征[J].
高分子材料科学与工程, 2008, 24 (10): 155–158.
LIN Z Q, XIAO X F, SHE H D, et al. Preparation and charac-terization of hydroxyapatite/polycaprolactone-chitosan composite porous scaffold[J]. Polymer Materials Science and Engineering, 2008, 24 (10): 155–158. DOI: 10.3321/j.issn:1000-7555.2008.10.040 |
| [17] |
福建师范大学.聚己内酯-壳聚糖网络/羟基磷灰石复合多孔支架材料的制备方法: ZL200710085930.1[P].2007-08-15. Fujian Normal University. Preparation of polycaprolactone chito-san network/hydroxyapatite composite porous scaffold material: china, ZL200710085930.1[P].2007-08-15. |
| [18] |
周泽全, 辛勇, 曹传亮. 选择性激光烧结尼龙-12/聚苯乙烯复合材料[J].
材料研究学报, 2016, 30 (10): 759–762.
ZHOU Z Q, XIN Y, CAO C L. Research of the selective laser sintering of nylon-12/polystyrene composite powder[J]. Chinese Journal of Material Research, 2016, 30 (10): 759–762. |
| [19] | LAPORTE D M, MONT M A, HUNGERFORD D S. Proxim-ally porous-coated ingrowth prostheses:limits of use[J]. Orth-opedics, 1999, 22 (12): 1154–1160. |
| [20] | KALEBO P, BUCH F, ALBREKTSSON T. Bone-formation rate in osseointegrated titanium implants-influence of locally applied hemostasis, peripheral-blood, autologous bone-marrow and fibrin adhesive system(FAS)[J]. Scandinavian Journal of Plastic and Reconstructive Surgery and Hand Surgery, 1988, 22 (1): 53–60. DOI: 10.3109/02844318809097935 |
| [21] |
樊宇平, 黄靖香, 蔡胥. 中空钛合金假体壁上孔洞直径对细胞生长的影响[J].
中国组织工程研究, 2012, 16 (43): 8067–8070.
FAN Y P, HUANG J X, CAI X. Effect of different pore sizes of hollow titanium alloy prosthesis's wall on the growth of bone narrow stromal cells[J]. Research on Organizational Engineer-ing in China, 2012, 16 (43): 8067–8070. DOI: 10.3969/j.issn.2095-4344.2012.43.019 |
| [22] |
王倞, 李元超, 汪方, 等. 人体松质骨矿质密度与弹性模量关系[J].
医用生物力学, 2014, 29 (5): 465–470.
WANG Q, LI Y C, WANG F, et al. Relationship between mine-ral density and elastic modulus of human cancellous bone[J]. Journal of Medical Biomechanics, 2014, 29 (5): 465–470. |
| [23] | MORGAN E F, BAYRAKTAR H H, KEAVENY T M. Trab-ecular bone modulus-density relationships depend on anatomic site[J]. Journal of Biomechanics, 2003, 36 (7): 897–904. DOI: 10.1016/S0021-9290(03)00071-X |
| [24] | KOPPERDAHL D L, KEAVENY T M. Yield strain behavior of trabecular bone[J]. Journal of biomechanics, 1998, 31 (7): 601–608. DOI: 10.1016/S0021-9290(98)00057-8 |
| [25] | REZWAN K, CHEN Q Z, BLAKER J J, et al. Biodegradable and bioactive porous polymer/inorganic composite scaffolds for bone tissue engineering[J]. Biomaterials, 2006, 27 (18): 3413–3431. DOI: 10.1016/j.biomaterials.2006.01.039 |
| [26] | GOGOLEWSKI S, GORNA K, ZACZYNSKA E, et al. Stru-cture-property relations and cytotoxicity of isosorbide-based biodegradable polyurethane scaffolds for tissue repair and regen-eration[J]. Journal of Biomedical Materials Research Part A, 2008, 85 (2): 456–465. |
 2019, Vol. 47
2019, Vol. 47


