文章信息
- 徐顺建
- XU Shun-jian
- 添加剂辅助水热热解制备尺寸可控纳米孔碳微球
- Additive-assisted hydrothermal route to synthesize nanoporous carbon microspheres with controlled particle size
- 材料工程, 2019, 47(5): 137-144
- Journal of Materials Engineering, 2019, 47(5): 137-144.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2017.000224
-
文章历史
- 收稿日期: 2017-03-01
- 修订日期: 2018-08-21
2. 新余学院 新余新能源研究所, 江西 新余 338004
2. Xinyu Institute of New Energy, Xinyu University, Xinyu 338004, Jiangxi, China
生物质是一类低价值的可再生资源。以生物质为前躯体通过水热技术合成碳微球是赋予其高附加值的有效途径之一。合成的碳微球是一类化学壳/核结构的功能碳材料(即内核为疏水性, 而外壳为亲水性),具有特殊的形貌、优异的化学稳定性、发达的纳米孔隙结构、良好的导热导电性能等众多优点,在药物输送、气体分离、能源转换和能源存储等领域具有较大的应用潜力[1-4]。
生物质的水热反应最早可追溯到20世纪初,当时的目的是调查煤炭的自然形成过程[5]。直至2001年,中科院黄学杰团队以糖为前躯体,通过低温水热处理(190℃)和后续高温热解(1000℃)2个环节,首次合成了具有纳米孔的碳微球,并展示了良好的储锂能力(430mA·h·g-1)[6]。与碳微球的其他合成技术(如化学气相沉积法和模板法等)相比,水热技术不仅具有工艺简单、反应条件温和以及环境友好等特点,而且能有效地裁剪碳微球的形貌(尺寸与形状)[7-12]。碳微球形貌的可调控性使其能满足不同领域的需求,更好地体现应用价值。基于水热技术合成碳微球时,常用的形貌调控手段包括改变前躯体类型与浓度、控制水热反应工艺以及水热反应中引入添加剂等。其中,引入添加剂是最近发展起来的一条有效的途径,目前已涉及的添加剂主要有醇[13]、间苯三酚[14]、丙烯酸[15]、二氧化碳[16]、铁离子[17]和三氯化铝[18]等,相应的影响机制和目的不尽相同。例如,醇在糖(葡萄糖、蔗糖、淀粉)溶液中起着结构导向的功能,使微球的形状由圆球形向橄榄球形转变;间苯三酚在木糖和果糖水热处理中起着交联作用,通过促使微球生长从而赋予更大的尺寸;二氧化碳则通过加速糖的脱水动力学,进而使微球的尺寸分布更均匀;三氯化铝的水解产物([Al(OH)(H2O)5]2+和H+)能加速HMF(5-hydro-xymethylfurfural)的产出,促使碳微球在更低的水热处理温度下析出,同时通过调整工艺参数将碳微球的尺寸控制在0.5~5.5μm之间。由此可见,为了更有效地调控碳微球的形貌,探索不同添加剂对碳微球形貌的影响以及相应的作用机制,具有一定的必要性。
本工作选取KCl和HCl作为添加剂,以典型的果糖和淀粉为单糖前躯体和多糖前躯体,通过低温水热处理和后续的高温热解合成碳微球,着重考察添加剂对碳微球形貌的影响,同时探讨添加剂的作用机制以及高温热解的影响。
1 实验材料与方法 1.1 碳微球的合成果糖(C6H12O6, 99%)、可溶性淀粉(C12H22O11, 平均分子量: 342.30, AR)、氯化钾(KCl, 99.8%),均购自上海阿拉丁生化科技股份有限公司;氯化氢(HCl, AR),购自国药集团化学试剂有限公司;去离子水(deionized water, H2O, ACS),购自阿法埃莎化学有限公司。碳微球的合成工艺:将4g糖和氯化物通过磁搅拌溶于40mL去离子水中,配成糖溶液;将糖溶液倒入容积为50mL的高压反应釜中,在190℃水热处理6h;将收集的固体粉末进行清洗;将固体粉末置于N2保护下进行热解,热解温度和时间分别为600℃和1h。
为了便于讨论,依次将纯果糖溶液、1mol·L-1 KCl的果糖溶液、1mol·L-1 HCl的果糖溶液和0.01mol·L-1 HCl的果糖溶液获得的碳微球命名为CS-F,CS-FK,CS-FH1和CS-FH2;将纯淀粉溶液、1mol·L-1 KCl的淀粉溶液、1mol·L-1 HCl的淀粉溶液和0.01mol·L-1 HCl的淀粉溶液获得的碳微球命名为CS-S,CS-SK,CS-SH1和CS-SH2。
1.2 测试与表征用D8 ADVANCE型X射线衍射仪(XRD)分析碳微球的晶体结构,铜靶Kα射线,步长为0.02 °;用K-alpha1063型X射线光电子能谱仪(XPS)测得碳微球的C1s谱图,铝靶Kα射线,步长为0.1eV;用TENSOR37型光谱仪获取碳微球的傅里叶变换红外光谱(FT-IR),KBr压片,扫描范围为500~4000cm-1;用ASAP 2020M型全自动吸附仪测定碳微球的N2吸附-脱附曲线,并采用BET (Brunauere-Emmette-Teller)方法获得碳微球的比表面积;用JSM-6701F型场发射扫描电镜(SEM)观察碳微球的形貌,同时基于SEM图像和图像处理软件获得碳微球的平均直径和尺寸分布,同一试样被统计的碳微球数量不少于200粒;用SDT-Q600型热重-差热分析仪(TG-DTA)分析试样的质量损失行为,升温速率为10℃·min-1;用TU-1901型双光束紫外可见分光光度计(UV-Vis)测定溶液的透光率曲线。
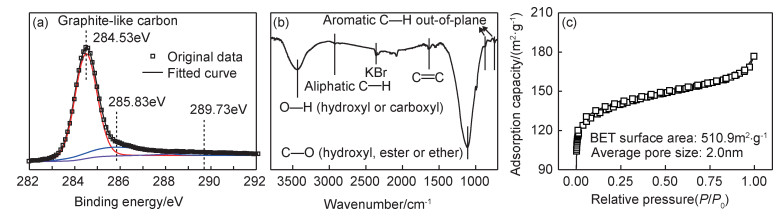
2 结果与分析 2.1 碳微球的结构碳微球的XRD谱图如图 1所示。可知,碳微球的微结构并未随着前躯体的类型和添加剂的引入出现明显的变化,所考察的5种碳微球的XRD曲线几乎一致,均仅在2θ约为23°和43°附近出现较宽的对称衍射峰,即为具有石墨特征的(002)和(100)晶面衍射峰。5种碳微球的微结构几近相同,均为由石墨微晶无序堆积而成的玻璃碳结构[19-20]。(002)和(100)晶面峰分别代表石墨微晶堆积块的层片在空间方向上的排列高度(Lc)和层片直径(La)。依据Debye-Scherrer公式[20]和布拉格方程作进一步的估算,石墨微晶堆积块的Lc值在1.11~1.13nm之间,而相应晶面间距在0.3741~0.3938nm之间,后者大于标准的石墨的(002)晶面间距(0.3335nm)。由此可见,碳微球中石墨微晶堆积块仅由2~3层的石墨层片组成。由于碳微球中的催化活性点位于暴露的石墨微晶堆积块的边缘,因此堆积块的尺寸越小(即单位面积内暴露的边缘越多),则越有利于碳微球作为染料敏化太阳电池对电极的应用[1]。图 2为碳微球的XPS C1s谱图,FT-IR光谱图和N2吸附-脱附等温曲线图。碳微球的玻璃碳特征可由图 2(a)所示的XPS C1s谱图得以进一步证实。从谱图上观察到3个峰,其中强度最高、面积最大的峰出现在结合能为284.53eV处,该峰对应于类石墨碳[14],其相对含量为75%。此外,其余的两个峰分属于羟基(或醚)和羧基(或酯),相应的结合能依次为285.83eV和289.73eV。

|
图 1 碳微球的XRD谱图 Fig. 1 XRD patterns of carbon microspheres |
|
图 2 碳微球的XPS C1s谱图(a),FT-IR光谱图(b)和N2吸附-脱附等温曲线(c) Fig. 2 XPS C1s spectra(a), FT-IR spectrum(b) and N2 adsorption-desorption isotherms(c) of carbon microspheres |
图 2(b)为FT-IR光谱图,在波数为1110cm-1和3444cm-1处出现了高强度的吸收峰,分属于C—O伸缩振动和O—H伸缩振动。结合图 2(a)可知,碳微球表面存在羟基、羧基、酯和醚等官能团[11, 21]。此外,在FT-IR光谱中还观察到强度相对较低的吸收峰:2922cm-1处吸附峰对应于脂肪族的C—H伸缩振动;1620cm-1处吸收峰归属于C=C伸缩振动;875~750cm-1之间的吸收峰为芳香环的C—H面外弯曲振动[7, 13]。碳微球的N2吸附-脱附等温曲线如图 2(c)所示,该等温吸附曲线属于第Ⅰ类,即含微孔的多孔材料的等温吸附曲线[22]。碳微球中微孔的平均尺寸为2.0nm,比表面积为510.9m2·g-1。碳微球中发达的纳米孔为其在氧还原反应和储氢等领域应用时提供强有力的保障[6, 23]。
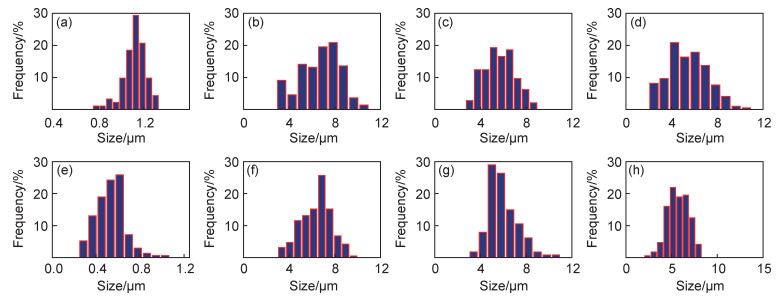
2.2 碳微球的形貌与尺寸分布碳微球的SEM形貌和尺寸分布分别如图 3和图 4所示。在2种前躯体中,KCl和HCl均能促使规则圆球形碳微球的尺寸呈不同程度的增大,平均直径在0.53~6.67μm之间变化。纯果糖溶液获得的碳微球的平均直径为1.12μm。当引入同摩尔(1mol·L-1)的KCl和HCl时,碳微球CS-FK和CS-FH1的平均直径分别增加到6.67μm和5.69μm。此外,CS-FK和CS-FH1在分散性方面存在差异,前者无明显团聚,而后者出现局部团聚。当果糖溶液中的HCl减少到0.01mol·L-1时,碳微球的团聚得以较好抑制,同时伴随着尺寸稍有减小,其平均直径为5.41μm。HCl浓度促使的碳微球之间微小的尺寸变化进一步表明,对于调控碳微球尺寸而言,1mol·L-1 HCl已趋于饱和。

|
图 3 碳微球的SEM图 (a)CS-F; (b)CS-FK; (c)CS-FH1;(d)CS-FH2;(e)CS-S; (f)CS-SK; (g)CS-SH1;(h)CS-SH2 Fig. 3 SEM images of carbon microspheres (a)CS-F; (b)CS-FK; (c)CS-FH1; (d)CS-FH2;(e)CS-S; (f)CS-SK; (g)CS-SH1;(h)CS-SH2 |
|
图 4 碳微球的尺寸分布图 (a)CS-F; (b)CS-FK; (c)CS-FH1;(d)CS-FH2;(e)CS-S; (f)CS-SK; (g)CS-SH1;(h)CS-SH2 Fig. 4 Size histograms of carbon microspheres (a)CS-F; (b)CS-FK; (c)CS-FH1;(d)CS-FH2; (e)CS-S; (f)CS-SK; (g)CS-SH1;(h)CS-SH2 |
添加剂对源于淀粉的碳微球的影响规律与其对源于果糖的碳微球的影响规律极其相似。纯淀粉合成的碳微球的平均直径为0.53μm,其值小于纯果糖合成的碳微球。然而,在KCl和HCl的辅助下,碳微球CS-SK和CS-SH1的尺寸与同条件下果糖获得的碳微球不相上下,相应的平均直径分别为6.37μm和5.95μm。其中,KCl能促使碳微球具有更均匀分布的尺寸,CS-S和CS-SK的尺寸分布范围分别为0.22~1.03μm和3.35~9.65μm。此外,1mol·L-1 HCl同样导致基于淀粉的CS-SH1出现局部团聚;当HCl的浓度减至0.01mol·L-1时,碳微球的团聚得以缓和,同时尺寸出现双峰分布,其中大球的平均直径为5.71μm,小球的平均直径为1.11μm。
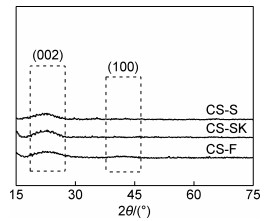
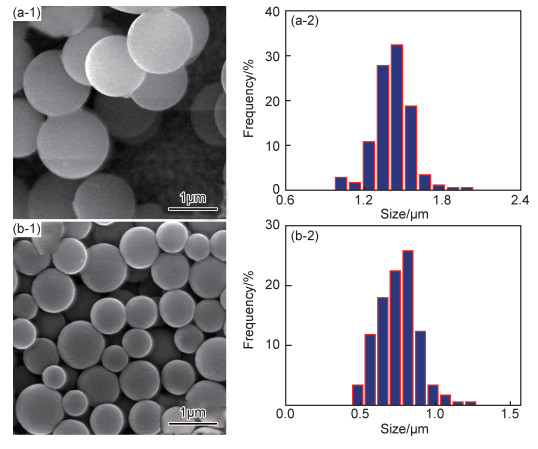
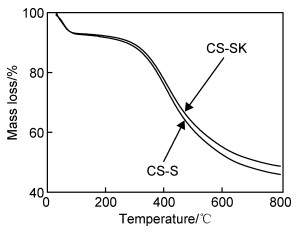
2.3 热解对碳微球的结构和形貌的影响未经热解处理的碳微球(即仅经水热处理与清洗获得的固体粉末)的XRD谱图、SEM形貌和TG曲线分别如图 5,6,7所示。CS-F,CS-S和CS-SK在未经热解处理时,相应的XRD曲线均仅在22.5°左右出现1个对称衍射峰。该峰的位置和强度在3条曲线中几乎一致;同时相对于图 1所示的(002)衍射峰,该峰不仅强度更低而且向低2θ方向微移。表明,碳微球中的石墨微晶堆积块是在热解过程中形成的,而热解前的固体粉末属于某种有序态结构的聚合物。通过对比图 3,4和图 6可知,碳微球热解前的形貌与热解后极其相似,亦为形状规则的圆球形,意味着碳微球的形貌源于水热处理。图 3和图 6还表明,热解引起了碳微球的尺寸收缩,CS-F和CS-S的平均直径收缩率分别为21.1%和30.9%。TG曲线进一步揭示,碳微球在结构转变和尺寸收缩的过程中还伴随着大量的质量损失,主要发生在300~500℃之间。600℃时CS-S和CS-SK的残余质量分别为52.65%和55.23%。此外,当热解温度继续升至800℃时,2组碳微球均仍有约6.5%的质量损失,可以理解为碳微球中石墨微晶堆积块不断长大以及非碳成分持续挥发的过程,同时也说明通过热解可以调整碳微球的结构和官能团。
|
图 5 未经热解处理的碳微球的XRD谱图 Fig. 5 XRD patterns of carbon microspheres before pyrolysis |
|
图 6 未经热解处理的碳微球CS-F,CS-S的SEM形貌(1)与尺寸分布图(2) (a)CS-F;(b)CS-S Fig. 6 SEM morphologies(1) and size histograms(2) of carbon microspheres of CS-F and CS-S before pyrolysis (a)CS-F; (b)CS-S |
|
图 7 未经热解处理的碳微球的TG曲线 Fig. 7 TG curves of carbon microspheres before pyrolysis |
水热条件下(温度>100℃,压力>9.8MPa),反应体系达到一种亚临界和超临界流体状,糖会发生大量常态下无法出现的反应,其过程复杂,中间产物繁多,加之反应是在封闭空间内进行,使得跟踪监测反应过程异常困难,导致目前尚无完全被认可的微球形成机制[7-8, 13-14, 21, 24]。在综合已有研究的基础上,淀粉在水热过程中大体需要经历4个主要环节[7, 25-26]:(1)淀粉水解为单糖(果糖、葡萄糖)和低聚糖(麦芽糖),其中低聚糖会进一步分解为单糖;(2)单糖脱水和分裂(即开环和C—C键断裂),形成多种可溶性物质;(3)脱水和分裂产物(即可溶性物质)发生聚合或缩合,形成可溶性聚合物;(4)微球的生长,主要通过与溶液中存在的化学物质(构造单元)发生交联反应实现。
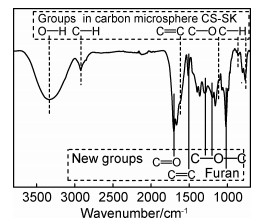
为了确定微球生长时的构造单元,测试了碳微球CS-SK在完成水热处理后清洗下来的表面残余物(未热解)的FT-IR光谱,如图 8所示。相比碳微球的FT-IR光谱(图 2(b)), 残余物的FT-IR光谱中出现了不少新的吸收峰。其中,1023cm-1处出现尖锐的吸收峰,标志着残余物中存在大量的交联呋喃环[10, 14],该结构由HMF通过缩合形成,意味着HMF是一种主要的脱水和分裂产物,同时也说明HMF和交联呋喃环均可能是微球生长的主要构造单元。
|
图 8 清洗废液干燥后获得的固体粉末的FT-IR光谱图 Fig. 8 FT-IR spectrum of solid powders obtained from the drying of the cleaned waste liquid |
图 9为水热处理2h后不同淀粉溶液的UV-Vis谱图,插入图为纯淀粉溶液和1mol·L-1 KCl的淀粉溶液经水热处理不同时间后的宏观照片,相应的碳微球分别为CS-S和CS-SK。当反应时间为2h时,2种溶液均由透明变为浅黄色,意味着此时的水热体系已进入聚合或缩合环节[13, 27]。由UV-Vis光谱可知,尽管此时纯淀粉溶液在可见光范围内的透光率稍高于含KCl的淀粉溶液,但是两者的差异较小,其中550nm处的透光率分别为64.5%和58.5%。当反应进一步持续到4h时,体系处在生长环节,具体体现为固体析出,其中纯淀粉体系为均匀的深棕色悬浊液,而含KCl的淀粉体系出现了分层现象,分为棕黄色液体层和固体析出层。分析表明,KCl的作用机制与已有报道的三氯化铝有所不同,KCl并未显著促进HMF等脱水和分裂产物的产出以及后续的聚合反应,或者说KCl加速微球的生长是其尺寸大幅度增加的主要原因。微球的生长除了通过与构造单元的交联实现外,应该还包括微粒合并这一模式,后者可在2个及以上的个体之间发生,如图 10所示。图 10(a)为CS-SK中存在的呈合并状态的碳微球的SEM形貌。碳微球的合并方式较多,有2球合并、3球合并和4球合并等。2球连接处的局部放大SEM图观察发现,该处表面存在大量的细小突起物,而在偏离此处的碳微球表面没有观察到这种突起物,如图 10(b)所示,意味着2球连接处是优先生长的部位。从图 10(a)还可看出2个碳微球呈不同合并程度的形貌,即从少量接触的葫芦状通过2球连接处的优先生长逐渐形成高度合并的椭圆状。此外,考虑到果糖是淀粉的一种水解产物,因此在水热处理过程中,KCl在果糖溶液中的作用机制应该与其在淀粉溶液中的作用机制相似,即KCl加速微球的生长是其尺寸增加的主要原因。

|
图 9 水热处理2h后不同淀粉溶液的UV-Vis谱图(插图为经水热处理不同时间后的宏观照片) Fig. 9 UV-Vis spectra of various starch solutions hydrothermally treated for 2h(the inserts show the photos of starch solutions hydrothermally treated for various time) |

|
图 10 合并状态的碳微球SEM形貌(a)及2球连接处的局部放大SEM形貌(b) Fig. 10 SEM morphologies of merged carbon microspheres(a) and the zoomed-in SEM morphology of the connection between the microspheres(b) |
HCl对碳微球尺寸的影响可以认为是由氢离子浓度的增加引起的。普遍认为水合氢离子(H3O+)在糖的水热反应过程中起着催化剂的作用。在水热反应刚启动时,H3O+来自水的自电离,能催化多糖水解为单糖[28]。随后,H3O+主要来自后续系列反应产生的有机酸,例如醋酸来自果糖分裂[11]以及乙酰丙酸来自HMF的再水合[8],可催化低聚糖分解为单糖以及果糖分裂为HMF[10]。由此可知,HCl的添加无疑增加了H3O+的浓度,在淀粉溶液中加速水解动力学以及脱水和分裂动力学,而在果糖溶液中则加速果糖向HMF转化,最终促使相应的碳微球具有更大的尺寸。
3 结论(1) 以HCl和KCl为添加剂,以果糖和淀粉为前躯体,通过水热处理和后续热解制备碳微球。合成的碳微球具有纳米孔隙结构和表面含氧官能团。2种添加剂均能促使碳微球的尺寸呈不同程度的增大,平均直径在0.53~6.67μm之间。
(2) 碳微球的形貌源于水热处理,而热解促使微球的结构由聚合物向玻璃碳转变,同时伴随着超过20%的尺寸收缩和近50%的质量损失。
(3) HCl主要加速前期的水解动力学以及脱水与分裂动力学,而KCl主要加速后期微球的生长动力学。
(4) 微球的生长涉及2种主要模式,即构造单元交联生长和微粒合并生长。
| [1] | SUN H C, CHEN T Q, LIU Y, et al. Carbon microspheres via microwave-assisted synthesis as counter electrodes of dye-sensi-tized solar cells[J]. Journal of Colloid and Interface Science, 2015, 445 : 326–329. DOI: 10.1016/j.jcis.2015.01.016 |
| [2] | SUN Y, YANG G, WEN C, et al. Preparation of carbon sphere from lactose by hydrothermal reaction and its performance in gas separation[J]. Environmental Progress & Sustainable Energy, 2014, 33 (2): 581–587. |
| [3] |
牛梅, 杨雅茹, 王欣, 等. CMSs/PET微胶囊阻燃PET纤维制备与表征[J].
材料工程, 2016, 44 (6): 63–69.
NIU M, YANG Y R, WANG X, et al. Preparation and charac-terization of flame retardant PET fiber with microencapsulated CMSs/PET[J]. Journal of Materials Engineering, 2016, 44 (6): 63–69. |
| [4] |
程有亮, 李铁虎, 李凤娟, 等. 硅油/煤沥青乳液制备中间相炭微球[J].
材料工程, 2010 (3): 56–59.
CHENG Y L, LI T H, LI F J, et al. Preparation of mesocarbon microbeads with silicone oil/pitch emulsion[J]. Journal of Mate-rials Engineering, 2010 (3): 56–59. |
| [5] | BERL E, SCHMIDT A, KOCH H. The origin of coal[J]. Angewandte Chemie, 1932, 45 (32): 517–519. DOI: 10.1002/(ISSN)1521-3757 |
| [6] | WANG Q, LI H, CHEN L Q, et al. Monodispersed hard carbon spherules with uniform nanopores[J]. Carbon, 2001, 39 (14): 2211–2214. DOI: 10.1016/S0008-6223(01)00040-9 |
| [7] | SEVILLA M, FUERTES A B. Chemical and structural proper-ties of carbonaceous products obtained by hydrothermal carboni-zation of saccharides[J]. European Journal of Chemistry, 2009, 15 (16): 4195–4203. DOI: 10.1002/chem.v15:16 |
| [8] | YAO C, SHIN Y, WANG L, et al. Hydrothermal dehydration of aqueous fructose solutions in a closed system[J]. The Journal of Physical Chemistry C, 2007, 111 (42): 15141–15145. DOI: 10.1021/jp074188l |
| [9] | SUN X M, LI Y D. Colloidal carbon spheres and their core/shell structures with noble-metal nanoparticles[J]. Angewandte Che-mie International Edition, 2004, 43 (5): 597–601. DOI: 10.1002/(ISSN)1521-3773 |
| [10] | QI Y, ZHANG M, QI L, et al. Mechanism for the formation and growth of carbonaceous spheres from sucrose by hydrothermal carbonization[J]. RSC Advances, 2016, 6 (26): 20814–20823. |
| [11] | SHIN Y S, WANG L Q, BAE I T, et al. Hydrothermal synth-eses of colloidal carbon spheres from cyclodextrins[J]. The Journal of Physical Chemistry C, 2008, 112 (37): 14236–14240. DOI: 10.1021/jp801343y |
| [12] | OKANO T, SUZUKI Y. Hydrothermal synthesis of carbonace-ous spheres starting from different starches[J]. Journal of the Ceramic Society of Japan, 2016, 124 (1): 79–81. DOI: 10.2109/jcersj2.15111 |
| [13] | ZHENG M T, LIU Y L, JIANG K M, et al. Alcohol-assisted hydrothermal carbonization to fabricate spheroidal carbons with a tunable shape and aspect ratio[J]. Carbon, 2010, 48 (4): 1224–1233. DOI: 10.1016/j.carbon.2009.11.045 |
| [14] | RYU J, SUH Y W, SUH D J, et al. Hydrothermal preparation of carbon microspheres from mono-saccharides and phenolic com-pounds[J]. Carbon, 2010, 48 (7): 1990–1998. DOI: 10.1016/j.carbon.2010.02.006 |
| [15] | DEMIR-CAKAN R, BACCILE N, ANTONIETTI M. Carboxy-late-rich carbonaceous materials via one-step hydrothermal carb-onization of glucose in the presence of acrylic acid[J]. Chemis-try of Materials, 2009, 21 (3): 484–490. DOI: 10.1021/cm802141h |
| [16] | MOON G H, SHIN Y S, AREV B W, et al. Carbon dioxide-assisted fabrication of highly uniform submicron-sized colloidal carbon spheres via hydrothermal carbonization using soft drink[J]. Colloid and Polymer Science, 2012, 290 (15): 1567–1573. DOI: 10.1007/s00396-012-2729-4 |
| [17] | CUI X J, ANTONIETTI M, YU S H. Structural effects of iron oxide nanoparticles and iron ions on the hydrothermal carboniza-tion of starch and rice carbohydrates[J]. Small, 2006, 2 (6): 756–759. DOI: 10.1002/(ISSN)1613-6829 |
| [18] | CAI H M, LIN X Y, TIAN L Y, et al. One-step hydrothermal synthesis of carbonaceous spheres from glucose with an alum-inum chloride catalyst and its adsorption characteristic for Uranium(Ⅵ)[J]. Industrial & Engineering Chemistry Resear-ch, 2016, 55 (36): 9648–9656. |
| [19] | TANABE Y, YAMANAKA J, HOSHI K, et al. Surface grap-hitization of furan-resin-derived carbon[J]. Carbon, 2001, 39 (15): 2347–2353. DOI: 10.1016/S0008-6223(01)00069-0 |
| [20] | BRAUN A, BARTSCH M, SCHNYDER B, et al. X-ray scat-tering and adsorption studies of thermally oxidized glassy carbon[J]. Journal of Non-Crystalline Solids, 1999, 260 (1/2): 1–14. |
| [21] | LI M, LI W, LIU S X. Control of the morphology and chemical properties of carbon spheres prepared from glucose by a hydr-othermal method[J]. Journal of Materials Research, 2012, 27 (8): 1117–1123. DOI: 10.1557/jmr.2011.447 |
| [22] | SING K S W. Reporting physisorption data for gas/solid syst-ems with special reference to the determination of surface-area and porosity[J]. Pure and Applied Chemistry, 1985, 57 (4): 603–619. DOI: 10.1351/pac198557040603 |
| [23] | YAO W T, YU L, YAO P F, et al. Bulk production of nonpre-cious metal catalysts from cheap starch as precursor and their excellent electrochemical activity[J]. ACS Sustainable Chem-istry & Engineering, 2016, 4 (6): 3235–3244. |
| [24] | LI M, LI W, LIU S. Hydrothermal synthesis, characterization, and KOH activation of carbon spheres from glucose[J]. Carb-ohydrate Research, 2011, 346 (8): 999–1004. DOI: 10.1016/j.carres.2011.03.020 |
| [25] | GARROTE G, DOMINGUEZ H, PARAJO J C. Hydrothermal processing of lignocellulosic materials[J]. Holz als Roh-und Werkstoff, 1999, 57 (3): 191–202. DOI: 10.1007/s001070050039 |
| [26] | NAGAMORI M, FUNAZUKURI T. Glucose production by hydrolysis of starch under hydrothermal conditions[J]. Journal of Chemical Technology & Biotechnology, 2004, 79 (3): 229–233. |
| [27] | SAKAKI T, SHIBATA M, MILI T, et al. Reaction model of cellulose decomposition in near-critical water and fermentation of products[J]. Bioresource Technology, 1996, 58 (2): 197–202. DOI: 10.1016/S0960-8524(96)00099-5 |
| [28] | TANGER Ⅳ C, PITZER K S. Calculation of the ionization con-stant of H2O to 2, 273K and 500MPa[J]. AIChE Journal, 1989, 35 (10): 1631–1638. DOI: 10.1002/(ISSN)1547-5905 |
 2019, Vol. 47
2019, Vol. 47


