文章信息
- 陈翔, 燕绍九, 王楠, 彭思侃, 王晨, 吴广明, 戴圣龙
- CHEN Xiang, YAN Shao-jiu, WANG Nan, PENG Si-kan, WANG Chen, WU Guang-ming, DAI Sheng-long
- δ-MnO2纳米片的制备、表征及电化学性能
- Fabrication, characterization and electrochemical behavior of δ-MnO2 nanoflakes
- 材料工程, 2019, 47(2): 49-55
- Journal of Materials Engineering, 2019, 47(2): 49-55.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2017.000499
-
文章历史
- 收稿日期: 2017-04-24
- 修订日期: 2018-08-14
2. 江西省送变电建设公司, 南昌 330200
2. Jiangxi Power Transmission & Transformation Construction Company, Nanchang 330200, China
二氧化锰是一类变价过渡金属氧化物,在自然界有着丰富的储量,工业上被广泛地应用于钢铁、磁性材料、环境净化、催化、电池等领域。但是,二氧化锰在超级电容器中的应用研究起步相对较晚,自1999年Lee等[1-2]首次报道以来至今也不到20年。但由于来源广泛、价格低廉、环境友好、理论电容性能优异等诸多优点[3],二氧化锰已被视为超级电容器的理想电极材料。二氧化锰在结构上是由锰氧八面体通过共角或者共棱的方式连接构成的[4]。锰的化合价通常在三价/四价之间相互转化,加上晶体中往往存在各种缺陷,催生了二氧化锰晶型的多样性[5]。常见的二氧化锰晶型有5种,包括α,β,γ,δ和λ等。Devaraj等[6]系统地比较了5种不同MnO2晶型的电容性能,发现δ-MnO2拥有较大尺寸的二维隧道结构(1×∞),有助于电解液阳离子(约0.3nm)在其间快速嵌入/脱出,因而具有更为优异的电容性能。δ-MnO2材料的制备方法主要包括氧化还原法和水热法。氧化还原法通常是在水溶液中利用氧化剂将二价锰盐氧化[7-8],或者利用还原剂将高锰酸盐还原[9]得到二氧化锰沉淀。其工艺过程简单,对反应条件比较敏感,容易得到无定型产物,具有较高的比电容。水热法则是利用水热釜产生的高温、高压、高湿环境,将含锰化合物转化为二氧化锰。水热反应温度相对较高(100~300℃),反应时间较长(6~48h),容易得到纯度较高、结晶度较好的产物[10]。Liu等[11]利用NH2OH·HCl在室温条件下还原KMnO4,制备出高比容量和循环稳定性优异的纳米δ-MnO2材料。通过增加还原剂NH2OH·HCl的浓度,能够实现对δ-MnO2的形貌调控,得到的产物逐渐由颗粒状转变为花球状。产物的比表面积由68.1m2/g增加到142.1m2·g-1,电容性能得到显著改善。Zhao等[12]在160℃水热条件下对KMnO4与KCl的混合溶液进行处理得到多级结构的δ-MnO2材料,该材料是由片状δ-MnO2单元组装而成的纳米花球。调整KMnO4与KCl的浓度能够实现δ-MnO2花球的结构调控,改变纳米花球的尺寸和纳米片层厚度。当纳米片厚度由20~25nm减少至10~15nm时,比电容增加40%。
不同制备方法和制备工艺参数下得到的δ-MnO2形貌各异,主要可以归为3类:颗粒状、片状和花球状。δ-MnO2形貌对其电容性能影响较大,其中片状δ-MnO2因具有丰富的表面,有助于实现大的比电容;同时片状形态有利于δ-MnO2与导电碳材料形成良好的接触,改善电极材料的倍率性能,从而受到广泛关注。片状δ-MnO2通常需要在特定的模板,如碳纳米管、介孔碳和石墨烯等表面生长形成,得到的产物往往是复合材料[13-14],很难剥离出片状δ-MnO2进行单独研究。因而目前针对片状δ-MnO2材料尤其是超薄的δ-MnO2纳米片材料的报道相对较少,而开发出简单的合成方法来制备高比表面积的超薄δ-MnO2纳米片材料显得尤为必要。据报道,二氧化锰电极材料的性能取决于其孔结构、比表面积和锰的平均化合价(average oxidation state, AOS)等因素[15-16]。合适的孔结构有助于电解液离子向电极表面迁移,而大的比表面积能够提供更多的氧化还原反应活性位点,有助于实现更大的比电容。但是一味地提高比表面积也并不可取,因为表面积的提高通常会引起二氧化锰结晶度下降,造成电导率降低而使得电容减少[17]。锰的平均化合价主要是由三价锰与四价锰的含量比决定,Taguchi等[18]认为,三价锰含量增加会引起二氧化锰电导率的降低,从而导致比电容衰减;也有文献报道了相反的变化规律[19]。总之,二氧化锰电极材料性能受到多方面的影响,作用机理较为复杂,目前各因素的影响还没有完全定论。
本工作通过氧化还原法成功制备了2种高比表面积的超薄δ-MnO2纳米片材料,对其成分、结构、孔径分布、比表面积以及电极材料在0.5mol/L Na2SO4电解液中的比容量、倍率性能和循环性能等电化学性能进行测试与对比,分析了形貌特征、片径尺寸、比表面积对电化学性能的影响,有助于理解δ-MnO2纳米片电极材料的电化学行为。
1 实验材料与方法纳米δ-MnO2电极材料是通过高锰酸钾与醋酸锰溶液或者无水乙醇的化学共沉淀反应合成的。实验试剂均由北京国药集团提供,纯度为99.5%。制备过程:首先称取1.0g高锰酸钾和1.8g四水醋酸锰试剂分别溶于500mL去离子水中,得到紫色高锰酸钾溶液与淡粉色的醋酸锰溶液各500mL;在磁力搅拌作用下将醋酸锰溶液逐滴加入高锰酸钾溶液中得到褐色悬浊液;继续搅拌1h确保反应充分进行,然后通过抽滤将固体沉淀物分离;先后分别通过去离子水和乙醇将固体沉淀物反复清洗、抽滤,将得到的产物置于80℃恒温箱中干燥12h;最后得到黑褐色纳米δ-MnO2粉末,记为δ-MnO2-A。高锰酸钾与无水乙醇化学共沉淀反应合成的操作过程和上述过程类似,区别在于磁力搅拌作用下将无水乙醇逐滴加入高锰酸钾溶液得到褐色悬浊液,继续搅拌2h后通过抽滤、分离、沉淀,最后得到棕黄色纳米δ-MnO2粉末,记为δ-MnO2-B。
X射线衍射仪为Bruker D8 advance,采用铜靶Kα射线,波长0.15406nm;扫描电镜为FEI Nova Nano SEM 450,工作电压20kV; 透射电镜为FEI Tecnai G2 F30,加速电压为100kV,配有高分辨附件; X射线光电子能谱分析仪为Thermo Scientific ESCALAB 250Xi,采用单色铝Kα射线; 比表面积测试仪为Kubo-X1000,吸附气体为氮气。
工作电极是由电极材料、乙炔黑和聚四氟乙烯按照7:2:1的质量比组成。将以上混合粉末在研钵中研磨30min,然后加入无水乙醇并置于超声池(37kHz,200W)中处理20min得到分散液。将分散液滴于抛光后的玻碳电极表面并干燥,得到伏安曲线(CV)测试工作电极。将工作电极、Ag/AgCl参比电极与铂丝电极组成三电极系统,浸入0.5mol/L Na2SO4电解液中形成开放的电化学池,进行CV性能测试。将分散液进行抽滤得到电极薄膜(面密度约为2mg·cm-2),干燥后组装扣电形成对称性超级电容器,电解液为0.5mol/L Na2SO4,用于交流阻抗分析(EIS)和恒流充放电测试(GCD)。
2 结果与分析 2.1 化学成分分析纳米δ-MnO2电极材料是通过醋酸锰或者乙醇还原高锰酸钾制备而成的,由于纳米δ-MnO2的制备条件为水系溶液,同时溶液中富含金属钾离子,因此制得的电极材料会含有一定量的金属钾和结晶水。电极材料中钾、锰的含量是通过ICP-AES化学成分分析得到,结晶水含量是通过测量粉末样品在200℃保温1h前后的质量变化得到,锰元素的平均价态是通过XPS分析得到。按照钾的化学价为+1价,氧的化学价为-2价,并固定化学式中氧的计量数为2(不包含结晶水中的氧),结合锰元素含量、钾元素含量、锰的平均价态以及水的含量能够确定电极材料的化学式。基于理想MnO2晶体结构中1:2的锰氧比,除去三价锰和四价锰的量,可计算得到锰空位含量,相关结果列于表 1,锰的平均化合价是通过XPS分析得到的。
| Sample | Chemical formula | Average Mn valence | Mass fraction/% | ||
| Mn | K | H2O | |||
| δ-MnO2-A | K0.122Mn0.0703+Mn0.9174+Mn0.013vO2·0.47H2O | 3.88 | 51.62 | 4.51 | 8.56 |
| δ-MnO2-B | K0.247Mn0.1243+Mn0.8454+Mn0.031vO2·0.50H2O | 3.75 | 48.44 | 8.72 | 8.62 |
| Note: Mn3+, Mn4+, Mnv represent trivalent, tetravalent and vacant manganese. | |||||
图 1所示为2种纳米粉体中Mn2p轨道电子的XPS谱图。可知,出现在655eV和642eV附近的峰分别对应锰的2p1/2和2p3/2轨道电子能谱。Mn3+与Mn4+的2p3/2轨道电子结合能略有不同,可以通过对Mn2p3/2峰进行分峰拟合得到2种化合价的锰元素的比值,从而判定锰的平均化合价。根据Biesinger等[20]的方法,可以将Mn2p3/2峰分成5组,结合能高的4组为Mn4+的主峰和卫星峰,结合能低的1组为Mn3+主峰。由此得到δ-MnO2-A和δ-MnO2-B中锰的平均化合价分别为3.88和3.75。理想的δ-MnO2是由锰氧八面体通过共角或者共棱的方式连接构成的,锰氧的原子比为1:2。实际中由于Mn3+和锰空位的存在,使得锰氧的原子比与理想的数值存在偏差,需要在层间纳入金属阳离子以保持整体化合价的平衡。同时金属阳离子往往为水合状态,嵌入δ-MnO2层间时会引入部分水分子形成层间结晶水。通过化学计量分析确定了2种纳米粉体的化学分子式,二者结晶水含量相近。与δ-MnO2-A相比,δ-MnO2-B的钾含量、Mn3+和锰空位含量更高。
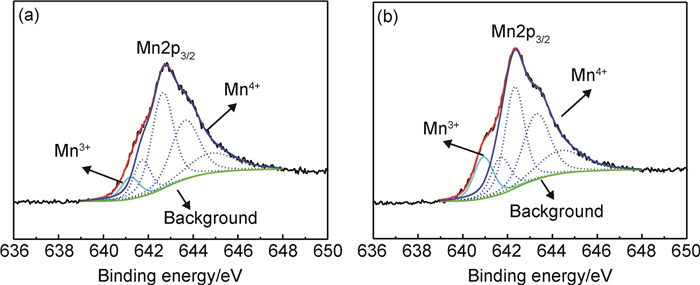
|
图 1 纳米δ-MnO2电极材料的Mn2p XPS谱图 (a)δ-MnO2-A;(b)δ-MnO2-B Fig. 1 Mn2p XPS spectra of nano δ-MnO2 electrode materials (a)δ-MnO2-A; (b)δ-MnO2-B |
图 2所示为2种纳米粉体的XRD谱图。经分析,2种纳米粉体的衍射峰与水合氧化锰钾相的特征峰匹配度最高(编号00-042-1317)。这种水合氧化锰钾相具有C心单斜晶体结构,出现在12.48°,25.21°,36.74°,65.77°附近的衍射峰分别对应该相的(001),(002),(110),(020)晶面。(001)晶面对应的晶面间距约为0.709nm,与层状Birnessite型二氧化锰层间距大小相符,在这类化合物层间常常存在一定数量的层间结晶水和金属阳离子[21],因而往往在(002)晶面上也会发生布拉格衍射,对应的晶面间距约为0.354nm。δ-MnO2-A与δ-MnO2-B衍射谱图的一个主要差异就在于是否存在明显的(002)晶面衍射峰,这种差异很可能是由于层间(002)晶面处结晶水或金属钾离子含量不同导致的。δ-MnO2-A的金属钾离子含量相对较低,不能对入射X射线产生强烈的布拉格衍射,从而未见明显的(002)衍射峰。衍射谱图的另一个主要区别在于2种材料(001)晶面的衍射峰位置存在一定差异,δ-MnO2-A的(001)晶面衍射峰发生明显左移。这可能与两者的层间结晶水含量存在一定差异有关,当层间结晶水含量较高时(001)晶面间距增大,反之亦然。
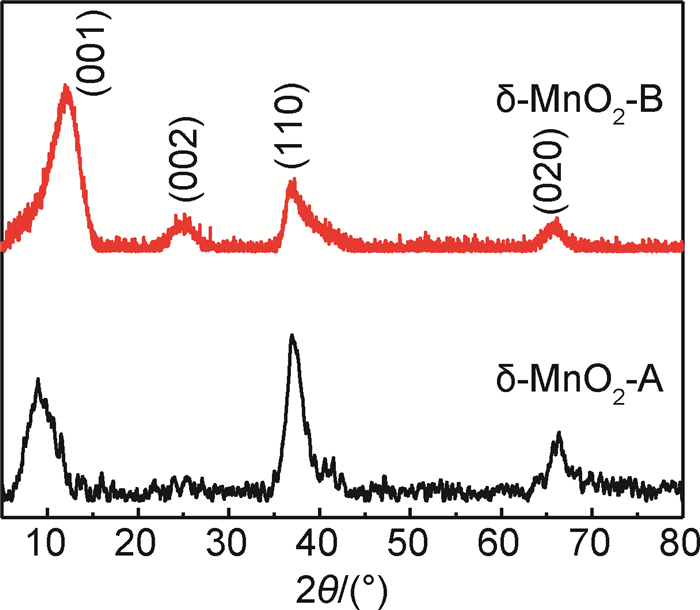
|
图 2 纳米δ-MnO2电极材料的XRD谱图 Fig. 2 XRD patterns of nano δ-MnO2 electrode materials |
图 3给出了纳米δ-MnO2电极材料的微观形貌。从图 3(a-1),(b-1)的SEM照片中可见,2种纳米粉末均呈现颗粒形貌,δ-MnO2-A颗粒直径约为100nm,δ-MnO2-B颗粒直径约为200nm。从图 3(a-2),(b-2)的TEM和其高分辨照片中能够进一步分辨纳米δ-MnO2颗粒的微观特征。2种纳米颗粒均呈现多褶的纳米片形貌特征,纳米片是由5nm左右的晶粒构成。δ-MnO2-A纳米片尺寸较小,其高分辨照片可观测到许多(010)晶面的窄条纹,偶尔出现(001)晶面宽条纹,层数为5~10层,且纳米片层状形态不清晰。δ-MnO2-B纳米片尺寸略大,其高分辨照片中能观测到许多(001)晶面宽条纹,层数为5~10层,层状形态非常清晰。2种材料的选区电子衍射均得到相同的多晶衍射环,表明这2种材料有着同样的晶体结构。

|
图 3 纳米δ-MnO2电极材料的微观形貌 (a)δ-MnO2-A;(b)δ-MnO2-B;(1)SEM图;(2)TEM图;(3)高分辨形貌 Fig. 3 Morphologies of nano δ-MnO2 electrode materials (a)δ-MnO2-A; (b)δ-MnO2-B; (1)SEM images; (2)TEM images; (3)HR-TEM images |
纳米δ-MnO2电极材料的氮气恒温吸脱附曲线(见图 4)具有典型的Ⅳ型等温线特征。吸脱附曲线组成H3型的磁滞环,这与电极材料的片状颗粒微观形貌特征是一致的。由脱附曲线得出的BJH孔径分布曲线可以看出,纳米δ-MnO2电极材料主要由介孔构成,孔径分布在2~30nm之间。介孔孔隙对电解液进入的阻力较小[22],有利于电解液阳离子在其中传输,因此有助于提高材料的电化学性能。由多点BET法计算得出δ-MnO2-A和δ-MnO2-B的比表面积值分别为211.8m2·g-1和144.9m2·g-1。二者之间的差异主要是由于δ-MnO2-A纳米片具有更小的片径尺寸,从而拥有更多的边界面积。

|
图 4 纳米δ-MnO2电极材料的氮气等温吸脱附曲线与孔径分布图 (a)δ-MnO2-A;(b)δ-MnO2-B Fig. 4 Nitrogen adsorption/desorption isotherms and pore size distribution of nano δ-MnO2 electrode materials (a)δ-MnO2-A; (b)δ-MnO2-B |
通过CV、EIS和GCD测试手段对纳米δ-MnO2-A和δ-MnO2-B电极材料的电化学性能进行全面的考察(图 5)。图 5(a)为三电极体系下纳米δ-MnO2-A和δ-MnO2-B电极材料的CV曲线,电解液采用0.5mol/L的Na2SO4溶液(通过氢氧化钠和硫酸溶液将pH值调为7),扫描速率为50mV·s-1,扫描范围为0~0.8V(vs Ag/AgCl)。可见,2种电极材料的CV曲线形状均近似矩形,非常接近理想双电层电容器的形状。与其他的贋电容电极材料(如氧化镍[23]、聚苯胺[24]等)不同,在δ-MnO2电极的CV曲线上并不出现明显的氧化还原反应峰,这是由于δ-MnO2独特的法拉第贋电容反应机理造成的。在充放电过程中,电解质阳离子和质子会在δ-MnO2电极表面发生吸附、脱附,或者在δ-MnO2浅表层发生嵌入脱出[25]。该过程被认为按照反应方程(1)[26]连续进行,因此从CV曲线上并不会表现出独立的氧化还原反应峰。

|
(1) |
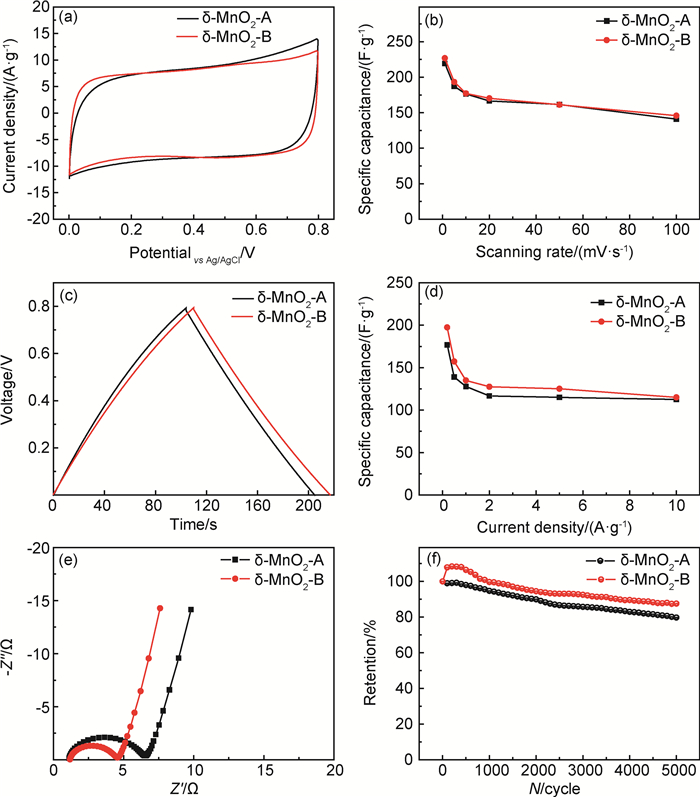
|
图 5 纳米δ-MnO2电极材料电化学性能 (a)50mV·s-1扫描速率下的CV曲线;(b)比电容与扫描速率的关系;(c)1A·g-1电流密度下的GCD曲线;(d)比电容与电流密度的关系;(e)Nyquist谱图;(f)100mV·s-1扫描速率下循环衰减曲线 Fig. 5 Electrochemical performance for nano δ-MnO2 electrode materials (a)CV curves at 50mV·s-1; (b)specific capacitance as a function of the scanning rate; (c)GCD curves at 1A·g-1; (d)specific capacitance as a function of the current density; (e)Nyquist spectra; (f)cycling performance at 100mV·s-1 |
通过对CV曲线进行积分,能够得到相对应的比电容C数据。
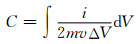
|
(2) |
式中:i为电流大小,A;m为电极中活性纳米δ-MnO2的质量,g;v为扫描速率,V/s;V为窗口电势,V。对每个扫描速率下前10次的CV循环曲线进行积分,求得的平均值即为该扫描速率下的比电容值。图 5(b)给出了1~100mV·s-1下比电容随扫描速率的变化情况。对于纳米δ-MnO2-A电极,其比电容从219,187,176,167,162F·g-1逐渐减小为141F·g-1,倍率保持率为64.4%。纳米δ-MnO2-B电极的比电容和倍率保持率性能与纳米δ-MnO2-A电极非常接近,其比电容从227,193,177,170,161F·g-1逐渐减小为146F·g-1,倍率保持率为64.3%。图 5(c)给出了1A·g-1电流密度下纳米δ-MnO2-A和δ-MnO2-B电极材料的GCD曲线。两者的充电和放电曲线较为对称,表明2种δ-MnO2电极在充放电过程发生的电化学反应可逆性优异。图 5(d)给出了2种电极材料的比电容与电流密度的关系,其变化趋势与CV分析结果一致。电极材料的频响特征可以通过EIS测试得到,图 5(e)所示为EIS测试δ-MnO2-A和δ-MnO2-B组成超级电容器得到的Nyquist图,具有典型的贋电容器特征。从高频区的阻抗弧半径大小可以看出,δ-MnO2-A的电荷转移电阻明显大于δ-MnO2-B,这种差异可能是与δ-MnO2-A片径较小而电导率较差有关。循环性能是超级电容器实际应用中另一个关键性能,图 5(f)给出了100mV·s-1下2种电极材料的循环性能曲线。在循环初期,材料均发生活化,比电容出现不同程度增长。其中δ-MnO2-B比电容增长更为显著,200次循环后其相对初始容量升高8.4%。随后,两者比电容在循环过程中逐渐减少。5000次循环后,δ-MnO2-A的容量保持率为79.7%,而得益于初期显著的活化δ-MnO2-B容量保持率高达87.6%。
从化学成分分析、结构表征与形貌观察中发现,2种工艺下制备的电极材料无论在组成元素、晶体结构还是形貌上都非常接近,因此电极材料构成电极后对电解液的浸润性、氧化还原反应机理均比较相似。但是在化学成分、片径尺寸和层状结构上,2种δ-MnO2纳米材料存在一定的差异。δ-MnO2-B相较于δ-MnO2-A拥有更高的钾离子和锰空位含量。钾离子和锰空位的存在被认为有助于稳定δ-MnO2片层结构,能促进电解液阳离子在层间的迁移。δ-MnO2-A比δ-MnO2-B具有更小的片层直径,因此拥有更多的侧表面面积,表现出更高比表面积值。二者的片层厚度相当,但是δ-MnO2-B由于具有更高的钾离子和锰空位含量,从而拥有更清晰的层间结构。Brousse等[17]研究发现,二氧化锰比表面积与比电容之间并不存在明显的正相关性,认为二氧化锰的电化学过程不仅涉及表面区域的阳离子迁移,也涉及浅表层区域的阳离子扩散。尽管纳米δ-MnO2-A材料相比δ-MnO2-B具有更小的片径尺寸和更大的比表面积数值,理论上能够提供更多的活性表面。但是δ-MnO2-A尺寸上的优势并没有引起比电容的提升,甚至在GCD测试中其比电容还要略低于δ-MnO2-B。这是由于:一方面,δ-MnO2-B材料层间结构更有利于促进电解液钠离子的可逆嵌入/脱出,从而弥补了二者比表面积不同带来的差异;另一方面,δ-MnO2-B材料片层尺寸更大,结构较完整且导电性更好,构成的多孔电极对电荷转移阻碍较少。因此,在纳米片层厚度相当的前提下,较大片径尺寸的δ-MnO2-B会因为结构完整、电荷转移电阻小而更适合用作超级电容器的电极材料。
3 结论(1)δ-MnO2-A和δ-MnO2-B纳米材料具有相同的C心单斜晶体结构和相似的多褶纳米片微观形貌。纳米δ-MnO2-A的片径约为100nm,纳米δ-MnO2-B的片径略大,约为200nm;2种纳米片片层均为5~10层,但δ-MnO2-B的层间结构较δ-MnO2-A更为清晰。比表面积测试表明,多孔纳米片孔径均属于介孔,尺寸为2~30nm。其中δ-MnO2-A和δ-MnO2-B纳米片的多点BET比表面积分别为211.8m2·g-1和144.9m2·g-1。
(2) 2种δ-MnO2电极材料具有相近的比电容和倍率性能,然而δ-MnO2-B的循环性能要优于δ-MnO2-A,并且构成多孔电极时δ-MnO2-B材料电荷转移电阻更小,因此相对于小片径的δ-MnO2-A更具有优势。片层状结构的δ-MnO2-B电极材料的比电容可达227F·g-1,5000次循环后的电容保持率高达87.6%,是一种非常具有潜力的超级电容器电极材料。
| [1] | LEE H Y, GOODENOUGH J B. Supercapacitor behavior with KCl electrolyte[J]. Journal of Solid State Chemistry, 1999, 144 (1): 220–223. DOI: 10.1006/jssc.1998.8128 |
| [2] | LEE H Y, MANIVANNAN V, GOODENOUGH J B. Electrochemical capacitors with KCl electrolyte[J]. Comptes Rendus de l Académie des Sciences-Series IIC-Chemistry, 1999, 2 (11): 565–577. |
| [3] | WANG J G, KANG F, WEI B. Engineering of MnO2-based nanocomposites for high-performance supercapacitors[J]. Progress in Materials Science, 2015, 74 : 51–124. DOI: 10.1016/j.pmatsci.2015.04.003 |
| [4] | CHEN X, YAN S, WANG N, et al. Facile synthesis and characterization of ultrathin δ-MnO2 nanoflakes[J]. RSC Advances, 2017 (88): 55734–55740. |
| [5] | POSR J E. Crystal structure determinations of synthetic sodium, magnesium, and potassium birnessite using TEM and the Rietveld method[J]. American Mineralogist, 1990, 75 (5/6): 477–489. |
| [6] | DEVARAJ S, MUNICHANDRAIAH N. Effect of crystallographic structure of MnO2 on its electrochemical capacitance properties[J]. Journal of Physical Chemistry C, 2008, 112 (11): 4406–4417. DOI: 10.1021/jp7108785 |
| [7] | JOTHIRAMALINGAM R, VISWANATHAN B, VARADARAJAN T K. Synthesis and structural characterization of copper incorporated manganese oxide OMS-2 materials synthesized via potassium birnessite[J]. Materials Chemistry & Physics, 2006, 100 (2/3): 257–261. |
| [8] | FENG Q, LIU L, YANAGISAWA K. Effects of synthesis parameters on the formation of birnessite-type manganese oxides[J]. Journal of Materials Science Letters, 2000, 19 (17): 1567–1570. DOI: 10.1023/A:1006733308073 |
| [9] | SHEN X F, DING Y S, LIU J, et al. Control of nanometer-scale tunnel sizes of porous manganese oxide octahedral molecular sieve nanomaterials[J]. Cheminform, 2005, 36 (7): 805–809. |
| [10] | ZHANG X, YU P, ZHANG H, et al. Rapid hydrothermal synthesis of hierarchical nanostructures assembled from ultrathin birnessite-type MnO2, nanosheets for supercapacitor applications[J]. Electrochimica Acta, 2013, 89 : 523–529. DOI: 10.1016/j.electacta.2012.11.089 |
| [11] | LIU L, YAO L, TAN W, et al. Facile synthesis of birnessite-type manganese oxide nanoparticles as supercapacitor electrode materials[J]. Journal of Colloid & Interface Science, 2016, 482 : 183–192. |
| [12] | ZHAO S, LIU T, HOU D, et al. Controlled synthesis of hierarchical birnessite-type MnO2 nanoflowers for supercapacitor applications[J]. Applied Surface Science, 2015, 356 : 259–265. DOI: 10.1016/j.apsusc.2015.08.037 |
| [13] | HUANG M, MI R, LIU H, et al. Layered manganese oxides-decorated and nickel foam-supported carbon nanotubes as advanced binder-free supercapacitor electrodes[J]. Journal of Power Sources, 2014, 269 (4): 760–767. |
| [14] | ZHAO Y, MENG Y, WU H, et al. In situ anchoring uniform MnO2 nanosheets on three-dimensional macroporous graphene thin-films for supercapacitor electrodes[J]. RSC Advances, 2015 (110): 90307–90312. |
| [15] | WANG G, ZHANG L, ZHANG J. A review of electrode materials for electrochemical supercapacitors[J]. Chemical Society Reviews, 2011, 41 (2): 797–828. |
| [16] | WEI W, CUI X, CHEN W, et al. Manganese oxide-based materials as electrochemical supercapacitor electrodes[J]. Chemical Society Reviews, 2011, 40 (3): 1697–1721. DOI: 10.1039/C0CS00127A |
| [17] | BROUSSE T, TOUPIN M, DUGAS R, et al. Crystalline MnO2 as possible alternatives to amorphous compounds in electrochemical supercapacitors[J]. Journal of the Electrochemical Society, 2006, 153 (12): 2171–2180. DOI: 10.1149/1.2352197 |
| [18] | TAGUCHI A, INOUE S, AKAMARU S, et al. Phase transition and electrochemical capacitance of mechanically treated manganese oxides[J]. Journal of Alloys & Compounds, 2006, 414 (1): 137–141. |
| [19] | CHANG J K, LEE M T, TSAI W T. In situ Mn K-edge X-ray absorption spectroscopic studies of anodically deposited manganese oxide with relevance to supercapacitor applications[J]. Journal of Power Sources, 2007, 166 (2): 590–594. DOI: 10.1016/j.jpowsour.2007.01.036 |
| [20] | BIESINGER M C, PAYNE B P, GROSVENOR A P, et al. Resolving surface chemical states in XPS analysis of first row transition metals, oxides and hydroxides:Cr, Mn, Fe, Co and Ni[J]. Applied Surface Science, 2011, 257 (7): 2717–2730. DOI: 10.1016/j.apsusc.2010.10.051 |
| [21] | ABOU K S. Hydrated layered manganese dioxide:part Ⅰ.synthesis and characterization of some hydrated layered manganese dioxides from α-NaMnO2[J]. Solid State Ionics, 2002, 150 (3): 407–415. |
| [22] | PENG S, YAN S, WANG N, et al. Fluorinated graphene/sulfur hybrid cathode for high energy and high power density lithium primary batteries[J]. RSC Advances, 2018 (23): 12701–12707. |
| [23] | LIU X M, ZHANG X G, FU S Y. Preparation of urchinlike NiO nanostructures and their electrochemical capacitive behaviors[J]. Materials Research Bulletin, 2006, 41 (3): 620–627. DOI: 10.1016/j.materresbull.2005.09.006 |
| [24] |
于美, 李新杰, 马玉骁, 等. 石墨烯基复合超级电容器材料研究进展[J].
材料工程, 2016, 44 (5): 101–111.
YU M, LI X J, MA Y X, et al. Progress in research on graphene-based composite supercapacitor materials[J]. Journal of Materials Engineering, 2016, 44 (5): 101–111. |
| [25] | MATHIEU T, THIERRY B, DANIEL B. Charge storage mechanism of MnO2 electrode used in aqueous electrochemical capacitor[J]. Chemistry of Materials, 2004, 16 (16): 3184–3190. DOI: 10.1021/cm049649j |
| [26] | SIMON P, GOGOTSI Y. Materials for electrochemical capacitors[J]. Nature Materials, 2008, 7 (11): 845–854. DOI: 10.1038/nmat2297 |
 2019, Vol. 47
2019, Vol. 47


