文章信息
- 秦振海, 黄昊, 吴爱民, 陈明珠, 杨影影, 姚曼
- QIN Zhen-hai, HUANG Hao, WU Ai-min, CHEN Ming-zhu, YANG Ying-ying, YAO Man
- 立方相碳化钛在锂空电池中的电化学行为
- Electrochemical behavior of cubic titanium carbide for lithium-air batteries
- 材料工程, 2019, 47(2): 34-41
- Journal of Materials Engineering, 2019, 47(2): 34-41.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2017.001447
-
文章历史
- 收稿日期: 2017-11-23
- 修订日期: 2018-05-10
锂离子电池是目前使用最广泛的储能系统,但是锂离子电池能量密度通常都限制在250Wh·kg-1以下,它不能满足耗电量日益增加的各种电子设备的需求,也远低于电动汽车动力电池对高比能量的要求[1-2],因此,开发新型高比能量、可循环使用的清洁电池体系迫在眉睫。锂空电池拥有超高比能量(2~3kWh·kg-1),是锂离子电池的5~10倍,可与汽油相媲美,完全能满足各种电子设备的需求,并被认为是最有希望在电动汽车中应用的能源体系[2-5]。然而,锂空电池距实际应用仍有很大的距离,存在很多问题需要解决,如:循环寿命短,循环效率低,倍率性能较差。这些问题主要是由空气正极上发生的不可逆反应引起的[6]。在正极反应Li2O2→2Li+ + O2 + 2e-中,由于放电产物的分解需要较多的能量,所以锂空电池的充电电压就比较高,造成电解液和正极材料分解严重,导致锂空电池较差的循环效率和循环寿命[6-8]。而开发出具有高效氧析出催化活性的正极催化剂是解决该问题的关键所在。
炭材料作为锂空电池正极催化剂,由于其低成本、低密度、良好的导电性而被广泛研究[9-10]。通常,炭材料具有良好的氧还原反应(ORR)催化性能,但是,氧析出反应(OER)催化性能却相对很弱[11-12],这就导致充放电过程中反应的不可逆,造成锂空电池较差的循环效率和循环寿命[13-14]。贵金属及其合金如Au,Pt,Ru等拥有优良的氧析出催化性能,但是它们的密度比较大,会导致锂空电池的比容量很小,而且它们储量有限、价格高昂,因此难于实现实际应用[15-16]。对于金属氧化物催化剂的研究也很多,多种金属氧化物已被证实对ORR,OER均有效,并且其来源广泛,价格低廉,比较适合实际应用,但是它们的导电性普遍不好[17-18]。
TiC作为过渡金属化合物,拥有优良的导电性和化学稳定性,更重要的是它拥有可与贵金属相媲美的OER催化性能[13, 19]。直流电弧等离子体法,属于一种物理气相沉积法,具有反应核心区域温度高、反应腔室内温度梯度大、合成纳米粉体纯度高、产出率高且工艺参数可控等优点,广泛用于各种纳米粉体的制备[20-21]。
本工作采用直流电弧等离子体法合成TiC纳米颗粒,将其作为锂空电池正极催化剂。该催化剂能显著提高锂空电池倍率性能,减缓充放电过程中有害副产物的积累,是一种兼具ORR和OER催化性能的双效催化剂。
1 实验 1.1 直流电弧等离子体法制备TiC纳米颗粒在直流电弧等离子体纳米粉体制备设备内,将纯度为99.99%的金属钛块作为负极,钨棒作为正极。封闭腔体,用真空泵抽至10-3Pa。随后,通入0.01MPa甲烷和0.02MPa氩气作为反应气体。引弧并保持电流为90A,使钛块在该电弧下蒸发15min。生成粉体沉积在腔体内壁,2h后,通入0.025MPa空气钝化12h,所得粉体即为TiC纳米颗粒。
1.2 材料表征采用PANalytical Empyrean型X射线衍射仪(XRD)研究样品的结构和物相,操作条件:CuKα(λ= 0.154nm)为辐射光源,管压50kV,管流140mA。使用Tecnai2 20 S-TWIN型高分辨透射电镜(TEM,加速电压为200kV)和S-4800型场发射扫描电子显微镜(SEM)对样品的形貌进行分析。利用NEX-US EURO型红外光谱仪(FT-IR)研究化学键振动类型。
1.3 线性扫描伏安法(LSV)测试采用线性扫描伏安法(LSV)测试TiC纳米颗粒的电化学性能,所用仪器为CHI760E电化学工作站和旋转圆盘电极(BAS, RRDE-3A)体系。测试采用三电极体系,其中工作电极为负载了催化剂层的玻碳电极(GC, ϕ3mm),对电极为10mm×10mm的铂片电极,参比电极为饱和甘汞电极(SCE)。
催化剂层的制备:取6mg TiC纳米颗粒,加入1mL无水乙醇和100μL质量分数为5%的Nafion溶液配制催化剂悬浊液,超声分散60min后用微量进样器吸取10μL滴在玻碳电极表面,室温晾干得到分散均匀的催化剂层。Pt/C催化剂层的制备采用同样方法。
测试所用溶液体系为氧饱和的0.1mol/L KOH溶液,扫描速率为5mV·s-1。测试前,向溶液中通入60mL/min的氮气1h,随后通入60mL/min的氧气1h。为了保持氧饱和状态,测试过程中始终保持30mL/min的氧气通量。根据Evs RHE=Evs SCE+0.0591pH+0.241,实验中所有的电极电位已换算为可逆氢电极电位(RHE)。
1.4 锂空电池组装与电化学测试TiC正极制备:将所制TiC纳米颗粒与导电炭黑(Super-P)、黏结剂(聚偏氟乙烯,PVDF)按质量比3:6:1均匀混合。加入适量N-甲基吡咯烷酮(NMP)溶液研磨30min以上,之后将浆料均匀涂覆在TGP-H-060碳纸上。将其在真空干燥箱中,110℃下干燥12h,之后制成直径为14mm的正极片待用。SP正极由质量比为9:1的Super-P和PVDF构成,制备采用上述相同的步骤。正极片上涂覆物质的负载量为0.4~0.7mg·cm-2。锂空电池的组装在有氩气保护的手套箱中进行。以所制电极为正极,锂片为负极,1mol·L-1LiTFSI(双三氟甲烷磺酰亚胺锂)/TEDGME(四乙二醇二甲醚)为电解液,使用玻璃纤维隔膜(GF/D, Whatman)组装成CR2032型纽扣电池,电池壳的正极处有19个直径为1mm、能使氧气扩散进入的小孔。组装好的锂空电池在手套箱中静置24h后进行电化学测试,所有电化学测试均是在1.01325×105Pa的纯氧中进行。采用LAND CT2001A电池测试系统对电池进行恒流充放电测试和倍率性能测试,充放电电压范围为2.0~4.5V(vs Li/Li+)。采用CHI 660E电化学工作站对电池进行循环伏安测试,电压区间为2.0~4.5V(vs Li/Li+),扫描速率为0.5mV·s-1。锂空电池的比容量基于TiC纳米颗粒与Super P的质量之和计算。
1.5 放电产物Li2O2的检测首先,将锂空电池由开路电压恒流放电(100mA·g-1)至2.0V。之后,在手套箱中将该电池拆开,取出TiC空气正极片。用DMC(碳酸二甲酯)溶剂清洗该正极片,并在真空干燥箱中常温下保持3h。接着对该电极片进行XRD,FTIR,SEM测试。对放电前和充电后空气正极的检测也采用同样的方法。
2 结果与讨论 2.1 形貌与结构图 1为所制备TiC纳米颗粒的TEM照片和XRD图。由图 1(a)可明显观察到TiC纳米颗粒呈现立方体结构,粒径约40~90nm。通过图 1(b)测量其晶格间距约为0.22nm,对应TiC的(200)晶面。图 1(c)为其XRD图,可看出所制备纳米粒子衍射峰与TiC标准谱图(PDF No.32-1383)完全一致,说明产物为单一相的TiC。在图中可看出2θ=35.9°,41.7°,60.5°,72.4°和76.1°分别对应TiC的(111),(200),(220),(311)和(222)晶面衍射峰,峰形规整尖锐,说明材料晶化程度良好。

|
图 1 TiC纳米颗粒的结构表征图 (a), (b)TEM照片; (c)XRD图 Fig. 1 Structural characterization of TiC nanoparticles (a), (b)TEM images; (c)XRD pattern |
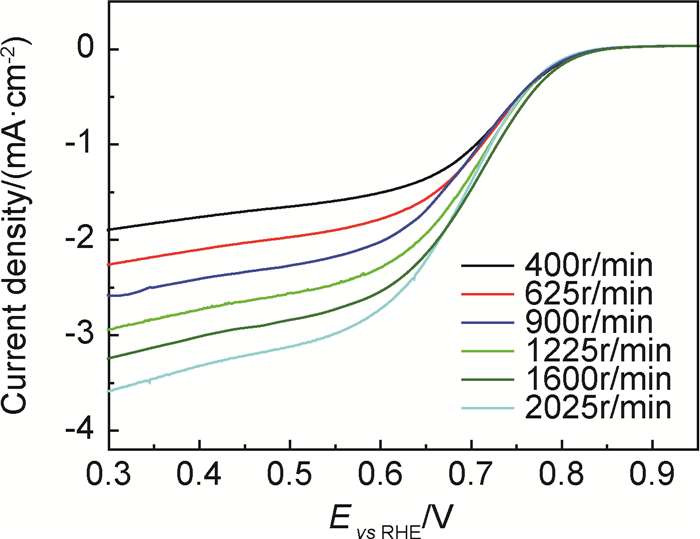
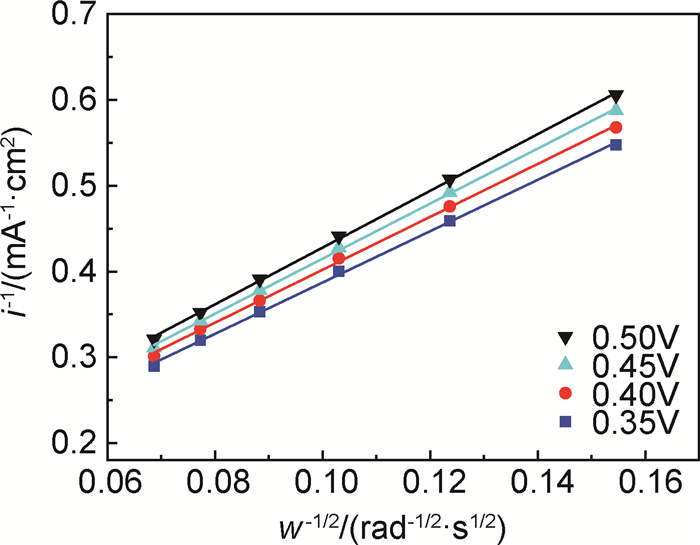
采用旋转圆盘电极(RDE)方法测试TiC纳米颗粒的ORR及OER催化活性。图 2是TiC纳米颗粒在扫描速率为5mV·s-1、转速为400~2025r/min时的ORR线性扫描伏安曲线(LSV)。如图 2所示,TiC的ORR电流密度的绝对值随转速增大而增加。图 3是根据TiC的ORR极化曲线所得Koutecky-Levich(K-L)曲线,TiC在电位为0.35,0.40,0.45,0.50V时均具有良好的线性关系,且斜率基本一致。氧分子电子转移数根据K-L方程计算:
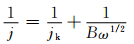
|
(1) |
|
图 2 TiC催化剂的ORR极化曲线 Fig. 2 ORR polarization curves of the TiC catalyst |
|
图 3 TiC催化剂Koutecky-Levich曲线 Fig. 3 Koutecky-Levich plots of the TiC catalyst based on ORR polarization curves |
式中:j为测试电流密度; jk是极限电流密度; ω为旋转角速度(ω=2πN, N为转速)。
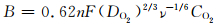
|
(2) |
式中:n是每还原一个氧分子的电子转移数量;F为法拉第常数(96485C·mol-1);DO2为氧气在电解质中的扩散系数(1.86×10-5cm2·s-1);ν为KOH的动力黏度(1.009×10-2cm2·s-1);CO2为在电解质中的氧气浓度(1.21×10-3mol·L-1)。
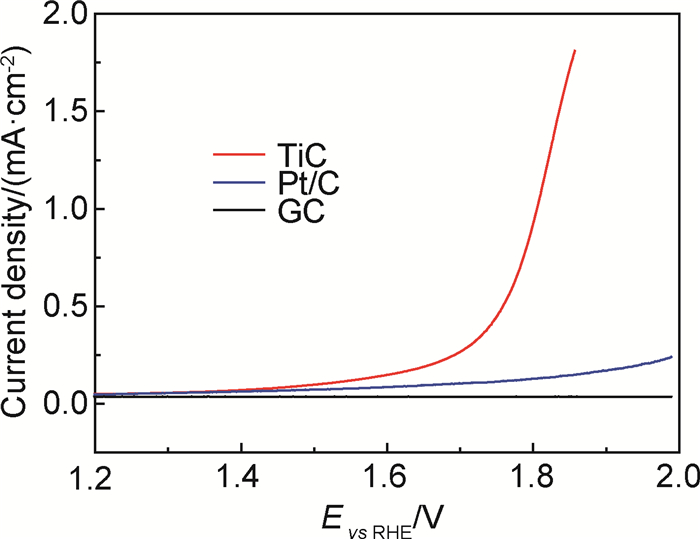
根据K-L方程计算得出,TiC催化剂在电势为0.35~0.50V时氧分子的电子转移数在2.8~3.1之间,如图 4所示,说明TiC的ORR过程是以二电子和四电子混合反应进行的。图 5是玻碳(GC)、商业Pt/C和TiC催化剂在转速为2025r/min时的OER极化曲线,以此来分析TiC的OER催化活性。由图 5可知,TiC的OER响应电流密度明显高于Pt/C和GC,且增加速率最快,说明TiC本身具有更强的OER催化活性。
|
图 5 玻碳(GC)、Pt/C和TiC催化剂的OER极化曲线 Fig. 5 OER polarization curves of glassy carbon(GC), Pt/C and TiC catalyst |
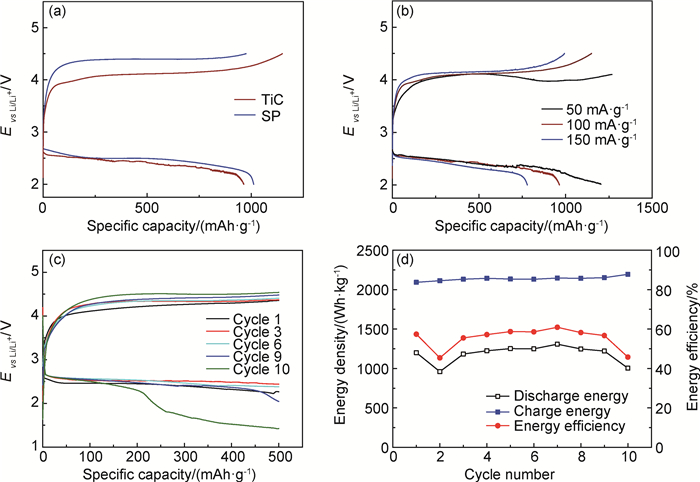
图 6(a)分别是SP、TiC纳米颗粒电极在电流密度为100mA·g-1下的首次充放电曲线图。如图所示,放电时,二者的放电平台和放电比容量都很接近,都取得了约1000mAh·g-1的比容量,说明二者都具有良好的ORR催化活性。而在充电过程中,TiC电极的充电电压比SP电极降低约280mV,说明TiC纳米颗粒具有更强的OER催化活性。这对于锂空电池电化学性能的提升至关重要:降低充电过电势可以减缓过高电压造成的电解液、正极材料的分解问题,进而改善锂空电池的循环效率和循环寿命[22-25]。TiC和SP电极电化学性能的对比表明,TiC纳米颗粒的加入促进了OER过程,进而降低锂空电池充电过电势。
|
图 6 TiC纳米颗粒电极的电化学性能表征 (a)SP电极与TiC电极的首次充放电曲线;(b)TiC电极首次充放电曲线图;(c)TiC电极的循环曲线图;(d)TiC电极的能量效率图 Fig. 6 Electrochemical performance obtained with TiC nanoparticles electrodes (a)discharge-charge curves obtained with SP and TiC nanoparticles electrodes; (b)discharge-recharge curves of TiC nanoparticles electrodes; (c)cycle curves of the TiC electrode; (d)energy efficiency of the TiC electrode |
图 6(b)是TiC电极在电流密度为50, 100,150mA·g-1下的首次充放电曲线。电流密度为50mA·g-1时,锂空电池放电比容量达到1267mAh·g-1;当增大充放电电流密度时,锂空电池的充放电平台基本不变,即使将电流密度扩大3倍至150mA·g-1,也取得了778mAh·g-1的比容量,体现了TiC纳米颗粒作为催化剂时锂空电池优良的倍率性能。
采用定容充放电的方式研究TiC电极的循环稳定性,这是目前对锂空电池研究中广泛使用的一种方法[26-28]。图 6(c)是TiC电极在电流密度为100mA·g-1、比容量为500mAh·g-1时的循环曲线图。如图所示,循环过程中总的趋势是:随着循环次数的增加,充电过电势持续上升,说明电池性能不断衰减。TiC电极经过10次循环之后,电池因极化严重充放电终止。锂空电池循环终止的主要原因可能为:(1)锂空电池经过多次充放电循环后,电解液、正极炭材料的分解加剧,产生副产物(Li2CO3,HCO2Li, CH3CO2Li等),导致锂空电池极化严重[29-31];(2)充放电循环过程中,负极锂金属始终处于富氧环境中,锂金属的自氧化也会使电池循环寿命衰减[32-33]。图 6(d)是6(c)对应的能量效率变化图。如图所示,TiC电极的能量效率基本保持在60%左右,其中,第2次循环效率为45%,它可能是由测试环境的波动引起;而第10次循环效率的明显降低是TiC电极发生极化所导致,与图 6(c)中的结果一致。
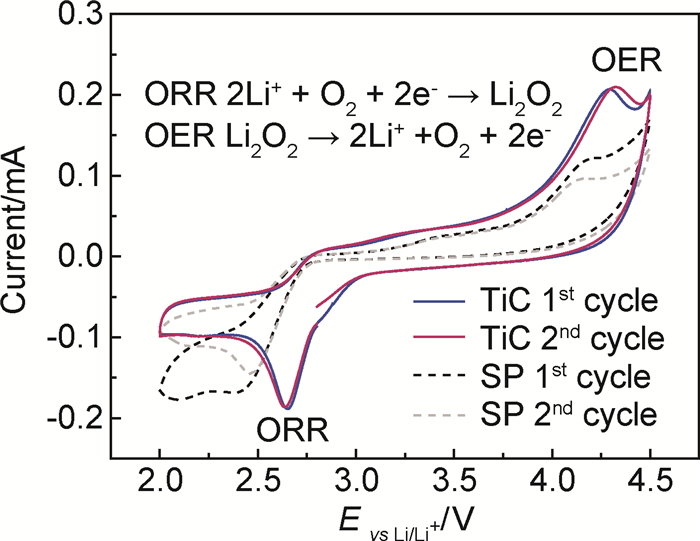
2.4 TiC纳米颗粒催化机理研究图 7分别是TiC电极与SP电极在0.5mV·s-1下的循环伏安(CV)曲线,扫描范围为2.0~4.5V。对于TiC电极,首次负向扫描时,在大约2.65V处出现很强的还原峰,该峰位对应氧还原反应(ORR):2Li++O2 + 2e-→Li2O2,说明TiC纳米粒子具有优良的氧还原催化性能;当正向扫描时,在约4.25 V处出现明显的氧化峰,该峰位对应氧析出反应(OER):Li2O2→2Li++O2+2e-,说明TiC纳米粒子同时兼具优良的氧析出催化性能。第二次扫描时,CV曲线基本未发生变化,表明TiC纳米颗粒作为锂空电池催化剂时,Li2O2的生成与分解反应具有良好的可逆性[7],能有效避免大量反应副产物积累的问题。而SP电极的氧化峰明显比TiC弱,这与SP本身较弱的OER催化活性相一致;并且在第二次扫描时,SP电极的氧化峰和还原峰均明显减弱,说明SP催化活性已经开始下降。
|
图 7 TiC电极的循环伏安曲线图 Fig. 7 Cyclic voltammogram of TiC nanoparticles electrode |
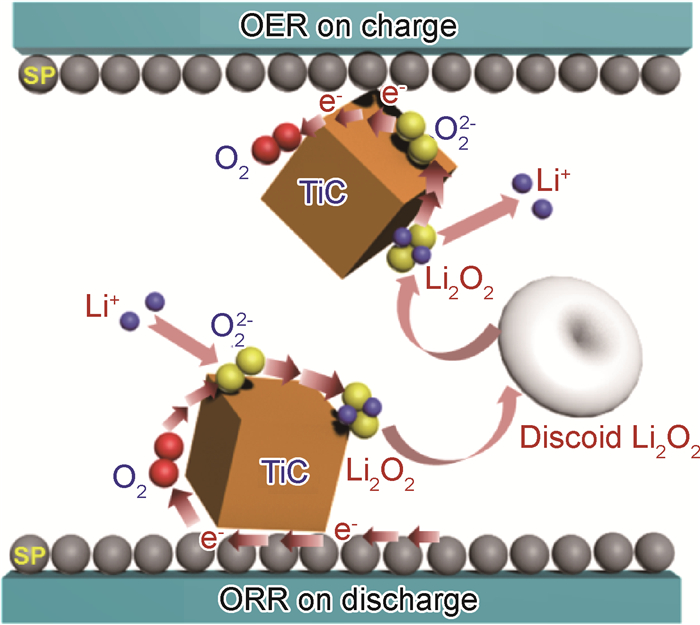
图 8是TiC纳米颗粒在锂空电池中的催化机理。如图所示,放电对应氧还原反应(ORR),是Li2O2的生成过程:氧气首先通过多孔正极通道扩散并吸附在TiC纳米颗粒表面,在TiC纳米粒子ORR催化作用下被还原成O22-;O22-再与Li+结合形成Li2O2,随着放电的进行,Li2O2不断沉积在TiC纳米颗粒表面,直至完全覆盖TiC催化活性位点,放电终止。而充电对应氧析出反应(OER),是Li2O2的分解过程:覆盖在TiC纳米粒子表面的Li2O2在外加电压和TiC OER催化作用下首先分解为Li+和O22-,O22-再进一步被氧化为氧气释放出来,直至放电产物Li2O2完全分解[34-36]。整个充放电过程可用化学式表示如下[19, 37]:

|
|
图 8 TiC纳米颗粒在锂空电池中的催化机理图 Fig. 8 Schematic diagram of the TiC nanoparticles catalyst mechanism in Li-O2 cell |
图 9是不同充放电状态下TiC正极的XRD,FT-IR图。如图 9(a)所示,经首次放电后,在2θ=32.9°,35.0°和64.1°处出现Li2O2标准峰(PDF No.09-0355),没有探测到其余反应副产物。而再充电之后,正极片上Li2O2的这些特征峰完全消失,与初始电极片基本相同,说明Li2O2已经完全分解。这一结果说明以TiC纳米颗粒作正极催化剂时,锂空电池的充放电过程具有优良的可逆性。同时也证明了图 8中所提出的TiC纳米颗粒的催化机理。
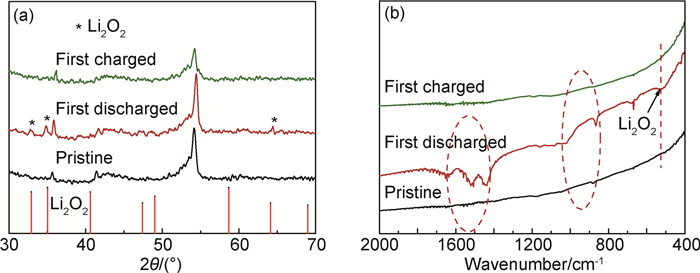
|
图 9 TiC电极在初始、首次放电和首次充电状态下的物理表征 (a)XRD图; (b)FT-IR图 Fig. 9 Physical characterization of TiC electrodes at the pristine, first discharged, and first charged states (a)XRD patterns; (b)FT-IR spectra |
FT-IR图进一步证实了TiC正极在充放电过程中的变化。由图 9(b)可知,放电后,在约550cm-1的位置处出现Li2O2的特征峰,充电后该峰完全消失。另外,放电后,在大约900,1550cm-1处出现的峰可能是HCO2Li, CH3CO2Li, Li2CO3这些放电副产物引起的,主要原因是电解液的部分分解导致,这说明广泛使用的电解液LiTFSI/TEDGME并不是完全稳定的[38-39]。但是,经充电后,HCO2Li, CH3CO2Li, Li2CO3这些物质的特征峰也完全消失,说明这些副产物在充电过程中也是可以分解的[5, 40]。
为了更加直观地认识TiC正极在充放电过程中的变化,采用场发射扫描电子显微镜(SEM)对TiC正极片的形貌进行分析。图 10(a)是TiC正极片的原始形貌,可以观察到TiC纳米颗粒和导电剂Super P、黏结剂PVDF均匀混合在一起。图 10(b)是放电之后TiC正极片的形貌,TiC电极表面出现放电产物Li2O2,该放电产物Li2O2呈尺寸大约为800nm的圆片状结构。图 10(c)对应的是再充电之后TiC正极的形貌,可以看出片状Li2O2完全消失,正极片基本恢复到原始状态。以TiC纳米颗粒作锂空电池催化剂时,Li2O2的生成与分解反应具有很好的可逆性,有效避免了大量反应副产物积累的问题。

|
图 10 TiC正极在不同状态下的SEM照片 (a)初始状态; (b)首次放电; (c)首次充电 Fig. 10 SEM images of TiC nanoparticles cathodes (a)pristine; (b)first discharged; (c)first charged |
(1) 采用直流电弧等离子体法,在CH4和Ar气氛下合成TiC纳米颗粒,颗粒呈粒径约40~90nm的立方体结构。TiC纳米颗粒兼具高效的氧还原和氧析出双效催化活性,可有效弥补炭材料氧析出催化活性较弱的缺陷。
(2) 相对于普通炭材料(导电炭黑,Super-P),TiC纳米颗粒催化剂可将锂空电池充电过电势降低280mV,并具有良好的倍率性能:在电流密度为50mA·g-1时,首次放电比容量达1267mAh·g-1;将电流密度扩大3倍,比容量仍保持在778mAh·g-1。在电流密度为100mA·g-1、限定比容量为500mAh·g-1下,锂空电池稳定循环10次。
(3) 在TiC纳米颗粒的双效催化作用下,Li2O2的生成与分解具有良好的可逆性,有效避免了大量反应副产物积累的问题,进而提高锂空电池的电化学性能。
| [1] |
袁琦, 邹正光, 万振东, 等. 锂离子电池正极材料铁掺杂V6O13的制备及电化学性能[J].
材料工程, 2018, 46 (1): 106–113.
YUAN Q, ZOU Z G, WAN Z D, et al. Synthesis and electrochemical properties of Fe-doped V6O13 as cathode material for lithium-ion battery[J]. Journal of Materials and Engineering, 2018, 46 (1): 106–113. |
| [2] | BRUCE P G, FREUNBERGER S A, HARDWICK L J, et al. Li-O2 and Li-S batteries with high energy storage[J]. Nature Materials, 2012, 11 (1): 19–29. |
| [3] |
吴爱明, 夏国锋, 沈水云, 等. 非水体系锂-空气电池研究进展[J].
物理化学学报, 2016, 32 (8): 1866–1879.
WU A M, XIA G F, SHEN S Y, et al. Recent progress in non-aqueous lithium-air batteries[J]. Acta Physico-Chimica Sinica, 2016, 32 (8): 1866–1879. |
| [4] | LEE J, TAI KIM S, CAO R, et al. Metal-air batteries:Metal-air batteries with high energy density:Li-air versus Zn-air[J]. Advanced Energy Materials, 2011, 1 (1): 34–50. DOI: 10.1002/aenm.201000010 |
| [5] | GUO Z, ZHOU D, LIU H, et al. Synthesis of ruthenium oxide coated ordered mesoporous carbon nanofiber arrays as a catalyst for lithium oxygen battery[J]. Journal of Power Sources, 2015, 276 : 181–188. DOI: 10.1016/j.jpowsour.2014.11.145 |
| [6] | KIM B G, KIM H J, BACK S, et al. Improved reversibility in lithium-oxygen battery:understanding elementary reactions and surface charge engineering of metal alloy catalyst[J]. Scientific Reports, 2014, 4 : 4225. |
| [7] | SUN B, MUNROE P, WANG G. Ruthenium nanocrystals as cathode catalysts for lithium-oxygen batteries with a superior performance[J]. Scientific Reports, 2013, 3 : 2247. DOI: 10.1038/srep02247 |
| [8] | CHEN M, JIANG X, YANG H, et al. Performance improvement of air electrode for Li/air batteries by hydrophobicity adjustment[J]. Journal of Materials Chemistry A, 2015, 3 (22): 11874–11879. DOI: 10.1039/C5TA01601K |
| [9] |
李鹏, 孙彦平. 非水系二次锂-氧电池正极[J].
化学进展, 2012, 24 (12): 2457–2471.
LI P, SUN Y P. Positive electrodes of non-aqueous rechargeable lithium-oxygen batteries[J]. Progress in Chemistry, 2012, 24 (12): 2457–2471. |
| [10] | LI Q, CAO R, CHO J, et al. Nanostructured carbon-based cathode catalysts for nonaqueous lithium-oxygen batteries[J]. Physical Chemistry Chemical Physics, 2014, 16 (27): 13568–13582. DOI: 10.1039/C4CP00225C |
| [11] | GUO Z, ZHOU D, DONG X, et al. Ordered hierarchical mesoporous/macroporous carbon:a high-performance catalyst for rechargeable Li-O2 batteries[J]. Advanced Materials, 2013, 25 (39): 5668–5672. DOI: 10.1002/adma.201302459 |
| [12] | DÉBART A, BAO J, ARMSTRONG G, et al. An O2 cathode for rechargeable lithium batteries:the effect of a catalyst[J]. Journal of Power Sources, 2007, 174 (2): 1177–1182. |
| [13] | THOTIYL M, FREUNBERGER S A, PENG Z, et al. A stable cathode for the aprotic Li-O2 battery[J]. Nature Materials, 2013, 12 (11): 1050–1056. DOI: 10.1038/nmat3737 |
| [14] | KIM J, LEE J, TAK Y. Relationship between carbon corrosion and positive electrode potential in a proton-exchange membrane fuel cell during start/stop operation[J]. Journal of Power Sources, 2009, 192 (2): 674–678. DOI: 10.1016/j.jpowsour.2009.03.039 |
| [15] | PENG Z, FREUNBERGER S A, CHEN Y, et al. A reversible and higher-rate Li-O2battery[J]. Science, 2012, 337 (6094): 563–566. DOI: 10.1126/science.1223985 |
| [16] | PARK I, KIM T, PARK H, et al. Preparation and electrochemical properties of Pt-Ru/Mn3O4/C bifunctional catalysts for lithium-air secondary battery[J]. Journal of Nanoscience & Nanotechnology, 2016, 16 (10): 10453–10458. |
| [17] | KONINCK M D, MARSAN B. MnxCuxCoO used as bifunctional electrocatalyst in alkaline medium[J]. Electrochimica Acta, 2008, 53 (23): 7012–7021. DOI: 10.1016/j.electacta.2008.02.002 |
| [18] | LI C, HAN X, CHENG F, et al. Phase and composition controllable synthesis of cobalt manganese spinel nanoparticles towards efficient oxygen electrocatalysis[J]. Nature Communications, 2015, 6 : 7345. DOI: 10.1038/ncomms8345 |
| [19] | QIU F, HE P, JIANG J, et al. Ordered mesoporous TiC-C composites as cathode materials for Li-O2 batteries[J]. Chemical Communications, 2016, 52 (13): 2713–2716. DOI: 10.1039/C5CC09034B |
| [20] |
甘小荣, 薛方红, 黄昊, 等. SiC/C纳米复合材料的制备与性能表征[J].
材料工程, 2014 (2): 75–80.
GAN X R, XUE F H, HUANG H, et al. Preparation and characterization of SiC/C nano-composites[J]. Journal of Materials Engineering, 2014 (2): 75–80. DOI: 10.3969/j.issn.1001-4381.2014.02.015 |
| [21] |
周远良, 赛义德, 张黎, 等. 树脂基Fe纳米粒子及碳纤维复合吸波平板的制备与性能[J].
材料工程, 2018, 46 (3): 41–47.
ZHOU Y L, SHAH S, ZHANG L, et al. Preparation and performance of resin-based Fe nanoparticals/carbon fibers microwave absorbing composite plates[J]. Journal of Materials Engineering, 2018, 46 (3): 41–47. |
| [22] | XU J, XU D, WANG Z, et al. Synthesis of perovskite-based porous La0.25MnO3 nanotubes as a highly efficient electrocatalyst for rechargeable lithium-oxygen batteries[J]. Angewandte Chemie, 2013, 52 (14): 3887–3890. DOI: 10.1002/anie.v52.14 |
| [23] | CHEN J, HUMMELSHØJ J S, THYGESEN K S, et al. The role of transition metal interfaces on the electronic transport in lithium-air batteries[J]. Catalysis Today, 2011, 165 (1): 2–9. |
| [24] | ZHANG T, IMANISHI N, SHIMONISHI Y, et al. A novel high energy density rechargeable lithium/air battery[J]. Chemical Communications, 2010, 46 (10): 1661–1663. DOI: 10.1039/b920012f |
| [25] | KALUBARME R S, JADHAV H S, NGO D T, et al. Simple synthesis of highly catalytic carbon-free MnCo2O4@Ni as an oxygen electrode for rechargeable Li-O2 batteries with long-term stability[J]. Scientific Reports, 2015, 5 : 13266. DOI: 10.1038/srep13266 |
| [26] | PENG S, HU Y, LI L, et al. Controlled synthesis of porous spinel cobaltite core-shell microspheres as high-performance catalysts for rechargeable Li-O2 batteries[J]. Nano Energy, 2015, 13 : 718–726. DOI: 10.1016/j.nanoen.2015.03.021 |
| [27] | WANG C, ZHAO Y, LIU J, et al. Highly hierarchical porous structures constructed from NiO nanosheets act as Li ion and O2 pathways in long cycle life, rechargeable Li-O2 batteries[J]. Chemical Communications, 2016, 52 (79): 11772–11774. DOI: 10.1039/C6CC05349A |
| [28] | DONG S, CHEN X, ZHANG K, et al. Molybdenum nitride based hybrid cathode for rechargeable lithium-O2 batteries[J]. Chemical Communications, 2011, 47 (40): 11291–11293. DOI: 10.1039/c1cc14427h |
| [29] | McCLOSKEY B D, BETHUNE D S, SHELBY R M, et al. Solvents' critical role in nonaqueous lithium-oxygen battery electrochemistry[J]. Journal of Physical Chemistry Letters, 2011, 2 (10): 1161–1166. DOI: 10.1021/jz200352v |
| [30] | McCLOSKEY B D, VALERY A, LUNTZ A C, et al. Combining accurate O2 and Li2O2 assays to separate discharge and charge stability limitations in nonaqueous Li-O2 batteries[J]. Journal of Physical Chemistry Letters, 2013, 4 (17): 2989–2993. DOI: 10.1021/jz401659f |
| [31] | THOTIYL M M O, FREUNBERGER S A, PENG Z, et al. The carbon electrode in nonaqueous Li-O2 cells[J]. Journal of the American Chemical Society, 2016, 135 (1): 494–500. |
| [32] | SHUI J L, OKASINSKI J S, KENESEI P, et al. Reversibility of anodic lithium in rechargeable lithium-oxygen batteries[J]. Nature Communications, 2013, 4 (4): 2255. |
| [33] | ASSARY R S, LU J, DU P, et al. The effect of oxygen crossover on the anode of a Li-O2 battery using an ether-solvent:insights from experimental and computational studies[J]. Chemsuschem, 2013, 6 (1): 51–55. DOI: 10.1002/cssc.201200810 |
| [34] | SU D, DOU S, WANG G. Gold nanocrystals with variable index facets as highly effective cathode catalysts for lithium-oxygen batteries[J]. NPG Asia Materials, 2015, 7 (1): e155. DOI: 10.1038/am.2014.130 |
| [35] | CAO R, LEE J, LIU M, et al. Non-precious catalysts:recent progress in non-precious catalysts for metal-air batteries[J]. Advanced Energy Materials, 2012, 2 (7): 816–829. DOI: 10.1002/aenm.201200013 |
| [36] | LEE C K, PARK Y J. Polyimide-wrapped carbon nanotube electrodes for long cycle Li-air batteries[J]. Chemical Communications, 2015, 51 (7): 1210–1213. DOI: 10.1039/C4CC08542F |
| [37] | ZHANG S S, FOSTER D, READ J. Discharge characteristic of a non-aqueous electrolyte Li/O2 battery[J]. Journal of Power Sources, 2010, 195 (4): 1235–1240. DOI: 10.1016/j.jpowsour.2009.08.088 |
| [38] | BALAISH M, KRAYTSBERG A, EIN-ELI Y. A critical review on lithium-air battery electrolytes[J]. Physical Chemistry Chemical Physics, 2014, 16 (7): 2801–2822. DOI: 10.1039/c3cp54165g |
| [39] | CHEN Y, FREUNBERGER S A, PENG Z, et al. Charging a Li-O2 battery using a redox mediator[J]. Nature Chemistry, 2013, 5 (6): 489–494. DOI: 10.1038/nchem.1646 |
| [40] | ZHANG T, ZHOU H. A reversible long-life lithium-air battery in ambient air[J]. Nature Communications, 2013, 4 (5): 1817. |
 2019, Vol. 47
2019, Vol. 47



