文章信息
- 李莹莹, 王昉, 刘其春, 张东敏, 张雪, 马青玉, 顾正桂
- LI Ying-ying, WANG Fang, LIU Qi-chun, ZHANG Dong-min, ZHANG Xue, MA Qing-yu, GU Zheng-gui
- 丝素蛋白及其复合材料的研究进展
- Research Progress in Silk Fibroin and Its Composite Materials
- 材料工程, 2018, 46(8): 14-26
- Journal of Materials Engineering, 2018, 46(8): 14-26.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2017.001242
-
文章历史
- 收稿日期: 2017-09-30
- 修订日期: 2018-03-05
2. 南京师范大学 化学与材料科学学院, 南京 210023;
3. 南京师范大学 物理科学与技术学院, 南京 210023
2. School of Chemistry and Materials Science, Nanjing Normal University, Nanjing 210023, China;
3. School of Physics and Technology, Nanjing Normal University, Nanjing 210023, China
蚕丝是目前世界上产量最大的天然纤维之一,广泛用于服装纺织领域。其以质地柔软、透气性良好、悬垂感优良、穿着舒适等特点备受人们的青睐,素有“纤维皇后”之称。丝素蛋白是蚕丝的主要成分,在蚕丝中含量较高,容易分离提纯,具有许多独特的物理、化学性质和优良的生物相容性[1-3]。丝素蛋白来源广泛,制备方法简单,可以再生和加工成薄膜、海绵、水凝胶和微球等形态,适用于不同的应用场合。为了拓展丝素蛋白材料的功能,人们对其进行了探索和研究。其中,有对蚕丝蛋白中的官能团进行的改性研究,以及将其与其他材料进行复合,制备出不同用途的丝素蛋白复合材料[4-7]。近年来,开发新型组织工程材料,用人造组织替代损坏的组织,进行组织修复成为研究的热点[8-10]。同时,有研究者指出,丝素蛋白材料在吸附和催化方面也具有较好的发展潜力[11-13]。本文结合目前国内外学者的研究现状,对丝素蛋白的结构、性能及其复合材料的制备方法、应用前景进行了介绍和展望。
1 丝素蛋白材料的研究进展 1.1 丝素蛋白的结构丝素蛋白主要由甘氨酸、丙氨酸、丝氨酸等18种氨基酸组成,由重链约390kDa(千道尔顿)、轻链约26kDa及糖蛋白链约28kDa三部分组成,其摩尔比为6: 6: 1。丝素蛋白的基本结构由紧密整齐的结晶区和松散无序的非结晶区组成,其中结晶区主要为甘氨酸、丙氨酸和丝氨酸的残基,非结晶区主要由苯丙氨酸、酪氨酸、色氨酸等其他氨基酸残基组成[14]。
蚕丝素蛋白的分子构象可分为2类,即Silk Ⅰ型和Silk Ⅱ型:SilkⅠ型分子链由α-螺旋和β-平行折叠构象交替堆积而成,其晶胞属于正交晶系;SilkⅡ型是反平行β折叠(β-sheet)的层状结构。在温度和溶剂影响下SilkⅠ型易向SilkⅡ型转变[15]。Valluzzi等[16]发现了存在于蚕丝素溶液-空气界面上的一种新的蚕丝素结晶形态,称之为Silk Ⅲ型,其晶体结构与聚甘氨酸Ⅱ相似,属六方晶系,肽链的立体构象为β-折叠螺旋。丝素蛋白的氨基酸排列顺序决定了分子结构,从而决定其力学性能和理化特性。
1.2 丝素蛋白的制备丝素蛋白从来源上分为天然丝素和再生丝素。直接从家蚕的后部丝腺得到的是天然的丝素,不含丝胶蛋白,呈白色半透明状。利用化学的方法将丝胶和丝素分离,并去除其他物质后得到的就是再生丝素。最早的丝素溶解研究始于20世纪30年代,使用较早的溶剂体系有无机酸,这类溶剂虽然可以溶解丝素,但对丝素破坏严重,将部分丝素分子降解为小分子肽链,形成的再生丝素蛋白材料几乎没有力学性能。Furuhata等[17]研究了丝素在卤化锂/有机氨溶剂体系中的溶解条件。于海洋等[18]指出,在氯化钙溶液中丝素蛋白会与钙离子形成配合物,使丝素蛋白体积膨胀,水分子逐渐进入膨胀后的空间,膨胀到一定程度后丝素蛋白的化学键断裂,形成可溶性的丝素蛋白溶液。这类高浓度的中性盐溶液在加热条件下可以溶解丝素,而且溶解能力和溶解效果都较好。还有用CaCl2-C2H5OH-H2O三元溶液[19]和溴化锂水溶液[20]来溶解蚕丝,这两种溶解方式对丝素大分子的破坏作用都相对较小。
1.3 丝素蛋白材料的性能研究 1.3.1 丝素蛋白的力学性能天然蚕丝纤维的初始模量为5~12GPa,断裂强度为500MPa,断裂伸长率为19%;脱胶蚕丝纤维的初始模量为15~17GPa,断裂强度为610~690MPa,断裂伸长率为4%~16%。与天然丝素纤维相比,再生丝素材料力学性能有所下降,主要原因是因为,在溶解天然丝素纤维的过程中,高浓度的中性盐溶液破坏了丝素蛋白分子原有的部分结构。所以,改善再生丝素材料力学性能已成为丝素蛋白生物材料领域的重要研究课题。如将一些高分子物质,如聚乙二醇[21]、聚己内酯[22]、聚乙烯醇[23]等,与丝素蛋白进行共混,从而达到改善丝素材料力学性能的效果。此外,向再生丝素蛋白材料中添加微/纳米级别的物质,同样可以制备得到力学性能增强的丝素材料。除了制备材料和方法的影响,丝素蛋白分子还受到外界物理(温度、射线等)或化学因素(酸、碱、氧化剂等)的影响,会产生物理、化学性质的变化。温度、射线等会使蚕丝变黄、力学性能下降;酸、碱会促使蚕丝发生水解;氧化剂会氧化氨基酸侧链[24]。另外,其复合材料的力学性能不仅取决于个体的特性组件,还取决于界面之间构成材料的兼容性[25]。
1.3.2 丝素蛋白的乳化活性蚕丝的核心是丝素蛋白,它具有交替亲水性和疏水性,并沿分子链有着高度重复的氨基酸序列。丝素蛋白同时具有亲水区和分子折叠成二级或更高级结构时所形成的不同的疏水区,所以丝素蛋白本身具有两亲性和表面活性,在水介质和油相的界面富集并最终形成稳定的黏弹性膜,可防止液滴聚结,有利于形成稳定的乳液[26],因此,丝素蛋白可以作为新型乳液稳定剂,应用于载药系统和化妆品领域。对于乳液稳定性的影响因素,除了温度、pH值和离子强度外,蛋白质浓度、油相体积分数和油相类型(极性)也同样对乳液的物理和化学性质以及黏弹性能有较大的影响[27]。
1.3.3 丝素蛋白的生物相容性生物相容性是指材料与人体之间相互作用而产生的各种复杂的生物、物理和化学反应。植入人体的生物材料必须无毒、无致敏性,对组织、血液和免疫等系统不能产生不良反应。丝素蛋白是蚕绢丝腺内壁上内皮细胞分泌、合成的天然高纯度蛋白质,其最终降解产物可被机体吸收,并且它的分子质量大小也可通过改造丝蛋白的成分来进行调节,从而达到适应不同生物体内环境的要求,因此具有很好的生物相容性[2]。
1.3.4 丝素蛋白的生物降解性丝素蛋白纤维的抗拉强度较高,高度的规整性和大量SilkⅡ结构使其在不加处理的情况下就可以植入生物体,并能完全降解,一般降解时间为6~12周[3]。Takayuki等[28]研究发现,丝素蛋白分子中存在蛋白酶特异性结合位点而容易被水解,但是水解程度取决于蛋白质基体的形态与结构。朱正华等[29]在再生丝素蛋白纤维制备过程中,添加不同浓度的氯化钙,可以控制其在生物体内的降解速率,结果表明,当添加的氯化钙质量分数为11%时,再生丝素蛋白纤维中的钙离子浓度接近天然丝素蛋白中谷氨酸和天冬氨酸的浓度,丝素蛋白纤维的机械强度下降90%,而降解速率明显加快。
2 丝素蛋白复合材料的研究进展 2.1 丝素蛋白复合材料的制备机理丝素是一种包含超过5000个氨基酸的高分子蛋白质,其侧链含有氨基、羟基、羧基等基团,如丝氨酸侧链的羟基,酪氨酸侧链的酚羟基、精氨酸侧链的胍基等。丝素与其他材料的复合一般是通过化学反应改变其某些侧基,或通过与侧基的反应引入其他功能基团,如磺酸基、磷酸基和环氧基等。常用的改性方法有接枝共聚改性、交联改性和互穿网络改性。
2.1.1 接枝共聚改性丝素蛋白的接枝共聚改性就是利用丝素分子中所具有的—OH、—NH2和—COOH等反应性基团与活泼单体发生接枝聚合反应以达到改性目的。接枝共聚是一种有效的化学修饰方法,在不破坏丝蛋白主链、保持其原有特性的同时有效地改善丝素的结构和性能。刘琼等[4]将活化的聚乙二醇酰化物通过化学反应直接接枝到酶解后的丝素蛋白粉末上,研究了接枝化合物的抗菌性以及细胞毒性。实验结果表明,其对大肠杆菌和金黄色葡萄球菌具有一定的抑菌效果,且对细胞无毒性作用。许云辉等[5]采用HNO3/H3PO4-NaNO2体系选择性地将氧化棉织物引入活性羧基,然后与丝素蛋白反应接枝形成酰胺化学键。研究了HNO3/H3PO4-NaNO2氧化时间对氧化棉织物羧基含量、断裂强力的影响,分析了氧化时间、丝素质量分数和处理时间对氧化棉织物接枝率的影响。结果表明,丝素改性棉织物的机械强度和白度稍有降低,而折皱回复性和吸湿性明显提高;丝素改性棉织物承载和缓释的金银花提取物为原棉织物的3.45倍,金银花处理的丝素改性棉织物经30次水洗后仍有较高的抑菌活性。Dhyani等[6]通过等离子体处理技术将聚丙烯酸接枝到丝素膜表面,从而增加了丝素的羧基,调控了丝素蛋白的亲水性。研究显示,与未改性丝素蛋白相比,细胞在表面接枝聚丙烯酸丝素上的黏附性增强。
2.1.2 交联改性交联剂与丝素之间的相互作用会引起丝素分子之间的相互作用,从而赋予材料不同的结构特征,使得人们可以在更大的范围内调节材料的性能,以满足组织工程上的应用需求。常用的化学交联剂有碳化二亚胺、二缩水甘油醚和京尼平等。杨华等[7]以环氧氯丙烷和聚乙二醇400为原料,合成聚乙二醇缩水甘油醚(Poly(Ethylene Glycol diglycidyl ether), PEGO),利用PEGO与丝氨酸的羟基、谷氨酸的羧基、赖氨酸的氨基以及胱氨酸的巯基的反应对丝素蛋白进行交联改性。实验结果表明,PEGO的添加改变了膜的结构,会引起其结晶性、热稳定性、亲水程度和力学性质的改变。改性膜具有更好的热稳定性和良好的力学性能,可应用于生物医学和日用化工领域。
2.1.3 互穿网络改性基于共价连接的磺酸基团可增强丝素膜的亲水性。马晓晔等[30]通过自由基聚合的方法,合成制备了自膨胀聚丙烯酸钠-SF半互穿网络水凝胶,进一步探讨了该水凝胶作为微创治疗中组织植入物的潜能。实验结果显示,随着水凝胶中SF含量的增加,膨胀率增大,压缩强度减小,药物释放速度加快。该自膨胀水凝胶具有高膨胀率和良好的药物释放能力,可以进行药物输送或植入其他材料。Romero等[31]提出一种制备互穿SF-聚吡咯导电网络的方法。带负电的亲水性磺酸基团共价结合到SF上,可以选择性促进吡咯的吸收,并在改性薄膜内聚合,增强了丝素表面的亲水性;其中两种带电聚合物之间的静电引力驱动聚吡咯在聚合过程中完全穿插到丝素内部,从而形成坚固的不可分层的复合材料。此方法为生产力学性能良好、电化学性能稳定的聚合物电极提供了新思路。
2.2 丝素蛋白复合材料的制备方法 2.2.1 干法纺丝法蚕在常温、常压下能以水为溶剂,在空气中吐丝形成高强度和高韧性的蚕丝纤维,而且纤维的综合性能优于普通合纤。因此,最早是采用干法纺丝技术来进行人工模拟生物纺丝。Yue等[32]用氯化钙/甲酸为溶剂溶解丝素,采用干法纺丝技术制备再生丝素蛋白纤维。该溶解过程简单、高效,且获得具有纳米原纤结构的纺丝原液。由于纺丝液中纳米原纤的保留,制得的再生丝素蛋白纤维的力学性能有明显提高,且更易于牵伸;当丝素溶液质量分数增加至25%时,再生丝素蛋白纤维的断裂强度可达230MPa,后牵伸可进一步改善纤维的断裂强度和断裂伸长率,纤维的韧性增强。
2.2.2 冷冻干燥法冷冻干燥法的原理是将聚合物(丝素蛋白或其复合物)制成溶液或凝胶状,放入真空冷冻干燥机中进行冷冻,预冻溶液发生汽化进而与聚合物分离,溶液中的冰晶升华,在原有位置产生孔洞,最终得到孔隙率较高的聚合物。该方法目前应用较多,可以通过时间、温度和浓度来控制支架材料的孔的尺寸和形状。Wang等[33]将Ca(NO3)2·4H2O和(NH4)2-H2O与丝素蛋白共混制得的溶液进行冷冻干燥。研究证明,二者共混物的生物相容性及在新骨形成方面的能力优于单一的丝素蛋白或胶原蛋白。Zhu等[34]将去离子水、十六烷基三甲基溴化铵、硅酸乙酯和氢氧化钙水溶液混合,经过高压、升温、保温和冷却至室温,再煅烧、保温和冷却后得到硅酸钙纳米晶须,然后按一定质量分数溶于丝素蛋白溶液中配成共混膜,研究结果显示,丝素蛋白/硅酸钙共混膜具有更高的比表面积和孔体积,骨肉瘤细胞能很好附着和增殖在此共混膜上,表明该复合膜具有良好的理化性能和生物学性能,在骨组织工程三维支架方面有很大的应用潜力。
2.2.3 静电纺丝法静电纺丝是一种简单、快速而高效的纳米/亚微米纤维制备技术[35]。在纺丝过程中,带电的聚合物液滴在电场力的作用下,在注射器或者毛细管的顶点被加速,当电场力足够大时,聚合物液滴克服表面张力形成喷射细流,接着转变为卷曲的螺旋纤维,在电场力作用下拉伸变细,分裂成微米级至纳米级的纤维。整个电纺过程中因溶剂挥发、纤维固化落在接收装置上形成类似非织造布状纤维毡。静电纺丝得到的无纺布具有孔隙率高、比表面积大和均一性强等优点,使得其能够在生物材料、过滤材料和传感器材料等方面具有很好的应用前景。崔新爱等[36]以六氟异丙醇(Hexafluoroisopropanol, HFIP)为溶剂,将胶原和丝素以一定的质量比共混后进行电纺,并经戊二醛蒸汽交联制备出胶原/丝素复合微/纳米纤维。研究显示,复合纤维的β化程度、结晶度和热稳定性均有一定提高,且随着丝素含量的增加其提高越明显。当丝素含量为70%时,纤维膜的平均断裂强度最高,细胞在材料表面生长状态良好,体现了其优良的生物相容性。Li等[37]将丝素蛋白和聚乳酸-羟基乙酸共聚物(SF/PLA-PLGA)以2: 1的质量比溶解于5%的HFIP中,进行静电纺丝。结果表明,纺丝电压为20kV、挤出率为2mL/h、接收距离为10cm时,纤维的平均直径为593nm;当接收距离为15nm时,纤维的平均直径为334nm。用这种静电纺丝制备得到的SF/PLA-PLGA纳米纤维膜能够模拟细胞外基质,并培养细胞附着,可以对大白鼠周围神经损伤进行有效的修复。和生物体自身组织修复不同的是:通过控制这种膜的规格、降解速率、力学性能和体系结构可以灵活地控制组织的修复效果。
2.2.4 气体发泡法气体发泡法包括化学发泡法和物理发泡法。化学发泡法一般采用碳酸盐类化合物作为发泡剂,即将丝素蛋白溶液和碳酸盐类化合物混合后加入到模具中,待溶剂部分挥发,直接浸入热水中发泡,使气体挥发,最后冷冻干燥得到多孔支架。物理发泡法是指在材料成型过程中,通过材料的挥发组分或分散在材料中的挥发组分使材料产生泡孔的方法。Xu等[38]采用碳酸钠(Na2CO3)气体发泡法制备高强度丝素蛋白/羟基磷灰石支架材料,避免了成型后的多次洗涤。此法制得的支架孔隙率较高且均匀,避免了有机溶剂对丝素蛋白支架活性的影响,但操作较复杂。Nazarov等[39]将冻干的丝素蛋白与HFIP配制成一定浓度的丝素醇溶液,再将其加入到装有碳酸氨(NH4CO3)颗粒的模具中,把支架放入95℃的热水中发泡得到多孔丝素支架。支架孔径为(155±144)μm,均为开孔,孔隙率高达99%,且孔隙间连通性好,支架表面没有留下较厚的表皮层,抗压应力及模量较高,符合骨组织工程要求。
2.2.5 3D打印近年来随着3D打印技术的快速发展,采用3D打印技术制备生物支架成为可能。3D打印技术是指在计算机控制下,根据物体的计算机辅助设计(CAD)模型或计算机断层扫描(CT)等数据,将这些材料数据进行精确3D堆积,快速制造出任意复杂形状的3D物体的一种新型数字化成型技术。3D打印技术可以对孔隙结构进行控制,可制备出气孔率可调、形状复杂、孔隙率较高和力学性能好的材料。孙凯等[40]以丝素、胶原两种材料为打印基质,探讨3D打印软骨组织工程支架的可行性。结果表明,当丝素蛋白与胶原蛋白质量比为4: 2时,支架的理化性能和生物相容性最佳,并且与传统的冷冻干燥法、化学交联方法相比,3D打印成形技术在支架材料的制备过程中,尤其是制备复杂结构和内部可控微结构材料中具有更大的优势;且还具有设计制造一体化,成型过程高度柔性化和快速化的特点。
2.3 各种丝素蛋白复合材料 2.3.1 天然生物蛋白复合材料角蛋白(Keratin)系硬蛋白之一,是一类具有结缔和保护功能的纤维状蛋白质。由于角蛋白含有较多的胱氨酸(14%~15%),故二硫键含量特别多,在蛋白质肽链中起交联作用,因此角蛋白化学性质特别稳定,有较高的机械强度且不易溶解和消化。陈慧[41]通过羊毛纤维与蚕丝下脚料和废弃物中提取出来的羊毛角蛋白(Wool Keratin Silk Fibroin,WKSF)与丝素蛋白复合,不仅保持了羊毛纤维良好的皮肤亲和性与力学性能,还能对废旧羊毛纤维与蚕丝进行循环利用,提高了羊毛纤维与蚕丝的利用率。其制备方法为:将提取好的羊毛角蛋白与丝素蛋白放入9mol/L硫氰酸锂中,配置成不同丝素蛋白质量比的混合溶液,并从每种比例的混合溶液中取出20g倒入直径为50mm的玻璃皿中,将玻璃皿放置在温度为105℃的烘箱中干燥至恒重,即可制备成羊毛角蛋白丝素蛋白膜。表 1列出了其各项性能。随着羊毛角蛋白与丝素蛋白质量比的增加,即随着质量比从1: 9到9: 1,蛋白膜的吸湿回潮率、溶胀率、断裂伸长率皆增加,而断裂强力降低。冯超等[42]将丝素蛋白和人发角蛋白进行有效的混合,并加入不同比例的氯化钙溶液,制备出自产氧型人发角蛋白/丝素蛋白复合材料。他们发现,当过氧化钙浓度为20%时,支架材料的释氧时间最长(P < 0.05),且后期释氧水平较为平稳;含有过氧化钙的复合材料在体外能够更好支持细胞生长,体现出了良好的生物相容性。
|
m(WKSF): m(SF) |
Moisture regain/% |
Swelling rate/% |
Breaking force/N |
Breaking elongation/% |
| 1: 9 | 8.13 | 187.48 | 0.62 | 3.14 |
| 2: 8 | 8.36 | 194.53 | 0.57 | 3.21 |
| 3: 7 | 8.71 | 209.53 | 0.51 | 3.32 |
| 4: 6 | 9.57 | 211.73 | 0.45 | 3.45 |
| 5: 5 | 10.24 | 223.14 | 0.39 | 3.54 |
| 6: 4 | 10.89 | 234.27 | 0.34 | 3.69 |
| 7: 3 | 11.37 | 251.64 | 0.29 | 3.77 |
| 8: 2 | 12.11 | 262.32 | 0.25 | 3.89 |
| 9: 1 | 12.94 | 273.73 | 0.22 | 4.17 |
壳聚糖和纤维素都是自然界中无毒、无污染、可生物降解和生物相容性较好的天然高分子材料。壳聚糖是一种无毒副作用的带正电的碱性天然多糖,是甲壳素脱乙酰的产物。壳聚糖不溶于水和碱溶液,可溶于部分无机酸和大多数有机酸,有抑制细菌活性、促进血液凝固的作用。纤维素是由b-(1→4)-链接的D-葡萄糖组成,含有大量羟基,易形成分子内和分子间氢键,具有一定的力学强度。但都有成膜性差、再生膜脆性大的缺点。胶原蛋白(Collagen,COL)是细胞外基质的结构蛋白质,具有低抗原性、可被人体吸收、体内降解产物无毒副作用等优点,但其力学性能不佳,特别是在水溶液中降解速率太快,从而限制了它的应用。马育栋等[43]将丝素蛋白-壳聚糖混合溶液与1%醋酸溶液共混制备得到复合凝胶材料。实验结果表明,在制备复合凝胶的过程中,混合时体积配比不同,形成凝胶的时间长短和均匀程度不同,凝胶化程度也不同,且此复合凝胶材料具有抑菌止血的功效。柳磊等[44]采用冷冻干燥法制备了丝素蛋白/壳聚糖支架,并通过二次交联(第一次是甲醇/氢氧化钠,第二次是碳化二亚胺/N-羟基琥珀酰亚胺)构建了稳定的且孔隙率较好的三维多孔结构。他们发现,40%丝素蛋白-60%壳聚糖的比例适合成骨细胞生长。郑丽等[45]选用氢氧化钠-尿素-硫脲体系溶解纤维素,并与丝素蛋白共混制得纤维素/丝素蛋白共混膜。结果表明,当m(纤维素): m(丝素蛋白)=4: 1时,丝素蛋白与纤维素的相容性、力学性能、吸湿保湿性能、透湿性能最好,纤维素/丝素蛋白共混膜的综合性能优于纯纤维素膜。李娟等[46]通过共混法制备了纤维素/丝素复合膜,研究结果表明,复合膜的最佳配比为纤维素占共混膜的90%,丝素占10%。XRD分析表明,随着丝素含量的增加,复合膜的结晶度有先增大后减小的趋势。因为混入少量的丝素可以与纤维素之间形成氢键,提高分子间的规整性;但随着丝素的不断加入,过量的丝素之间又会形成氢键结合,降低分子间的规整性。在此条件下形成的复合膜的力学性能、水溶液稳定性和水蒸气透过系数较单一成分的膜有明显改善,纤维素与丝素之间因存在着氢键等强烈的相互作用而使其具有良好的相容性。白莲村等[47]将丝素纤维/胶原蛋白纤维以不同质量配比进行混纺,然后通过针刺非织造工艺制备软半月板组织工程支架材料,研究表明,丝素纤维含量越多越难成网,且纤维的损失率越高。因此,将丝素纤维与表面较粗糙、卷曲度高的胶原纤维在高湿度状态下进行混纺,则可较好成网。随着胶原纤维含量的增加,支架材料的孔径范围有所扩大,支架材料的孔径大于100μm时,其细胞增殖情况良好,有利于支架材料降解,且其生物相容性满足细胞的生长要求。
2.3.2 丝素蛋白/无机复合材料纳米SiO2独特的体积效应和宏观量子隧道效应,使其能与材料的大分子结合成立体网状结构[48]。徐水等[49]以纳米SiO2为基材,乙醇为溶剂,与丝素共混,制备出不同质量比的丝素/纳米SiO2凝胶共混膜。实验结果显示,加入具有补强增韧功能的纳米SiO2制备的丝素共混膜,更接近于优良人工皮肤材料的物理特性,丝素与纳米SiO2的共混质量比以80: 3和80: 5为宜。纳米银具有抗菌能力强、效果持久等优点。Min等[50]用一定量氨水和0.05mol/L的硝酸银溶液配制银氨溶液,再将0.8%的丝素溶液、0.2%的葡萄糖溶液与银氨溶液混合,调节混合溶液pH值为10,80℃水浴搅拌4h可制得丝素纳米银水溶液。用丝素纳米银溶液对棉织物进行浸渍整理,质量浴比为1: 50,在60℃水浴中振荡30min后取出,水洗后自然晾干,得到丝素纳米银棉织物。得到的纳米银棉织物不仅保持了原有棉织物的柔韧性以及舒适感,而且在抗菌、杀菌方面也有着优异的性能。
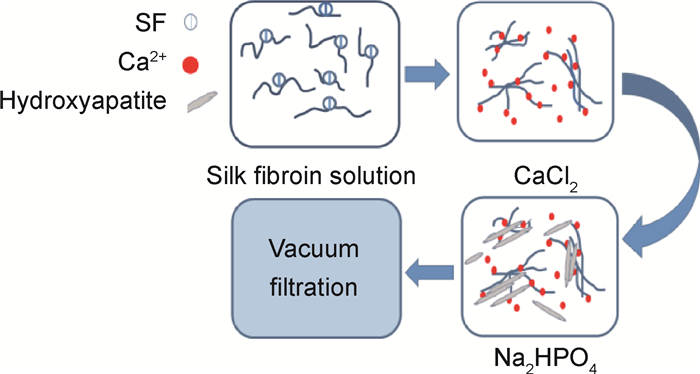
人体骨组织是由有机和无机成分构成的生物矿化组织,无机成分主要是纳米羟基磷灰石结晶,Ⅰ型胶原是天然骨组织中含量最多的有机基质。羟基磷灰石的优点主要包括良好的生物相容性、化学稳定性,以及材料中有孔隙度,有利于骨组织长入,可以为新骨的沉积与再生提供优良的生理支架[51]。丝素蛋白或羟基磷灰石单独作为骨组织工程种植材料时,暴露出如强度较低、韧性较差和力学性能不足等缺点,显著降低了其作为生物支架的潜能。将两者复合后可以利用组合材料的优点来克服单个材料的缺点[52]。宁旭等[53]以丝素蛋白和钙磷溶液为基材,通过共沉淀法合成了丝素纳米纤维/纳米羟基磷灰石复合材料。通过对复合材料进行透射电镜和X射线衍射实验发现,复合材料具有类似于天然骨的结构和性能,与天然骨组织中磷灰石十分类似,但是力学性能还未达到组织工程应用中支架强度的标准。图 1为丝素蛋白和羟基磷灰石复合工艺流程。如图 1所示,Mi等[54]将0.2mol/L氯化钙水溶液与丝素蛋白纳米纤维混合30min,然后加入0.2mol/L的磷酸氢二钠水溶液搅拌,30min后在37℃下获得不同质量比(0.05,0.10,0.15,0.20,0.25,0.40)的丝素蛋白纳米纤维和纳米羟基磷灰石混合溶液,悬浮培养24h后,通过过滤膜的溶液,室温干燥12h后得到复合薄膜(孔径为0.2μm)。实验结果表明,该法下制备的复合薄膜具有良好的机械强度,当施加5000%剪切应变时,储能模量能够在50s内恢复到85%。另外,介孔生物玻璃具有更高、有序的介观尺度,在机体内能激活成骨细胞基因的应用中,更加有利于提高细胞的增殖和分化,具有良好的骨传导和骨诱导作用。李静静等[55]采用冷冻干燥法制备了介孔生物玻璃(M58S)/丝素蛋白复合多孔海绵,其中M是介孔生物玻璃(mesoporous bioactive glasses)的英文首字母代称,S指二氧化硅(SiO2),58是二氧化硅在物质中的含量。他们通过透射电镜和场发射扫描电镜观察发现,该复合多孔海绵主要通过作用于血液的内源性凝血系统途径促进凝血;小鼠肝脏止血模型显示,当M58S含量>15%时,复合多孔海绵的止血效果较好,且优于明胶海绵,可以用作体外快速止血材料。
2.3.3 丝素蛋白/合成聚合物复合材料丝素的湿膜强度小、致密无孔以及支撑性较差等缺点限制了丝素膜的应用范围,而将其与聚合物共混制备多孔膜,是改善丝素不足的有效途径。张静等[56]以饱和硫氰酸钠(NaSCN)水溶液为共溶剂,制备了不同共混比的丝素蛋白/聚丙烯腈(SF/PAN)共混膜,用溶度参数法及红外光谱研究了SF/PAN共混体系的相容性,分析和讨论了铸膜液的共混比、温度和凝固浴组成等对膜结构与性能的影响,并用场发射扫描电镜观察了共混膜的表面和断面微观形貌。结果显示,SF与PAN具有部分相容性,其在成膜过程中会产生界面微孔;随着共混膜中SF含量的增加,共混膜呈孔隙率增大和截留率减小的变化趋势;随着铸膜液温度的升高,共混膜呈孔隙率和水通量增大的变化趋势;当凝固浴组分为50%乙醇水溶液时,所得共混膜孔结构较为疏松;SF的添加使PAN膜的水接触角明显减小,表明SF可有效改善PAN膜的亲水性。钱巧芬等[57]将一定比例的聚乙二醇混入丝素膜中,可使膜在保持原有良好生物性质的前提下,柔韧性有所改善,且透光性较好,但因其聚合物相对分子量较大,故与丝素的可混性稍差。Suzuki等[58]将丝素溶液与分子量为300的聚乙二醇混合,并通过京尼平制备得到复合丝素蛋白膜。在与非处理膜的对比中发现,复合膜的力学性能有着明显提升,并在人类角膜缘上皮细胞的原代培养中体现了良好的生物相容性。王利君等[59]通过静电纺丝技术,制备出不同质量比的聚乳酸-聚己内酯/丝素蛋白复合纳米纤维膜支架。研究结果显示,复合纳米纤维膜中丝素蛋白经甲醇处理后由无定形结构转变为β-折叠结构,随着复合纳米纤维膜中丝素含量的增加,纳米纤维膜的孔隙率和吸附性降低,亲水性和生物相容性增加,有利于细胞的黏附和增殖。聚乳酸-乙醇酸共聚物具有良好的生物降解性和力学性能,且降解速率可调节,但在生物相容性方面较之于天然高分子材料还有一定的差距,主要有亲水性差、细胞吸附能力较弱、缺少细胞识别位点等缺点。肖红伟等[60]以六氟异丙醇为共溶剂,通过静电纺丝法制备了聚乳酸-乙醇酸共聚物/丝素蛋白共混纳米纤维多孔膜。实验结果显示,共混多孔膜中纤维直径随SF的加入逐渐降低,均匀性变好;共聚物与SF只发生分子间的互容并且存在氢键作用,但当SF含量超过40%时,共混多孔膜的力学性能下降;另外发现,SF的加入能够显著改变共混多孔膜的亲水性和生物相容性。
2.3.4 丝素蛋白/碳纳米管与氧化石墨烯复合材料碳纳米管(CNT)是一种一个原子厚的石墨层圆柱体, 它是典型的力学性能增强剂[61]。潘彩霞[62]以丝素蛋白为材料,通过与多壁碳纳米管及碳化二亚胺(EDC)共混,研制出丝素蛋白复合膜材料。结果显示,相比纯丝素膜,添加了质量分数为0.5%碳纳米管的复合丝素膜的弹性模量和最大应力分别提高了24%和39%;而且,随着碳纳米管含量的增加,丝素蛋白的β-折叠质量分数含量从17.8%提高到53.6%;当碳纳米管含量为1%时,混合溶液的黏度提高了10倍;此外,通过细胞培养实验证实,丝素蛋白/碳纳米管复合膜无毒,具有良好的生物相容性,可以作为生物材料。Pan等[63]将多壁碳纳米管悬浮液加入丝素溶液中,使用高压静电纺丝技术制备多壁碳纳米管/丝素复合纳米纤维支架。发现与纯丝素静电纺纳米纤维支架相比,添加1.0%多壁碳纳米管的复合膜的断裂强度提高2.8倍,弹性模量提高4.4倍,断裂功提高2.1倍;多壁碳纳米管在丝素蛋白基体中,不仅能防止基体的裂纹扩展,而且因诱导丝素蛋白向β-折叠结构转变,可有效提高丝素纤维网支架的力学性能。氧化石墨烯(Graphene Oxide,GO)是具有独特二维平面结构的六边形环状碳网络。GO含有大量含氧官能团,这些官能团主要是分布在平面上的羟基和环氧基,少量分布在平面边缘上的羧基、羰基、酚、内酯和醌等。这种结构使其具有良好的亲水性和分散性;同时,氧化石墨烯也具有良好的生物相容性、超强的吸附能力以及优异的力学性能,由于其化学反应能力强,常被作为增强填料添加到聚合物基体中[64]。方洁羽等[65]采用浇铸法制备出丝素-甘油复合膜,并在其中加入了氧化石墨烯来改善复合膜的综合性能。实验结果表明,加入氧化石墨烯后,丝素由晶型Silk Ⅰ向Silk Ⅱ结构转变,复合膜拉伸强度提高了35%,氧化石墨烯在丝素结晶过程中起到了成核剂的作用,并且增强了复合膜的稳定性。Zhang等[66]将氧化石墨烯添加到再生丝素蛋白水溶液中进行共混纺丝,他们认为氧化石墨烯的加入可以增强其力学性能;并且随着晶体比例的逐渐增加,复合材料的应变率从5%增加到18%,表明其复合材料的拉伸强度也与两者的结晶状态有关。
2.4 丝素蛋白及其复合材料的应用 2.4.1 药物缓释载体药物控释是指控制药物定量、匀速地在体内释放,使血药浓度保持恒定。许多药物由于其本身的限制,如小分子药物在体内容易突释,大分子药物半衰期短,组织渗透性慢以及药物潜在的毒性等,都会影响药物的治疗效果[67]。将药物固定在特定部位并以恒定的速率释放,不仅可以在局部提高药物的浓度,降低毒副作用,还可以减轻病人的痛苦。丝素蛋白具有较强的可塑性,易于加工成各种形态,是一种优良的载体材料,通过改变丝素蛋白的β-折叠的含量能够实现对药物的控释。以丝素蛋白作为缓释载体材料,目前主要有水凝胶、薄膜衣、微粒子、纳米粒子、通道、支架以及药片等几种物理形式,可根据药物分子量大小及释放快慢要求,制成不同规格的药物载体。马晓晔等[30]通过自由基聚合的方法合成了自膨胀聚丙烯酸钠-丝素半互穿网络水凝胶,并研究了抗生素药物阿莫西林在其中的包载与释放性能。研究发现,随着水凝胶中丝素蛋白含量的增加,其膨胀率增大,压缩强度减小,药物释放速率加快;且能在120h内释放(83.4±0.9)%的药物,体现了其具有微创治疗和局部药物释放的优点,可以应用于在药物输送或其他植入材料领域。Yang等[68]用聚乙二醇诱导丝素蛋白形成纳米颗粒,并将姜黄素包埋其中,研究了其抗细胞衰老的作用。研究发现,包埋在丝素蛋白纳米颗粒中的姜黄素延缓大鼠骨髓间充质干细胞衰老的效果明显优于游离的姜黄素。
2.4.2 抗血凝性材料人体创伤出血是常见现象,因此止血就显得尤为重要。创伤急救主要是为了暂时控制出血,将伤口与外界隔离避免感染,为了能达到较好的止血效果和形成良好的创面,医用止血材料的研究备受关注。丝素蛋白具有极小的炎症反应性,同时有一定的生物降解性,因此丝素蛋白及其复合材料是一种性能良好的抗凝血材料。张桂媛[69]研究了一种加载Ca2+的再生丝素蛋白多孔止血材料,将蚕丝蛋白与交联剂聚乙二醇双环氧丙烷醚(PEG-DE)按一定比例混合,通过冷冻干燥的方法制备丝素多孔材料。聚乙二醇双环氧丙烷醚的加入改善了蚕丝蛋白材料的柔软性,而多孔结构也改善了材料的可压缩性和吸水性,并为血小板的黏附聚集提供空间。吸水性的提高,能快速吸收血液中的水分,增加血液的黏度,使血流减慢而凝固;血小板黏附空间的增加,有利于材料在短时间内聚集大量血小板,激活凝血因子,快速止血。实验结果表明,加载Ca2+后的丝素蛋白多孔材料止血性能显著提高,以100: 10和100: 15加载Ca2+的丝素蛋白多孔材料,综合止血效果较好。
2.4.3 组织工程材料组织工程是将人体各种缺损组织或器官的细胞在体外培养扩增后,采用物理、化学和生物的方法制成细胞-支架复合体植入缺损部位,从而实现缺损组织的治疗目的[8]。组织工程的核心是建立由细胞和生物支架材料构成的三维空间复合体,材料在其中起关键作用[9]。作为组织工程研究的人工细胞外基质,支架材料为细胞的生长、繁殖、新陈代谢以及形成新组织提供支持。由于支架材料是细胞生长的基础,所以良好的支架材料必须满足无毒、一定的机械强度、良好的生物相容性、生物降解性以及可塑性等要求[10]。目前研究较多的有可降解高分子材料、陶瓷类材料、复合材料和生物衍生材料等[70]。郭志豪等[71]通过溶液共混法制备了丝素蛋白/介孔生物玻璃陶瓷复合材料,并对30只SD(Sprague Dawley)大鼠(远交群大鼠)建立5mm颅骨缺损模型进行修复实验。研究表明,骨缺损处填充支架材料后,能使来自周围组织的结缔组织发生迁移,形成具有骨细胞潜能的细胞块,容易包膜骨填充材料,从而能延缓骨愈合时间,影响骨修复的质量;复合材料与宿主之间具备良好的生物相容性,能促进缺损部位早期恢复。李明等[72]通过引入石墨烯,并采用盐析法制备了石墨烯/丝素蛋白骨组织工程三维多孔支架材料,用于提高骨组织修复与重建。他们发现,丝素蛋白内加入石墨烯作为力学增强材料,不仅提高了支架材料的力学性能,而且增加了支架材料的电传导性与成骨活性。胡沐黎[73]制备了与骨软骨组织相仿的丝素蛋白/羟基磷灰石一体化三层支架,这种支架孔径在300~500μm,且具有良好连通性,结构致密并呈一定取向排列,具有较好的拉伸强度,能够有效防止骨相与软骨相的剥离;通过支架的骨髓间充斥干细胞(Bone Marrow filled with Stem Cells, BMSCs)贴附实验以及兔股骨髁处缺损的修复实验,验证了此复合材料具有良好的生物相容性和软骨修复能力。
2.4.4 固定化酶载体材料酶的固定化在化学、生物医学以及生物感应器等领域应用较广。固定化酶的效果在很大程度上取决于载体结构。丝素有大量的亲水和疏水基团,不需要任何的交联剂就能完成基本的固定,因此固定过程中很少引入其他的化学试剂,从而减小酶失活的可能性,提高了酶的固定效率;并且丝素蛋白变性的程度可控、无毒、安全性高、经过一定的处理可以制成多种形状,这些优点使得丝素成为固定化酶的优质材料[74]。Xu等[75]将丝素和聚酰胺-胺共价结合到磁性Fe3O4纳米颗粒上,制备成磁性丝素纳米颗粒,并用戊二醛将过氧化物酶交联到磁性丝素纳米颗粒上制备成结合酶,向反应溶液中插入电极,在溶液中直接产生过氧化氢,同时通入氧气。该方法不仅将丝素制备成纳米颗粒,增加了酶载量和反应的比表面积,且加入的Fe3O4方便反应结束后固定化酶的回收,同时该装置还可自释氧。该材料为用电极和酶结合的方法除去废水中的有机磷和芳香类化合物提供了理论依据。Delezuk等[76]制备并研究了壳聚糖/丝素蛋白复合组织材料,通过圆二色谱分析显示,改性丝素溶液在197nm处值最小,这说明壳聚糖的加入引发了丝素蛋白薄层的构象变化,并出现了无规则卷曲。在进一步的实验中发现,该复合材料对植酸检测的敏感度明显增强,因此作为新型生物传感器具有良好的发展前景。
2.4.5 吸附材料随着社会经济的发展、工业化生产的普及等,在自然界和人类生活环境中,存在较多的有害金属离子,危及人类和动植物的健康。研究表明,不同形态的丝素蛋白对重金属离子存在不同能力的吸附作用,且其吸附比率随着丝素蛋白浓度的增加而增大,对单一金属离子和混合离子具有同样效果[77]。孙越宜等[11]测定和分析了不同状态下的丝素蛋白,包括溶液状、凝胶状和粉末状丝素蛋白对金属离子锌的吸附作用。实验结果显示,丝素蛋白吸附锌离子时,氢元素与氧元素参与了其反应,而氮元素也可能参与了反应。丝素蛋白肽链上的—OH、—CO—NH—以及—NH2与Zn2+通过配位键形成了配合物,且丝素蛋白β-折叠增加而无规卷曲减少,丝素蛋白与Zn2+形成的配合物具有更稳定配位结构;同时发现pH值对该配位反应过程也存在一定的影响。张凯等[12]采用流延法将丝素蛋白涂覆在聚苯乙烯板上,室温下成膜,并通过添加硅烷偶联剂制备了水不溶性丝素杂化膜(水溶性低于3%)。他们指出,偶联剂的加入促使丝素蛋白的构象由无规卷曲α-螺旋型向β-折叠型转变,相应的结晶形态由SilkⅠ型向SilkⅡ型转变,并使得材料对镉离子和铅离子存在较强的选择性吸附能力。
2.4.6 织物改性添加剂丝素蛋白自身易形成分子水平的空腔,其结构性能特点决定了它具有改善织物的表面摩擦性、功能性、保健整理等性能,又被称为是天然的“绿色整理剂”。近年来,国内外学者研究采用乙二醛、戊二醛、多元羧酸、环氧树脂、聚乙烯醇等交联剂将丝素蛋白接枝固定在纤维或织物表面,使其具有丝素蛋白的表观特点,并将丝素蛋白的优异功能转移到服用纤维中。李继丰等[78]对棉织物进行羧基化改性,再将丝素蛋白接枝处理,棉织物的抗皱能力、耐磨性能和吸湿性能显著提高,但拉伸强度和白度略有降低,改性后的丝素蛋白棉织物具有良好的耐热水洗性,具有棉织物亲肤、抗皱、高吸湿性和抗静电性等优点。李陈梅等[79]以丝素为保护剂,葡萄糖为还原剂,制备丝素纳米银水溶液,并对棉织物进行处理。处理后的织物对大肠杆菌和金黄色葡萄球菌的抑菌率分别为98.36%和98.50%,经50次洗涤后其抑菌率仍能保持在92%以上;同时,整理后棉织物表面摩擦因数和表面粗糙度均有所降低,光滑度增加。
2.4.7 催化剂目前,有学者开始将丝素材料应用在催化领域。例如,将丝素与无机材料进行复合改性后得到光催化材料,用于消除污染,这是一种环境友好的新型材料。赵林等[80]通过溶胶-凝胶法制备了丝素蛋白/TiO2 复合纳米材料,研究了其在可见光下的催化活性。研究发现,在可见光照射下,复合材料的Cr(Ⅵ)光催化还原效率达36%,甲酸降解效率达3.4%,相对于纯TiO2,复合材料的可见光吸收能力有所提高。Luo等[13]利用丝素蛋白和Fe2+/Fe3+之间的螯合作用,通过共沉淀法制备了Fe3O4负载的丝素凝胶材料,该水凝胶具有较高的饱和磁化强度,并提高了过氧化物的酶活性和催化时间,结合丝素蛋白的生物相容性,丝素/Fe3O4水凝胶可应用在环境化学与生物技术方面。
2.4.8 食品与美容产品助剂食物腐败不仅影响着食品质量和安全,还导致了资源的浪费和经济损失。迄今为止,人们研究出了许多方法延长水果食物的保质期,如冷冻、化学杀菌剂、防腐包装、低压以及热处理等。随着科技的不断发展,可食用防腐涂层的出现为食物防腐提供了新的解决方案。丝素蛋白具有良好的生物相容性并且无味,是一种良好的食品防腐涂层添加剂。Marelli等[81]将1%的丝素蛋白悬浮液涂抹于草莓上,考察了其对草莓保鲜性能的改善效果,并对该悬浮液进行了金属离子以及元素检测来评估溶液的安全性。他们发现,丝素蛋白涂层能有效减缓草莓表面呼吸氧化速率,从而延长其保质期;并且,毒性水平远低于日常饮用水标准,为可食用防腐涂层的发展提供了有利的科学实验依据。屠洁等[82]为改善搅拌型酸奶的品质,采用二因素三水平析因实验设计,将4种常用稳定剂,包括果胶、黄原胶、海藻酸钠和耐酸性羧甲基纤维素钠(CMC)分别与丝素蛋白混合,加入酸奶中,考察它们对搅拌型酸奶的黏度和保水性的影响。实验结果显示,稳定剂和丝素蛋白的加入对酸奶的黏度和保水性均有极显著的交互作用,其中海藻酸钠与丝素蛋白的组合不仅提升了酸奶的口感,还提升了酸奶的营养价值,可作为新型的酸奶添加剂。
丝素蛋白同样是提升美容产品的保水性和弹性的优质材料,可以用于角膜修复和皮肤护理等方面。赵应征等[83]提供了一种肌肤护理用丝素蛋白水凝胶的制备方法。通过改变丝素蛋白、透明质酸和蜗牛黏蛋白等组分的配比来调节材料的力学强度和降解速率。研究指出,该丝素蛋白水凝胶具有良好的保水性,能促进皮肤表面的新陈代谢,达到抗皱、养容的作用,可以作为面膜和护肤霜等护肤产品中的基质。曹丽楠等[84]在丝素蛋白和胶原蛋白的复合膜上接种L-929细胞,细胞正常生长,后期在新西兰大白兔皮肤缺损处分别敷贴医用丝素蛋白皮肤再生膜,定期观察红斑和水肿情况,同时建立急性全身毒性实验,检测细胞毒性和细胞纤维连接蛋白mRNA表达等。研究发现,丝素蛋白复合膜未对皮肤造成刺激,具有保护创面和诱导皮肤再生的作用。
3 结束语与传统材料相比,由于丝素蛋白独特的结构,使得改性后的丝素复合材料在力学、生物和化学等方面的性能显著提高,从而在生物工程、医药、食品、美容以及催化等领域具有很好的发展前景,是一种极具研究价值的新型功能材料。但是,目前丝素蛋白在实际应用方面还存在一些不足,例如,在骨修复中其机械强度仍不足以适应高强度的物理负荷,丝素与一些人工高分子材料复合的机理尚需进一步验证等。目前国内对丝素蛋白的应用研究较多,主要是集中在医药生物功能材料方面,但是对其基因序列、改性机理方面的研究基本上都是来源于国外,所以通过对丝素蛋白结构更深的了解,可以从基因层面对丝素蛋白进行重组改性,从而得到具有前瞻性的材料合成路线。
结合目前丝素蛋白的研究现状,其发展趋势为以下4方面:(1)智能材料可以自适应不同的生物体系以延长其使用寿命,所以智能丝素蛋白材料应具有很大的应用潜力;(2)丝素蛋白材料在医学上的应用目前还处于动物实验阶段,如何将其运用到人类的康复治疗中还需进行大量的实验研究;另外,值得思考的是如何载入生物信号分子,使其直达损伤部位,从而提高丝素支架的治疗效果;(3)丝素蛋白复合材料的热力学机理以及在环境和催化等方面的研究;(4)规模化、高效率和可重复使用等这些产业化应用的技术问题。
| [1] |
张扬, 李明忠. 改善再生丝素蛋白材料力学性能的研究进展[J].
现代丝绸科学与技术, 2014, 29 (6): 236–240.
ZHANG Y, LI M Z. Research progress in improving mechanical properties of regenerated silk fibroin material[J]. Modern Silk Science & Technology, 2014, 29 (6): 236–240. |
| [2] |
黄泉, 杨吉成, 缪竞诚. 丝素蛋白生物相容性评价进展[J].
国际生物医学工程杂志, 2007, 30 (3): 163–166.
HUANG Q, YANG J C, LIAO J C. Progress in biocompatibility evaluation of silk fibroin[J]. International Journal of Biomedical Engineering, 2007, 30 (3): 163–166. |
| [3] | KAPLAN D L, MC G K. Protein based materials[M]. Boston: Birkhauser, 1998: 103-131. |
| [4] |
刘琼, 陈忠敏, 陈枭, 等. 纳米蚕丝素蛋白/PEG复合材料的抗菌性与药物缓释效果[J].
材料导报, 2014, 28 (2): 55–59.
LIU Q, CHEN Z M, CHEN X, et al. Antibacterial properties and delayed release effect of nano-silk fibroin peptide polyethylene glycol graft polymer[J]. Materials Review, 2014, 28 (2): 55–59. |
| [5] |
许云辉, 李继丰, 王云霞, 等. 丝素酰胺改性棉织物的结构及性能[J].
纺织学报, 2017, 38 (2): 134–140.
XU Y H, LI J F, WANG Y X, et al. Structure and properties of cotton fabric by amide modification of silk fibroin[J]. Journal of Textile Research, 2017, 38 (2): 134–140. |
| [6] | DHYANI V, SINGH N. Controlling the cell adhesion property of silk films by graft polymerization[J]. Appl Mater Interfaces, 2014, 6 (7): 5005–5011. DOI: 10.1021/am4060595 |
| [7] |
杨华, 聂涛, 蔡辉, 等. 聚乙二醇缩水甘油醚改性丝素蛋白研究[J].
化工科技, 2013, 21 (5): 4–8.
YANG H, NIE T, CAI H, et al. Modification of silk fibroin with polyethylene glycol diglycidyl[J]. Science & Technology in Chemical Industry, 2013, 21 (5): 4–8. |
| [8] | KASOJU N, BORA U. Silk fibroin in tissue engineering[J]. Advances Healthcare Materials, 2012, 1 : 393–412. DOI: 10.1002/adhm.201200097 |
| [9] |
肖阳, 杨蓉, 李庆荣, 等. 丝素蛋白在生物医药工程中的应用[J].
广东蚕业, 2016, 50 (2): 24–29.
XIAO Y, YANG R, LI Q R, et al. Application of silk fibroin in biomedical engineering[J]. Guangdong Silk, 2016, 50 (2): 24–29. |
| [10] |
潘岳林, 杨明英, 邓连霞, 等. 丝素在组织工程领域中的研究热点[J].
蚕桑通报, 2016, 47 (2): 15–17.
PAN Y L, YANG M Y, DENG L X, et al. Silk fibroin for tissue engineering[J]. Bulletin of Sericulture, 2016, 47 (2): 15–17. |
| [11] |
孙越宜, 俞纪维, 支金丝, 等. 丝素蛋白对重金属离子吸附性能的研究[J].
蚕桑通报, 2015, 46 (1): 37–40.
SUN Y Y, YU J W, ZHI J S, et al. Study on the adsorption of heavy metal ions by silk fibroin[J]. Bulletin of Sericulture, 2015, 46 (1): 37–40. |
| [12] |
张凯, 谢孔良. 水不溶性丝素杂化膜的制备及其金属离子吸附性能研究[J].
印染助剂, 2016, 33 (4): 18–23.
ZHANG K, XIE K L. Preparation and metal ion adsorption properties of water-insoluble silk fibroin hybrid membrane[J]. Textile Auxiliaries, 2016, 33 (4): 18–23. |
| [13] | LUO K Y, SHAO Z Z. A novel regenerated silk fibroin-based hydrogels with magnetic and catalytic activities[J]. Chinese Journal of Polymer Science, 2017, 35 (4): 515–523. DOI: 10.1007/s10118-017-1910-0 |
| [14] | HAYASHI C Y, LEWIS R V. Evidence from flagelliform silk cDNA for the structural basis of elastic city and modular nature of spider silk[J]. Journal of Molecular Biology, 1998, 275 : 773–784. DOI: 10.1006/jmbi.1997.1478 |
| [15] | CRISTIAN C R, CLIFFORF B, HA S W, et al. Conformational changes induced in bombyxmori silk fibroin bycyclodextrin inclusion complexation[J]. Macromolecules, 2005, 38 (13): 5640–5646. DOI: 10.1021/ma050340a |
| [16] | VALLUZZI R, GIDO S, ZHANG W, et al. Trigonal crystal structure of bombyx mori silk incorporating threefold helical chain conformation found at the air-water interface[J]. Macromolecules, 1996, 29 (95): 8606–8614. |
| [17] | FURUHATA K I, OKADA A, CHEN Y, et al. Dissolution of silk fibroin in lithium halide/organic amide solvent systems[J]. Polymer, 1994, 63 (4): 315–322. |
| [18] |
于海洋, 王昉, 刘其春, 等. 新型丝素蛋白膜的结构和热分解动力学机理[J].
物理化学学报, 2017, 33 (2): 344–355.
YU H Y, WANG F, LIU Q C, et al. Structure and kinetics of thermal decomposition mechanism of novel silk fibroin films[J]. Acta Physico-Chimica Sinica, 2017, 33 (2): 344–355. DOI: 10.3866/PKU.WHXB201611023 |
| [19] | SIONKOWSKA A, LEWANDOWSKA K, MICHALSKA M, et al. Characterization of silk fibroin 3D composites modified by collagen[J]. Journal of Molecular Liquids, 2016, 215 : 323–327. DOI: 10.1016/j.molliq.2015.12.047 |
| [20] | LV X G, LI Z, CHEN S Y, et al. Structural and functional evaluation of oxygenating keratin/silk fibroin scaffold and initial assessment of their potential for urethral tissue engineering[J]. Biomaterials, 2016, 84 (4): 99–110. |
| [21] | NUMATA K, YAMAZAKI S, KATASHIMA T, et al. Silk-petin hydrogel with superior mechanical properties, biodegrad-ability, and biocompatibility[J]. Macromolecular Bioscience, 2014, 14 (6): 799–806. DOI: 10.1002/mabi.201300482 |
| [22] | LEE H, JANG C H, KIM G H. A polycaprolactone/silk-fibroin nanfibrous composite combined with human umbilical cord serum for subacute tympanic mambrane perforation; an in vitro and vivo study[J]. Journal of Materials Chemistry B, 2014, 2 (18): 2703–2713. DOI: 10.1039/c4tb00213j |
| [23] | ASAKURA T, OKUSHITA K, MIKE P. Analysis of the structure of bombyx mori silk fibroin by NMR[J]. Macromolecules, 2015, 48 (8): 2345–2357. DOI: 10.1021/acs.macromol.5b00160 |
| [24] |
余劭婷, 秦金桥, 关国平, 等. 丝素纤维表面改性提高细胞粘附性能[J].
生物医学工程学进展, 2016, 37 (3): 144–149.
YU S T, QIN J Q, GUAN G P, et al. Surface modification of silk fibroin fiber for improving cell adhesion[J]. Progress in Biomedical Engineering, 2016, 37 (3): 144–149. |
| [25] | SAGNELLA A, PISTONE A, BONETTI S, et al. Effect of different fabrication methods on the chemo-physical properties of silk fibroin films and on their interaction with neural cells[J]. RSC Advances, 2016, 6 (11): 9304–9314. DOI: 10.1039/C5RA20684G |
| [26] |
王鹏, 左保齐. 不同盐/甲酸溶解体系下丝素膜的制备及性能表征[J].
丝绸, 2016, 57 (7): 18–22.
WANG P, ZUO B Q. Preparation of silk fibroin films in different salt/formic acid dissolution system and its property characterization[J]. Silk, 2016, 57 (7): 18–22. |
| [27] | JIAN W Y, ER Q C, DAVID P, et al. Enhancing the toughness of regenerated silk fibroin film through uniaxial extension[J]. Biomacromolecules, 2010, 11 : 2890–2895. DOI: 10.1021/bm100643q |
| [28] | TAKAYUKI A, FREDDI G, INNOCENTI R, et al. Biodegradation of bombyxmori silk fibroin fibers and films[J]. Journal of Applied Polymer Science, 2004, 91 (4): 2383–2390. DOI: 10.1002/(ISSN)1097-4628 |
| [29] |
朱正华, 陆旋, 周晓红. 钙离子含量对再生丝素蛋白纤维生物降解性的影响[J].
蚕业科学, 2014, 40 (1): 107–112.
ZHU Z H, LU X, ZHOU X H. Impact of calcium ion content on biodegradablity of the regenerated silk fibroin fiber[J]. Science of Sericulture, 2014, 40 (1): 107–112. |
| [30] |
马晓晔, 施丽君, 周涓, 等. 聚丙烯酸钠和丝素蛋白自膨胀水凝胶的制备及其释药性能[J].
有机化学, 2013, 33 (5): 1080–1087.
MA X Y, SHI L J, ZHOU J, et al. Preparation of the self-inflating hydrogels based on poly(sodium acrylate)and silk fibroin and their drug releasing properties[J]. Chinese Journal of Organic Chemistry, 2013, 33 (5): 1080–1087. |
| [31] | ROMERO I S, SCHURR M L, LALLY J V, et al. Enhancing the interface in silk-polypyrrole composites through chemical modification of silk fibroin[J]. ACS Appl Mater & Interfaces, 2013, 5 (3): 553–564. |
| [32] | YUE X X, ZHANG F, WU H Y, et al. A novel route to prepare dry-spun silk fibers from CaCl2-formic acid solution[J]. Materials Letters, 2014, 128 (8): 175–178. |
| [33] | WANG J L, YANG Q, MAO C B, et al. Osteogenic differentiation of bone marrow mesenchymal stem cells collagen/silk fibroin bi-template-induced biomimetic bone substitutes[J]. Journal of Biomedical Materials Research Part A, 2012, 100 (11): 2929. |
| [34] | ZHU H L, WU B W, FENG X X, et al. Preparation and characterization of bioactive mesoporous calcium silicate-silk fibroin composites films[J]. Journal of Biomedical Materials Research Part B Applied Biomaterials, 2011, 98 (2): 330. |
| [35] |
张睿晗, 蔡志江. 静电纺制备丝素蛋白纳米纤维及其复合纳米纤维的研究进展[J].
高分子通报, 2013 (7): 33–39.
ZHANG R H, CAI Z J. Advances on fabrication of electrospun silk fibroin nanofibres[J]. Chinese Polymer Bulletin, 2013 (7): 33–39. |
| [36] |
崔新爱, 刘欣, 孔德领, 等. 静电纺胶原/丝素复合微纳米纤维的制备及细胞相容性研究[J].
中国生物医学工程学报, 2012, 31 (2): 291–299.
CUI X A, LIU X, KONG D L, et al. Preparation of collagen/silk fibroin bicomponent micro-nanofibers and its cytocompatibility study[J]. Chinese Journal of Biomedical Engineering, 2012, 31 (2): 291–299. |
| [37] | LI S, WU H, HU X, et al. Preparation of electrospun PLGA-silk fibroin nanofibers-based nerve conduits and evaluation in vivo[J]. Artifcells Blood Substitues Immobilization Biotechol, 2012, 40 (1/2): 171–178. |
| [38] | XU H, LIU C, SILBERSCHMIT V V, et al. Behavior of aluminum oxide, intermetallics and voids in Cu-Al wire bonds[J]. Acta Materialia, 2011, 41 (5): 5611. |
| [39] | NAZAROV R, JIN H J, KAPLAN D L. Porous 3-D scaffolds from regenerated silk fibroin[J]. Biomacromolecules, 2004, 5 (3): 718–726. DOI: 10.1021/bm034327e |
| [40] |
孙凯, 李瑞欣, 范猛, 等. 3D打印丝素蛋白/胶原蛋白支架的制备及性能[J].
中国组织工程研究, 2017, 21 (2): 280–285.
SUN K, LI R X, FAN M, et al. Three-dimensional printed silk fibroin/collagen scaffold and its performance[J]. Chinese Journal of Tissue Engineering Research, 2017, 21 (2): 280–285. DOI: 10.3969/j.issn.2095-4344.2017.02.021 |
| [41] |
陈慧. 羊毛角蛋白丝素膜的制备及性能表征[J].
毛纺科技, 2016, 44 (6): 46–49.
CHEN H. Preparation and properties characterization of wool keratin-silk fibroin membrane[J]. Wool Textile Journal, 2016, 44 (6): 46–49. |
| [42] |
冯超, 李喆, 吕向国, 等. 自产氧型人发角蛋白/丝素蛋白复合材料体外制备及生化评估[J].
中国组织工程研究, 2014, 18 (52): 8480–8486.
FENG C, LI Z, LV X G, et al. In vitro preparation and biochemical evaluation of oxygen generative keratin/silk fibroin compound biomaterial[J]. Chinese Journal of Tissue Engineering Research, 2014, 18 (52): 8480–8486. DOI: 10.3969/j.issn.2095-4344.2014.52.021 |
| [43] |
马育栋, 卢志华. 丝素蛋白/壳聚糖复合凝胶材料的制备[J].
济宁学院学报, 2013, 34 (6): 41–43.
MA Y D, LU Z H. Preparation of gel material with silk fibroin and chitosan[J]. Journal of Jining University, 2013, 34 (6): 41–43. |
| [44] |
柳磊, 曾曙光, 仁力, 等. 丝素蛋白/壳聚糖三维多孔支架的构建及结构表征[J].
中国组织工程研究, 2012, 16 (12): 2197–2202.
LIU L, ZENG S G, REN L, et al. Preparation and characterization of porous silk fibroin/chitosan scaffolds[J]. Chinese Journal of Tissue Engineering Research, 2012, 16 (12): 2197–2202. DOI: 10.3969/j.issn.1673-8225.2012.12.025 |
| [45] |
郑丽, 朱平, 张林, 等. 纤维素/丝素蛋白共混膜的制备及性能研究[J].
印染助剂, 2012, 29 (6): 27–29.
ZHENG L, ZHU P, ZHANG L, et al. Study on the preparation and performance of cellulose/silk fibroin composite film[J]. Textile Auxiliaries, 2012, 29 (6): 27–29. |
| [46] |
李娟, 何建新. 纤维素/丝素复合膜的制备与性能[J].
纤维素科学与技, 2011, 19 (3): 62–67.
LI J, HE J X. Preparation and properties of cellulose-silk compound membrane[J]. Journal of Cellulose Science and Technology, 2011, 19 (3): 62–67. |
| [47] |
白莲村, 柯勤飞, 黄晨. 丝素/胶原纤维针刺支架材料的制备和性能测试[J].
产业用纺织品, 2016 (6): 17–20.
BAI L C, KE Q F, HUANG C. Preparation and performance test of tissue engineering scaffold materials of silk fibers and collagen fibers with needle-punch technique[J]. Technical Textiles, 2016 (6): 17–20. |
| [48] |
李曦, 刘连利, 王莉莉. 纳米二氧化硅的研究现状与进展[J].
渤海大学学报, 2006, 27 (4): 304–308.
LI X, LIU L L, WANG L L. Status quo and progress in research nano-SiO2[J]. Journal of Bohai University Natural Science Edition, 2006, 27 (4): 304–308. |
| [49] |
徐水, 张胡静, 李雯静, 等. 丝素/纳米SiO2凝胶共混膜的制备及性能测试[J].
蚕业科学, 2011, 37 (1): 82–87.
XU S, ZHANG H J, LI W J, et al. Preparation and property determination of fibroin/nano-SiO2 gel blend membrane[J]. Science of Sericulture, 2011, 37 (1): 82–87. |
| [50] | MIN K, UMAR M, HAEKYO S, et al. Optically transparent, patterned, and flexible electrodes and radio frequency antennas prepared from silk protein and silver nanowire networks[J]. RSC Advances, 2017, 7 (1): 574–580. DOI: 10.1039/C6RA25580A |
| [51] |
范纯泉, 叶晓健. 丝素蛋白纳米羟基磷灰石复合材料的生物安全性[J].
中国组织工程研究, 2016, 20 (38): 5650–5656.
FAN C Q, YE X J. Biological safety of silk fibroin/nano-hydroxyapatite composites[J]. Chinese Journal of Tissue Engineering Research, 2016, 20 (38): 5650–5656. DOI: 10.3969/j.issn.2095-4344.2016.38.004 |
| [52] |
刘浩, 褚亚伟, 丁涛, 等. 丝素蛋白/羟基磷灰石支架对成骨诱导脂肪干细胞活性及成骨性能的影响[J].
中国组织工程研究, 2015, 19 (45): 7224–7229.
LIU H, ZHU Y W, DING T, et al. Effect of silk fibroin/hydro-xyapatite scaffold on the viability and osteogenic properties of adipose-derived stem cells under osteogenic induction[J]. Chinese Journal of Tissue Engineering Research, 2015, 19 (45): 7224–7229. DOI: 10.3969/j.issn.2095-4344.2015.45.002 |
| [53] |
宁旭, 庄勇, 刘淼, 等. 丝素蛋白纳米羟基磷灰石复合材料制备及与脊柱的融合[J].
中国组织工程研究, 2017, 21 (2): 221–226.
NING X, ZHUANG Y, LIU M, et al. Preparation of silk fibroin/nano-hydroxypatite composite scaffold and its treatment outcomes in spinal fusion[J]. Chinese Journal of Tissue Engineering Research, 2017, 21 (2): 221–226. DOI: 10.3969/j.issn.2095-4344.2017.02.011 |
| [54] | MI R X, LIU Y X, CHEN X, et al. Structure and properties of various hybrids fabricated by silk nanofibrils and nanohydroxyapatite[J]. Nanoscale, 2016, 8 : 20096–20102. DOI: 10.1039/C6NR07359J |
| [55] |
李静静, 朱海霖, 雷彩虹, 等. 介孔生物玻璃/丝素蛋白复合多孔海绵的结构及止血性能研究[J].
功能材料, 2017, 48 (2): 2097–2101.
LI J J, ZHU H L, LEI C H, et al. Study on structure and hemostatic property of mesoporous bioglass/silk fibroin composite sponge[J]. Journal of Functional Materials, 2017, 48 (2): 2097–2101. |
| [56] |
张静, 肖长发, 王健, 等. 丝素蛋白/聚丙烯腈共混膜的制备及性能研究[J].
天津工业大学学报, 2011, 30 (6): 5–8.
ZHANG J, XIAO C F, WANG J, et al. Study on preparation and properties of SF/PAN blend membranes[J]. Journal of Tianjin Polytechnic University, 2011, 30 (6): 5–8. |
| [57] |
钱巧芬, 张珊珊, 侯静, 等. 乙二醇/丝素蛋白共混膜的研究[J].
丝绸, 2013, 50 (9): 1–6.
QIAN Q F, ZHANG S S, HOU J, et al. Study on ethylene glycol/silk fibroin blend membrane[J]. Silk Monthly, 2013, 50 (9): 1–6. |
| [58] | SUZUKI S, REBBACA A, TRAIAN V, et al. Treatment of silk fibroin with poly(ethylene glycol) for the enhancement of corneal epithelial cell growth[J]. Journal of Functional Biomaterials, 2015, 6 (2): 345–366. DOI: 10.3390/jfb6020345 |
| [59] |
王利君, 熊杰, 骆菁菁, 等. 聚乳酸-聚己内酯/丝素蛋白三元复合纳米纤维膜支架的结构与性能[J].
纺织学报, 2014, 38 (5): 8–13.
WANG L J, XIONG J, LUO J J, et al. Structure and properties of polylactic acid-polycaprolactone/silk fibroin composite nanofibrous scaffolds[J]. Journal of Textile Research, 2014, 38 (5): 8–13. |
| [60] |
肖红伟, 熊杰, 李妮, 等. 聚乳酸-乙醇酸共聚物/丝素共混纳米纤维多孔膜的制备及性能[J].
高分子材料科学与工程, 2011, 27 (12): 142–145.
XIAO H W, XIONG J, LI N, et al. Preparation and properties of poly(lactide-co-glycolide)/silk blend nanofibrous porous membrane[J]. Polymer Materials Science & Engineering, 2011, 27 (12): 142–145. |
| [61] | PAN H, ZHANG Y P, HANG Y C, et al. Significantly reinforced composite fibers electrospun from silk finroin/carbon nanotube aqueous solutions[J]. Biomacromolacules, 2012, 13 : 2859–2867. DOI: 10.1021/bm300877d |
| [62] |
潘彩霞. 丝素/碳纳米管及丝素/EDC复合膜的制备及性能研究[D]. 杭州: 浙江大学, 2016. PAN C X. Preparation and properties of SF/MWCNT and SF/EDC composites films[D]. Hangzhou: Zhejiang University, 2016. |
| [63] | PAN H, ZHANG Y, HANG Y, et al. Significantly reinforced composite fibers electrospun from silk fibroin/carbon nanotube aqueous solutions[J]. Biomacromolecules, 2012, 13 (9): 2859–2876. DOI: 10.1021/bm300877d |
| [64] |
杨珊珊, 沙金, 赵海利, 等. 氧化石墨烯掺杂丝素蛋白复合材料的结晶和力学特性[J].
高分子材料科学与工程, 2016, 32 (1): 46–51.
YANG S S, SHA J, ZHAO H L, et al. Crystallinity and mechanical property of silk fibroin/graphene oxide composites[J]. Polymer Materials Science & Engineering, 2016, 32 (1): 46–51. |
| [65] |
方洁羽, 李延报, 李怀栋. 丝素-氧化石墨烯-甘油复合膜的制备及性能[J].
功能高分子学报, 2015, 28 (1): 73–78.
FANG J Y, LI Y B, LI H D. Preparation and properties of silk fibroin-graphene oxide-glycerin composite films[J]. Journal of Functional Polymers, 2015, 28 (1): 73–78. |
| [66] | ZHANG C, ZHANG Y P, LUO J, et al. Microstructural evolution of regenerated silk fibroin/graphene oxide hybrid fibers under tensile deformation[J]. RSC Advances, 2017, 7 (6): 3108–3116. DOI: 10.1039/C6RA22544F |
| [67] |
郭文君, 吴建兵. 丝素蛋白材料在药物控释中的应用[J].
轻工科技, 2017 (5): 23–24.
GUO W J, WU J B. Application of silk fibroin material in controlled release of drugs[J]. Light Industry Science and Technology, 2017 (5): 23–24. |
| [68] | YANG L, ZHENG Z Z, QIAN C, et al. Curcumin-functionalized silk biomaterials for anti-aging utility[J]. Journal of Colloid and Interface Science, 2017, 496 : 66–77. DOI: 10.1016/j.jcis.2017.01.115 |
| [69] |
张桂媛. 丝素蛋白止血材料的制备及其性能研究[D]. 苏州: 苏州大学, 2015. ZHANG G Y. Preparation and properties of silk fibroin hemostatic material[D]. Suzhou: Soochow University, 2015. |
| [70] |
姚康德, 尹玉姬.
组织工程相关生物材料[M]. 北京: 化学工业出版社, 2003: 100-120.
YAO K D, YIN Y J. Biomaterials for tissue engineering[M]. Beijing: Chemical Industry Press, 2003: 100-120. |
| [71] |
郭志豪, 田林强, 刘槃, 等. 丝素蛋白/介孔生物玻璃陶瓷复合材料修复颅骨缺损[J].
中国组织工程研究, 2017, 21 (2): 192–196.
GUO Z H, TIAN L Q, LIU P, et al. Repair of skull defects with silk fibroin/mesoporous glass ceramic composites[J]. Chinese Journal of Tissue Engineering Research, 2017, 21 (2): 192–196. DOI: 10.3969/j.issn.2095-4344.2017.02.006 |
| [72] |
李明, 莫茂松. 基于石墨烯/丝素蛋白的骨组织工程三维多孔支架制备方法: CN201610097176. 2[P]. 2016-06-15. LI M, MO M S. Preparation of three dimensional porous scaffold for bone tissue engineering based on graphene/fibroin: CN201610097176. 2[P]. 2016-06-15. |
| [73] |
胡沐黎. 丝素蛋白-磷酸钙类复合材料在椎体强化以及骨软骨修复中的应用研究[D]. 苏州: 苏州大学, 2016. HU M L. Research on the application of silk fibroin calcium phosphate composite in vertebral augmentation and osteochondral repair[D]. Suzhou: Soochow University, 2016. |
| [74] | ZHANG Y Q. Natural silk fibroin as a support for enzymeimmobilization[J]. Biotechnology Advances, 1998, 16 (5): 961–971. |
| [75] | XU J, TANG T, ZHANG K, et al. Electroenzymatic catalyzed oxidation of bisphenol-a using HRP immobilized on magnetic silk fibroin nanoparticles[J]. Process Biochemistry, 2011, 46 (5): 1160–1165. DOI: 10.1016/j.procbio.2011.02.004 |
| [76] | DELEZUK J, PAVINATTO A, MORAES M, et al. Silk fibroin organization induced by chitosan in layer-by-layer films:application as a matrix in a biosensor[J]. Carbohydrate Polymers, 2017, 155 : 146–151. DOI: 10.1016/j.carbpol.2016.08.060 |
| [77] |
孙越宜, 唐科梦, 杨明英, 等. 丝素蛋白吸附金属离子的性能及其机理的研究[J].
蚕桑通报, 2016, 47 (2): 26–31.
SUN Y Y, TANG K M, YANG M Y, et al. Study of the adsorption and the mechanism of metal ions by fibroin[J]. Bulletin of Sericulture, 2016, 47 (2): 26–31. |
| [78] |
李继丰, 杨震, 彭凤霞, 等. 羧基化棉织物的丝素蛋白接枝改性[J].
印染, 2015 (7): 1–6.
LI J F, YANG Z, PENG F X, et al. Modification of carboxylated cotton fabric with silk fibroin[J]. Shtexcloud, 2015 (7): 1–6. |
| [79] |
李陈梅, 熊佳庆, 张德锁, 等. 丝素纳米银的制备及其对棉织物的改性实验研究[J].
纺织导报, 2014 (1): 102–105.
LI C M, XIONG J Q, ZHANG D S, et al. Preparation of silk fibroin stabilized silver nanoparticles and their application for modification of cotton fabric[J]. China Textile Leader, 2014 (1): 102–105. |
| [80] |
赵林, 林小贞, 赖宏波, 等. 丝素蛋白/TiO2复合催化剂的制备及其可见光催化性能[J].
分子催化, 2014, 28 (3): 275–281.
ZHAO L, LIN X Z, LAI H B, et al. Preparation and visible light photocatalytic activity of silk fibroin/TiO2 nanocomposite[J]. Journal of Molecular Catalysis, 2014, 28 (3): 275–281. |
| [81] | MARELLI B, BRENCKLE M A, KAPLAN D L, et al. Silk fibroin as edible coating for perishable food preservation[J]. Scientific Reports, 2016, 6 : 25263. DOI: 10.1038/srep25263 |
| [82] |
屠洁, 刘冠卉, 燕薇. 4种常用稳定剂和丝素蛋白对搅拌型酸奶黏度和保水性的影响[J].
食品科学, 2012, 33 (21): 136–140.
TU J, LIU G H, YAN W. Effects of four common stabilizers combined with silk fibroin on viscosity and water-holding capacity of stirred yogurt[J]. Food Science, 2012, 33 (21): 136–140. |
| [83] |
赵应征, 鲁翠涛, 肖健, 等. 一种肌肤护理用丝素蛋白水凝胶及其制备方法: CN106420371 A[P]. 2017-02-22. ZHAO Y Z, LU C T, XIAO J, et al. Preparation of skin care silk fibroin hydrogel: CN106420371 A[P]. 2017-02-22. |
| [84] |
曹丽楠, 徐保来. 医用丝素蛋白皮肤再生膜的生物相容性评价[J].
中国组织工程研究, 2016, 20 (25): 3653–3658.
CAO L N, XU B L. Biocompatibility evaluation for skin reproducing membrane of medical fibroin[J]. Chinese Journal of Tissue Engineering Research, 2016, 20 (25): 3653–3658. DOI: 10.3969/j.issn.2095-4344.2016.25.001 |
 2018, Vol. 46
2018, Vol. 46