文章信息
- 葛梦妮, 张建峰, 曹惠杨, 王红兵
- GE Meng-ni, ZHANG Jian-feng, CAO Hui-yang, WANG Hong-bing
- 剥离时间对二维Ti3C2吸附染料污染物性能的影响
- Effect of Etching Time on the Adsorption Performance of Two-dimensional Ti3C2 for Organic Dyes
- 材料工程, 2018, 46(7): 144-150
- Journal of Materials Engineering, 2018, 46(7): 144-150.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2017.000898
-
文章历史
- 收稿日期: 2017-07-13
- 修订日期: 2018-03-07
纺织、造纸等行业排出的废水中含有大量有毒、难降解且致癌的染料分子,极大地威胁着人类的环境安全[1],如何高效、简便地去除及利用废水中的染料污染物成为亟待解决的现实问题。常用的处理染料废水的方法有氧化催化法、离子交换法、生物处理法、吸附法等,其中吸附法具有成本低、去除效果好、操作简单安全等优点[2-3]。而作为决定高效能吸附处理过程的关键因素,吸附剂应具有吸附能力强、化学性质稳定、易回收再生等特点[4]。目前常用的吸附材料有如下几种:活性炭吸附剂、矿物吸附剂、煤及煤渣吸附剂、离子交换树脂吸附剂、天然废料吸附剂等,大多存在吸附效率不足、循环利用率差等问题。因此,开发吸附效果更好、效率更高的吸附剂成为材料和环境领域关注的重点课题之一。
MXenes是一种类石墨烯结构的新型二维过渡金属碳化物或碳氮化物,其化学通式可用Mn+1Xn表示,其中M指过渡族金属(如Ti,Zr,V等),X指C或/和N,n一般为1~3,其可由HF刻蚀三元层状陶瓷材料MAX相的活泼金属层“A”元素而得到,不仅具有高比表面积、高电导率的特点,同时又具备组分灵活可调,最小纳米层厚可控等优势,成为近五年来的研究热点[5-7]。特别是其特殊的片层状结构和较大的比表面积使其具有优异的表面吸附活性,可作为一种应用前景广阔的吸附材料,引起了研究者的广泛兴趣,并取得了一定的研究成果。例如,Ying等[8]发现二维碳化钛可高效还原去除剧毒铬(Ⅵ)的水溶液,Zhang等[9]发现Ti3C2(OH)2能够有效吸附铀酰离子,Peng等[10]发现碱化后的Ti3C2对重金属Pb+具有很好的选择吸附性,其中,对铬离子的理论吸附量达250mg·g-1,对铀酰离子的理论吸附量达595.3mg·g-1,对Pb+进行吸附后排出的水中Pb+含量可符合WHO推荐的饮用水标准。吸附有机染料方面,Mashtalir等[11]研究发现Ti3C2能够吸附有机染料亚甲基蓝,对酸性红80却几乎没有吸附效果。针对二维晶体MXene吸附有机染料的报道较少,而对于构效关系并未有深入的研究[12]。
本研究以HF溶液刻蚀MAX相Ti3AlC2制备不同剥离程度的二维晶体MXene相Ti3C2,并以此为吸附剂,考察了不同剥离时间对微观结构及吸附效能的影响规律。染料废水一般分3种:阳离子型、阴离子型、非离子型,本实验分别研究Ti3C2对使用较为广泛的阳离子型染料亚甲基蓝和阴离子型染料刚果红的吸附效果,旨在比较基于二维Ti3C2吸附阳离子型染料和阴离子型染料的差异,并结合吸附结果建立吸附动力学、吸附等温线模型拟合,分析吸附过程及机理。
1 实验材料与方法 1.1 实验材料Ti3AlC2粉,纯度≥99%,粉体尺寸400目;氢氟酸,分析纯,浓度为40%,阿拉丁-上海晶纯实业有限公司。亚甲基蓝,分析纯,Sigma-Aldrich。刚果红,分析纯,天津市化学试剂研究所。所用仪器为XRD-6000型X射线衍射仪,SSX-550型扫描电子显微镜,TU-1901型紫外-可见分光光度计。
1.2 二维晶体Ti3C2的制备及表征称取一定量Ti3AlC2粉置于试管,缓慢加入10mL 40%的HF溶液,在298K下水浴振荡5,15,120,2880min,然后将样品用去离子水反复离心清洗至上清液接近中性,最后将样品在333K真空干燥箱中烘干备用。为方便分析表述,将实验样品分别进行编号,如表 1所示。
| Label | Material | Etching temperature/K | Etching time/min |
| TC0 | Ti3AlC2 | - | - |
| TC1 | Ti3C2 etched from Ti3AlC2 | 298 | 5 |
| TC2 | Ti3C2 etched from Ti3AlC2 | 298 | 15 |
| TC3 | Ti3C2 etched from Ti3AlC2 | 298 | 120 |
| TC4 | Ti3C2 etched from Ti3AlC2 | 298 | 2880 |
采用X射线衍射仪(XRD)对Ti3AlC2剥离前后样品的晶体结构进行表征,采用扫描电子显微镜(SEM)观察样品的微观结构。采用JADE软件对XRD结果进行物相定性分析和寻峰,其中物相定性分析可确定晶体组成,寻峰操作后选择菜单命令“Report-Peak Search Report”列出寻峰报告,获得峰位角度和晶面间距d值。
1.3 Ti3C2的吸附性能测试采用上述制备的样品为吸附剂对有机染料亚甲基蓝和刚果红进行吸附实验。配制质量浓度为100mg·L-1的刚果红和亚甲基蓝溶液,采用去离子水稀释上述溶液,得到初始质量浓度为50mg·L-1的模拟废液,取50mg的Ti3C2于锥形瓶中,加入50mL一定浓度的模拟废液,置于298K恒温振荡器中,每隔一定时间离心取1mL上清液,稀释5倍后,以去离子水为参比,通过紫外分光光度计测定滤液的吸光度,直至染料吸附达到平衡。根据Lambert-Beer定律,在低浓度时溶液浓度与吸光度呈良好的线性关系。因此,可用相对吸光度值的变化来表征吸附过程中溶液浓度的变化,即吸附量qt为:
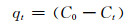
|
(1) |
式中:qt为吸附剂在t时刻的吸附量;C0为吸附质初始浓度;Ct为t时刻吸附质的浓度。
2 结果与分析 2.1 Ti3C2的结构分析图 1为Ti3AlC2剥离前后样品的XRD图谱。由图 1可看出随着剥离时间的延长,Ti3C2的特征峰开始出现,并且(002)峰发生左移,说明层间距增大。当Ti3AlC2用HF刻蚀(2880min)48h之后,Ti3AlC2的特征峰消失,表明Ti3AlC2中的Al原子层被剥离完全,获得了二维晶体Ti3C2。基于布拉格方程,用JADE软件对图 1进行分析,根据寻峰报告可知Ti3AlC2的片层间距d=0.9246nm,腐蚀15min后的Ti3C2的片层间距d=0.9789nm,而腐蚀(2880min)48h后,Ti3C2的片层间距变为d=0.9840nm。Barsoum等[13]通过理论计算,得出单层双面Ti3C2(OH)2的比表面积为483.94m2·g-1,而随着层数的增加比表面积逐渐减小,与层数为倒数关系,而在其前期采用HF腐蚀Ti3AlC2的文献中,得到的比表面积为23m2·g-1[14],这也与我们前期发表的数据相当[15],原因在于片层间未完全打开以及粘连等导致片层面积不能够完全裸露,这在下面的扫描电镜观察中也可以得到证实。

|
图 1 Ti3AlC2剥离前后样品的XRD图谱 Fig. 1 XRD pattern of the samples before and afteretching Ti3AlC2 |
图 2为Ti3AlC2剥离前后样品的SEM图。由图 2可看出Ti3AlC2原粉片层闭合,而随着HF腐蚀剥离时间的延长,片层间距增加,部分片层发生了分离,呈手风琴状结构,因此可以增加实际的比表面积,提供更多的物理空间和活性位点,由此推测其可作为一种较好的吸附材料得以应用。

|
图 2 Ti3AlC2剥离前后样品的SEM图 (a)TC0; (b)TC1; (c)TC2; (d)TC4 Fig. 2 SEM images of the samples before and after etching Ti3AlC2 (a)TC0; (b)TC1; (c)TC2; (d)TC4 |
图 3为TC4对亚甲基蓝、刚果红和去离子水吸附前后的XRD图谱(吸附时间为72h)。由图 3可以看出,吸附前后样品的XRD没有发生明显的变化,二维Ti3C2对有机染料的吸附反应主要发生在表面,吸附的颗粒也没有进入片层中。Mashtalir等在二甲基亚砜(DMSO)改性Ti3C2Tx吸附亚甲基蓝和酸性蓝的实验中发现,吸附时间达到20h后,二维Ti3C2(002)峰的位置向小角度发生了偏移,推测是由于染料分子对层状材料的插层作用以及吸附剂与水的反应导致[11]。而本实验结果发现,即使吸附时间达到72h,所制备的Ti3C2Tx仍然具有很高的结构稳定性,有利于在染料废水处理中的实际应用。

|
图 3 TC4吸附前后的XRD图谱 Fig. 3 XRD patterns before and after TC4 adsorption |
图 4为TC4对亚甲基蓝和刚果红完全吸附后的SEM图。由图 4可以看出,亚甲基蓝和刚果红的颗粒较大,吸附达到平衡时,亚甲基蓝颗粒和刚果红颗粒包覆在Ti3C2粉体表面,未观察到颗粒进入片层中。以亚甲基蓝为例,亚甲基蓝的分子颗粒约为1.70nm×0.76nm×0.325nm(l×w×h)[16],假设亚甲基蓝分子进入二维Ti3C2的片层间距,则剥离前后的片层间距变化至少应为0.325nm,本实验完全剥离前后Δd=0.9840nm-0.9246nm =0.0594nm,无法容纳亚甲基蓝分子,需要增大片层间距才可能让染料分子进入片层。

|
图 4 TC4吸附后的SEM图 (a)MB; (b)CR Fig. 4 SEM images of TC4 after adsorption (a)MB; (b)CR |
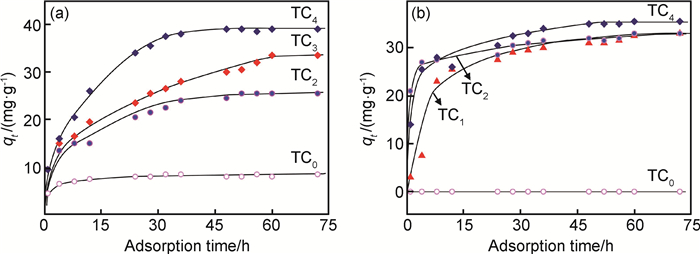
图 5和图 6分别为298K下Ti3AlC2剥离前后样品对亚甲基蓝和刚果红的吸附曲线及吸附量图。对于亚甲基蓝的吸附,随着剥离时间的延长,吸附反应加快,达到平衡的时间缩短,最终平衡吸附量随之增大,剥离15min的Ti3C2对亚甲基蓝的吸附效果仅为剥离48h的Ti3C2的63%左右。而对于刚果红的吸附,稍作剥离的样品即可展现出优异的吸附性能,与吸附亚甲基蓝相比,吸附量增加迅速,2h的吸附量即达到25mg·g-1。随着剥离时间的进一步延长,吸附量增加缓慢,吸附60h后的平衡吸附量仅为35mg·g-1,表明剥离时间对亚甲基蓝吸附具有更明显的影响。亚甲基蓝是典型的阳离子型染料,呈碱性,而刚果红是典型的阴离子型染料,呈弱酸性。本实验处理过的Ti3AlC2剥离后的样品作为HF腐蚀的产物,本身呈弱酸性,随剥离时间延长,酸性增强,故对碱性的亚甲基蓝染料呈现吸附加快的趋势,而对酸性的刚果红的吸附几乎不产生影响。初期对刚果红吸附速率较快,猜测其表面可能存在更多与刚果红结合的活性位点。两种染料吸附速率变化不同,最终平衡吸附量接近,可能与其表面活性位点达到饱和有关。
|
图 5 Ti3AlC2剥离前后样品的吸附曲线 (a)MB; (b)CR Fig. 5 Adsorption curves of the samples before and after etching Ti3AlC2 (a)MB; (b)CR |
|
图 6 Ti3AlC2剥离前后样品的吸附量图 (a)MB; (b)CR Fig. 6 Adsorption amount figures of the samples before and after etching Ti3AlC2 (a)MB; (b)CR |
另外,Mashtalir等[11]用二甲基亚砜插层改性后的Ti3C2对初始浓度为50mg·L-1的亚甲基蓝溶液进行吸附,平衡吸附量为39mg·L-1。而本实验仅通过优化剥离时间和温度等工艺参数,即得到了跟文献类似的具有优异吸附效果的二维Ti3C2样品,避免了复杂的改性处理操作,简单方便,具高结构稳定性,具有更明显的应用前景。
2.3 Ti3C2的吸附动力学为了研究二维Ti3C2对有机染料吸附动力学特征,选用准一级吸附动力学、准二级吸附动力学、颗粒内扩散三种动力学模型进行拟合[17-19]。
准一级吸附动力学方程:ln(qe-qt)=lnqe-k1t
准二级吸附动力学方程:t/qt=1/(k2qe2)+t/qe
颗粒内扩散方程:qt=kst0.5
式中:qe为吸附剂的平衡吸附量,mg·g-1;qt为吸附剂在时间t时的吸附量,mg·g-1;k1为准一级动力学吸附速率常数,1·min-1;k2为准二级动力学吸附速率常数,g·(g·min)-1;ks为颗粒内扩散模型的吸附速率常数,g·(g·min)-0.5。
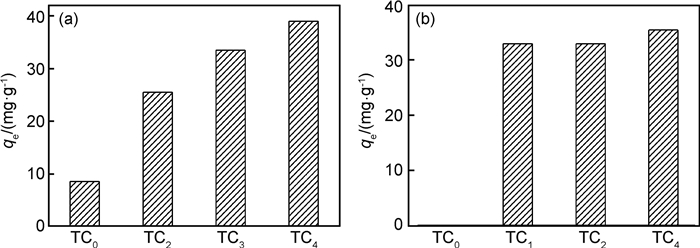
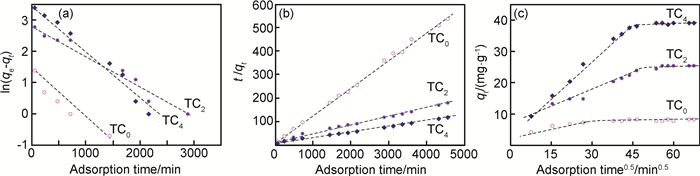
同时用3个方程分别拟合Ti3AlC2剥离前后样品对亚甲基蓝和刚果红的吸附动力学曲线,得到Ti3AlC2剥离前后样品对亚甲基蓝(图 7)和刚果红(图 8)的吸附动力学模型图。通过图 7和图 8的分析可知,二维Ti3C2对亚甲基蓝和刚果红的吸附均符合准二级动力学曲线模型,表明吸附剂存在饱和活性位点,化学吸附是主要吸附机制,吸附中包括外表面扩散、表面吸附以及粉末内扩散等过程,从而影响吸附平衡量,验证图 6所得结果。
|
图 7 Ti3AlC2剥离前后样品吸附MB的动力学模型图 (a)准一级吸附动力学模型; (b)准二级吸附动力学模型; (c)颗粒内扩散模型 Fig. 7 Kinetic model of the samples before and after etching Ti3AlC2 for adsorption of MB solution (a)pseudo-first-order plot; (b)pseudo-second-order plot; (c)intra-particle diffusion kinetic plot |
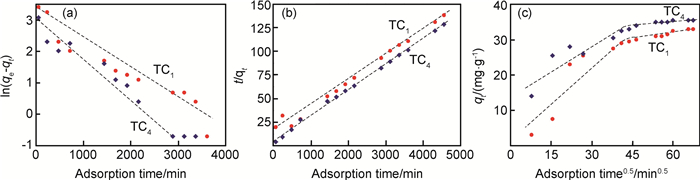
|
图 8 Ti3AlC2剥离后样品吸附CR的动力学模型图 (a)准一级吸附动力学模型; (b)准二级吸附动力学模型; (c)颗粒内扩散模型 Fig. 8 Kinetic model of the samples after etching Ti3AlC2 for adsorption of CR solution (a)pseudo-first-order plot; (b)pseudo-second-order plot; (c)intra-particle diffusion kinetic plot |
为了研究二维Ti3C2对有机染料的等温吸附线,选用Langmuir等温吸附模型和Freundlich等温吸附模型进行拟合[20-21]。
Langmuir吸附等温线方程:
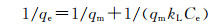
|
Freundlich吸附等温线方程:
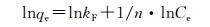
|
式中:qe为吸附剂的平衡吸附量,mg·g-1;Ce为平衡时吸附质在溶液中的浓度,mg·L-1;qm为最大饱和吸附量,mg·g-1;kL为Langmuir吸附平衡常数;kF,n为Freundlich吸附平衡常数。
图 9给出了不同温度下Ti3AlC2剥离后样品对亚甲基蓝和刚果红的吸附等温线。由图 9可以看出,两种物质的吸附量均随初始浓度的增大而增大,随着温度的升高吸附量增多。对于图中的吸附等温线形状进行分析发现,所有曲线基本符合“S”型等温线,曲线向上凸,在低浓度时,吸附的溶质越多,溶质就越容易吸附,表现为协同吸附[22],即吸附剂上被束缚的染料分子间与相邻的染料分子相互作用促进吸附。协同吸附不仅可以提高吸附量,还可在一定程度提高吸附选择性。
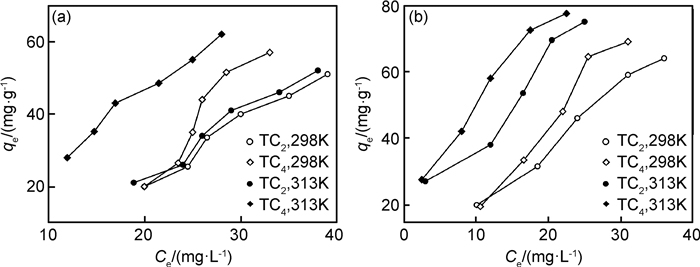
|
图 9 Ti3AlC2剥离后样品的吸附等温线 (a)MB; (b)CR Fig. 9 Adsorption isotherms on the samples after etching Ti3AlC2 (a)MB; (b)CR |
同时用两个方程分别拟合298,313K时Ti3AlC2剥离后样品Ti3C2对亚甲基蓝和刚果红的吸附等温线,各等温式的参数如表 2所示。观察图中的相关系数R2,发现两种模型下的R2均接近于1,故Langmuir和Freundlich方程都能较好地描述Ti3C2对亚甲基蓝和刚果红的吸附。通常情况下,Freundlich常数kF可用来表示吸附能力的相对大小,kF越大,吸附能力越大。从表 2中的kF值可看出,两者kF接近,即在实验范围内,二维Ti3C2对亚甲基蓝的吸附能力与对刚果红的吸附能力相当,与图 6所得最终平衡吸附量相符。
| Sample | T/K | Langmuir(MB) | Freundlich(MB) | Langmuir(CR) | Freundlich(CR) | |||||||||||
| qm/(mg·g-1) | kL | R2 | n | kF | R2 | qm/(mg·g-1) | kL | R2 | n | kF | R2 | |||||
| TC2 | 298 | 68.5 | 0.01 | 0.959 | 2.03 | 6.87 | 0.963 | 55.1 | 0.19 | 0.988 | 2.09 | 15.89 | 0.986 | |||
| 313 | 62.0 | 0.02 | 0.994 | 2.18 | 9.78 | 0.917 | 69.5 | 0.20 | 0.994 | 2.15 | 17.84 | 0.985 | ||||
| TC4 | 298 | 72.8 | 0.01 | 0.966 | 3.03 | 23.04 | 0.960 | 69.0 | 0.20 | 0.938 | 2.08 | 15.82 | 0.950 | |||
| 313 | 72.0 | 0.16 | 0.999 | 3.59 | 26.87 | 0.981 | 81.9 | 0.21 | 0.946 | 2.12 | 17.85 | 0.978 | ||||
(1) 采用HF刻蚀Ti3AlC2可制备层状二维晶体Ti3C2,所得样品具有高结构稳定性。剥离时间可影响制得样品的性能,一定范围内,随着剥离时间的延长,二维晶体Ti3C2片层间距增加,呈手风琴状结构。
(2) 二维Ti3C2作为有机染料吸附剂,对阴、阳离子型染料均具有良好吸附能力,随着剥离时间的增加,吸附量随之提高,最终平衡吸附量接近。其中剥离时间对亚甲基蓝的吸附影响较大,对于刚果红的吸附几乎不产生影响,表现差异性吸附行为。
(3) 从动力学角度分析,二维Ti3C2对刚果红、亚甲基蓝的吸附均符合准二级吸附动力学模型,表明化学吸附是主要吸附机制,吸附中存在饱和活性位点。从吸附等温线角度分析,两种染料的吸附等温线均呈“S”型,表现出协同吸附的作用,两者均满足Langmuir和Freundlich吸附等温线拟合模型,既存在单分子层吸附,也存在多分子层吸附。
| [1] | SEYAHMAZEGI E N, MOHAMMAD-REZAEI R, RAZMI H. Multiwall carbon nanotubes decorated on calcined eggshell waste as a novel nano-sorbent:application for anionic dye congo red removal[J]. Chemical Engineering Research & Design, 2016, 109 : 824–834. |
| [2] | CHATTERJEE S, CHATTERJEE S, CHATTERJEE B P, et al. Adsorptive removal of congo red, a carcinogenic textile dye by chitosan hydrobeads:binding mechanism, equilibrium and kinetics[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2007, 299 (1/3): 146–152. |
| [3] |
王艳春, 曾效舒, 敖志强, 等. 热还原石墨烯的制备及其对重金属Pb2+的吸附性[J].
材料工程, 2017, 45 (10): 6–11.
WANG Y C, ZENG X S, AO Z Q, et al. Preparation of graphene via thermal reduction and its adsorption capacity for heavy metal Pb2+[J]. Journal of Materials Engineering, 2017, 45 (10): 6–11. DOI: 10.11868/j.issn.1001-4381.2016.000815 |
| [4] | LI C, ZHONG H, WANG S, et al. Removal of basic dye (methylene blue) from aqueous solution using zeolite synthesized from electrolytic manganese residue[J]. Journal of Industrial & Engineering Chemistry, 2015, 23 : 344–352. |
| [5] | NAGUIB M, MOCHALIN V N, BARSOUM M W, et al. 25th anniversary article:MXenes:a new family of two-dimensional materials[J]. Advanced Materials, 2014, 26 (7): 982–982. DOI: 10.1002/adma.201470041 |
| [6] | YANG J H, ZHANG S Z, JI J L, et al. Adsorption activities of O, OH, F and Au on two-dimensional Ti2C and Ti3C2 surfaces[J]. Acta Physico Chimica Sinica, 2015, 31 : 369–376. |
| [7] |
张建峰, 曹惠杨, 王红兵. 新型二维材料MXene的研究进展[J].
无机材料学报, 2017, 32 (6): 561–570.
ZHANG J F, CAO H Y, WANG H B. Research progress of novel two-dimensional material MXene[J]. Journal of Inorganic Materials, 2017, 32 (6): 561–570. |
| [8] | YING Y, LIU Y, WANG X, et al. Two-dimensional titanium carbide for efficiently reductive removal of highly toxic chromium(Ⅵ) from water[J]. Acs Applied Materials & Interfaces, 2015, 7 (3): 1795–803. |
| [9] | ZHANG Y J, LAN J H, WANG L, et al. Adsorption of uranyl species on hydroxylated titanium carbide nanosheet:a first-principles study[J]. Journal of Hazardous Materials, 2016, 308 (308): 402–410. |
| [10] | PENG Q, GUO J, ZHANG Q, et al. Unique lead adsorption behavior of activated hydroxyl group in two-dimensional titanium carbide[J]. Journal of the American Chemical Society, 2014, 136 (11): 4113–4116. DOI: 10.1021/ja500506k |
| [11] | MASHTALIR O, COOK K M, MOCHALIN V N, et al. Dye adsorption and decomposition on two-dimensional titanium carbide in aqueous media[J]. Journal of Materials Chemistry A, 2014, 2 (35): 14334–14338. DOI: 10.1039/C4TA02638A |
| [12] |
申长洁, 高誉鹏, 王李波, 等. 二维晶Ti3C2的制备及其对有机染料的吸附性能研究[J].
人工晶体学报, 2016, 45 (7): 1812–1819.
SHENG C J, GAO Y P, WANG L B, et al. Preparation of two-dimensional crystal Ti3C2 and its adsorption property to organic dyes[J]. Journal of Synthetic Crystals, 2016, 45 (7): 1812–1819. |
| [13] | LUKATSKAYA M R, MASHTALIR O, REN C E, et al. Cation intercalation and high volumetric capacitance of two-dimensional titanium carbide[J]. Science, 2013, 341 (6153): 1502–1505. DOI: 10.1126/science.1241488 |
| [14] | MASHTALIR O, NAGUIB M, MOCHALIN V N, et al. Intercalation and delamination of layered carbides and carbonitrides[J]. Nature Communications, 2013, 4 (2): 1–7. |
| [15] | WANG H, ZHANG J, WU Y, et al. Surface modified MXene Ti3C2 multilayers by aryl diazonium salts leading to large-scale delamination[J]. Applied Surface Science, 2016, 384 : 287–293. DOI: 10.1016/j.apsusc.2016.05.060 |
| [16] | HANG P T. Methylene blue absorption by clay minerals. determination of surface areas and cation exchange capacities (clay-organic studies XVⅢ)[J]. Clays & Clay Minerals, 1970, 18 (4): 203–212. |
| [17] | DOGAN M, ALKAN M, DEMIRBAS O, et al. Adsorption kinetics of maxilon blue GRL onto sepiolite from aqueous solutions[J]. Chemical Engineering Journal, 2006, 124 (1/3): 89–101. |
| [18] | HO Y S, CHIANG C C. Sorption studies of acid dye by mixed sorbents[J]. Adsorption-journal of the International Adsorption Society, 2001, 7 (2): 139–147. DOI: 10.1023/A:1011652224816 |
| [19] | UZUN I. Kinetics of the adsorption of reactive dyes by chitosan[J]. Dyes & Pigments, 2006, 70 (2): 76–83. |
| [20] | GAO B, GAO Y, LI Y. Preparation and chelation adsorption property of composite chelating material poly(amidoxime)/SiO2 towards heavy metal ions[J]. Chemical Engineering Journal, 2010, 158 (3): 542–549. DOI: 10.1016/j.cej.2010.01.046 |
| [21] | PICCIN J S, VIEIRA M L G, GONCALVES J O, et al. Adsorption of FD & C red No.40 by chitosan:isotherms analysis[J]. Journal of Food Engineering, 2009, 95 (1): 16–20. DOI: 10.1016/j.jfoodeng.2009.03.017 |
| [22] | GILES C H, D'SILVA A P, EASTON I A. A general treatment and classification of the solute adsorption isotherm part Ⅱ. experimental interpretation[J]. Journal of Colloid & Interface Science, 1974, 47 (3): 766–778. |
 2018, Vol. 46
2018, Vol. 46


