文章信息
- 舒展, 张毅, 谢虹忆, 欧阳静, 杨华明
- SHU Zhan, ZHANG Yi, XIE Hong-yi, OUYANG Jing, YANG Hua-ming
- 硅酸盐黏土矿物在抗菌方面研究进展
- Research Progress of Silicate Clay Minerals in Antibacterial Applications
- 材料工程, 2018, 46(4): 23-30
- Journal of Materials Engineering, 2018, 46(4): 23-30.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2017.000986
-
文章历史
- 收稿日期: 2017-08-10
- 修订日期: 2017-12-14
硅酸盐黏土矿物基抗菌材料是目前新兴的抗菌剂,基于其独特的化学组成成分、形貌结构以及物理化学特性,能够高效抑制某些细菌、真菌、酵母菌、藻类及病毒等微生物的正常增殖,广泛应用于生物医药,污水处理,食品包装等方面[1-4]。一方面,含有Fe,Cu等元素的硅酸盐黏土矿物,渗透液能够破坏革兰氏阳性菌及革兰氏阴性菌细胞膜,同时进入细胞内破坏细胞质,达到抑制细菌增殖的目的[5]。另一方面,硅酸盐黏土矿物表面电荷由晶格取代引起的永久负电荷、矿物边棱价键断裂引起的可变电荷和吸附在其表面腐殖酸电离等不同因素决定,硅酸盐黏土矿物通过物理静电吸附在细菌细胞膜表面,影响细胞通透性,阻碍细菌与外界环境正常的物质交换。
传统抗菌材料主要包含金属氧化物、贵金属等无机抗菌材料[6-9]和天然萃取物、化学合成物类等有机抗菌材料[10-12]。金属氧化物、贵金属等无机纳米抗菌材料能够产生活性氧,氧化破坏细胞膜及细胞质,抑制细菌增殖[13],但纳米颗粒易团聚,难回收,生物毒副作用大[14]。硅酸盐黏土矿物比表面积较大,表面羟基丰富,能够作为载体材料对无机抗纳米菌材料可起到固定和分散的效果,提升无机抗菌材料的抗菌性能[15-17]。有机抗菌剂(如酯类,醇类,有机酸和酚类)能够与细菌表面的阴离子结合,破坏细菌的细胞膜以及细胞蛋白,导致细菌的死亡。但有机抗菌剂易挥发、难回收、稳定性差、毒副作用大等影响了其在工业领域的大范围内使用。黏土矿物形貌结构多样(片状、棒状、管状),比表面积大,能够作为载体材料,提高有机抗菌剂的化学稳定性,降低其毒副作用,并减少环境污染。基于传统抗菌材料目前所存在的问题,本工作通过对硅酸盐黏土矿物的组成结构、物理化学性质及生物相容性的归纳总结,分析了硅酸盐黏土矿物基抗菌材料的抗菌机理及其提升性能的原因,并简单介绍硅酸盐黏土矿物在抗菌薄膜、纤维制品中的应用。
1 硅酸盐黏土简介硅酸盐黏土矿物为天然产出中颗粒最为细小的一类矿物,在自然界中分布广泛,约占岩石圈和风化壳层的一半。颗粒尺寸一般小于0.01mm,主要由硅、氢、氧、铝、镁等元素组成[18],常伴随某些金属杂质元素存在。常见硅酸盐黏土矿物有高岭石、蒙脱石、凹凸棒石、埃洛石等,不同矿物的微观形貌、物相组成以及物理化学性质主要受其沉积地以及周围环境的影响。
1.1 结构形貌硅酸盐黏土矿物是细分散的、含水的层状或层链状构造的硅酸盐矿物及含水的非晶质硅酸盐矿物的总称。硅酸盐黏土矿物经由沉积物风化成岩后,完成元素分配、蚀变富集,形成不同微观形貌结构,常见如纳米管状(埃洛石)、纳米棒状(凹凸棒石)、纳米片状(蒙脱石、高岭土)等。
高岭石和埃洛石同属高岭石族矿物。高岭石是典型的假六方片状硅酸盐黏土矿物,理论结构式为Al4(Si4O10)(OH)8。埃洛石是1:1型层状高岭石卷曲形成的中空管状硅酸盐黏土矿物,理论结构式为Al2Si2O5(OH)4·nH2O (n=0, 2)。蒙脱石是一种含少量碱金属和碱土金属的片层状水铝硅酸盐黏土矿物,理论结构式为(1/2Ca, Na)x(H2O)4{(Al2-xMgx)[Si4O10](OH)2}。凹凸棒石是一种含水富镁的针状硅酸盐黏土矿物,其理论结构式为Mg5(H2O)4[Si4O10]2(OH)2。图 1所示为高岭石、埃洛石、蒙脱石及凹凸棒石的扫描电镜及透射电镜图。不同形貌特征在抗菌复合材料中的作用方式各不相同。管状形貌内表面及片状形貌层间可用于装载有机抗菌剂,实现有机抗菌剂控释目的。管状形貌外表面、棒状形貌外表面及层状形貌表面可用于负载无机抗菌纳米颗粒,达到纳米颗粒均匀分散效果,也可用于有机抗菌制品强度提升。

|
图 1 不同硅酸盐黏土矿物的扫描及透射电镜图 (a)高岭石;(b)埃洛石;(c)蒙脱石;(d)凹凸棒石 Fig. 1 SEM and TEM images of different silicate clay mineral samples (a)kaolin; (b)halloysite; (c)montmorillonite; (d)attapulgite |
硅酸盐黏土矿物比表面积主要受矿物种类、有机质含量、水分含量及后期处理等多种因素影响。不同种类矿物的微观形貌,孔层大小及分布为影响比表面积的主要因素。矿物表面吸附的有机物也会影响其比表面积,有机质能够在其表面形成纳米空隙,增大其比表面积。硅酸盐黏土矿物具有较强的吸水性,表面吸附的水分子会降低自身的比表面积。后期处理也会极大影响比表面积,如通过稀硫酸或者稀盐酸浸渍,硅酸盐黏土矿物表面腐蚀形成大量的微孔结构,比表面积明显增大[19]。表 1总结了4种硅酸盐黏土矿物的比表面积、孔径体积及孔径大小。硅酸盐黏土矿物的比表面积及孔结构特征影响其装载功能组分的形式及负载量。大的比表面积及丰富的孔结构,能够为无机纳米颗粒及有机抗菌剂提供丰富负载位点,增强有机抗菌剂包埋率及控释能力,提升无机纳米颗粒分散固定效果及抗菌效率。
硅酸盐黏土矿物正电荷和负电荷的代数为其净电荷,黏土种类决定黏土带电量,黏土介质决定电荷性质。蒙脱石结构中的Si4+常被Al3+置换,Al3+常被Mg2+,Fe2+等低价阳离子置换,从而使蒙脱石层间产生多余的永久负电荷。硅酸盐黏土矿物在分散过程中边棱破键,断裂处在不同pH值介质环境中吸附H+带上正电荷或者负电荷。硅酸盐黏土表面吸附的腐殖酸中含有的羧基(—COOH)和羟基(—OH)的H+解离会使黏土板面带有负电荷。纵观硅酸盐黏土矿物带电的种种原因,带负电的机会远大于正电荷,且黏土体系一般呈碱性,因此一般带负电荷。硅酸盐黏土矿物表面电荷带电量及正负电性特征影响有机抗菌剂包埋及无机纳米颗粒固定效果,表面电荷调控,可实现有机抗菌剂控释及无机纳米颗粒均匀分散,同时对异号电荷的静电吸附作用也会受硅酸盐黏土矿物表面电荷调控的影响。
1.3 生物相容性硅酸盐黏土矿物在催化材料[23-24],生物医药材料[25-27],抗菌材料[28-29]有着广泛应用,但同时,硅酸盐黏土矿物的生物相容性、毒副作用及对环境污染性也引起了普遍关注[30-32]。动植物正常细胞表面带负电荷且生存环境偏中性和碱性,硅酸盐黏土矿物在中性和碱性环境下一般带负电荷,由于静电排斥作用,硅酸盐黏土材料对正常细胞接触破坏较小。黏土纳米微观形貌较小,能够被免疫巨噬细胞吞噬,石棉的毒性主要是因为其数十微米的纤维长度,容易造成细胞损伤和炎症反应[33]。硅酸盐黏土矿物的主要成分为SiO2,其生物毒副性较小,因此其对正常细胞生物毒副作用较小。黏土中所含的Al元素对细胞有一定的毒副作用,高浓度的黏土长时间与细胞接触会抑制细胞的正常增殖,同时黏土的生物降解性较低,因此不能够作为静脉注射药物。
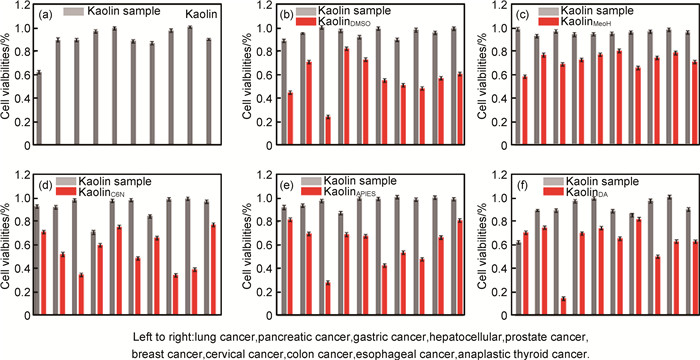
图 2为10种癌细胞生物毒性实验。Zhang等[25]以十种癌细胞为研究对象,探索高岭土和高岭土基复合材料的生物兼容性。从图 2可以看出,200μg/mL高岭土对癌细胞的生长抑制最高达到85%,复合材料对癌细胞的抑制最高仅有70%。高岭土基复合材料较好的生物相容性,可在载药传输体系和生物组织工程有广泛的应用。
|
图 2 高岭土及高岭土基复合材料(200μg/mL)对10种癌症细胞生物相容性[25] (a)高岭土; (b)高岭土-DMSO; (c)高岭土-MeOH; (d)高岭土-C6N;(e)高岭土-APTES; (f)高岭土-DA Fig. 2 Viabilities of ten model cell cultures when incubated with Kaolin, Kaolin intercalation compounds at the concentration of 200μg/mL[25] (a)Kaolin; (b)Kaolin-DMSO; (c)Kaolin-MeOH; (d)Kaolin-C6N;(e)Kaolin-APTES; (f)Kaolin-DA |
Li等[34]探究单片层状蒙脱石的生物毒副作用。DNA损伤率实验表明,不同浓度(62.5,125,250,500,1000μg/mL)单片层状蒙脱石24h下对小鼠细胞DNA均没有明显损伤。细胞毒性实验(MTT细胞毒性实验、LDH细胞毒性实验)结果表明,只有1000μg/mL的单片层状蒙脱石在与细胞接触大于24h,才会对细胞造成微量的损伤。5种沙门氏菌埃姆斯实验表明,单片层状蒙脱石对细胞无基因毒性,不会导致沙门氏菌的基因突变。Vergaro等[35]探究埃洛石对人体乳腺癌和宫颈癌细胞的细胞相容性,台酚蓝不相容实验表明,当浓度为50μmg/mL,处理48h时,两种细胞损失率约为10%,对细胞损伤较少。浓度超过100μg/mL和72h处理下,细胞损失率可达到50%。这是因为埃洛石外表面主要是由二氧化硅组成,其负电性以及低生物毒性不会对细胞造成危害,同时埃洛石尺寸只有0.5~1.5μm,能够被免疫巨噬细胞吞噬除去。
2 硅酸盐黏土抗菌机理 2.1 物理吸附受晶格取代、矿物边棱价键断裂,黏土表面腐殖酸电离及碱性黏土体系等多种因素影响,硅酸盐黏土矿物一般带负电荷。细菌细胞壁成分主要含有磷壁酸,磷酸基团,脂肪酸链等,同时表面含羧基,羟基等,所以表面带负电荷。通过有机改性调节硅酸盐黏土矿物表面电荷,可增强其与细菌细胞膜界面关系,阻止细菌与外界环境的物质交换,达到抗菌目的。
Malek等[36]将高岭石在不同浓度溴化十六烷基吡啶浸渍得到改性高岭石,并探究高岭石表面电荷及其对抗菌性能的影响。结果表明,当溴化十六烷基吡啶浓度增加到1.5mmoL/L时,高岭石表面电荷由-10mV调节为20mV,抑菌圈直径由0mm提高到1.4mm。继续增大溴化十六烷基吡啶浓度,高岭石表面电荷值不变,抗菌性能亦保持不变。Wu等[37]用十四烷基三丁基溴化膦调节4种不同黏土表面电荷并探究抗菌性能,如表 2所示蒙脱石、蛭石、凹凸棒石、高岭石改性前后表面电荷分别为-36.9,-37.7,-31.2,-39.1mV和2.3,-1.8,-16.1,0.2mV,有机改性后的黏土对大肠杆菌和金黄色葡萄球菌的最小抑菌浓度分别为200,750,800,200mg/L和80,120,150,100mg/L。硅酸盐黏土矿物对大肠杆菌和金黄色葡萄球菌抗菌性能随黏土表面正电荷增大而增强,蒙脱石抗菌性能最强。进一步以高岭石为例,观察黏土与细胞表界面关系,带正电荷的高岭石聚集在细胞周围与细胞膜接触,阻止细胞与外界进行正常物质交换。
| Sample | Zeta potential/mV | Minimal inhibitory concentration/(mg·L-1) | |
| E.coli | S.aureus | ||
| Kaolin | -39.1±3.2 | >10000 | >10000 |
| Org-kaolin | 0.2±2.9 | 400±40 | 100±15 |
| Montmorillonite | -36.9±1.7 | >10000 | >10000 |
| Org-montmorillonite | 2.3±3.2 | 200±20 | 80±15 |
| Vermiculite | -37.3±2.7 | >10000 | >10000 |
| Org-vermiculite | -1.8±1.8 | 750±30 | 120±25 |
| Attapulgite | -31.2±2.1 | >10000 | >10000 |
| Org-attapulgite | -16.1±2.4 | 800±50 | 150±20 |
硅酸盐黏土矿物主要含硅、氢、氧、铝、镁等元素,受沉积地和周围环境影响,部分黏土中存在杂质元素如铁、铜等。黏土浸出液中所含的铁、铜等抑菌元素能够产生活性氧,破坏细胞膜和细胞质,有效抑制细菌的生长。
Williams等[38]以太平洋沿岸的一种黏土为例探究黏土的抗菌性能,黏土孔层内吸附有Fe,Cu,Mg,Al等抑菌元素。黏土浸出液处理后的大肠杆菌整体的Fe,Al元素质量分数分别是空白组的20倍和4倍,黏土浸出液处理后的大肠杆菌细胞质的Fe,Al元素质量分别是空白组的8倍和2倍。过量的Al元素与大肠杆菌细胞膜结合,增大细胞膜通透性。Fe元素进入细胞,破坏细胞质。Londono等[39]以亚马逊河流黏土为例,主要成分为高岭土(29%)、埃洛石(15%)、蒙脱石(30%)、白云母(7%)以及石英相(15%),进一步探索了含铝、铁型混合黏土(AMZ)的抗菌性能。黏土对大肠杆菌的最小抑菌浓度(MIC)和最小杀菌浓度(MBC)分别为80mg/mL和100mg/mL。表 3为抗菌过程前后AMZ与大肠杆菌的元素组成[39]。抗菌过程中,大肠杆菌表面的Al,Fe,Cu元素增加了7131,1149,21μg/mL。大肠杆菌表面P元素从8826μg/mL降低到4663μg/mL,同时证明了细胞膜通透性的增大。Al元素靶向作用于细菌细胞膜上的磷酸盐分子,使得细胞膜上磷脂发生过氧化反应,破坏细胞膜表面,增大细胞膜的通透性[40]。细胞膜通透性增大,Fe,Cu等元素进入细胞质中产生活性氧,对蛋白质,DNA,生物酶等进行破坏[41],达到抗菌的目的。
| Element | Control AMZ | Reacted AMZ | Change in AMZ | Control E.coil | Reacted E.coil | Change in E.coil |
| Al | 1411138 | 103625 | -37513 | 34 | 7166 | 7131 |
| Fe | 22084 | 16486 | -5598 | 82 | 1231 | 1149 |
| Cu | 82.5 | 52.1 | -30.4 | 3.88 | 24.87 | 21 |
| K | 9167 | 7171 | -1996 | 1965 | 741 | -1224 |
| Ti | 4061 | 3218 | -843 | 13 | 24 | 10 |
| Mg | 3595 | 2259 | -1336 | 562 | 264 | -298 |
| Ca | 1348 | 454 | -894 | 15 | 69 | 54 |
| P | 150 | 1117 | 967 | 8826 | 4663 | -4163 |
应用于抗菌材料的金属及金属氧化物包括金、银、二氧化钛、氧化锌、氧化铜、氧化铈、氧化亚铁等纳米颗粒。金属单质纳米颗粒与金属氧化物纳米颗粒抗菌机理分别为金属离子接触抗菌和活性氧抗菌。天然硅酸盐黏土矿物对纳米颗粒的形貌尺寸及分散固定有较大的影响,纳米颗粒尺寸与其抗菌效果成反比,纳米颗粒分散固定与抗菌效果成正比。同时,纳米颗粒回收、生物毒性等问题也受到天然硅酸盐黏土矿物的影响。
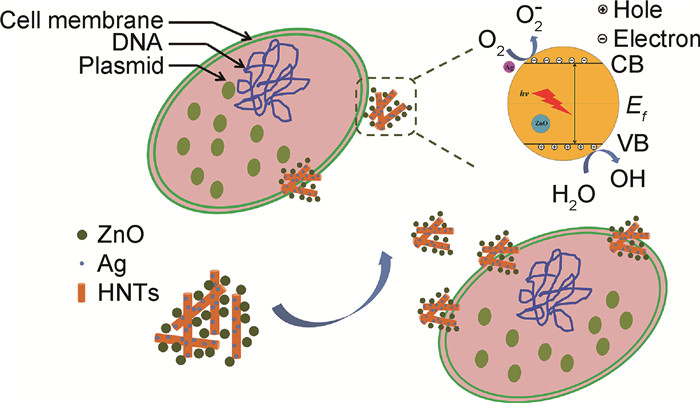
Shu等[16]以埃洛石作为载体材料,研究氧化锌和银纳米颗粒在埃洛石表面的分散特征及抗菌机理。图 3为复合材料抗菌机理增强示意图,管状埃洛石大比表面积为纳米氧化锌和银纳米颗粒提供负载位点,有效缓解纳米颗粒团聚现象,提升纳米颗粒抗菌性能。同时,基于埃洛石的亲水性,埃洛石能够使其表面氧化锌及银纳米可以更多地聚集在大肠杆菌表面,产生更多的活性氧抑制细菌的正常增殖。
Jiang等[42]以蒙脱石为载体,研究银纳米颗粒在蒙脱石表面的分散特征及抗菌机理。蒙脱石的大比表面积为银纳米颗粒起到很好的固定作用。同时,蒙脱石表面正电荷对异号电荷细胞产生物理吸附作用,增强复合材料与细胞的表界面关系,提升复合材料抗菌性能。Motshekga等[43]进一步研究了银-氧化锌-膨润土复合材料生物安全性。离子浸出量数据表明,氧化锌/膨润土和银/膨润土的锌离子和银离子浸出量在长达12h下,分别为0.71mg/L和0.011mg/L,氧化锌-银/膨润土二元抗菌复合材料的锌离子和银离子浸出量为0.4mg/L和 < 0.005mg/L,均符合世界卫生组织饮用水安全标准。
硅酸盐黏土矿物大比表面积可以有效分散纳米颗粒,提高抗菌复合材料抗菌效果。表面电荷特征可以增强与异号电荷细胞物理吸附作用,增强复合材料与细胞的表界面作用。表面丰富羟基可以与金属及金属氧化物纳米颗粒形成稳定的键合,提高抗菌复合材料的抗菌稳定性。同时,黏土基复合抗菌材料保证抗菌效果的前提下降低纳米颗粒使用量,明显降低纳米颗粒生物毒副作用。
3.2 黏土基有机抗菌复合材料有机抗菌剂包括天然提取物如甲壳素、芥末、蓖麻油、山葵等,合成化合物如香草醛、乙基香草醛类等。有机抗菌剂抗菌性能强,但热稳定性差,易泄漏且生物毒副性较大。硅酸盐黏土矿物表面羟基及其电荷特征,可实现有机抗菌剂控制释放,提高抗菌复合材料的抗菌稳定性。硅酸盐黏土矿物的多样形貌和孔径结构特征,可实现有机抗菌剂包埋,降低抗菌复合材料生物毒副作用[44]。
Sun等[45]基于埃洛石管状形貌和管内(24mV)、管外(-35mV)的不同表面电荷,于管内外分别装载脂肪酶和溶解酶素,研究管状形貌对有机抗菌剂的保护作用。相比无纳米管保护,管内脂肪酶在60℃和80℃时的生物活性分别提升10%和25%,pH值为4和10时的生物活性分别提升10%和50%。Cai等[46]以装载抗菌剂季鏻盐的凹凸棒石基抗菌复合材料为研究对象,探究硅酸盐黏土矿物基复合抗菌材料的生物安全性。复合材料抗菌效果与季鏻盐装载量成正比,凹凸棒石腔体内的保护能够固定季鏻盐,复合材料长达70h的季鏻盐释放量不高于35%,有效提高抗菌复合材料生物安全性。季鏻盐对正常细胞的损伤率高达90%,复合材料对正常细胞损伤率最高仅达50%。
4 复合抗菌材料抗菌制品目前硅酸盐黏土矿物基抗菌材料主要用于棉布、薄膜等生活用品,用于降低病菌的交叉感染与传播。硅酸盐黏土矿物基抗菌制品的安全性能、机械强度及使用寿命得到明显改善,完全满足当下薄膜、纤维、棉布等抗菌制品的工业机械强度标准[47-50]。
Ui-islam等[51]将细菌纤维素膜在不同阳离子蒙脱石溶液中浸渍并探究复合材料的抗菌性能。复合材料抗菌性能主要依赖阳离子改性蒙脱石中阳离子释放直接抗菌作用及黏土对细菌吸附作用,且铜离子改性蒙脱石对细菌纤维素膜抗菌性能影响效果最明显。其优异的生物相容性、抗菌活性及机械强度,可被用作伤口临时包扎。Gorrasi等[52]研究迭迭香精油/埃洛石复合抗菌粉末对果胶薄膜的力学性能影响。复合抗菌粉末含量为5%和10%时,弹性模量和拉伸强度有明显增加。复合抗菌粉末含量增加至20%时力学性能下降,是由于复合粉末过量添加时,在果胶薄膜中分散性不均一造成的应力集中,导致机械强度减小。Maryan等[53]基于黏土对细菌的吸附杀菌作用,研究有机改性蒙脱石基抗菌棉布的抗菌稳定性,抗菌棉布长达50次的洗涤对制品抗菌性能影响不到40%。
5 结束语目前,硅酸盐黏土矿物抗菌材料的基础研究重点集中在黏土表面状态(元素分布、电荷特征、亲疏水性、吸附性能)与抗菌活性的内在关系,如组成成分中Al,Fe,Cu等元素渗透抗菌机理,表面电荷调控增强静电吸附及实现有机抗菌剂控释,形貌特征解决无机纳米颗粒分散及生物毒性降低。同时,硅酸盐黏土抗菌材料的应用研究重点集中在硅酸盐黏土矿物的添加量、添加方式等对抗菌制品抗菌活性及抗菌稳定性(耐热性、耐光性、溶出性)的影响。本文综述物理化学特征、复合材料作用机理及抗菌制品性能的相互关系,基于硅酸盐黏土矿物物理化学特征,分析其与功能组分的结合方式,探讨其对抗菌制品性能的影响。对于提高我国抗菌材料基础研究水平,推动化学、材料学及微生物学学等学科交叉具有重要意义。
| [1] | BIDDECI G, CAVALLARO G, BLASI F D, et al. Halloysite nanotubes loaded with peppermint essential oil as filler for functional biopolymer film[J]. Carbohydrate Polymers, 2016, 152 : 548–557. DOI: 10.1016/j.carbpol.2016.07.041 |
| [2] |
邓城, 漆小鹏, 李倩, 等. 沉淀法与水热法合成载银羟基磷灰石及其抗菌性能[J].
材料工程, 2017, 45 (4): 113–120.
DENG C, QI X P, LI Q, et al. Synthesis and antibacterial property of silver doped hydroxyapatatie by precipitation and hydrothermal method[J]. Journal of Materials Engineering, 2017, 45 (4): 113–120. DOI: 10.11868/j.issn.1001-4381.2016.000319 |
| [3] | BEHROOZIAN S, SVENSSONS L, DAVIES J. Kisameet clay exhibits potent antibacterial activity against the ESKAPE pathogens[J]. MBIO, 2016, 7 (1): e01842–15. |
| [4] |
李雅琳, 张健, 平清伟, 等. 硅藻土基无机抗菌材料的制备与性能[J].
材料工程, 2016, 44 (3): 72–76.
LI Y L, ZHANG J, PING Q W, et al. Preparation and properties of diatomite based antibacterial inorganic material[J]. Journal of Materials Engineering, 2016, 44 (3): 72–76. DOI: 10.11868/j.issn.1001-4381.2016.03.012 |
| [5] | MORRISON K D, MISRA R, WILLIAMS L B. Unearthing the antibacterial mechanism of medicinal clay:ageochemical approach to combating antibiotic resistance[J]. Scientific Reports, 2016, 6 : 19043. DOI: 10.1038/srep19043 |
| [6] | XU W R, XIE W J, HUANG X Q, et al. The graphene oxide and chitosan biopolymer loads TiO2 for antibacterial and preservative research[J]. Food Chemistry, 2017, 221 : 267–277. DOI: 10.1016/j.foodchem.2016.10.054 |
| [7] |
高党鸽, 陈琛, 吕斌, 等. 原位制备季铵盐聚合物/纳米ZnO复合抗菌剂[J].
材料工程, 2015, 43 (6): 38–45.
GAO D G, CHEN C, LV B, et al. Synthesis polymer quaternary ammonium salt/nano-ZnO composite antibacterial agent via in-situ method[J]. Journal of Materials Engineering, 2015, 43 (6): 38–45. DOI: 10.11868/j.issn.1001-4381.2015.06.007 |
| [8] | AZAM A, AHMED A S, OVES M, et al. Antimicrobial activity of metal oxide nanoparticles against gram-positive and gram-negative bacteria:a comparative study[J]. International Journal of Nanomedicine, 2012, 7 : 6003–6009. |
| [9] |
叶伟杰, 陈楷航, 蔡少龄, 等. 纳米银的合成及其抗菌应用研究进展[J].
材料工程, 2017, 45 (9): 22–30.
YE W J, CHEN K H, CAI S L, et al. Progress in research on systhesis and antibacterial applications of silver nanoparticles[J]. Journal of Materials Engineering, 2017, 45 (9): 22–30. DOI: 10.11868/j.issn.1001-4381.2015.001177 |
| [10] | MUCCI M, NOYMA N P, DEMAGALHAES L, et al. Chitosan as coagulant on cyanobacteria in lake restoration management may cause rapid cell lysis[J]. Water Research, 2017, 118 : 121–130. DOI: 10.1016/j.watres.2017.04.020 |
| [11] | WANG H, WANG Z M, YAN X, et al. Novel organic-inorganic hybrid polyvinylidene fluoride ultrafiltration membranes with antifouling and antibacterial properties by embedding N-halamine functionalized silica nanospheres[J]. Journal of Industrial and Engineering Chemistry, 2017, 52 : 295–304. DOI: 10.1016/j.jiec.2017.03.059 |
| [12] | IOANNIDOU E, FRONTISTIS Z, ANTONOPOULOU M, et al. Solar photocatalytic degradation of sulfamethoxazole overtungsten-modified TiO2[J]. Chemical Engineering Journal, 2017, 318 : 143–152. DOI: 10.1016/j.cej.2016.06.012 |
| [13] | LI Y, ZHANG W, NIU J F. Mechanism of photogenerated reactive oxygen species and correlation with the antibacterial properties of engineered metal-oxide nanoparticles[J]. ACS Nano, 2012, 6 (6): 5164–5173. DOI: 10.1021/nn300934k |
| [14] | XIA T, KOVOCHICH M, LIONG M. Comparison of the mechanism of toxicityof zinc oxide and cerium oxide nanoparticles based on dissolution and oxidative stress properties[J]. ACS Nano, 2008, 2 (8): 2121–2134. |
| [15] | SHU Z, ZHANG Y, OUYANG J, et al. Characterization and synergetic antibacterial properties of ZnO and CeO2 supported by halloysite[J]. Applied Surface Science, 2017, 420 : 833–838. DOI: 10.1016/j.apsusc.2017.05.219 |
| [16] | SHU Z, ZHANG Y, YANG Q, et al. Halloysite nanotubes supported Ag and ZnO nanoparticles with synergisticallyenhanced antibacterial activity[J]. Nanoscale Research Letters, 2017, 12 (1): 135. DOI: 10.1186/s11671-017-1859-5 |
| [17] | HUO C L, YANG H M. Synthesis and characterization of ZnO/palygorskite[J]. Applied Clay Science, 2010, 50 (3): 362–366. DOI: 10.1016/j.clay.2010.08.028 |
| [18] | HU P W, YANG H M. Insight into the physicochemical aspects of Kaolins with different morphologies[J]. Applied Clay Science, 2013, 74 : 58–65. DOI: 10.1016/j.clay.2012.10.003 |
| [19] | NIU M Y, YANG H M, ZHANG X C, et al. Amine-impregnated mesoporous silica nanotube as an emerging nanocomposite for CO2 capture[J]. ACS Applied Materials & Interfaces, 2016, 8 (27): 17312–17320. |
| [20] | LONG H, WU P X, ZHU N W. Evaluation of Cs+ removal from aqueous solution by adsorption ethylamine-modified montmorillonite[J]. Chemical Engineering Journal, 2013, 225 : 237–244. DOI: 10.1016/j.cej.2013.03.088 |
| [21] | AYODELE O B, HAMEED B H. Development of kaolinite supported ferric oxalate heterogeneous catalyst for degradation of 4-nitrophenol in photo-fenton process[J]. Applied Clay Science, 2013, 83/84 : 171–181. DOI: 10.1016/j.clay.2013.08.019 |
| [22] | PAPOULIS D, KOMARNENI S, NIKOLOPOULOU A, et al. Palygorskite-and halloysite-TiO2 nanocomposites:synthesis and photocatalytic activity[J]. Applied Clay Science, 2010, 50 (1): 118–124. DOI: 10.1016/j.clay.2010.07.013 |
| [23] | PENG K, FU L J, OUYANG J, et al. Emerging parallel dual 2D composites:natural clay mineral hybridizing MoS2 and interfacial structure[J]. Advanced Functional Materials, 2016, 26 : 2666–2675. DOI: 10.1002/adfm.v26.16 |
| [24] | PENG K, FU L J, YANG H M, et al. Hierarchical MoS2 intercalated clay hybrid nanosheets with enhanced catalytic activity[J]. Nano Research, 2017, 10 (2): 570–583. DOI: 10.1007/s12274-016-1315-3 |
| [25] | ZHANG Y, LONG M, HUANG P, et al. Intercalated 2D nanoclay for emerging drug delivery in cancer therapy[J]. Nano Research. DOI: 10.1007/s12274-017-1466-x. |
| [26] | ZHANG Y, LONG M, HUANG P, et al. Emerging integrated nanoclay-facilitated drug delivery system for papillary thyroid cancer therapy[J]. Scientific Reports, 2016, 6 : 33335. DOI: 10.1038/srep33335 |
| [27] | YANG J, WU Y P, SHEN Y, et al. Enhanced therapeutic efficacy of doxorubicin for breast cancer using chitosan oligosaccharide-modified halloysite nanotubes[J]. ACS Applied Materials & Interfaces, 2016, 8 (40): 26578–26590. |
| [28] | PING Y, HU X R, YAO Q, et al. Engineering bioinspired bacteria-adhesive clay nanoparticles with a membrane-disruptive property for the treatment of helicobacter pylori infection[J]. Nanoscale, 2016, 8 (36): 16486–16498. DOI: 10.1039/C6NR05551F |
| [29] | LONG M, ZHANG Y, SHU Z, et al. Fe2O3 nanoparticles anchored on 2D kaolinite with enhanced antibacterial activity[J]. Chemical Communications, 2017, 53 (46): 6255–6258. DOI: 10.1039/C7CC02905E |
| [30] | SANCHEZ-FERNANDEZ A, PENA-PARAS L, VIDALTAMAYO R, et al. Synthesization, characterization, and in vitro evaluation of cytotoxicity of biomaterials based on halloysite nanotubes[J]. Materials, 2014, 7 (12): 7770–7780. DOI: 10.3390/ma7127770 |
| [31] | TOYOTA Y, MATSUURA Y, ITO M, et al. Cytotoxicity of natural allophane nanoparticles on human lung cancer A549 cells[J]. Applied Clay Science, 2017, 135 : 485–492. DOI: 10.1016/j.clay.2016.10.037 |
| [32] | HUANG B, LIU M X, LONG Z R, et al. Effects of halloysite nanotubes on physical properties and cytocompatibility of alginate composite hydrogels[J]. Materials Science & Engineering C, 2017, 70 : 303–310. |
| [33] | WIESSNER J H, MANDEL N S, SOHNLE P G, et al. Effect of particle size on quartz-induced hemolysis and on lung inflammationand fibrosis[J]. Experimental Lung Research, 1989, 15 : 801–812. DOI: 10.3109/01902148909069627 |
| [34] | LI P R, WEI J C, CHIU Y F, et al. Evaluation on cytotoxicity and genotoxicity of the exfoliated silicate nanoclay[J]. ACS Applied Materials & Interfaces, 2010, 2 (6): 1608–1613. |
| [35] | VERGARO V, ABDULLAYEV E, LVOV Y M. Cytocompatibility and uptake of halloysite clay nanotubes[J]. Biomacromolecules, 2010, 11 : 820–826. DOI: 10.1021/bm9014446 |
| [36] | MALEK N A N N, RAMLI N I. Characterization and antibacterial activity of cetylpyridinium bromide (CPB) immobilized on kaolinite with different CPB loadings[J]. Applied Clay Science, 2015, 109/110 : 8–14. DOI: 10.1016/j.clay.2015.03.007 |
| [37] | WU T, XIE A G, TAN S Z, et al. Antimicrobial effects of quaternary phosphonium salt intercalated clay minerals on escherichia coli and staphylococci aureus[J]. Colloids and Surfaces B, Biointerfaces, 2011, 86 (1): 232–236. DOI: 10.1016/j.colsurfb.2011.04.009 |
| [38] | WILLIAMS L B, METGE D W, EBERL D D, et al. What makes a natural clay antibacterial?[J]. Environmental Science & Technology, 2011, 45 (8): 3768–3773. |
| [39] | LONDONO S C, HARTNETT H E, WILLIAMS L B. Antibacterial activity of aluminum in vlay from the colombian amazon[J]. Environmental Science & Technology, 2017, 51 (4): 2401–2408. |
| [40] | LUQUE N B, MUJIKA J I, REZABAL E, et al. Mapping the affinity of aluminum(Ⅲ) for biophosphates:interaction mode and binding affinity in 1:1 complexes[J]. Physical Chemistry Chemical Physics, 2014, 16 (37): 20107–20119. DOI: 10.1039/C4CP02770A |
| [41] | WARNES S L, CAVES V, KEEVIL C W. Mechanism of copper surface toxicity in escherichia coli O157:H7 and salmonella involves immediate membrane depolarization followed by slower rate of DNA destruction which differs from that observed for Gram-positive bacteria[J]. Environmental Microbiology, 2012, 14 (7): 1730–1743. DOI: 10.1111/j.1462-2920.2011.02677.x |
| [42] | JIANG J, ZHANG C, ZENG G M, et al. The disinfection performance and mechanisms of Ag/lysozyme nanoparticles supported with montmorillonite clay[J]. Journal of Hazardous Materials, 2016, 317 : 416–429. DOI: 10.1016/j.jhazmat.2016.05.089 |
| [43] | MOTSHEKGA S C, RAY S S, ONYANGO M S, et al. Microwave-assisted synthesis, characterization and antibacterial activity of Ag/ZnO nanoparticles supported bentonite clay[J]. Journal of Hazardous Materials, 2013, 262 : 439–446. DOI: 10.1016/j.jhazmat.2013.08.074 |
| [44] | IBARGUREN C, NARANJO P M, STOTZEL C, et al. Adsorption of nisin on raw montmorillonite[J]. Applied Clay Science, 2014, 90 : 88–95. DOI: 10.1016/j.clay.2013.12.031 |
| [45] | SUN J J, YENDLURI R, LIU K, et al. Enzyme-immobilized clay nanotube-chitosan membranes with sustainable biocatalytic activities[J]. Physical Chemistry Chemical Physics, 2017, 19 (1): 562–567. DOI: 10.1039/C6CP07450B |
| [46] | CAI X, ZHANG J L, OUYANG Y, et al. Bacteria-adsorbed palygorskite stabilizes the quaternary phosphonium salt with specific-targeting capability, long-term antibacterial activity, and lower cytotoxicity[J]. Langmuir, 2013, 29 (17): 5279–5285. DOI: 10.1021/la400824f |
| [47] | SADEGH-HASSANI F, MOHAMMADI NAFCHI A. Preparation and characterization of bionanocomposite films based on potato starch/halloysite nanoclay[J]. International Journal of Biological Macromolecules, 2014, 67 : 458–462. DOI: 10.1016/j.ijbiomac.2014.04.009 |
| [48] | MARTUCCI J F, RUSECKAITE R A. Antibacterial activity of gelatin/copper (Ⅱ)-exchanged montmorillonite films[J]. Food Hydrocolloids, 2017, 64 : 70–77. DOI: 10.1016/j.foodhyd.2016.10.030 |
| [49] | ABREU A S, OLIVEIRA M, DES A, et al. Antimicrobial nanostructured starch based films for packaging[J]. Carbohydrate Polymers, 2015, 129 : 127–134. DOI: 10.1016/j.carbpol.2015.04.021 |
| [50] | MAKAREMI M, PASBAKHSH P, CAVALLARO G, et al. Effect of morphology and size of halloysite nanotubes on functional pectin bionanocomposites for food packaging applications[J]. ACS Applied Materials & Interfaces, 2017, 9 (20): 17476–17488. |
| [51] | UI-ISLAM M, KHAN T, KHATTAK W A, et al. Bacterial cellulose-MMTs nanoreinforced composite films[J]. Cellulose, 2013, 20 : 589–596. DOI: 10.1007/s10570-012-9849-3 |
| [52] | GORRASI G. Dispersion of halloysite loaded with natural antimicrobials into pectins:characterization and controlled release analysis[J]. Carbohydrate Polymers, 2015, 127 : 47–53. DOI: 10.1016/j.carbpol.2015.03.050 |
| [53] | MARYAN A S, MONTAZER M. Natural and organo-montmorillonite as antibacterial nanoclays for cotton garment[J]. Journal of Industrial and Engineering Chemistry, 2015, 22 : 164–170. DOI: 10.1016/j.jiec.2014.07.005 |
 2018, Vol. 46
2018, Vol. 46