文章信息
- 李尧, 卢怡, 曹文斌
- LI Yao, LU Yi, CAO Wen-bin
- W掺杂二氧化钒的水热晶化机理及其相变性能
- Crystallization Mechanism and Phase Transition Properties of W-doped VO2 Synthesized by Hydrothermal Method
- 材料工程, 2017, 45(11): 58-65
- Journal of Materials Engineering, 2017, 45(11): 58-65.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2017.000459
-
文章历史
- 收稿日期: 2017-04-16
- 修订日期: 2017-07-18
2. 解放军306 医院 口腔科, 北京 100101;
3. 北京科技大学 天津学院, 天津 301830
2. Department of Stomatology, the 306 Hospital of PLA, Beijing 100101, China;
3. Tianjin College, University of Science and Technology Beijing, Tianjin 301830, China
VO2在68℃附近发生低温单斜相(M相)与高温四方金红石相(R相)的可逆相变[1],同时伴随着红外光透过率、电阻率等性能的突变,这一特性使得VO2在智能温控等领域具有巨大的应用前景。为了满足不同应用领域对其温度响应的需求,VO2相变温度的调控十分重要。因此,如何调控VO2相变温度成为了研究热点之一。研究表明,离子掺杂是有效降低VO2相变温度的有效手段[2],高价态离子的掺入可在V的dⅡ轨道中引入多余电子,减小dⅡ带分裂间隙,降低相变能垒,实现相变温度的降低[3]。W6+[4],Mo6+[5],Nb5+[6]等高价离子是常用掺杂离子,其中W6+的掺杂能够使VO2相变温度降低的幅度达到20~30K/%W[7]。从而,W6+掺杂VO2所形成的W-VO2(M)粉体在低温相变领域极具应用前景。
制备W-VO2(M)粉体的方法有很多种[4, 8-11]。其中,水热法具有产物纯度高、粒径可控等特点而备受青睐。然而,由于钒元素复杂的价态变化(从V3+到V5+)以及VO2存在的多种晶体结构[12](亚稳态VO2(B)、VO2(A)和稳态VO2(M)和VO2(R)),水热合成产物往往是混价钒氧化物或亚稳态W-VO2(B)[13],难以制得单相W-VO2(M)粉体。为了解决这一难题,常采用2种方法制备W-VO2(M)粉体:(1)先低温水热制备W-VO2(B)粉体,随后高温退火,将W-VO2(B)转变为W-VO2(M)粉体。Zhang等[10]利用NH4VO3、草酸和WO2Cl2为主要原料,在180℃保温48h的条件下水热合成制备得到W-VO2(B)粉体,然后在750℃条件下热处理2h得到W-VO2(M)粉体。但是,高温退火处理会造成严重团聚,破坏粉体的形貌结构,削弱热致相变强度[14]; (2)一步水热法直接制备得到W-VO2(M)粉体。Cao等[15]利用V2O5、草酸和钨酸在240℃水热7天,得到雪花状W-VO2(M)粉体。虽然采用一步水热法避免了高温热处理,但是却需要较长的水热时间。为此,部分研究工作采用溶胶的水热晶化方式实现W掺杂VO2(M)的合成。在此过程中,随着水热温度的升高,溶胶结构逐渐被破坏而发生形核,生长得到W-VO2晶体。Li等[16]探究了利用高温水淬法制备W掺杂V2O5溶胶,然后将溶胶与聚乙二醇混合,在200℃条件下水热2天,合成产物经过700℃热处理2h后制得了针状W-VO2(M)粉体。Zhang等[17]采用V2O5与H2O2形成V2O5溶胶,然后将溶胶与乙醇、偏钨酸铵混合均匀,在280℃条件下水热处理48h制备得到W-VO2(M)粉体。这表明利用水热法对溶胶进行晶化处理可直接制备W-VO2(M)粉体。然而,由于+4价钒醇盐化学稳定性差,易于氧化,高温水淬法制得的是V2O5溶胶,VO2溶胶的制备存在较大的难度。
基于课题组前期研究[18],本工作先以沉淀-胶溶反应法制备VO2溶胶,再采用溶胶水热晶化法合成W-VO2(M)粉体。探讨水热反应时间、水热反应温度、W掺杂量对掺杂VO2物相组成及相变性能的影响。研究W-VO2(M)在水热晶化过程中可能的形成机理。
1 实验材料与方法 1.1 原料硫酸氧钒(VOSO4·1.6H2O), 沈阳海中天精细化工厂,工业级;氨水(NH3·H2O),双氧水(H2O2,30%)和无水乙醇(CH3CH2OH),国药集团化学试剂北京有限公司,分析纯;草酸(H2C2O4·2H2O)和偏钨酸铵((NH4)6H2W12O40·xH2O),上海阿拉丁生化科技股份有限公司,分析纯。实验所用水为去离子水。
1.2 样品制备VO2溶胶的制备:将VOSO4·1.6H2O(2.28g,0.01mol)水溶液与NH3·H2O溶液(6mL,VNH3·H2O:VH2O=1:1)通过共滴定法混合,调节体系pH≈7,制备得到VO(OH)2沉淀。将所得VO(OH)2沉淀经过多次洗涤后,超声分散于50mL去离子水中。向上述分散溶液中滴加10mL由H2O2和H2C2O4·2H2O构成的水溶液(VH2O2=0.5mL, mH2C2O4·2H2O=0.63g, nH2O2:nH2C2O4·2H2O=1:1),混合搅拌30min,即得到VO2溶胶。
W-VO2样品的制备:取60mL自制VO2溶胶,偏钨酸铵作为W源,按W:V配比1.0%(原子分数,下同),3.0%,6.0%分别加入溶胶中(分别表示为W-VO2-1,W-VO2-3,W-VO2-6),超声分散10min,填充至100mL水热釜中(填充率为0.6),280℃水热反应48h。水热反应结束后,待水热釜自然冷却至室温,所得产物用去离子水、无水乙醇多次洗涤后,60℃真空干燥6h,即得到蓝黑色W-VO2样品。图 1为水热合成W-VO2的流程图。
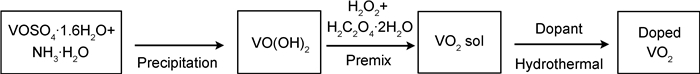
|
图 1 水热法制备W-VO2流程图 Fig. 1 Schematic of hydrothermal route for the preparation of W-doped VO2 sample |
不同水热反应温度条件下W-VO2样品的制备:水热温度为230~280℃,水热反应时间为48h,其他制备过程与W-VO2-1相同。
不同水热反应时间条件下W-VO2样品的制备:水热时间为4~48h,水热反应温度为280℃,其他制备过程与W-VO2-1相同。
1.3 测试表征采用DMAX-RB型X射线衍射仪分析样品物相;用ESCALAB 250XI型X射线光电子能谱仪分析样品表面状态;用S-4800型场发射扫描电子显微镜观察水热过程中样品的微观形貌;用TA SDT Q100型示差扫描热量分析仪对样品的热致相变性能进行分析。
2 结果与分析 2.1 水热条件对样品物相组成的影响图 2为不同水热条件下样品的XRD谱图。图 2(a)是在水热反应48h,无掺杂VO2溶胶在280℃制得样品和1.0%W掺杂VO2溶胶在230~280℃下制得样品的XRD谱图。物相分析表明,无掺杂溶胶在280℃水热反应48h,所得样品的衍射峰均属于单斜相VO2(B),其空间群为C2/m(JCPDS No.81-2392)。这一现象与Cao等[15]、Whittaker等[19]和Corr等[20]报道的结果一致,在无掺杂剂存在条件下180~300℃水热反应难以制备得到VO2(M)粉体,往往得到亚稳态VO2(B)或VO2(A)粉体。Théobald等[21]采用V2O3-V2O5-H2O体系,通过水热法研究VO2(B)向VO2(M)的转变过程,发现在180℃水热条件下先形成VO2(B)粉体,350℃水热条件下得到VO2(M)粉体。而高价态W6+离子的掺入可在V的dⅡ轨道中引入多余电子,减小dⅡ带分裂间隙,降低由亚稳态B相向M相转变所需的活化能[22],降低水热反应温度。对于1.0%W掺杂样品,当水热温度为230℃时,水热晶化产物的衍射峰均归属于单斜相W-VO2(B)(JCPDS No. 81-2392)。当水热温度为260℃时,水热晶化产物是W-VO2(B)和W-VO2(M)混合物,表明在260℃附近W-VO2(B)开始向W-VO2(M)晶型转变。当水热温度为280℃时,所得水热晶化产物衍射峰均归属于单斜相W-VO2(M),对应空间群为P21/c(JCPDS No. 82-0661),W-VO2(B)完全转变为W-VO2(M)。XRD结果表明,在溶胶水热合成单相W-VO2(M)过程中,水热温度低时先得到W-VO2(B),水热温度升高有利于B相向M相转变,当水热温度为280℃时得到单相W-VO2(M)。

|
图 2 不同水热条件下样品的XRD谱图 (a)280℃无掺杂和230~280℃时1.0%W掺杂;(b)1.0%W掺杂反应4~48h Fig. 2 XRD patterns of samples with different hydrothermal conditions (a)without W-doping at 280℃ and 1.0%W-doping at 230-280℃; (b)1.0%W-doping for 4-48h |
图 2(b)是在280℃条件下水热反应4~48h制备1.0%W掺杂样品的XRD谱图。物相分析发现,当水热反应时间为4~6h时,水热晶化产物是W-VO2(B)(JCPDS No.81-2392),结晶度较差;当水热反应12h时,水热晶化产物为W-VO2(B)和W-VO2(M)混合物;当水热反应24~36h时,水热晶化产物中W-VO2(M)所占比重加大;当水热反应时间延长至48h时,所得产物为单相W-VO2(M)(JCPDS No.82-0661),结晶度高。表明在溶胶水热过程中,VO2溶胶水热先生成亚稳态W-VO2(B),结晶度差。随着水热时间的延长,W-VO2(B)向W-VO2(M)发生晶型转变。当水热时间达到48h时,所得水热晶化产物是单相W-VO2(M),结晶度好,纯度高。根据水热温度230~280℃和水热时间4~48h的XRD分析可知,当水热温度为280℃、水热时间为48h时,采用VO2溶胶水热法合成得到单相W-VO2(M)。
为了进一步确认W-VO2样品的表面状态,利用XPS能谱对1.0%W掺杂样品进行分析,如图 3所示。
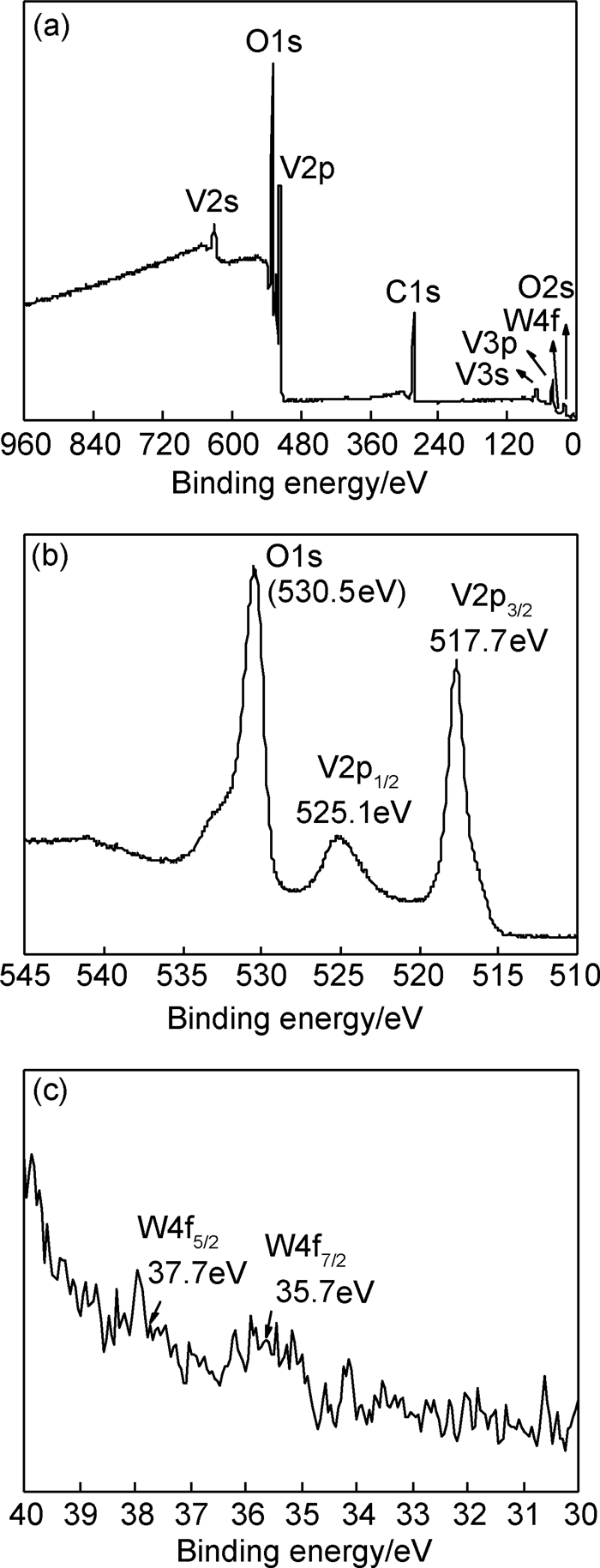
|
图 3 1.0%W-VO2样品的XPS谱图 (a)全谱图; (b)V2p和O1s;(c)W4f Fig. 3 XPS spectra of 1.0%W-VO2 samples (a)full spectrum; (b)V2p and O1s;(c)W4f |
由图 3(a)可知,样品由V,O和W这3种元素组成,其中C1s峰来源于样品表面残碳。图 3(b),(c)中,样品结合能525.1eV和517.7eV分别归属于V2p1/2和V2p3/2,对应于+4价钒的特征峰,而结合能37.7eV和35.8eV分别归属于W4f5/2和W4f7/2,O1s结合能为530.1eV,与文献报道W掺杂VO2(M)粉体结合能值一致[13]。XPS结果表明,溶胶水热制备的W-VO2-1样品中V元素的价态为+4价,W为+6价。XRD和XPS分析表明,采用VO2溶胶在280℃水热48h制备得到的产物是单相W-VO2(M),无混价钒氧化物存在。
2.2 W掺杂量对样品物相的影响图 4为不同W掺杂量溶胶在280℃时水热晶化48h的XRD谱图及局部放大图。可知,W-VO2-1的衍射峰归属于M相单斜结构(JCPDS No.82-0661)。提高W掺杂浓度时,W-VO2-3和W-VO2-6的衍射峰向低角度偏移,在27.0° ≤2θ≤28.5°区域的(011)面对应衍射峰的2θ值从27.9°变化为27.6°,如图 4(b)所示。表明高价态W6+成功掺杂进入VO2晶格替代了V4+,而W6+半径(60pm)略大于V4+(58pm)导致晶胞参数变大,因此,随着W掺杂浓度的增加,W-VO2样品衍射峰向低角度偏移。

|
图 4 不同W掺杂量的W-VO2样品的XRD谱图(a)及27.0°≤2θ≤28.5°范围放大图(b) Fig. 4 XRD patterns of W-VO2 samples with different W-doping content(a)and magnified patterns of 27.0°≤2θ≤28.5°(b) |
图 5为280℃时不同水热时间的W-VO2-1的FESEM图。水热晶化4h时得到的W-VO2-1呈现出一维纳米棒状结构,其长度约为1~2μm,直径约为100~200nm(图 5(a)),与相关文献报道的W-VO2(B)形貌一致[23, 24]。水热晶化6h时样品形貌与4h时相似,局部出现纳米棒沿生长界面堆叠在一起(图 5(b))。当水热晶化12~36h时,水热晶化产物为W-VO2-1(B)和W-VO2-1(M)的混合物(图 5(c),(d),(e)),棒状晶体堆积在一起形成少量片状晶体或雪花状晶体。当水热晶化时间延长到48h时,水热晶化产物为W-VO2-1(M),呈现为不规则雪花状结构。

|
图 5 不同水热时间时W-VO2-1的FESEM图 (a)4h;(b)6h;(c)12h;(d)24h;(e)36h;(f)48h Fig. 5 FESEM images of the W-VO2-1 with different hydrothermal time (a)4h;(b)6h;(c)12h;(d)24h;(e)36h;(f)48h |
溶胶水热晶化法制备W-VO2(M)粉体包括两部分,即VO2溶胶制备和水热晶化。VO2溶胶制备过程中,首先,VOSO4水溶液与NH3·H2O通过共沉淀反应(pH≈7)合成VO(OH)2,随后向VO(OH)2滴加H2O2和H2C2O4·2H2O的混合液(nH2O2:nH2C2O4·2H2O=1:1),VO(OH)2中的V原子为了达到六配位空间稳定结构,原子外层空的d轨道会自发地与H2O2电离出的亲核基团O22-或H2C2O4·2H2O中羧基官能团进行配位[25],生成单核化合物(例如,VO(O2)(OH)-)。单核化合物进一步通过分子内重排和缩聚反应形成VO2溶胶[18]。此外,在溶胶水热晶化过程中,H2C2O4·2H2O起到了重要的作用,它既是胶溶剂,又是还原剂,不仅协同H2O2与VO(OH)2通过配位、重排和缩聚反应制备VO2溶胶,还在水热过程中保护和避免V4+被氧化。
通过测试Zeta电位分析溶胶稳定性,探究胶溶过程中H2C2O4·2H2O对制备VO2溶胶的作用。当无H2C2O4·2H2O参与胶溶反应时,所制备得到的VO2溶胶的Zeta电位为-19.4eV;当H2C2O4·2H2O参与胶溶反应时,制备得到的VO2溶胶的Zeta电位为-28eV。表明H2C2O4·2H2O可以协同H2O2与VO(OH)2通过配位、重排和缩聚反应制备VO2溶胶,提高VO2溶胶的稳定性。
图 6为添加H2C2O4·2H2O制得的溶胶和未添加H2C2O4·2H2O制得的溶胶在280℃水热晶化反应48h合成1.0%W掺杂样品的XRD谱图。物相分析表明,当未添加H2C2O4·2H2O时,所制得的溶胶水热晶化产物为V3O7(JCPDS No.71-0454),同时还存在少量V6O13相氧化物,表明无H2C2O4·2H2O参与反应时,溶胶在水热晶化过程中V4+容易被氧化;当添加H2C2O4·2H2O时,所制得的溶胶水热晶化产物为VO2(JCPDS No. 82-0661)。表明H2C2O4·2H2O在水热过程中保护和避免V4+被氧化。
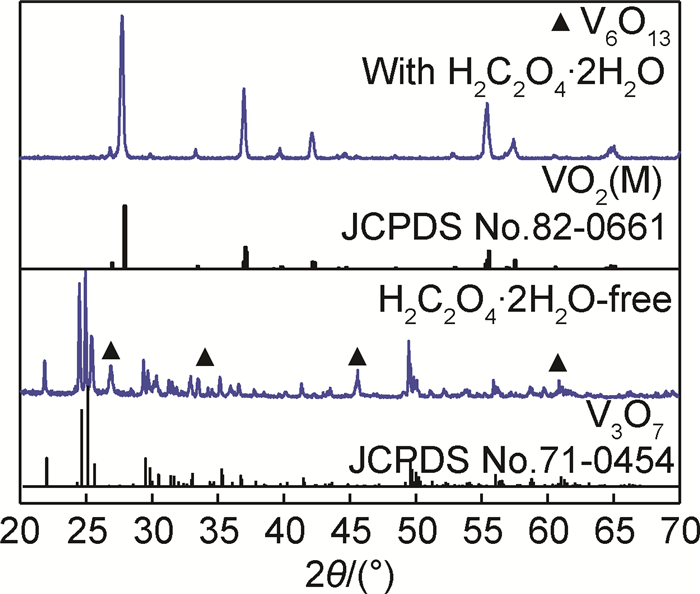
|
图 6 1.0%W掺杂样品的XRD谱图 Fig. 6 XRD patterns of 1.0%W-doping samples |
目前,对于W-VO2(M)在水热晶化过程中的生长机理还没有公认的解释,本工作根据XRD物相组成和FESEM观察到的形貌演化结果,基于“负离子配位多面体生长基元”模型[26-28],提出利用“形核-生长-转化-熟化”机制对VO2的水热晶化过程进行解释,如图 7所示。“负离子配位多面体生长基元”模型认为,晶体的生长形态由构成晶体的各面族生长速率决定,与晶体的内部结构和外部生长条件密切相关。水热反应初期,VO2溶胶随着水热温度升高而逐渐破坏,溶胶在水热介质中溶解,并分解出V4+,而V4+不稳定,容易通过配位反应生成[VO6]八面体生长基元稳定结构[25]。生长基元通过水解得到晶核,晶核长大优先形成一维纳米棒状VO2(B)晶体(图 2(b)4h, 图 5(a)),局部区域棒状VO2(B)沿生长界面出现堆积现象(图 2(b)6h,图 5(b))。Leroux等[29]认为VO2(B)向VO2(M)转变时,B相晶体中长程有序[VO6]八面体结构破坏,相邻八面体间发生断裂,随后[VO6]八面体碎片重新组装,同时氧八面体4倍轴方向由沿着一个垂直的方向延伸生长(B相)转变为沿着两个垂直的方向延伸生长(M相)。高价态W6+掺入VO2晶格替代了V4+,加剧了[VO6]八面体结构扭曲,促进了相邻八面体结构断开,实现了由B相向M相转变(图 2(b))。伴随着晶型的转变,较小棒状晶体堆积在一起形成少量较大片状晶体或雪花状晶体,棒状W-VO2(B)逐渐消溶(图 2(b)12~36h,图 5(c)~(e))。片状或雪花状W-VO2(M)继续Ostwald熟化,最终得到较大不规则雪花状单相W-VO2(M)(图 2(b)48h,图 5(f))。因此,VO2溶胶在280℃水热48h条件下,经过“形核-生长-转化-熟化”过程,实现了晶型由B相向M相转变,得到了单相W-VO2(M)晶体。
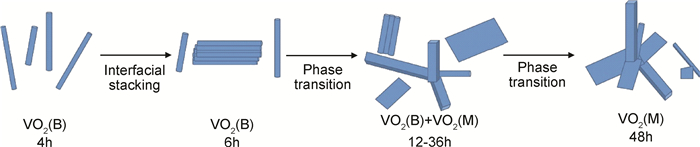
|
图 7 W-VO2(B相到M相)晶型转变形貌演变过程 Fig. 7 Schematic illustration of crystalline transformation and morphological evolution process of W-VO2(from B phase to M phase) |
图 8为W-VO2样品在-20~100℃时的DSC曲线。DSC曲线中的吸热峰表示W-VO2样品的相变温度。当W掺杂浓度分别为1.0%,3.0%和6.0%时,样品W-VO2的相变温度分别为50,31℃和28℃,吸热峰和放热峰出现宽化,峰强度减弱。当6.0%W掺杂时,相变幅度削弱严重。Wu等[30]通过研究VO2晶格中W掺杂原子和V原子周围的化学状态和局部几何结构变化,发现高价态W6+掺入VO2晶格中替代了V4+,W6+的dⅡ轨道电子转移到相邻V4+的dⅡ轨道,在沿着单斜相VO2晶胞a轴方向形成V3+-W6+和V3+-V4+对,V4+的dⅡ带分裂间隙减小,促使VO2由单斜相更容易向金红石相转变,相变温度降低。Tan等[31]认为,W-VO2中W原子周围的局部结构与四方相晶体结构对称,不对称单斜相VO2晶格在W原子的作用下衍生出金红石型VO2核,这些含W的VO2核通过基体扩散降低了相变的热能势垒。随着W掺杂量的增加,VO2相变所需要的外界能量减小,相变幅度也减弱。此外,Zhang等[17]发现,W掺杂量低于3.0%时,W掺杂VO2相变温度随W掺杂量升高而降低;掺杂量为3.0%时,W掺杂VO2相变温度为26℃,接近室温,这使W-VO2材料在民用领域拥有巨大的应用潜力;而当W掺杂量高于4.0%时,W掺杂VO2相变吸热峰和放热峰强度明显削弱,甚至无峰。这表明,虽然W掺杂可以有效降低相变温度,但掺杂的同时也会削弱VO2的相变性能。因此,采用溶胶水热制备W掺杂VO2(M)时,W掺杂浓度不宜高于3.0%。
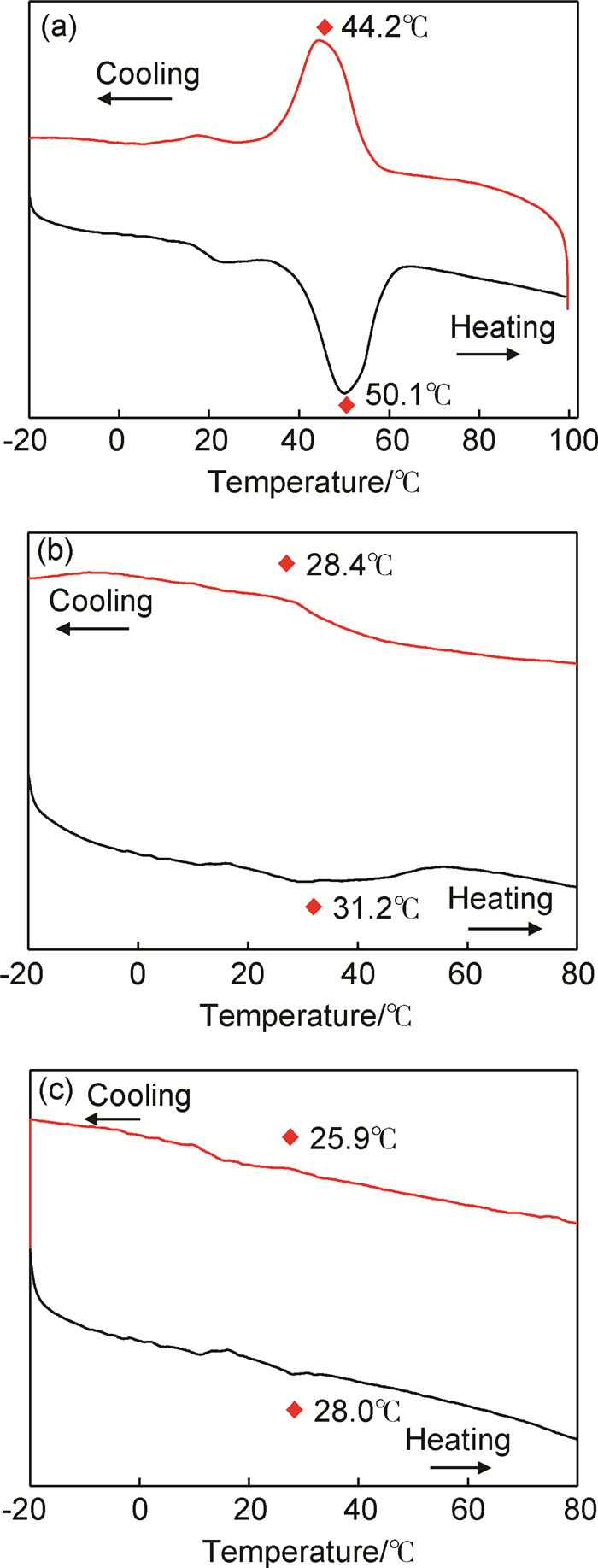
|
图 8 W-VO2样品在-20~100℃的DSC曲线 (a)W-VO2-1;(b)W-VO2-3;(c)W-VO2-6 Fig. 8 DSC curves of W-VO2 samples at -20-100℃ (a)W-VO2-1;(b)W-VO2-3;(c)W-VO2-6 |
(1) 在VO2溶胶水热晶化过程中,先生成W-VO2(B)晶体,水热反应温度越高,水热反应时间越长,越有利于W-VO2晶体生长和晶型转变(B相到M相)。当水热反应温度为280℃、水热反应时间为48h时,通过VO2溶胶水热晶化得到单相W-VO2(M)。
(2) 提出了W-VO2溶胶水热晶化可能的“形核-生长-转化-熟化”机制,解释了W-VO2(M)的形成过程。在280℃条件下4~48h水热晶化过程中,VO2溶胶结构被破坏,形成[VO6]八面体生长基元,生长基元水解形核,先生成长约1~2μm、直径约100~200nm棒状VO2(B)晶体,随后发生B相向M相晶型转变,较小棒状晶体堆积在一起形成少量较大片状晶体或雪花状晶体,棒状W-VO2(B)逐渐消溶,W-VO2(M)经过Ostwald熟化,最终得到较大不规则雪花状结构。
(3) 随着W掺杂浓度由1.0%增加至6.0%,W-VO2(M)的相变温度由50℃降低至28℃,但相变幅度减弱。这表明,虽然W掺杂可以有效降低相变温度,但也削弱VO2的相变性能。溶胶水热制备W掺杂VO2(M)时,W掺杂量不宜高于3.0%。
| [1] | MORIN F J. Oxides which show a metal-to-lnsulator transition at the neel temperature[J]. Physical Review Letters, 1959, 3 (1): 34–36. DOI: 10.1103/PhysRevLett.3.34 |
| [2] | JO C W, KIM H J, YOOJ W. Thermochromic properties of W-Mo Co-doped VO2(M) nanoparticles according to reaction parameters[J]. Journal of Nanoscience and Nanotechnology, 2017, 17 (5): 2923–2928. DOI: 10.1166/jnn.2017.14049 |
| [3] | XU S Q, MA H P, DAI S X, et al. Study on optical and electrical switching properties and phase transition mechanism of Mo6+-doped vanadium dioxide thin films[J]. Journal of Materials Science, 2004, 39 (2): 489–493. DOI: 10.1023/B:JMSC.0000011503.22893.f4 |
| [4] | WANG N, DUCHAMP M, XUE C, et al. Single-crystalline W-doped VO2nanobeams with highly reversible electrical and plasmonic responses near room temperature[J]. Advanced Materials Interfaces, 2016, 3 (15): 1600164–1600172. DOI: 10.1002/admi.201600164 |
| [5] | ZHANG Y, ZHANG J, ZHANG X, et al. The additives W, Mo, Sn and Fe for promoting the formation of VO2(M) and its optical switching properties[J]. Materials Letters, 2013, 92 (2): 61–64. |
| [6] | QUESADA-CABRERA R, POWELL M J, MARCHAND P, et al. Scalable production of thermochromic Nb-doped VO2 nanomaterials using continuous hydrothermal flow synthesis[J]. Journal of Nanoscience and Nanotechnology, 2016, 16 (9): 10104–10111. DOI: 10.1166/jnn.2016.12842 |
| [7] | TAN X, YAO T, LONG R, et al. Unraveling metal-insulator transition mechanism of VO2 triggered by tungsten doping[J]. Scientific Reports, 2012, 2 (6): 466–471. |
| [8] | LIANG Z, ZHAO L, MENG W, et al. Tungsten-doped vanadium dioxide thin films as smart windows with self-cleaning and energy-saving functions[J]. Journal of Alloys and Compounds, 2017, 694 : 124–131. DOI: 10.1016/j.jallcom.2016.09.315 |
| [9] | DONG B, SHEN N, CAO C, et al. Phase and morphology evolution of VO2 nanoparticles using a novel hydrothermal system for thermochromic applications:the growth mechanism and effect of ammonium (NH4+)[J]. Rsc Advances, 2016, 6 (85): 81559–81568. DOI: 10.1039/C6RA14569H |
| [10] | ZHANG C X, CHENG J, ZHANG J, et al. Simple and facile synthesis W-doped VO2 (M) powder based on hydrothermal pathway[J]. International Journal of Electrochemical Science, 2015, 10 (7): 6014–6019. |
| [11] | RAJESWARAN B, UMARJI A M. Phase evolution and infrared transmittance in monophasic VO2 synthesized by a rapid non-equilibrium process[J]. Materials Chemistry and Physics, 2017, 190 : 219–229. DOI: 10.1016/j.matchemphys.2016.12.070 |
| [12] | GALY J. A proposal for (B)VO2⇒(A)VO2 phase transition:a simple crystallographic slip[J]. Journal of Solid State Chemistry, 1999, 148 (2): 224–228. DOI: 10.1006/jssc.1999.8436 |
| [13] | LI W, JI S, LI Y, et al. Synthesis of VO2 nanoparticles by a hydrothermal-assisted homogeneous precipitation approach for thermochromic applications[J]. Rsc Advances, 2014, 4 (25): 13026–13033. DOI: 10.1039/C3RA47666A |
| [14] | WANG S, WAN M, HUANG B, et al. Influence of annealing temperature on the structure and morphology of the nano VO2 powder[J]. Rare Metal Materials and Engineering, 2016, 45 (1): 278–281. |
| [15] | CAO C, GAO Y, LUO H. Pure single-crystal rutile vanadium dioxide powders:synthesis, mechanism and phase-transformation property[J]. Journal of Physical Chemistry C, 2008, 112 (48): 18810–18814. DOI: 10.1021/jp8073688 |
| [16] | LI M, LI D B, PAN J, et al. W-doped VO2(M) with tunable phase transition temperature[J]. Applied Mechanics and Materials, 2013, 320 : 483–487. DOI: 10.4028/www.scientific.net/AMM.320 |
| [17] | ZHANG Y F, ZHANG J C, ZHANG X Z, et al. Direct preparation and formation mechanism of belt-like doped VO2(M) with rectangular cross sections by one-step hydrothermal route and their phase transition and optical switching properties[J]. Journal of Alloys and Compounds, 2013, 570 (38): 104–113. |
| [18] | LI Y, JIANG P, XIANG W, et al. A novel inorganic precipitation-peptization method for VO2 sol and VO2 nanoparticles preparation:synthesis, characterization and mechanism[J]. Journal of Colloid and Interface Science, 2016, 462 (5): 42–47. |
| [19] | WHITTAKER L, WU T L, PATRIDGE C J, et al. Distinctive finite size effects on the phase diagram and metal-insulator transitions of tungsten-doped vanadium(Ⅳ) oxide[J]. Journal of Materials Chemistry, 2011, 21 (15): 5580–5592. DOI: 10.1039/c0jm03833d |
| [20] | CORR S A, GROSSMAN M, SHI Y, et al. VO2(B) nanorods:solvothermal preparation, electrical properties, and conversion to rutile VO2 and V2O3[J]. Journal of Materials Chemistry, 2009, 19 (25): 4362–4367. DOI: 10.1039/b900982e |
| [21] | THÉOBALD F. Étude hydrothermale du système VO2-VO2, 5-H2O[J]. Journal of the Less Common Metals, 1977, 53 (1): 55–71. DOI: 10.1016/0022-5088(77)90157-6 |
| [22] | SOLTANE L, SEDIRI F, GHARBI N. Hydrothermal synthesis of mesoporous VO2·1/2(H2O) nanosheets and study of their electrical properties[J]. Materials Research Bulletin, 2012, 47 (7): 1615–1620. DOI: 10.1016/j.materresbull.2012.03.064 |
| [23] | ZHANG Y, HUANG Y. A facile hydrothermal synthesis of tungsten doped monoclinic vanadium dioxide with B phase for supercapacitor electrode with pseudocapacitance[J]. Materials Letters, 2016, 182 (1): 285–288. |
| [24] | YU W, LI S, HUANG C. Phase evolution and crystal growth of VO2 nanostructures under hydrothermal reactions[J]. Rsc Advances, 2016, 6 (9): 7113–7120. DOI: 10.1039/C5RA23898F |
| [25] | BAL-DEMIRCI T, SAHIN M, KONDAKCI E, et al. Synthesis and antioxidant activities of transition metal complexes based 3-hydroxysalicylaldehyde-S-methylthiosemicarbazone[J]. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 2015, 138 : 866–872. DOI: 10.1016/j.saa.2014.10.088 |
| [26] |
李汶军, 施尔畏, 殷之文. 离子晶体生长机理及其生长习性[J].
人工晶体学报, 2001, 30 (3): 232–241.
LI W J, SHI E W, YIN Z W. Growth mechanism and growth habit of crystals[J]. Journal of Synthetic Crystals, 2001, 30 (3): 232–241. |
| [27] |
李汶军, 施尔畏, 郑燕青, 等. 氧化物晶体的成核机理与晶粒粒度[J].
无机材料学报, 2000, 15 (5): 777–786.
LI W J, SHI E W, ZHENG Y Q, et al. Nucleating mechanism of oxide crystal and its particle size[J]. Journal of Inorganic Materials, 2000, 15 (5): 777–786. |
| [28] |
李汶军, 施尔畏, 殷之文. 晶体的生长习性与配位多面体的形态[J].
人工晶体学报, 1999, 28 (4): 368–372.
LI W J, SHI E W, YIN Z W. Growth habit of crystal and the shape of coordination polyhedron[J]. Journal of Synthetic Crystals, 1999, 28 (4): 368–372. |
| [29] | LEROUX C, NIHOUL G, TENDELOO G V. From VO2(B) to VO2(R):theoretical structures of VO2 polymorphs and in situ electron microscopy[J]. Physical Review B, 1998, 57 (9): 5111–5121. DOI: 10.1103/PhysRevB.57.5111 |
| [30] | WU Y F, FAN L L, HUANG W F, et al. Depressed transition temperature of WxV1-xO2:mechanistic insights from the X-ray absorption fine structure (XAFS) spectroscopy[J]. Physical Chemistry Chemical Physics, 2014, 16 (33): 17705–17714. DOI: 10.1039/C4CP01661K |
| [31] | TAN X G, YAO T, LONG R, et al. Unraveling metal-insulator transition mechanism of VO2 triggered by tungsten doping[J]. Scientific Reports, 2012, 2 (6): 466–471. |
 2017, Vol. 45
2017, Vol. 45


