文章信息
- 王艳春, 曾效舒, 敖志强, 袁秋红, 杨文庆, 沈佐健
- WANG Yan-chun, ZENG Xiao-shu, AO Zhi-qiang, YUAN Qiu-hong, YANG Wen-qing, SHEN Zuo-jian
- 热还原石墨烯的制备及其对重金属Pb2+的吸附性
- Preparation of Graphene via Thermal Reduction and Its Adsorption Capacity for Heavy Metal Pb2+
- 材料工程, 2017, 45(10): 6-11
- Journal of Materials Engineering, 2017, 45(10): 6-11.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2016.000815
-
文章历史
- 收稿日期: 2016-07-05
- 修订日期: 2017-06-06
2. 南昌航空大学 航空制造工程学院, 南昌 330063;
3. 包头北方铁路产品有限责任公司, 内蒙古 包头 014030
2. School of Aeronautic and Mechanical Engineering, Nanchang Hongkong University, Nanchang 330063, China;
3. Baotou North Railroad Product Co., Ltd., Baotou 014030, Inner Mongolia, China
近年来,水污染问题受到全世界的广泛关注,其中工业废水排放所引起的重金属离子水污染问题更成为人们关注的焦点之一。由此而衍生出一系列的去除水中重金属离子的方法,主要有电化学方法[1]、离子交换法[2]、沉淀法[3]、薄膜过滤法[4]和吸附法[5]等。吸附法由于操作简单易行、效率高、吸附速率快等优点,成为去除重金属离子的重要方法。吸附法中所用到的吸附剂种类较多,吸附能力差别较大,工业上常用的吸附材料有介孔材料[6]、活性炭[7]、沸石[8]及高分子聚合物[9]等材料,但以上吸附材料都存在吸附量偏小,吸附效率较低等缺点。近年来碳纳米管及石墨烯作为吸附剂受到广泛的关注,而碳纳米管的制备成本较高,有效吸附表面比石墨烯要低[10]。石墨烯具有优异的电学性能、力学性能、防腐蚀性能等,可用来制作超级电容器[11]、透明导电薄膜[12]、锂电池[13]、金属表面的防腐[14]等。石墨烯具有超大的比表面积,理论值达2630m2·g-1,使其在吸附剂的应用上成为新的热点。
石墨烯的制备方法主要有化学气相沉积方法[15, 16]、外延生长法[17]、微机械剥离法[18]和化学氧化还原方法[19]等。其中化学还原方法由于成本低、易操作等优点成为石墨烯工业化生产的主要方法,所用的还原剂主要包括水合肼[20]、氢碘酸[21]、硼氢化钠[22]等,这些化学还原剂都具有一定的毒性。近年来微波还原、热还原等方法利用瞬时加热膨胀剥离氧化石墨烯,通过氧化石墨烯片层间的含氧官能团的热分解而还原,成为石墨烯量产的有效途径[23]。热还原方法无须添加有毒的化学还原剂,避免了石墨烯在液相中还原所产生的团聚现象,绿色环保。
本工作利用Hummers方法[24]制备氧化石墨,然后利用高温瞬时加热的方法还原剥离氧化石墨,得到热还原的石墨烯。并将其用于水中重金属Pb2+的吸附,着重分析接触时间和pH值对吸附的影响。同时应用吸附等温模型和吸附动力学模型研究其吸附机理。
1 实验材料与方法 1.1 实验材料天然鳞片石墨(100目);浓硫酸(H2SO4,纯度98%),高锰酸钾(KMnO4, 分析纯),双氧水(H2O2,纯度30%),盐酸(HCl,纯度36%~38%),氯化钡(BaCl2,分析纯),氨水(NH3·H2O,分析纯),均购自西陇化工股份有限公司;硝酸钠(NaNO3, 分析纯),氯化铅(PbCl2,分析纯),购自天津市永大化学试剂开发中心;均不作处理直接使用。
1.2 石墨烯的制备利用改进的Hummers法制备氧化石墨。10g石墨,230mL的浓硫酸和5g的硝酸钠混合后,在冰浴中磁力搅拌大约30min,然后缓慢加入30g的高锰酸钾,继续搅拌3h左右,接着将混合液置于35℃的水浴中。直到混合液变得黏稠搅不动后,缓慢加入500mL的去离子水,搅拌30min左右。将混合液置于90℃的水浴中,继续反应40min,加入100mL的去离子水,搅拌15min后,加入150mL 30%的双氧水溶液终止反应。趁热用稀盐酸洗涤,用BaCl2溶液检测到没有SO42-为止,然后用去离子水洗涤至中性。将洗涤好的氧化石墨胶体放在玻璃皿中抽真空去除水分,干燥好的氧化石墨粉末放入750℃的真空炉中加热还原,得到还原的石墨烯样品。
1.3 石墨烯吸附Pb2+用去离子水配置一定浓度(10~80mg/L)的Pb2+溶液,称取50mg的石墨烯,加入到100mL含Pb2+溶液中。用0.1mol的NaOH溶液和HCl溶液调整溶液的pH值,磁力搅拌仪搅拌4h。接着用混合纤维素滤膜(孔径为0.22μm)过滤混合液,静置过滤5min得到滤液。用ICP-AES检测滤液中的Pb2+浓度。石墨烯对Pb2+的吸附量qe及吸附率A用式(1),(2) 进行计算。
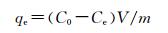
|
(1) |

|
(2) |
式中:C0和Ce分别为Pb2+溶液的初始浓度和吸附平衡浓度,mg/L;V为Pb2+溶液的体积,L;m为石墨烯的质量,g。
吸附动力学模型选择准一级动力学[25]和准二级动力学[26]模型进行分析拟合计算。
准一级动力学方程表达式为:

|
(3) |
准二级动力学方程表达式为:

|
(4) |
式中:qe为平衡状态下的吸附容量,mg/g;qt为t时刻石墨烯对Pb2+的吸附量,mg/g;t为吸附反应时间,min;k1为准一级动力学的吸附速率常数,min-1;k2为准二级动力学的吸附速率常数,g·mg-1·min-1。
吸附等温模型采用Langmuir模型[27]和Freundlich模型[28]描述。
Langmuir模型表达式为:

|
(5) |
Freundlich模型表达式为:
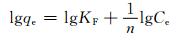
|
(6) |
式中:qm为吸附剂的最大吸附容量,mg/g;KL为Langmuir常数值,L/mg。KF为Freundlich模型中吸附容量,mg·g-1·(L·mg)1/n;n为吸附强度的常数。
1.4 测试及表征采用JEM-2100型透射电子显微镜(TEM)和FEI Quanta200F型扫描电子显微镜(SEM)观测石墨烯的形貌和结构;采用DI SYSTEM X射线衍射仪(XRD)和Nicolet5700型傅里叶变换红外光谱仪(FTIR)表征热还原石墨烯的还原程度和结构变化;用optima 5300DV型ICP-AES检测滤液中Pb2+的浓度。
2 结果与讨论 2.1 石墨烯的表征 2.1.1 石墨烯的形貌分析图 1为石墨烯的TEM和SEM像。图 1(a),(b)为石墨烯的透射电镜低倍形貌和高倍形貌。可以看出,片层呈褶皱状,这是由于片层之间的微弱作用力引起的。片层大概有几个微米的大小。高倍放大的图像可以看到很多片层堆叠在一起,这可能是热还原对石墨烯结构造成了一定的破坏。表面褶皱和缺陷形成的微孔成为吸附位点。由图 1(c)的扫描电子显微镜结果可知,石墨烯片层呈褶皱薄纱状,表面凹凸不平,各层之间重叠在一起以降低石墨烯的表面能,石墨烯片卷曲之后的横向尺寸约有十几个微米的宽度,表明石墨烯具有较强的吸附能力[29]。

|
图 1 石墨烯(GR)的TEM和SEM像(a)低倍TEM; (b)高倍TEM; (c)SEM Fig. 1 TEM and SEM images of GR (a)low magnification TEM image; (b)high magnification TEM image; (c)SEM image |
图 2为氧化石墨烯(GO)和热还原石墨烯(GR)的红外光谱和XRD谱图。由图 2(a)的FTIR图可知,GO在3419cm-1附近的峰值对应羟基峰(—OH),是由GO本身的羟基峰和表面吸附的水分子羟基峰的双重作用引起的,1622cm-1的峰值对应C=C键的振动峰和氧化后形成的C=O键,1054cm-1的峰值为C—O—C伸缩振动峰。高温还原后的GR位于3419cm-1和1622cm-1的峰值都发生蓝移,且相应变弱,表明高温下GO还原为GR。

|
图 2 氧化石墨烯和热还原石墨烯的FTIR光谱(a)和XRD谱图(b) Fig. 2 FTIR spectra(a) and XRD patterns(b) of GO and GR |
图 2(b)为氧化石墨烯(GO)和热还原石墨烯(GR)的X射线衍射谱图。天然鳞片石墨的(002) 衍射峰大约在26.5°,由布拉格方程计算层间距大约为0.34nm。GO的(001) 衍射峰位于11.02°,层间距为0.802nm,经过热处理还原后的GR(001) 衍射峰消失,(002) 衍射峰低且宽,表明GO经过高温热处理后得到了还原和剥离。
2.2 pH值对吸附的影响溶液的pH值是影响吸附的主要因素之一。不同的pH值会使吸附剂表面带上不同的电荷。吸附剂表面所带的负电荷有利于吸附溶液中的阳离子,pH值越低,吸附剂表面可能带更多的正电荷,这样就会降低Pb2+的吸附率。取0.1mol的HCl和NaOH溶液,将浓度为41mg/L的Pb2+溶液的pH值调整为3~9。图 3为pH值对Pb2+吸附率的影响。可知,随着pH值的增加,吸附率呈现明显的上升趋势,当pH值达到7以上时,溶液的吸附率上升得比较缓慢,这与石墨烯表面本身就带有负电荷有很大的关系,可见在石墨烯吸附重金属阳离子的过程中化学吸附起着重要的作用。

|
图 3 pH值对Pb2+吸附率的影响 Fig. 3 Effect of pH value on the adsorption rate of Pb2+ |
吸附会随着时间的推移达到平衡,图 4为不同的接触时间对Pb2+的吸附量和吸附率的影响。可知,开始的5min内吸附量和吸附率增加得非常快。吸附1h以后吸附量和吸附率的增加趋于放缓。这有可能是在反应初期,石墨烯表面的吸附位点较多,Pb2+能够很快进入吸附位点。随着反应时间的进行,吸附位点逐渐变少,并且Pb2+溶液的浓度显著降低,因此吸附率随时间的延长呈缓慢增加趋势,直到达到吸附平衡。吸附1h的吸附量为80mg/g,去除率为97.8%,本工作选最佳吸附时间为1h。

|
图 4 接触时间对吸附量和吸附率的影响 Fig. 4 Effect of contact time on the adsorption capacity and adsorption rate |
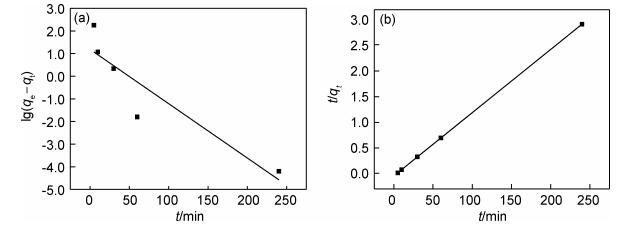
分别采用准一级动力学方程(式(3))和准二级动力学方程(式(4))对图 4中的数据进行动力学线性拟合,结果如图 5所示,拟合后的相关参数如表 1所示。由相关系数R2可以看出,通过准二级动力学模型计算得到的qe值与实验所得到的数据更加接近。准二级动力学模型的主要影响因素为化学键的形成,由此表明GR吸附Pb2+的过程主要以化学吸附为主[28]。准二级动力学模型能够较好地解释热还原GR吸附Pb2+的动力学机制。
|
图 5 GR吸附Pb2+的动力学线性拟合 (a)准一级动力学模型图;(b)准二级动力学模型图 Fig. 5 Pseudo-first-order (a) and pseudo-second-order(b) for Pb2+ adsorption onto GR |
| qe, exp/ (mg·g-1) |
Pseudo-first-order | Pseudo-second-order | |||||
| qe, cal/(mg·g-1) | k1/min-1 | R2 | qe, cal/(mg·g-1) | k2/(g·mg-1·min-1) | R2 | ||
| 80.88 | 15.6 | 0.055 | 0.7973 | 81.3 | 0.043 | 0.9999 | |
| Note: qe, expwas the equilibrium adsorption capacity for experiment; qe, cal was the equilibrium adsorption capacity for model fitting. | |||||||
吸附等温模型用来研究吸附剂与被吸附物质的相互作用,确定吸附机理。用Langmuir(式(5))和Freundlich(式(6))等温模型对吸附实验数据进行线性拟合,结果如图 6所示,相关参数如表 2所示。通过拟合结果可知,用Langmuir模型对实验数据进行拟合的R2值比用Freundlich模型拟合的值要高,说明GR对Pb2+的吸附为单分子层的化学吸附为主。通过Langmuir等温模型拟合的最大理论吸附量为86.5mg·g-1。GR对Pb2+的较高吸附量可能由两个方面引起:(1) 通过FTIR图像可以看出,GR表面有剩余的含氧官能团,这些含氧基团对Pb2+有较强的吸附作用,准二级动力学和Langmuir等温模型拟合结果都表明吸附以化学吸附为主。(2) GR较大的比表面积、表面的褶皱及多孔性。

|
图 6 GR吸附Pb2+的等温模型线性拟合 (a)Langmuir模型;(b)Freundlich模型 Fig. 6 Langmuir(a) and Freundlich(b) isotherms for Pb2+ adsorption onto GR |
| Langmuir model | Freundlich model | |||||
| qm/ (mg·g-1) | KL/(L·mg-1) | R2 | KF/(mg·g-1·(L·mg)1/n) | 1/n | R2 | |
| 86.5 | 10.7 | 0.9982 | 61.8 | 0.379 | 0.941 | |
(1) 采用热还原方法制备石墨烯,避免了还原剂的使用,绿色环保。
(2) 热还原石墨烯表面仍含有少量残余的含氧官能团,存在大量的活性位点,促使石墨烯能够有效吸附重金属阳离子。石墨烯对Pb2+的吸附率随着溶液pH值的增加而增加,吸附在5min内基本趋于平衡。
(3) 热还原石墨烯吸附Pb2+符合Langmuir等温模型和准二级动力学模型。两者的相关系数R2都大于0.99,理论最大吸附量为86.5mg/g。
| [1] | BASHA C A, BHADRINARAYANA N S, ANANTHARAMAN N, et al. Heavy metal removal from copper smelting effluent using electrochemical cylindrical flow reactor[J]. J Hazard Mater, 2008, 152 (1): 71–78. DOI: 10.1016/j.jhazmat.2007.06.069 |
| [2] | DABROWSKI A, HUBICKI Z, PODKOSCIELNY P, et al. Selective removal of the heavy metal ions from waters and industrial wastewaters by ion-exchange method[J]. Chemosphere, 2004, 56 (2): 91–106. DOI: 10.1016/j.chemosphere.2004.03.006 |
| [3] | GONZALEZ-MUNOZ M J, RODRIGUEZ M A, LUQUE S, et al. Recovery of heavy metals from metal industry waste waters by chemical precipitation and nanofiltration[J]. Desalination, 2006, 200 (1/3): 742–744. |
| [4] | QDAIS H A, MOUSSA H. Removal of heavy metals from wastewater by membrane processes:a comparative study[J]. Desalination, 2004, 164 (2): 105–110. DOI: 10.1016/S0011-9164(04)00169-9 |
| [5] | DEMIRBAS A. Heavy metal adsorption onto agro-based waste materials:a review[J]. J Hazard Mater, 2008, 157 (2): 220–229. |
| [6] | MANSOOR A, KAZEM K, SANAZ K. Heavy metal ions removal from aqueous media by modified magnetic mesoporous silica MCM-48[J]. Chem Eng Res Des, 2015, 93 (1): 779–788. |
| [7] | LUO X S, ZHANG Z, ZHOU P X, et al. Synergic adsorption of acid blue 80 and heavy metal ions (Cu2+/Ni2+) onto activated carbon and its mechanisms[J]. Journal of Industrial and Engineering Chemistry, 2015, 27 : 164–174. DOI: 10.1016/j.jiec.2014.12.031 |
| [8] | SHI W Y, SHAO H B, LI H, et al. Progress in the remediation of hazardous heavy metal-polluted soils by natural zeolite[J]. J Hazard Mater, 2009, 170 (1): 1–6. DOI: 10.1016/j.jhazmat.2009.04.097 |
| [9] | SAMANI M R, BORGHEI S M, OLAD A, et al. Removal of chromium from aqueous solution using polyaniline-poly ethylene glycol composite[J]. J Hazardous Mater, 2010, 184 (1/3): 248–254. |
| [10] | ANNA S, KRYSTYNA P. Adsorption of heavy metal ions with carbon nanotube[J]. Sep Purif Technol, 2007, 58 : 49–52. DOI: 10.1016/j.seppur.2007.07.008 |
| [11] | YANG X W, CHENG C, WANG Y F, et al. Liquid-mediated dense integration of graphene materials for compact capacitive energy storage[J]. Science, 2013, 341 (6145): 534. DOI: 10.1126/science.1239089 |
| [12] |
李宏, 李云. 石墨烯透明导电薄膜的研究现状及应用前景[J].
材料导报, 2013, 27 (8): 37–41.
LI H, LI Y. Research and application progress of transparent conductive graphene thin film[J]. Materials Review, 2013, 27 (8): 37–41. |
| [13] | MUGYEOM C, SIVA K K, DOHYEON Y, et al. A route to synthesis molybdenum disulfide-reduced graphene oxide (MoS2-RGO) composites using supercritical methanol and their enhanced electrochemical performance for Li-ion batteries[J]. J Power Sources, 2016, 309 : 202–211. DOI: 10.1016/j.jpowsour.2016.01.081 |
| [14] | LIU J H, HUA L, LI S M, et al. Graphene dip coatings:an effective anticorrosion barrier on aluminum[J]. Appl Surf Sci, 2015, 327 : 241–245. DOI: 10.1016/j.apsusc.2014.11.187 |
| [15] | CHEN S S, JI H X, CHOU H, et al. Millimeter-size single crystal graphene by suppressing evaporative loss of Cu during low pressure chemical vapor deposition[J]. Adv Mater, 2013, 25 (14): 2062–2065. DOI: 10.1002/adma.201204000 |
| [16] |
陈牧, 颜悦, 张晓锋, 等. 大面积石墨烯薄膜转移技术研究进展[J].
航空材料学报, 2015, 35 (2): 1–11.
CHEN M, YAN Y, ZHANG X F, et al. Advances in large-area graphene film transfer techniques[J]. Journal of Aeronautical Materials, 2015, 35 (2): 1–11. DOI: 10.11868/j.issn.1005-5053.2015.2.001 |
| [17] | BERGER C, SONG Z, LI X, et al. Electronic confinement and coherence in patterned epitaxial graphene[J]. Science, 2006, 312 (5777): 1191–1196. DOI: 10.1126/science.1125925 |
| [18] | NOVOSELOV K S, GEIM A K, MOROZOV S V, et al. Electric field effect in atomically thin carbon films[J]. Science, 2004, 306 (5696): 666–669. DOI: 10.1126/science.1102896 |
| [19] |
赵天宇, 杨程, 宋洪松. 原料尺寸对氧化石墨与石墨烯性能的影响[J].
材料工程, 2014 (9): 76–82.
ZHAO T Y, YANG C, SONG H S. Effects of raw materials size on properties of graphite oxide and graphene[J]. Journal of Materials Engineering, 2014 (9): 76–82. DOI: 10.11868/j.issn.1001-4381.2014.09.013 |
| [20] | STANKOVICH S, DIKIN D A, PINER R D, et al. Synthesis of graphene-based nanosheets via chemical reduction of exfoliated graphite oxide[J]. Carbon, 2007, 45 (7): 1558–1565. DOI: 10.1016/j.carbon.2007.02.034 |
| [21] | PEI S F, ZHAO J P, DU J H, et al. Direct reduction of graphene oxide films into highly conductive and flexible graphene films by hydrohalic acids[J]. Carbon, 2010, 48 (15): 4466–4474. DOI: 10.1016/j.carbon.2010.08.006 |
| [22] | SHIN H J, KIM K K, BENAYAD A, et al. Efficient reduction of graphite oxide by sodium borohydride and its effect on electrical conductance[J]. Adv Funct Mater, 2009, 19 (12): 1987–1992. DOI: 10.1002/adfm.v19:12 |
| [23] | MCALLISTER M J, LI J L, ADAMSON D H, et al. Single sheet functionalized graphene by oxidation and thermal expansion of graphite[J]. Chem Mater, 2007, 19 (18): 4396–4404. DOI: 10.1021/cm0630800 |
| [24] | HUMMERS W S, OFFEMAN R E. Preparation of graphitic oxide[J]. Am Chem Soc, 1958, 80 (6): 1339. DOI: 10.1021/ja01539a017 |
| [25] | LAGERGREN S. Zur theorie der sogenannten absorption gelöster stoffe[M]. Sweden: Kungliga Svenska Vetenskapskademiemiens Handlingar, 1898. |
| [26] | HO Y S, MCKAY G. Pseudo-second order model for adsorption processes[J]. Process Biochemistry, 1999, 34 (5): 451–465. DOI: 10.1016/S0032-9592(98)00112-5 |
| [27] | LANGMUIR I. The adsorption of gases on plane surfaces of glass, mica and platinum[J]. J Am Chem Soc, 1918, 40 (9): 1361–1403. DOI: 10.1021/ja02242a004 |
| [28] | FREUNDLICH H. Over the adsorption on solution[J]. J Phys Chem, 1906, 57 (385): 385–470. |
| [29] | TAN P, SUN J, HUA Y Y, et al. Adsorption of Cu2+, Cd2+ and Ni2+ from aqueous single metal solutions on graphene oxide membranes[J]. J Hazard Mater, 2015, 297 : 251–260. DOI: 10.1016/j.jhazmat.2015.04.068 |
 2017, Vol. 45
2017, Vol. 45


