文章信息
- 史艳华, 赵杉林, 王玲, 梁平, 关学雷
- SHI Yan-hua, ZHAO Shan-lin, WANG Ling, LIANG Ping, GUAN Xue-lei
- 稀土Ce掺杂纳米晶Mn-Mo-Ce氧化物阳极及其选择电催化性能
- Nanocrystalline Mn-Mo-Ce Oxide Anode Doped Rare Earth Ce and Its Selective Electro-catalytic Performance
- 材料工程, 2017, 45(9): 72-80
- Journal of Materials Engineering, 2017, 45(9): 72-80.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2016.001320
-
文章历史
- 收稿日期: 2016-11-07
- 修订日期: 2017-03-31
电解海水氢能开发应用中,最理想的析氧抑氯阳极材料是过渡族元素Mn的二元或三元复合氧化物,其中以阳极沉积制备的γ-MnO2物相结构Mn-Mo氧化物及其基础上开发的Mn-Mo-Fe,Mn-Mo-V等氧化物最为成熟,在碱性海水介质中具有95%以上析氧的高效选择电催化性能[1-3]。Mn系氧化物由于其结构具有较大的隧道空间和比表面积、高的晶格氧浓度等而具有高的电催化性能[4-6],元素掺杂和纳米化是提高Mn系氧化物阳极电催化性能的重要途径[7-9]。但Mn的氧化物阳极的电催化稳定性有待进一步提高,而且其选择电催化的机理也少有报道。稀土元素具有未充满的4f层电子结构,可以产生多种电子能级;具有大的原子磁矩、很强的自旋轨道耦合,使其具有独特的光、电、磁等物理化学性质,有“工业味精”之称,极少量的加入就可改善性能,在众多高新材料领域受到高度关注[10, 11]。研究表明:电沉积技术是稀土实现其功能性的重要途径,阴极电沉积复合CeO2和La2O3等稀土氧化物或阳极电沉积CeO2制备的纳米涂层,可以获得优良的耐蚀、耐磨、抗氧化及催化性能[12-15]。稀土Ce的氧化物作为强大而优异的组分被广泛应用于催化剂体系、固体电解质及高温陶瓷等领域[16, 17]。我国稀土资源丰富,开发新型的稀土功能镀层具有重要的实际价值。对于具有高催化活性的Mn系氧化物阳极,其析氧反应机理为“氧化物对控制理论”[18],依靠Mn3+/Mn4+及晶格氧的参与实现催化过程;而CeO2作为优异催化剂的关键是其具有变价化学态(Ce3+/Ce4+)[19, 20],二者具有类似的催化机理。将特殊d电子结构的Mn系氧化物与具有特殊4f电子结构的稀土Ce通过阳极电沉积法复合,有望提高阳极的电催化性能,制备高效阳极材料。
本工作将稀土盐CeCl3加入镀液,采用阳极电沉积技术制备纳米晶Mn-Mo-Ce氧化物阳极。在表征氧化物结构的基础上,对比研究稀土元素掺杂前后氧化物的电催化性能,从纳米结构的形貌效应方面对Mn系氧化物析氧选择电催化机理进行探讨。
1 实验材料与方法 1.1 实验材料浓H2SO4,H2IrCl6,正丁醇,MnSO4·5H2O,Na2MoO4·2H2O,CeCl3·7H2O,均为分析纯。
1.2 试样制备(1) 基体前处理:将喷砂后钛板作基体,加工成20mm×20mm×1mm试样,碱洗除油后在90℃含15%~20%(质量分数)草酸溶液中浸蚀10min,试样表面呈亮白色后用去离子水冲洗,烘干备用。
(2) IrO2中间层:将0.1mol·L-1氯铱酸正丁醇溶液均匀涂刷在钛基体表面,90℃烘干10min,400℃烧结10min,重复上述过程3次,最后一次在400℃烧结60min。
(3) 阳极电沉积:镀液配方0.2mol·L-1 MnSO4+0.003mol·L-1 Na2MoO4+(0~0.02) mol·L-1 CeCl3,用H2SO4调节镀液(pH值为0.5,电流密度为0.04A·cm-2,90℃),电镀1h,电磁搅拌。为抑制CeO2析出改变Mn系氧化物的物相结构,镀液中CeCl3含量较低且未添加络合剂。
1.3 实验方法(1) 结构表征:采用TESCAN-VEGA3扫描电镜和SU8010场发射扫描电子显微镜观察氧化物涂层的微观形貌;采用BRUKER能谱仪分析氧化物成分;采用X-7000型X射线衍射仪分析物相结构;采用JEM-2100F高分辨透射电镜分析氧化物的微纳结构。
(2) 电化学测试:采用三电极体系在模拟碱性海水(pH=12,0.5mol·L-1 NaCl溶液)中进行电化学测试,Mn系氧化物为工作电极,参比电极为饱和甘汞电极(SCE),辅助电极为20mm×20mm铂片,25℃。循环伏安曲线测试扫描范围为-0.3~0.6V,扫描速率为5mV·s-1;阻抗谱测试电位为开路电位,频率为10-2~105Hz。
(3) 析氧效率的测定:析氧效率用来表征阳极在含Cl-1介质中析氧抑氯的选择电催化活性,其值等于析氧电量与通过阳极总电量之比。电解pH=12,0.5mol·L-1 NaCl溶液300mL,以Mn系氧化物为阳极,直径0.25mm铂丝为阴极,电流密度为1000A·m-2,通过阳极电量为300C,以1cm2面积计算电解时间为50min。电量与溶液体积比为106C·m-3,溶液体积与阳极面积比为3m3·m-2。采用碘氧化滴定法测定溶液中NaClO的量,通过氯气生成量计算析氧效率[21]。
2 结果与分析 2.1 稀土盐CeCl3含量对Mn-Mo-Ce氧化物结构的影响 2.1.1 对显微形貌的影响调节镀液中CeCl3含量分别为0.000,0.005,0.010,0.020mol·L-1,阳极电沉积制备Mn-Mo-Ce氧化物,图 1为镀层形貌的SEM像。可见,CeCl3含量对氧化物涂层形貌有明显影响,当镀液中加入少量CeCl3时,涂层表面光滑、平坦,结合致密,有乌亮光泽,微裂纹均匀细密,镀层无剥离现象;随着CeCl3含量的增加,微裂纹粗化且数量减少。CeCl3含量为0.020mol·L-1时,表面微裂纹数量明显减少,镀层表面凹凸不平,胞状突起数量增多。

|
图 1 不同CeCl3含量时Mn-Mo-Ce氧化物镀层SEM像 (a)0.000mol·L-1; (b)0.005mol·L-1; (c)0.010mol·L-1; (d)0.020mol·L-1 Fig. 1 SEM images of Mn-Mo-Ce oxide coating with different CeCl3 content (a)0.000mol·L-1; (b)0.005mol·L-1; (c)0.010mol·L-1; (d)0.020mol·L-1 |
图 2为不同CeCl3含量时Mn-Mo-Ce氧化物的场发射电镜照片。可见,阳极电沉积获得的Mn系氧化物为纳米结构,其中无Ce掺杂的Mn-Mo氧化物的纳米结构为颗粒状,平均尺寸约为20nm;掺杂Ce后纳米结构的形貌发生明显改变,当镀液中CeCl3含量为0.005mol·L-1时,在颗粒状基础上混有短的纳米棒,与Mn-Mo氧化物相比颗粒尺寸有所细化;当镀液中CeCl3含量为0.010mol·L-1时,颗粒状形貌消失,Mn-Mo-Ce氧化物呈现均匀、致密的网孔状纳米结构,该纳米结构由直径约3~5nm、长径比约4~10的纳米线自组装而成,平均网孔直径约3~10nm;随着镀液中CeCl3含量的继续增加,网孔出现塞结,网孔数量显著减少。

|
图 2 不同CeCl3含量时Mn-Mo-Ce氧化物镀层的FESEM像 (a)0.000mol·L-1; (b)0.005mol·L-1; (c)0.010mol·L-1; (d)0.020mol·L-1 Fig. 2 FESEM images of Mn-Mo-Ce oxide coating with different CeCl3 content (a)0.000mol·L-1; (b)0.005mol·L-1; (c)0.010mol·L-1; (d)0.020mol·L-1 |
表 1为不同CeCl3含量制备的Mn-Mo-Ce氧化物的成分。可见,随着镀液中CeCl3含量的增加,镀层中Mn和Ce含量增加,而Mo含量降低。在相同工艺下,稀土Ce掺杂对Mn和Mo的沉积效果相反,而镀液中存在的微量稀土盐即可使镀层中含有>1%的Ce元素。
| CeCl3 content/(mol·L-1) | Mn | Mo | Ce |
| 0.000 | 78.18 | 21.82 | 0.00 |
| 0.005 | 83.73 | 14.72 | 1.55 |
| 0.010 | 84.34 | 13.52 | 2.14 |
| 0.020 | 84.36 | 11.47 | 4.17 |
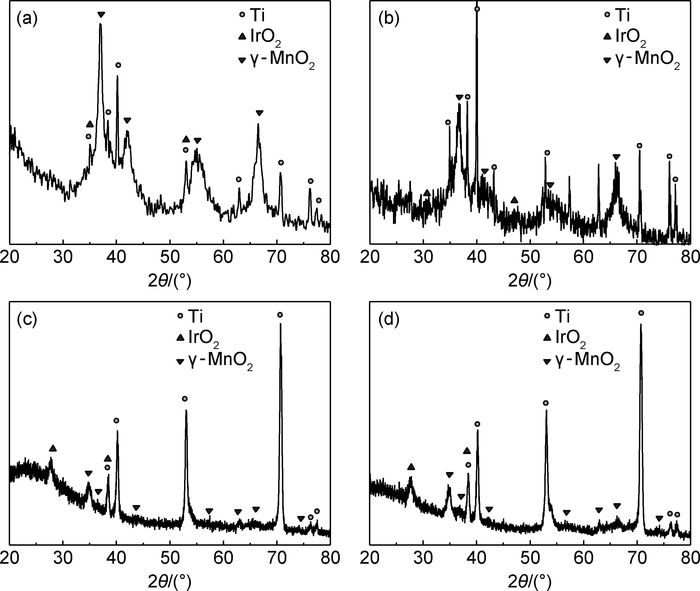
图 3为不同CeCl3含量制备的Mn-Mo-Ce氧化物阳极的XRD谱图。可见,Mn-Mo-Ce氧化物阳极的XRD谱线包含Ti基体、中间层IrO2和Mn-Mo-Ce氧化物3层物质的特征峰,其中γ-MnO2兼具软锰矿(30-0832#)和斜方锰矿(42-1316#)两种晶体结构谱线特征[21],在2θ为37.1°,42.4°,56.2°及65°附近出现4个特征峰,分别对应软锰矿的(100) 晶面、斜方软锰矿的(401),(402) 和(020) 晶面。由于Mn-Mo-Ce氧化物镀层较薄,所以Ti和IrO2特征峰较强,没有发现单独Ce的氧化物,Ce离子的掺杂使γ-MnO2各晶面的特征峰明显宽化及弱化,纳米结构特征明显,随着镀液中CeCl3含量增加,γ-MnO2特征峰呈弱化趋势。
|
图 3 不同CeCl3含量时Mn-Mo-Ce氧化物阳极的XRD谱图 (a)0.000mol·L-1; (b)0.005mol·L-1; (c)0.010mol·L-1; (d)0.020mol·L-1 Fig. 3 XRD patterns of Mn-Mo-Ce oxide anode with different CeCl3 content (a)0.000mol·L-1; (b)0.005mol·L-1; (c)0.010mol·L-1; (d)0.020mol·L-1 |
对CeCl3含量为0.010mol·L-1条件下制备的Mn-Mo-Ce氧化物与MnO2进行微纳结构分析,图 4和图 5分别为MnO2和Mn-Mo-Ce氧化物高分辨像(HR-TEM)及电子衍射花样,表 2为两种氧化物与PDF卡片各晶面间距数据的对比结果。可知,阳极电沉积获得的纯MnO2电子衍射花样为同心晕环,为典型纳米晶结构,根据γ-MnO2的晶格常数标定为(100)、(402) 和(020) 晶面,与PDF卡片标准值相比,纯MnO2各晶面间距稍有减小。纯MnO2高分辨像中主要暴露的活性晶面为低表面自由能的(100) 晶面(如图 4中3,4区),不同生长方向晶面间多以层错和空位组合的形式实现过渡(如图 4中1,2区),界面处原子混排程度较大。

|
图 4 MnO2的HR-TEM像及电子衍射花样 Fig. 4 HR-TEM image and electron diffraction patterns of MnO2 |

|
图 5 Mn-Mo-Ce氧化物的HR-TEM像及电子衍射花样 Fig. 5 HR-TEM image and electron diffraction patterns of Mn-Mo-Ce oxide |
| Sample | d(100)/nm | d(402)/nm |
| MnO2 | 0.241 | 0.166 |
| Mn-Mo-Ce oxide | 0.259 | 0.161 |
| PDF card | 0.242 | 0.167 |
Mn-Mo-Ce氧化物的电子衍射花样为同心晕环,纳米晶结构仅清晰显示出(100) 和(402) 两个晶面,与PDF卡片标准值相比,Mn-Mo-Ce氧化物(100) 晶面间距明显增大,而(402) 晶面间距明显减小。高分辨像中Mn-Mo-Ce氧化物结构以表面自由能低的(100) 晶面为主(如图 5中2,3区),且该晶面上点缺陷的数量明显增多,存在大量配位不饱和的离子空位,不同生长方向晶面间以共格或半共格形式连接(如图 5中1,4区),界面处原子混排程度降低,晶粒结合更牢固。
可见,稀土Ce掺杂没有改变γ-MnO2晶体结构,但改变了晶体内部微区原子排列规律,暴露的活性(100) 晶面点缺陷增多,晶面间距增大,产生较大的晶格畸变,具有高的晶格活化能。
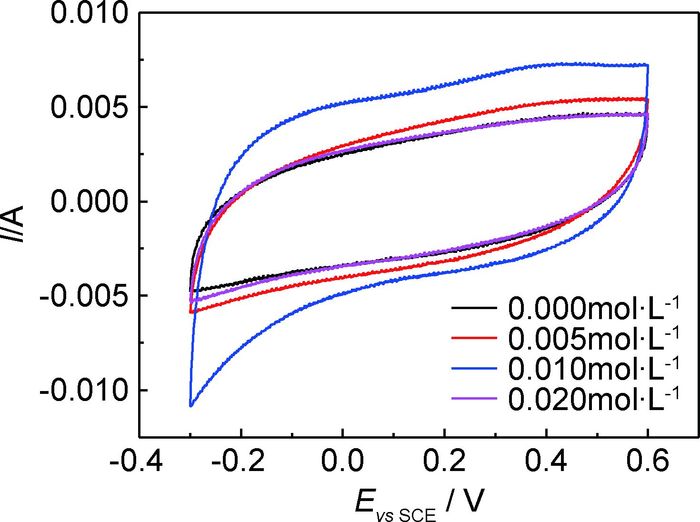
2.2 稀土盐CeCl3含量对Mn-Mo-Ce氧化物电催化性能的影响 2.2.1 对循环伏安曲线的影响图 6为不同CeCl3含量制备的Mn-Mo-Ce氧化物在pH=12,0.5mol·L-1 NaCl溶液中的循环伏安曲线。可见,在-0.3~0.6V电位区间各电极循环伏安曲线呈良好的矩形,阴极和阳极过程对称性较好,相同电位下,阴极过程和阳极过程电流密度相当;不同CeCl3含量制备氧化物的循环伏安曲线包围的面积均大于Mn-Mo氧化物的,随着镀液中CeCl3含量的增加,循环伏安曲线包围面积呈先增加后降低的趋势;当镀液中CeCl3的含量为0.010mol·L-1时,曲线包围面积最大,对其阳极支曲线进行积分,获得阳极循环伏安积分电荷q*=46.90mC·cm-2。有研究表明,q*与电极表面活性点的数目成正比,能够表征电极真实的反应面积[22]。由此可以认为,镀液中CeCl3含量为0.010mol·L-1时,获得的Mn-Mo-Ce氧化物具有较高的电催化活性。
|
图 6 Mn-Mo-Ce氧化物的循环伏安曲线 Fig. 6 Electrode cyclic voltammetry curves of Mn-Mo-Ce oxide |
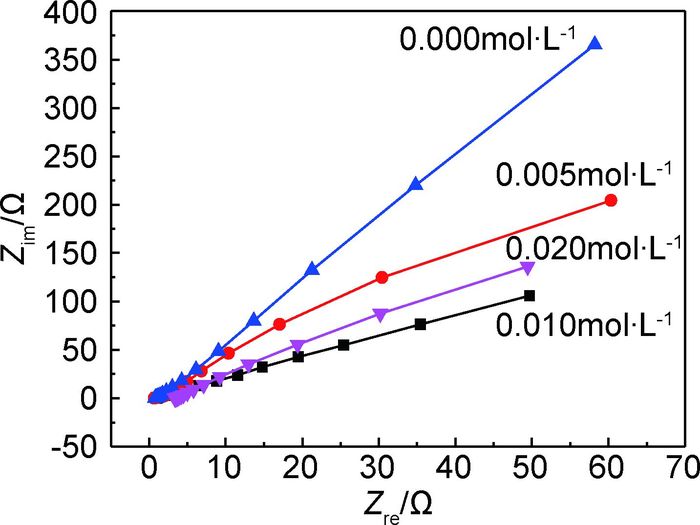
图 7为不同CeCl3含量制备的Mn-Mo-Ce氧化物的电化学交流阻抗谱Nyquist图,表 3为采用Zview软件Rs(CRt)等效电路拟合后的电化学参数,其中Rs为溶液电阻,Rt为电荷转移电阻,C为双电层电容。可见,各氧化物的Nyquist图均表现为1/4容抗弧,Ce的加入降低了容抗弧的半径;没有掺杂Ce时,Mn-Mo氧化物电荷转移电阻为1461Ω·cm2,掺杂Ce后电荷转移电阻出现不同程度降低,随着镀液中CeCl3含量增加,电荷转移电阻先降低后增大,镀液CeCl3含量为0.010mol·L-1时电荷转移电阻最低,为342Ω·cm2。氧化物表面OH-的吸附及扩散速率取决于表面阻抗,阻抗小,使得OH-很容易扩散到氧化物内部的活性位点,增大催化活性。
|
图 7 Mn-Mo-Ce氧化物的电化学交流阻抗谱 Fig. 7 Electrochemical impedance spectroscopy (EIS) of Mn-Mo-Ce oxide |
| CeCl3 content/ (mol·L-1) |
Rs/(Ω·cm2) | C/(μF·cm-2) | Rt/(Ω·cm2) |
| 0.000 | 0.8910 | 0.0160 | 1461.0 |
| 0.005 | 1.2420 | 0.0220 | 534.5 |
| 0.010 | 0.9756 | 0.0421 | 342.0 |
| 0.020 | 3.7790 | 0.0087 | 1082.0 |
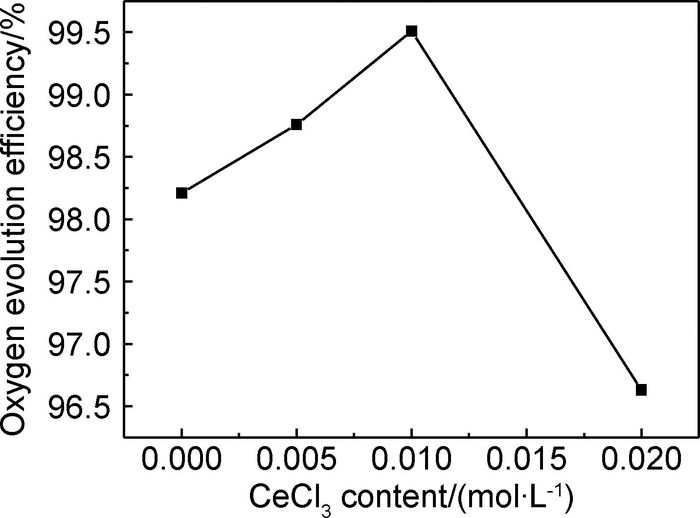
图 8为不同CeCl3含量制备的Mn-Mo-Ce氧化物阳极在模拟海水中析氧效率曲线。Mn-Mo氧化物的析氧效率为98.21%,随着镀液中CeCl3含量的增加,Mn-Mo-Ce氧化物阳极析氧效率呈先增大后降低的趋势,CeCl3含量为0.010mol·L-1时阳极的析氧效率达到99.51%,具有较高的析氧抑氯选择电催化活性。
|
图 8 CeCl3含量与析氧效率的关系 Fig. 8 Relationship of CeCl3 content and oxygen evolution efficiency |
在电解海水氢能开发研究中要求阳极发生析氧反应而抑制析氯反应。理论上pH=12,0.5mol·L-1 NaCl液溶中析氧电位为0.528V(SHE)。析氯电位为1.376V(SHE),从热力学看,碱性海水介质中阳极析氧反应更容易发生,但是由于析氧过程涉及4电子反应,步骤复杂,大多阳极均存在较大析氧过电位和较低的析氯过电位,使析氧真实电位高于析氯真实电位而析氯。在海水介质中具有γ-MnO2晶体结构的Mn系氧化物析氧效率均较高,镀液中CeCl3含量为0.010mol·L-1时获得的Mn-Mo-Ce氧化物阳极几乎100%析氧,具有高的析氧选择电催化性能。研究认为,具有γ-MnO2晶体结构的Mn-Mo-Ce氧化物高效析氧选择电催化性能与暴露的活性(100) 晶面的形貌效应相关。
γ-MnO2的选择电催化性能是由其自身的物理化学性质决定的,Mn系氧化物无论析氧还是析氯首先涉及OH-,Cl-在氧化物表面的吸附。Ruetschi[23]提出γ-MnO2晶体是由[MnO6]八面体以共用棱或共用角排列而成,晶格呈O2-的六面体密堆,Mn4+规则地排列O2-层间八面体链的共用棱上,是包含软锰矿[1×1]隧道和斜方锰矿[1×2]隧道晶胞不规则交替生长而形成单链与双链交替的结构,存在大量阳离子空位、层错等晶格缺陷。缺陷的存在使局部电场失衡,为达到电平衡,每个Mn4+空位有4个质子配位,质子以OH-形式存在,在晶格中由OH-(rOH-=0.137nm)取代O2- (rO2-=0.140nm)时,由于两者离子半径接近,依然能保持正常的晶胞参数[23, 24]。海水介质中存在大量Cl-,从电平衡角度看Cl-也存在被吸附的可能,但由于Cl-半径较大(rCl- =0.184nm),进入γ-MnO2晶格阻力较大,因此,从热力学看缺陷处晶格优先选择吸附OH-,一定程度上起到抑制氯气析出的作用,实现析氧的选择性。
吸附后的Mn4+(OH-)从结构上具备了Pauling模式[25, 26]“单址吸附”的条件,通过4电子途径在Mn4+/Mn3+变价电催化作用下实现析氧,缺陷处Mn4+(OH-)析氧过程如图 9所示。
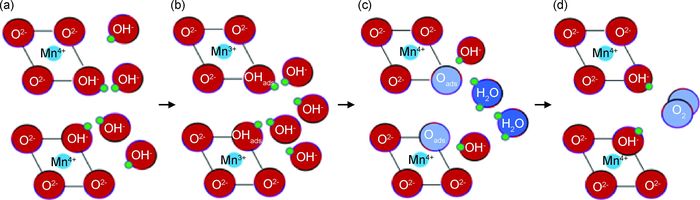
|
图 9 析氧过程示意图 (a)Mn4+(OH-); (b)(Mn3+)OHads; (c)(Mn4+)Oads; (d)析出氧气 Fig. 9 Diagrams of oxygen evolution process (a)Mn4+(OH-); (b)(Mn3+)OHads; (c)(Mn4+)Oads; (d)oxygen evolution |
在电场作用下, 空位处Mn4+(OH-)中OH-将1个电子给予Mn4+而生成(Mn3+)OHads,如图 9(a)及反应(1) 所示;Mn3+不饱和的d层成为O孤对电子的受体,Mn3+增强了对O-H键的氧原子的吸附力,溶液中OH-作用于(OHads)的H+,使(Mn3+)OHads中的O-H键断裂发生脱水反应,同时O-失去1个电子变成吸附态原子O,Mn3+失去1个电子生成Mn4+,如图 9(b),(c)及反应式(2) 所示;两个吸附态原子O结合生成O2,发生脱附,缺陷晶格处再次吸附溶液中OH-,实现电催化析氧过程,如图 9(d)和反应式(3),(4) 所示。其中反应式(2) 的放电过程是析氧的控制步骤。
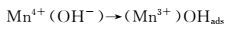
|
(1) |
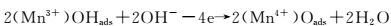
|
(2) |
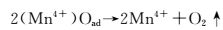
|
(3) |
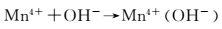
|
(4) |
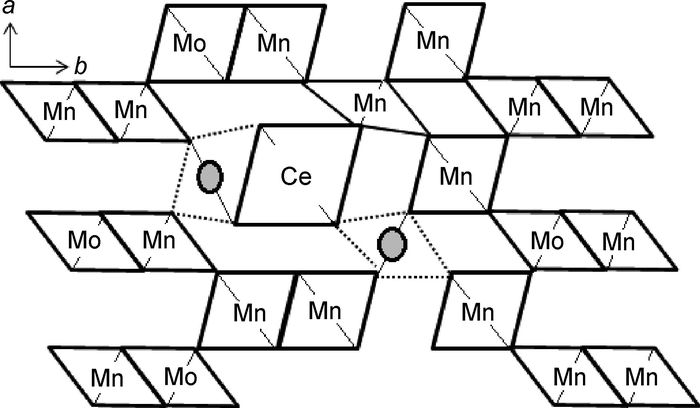
Mn-Mo-Ce氧化物中Mo6+半径(0.065nm)与Mn4+半径(0.054nm)较接近,因此掺杂量较大(最高为21.82%)引起的晶格畸变较小;Ce离子半径(rCe3+=0.102nm,rCe4+=0.097nm)约是Mn4+的2倍,因此Ce掺杂量较少且引起较大晶格畸变。由前面实验结果知,Mn-Mo-Ce氧化物阳极以暴露的活性(100) 晶面为主,图 10是参考文献[23, 27]建立的空位与元素掺杂在γ-MnO2(100) 晶面上的投影图。
|
图 10 空位和元素掺杂在γ-MnO2(100) 晶面的投影 Fig. 10 Projection of vacancy and doping element on the (100) crystal plane of γ-MnO2 |
由图 10可知,在(100) 晶面上半径大的Ce离子对周围晶格产生较大挤压,晶格O2-及Mn4+偏离原来平衡位置,阳离子空位增多,与空位相邻的晶格O2-被OH-取代,增加了反应活性点的数量,同时大的晶格畸变增强了晶格O2-及Mn4+的活性,进一步降低晶格吸附OH-的形成能,明显促进了析氧电催化反应中吸附与放电过程的进行。
镀液中CeCl3含量为0.010mol·L-1时,获得的Mn-Mo-Ce氧化物具有独特的网孔状纳米结构,该纳米结构使Mn-Mo-Ce氧化物暴露了更多的活性(100) 晶面,增加了反应活性点的数量,在循环伏安曲线测试中表现为伏安积分电荷的显著增加。Ce掺杂增大了活性(100) 晶面的晶面间距,从空间上更利于OH-的流动及新生O2的逸出;掺杂元素Ce3+/Ce4+变价化学态的存在,对析氧过程具有同样的电催化机理,协同促进了Mn-Mo-Ce氧化物阳极的电催化活性,从而实现纳米结构催化中的形貌效应。
3 结论(1) 采用阳极电氧化法制备具有γ-MnO2晶型纳米晶Mn-Mo-Ce氧化物,Ce掺杂降低镀层中Mo的含量,增大Mn的含量,使纳米晶形貌由颗粒状向网孔状转变。
(2) 当CeCl3含量为0.010mol·L-1时,Mn-Mo-Ce氧化物以暴露活性(100) 晶面为主,其晶面间距增大且晶面上空位等缺陷显著增多,该阳极在海水中析氧效率达99.51%,具有高效析氧抑氯选择电催化性能。
(3) 由于γ-MnO2结构特性优先吸附OH-,抑制Cl-吸附,OH-在Mn4+/Mn3+变价电催化作用下完成析氧,实现选择电催化过程。
(4) Ce掺杂增加反应活性,促进吸附与放电过程;活性(100) 晶面的晶面间距增大促进了OH-的流动和新生O2的逸出,从纳米形貌效应上实现高效析氧抑氯选择电催化性能。
| [1] | FUJIMURA K, MATSUI T, HABAZAKI H, et al. The durability of manganese molybdenum oxide anodes for oxygen evolution in seawater electrolysis[J]. Electrochimica Acta, 2000, 45 (14): 2297–2303. DOI: 10.1016/S0013-4686(00)00316-9 |
| [2] | HABAZAKI H, MATUI T, KAWASHIMA A, et al. Nanocrystalline manganese-molybdenu-tungsten oxide anodes for oxygen evolution in seawater electrolysis[J]. Scripta Mater, 2001, 44 (8): 1659–1662. |
| [3] |
史艳华, 赵杉林, 梁平, 等. pH值对阳极电沉积Mn-Mo氧化物结构与性能的影响[J].
材料工程, 2016, 44 (12): 7–12.
SHI Y H, ZHAO S L, LIANG P, et al. Effect of pH value on structure and properties of anodic electrodeposited Mn-Mo oxide[J]. Journal of Materials Engineering, 2016, 44 (12): 7–12. DOI: 10.11868/j.issn.1001-4381.2016.12.002 |
| [4] | SUN M, LAN B, YU L, et al. Manganese oxides with different crystalline structures:facile hydrothermal synthesis and catalytic activities[J]. Mater Lett, 2012, 86 : 18–20. DOI: 10.1016/j.matlet.2012.07.011 |
| [5] | TIAN W, YANG H, FAN X, et al. Catalytic reduction of NOx with NH3 over different-shaped MnO2 at low temperature[J]. J Hazard Mater, 2011, 188 (1/3): 105–109. |
| [6] |
李勇, 申文杰. 金属氧化物纳米催化的形貌效应[J].
中国科学:化学, 2012, 42 (4): 376–389.
LI Y, SHEN W J. Morphology-dependent:nanocatalysis on metal oxides[J]. J Sci China Chem, 2012, 42 (4): 376–389. |
| [7] |
付花荣, 孟惠民, 史艳华, 等. 掺杂元素对锰混合氧化物阳极析氧抑氯性能的影响[J].
北京科技大学学报, 2008, 30 (11): 1290–1295.
FU H R, MENG H M, SHI Y H, et al. Influence of doped elements on the property of manganese mixed oxide anode for oxygen production by electrolyzing seawater[J]. Journal of University of Science and Technology Beijing, 2008, 30 (11): 1290–1295. DOI: 10.3321/j.issn:1001-053X.2008.11.016 |
| [8] | JIANG N, MENG H M. The durability of different elements doped manganese dioxide-coated anodes for oxygen evolution in seawater electrolysis[J]. Surface and Coatings Technology, 2012, 206 (21): 4362–4367. DOI: 10.1016/j.surfcoat.2012.04.059 |
| [9] |
姜楠, 孟惠民. 元素掺杂Mn复合氧化物阳极电解海水的催化性和稳定性[J].
功能材料, 2014, 45 (6): 6083–6086.
JIANG N, MENG H M. The synthesis of two-dimensional ultrathin nanosheets by using plant membrane as template and photo catalytic performance[J]. Functional Materials, 2014, 45 (6): 6083–6086. |
| [10] |
王萃, 杨仲年, 张岩. 稀土合金材料电沉积机理的研究进展[J].
应用化工, 2013, 42 (10): 1896–1898.
WANG C, YANG Z N, ZHANG Y. Study on electrodepositing preparation and mechanism of rare earth alloy materials[J]. Applied Chemical Industry, 2013, 42 (10): 1896–1898. |
| [11] |
桂俊峰, 蒋良兴, 钟晓聪, 等. Ag和RE含量对Pb-Ag-RE合金阳极电化学性能的影响[J].
中国有色金属学报, 2015, 25 (1): 111–118.
GUI J F, JIANG L X, ZHONG X C, et al. Effects of Ag and RE contents on electrochemical performance of Pb-Ag-RE alloy anode[J]. Chin J Nonferrous Met, 2015, 25 (1): 111–118. |
| [12] |
邬明钰, 李谋成. 铈对纳米晶锌镀层耐蚀性能的影响[J].
腐蚀与防护, 2013, 23 (2): 129–132.
WU M Y, LI M C. Influence of Ce on corrosion resistance of nanocrystalline zinc coating[J]. Corrosion and Protection, 2013, 23 (2): 129–132. |
| [13] | LI J L, XIONG D S, HUANG Z J, et al. Effect of Ag and CeO2 on friction and wear properties of Ni-base composite at high temperature[J]. Wear, 2009, 267 (1): 576–584. |
| [14] | ZHOU X W, SHEN Y F, JIN H M, et al. Microstructure and depositional mechanism of Ni-P coatings with nano-ceria particles by pulse electrodeposition[J]. Trans Nonferrous Met Soc China, 2012, 22 (22): 1981–1988. |
| [15] | KULP E A, LIMMER S J, BOHANNAN E W, et al. Electrodeposition of nanometer-thick ceria films by oxidation of cerium (Ⅲ)-acetate[J]. Solid State Ionics, 2007, 178 (11/12): 749–757. |
| [16] | QU N S, ZHU D, CHAN K C. Fabrication of Ni-CeO2 nanocomposite by electrodeposition[J]. Scripta Mater, 2006, 54 (7): 1421–1425. DOI: 10.1016/j.scriptamat.2005.10.069 |
| [17] | SEN R, BHATTACHARYA S, DAS S, et al. Effect of surfactant on the co-electrodeposition of the nano-sized ceria particle in the nickel matrix[J]. J Alloys Compd, 2010, 489 (2): 650–658. DOI: 10.1016/j.jallcom.2009.09.142 |
| [18] | SMITH C G, OKINAKA Y. High speed gold plating:anodic bath degradation and search for stable low polarization anodes[J]. J Electrochem Soc, 1983, 11 (130): 2149–2157. |
| [19] |
杨青松, 李纯, 王杰, 等. 阳极电沉积制备CeO2薄膜[J].
中国腐蚀与防护技术, 2012, 32 (1): 34–38.
YANG Q S, LI C, WANG J, et al. Preparation of ceria thin films by anodic electrodeposition[J]. J Chin Soc Corros Rrot, 2012, 32 (1): 34–38. |
| [20] |
何贵平, 张弜, 姚若河. Er3+和Ce3+/Ce4+掺杂β-BaB2O4纳米棒的制备、结构与发光性质[J].
物理化学学报, 2010, 26 (3): 685–690.
HE G P, ZHANG J, YAO R H. Preparation, structure and photolum inescence of Er3+ and Ce3+/Ce4+ doped β-BaB2O4 nanorods[J]. Acta Phys Chim Sin, 2010, 26 (3): 685–690. |
| [21] | KUMAGAI N, SAMATA Y, KAWASHIMA A, et al. Anodic characteristics of amorphous nickel-value metal alloys containing small amounts of platinum group elements in 0.5 M NaCl[J]. J Appl Electrochem, 1987, 17 (2): 347–356. DOI: 10.1007/BF01023301 |
| [22] | SAVINELL R F, LⅡ R L Z, ADAMS J A, et al. Electrochemically active surface area voltammetric charge correlations for ruthenium and iridium dioxide electrodes[J]. Electrochem Soc, 1990, 137 (4): 489–493. |
| [23] | RUETSCHI P. Cation-vacancy model for MnO2[J]. J Electrochem Soc, 1984, 131 (12): 2737–2744. DOI: 10.1149/1.2115399 |
| [24] |
夏熙. 二氧化锰及相关锰氧化物的晶体结构、制备及放电性能(2)[J].
电池, 2005, 35 (1): 27–30.
XIA X. Crystal structure, preparation and discharge performance for manganese dioxides and related manganese oxides(Ⅱ)[J]. Battery, 2005, 35 (1): 27–30. |
| [25] | YEAGER E. Dioxygen electrocatalysis:mechanisms in relation to catalyst structure[J]. J Mol Catal, 1986, 38 (1/2): 5–25. |
| [26] |
张云河, 李新海, 吴显明, 等. PEMFC用Pt-Co/C催化剂的制备及性能[J].
贵金属, 2004, 25 (1): 19–23.
ZHANG Y H, LI X H, WU X M, et al. Preparation and performance of Pt-Co/C catalyst for PEMFC[J]. Precious Metals, 2004, 25 (1): 19–23. |
| [27] | OWEN M P, LAWRANCE G A, DONNE S W. An electrochemical quartz crystal microbalance study into the deposition of manganese dioxide[J]. Electrochimica Acta, 2007, 52 (14): 4630–4639. DOI: 10.1016/j.electacta.2007.01.012 |
 2017, Vol. 45
2017, Vol. 45


