文章信息
- 叶伟杰, 陈楷航, 蔡少龄, 陈利科, 钟同苏, 王小英
- YE Wei-jie, CHEN Kai-hang, CAI Shao-ling, CHEN Li-ke, ZHONG Tong-su, WANG Xiao-ying
- 纳米银的合成及其抗菌应用研究进展
- Progress in Research on Synthesis and Antibacterial Applications of Silver Nanoparticles
- 材料工程, 2017, 45(9): 22-30
- Journal of Materials Engineering, 2017, 45(9): 22-30.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2015.001177
-
文章历史
- 收稿日期: 2015-09-24
- 修订日期: 2017-03-04
2. 深圳市美盈森环保科技股份有限公司, 广东 深圳 518107
2. Shenzhen MYS Environmental Protection & Technology Co., Ltd., Shenzhen 518107, Guangdong, China
近年来,环境微生物灾害事件频繁发生,造成了巨大的经济损失和社会危害。病原微生物在传播过程中通过不断突变,其耐药性越来越强,传统抗菌剂杀菌效果降低[1]。因此,为了防止病原微生物的传播和蔓延,有必要发展新型抗菌材料。目前,抗菌材料主要分为有机抗菌材料和无机抗菌材料,其中有机抗菌材料可细分为天然抗菌材料和有机合成抗菌材料。虽然有机合成抗菌材料抗菌范围广、杀菌速度快,但其毒副作用也相对较大[2];天然抗菌材料的安全性较高,但其使用耐热性差、不易进行再加工[3];无机系抗菌剂具有低毒性、耐热性、持续性和抗菌广谱等优点,但是起效慢以及价格较高[4, 5]。然而,无机抗菌材料具有天然抗菌材料和有机合成抗菌材料无法比拟的优点,逐渐成为抗菌材料领域的研究热点。
在无机金属抗菌材料中,银系抗菌剂的杀菌能力最强[6]。通过纳米技术对银单质或银离子进行加工,可以制备得到粒径在1~100nm的纳米银颗粒(silver nanopartcicles, Ag NPs)[7]。作为新型无机抗菌材料,Ag NPs具有传统银系抗菌剂所无法比拟的优良抗菌效果和安全性。Ag NPs不仅抗菌范围较广、持续杀菌的有效期长,而且无耐药性、安全性高。同时,Ag NPs还具有抗病毒和抗肿瘤等生物活性[7]。目前,Ag NPs的制备与应用已成为抗菌材料的研究热点。
化学还原法是目前最常见的制备稳定态Ag NPs的方法[8]。在水或有机溶剂中,加入适当的还原剂,一定条件下,将银盐还原得到Ag NPs。该方法制备Ag NPs具有方便、快速、粒子尺寸易控制、反应条件温和及对仪器要求低等优点[9]。目前,常用的还原剂有:硼氢化钾、水合肼、氢气、一氧化碳、甲醛、柠檬酸钠、小分子醇和具有还原性的多羟基化合物等[10-12]。在化学还原法制备Ag NPs时,可以通过还原过程和生长过程这两个阶段的控制来调节Ag NPs的粒径[13]。由于团聚作用,Ag NPs的粒径可以从20~45nm增加到120~170nm[14]。因此,用化学还原法制备Ag NPs时往往需要添加稳定剂,稳定剂的存在能和Ag NPs产生较强的相互作用,防止Ag NPs发生团聚[15]。然而,化学稳定剂与还原剂往往难以与Ag NPs彻底分离,极大地限制了Ag NPs的后续应用,并且容易带来环境污染。因此,寻找合适的Ag NPs合成方法是纳米金属领域亟待解决的问题之一。
本文综述了目前Ag NPs的合成方法,并总结了Ag NPs的抗菌机理及其抗菌应用。
1 Ag NPs的主要合成方法目前,Ag NPs的主要合成方法包括多糖法、Tollens试剂法、辐射法、生物法和多金属氧酸盐法。
1.1 多糖法多糖法制备Ag NPs通常是在水相条件下进行,多数情况下多糖仅作为稳定剂,需要另外加入还原剂。Hassabo等[16]以葡萄糖作为还原剂,分别以纤维素粉、微晶纤维素、羧甲基纤维素和壳聚糖作为稳定剂,制备出相应的Ag NPs负载的多糖纳米复合材料。Ag NPs在多糖上的分布形态如图 1所示,红点代表嵌入在多糖表面的Ag NPs,其粒径约4~6nm。结果表明,多糖中的Ag NPs含量因多糖的种类而异(羧甲基纤维素>壳聚糖>纤维素粉>微晶纤维素),取决于多糖的结晶度。另外,Yang等[17]使用桃胶多糖与银离子反应,制备出立方体的Ag NPs,其粒径在23.56~77.87nm。在此过程中,桃胶多糖主要作为稳定剂,调节Ag NPs的生长及聚集状态。当使用具有还原性基团的多糖时,多糖既可以作为还原剂又可以作为稳定剂来制备Ag NPs。Yang等[18]利用芒果皮提取液中的半纤维素作为还原剂和稳定剂制备Ag NPs,其粒度为9~15nm。该研究提出从银离子到Ag NPs有两种可行路径:第一种是在酸性条件下,银离子与羧基和羟基生物分子形成复合物,然后生物分子中的醛类和酮类与银离子复合物发生反应,将银离子还原成Ag NPs。第二种是在碱性条件下,银离子和羟基反应生成氧化银。羧基和羟基失去氢离子形成对应的盐,与氧化银形成复合物。然后生物分子中的醛类和酮类与氧化银复合物发生反应,将氧化银还原成Ag NPs。两种方法中,醛基起主要的还原作用,原有的羧基和羟基以及反应生成的羧基对生成的Ag NPs起稳定作用。多糖法合成的Ag NPs具有较高的稳定性,结合多糖良好的生物相容性,其在生物材料以及医药工程方面具有很好的发展前景[19]。
Tollens试剂法制备Ag NPs的机理是用银氨溶液作为Tollens试剂,以含醛基化合物作为还原剂,其反应见方程式(1)。Tollens试剂法的优点是能够通过一步法控制生成Ag NPs的粒径[20]。
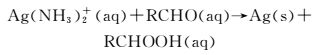
|
(1) |
使用Tollens试剂法制备Ag NPs同样可以使用还原性单糖、多糖或其他化合物作为还原剂和稳定剂。Shen等[21]以醋酸木质素作为还原剂和稳定剂,在微波辐射条件下,通过Tollens反应合成Ag NPs。随着木质素与银离子比例的增加,Ag NPs的粒径会随之增大,Ag NPs呈球状,粒径在21~26nm。其中,木质素具有空间三维结构,可以为Ag NPs提供稳定的载体。另外,Luo等[22]以壳聚糖季铵盐作为还原剂,累托石作为稳定剂,利用快速Tollens反应,制备出剥离型壳聚糖季铵盐/累托石/Ag NPs复合材料。其中,Ag NPs能够稳定分散在壳聚糖季铵盐基质中,部分Ag NPs以插层形式进入累托石层间。
改进Tollens试剂法中,银离子在氨水环境下,利用糖类化合物对其进行还原[23]。[Ag(NH3)2]+是一种通过氨水与银离子强力结合而形成的稳定态的复合物,因此,氨水浓度和还原剂的性质对于控制Ag NPs的粒径至关重要[24]。Liu等[25]以羧甲基壳聚糖季铵盐作为还原剂和稳定剂,在微波辐射条件下,制备出具有球形、圆柱形以及立方体的Ag NPs。Yu等[26]在水相中加入不同浓度的十六烷基三甲基溴化铵(HTAB)、Tollens试剂,制备出直径小于100nm的不同形态的Ag NPs,其TEM像如图 2所示。
利用Tollens试剂法可合成粒径大小可控和形状可控的Ag NPs。由于结晶方式的不同,不同形态的Ag NPs在性能上有很大的差异,可应用于光学、催化以及拉曼增强等方面[27]。
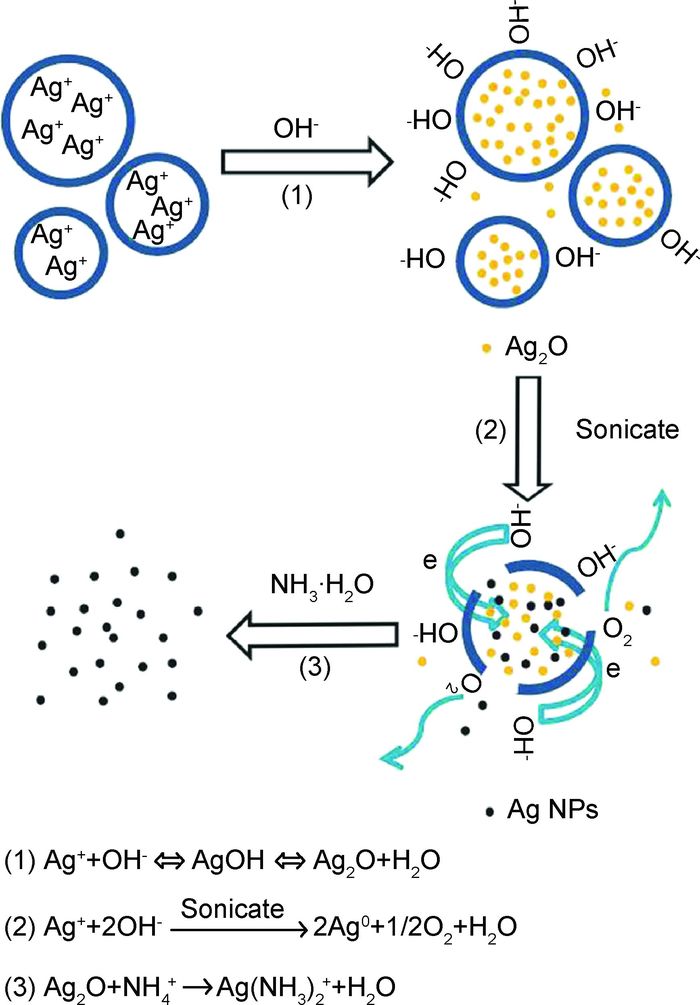
1.3 辐射法除了用多糖和Tollens试剂法之外,还可以通过不同的辐射方法制备Ag NPs。一般来说,辐射法能够有效结合其他方法,作为一种反应过程的改良手段,通过控制辐射的强度和时间等变量,制备出具有特定形态和尺寸的Ag NPs。目前,微波辐射是一种简单快速的合成Ag NPs的手段。在传统加热方法中,温度梯度的存在导致了反应体系中温度的局部差异,从而引起不均匀成核、结晶和生长过程。而微波辐射是穿透性的加热过程,能够使Ag NPs快速均匀成核和快速晶体生长。因此,微波辐射可以得到粒径分布较窄,尺寸较大的Ag NPs。Zhang等[28]使用太阳光照射银的盐溶液,加入有机物(水溶性有机碳),将银离子还原成Ag NPs。探讨了不同pH值对反应的影响,结果发现酸性条件下更有利于Ag NPs的生成。Eghbalifam等[29]使用γ射线辐射AgNO3溶液原位还原得到Ag NPs,并且进一步制备出聚乙烯醇/海藻酸钠/Ag NPs复合薄膜。所得Ag NPs的粒径为43.8~164nm,平均粒径为69.8nm。结果表明,辐射强度越大,Ag NPs的产量越高,并且聚乙烯醇的加入能防止Ag NPs的团聚。此外He等[30]提出了一种利用超声辐射快速制备Ag NPs的方法。在超声反应器中,向NaOH溶液滴加AgNO3溶液,制备出超微Ag NPs,其平均粒径仅为8nm。研究发现,在超声作用下,水分子能够分解成氢自由基(·H)和氢氧自由基(·OH),然后由氢自由基提供电子,银离子得到电子后还原成Ag NPs,其反应过程如图 3所示。
辐射法改变了传统能量的给予方式,可用作直接还原或者辅助还原,灵活性高,能够实现快速、大规模Ag NPs的制备。所得Ag NPs应用广泛,可根据不同的载体选择不同的使用方向。
1.4 生物法在制备Ag NPs的过程中,生物有机体的提取物既可以作为还原剂也可以作为稳定剂。酶/蛋白质、氨基酸、多糖和维生素等生物大分子可以通过复杂的化学反应还原银离子制备Ag NPs。使用植物提取物作为还原剂,还原银离子制备Ag NPs是目前主流的Ag NPs生物合成方法。
利用植物提取物制备Ag NPs具有巨大的潜力。对于不同的植物提取物,所得到的Ag NPs的粒径有明显的区别。Niraimathi等[31]采用莲子草提取物制备Ag NPs,其粒径达到344.4nm。而Baghizadeh等[32]采用金盏花种子提取物制备Ag NPs,其粒径仅为5~10nm。此外,植物苜蓿的提取物、含羞草、芸香草汤和天竺葵叶片或者其他的还原剂也可以用来制备Ag NPs。另外,有研究发现植物提取物中的蛋白质在Ag NPs合成过程中具有还原和控制Ag NPs形态的双重作用。Ahmed等[33]在太阳光照射下,利用植物提取物中的氧化还原蛋白质复合体制备出Ag NPs。氧化还原蛋白质复合体含有铁氧化还原蛋白-NADP+还原酶和铁氧化还原蛋白。结果表明,太阳光和氧化还原蛋白是生成Ag NPs的必要条件,光诱导氧化还原蛋白产生自由基,使银离子还原成Ag NPs,得到的Ag NPs呈球形,其粒径为10~15nm。
生物法充分利用了植物或微生物中的有效成分,有效地减少了化学试剂的使用,是一种环境友好的Ag NPs合成方法。其产物Ag NPs可用于不同领域,如抗菌材料、能源材料和生物材料等[34, 35]。
1.5 多金属氧酸盐法多金属氧酸盐(POMs)具有良好的水溶性、缓释性、结构稳定性以及多电子氧化还原反应,因此在纳米金属制备领域具有很大的潜力。
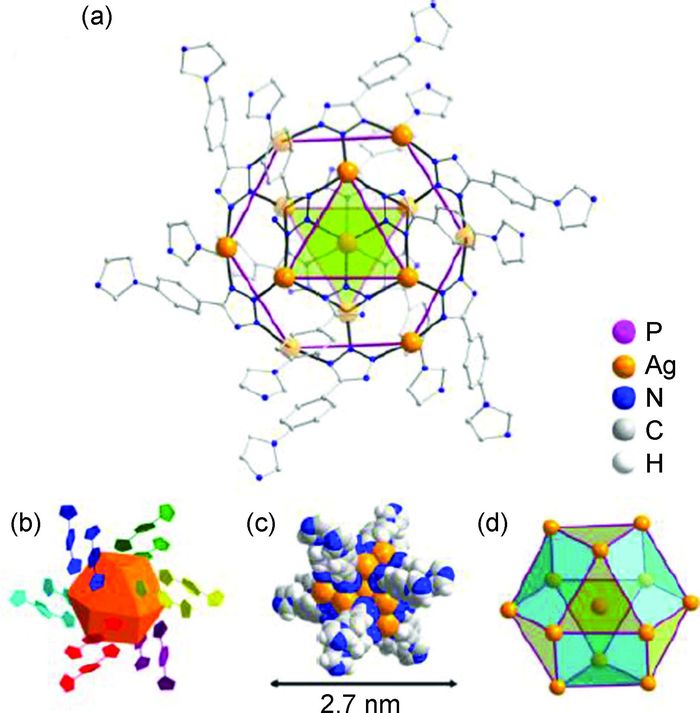
不同的POMs作为还原剂和稳定剂可以制备出形状和大小完全不同的Ag NPs。例如,Zhang等[36]以Ag2SO4与两种不同的POMs反应,制备出球形Ag NPs和银纳米线,两者均具有Ag-POMs核壳结构。此外,在合成Ag NPs的过程中适当加入具有独特结构的配体和模板,同样能够制备出具有特定形状的Ag NPs复合物。Liu等[37]在使用Ag2SO4与H7[β-P(MoVI)4(MoVI)8O40]反应制备Ag NPs的基础上,加入二维氧化石墨烯作为模板,制备出银纳米网/POMs/石墨烯纳米材料。银纳米线平均直径约为40~50nm,其纵横比达到2000,具有极高的导电性和比表面积。Wang等[38]使用POMs阴离子引导方法,以POM:H3PW12O40作为模板,以具有多齿结构的5-(4-imidazol-1-yl-phenyl)-2Htetrazole作为配体,制备出十三核银簇/POM复合物[Ag13L12][PW12O40]4·30H2O。该多核纳米银簇复合物具有风车形状以及立方八面体的拓扑结构,其中Ag13(L)12的结构如图 4所示。
多金属氧酸盐法具有反应快速,条件温和的优点,是一种新型的大规模制备Ag NPs的方法。POMs能够同时作为Ag NPs的还原剂、稳定剂以及形貌控制剂,实现了对Ag NPs在纳米尺度上的调控。因此,Ag NPs-POMs材料具有良好的光学、电学以及催化性能,有利于制备出各种功能性材料[39]。
以上Ag NPs的合成方法各有优点,使用不同方法得到的Ag NPs在性能上会有所差异。一般而言,为了快速、大规模制备高性能的Ag NPs,往往需要多种方法的结合。不同方法的相互交错有利于拓宽Ag NPs应用方向。随着Ag NPs应用领域的不断扩展,其合成手段也将会得到进一步的发展,合成出更精细、更规整和更多样化的Ag NPs多维结构。
2 Ag NPs的抗菌机理金属银、银离子和Ag NPs的抗菌作用机制主要是通过改变细菌细胞的形态和结构,从而使细菌失活,达到抗菌的效果。目前已有研究表明,Ag NPs能够附着在细胞膜的表面阻断细胞的通透性和呼吸功能,特别是当细胞膜上有含硫蛋白质或含磷物质时,Ag NPs会与其产生较强的相互作用[40]。Ag NPs不仅与膜表面反应,同时也可以穿透进入细菌内,攻击呼吸链,阻碍细胞代谢和细胞分裂,促进细胞凋亡[41]。另外,有研究提出Ag NPs的抗菌活性主要依赖于银离子的缓释,银离子可以与含有硫、氧或氮的生物分子中的电子供体结合[42],银离子与蛋白质中的巯基相互作用可能诱发细菌酶的失活,导致DNA分子变性并且无法复原[43]。虽然Ag NPs与银离子均具有良好的抗菌活性,但是Ag NPs的有效浓度为纳摩尔水平,而银离子则在微摩尔水平才有效。因此,Ag NPs比银离子具有更高效的抗菌效果。
尺寸较小的Ag NPs比表面积较大,杀菌作用优于尺寸大的Ag NPs。Panacek等[44]通过比较4种糖类还原[Ag(NH3)2]+得到Ag NPs的抗菌性能发现,采用麦芽糖和乳糖等二糖还原得到的Ag NPs比采用葡萄糖和半乳糖等单糖得到的Ag NPs具有更高的抗菌活性,其原因是采用二糖得到的Ag NPs具有较小的尺寸。Morones等[45]利用高角度环形暗场和扫描透射电子显微镜技术研究了不同尺寸的Ag NPs(1~100nm)对革兰氏阴性菌的影响。结果表明,只有粒径在1~10nm的Ag NPs才能与细菌产生直接的相互作用。
3 Ag NPs及其复合材料的抗菌应用与传统银系抗菌剂相比,Ag NPs材料由于其极大的比表面积特性,容易与病原微生物密切接触,不仅具有更加显著的抗菌效果,而且安全性更高,持续效力更长[7]。
在医疗过程中,感染是最常见的并发症和患者死亡的原因,因此具有抗菌作用的银已被纳入各种医疗应用。有研究表明,在抗生素中掺杂Ag NPs能够起到协同效果。Ibrahim[46]利用香蕉皮提取液制备Ag NPs。Ag NPs除了对典型的病原体细菌和酵母菌有明显的抑制效果,还能够与左氧氟沙星抗生素产生协同抗菌效果。Ag NPs的存在提高了抗生素对菌株的抗菌活性,抗菌效果可以提高1.16~1.32倍。Zhong等[47]利用微波辐射法快速制备了Ag NPs/羧甲基壳聚糖季铵盐/有机累托石纳米复合材料,通过静电交联得到负载Ag NPs羧甲基壳聚糖季铵盐/海藻酸钠聚电解质海绵。该复合海绵对金黄色葡萄球菌、大肠杆菌和黑曲霉有良好的抑制效果,以其作为创伤敷料,用于处理伤口,有明显的止血效果和促进伤口愈合的能力。目前,英国施乐辉公司已经生产出Ag NPs敷料-ACTICOAT,有效对抗150种病原体,有效控制烧伤、烫伤程度,预防伤口感染,促进组织再生[48]。
抗菌织物是Ag NPs抗菌剂的一个重要发展方向。通过后整理技术将纤维、纱线、织物或成衣浸入含有抗菌物质的溶液中可获得具有抗菌能力的织物,该方法操作简单,成本低。Lu等[34]将经过聚多巴胺包覆蚕丝纤维织物浸入AgNO3溶液中反应,得到Ag NPs-聚多巴胺-蚕丝纤维织物。与原来纤维织物相比,负载了Ag NPs的纤维织物对金黄色葡萄球菌和大肠杆菌有明显的抑制效果。Yang等[18]利用芒果皮提取液制备Ag NPs,并且进一步将Ag NPs负载到无纺布上进行抗菌研究。研究显示,负载纳米银的无纺布对大肠杆菌、葡萄球菌和枯草杆菌具有良好的抗菌活性。
抗菌涂料是抗菌织物的进一步发展。具有抗菌功能的Ag NPs抗菌涂料,可以涂覆到各种材料的表面,极大地拓展了Ag NPs抗菌剂的应用范围。相关研究表明Ag NPs抗菌涂料可有效抑制和杀灭环境中的有害微生物,降低环境微生物对人体的危害,改善生活环境和提高生活质量,具有十分重要的意义。Kokura等[49]对Ag NPs进行了抗菌活性以及临床研究,发现在中波紫外线照射下,Ag NPs不会影响人类角质细胞的正常生长,并且不会穿透人类皮肤,有望应用于化妆品防腐剂。Ling等[50]以羧甲基壳聚糖季铵盐为还原剂,有机蒙脱土为稳定剂制备了Ag NPs抗菌剂,并且将Ag NPs抗菌剂分别以表面涂布法和内部添加法对纤维进行加工,得到复合抗菌纸。结果显示,表面涂布的抗菌纸其抗菌效果要优于内部添加的。
在国内外,Ag NPs抗菌涂料的发展都十分迅速,广泛应用于建筑装饰、工业器件等领域,还可以用在日常生活用品上[51, 52]。如我国晨光公司研制的Ag NPs内墙抗菌涂料,能有效抑制室内微生物生长,广泛用于家居、食品、工厂和医院等场所装修。韩国LG公司将Ag NPs与家用电器完美结合,如抗菌冰箱、抗菌空调和抗菌显示器,降低了环境中微生物的威胁,提高生活质量。日本ARTGENIC公司已经研发出Ag NPs抗菌树脂,并引入到其美甲产品中,有效解决日益严重的美甲卫生问题。
在大气污染和水污染方面,Ag NPs抗菌材料也能够发挥出重要的作用。生物气溶胶是大气颗粒物的源头,也是造成急性和慢性疾病的重要原因。目前,活性碳纤维过滤器被广泛用于从空气中去除有害气体污染物。然而,吸附饱和的活性碳纤维过滤器容易引起二次污染,其本身又成为一个生物气溶胶的来源。Yoon等[53]制备了含银涂层的活性碳纤维过滤器,该过滤器可以有效去除生物气溶胶。日常生活中,水中的微生物极易传播疾病,危害人类健康;工业生产中,水中的微生物会形成生物膜,引起设备的腐蚀和堵塞,影响工业生产。研究表明,含有Ag NPs的抗菌水过滤器能够降低水中的有害微生物,减少如腹泻和脱水等与水有关的疾病的患病风险[54]。
Ag NPs抗菌材料也可以在食品包装领域得到应用。Ag NPs具有高温稳定性和低挥发性的加工优势,因此可以用来作为抗菌食品包装材料。目前,抗菌食品包装中使用的主要是基于Ag NPs的纳米复合材料。Kanmani等[55]制备明胶/Ag NPs复合薄膜并研究了其对常见食源性病原微生物(大肠杆菌、沙门氏菌、李斯特菌、金黄色葡萄球菌和芽孢杆菌)的抗菌效果。当Ag NPs的含量为40mg时,复合薄膜(5cm×5cm×91μm)具有最佳的抗菌效果,除了李斯特菌,其他病原菌均能够在12h内得到完全抑制。Emamifar等[56]用含有Ag NPs的低密度聚乙烯复合材料包装薄膜在4℃下保鲜新鲜橙汁。结果表明,复合包装材料能够有效减少微生物生长。此外,在传统食品包装中,通常加入乙烯吸收剂来减少乙烯含量,但是效果并不理想,而Ag NPs具有良好的催化性能,能够催化乙烯氧化反应,加速氧化果蔬食品释放出的乙烯,从而减少包装中乙烯含量。因此,在食品包装中添加Ag NPs有助于延长水果和蔬菜的保质期[57]。
4 结束语纳米技术作为新兴科学技术,已经逐渐发展成为一门集前沿性、交叉性和多学科特征的新兴研究领域,其理论基础、研究对象涉及物理学、化学、材料学、生物学等多个不同的学科,纳米材料将成为一种最具有市场应用潜力的新型材料。Ag NPs是纳米金属材料中的重要组成部分,其制备及研究已经成为当今的热点。国内外学者致力于Ag NPs的新型制备工艺研究,提出了大量关于制备Ag NPs的方法,制备更加温和,成本更加低廉,并且避免使用毒性化学试剂,减少对环境的污染。再者,新型制备Ag NPs技术极大地推动了银系抗菌剂在抗菌领域的发展,高效、低毒、广谱和持久的杀菌性能,以及促进伤口修复的再生能力,使得Ag NPs抗菌材料在医用、日用和工业等领域得到逐步应用。相信在不久的将来,Ag NPs产品和应用将越来越广泛。
| [1] |
王严, 宁唤唤, 梁鹰, 等. 细菌耐药性的起源与演变[J].
基因组学与应用生物学, 2015, 34 (4): 855–861.
WANG Y, NING H H, LIANG Y, et al. The origin of resistance genes and evolution of antibiotic resistance[J]. Genomics and Applied Biology, 2015, 34 (4): 855–861. |
| [2] | BOUND D J, MURTHY P S, SRINIVAS P. Synthesis and antibacterial properties of 2, 3-dideoxyglucosides of terpene alcohols and phenols[J]. Food Chemistry, 2015, 185 (1): 192–199. |
| [3] | GORRASI G. Dispersion of halloysite loaded with natural antimicrobials into pectins:characterization and controlled release analysis[J]. Carbohydrate Polymers, 2015, 127 (1): 47–53. |
| [4] | FANG M, CHEN J H, XU X L, et al. Antibacterial activities of inorganic agents on six bacteria associated with oral infections by two susceptibility tests[J]. International Journal of Antimicrobial Agents, 2006, 27 (6): 513–517. DOI: 10.1016/j.ijantimicag.2006.01.008 |
| [5] |
马建中, 惠爱平, 刘俊莉. 纳米ZnO抗菌材料的研究进展[J].
功能材料, 2014, 24 (45): 24001–24007.
MA J Z, HUI A P, LIU J L. Research progress on antibacterial materials of nano-ZnO[J]. Journal of Functional Materials, 2014, 24 (45): 24001–24007. |
| [6] |
王静, 水中和, 冀志江, 等. 银系无机抗菌材料研究进展[J].
材料导报, 2012, 27 (9): 59–78.
WANG J, SHUI Z H, JI Z J, et al. Research progress of the silver-typed inorganic antibacterial materials[J]. Materials Review, 2012, 27 (9): 59–78. |
| [7] | RAI M, YADAV A, GADE A. Silver nanoparticles as a new generation of antimicrobials[J]. Biotechnology Advances, 2009, 27 (1): 76–83. DOI: 10.1016/j.biotechadv.2008.09.002 |
| [8] | TAO A, SINSERMSUKSAKUL P, YANG P. Polyhedral silver nanocrystals with distinct scattering signatures[J]. Angewandte Chemie International Edition, 2006, 45 (28): 4597–4601. DOI: 10.1002/(ISSN)1521-3773 |
| [9] | SONG J Y, KIM B S. Rapid biological synthesis of silver nanoparticles using plant leaf extracts[J]. Bioprocess and Biosystems Engineering, 2009, 32 (1): 79–84. DOI: 10.1007/s00449-008-0224-6 |
| [10] | ZHANG Q, LI N, GOEBL J, et al. A systematic study of the synthesis of silver nanoplates:is citrate a "magic" reagent?[J]. Journal of the American Chemical Society, 2011, 133 (46): 18931–18939. DOI: 10.1021/ja2080345 |
| [11] | SHARMA V K, YNGARD R A, LIN Y. Silver nanoparticles:green synthesis and their antimicrobial activities[J]. Advances in Colloid and Interface Science, 2009, 145 (1): 83–96. |
| [12] | KASTHURI J, VEERAPANDIAN S, RAJENDIRAN N. Biological synthesis of silver and gold nanoparticles using apiin as reducing agent[J]. Colloids and Surfaces B:Biointerfaces, 2009, 68 (1): 55–60. DOI: 10.1016/j.colsurfb.2008.09.021 |
| [13] | CREIGHTON J A, BLATCHFORD C G, ALBRECHT M G. Plasma resonance enhancement of Raman scattering by pyridine adsorbed on silver or gold sol particles of size comparable to the excitation wavelength[J]. Journal of the Chemical Society, Faraday Transactions 2:Molecular and Chemical Physics, 1979, 75 (1): 790–798. |
| [14] | RIVAS L, SANCHEZ-CORTES S, GARCIA-RAMOS J, et al. Growth of silver colloidal particles obtained by citrate reduction to increase the Raman enhancement factor[J]. Langmuir, 2001, 17 (3): 574–577. DOI: 10.1021/la001038s |
| [15] | AHMED K B A, KALLA D, UPPULURI K B, et al. Green synthesis of silver and gold nanoparticles employing levan, a biopolymer from acetobacter xylinum NCIM 2526, as a reducing agent and capping agent[J]. Carbohydrate Polymers, 2014, 112 (1): 539–545. |
| [16] | HASSABO A G, NADA A A, IBRAHIM H M, et al. Impregnation of silver nanoparticles into polysaccharide substrates and their properties[J]. Carbohydrate Polymers, 2015, 122 (1): 343–350. |
| [17] | YANG N, WEI X F, LI W H. Sunlight irradiation induced green synthesis of silver nanoparticles using peach gum polysaccharide and colorimetric sensing of H2O2[J]. Material Letters, 2015, 154 (1): 21–24. |
| [18] | YANG N, LI W H. Mango peel extract mediated novel route for synthesis of silver nanoparticles and antibacterial application of silver nanoparticles loaded onto non-woven fabrics[J]. Industrial Crops and Products, 2013, 48 (1): 81–88. |
| [19] | SATHIYANARAYANAN G, KIRAN G S, SELVIN J. Synthesis of silver nanoparticles by polysaccharide bioflocculant produced from marine bacillus subtilis MSBN17[J]. Colloids and Surfaces B:Biointerfaces, 2013, 102 (1): 13–20. |
| [20] | YIN Y D, LI Z Y, ZHONG Z Y, et al. Synthesis and characterization of stable aqueous dispersions of silver nanoparticles through the Tollens process[J]. Journal of Materials Chemistry, 2002, 12 (3): 522–527. DOI: 10.1039/b107469e |
| [21] | SHEN Z G, LUO Y Q, WANG Q, et al. High-value utilization of lignin to synthesize ag nanoparticles with detection capacity for Hg2+[J]. ACS Applied Materials & Interfaces, 2014, 6 (18): 16147–16155. |
| [22] | LUO J W, XIE M J, WANG X Y. Green fabrication of quaternized chitosan/rectorite/Ag NP nanocomposites with antimicrobial activity[J]. Biomedical Materials, 2014, 9 (1): 011001. DOI: 10.1088/1748-6041/9/1/011001 |
| [23] | LI X Y, LIU B, YE W J, WANG X Y, et al. Effect of rectorite on the synthesis of Ag NP and its catalytic activity[J]. Materials Chemistry and Physics, 2015, 151 (1): 301–307. |
| [24] | LUO Y Q, SHEN S Q, LUO J W, et al. Green synthesis of silver nanoparticles in xylan solution via Tollens reaction and their detection for Hg2+[J]. Nanoscale, 2015, 7 (2): 690–700. DOI: 10.1039/C4NR05999A |
| [25] | LIU B, LI X Y, ZHENG C F, et al. Facile and green synthesis of silver nanoparticles in quaternized carboxymethyl chitosan solution[J]. Nanotechnology, 2013, 24 (23): 235601. DOI: 10.1088/0957-4484/24/23/235601 |
| [26] | YU D, YAM V W W. Hydrothermal-induced assembly of colloidal silver spheres into various nanoparticles on the basis of HTAB-modified silver mirror reaction[J]. Journal of Physical Chemistry B, 2005, 109 (12): 5497–5503. DOI: 10.1021/jp0448346 |
| [27] | SUN Y, XIA Y. Shape-controlled synthesis of gold and silver nanoparticles[J]. Science, 2002, 298 (5601): 2176–2179. DOI: 10.1126/science.1077229 |
| [28] | ZHANG Z, YANG X Y, SHEN M H, et al. Sunlight-driven reduction of silver ion to silver nanoparticle by organic matter mitigates the acute toxicity of silver to daphnia magna[J]. Journal of Environmental Sciences, 2015, 35 (1): 62–68. |
| [29] | EGHBALIFAM N, FROUNCHI M, DADBIN S. Antibacterial silver nanoparticles in polyvinyl alcohol/sodium alginate blend produced by gamma irradiation[J]. International Journal of Biological Macromolecules, 2015, 80 (1): 170–176. |
| [30] | HE C D, LIU L L, FANG Z G, et al. Formation and characterization of silver nanoparticles in aqueous solution via ultrasonic irradiation[J]. Ultrasonics Sonochemistry, 2014, 21 (2): 542–548. DOI: 10.1016/j.ultsonch.2013.09.003 |
| [31] | NIRAIMATHI K, SUDHA V, LAVANYA R, et al. Biosynthesis of silver nanoparticles using Alternanthera sessilis (Linn.) extract and their antimicrobial, antioxidant activities[J]. Colloids and Surfaces B:Biointerfaces, 2013, 102 (1): 288–291. |
| [32] | BAGHIZADEH A, RANJBAR S, GUPTA V K, et al. Green synthesis of silver nanoparticles using seed extract of calendula officinalis in liquid phase[J]. Journal of Molecular Liquids, 2015, 207 (1): 159–163. |
| [33] | AHMED K B A, SENTHILNATHAN R, MEGARAJAN S, et al. Sunlight mediated synthesis of silver nanoparticles using redox phytoprotein and their application in catalysis and colorimetric mercury sensing[J]. Journal of Photochemistry and Photobiology B Biology, 2015, 151 (1): 39–45. |
| [34] | LU Z, XIAO J, WANG Y, et al. In situ synthesis of silver nanoparticles uniformly distributed on polydopamine-coated silk fibers for antibacterial application[J]. Journal of Colloid and Interface Science, 2015, 452 (1): 8–14. |
| [35] | DURÁN N, MARCATO P D, ALVES O L, et al. Mechanistic aspects of biosynthesis of silver nanoparticles by several fusarium oxysporum strains[J]. Journal of Nanobiotechnology, 2005, 3 (8): 1–7. |
| [36] | ZHANG G, KEITA B, DOLBECQ A, et al. Green chemistry-type one-step synthesis of silver nanostructures based on MoV-MoVI mixed-valence polyoxometalates[J]. Chemistry of Materials, 2007, 19 (24): 5821–5823. DOI: 10.1021/cm7020142 |
| [37] | LIU R J, YU X L, ZHANG G J, et al. Polyoxometalate-mediated green synthesis of a 2D silver nanonet/graphene nanohybrid as a synergistic catalyst for the oxygen reduction reaction[J]. Journal of Materials Chemistry A, 2013, 1 (38): 11961–11969. DOI: 10.1039/c3ta12941a |
| [38] | WANG L, YANG W T, ZHU W, et al. A nanosized {Ag@Ag12} "molecular windmill" templated by polyoxometalates anions[J]. Inorganic Chemistry, 2014, 53 (21): 11584–11588. DOI: 10.1021/ic501657p |
| [39] | TROUPIS A, TRIANTIS T, HISKIA A, et al. Rate-redox-controlled size-selective synthesis of silver nanoparticles using polyoxometalates[J]. European Journal of Inorganic Chemistry, 2008, 2008 (36): 5579–5586. DOI: 10.1002/ejic.v2008:36 |
| [40] | LIU B, SHEN S Q, LUO J W, et al. One-pot green synthesis and antimicrobial activity of exfoliated Ag NP-loaded quaternized chitosan/clay nanocomposites[J]. RSC Advances, 2013, 3 (25): 9714–9722. DOI: 10.1039/c3ra41270a |
| [41] | SONDI I, SALOPEK-SONDI B. Silver nanoparticles as antimicrobial agent:a case study on E. coli as a model for gram-negative bacteria[J]. Journal of Colloid and Interface Science, 2004, 275 (1): 177–182. DOI: 10.1016/j.jcis.2004.02.012 |
| [42] | KUMAR R, M NSTEDT H. Silver ion release from antimicrobial polyamide/silver composites[J]. Biomaterials, 2005, 26 (14): 2081–2088. DOI: 10.1016/j.biomaterials.2004.05.030 |
| [43] | FENG Q, WU J, CHEN G, et al. A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus[J]. Journal of Biomedical Materials Research, 2000, 52 (4): 662–668. DOI: 10.1002/(ISSN)1097-4636 |
| [44] | PANCEK A, KVITEK L, PRUCEK R, et al. Silver colloid nanoparticles:synthesis, characterization, and their antibacterial activity[J]. Journal of Physical Chemistry B, 2006, 110 (33): 16248–16253. DOI: 10.1021/jp063826h |
| [45] | MORONES J R, ELECHIGUERRA J L, CAMACHO A, et al. The bactericidal effect of silver nanoparticles[J]. Nanotechnology, 2005, 16 (10): 2346. DOI: 10.1088/0957-4484/16/10/059 |
| [46] | IBRAHIM H M. Green synthesis and characterization of silver nanoparticles using banana peel extract and their antimicrobial activity against representative microorganisms[J]. Journal of Radiation Research and Applied Sciences, 2015, 8 (3): 265–275. DOI: 10.1016/j.jrras.2015.01.007 |
| [47] | ZHONG H Q, YE W J, LI X Y, et al. Polyelectrolyte sponge reinforced with organic rectorite and silver nanoparticles[J]. Current Nanoscience, 2013, 9 (6): 742–746. DOI: 10.2174/15734137113099990081 |
| [48] | ARGIROVA M, HADJⅡSKI O. Application of the nanocrystalline silver in treatment of burn wounds in children[M].[S.l.]:INTECH Open Access Publisher, 2011:237-265. |
| [49] | KOKURA S, HANDA O, TAKAGI T, et al. Silver nanoparticles as a safe preservative for use in cosmetics[J]. Nanomedicine:Nanotechnology, Biology and Medicine, 2010, 6 (4): 570–574. DOI: 10.1016/j.nano.2009.12.002 |
| [50] | LING Y Z, LUO Y Q, LUO J W, et al. Novel antibacterial paper based on quaternized carboxymethyl chitosan/organic montmorillonite/Ag NP nanocomposites[J]. Industrial Crops and Products, 2013, 51 (1): 470–479. |
| [51] | KUMAR A, VEMULA P K, AJAYAN P M, et al. Silver-nanoparticle-embedded antimicrobial paints based on vegetable oil[J]. Nature Materials, 2008, 7 (3): 236–241. DOI: 10.1038/nmat2099 |
| [52] |
程明明, 柴立元, 彭兵, 等. 抗菌陶瓷的研究现状及展望[J].
材料导报, 2005, 19 (9): 47–49.
CHENG M M, CHAI L Y, PENG B, et al. Current research status and prospect of antibacterial ceramics[J]. Materials Review, 2005, 19 (9): 47–49. |
| [53] | YOON K Y, BYEON J H, PARK C W, et al. Antimicrobial effect of silver particles on bacterial contamination of activated carbon fibers[J]. Environmental Science & Technology, 2008, 42 (4): 1251–1255. |
| [54] | CLASEN T F, BROWN J, COLLIN S, et al. Reducing diarrhea through the use of household-based ceramic water filters:a randomized, controlled trial in rural Bolivia[J]. The American Journal of Tropical Medicine and Hygiene, 2004, 70 (6): 651–657. |
| [55] | KANMANI P, RHIM J W. Physicochemical properties ofgelatin/silver nanoparticle antimicrobial composite films[J]. Food Chemistry, 2014, 148 (1): 162–169. |
| [56] | EMAMIFAR A, KADIVAR M, SHAHEDI M, et al. Evaluation of nanocomposite packaging containing Ag and ZnO on shelf life of fresh orange juice[J]. Innovative Food Science & Emerging Technologies, 2010, 11 (4): 742–748. |
| [57] | HU A W, FU Z H. Nanotechnology and its application in packaging and packaging machinery[J]. Packaging Engineering, 2003, 24 (1): 22–24. |
 2017, Vol. 45
2017, Vol. 45