文章信息
- 曲家惠, 陈金垒, 李红, 张文杰
- QU Jia-hui, CHEN Jin-lei, LI Hong, ZHANG Wen-jie
- 溶胶-凝胶法制备xLa-3%In-TiO2光催化材料
- xLa-3%In-TiO2 Photocatalytic Material Prepared by Sol-gel Method
- 材料工程, 2017, 45(8): 14-18
- Journal of Materials Engineering, 2017, 45(8): 14-18.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2015.000948
-
文章历史
- 收稿日期: 2015-08-10
- 修订日期: 2017-03-03
光催化净化技术经过近50年的研究和发展,已经逐渐被应用于环境污染物的降解处理过程[1]。大量的研究集中在制备新型和高效的光催化材料,其中研究最为广泛的材料是TiO2[2, 3]。纳米TiO2已广泛应用于水、大气污染物的处理,对各种类型的污染物都表现出令人关注的活性[4-6]。然而,TiO2禁带宽度较大、对光的利用率低,尤其不能利用太阳光谱中占绝大多数能量的可见光和近紫外光;因此,对TiO2进行改性以提高其对污染物的光催化活性,受到了研究者的广泛关注。离子掺杂是对TiO2的一种主要改性手段,掺杂了某些离子的TiO2在多种污染物的降解中都发挥了更强的能力[7-9]。
近年来,两种离子共掺杂TiO2受到了一些学者的关注。与掺杂了单一离子的TiO2相比,三元TiO2体系表现出更高的光催化活性。Liu等采用溶胶-凝胶法合成了Ce,V共掺杂TiO2光催化剂,能抑制电子和空穴的复合并进而提高其光催化活性[10]。Chen等采用溶胶-凝胶法制备In2O3/SnO2掺杂TiO2材料,促进了光生电子的转移,增加了对可见光的吸收率[11]。
稀土元素特殊的电子轨道结构为电子迁移提供了良好的途径,可以促进电子和空穴的分离,提高TiO2的光催化效率[12-14]。然而,对于In与稀土元素共掺杂TiO2光催化剂的研究还鲜有报道。在作者前期制备In掺杂TiO2光催化剂的基础上[15],本工作采用溶胶-凝胶法制备xLa-3%(摩尔分数,下同)In-TiO2光催化剂,并通过XRD,SEM,比表面,孔径分布等表征手段研究La掺杂对3%In-TiO2光催化剂结构和活性的影响。
1 实验方法 1.1 材料制备采用溶胶-凝胶法制备La掺杂3%In-TiO2光催化剂。首先将0.0675g硝酸铟和一定量氯化镧加入到8mL无水乙醇中完全溶解,再加入2mL钛酸四正丁酯和0.1mL浓盐酸,配成前驱液,搅拌30min。然后将4mL无水乙醇和0.9mL水的混合液缓慢滴入前驱液中,继续搅拌一段时间直到形成凝胶。将凝胶在室温下陈化24h后,置于80℃烘箱中烘干,之后研磨成粉末。将粉末放入程控箱式电炉,以5℃/min速率升温至400℃煅烧3h,冷却至室温后研磨。最后将研磨后的样品记做xLa-3%In-TiO2,其中x为La/Ti的摩尔分数(%),3%In代表In/Ti的摩尔分数为3%。
1.2 材料表征采用D/max-r B型X射线衍射仪测定催化剂的晶体结构,CuKα射线。采用S-3400N型扫描电镜观察光催化剂表面形貌,样品表面喷金以消除电荷积累。采用F-Sorb3400分析仪进行比表面积及孔径测试。
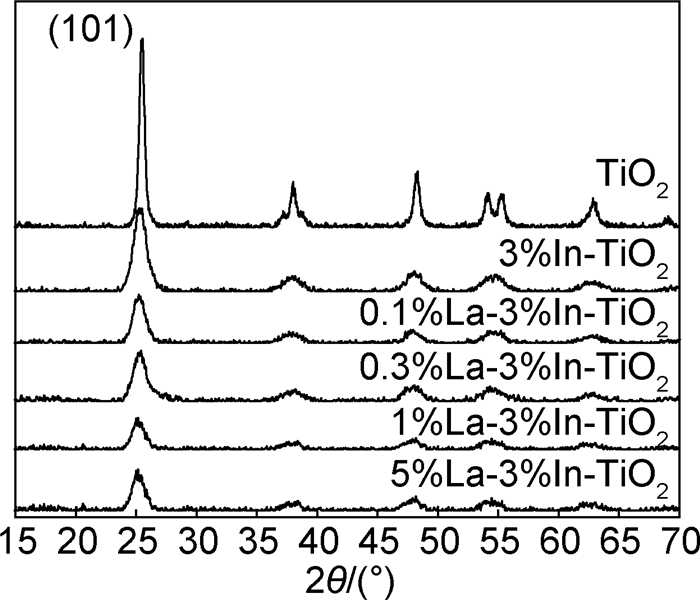
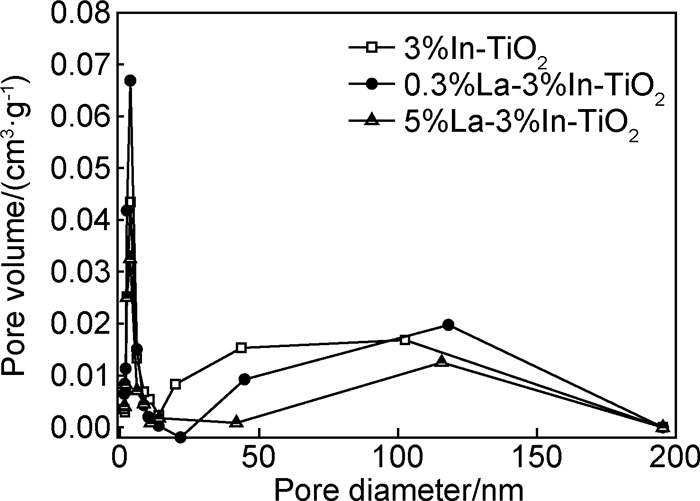
1.3 光催化反应通过甲基橙溶液脱色率的变化来检验光催化剂的吸附和降解活性,光催化反应激发光源为20W石英紫外灯(主波长为253.7nm)。在100mL石英烧杯中加入50mL甲基橙溶液和催化剂,甲基橙初始浓度为10mg/L,催化剂浓度为300mg/L。使用721E型可见分光光度计在甲基橙最大吸收波长468nm处测定甲基橙初始吸光度,记做A0。实验中先将溶液避光磁力搅拌60min,待吸附平衡后取样5mL,用微滤膜(孔径为0.22μm)过滤后测定甲基橙吸光度,记做A1。随后开启光源,将反应溶液置于紫外灯正下方固定距离,光照强度为1300μW/cm2(UV-B型紫外辐照计测定),光照30min后取样,经微滤膜过滤后再次测定吸光度,记做A2。根据Lambert-Beer定律计算甲基橙溶液浓度。染料在催化剂上的吸附率WA和光催化降解率WP的计算方法如下所示:
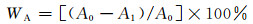
|
(1) |
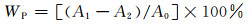
|
(2) |
图 1为TiO2,3%In-TiO2和xLa-3%In-TiO2的XRD图谱,所有样品的衍射峰与锐钛矿TiO2基本吻合,表明所制样品均为四方晶系锐钛矿型结构。引入In后,样品(101) 面峰强度明显降低,说明In的掺杂导致TiO2结晶度的下降。进一步引入La后,样品(101) 面的峰强度进一步降低,半峰宽变大。由于一部分La未能进入到TiO2晶格中,而是均匀地分布在TiO2表面,经表面相互作用形成Ti—O—La键,这种键的存在能阻止晶粒的生长[16]。根据Scherrer公式由锐钛矿TiO2 (101) 晶面半峰宽数据计算得出,La的摩尔分数从0.1%到5%的样品中TiO2晶粒尺寸依次分别为6.7,6.4,6.0,6.2nm。TiO2与3%In-TiO2的晶粒尺寸分别为23.9nm和8.9nm,掺杂La样品的TiO2晶粒尺寸均有所减小。In3+,La3+以置换型进入TiO2晶格中,导致晶胞参数和晶胞体积增大,不同La掺杂量的xLa-3%In-TiO2的晶格参数如表 1所示。
|
图 1 TiO2, 3%In-TiO2和xLa-3%In-TiO2的XRD图谱 Fig. 1 XRD patterns of TiO2, 3%In-TiO2 and xLa-3%In-TiO2 |
| Sample | a(=b)/nm | c/nm | V/nm3 |
| TiO2 | 0.37828 | 0.94762 | 0.13560 |
| 3%In-TiO2 | 0.37952 | 0.94792 | 0.13653 |
| 0.1%La-3%In-TiO2 | 0.37956 | 0.94877 | 0.13669 |
| 0.3%La-3%In-TiO2 | 0.37953 | 0.94952 | 0.13677 |
| 1%La-3%In-TiO2 | 0.37973 | 0.95030 | 0.13703 |
| 5%La-3%In-TiO2 | 0.37974 | 0.95031 | 0.13704 |
图 2为不同La掺杂量的xLa-3%In-TiO2的SEM照片。可以看出,不同La掺杂量的xLa-3%In-TiO2样品的颗粒形状都不规则,样品中存在很多小颗粒,同时分布着少数4~6μm的大颗粒。溶胶-凝胶过程制备的材料主要由小颗粒组成,然而高温煅烧所引起的颗粒团聚导致了大颗粒的存在。材料制备过程中的研磨处理未能粉碎少量的大颗粒。

|
图 2 不同La掺杂量的xLa-3%In-TiO2的SEM照片 (a)3%In-TiO2; (b)0.1%La-3%In-TiO2; (c)0.3%La-3%In-TiO2; (d)1%La-3%In-TiO2; (e)5%La-3%In-TiO2 Fig. 2 SEM images of xLa-3%In-TiO2 with different La contents (a)3%In-TiO2; (b)0.1%La-3%In-TiO2; (c)0.3%La-3%In-TiO2; (d)1%La-3%In-TiO2; (e)5%La-3%In-TiO2 |
表 2给出xLa-3%In-TiO2样品的比表面积和孔结构数据。xLa-3%In-TiO2的比表面积和孔结构受到La掺杂量的影响,掺杂La后材料的比表面积增大、平均孔径减小。La掺杂量为1%时,光催化剂的比表面积最大,达到144.4m2/g。比表面积与晶粒尺寸和材料的孔隙特征有密切关系。在一定的La掺杂量范围内,随着La掺杂量的增加,材料晶粒尺寸和平均孔径减小、孔容增加,导致比表面积增大。当La掺杂达到饱和时(超过1%),继续增加La掺杂量使材料晶粒尺寸和平均孔径增大、孔容下降,造成比表面积减小。
| Sample | BET surface area/(m2·g-1) | Average pore size/nm | Pore volume/ (cm3·g-1) |
| 3%In-TiO2 | 94.4 | 10.3 | 0.1506 |
| 0.1%La-3%In-TiO2 | 115.1 | 9.1 | 0.1512 |
| 0.3%La-3%In-TiO2 | 129.8 | 7.4 | 0.1654 |
| 1%La-3%In-TiO2 | 144.4 | 7.6 | 0.1679 |
| 5%La-3%In-TiO2 | 123.3 | 8.9 | 0.1133 |
图 3为xLa-3%In-TiO2的孔径分布曲线,可以看出,xLa-3%In-TiO2的孔径主要分布在1.5~10nm范围内,为晶粒生长过程中形成的介孔。样品中少量大孔的存在是材料颗粒团聚所致。与未掺杂La的3%In-TiO2相比,La掺杂量为0.3%时,样品中孔径2~6nm介孔的孔容明显增大;而La掺杂量为5%时,样品中小介孔的体积甚至少于未掺杂La的样品。这表明合适的La掺杂量有利于小孔的形成,并最终影响材料的比表面积和总孔容。
|
图 3 xLa-3%In-TiO2的BJH孔径分布曲线 Fig. 3 BJH pore size distribution curves of xLa-3%In-TiO2 |
图 4给出La的掺杂量对xLa-3%In-TiO2吸附和光催化降解甲基橙的影响。甲基橙总脱色率曲线的变化趋势与其在光催化剂上的吸附曲线和光催化降解曲线趋势大体一致。总脱色率随着La掺杂量的增加而逐渐提高,当样品中La掺杂量为0.3%时,总脱色率达到最大值为85.4%,光催化降解率也达到最高值为59.8%。随着La掺杂量的进一步增大,甲基橙在催化剂上的吸附量和光催化降解率也逐渐下降。
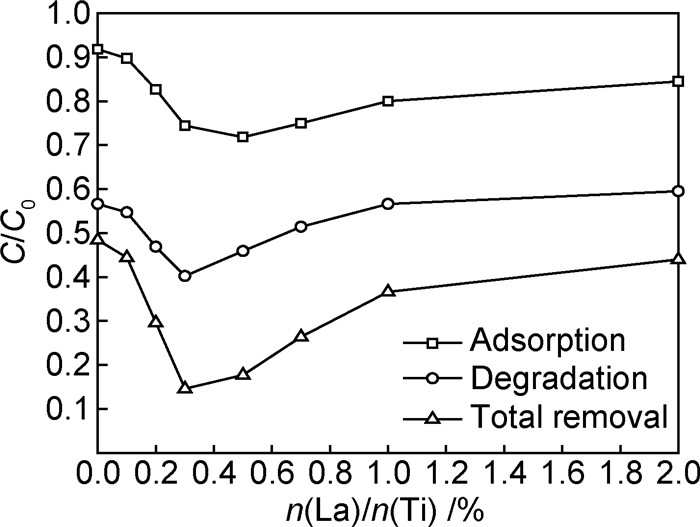
|
图 4 甲基橙在xLa-3%In-TiO2上的吸附和光催化降解 Fig. 4 Adsorption and photocatalytic degradation of methyl orange on xLa-3%In-TiO2 |
材料的吸附能力和光催化性能的提高与掺杂La样品比表面积的增加有关,同时又受到材料表面性质变化的影响,光催化性能提高的原因更为复杂。La掺杂后的杂质能级位于TiO2禁带之间,能捕获光生电子和空穴,促进电子和空穴的分离[17]。掺杂La后样品晶粒尺寸减小,缩短TiO2中电子和空穴扩散到表面的时间,降低电子和空穴的复合概率。当La3+掺杂量过大时,xLa-3%In-TiO2的光催化活性逐渐下降。过大的La掺杂量会延缓TiO2成核,造成晶粒尺寸增大,比表面积下降。过量的La还可能成为电子和空穴的复合中心。
经不同光照时间后,0.3%La-3%In-TiO2和3%In-TiO2光催化降解甲基橙的活性如图 5所示。可以看出,0.3%La-3%In-TiO2具有较好的吸附能力和光催化活性。经过40min光照,0.3%La-3%In-TiO2光催化剂使甲基橙溶液完全脱色,而3%In-TiO2在经过光照70min后才使甲基橙溶液完全脱色。La的掺杂明显提高了材料的光催化活性。甲基橙在0.3%La-3%In-TiO2和3%In-TiO2上的光催化一级反应速率常数kapp值分别为0.061,0.029min-1。在3%In-TiO2中掺杂0.3%La后,光催化反应速率常数提高了1倍。
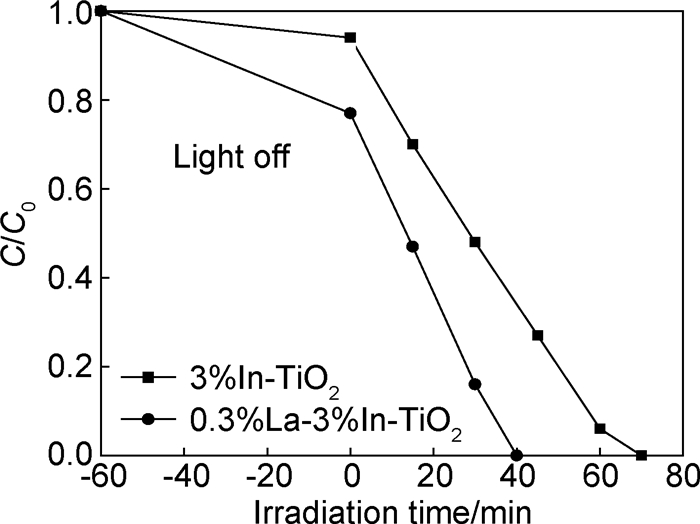
|
图 5 光照时间对甲基橙溶液脱色率的影响 Fig. 5 Effect of irradiation time on decoloration of methyl orange solution |
图 6为甲基橙溶液在光催化降解过程中的紫外-可见吸收光谱。随着光照时间的延长,甲基橙在紫外和可见光谱区的吸收强度都逐渐降低,说明染料中的吸光基团在光催化过程中逐渐分解。经紫外光照40min后,0.3%La-3%In-TiO2降解甲基橙溶液谱图中的可见吸收峰已全部消失,只存有微弱的紫外吸收峰。而在紫外光照70min后,3%In-TiO2降解甲基橙溶液谱图中的紫外和可见吸收峰才基本消失。对比图 6(a),(b)可以看出,甲基橙在0.3%La-3%In-TiO2上的光催化降解速率明显加快。另外,从甲基橙溶液吸收峰的变化趋势可知,甲基橙分子中的显色基团在这两种光催化剂上可以完全降解,在降解过程中也未产生新的物质。

|
图 6 光催化过程中甲基橙溶液的紫外-可见吸收光谱 (a)3%In-TiO2; (b)0.3%La-3%In-TiO2 Fig. 6 UV-visible absorption spectra of methyl orange solution during photocatalytic degradation (a)3%In-TiO2; (b)0.3%La-3%In-TiO2 |
(1) In3+,La3+以置换型进入TiO2晶格中,引起晶胞参数和晶胞体积增大,同时TiO2晶粒尺寸有所减小。在一定的La掺杂量范围内,随着La掺杂量的增加,材料平均孔径减小、孔容增加,导致比表面积增大。
(2)0.3%La-3%In-TiO2具有较好的吸附能力和光催化活性。经过40min光照后,0.3%La-3%In-TiO2使甲基橙溶液完全脱色,而3%In-TiO2在光照70min后才使甲基橙溶液完全脱色。
| [1] | PLANTARD G, JANIN T, GOETZ V, et al. Solar photocatalysis treatment of phytosanitary refuses:efficiency of industrial photocatalysts[J]. Applied Catalysis B:Environmental, 2012, 115-116 : 38–44. DOI: 10.1016/j.apcatb.2011.11.034 |
| [2] |
陈昱, 王京钰, 李维尊, 等. 新型二氧化钛基光催化材料的研究进展[J].
材料工程, 2016, 44 (3): 103–113.
CHEN Y, WANG J Y, LI W Z, et al. Research process in TiO2-based photocatalysis material[J]. Journal of Materials Engineering, 2016, 44 (3): 103–113. DOI: 10.11868/j.issn.1001-4381.2016.03.017 |
| [3] | NAKATA K, FUJISHIMA A. TiO2 photocatalysis:design and applications[J]. Journal of Photochemistry and Photobiology C, 2012, 13 : 169–189. DOI: 10.1016/j.jphotochemrev.2012.06.001 |
| [4] | MARIEN C B D, COTTINEAU T, ROBERT D, et al. TiO2 nanotube arrays:influence of tube length on the photocatalytic degradation of Paraquat[J]. Applied Catalysis B:Environmental, 2016, 194 : 1–6. DOI: 10.1016/j.apcatb.2016.04.040 |
| [5] | KU Y, SHIU S J, WU H C. Decomposition of dimethyl phthalate in aqueous solution by UV-LED/TiO2 process under periodic illumination[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2017, 332 : 299–305. DOI: 10.1016/j.jphotochem.2016.09.011 |
| [6] | LI H, SHEN X J, LIU Y D, et al. Titanate nanowire as a precursor for facile morphology control of TiO2 catalysts with enhanced photocatalytic activity[J]. Journal of Alloys and Compounds, 2016, 687 : 927–936. DOI: 10.1016/j.jallcom.2016.05.320 |
| [7] | LING Y, LIAO G, XIE Y, et al. Coupling photocatalysis with ozonation for enhanced degradation of Atenolol by Ag-TiO2 micro-tube[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2016, 329 : 280–286. DOI: 10.1016/j.jphotochem.2016.07.007 |
| [8] | CAVALCANTEA R P, DANTASB R F, BAYARRIC B, et al. Photocatalytic mechanism of metoprolol oxidation by photocatalysts TiO2 and TiO2 doped with 5% B:primary active species and intermediates[J]. Applied Catalysis B:Environmental, 2016, 194 : 111–122. DOI: 10.1016/j.apcatb.2016.04.054 |
| [9] | HAN C, ANDERSEN J, LIKODIMOS V, et al. The effect of solvent in the sol-gel synthesis of visible light-activated, sulfur-doped TiO2 nanostructured porous films for water treatment[J]. Catalysis Today, 2014, 224 : 132–139. DOI: 10.1016/j.cattod.2013.11.052 |
| [10] | LIU J H, YANG R, LI S M. Synthesis and photocatalytic activity of TiO2/V2O5 composite catalyst doped with rare earth ions[J]. Journal of Rare Earths, 2007, 25 : 173–178. DOI: 10.1016/S1002-0721(07)60068-4 |
| [11] | CHEN L C, HUANG C M, GAO C S, et al. A comparative study of the effects of In2O3 and SnO2 modification on the photocatalytic activity and characteristics of TiO2[J]. Chemical Engineering Journal, 2011, 175 : 49–55. DOI: 10.1016/j.cej.2011.09.032 |
| [12] | WEI H Y, WU Y S, LUN N, et al. Preparation and photocatalysis of TiO2 nanoparticles co-doped with nitrogen and lanthanum[J]. Journal of Materials Science, 2004, 39 : 1305–1308. DOI: 10.1023/B:JMSC.0000013889.63705.f3 |
| [13] | YANG J, DAI J, LI J T. Synthesis, characterization and degradation of Bisphenol A using Pr, N co-doped TiO2 with highly visible light activity[J]. Applied Surface Science, 2011, 257 : 8965–8973. DOI: 10.1016/j.apsusc.2011.05.074 |
| [14] | PARIDA K M, SAHU N. Visible light induced photocatalytic activity of rare earth titania nanocomposites[J]. Journal of Molecular Catalysis A:Chemical, 2008, 287 : 151–158. DOI: 10.1016/j.molcata.2008.02.028 |
| [15] | ZHANG W J, CHEN J L, HE H B. Properties of In-TiO2 photocatalyst as the factors of indium doping content and calcination temperature[J]. Journal of Advanced Oxidation Technologies, 2014, 17 (2): 365–371. |
| [16] | YUAN S, SHENG Q R, ZHANG J L. Synthesis of La3+ doped mesoporous titania with highly crystallized walls[J]. Microporous and Mesoporous Materials, 2005, 79 : 93–99. DOI: 10.1016/j.micromeso.2004.10.028 |
| [17] |
陈恩伟, 银董红, 宋慧娟, 等. 镧系离子掺杂TiO2的制备及其对咪唑降解反应的光催化活性[J].
催化学报, 2006, 27 (4): 344–348.
CHEN E W, YIN D H, SONG H J, et al. Preparation of lanthanide ions-doped TiO2 and its photocatalytic activity for imidazole degradation[J]. Chinese Journal of Catalysis, 2006, 27 (4): 344–348. |
 2017, Vol. 45
2017, Vol. 45


