文章信息
- 谭德新, 徐远, 王艳丽, 疏瑞文, 邢宏龙
- TAN De-xin, XU Yuan, WANG Yan-li, SHU Rui-wen, XING Hong-long
- 聚二苯基二苯乙炔基硅烷树脂的制备与非等温热分解
- Synthesis and Non-isothermal Thermal Decomposition of Polydiphenyl(diphenylethynyl)Silane
- 材料工程, 2017, 45(7): 77-83
- Journal of Materials Engineering, 2017, 45(7): 77-83.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2015.000941
-
文章历史
- 收稿日期: 2015-07-30
- 修订日期: 2016-12-07
2. 安徽理工大学 材料科学与工程学院, 安徽 淮南 232001
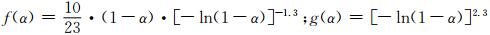 。
。2. School of Materials Science and Engineering, Anhui University of Science and Technology, Huainan 232001, Anhui, China
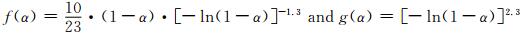 .
.
含硅芳炔因具有优良的导电、耐高温性能而引起了广泛关注,已成为高性能材料的研究热点[1, 2]。此类单体具有高反应性,在热、辐射等条件下聚合形成高度交联的网状结构,且固化过程中没有挥发性副产物产生,固化产物具有耐湿热、耐辐射、热稳定性好和性能保持率高等特点[3-5]。现有文献对该类树脂的研究主要集中在原料的合成[6]和耐热性测试[7, 8]、介电损耗[9]等方面,对分解过程研究相对较少[10, 11]。而对于二苯基二苯乙炔基硅烷单体文献报道目前也仅限于合成方法[12-15],以及荧光性能[16]、固化动力学[17]等,对于该类单体的聚合物的热分解过程及分解机理的研究目前还未见报道。
热分析法研究热分解反应动力学有模型拟合法和非模型拟合法两种[18]。模型法是借助反应函数用同一个扫描速率对反应测定的热重曲线进行动力学分析,用反应机理函数进行拟合得最佳动力学参数和最佳机理函数,主要以Coats-Redfern法[19]、Achar法[20]为代表;非模型拟合法是在不涉及动力学模式函数前提下,对多个扫描速率测定的热重曲线进行动力学分析。
本工作借助傅里叶红外光谱(FTIR)、核磁共振谱(1H-NMR)对自制二苯基二苯乙炔基硅烷分子结构进行了表征,并结合模型法和非模型法分析了该聚合物的热分解过程,得到了该树脂的分解动力学三因子及分解机理,为使其成为新型耐高温材料基体做铺垫。
1 实验 1.1 实验试剂二苯基基二氯硅烷,AR,成都艾科达化学试剂有限公司;溴乙烷,AR,天津博迪化工股份有限公司;苯乙炔,CP,山东淄博汉王公司;四氢呋喃,AR,天津博迪化工股份有限公司;镁条,AR,成都市科龙化工试剂厂;盐酸,AR,上海中试化工总公司。
1.2 单体DPDPES合成及固化单体DPDPES的合成实验室自制[17],合成途径见图 1。
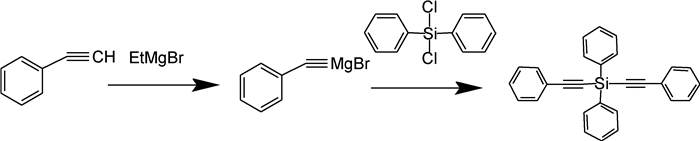
|
图 1 单体DPDPES的合成示意图 Fig. 1 Synthetic routes to the DPDPES monomer |
将单体放入真空管式炉中进行固化,固化温度程序参考文献[17],得到聚二苯基二苯乙炔基硅烷树脂(PDPDPES),见图 2。
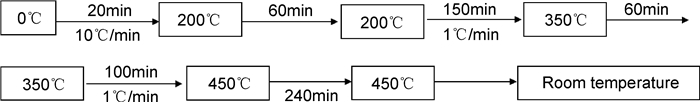
|
图 2 单体DPDPES固化温度程序 Fig. 2 Curing temperature program for DPDPES monomer |
将固化树脂研磨过200目筛子,取筛下物7.0mg作为测试样品,采用TG209F3热重分析仪,在氮气气氛保护下,将固化树脂样品以升温速率分别为10, 15, 20,25,30℃·min-1进行升温,升温范围是室温~800℃,进行热重分析。
1.3 结构表征及热分解动力学分析傅里叶转换红外光谱(FTIR)采用KBr压片法,在Nicolet 380型傅里叶转换红外光谱上进行分析;核磁共振氢谱1H-NMR采用BRUKER AVANCE AV-400超导脉冲傅里叶变换核磁共振谱仪进行分析(其中1H-NMR 400 MHz)。
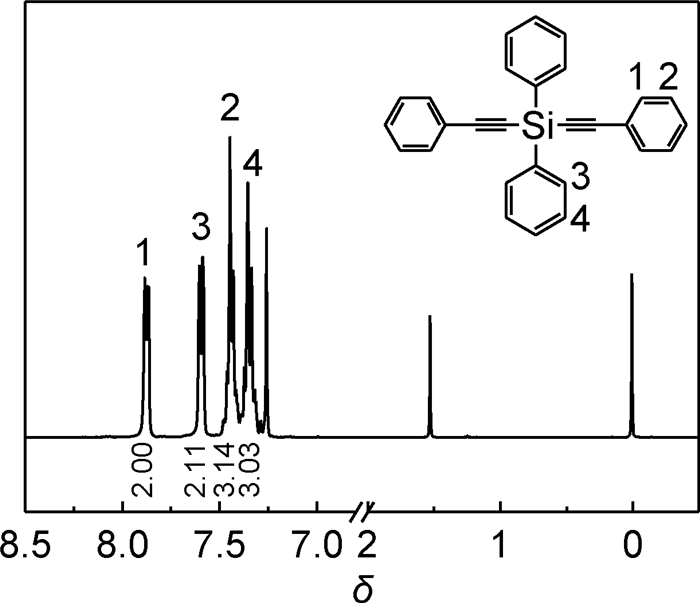
2 结果和讨论 2.1 单体DPDPES的FTIR和1H-NMR分析单体DPDPES的FTIR谱图如图 3所示波长在2159cm-1处的强吸收峰是C≡C键的伸缩振动;波数在1486~1427cm-1的吸收峰是苯环的C-C伸缩振动;1218cm-1的强吸收峰是Si-CH3的对称变形;840~690cm-1的吸收峰是CH3基的面内弯曲振动和Si-C键的伸缩振动;3068cm-1处的吸收峰是苯环上碳氢键的伸缩振动。图 4是单体DPDPES的1H-NMR图谱,通过计算4种不同位移的峰积分面积之比为2:2:3:3,由结构式可知该物质高度对称只有如图 4中1,2,3,4的4种不同位移的氢原子且比例为4:6:4:6,简化为2:3:2:3;苯环上的氢的化学位移在7.30~7.87之间,且苯环上炔基邻位的氢(m, 4H, Ph-H-C≡C)和间、对位上的氢(m, 6H, Ph-H-C≡C)、苯环上硅原子邻位的氢(m, 4H, Ph-H-Si)和间位上的氢(m, 6H, Ph-H-Si)峰面积比为2:3:2:3,这与二苯基二苯乙炔基硅烷上4种氢的个数相对应。通过FTIR与1H-NMR图谱分析证明测试样品为DPDPES。

|
图 3 单体DPDPES的FT-IR谱图 Fig. 3 FTIR of DPDPES monomer |
|
图 4 单体DPDPES的1H-NMR谱图 Fig. 4 1H-NMR of DPDPES monomer |
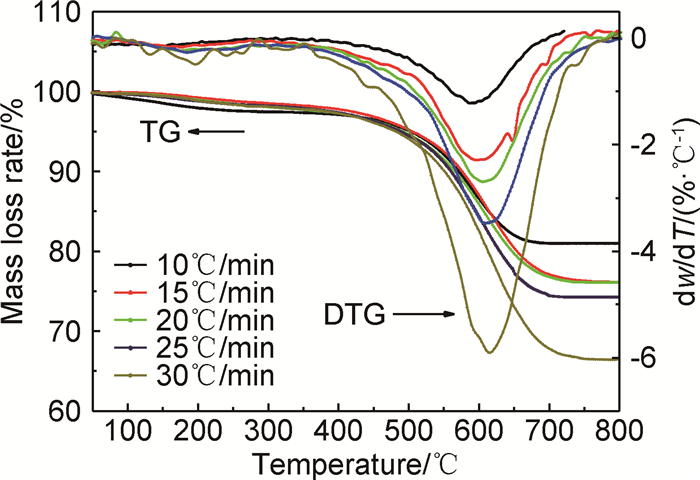
图 5是在不同升温速率下PDPDPES的TG-DTG曲线。由图可看出随升温速率的增加,PDPDPES最大失重速率峰值温度Tp向高温移动,见表 1;同时残炭率降低,这与PDPDPES分子结构特性有关,其基本结构单元主体为缩合的芳香核和与之相连的官能团。其中芳香核部分热稳定性好,而侧链和活泼官能团热稳性较差,受热时首先断裂,析出挥发分。在低升温速率下一些难以断裂的侧链和官能团随着升温速率的增加,在快速热冲击作用下开始断裂,形成挥发分析出,最终挥发产量有所增加而残炭率降低。由DTG曲线上不同升温速率下均只出现一个最大失重速率峰,表明该树脂的热分解过程可能遵循一步分解机理完成。
|
图 5 PDPDPES在不同升温速率下的TG-DTG曲线 Fig. 5 TG-DTG curves of PDPDPES at different heating rates |
| β/(℃·min-1) | Tp/℃ | Char yield/% |
| 10 | 593 | 80.99 |
| 15 | 599 | 76.15 |
| 20 | 603 | 76.09 |
| 25 | 609 | 74.28 |
| 30 | 614 | 66.47 |
Kissinger法[21]为微分处理法,该法避开了反应机理而用了每个升温速率下最大失重速率下的温度来计算活化能,其微分方程为:
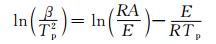
|
(1) |
式中:β为升温速率,℃·min-1;Tp为DTG曲线的峰值温度,K;A为指前因子,s-1;E为反应活化能,kJ·mol-1;R为摩尔气体常数,8.314J·K-1·mol-1。根据式(1) 以ln(β/Tp2)对Tp-1作图得到一条斜率为-E/R的拟合曲线如图 6。由图 6可得到斜率为-30.26,截距为23.84,进而计算得到活化能E为251.58 kJ·mol-1,指前因子lgA为11.83s-1;线性相关系数r2为0.9936,实验数据线性相关性较好,表明Kissinger法有一定的可靠性。

|
图 6 PDPDPES的Kissinger法ln(β/Tp2) -Tp-1 Fig. 6 ln(β/Tp2) vs Tp-1of PDPDPES by Kissinger |
根据Ozawa理论[22]利用不同升温速率下相同转化率来求解活化能:

|
(2) |
式中:α为转化率,%;T为反应温度,K;g(a)为积分机理函数;其他参数物理意义同上。其中α可通过下式进行定义:
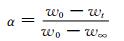
|
(3) |
式中:w0为初始质量;wt为t时间质量;w∞为反应终止质量。
在不同转化率下以lgβ对1/T作图得图 7,相关数据见表 2,结合图及表可看出在转化率为20%~95%时,直线相关性较好;转化率低时(5%~20%)活化能差异大,原因是由于样品中可能存在着层间结合水以及在样品测试前准备过程中,样品表面与空气接触而吸附一定的水分子造成对活化能的影响。Ozawa法计算20%~95%所得活化能进行平均计算[23, 24],所得的平均活化能值为255.68kJ·mol-1而Kissinger法计算得到的活化能为251.58kJ·mol-1,两者相差不大。而两种方法都避开了因反应机理函数假设的不同带来的误差,常被用来检验其他方法求出的活化能。
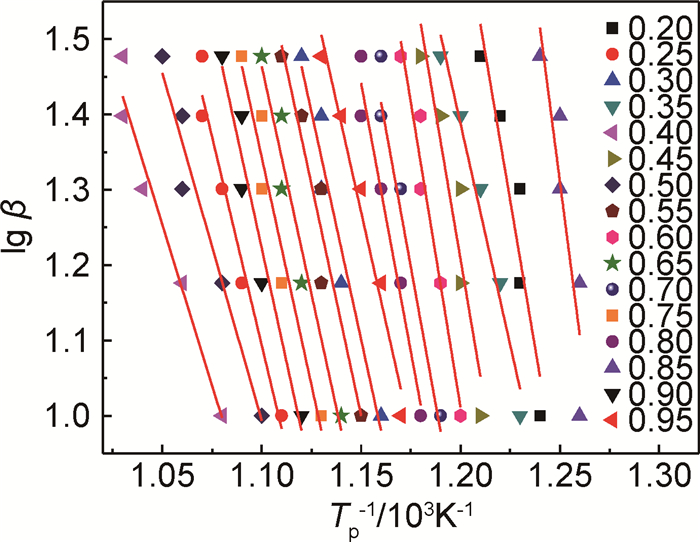
|
图 7 PDPDPES的Ozawa法lgβ-Tp-1 Fig. 7 lgβ vs Tp-1 of PDPDPES by Ozawa |
| α | E/(kJ·mol-1) | r2 |
| 0.05 | 46.73 | -0.0808 |
| 0.10 | 9.38 | -0.3291 |
| 0.15 | 29.89 | -0.3174 |
| 0.20 | 232.96 | 0.1816 |
| 0.25 | 266.75 | 0.6008 |
| 0.30 | 287.70 | 0.7973 |
| 0.35 | 299.66 | 0.9527 |
| 0.40 | 294.06 | 0.9709 |
| 0.45 | 284.03 | 0.9917 |
| 0.50 | 282.99 | 0.9840 |
| 0.55 | 255.34 | 0.9835 |
| 0.60 | 259.83 | 0.9927 |
| 0.65 | 251.40 | 0.9905 |
| 0.70 | 258.07 | 0.9930 |
| 0.75 | 230.47 | 0.9972 |
| 0.80 | 226.27 | 0.9811 |
| 0.80 | 226.27 | 0.9811 |
| 0.85 | 212.27 | 0.9792 |
| 0.90 | 193.35 | 0.9811 |
| 0.95 | 172.33 | 0.9774 |
根据本课题组已完成的研究,含硅芳炔树脂的热分解机理主要遵循随机成核和随后生长机理以及扩散机理[4, 18]。本工作以不同升温速率下的TG/DTG曲线为基础,将实验数据T, α, dα/dt利用模型拟合法的Coats-Redfern积分方程和Achar微分方法结合20种随机成核和随后生长机理及扩散机理函数进行计算[25],得到相应的E, lgA,当线性相关性较好,活化能与多速率扫描法处理结果一致时,机理函数即为可能的反应机理函数。经过计算比较分析发现4, 6, 17, 18, 44号5种机理较符合,其中44号为最优(表 3)。
| Method | Mechanism | E/(kJ·mol-1) | lgA | r2 |
| Coast-Redfern | 4 | 173.38 | 9.02 | 0.9960 |
| 6 | 189.02 | 9.73 | 0.9988 | |
| 9 | 265.31 | 14.83 | 0.9881 | |
| 17 | 164.78 | 9.34 | 0.9974 | |
| 18 | 224.37 | 13.06 | 0.9974 | |
| 44 | 260.13 | 15.27 | 0.9994 | |
| Achar | 4 | 159.80 | 7.22 | 0.9629 |
| 6 | 187.22 | 8.65 | 0.9855 | |
| 9 | 303.96 | 16.22 | 0.9842 | |
| 17 | 183.51 | 9.52 | 0.9906 | |
| 18 | 244.16 | 13.30 | 0.9941 | |
| 44 | 280.56 | 15.55 | 0.9951 |
依据44号分解机理函数方程,应用Coats-Redfern方程对5种不同升温速率下的函数g(α)和f(α)进行处理得到对应的E和lgAc,分别用这些E与Ozawa法计算E0值比较,找出满足|(E0-E)/E0|≤0.1的E值,再分别用lgA值与Kissinger值求得的lgAk值相比较,找出满足|(lgA-lgAk)/lgAk|≤0.2的lgA[26]。经过计算得到数据表 4,从表中可以看出44号机理函数在不同β下其f(α):|(E0-E)/E0|=0.0779,|(lgA-lgAk)/lgAk|=0.0831和g(α):|(E0-E)/E0|=0.0944,|(lgA-lgAk)/lgAk|=0.1095均满足上述条件,由此推测分解机理函数: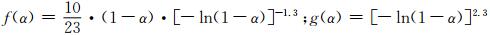
| Method | β/(℃·min-1) | E/(kJ·mol-1) | lgA/s-1 | r2 | |(E0-E)/E0| | |(lgA-lgAk)/lgAk| |
| Coast-Redfern | 10 | 260.13 | 15.27 | 0.9975 | 0.0502 | 0.0300 |
| 15 | 235.81 | 13.75 | 0.9924 | 0.0480 | 0.0727 | |
| 20 | 214.47 | 12.48 | 0.9940 | 0.1341 | 0.1587 | |
| 25 | 212.73 | 12.40 | 0.9942 | 0.1412 | 0.1639 | |
| 30 | 223.25 | 13.02 | 0.9969 | 0.0987 | 0.1222 | |
| Average | 229.28 | 13.38 | 0.0944 | 0.1095 | ||
| Achar | 10 | 280.56 | 16.55 | 0.9951 | 0.1327 | 0.1158 |
| 15 | 252.76 | 14.81 | 0.9849 | 0.0204 | 0.0012 | |
| 20 | 221.79 | 12.97 | 0.9934 | 0.1046 | 0.1257 | |
| 25 | 228.05 | 13.35 | 0.9936 | 0.0793 | 0.0996 | |
| 30 | 234.75 | 13.74 | 0.9912 | 0.0523 | 0.0734 | |
| Average | 243.58 | 14.28 | 0.0779 | 0.0831 |
热分解动力学研究的目的在于确定动力学三因子。模型法是在引入函数的基础上推算出物质分解的可能机理,而非模型法避免了因机理函数不同带来的误差,因此可以通过非模型法的计算结果来进一步佐证模型法计算的正确性[27]。
采用非模型法中的Vyazovkin-Wight(V-W)法和Tang(T)法对PDPDPES的分解过程进行进一步计算,其PDPDPES的热分解活化能及随转化率的变化趋势见图 8,9和表 5。结合图和表可以看出,两种方法计算活化能基本一致,分别是250.22,249.87kJ·mol-1,与模型法Coats-Redfern积分方程和Achar微分方法计算结果相差也不大(229.28,243.58kJ·mol-1);所得数据与非模型法中的Kissing法和Ozawa法结果更为接近(247.70,251.58kJ·mol-1),而几种方法计算得到的指前因子相差也不大。

|
图 8 DPDPES的Vyazovkin-Wight法ln(β/Tp2)-Tp-1 Fig. 8 ln(β/Tp2) vs Tp-1 of PDPDPES by Vyazovkin-Wight |
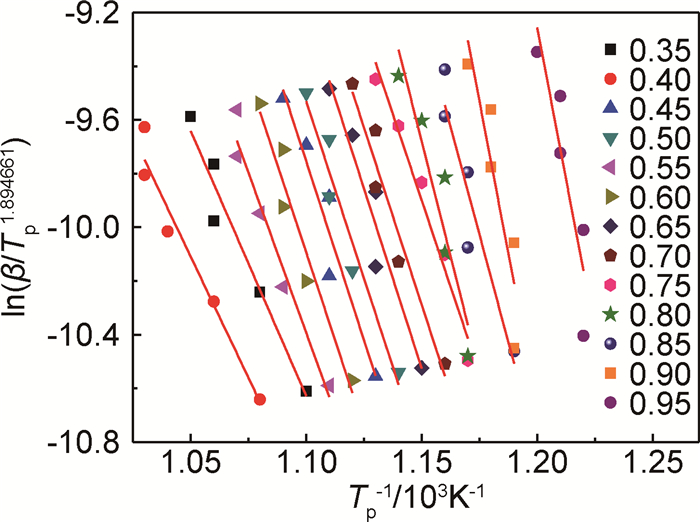
|
图 9 DPDPES的Tang法ln(β/Tp1.894661)-Tp-1 Fig. 9 ln(β/Tp1.894661) vs Tp-1 of PDPDPES by Tang |
| α | Vyazovkin-Wight | Tang | |||
| E/(kJ·mol-1) | r2 | E/(kJ·mol-1) | r2 | ||
| 0.95 | 165.46 | 0.9731 | 165.54 | 0.9734 | |
| 0.90 | 187.86 | 0.9780 | 187.82 | 0.9782 | |
| 0.85 | 207.95 | 0.9762 | 207.82 | 0.9764 | |
| 0.80 | 222.84 | 0.9786 | 222.63 | 0.9788 | |
| 0.75 | 215.92 | 0.9228 | 215.74 | 0.9234 | |
| 0.70 | 256.55 | 0.9922 | 256.18 | 0.9922 | |
| 0.65 | 249.67 | 0.9893 | 249.32 | 0.9894 | |
| 0.60 | 258.66 | 0.9919 | 258.26 | 0.9919 | |
| 0.55 | 254.05 | 0.9816 | 253.67 | 0.9817 | |
| 0.50 | 268.69 | 0.9857 | 268.24 | 0.9858 | |
| 0.45 | 284.48 | 0.9908 | 283.95 | 0.9909 | |
| 0.40 | 359.11 | 0.9645 | 358.24 | 0.9647 | |
| 0.35 | 321.60 | 0.9253 | 320.89 | 0.9257 | |
| Average | 250.22 | 249.87 | |||
因此通过6种热分解动力学方程可以得到,树脂的热分解活化能其平均值为245.37kJ·mol-1左右,指前因子为lgA=13.78s-1,分解机理符合44号机理方程。
3 结论(1) 以溴乙烷、二苯基二氯硅烷、苯乙炔为原料,通过格利雅反应成功制备出二苯基二苯乙炔基硅烷单体(DPDPES),采用热聚合方法制备了相应聚合物。
(2) 借助TG-DTG测试方法结合6种热分解动力学方程得到树脂的分解活化能E=245.37kJ·mol-1,指前因子lgA=13.78s-1,分解过程符合44号机理函数即随机成核和随后生长,其微分式为: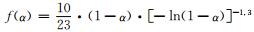
| [1] | 池铁, 齐会民, 黄发荣, 等. 含硅芳炔树脂的热氧化降解动力学研究[J]. 玻璃钢/复合材料, 2013 (2): 34–38. CHI T, QI H M, HUANG F R, et al. Thermal oxidative degradation kinetics of silicon-arylacetylene-containing resin[J]. Fiber Reinforced Plastics/Composites, 2013 (2): 34–38. |
| [2] | ZHOU Y, HUANG F, DU L, et al. Synthesis and properties of silicon-containing arylacetylene resins with polyhedral oligomeric silsesquioxane[J]. Polymer Engineering & Science, 2015, 55 (2): 316–321. |
| [3] | SHEN Y, YUAN Q, HUANG F, et al. Effect of neutral nickel catalyst on cure process of silicon-containing polyarylacetylene[J]. Thermochimica Acta, 2014, 590 : 66–72. DOI: 10.1016/j.tca.2014.06.002 |
| [4] | 谭德新, 王艳丽, 邢宏龙, 等. 聚苯基三苯乙炔基硅烷的制备及热分解动力学[J]. 固体火箭技术, 2013, 36 (3): 385–389. TAN D X, WANG Y L, XING H L, et al. Preparation and thermal decomposition kinetics of poly (phenyl (triphenylethynyl) silane)s[J]. Journal of Solid Rocket Technology, 2013, 36 (3): 385–389. |
| [5] | ZHANG J, HUANG J, YU X, et al. Preparation and properties of modified silicon-containing arylacetylene resin with bispropargyl ether[J]. Bull Korean Chem Soc, 2012, 33 (11): 3706–3710. DOI: 10.5012/bkcs.2012.33.11.3706 |
| [6] | MAJI A, HAZRA A, MAITI D. Direct synthesis of α-trifluoromethyl ketone from (hetero) arylacetylene: design, intermediate trapping, and mechanistic investigations[J]. Organic Letters, 2014, 16 (17): 4524–4527. DOI: 10.1021/ol502071g |
| [7] | 吴永胜, 余若冰, 朱长进, 等. 硅烷改性芳基乙炔固化物的耐热性能[J]. 上海大学学报(自然科学版), 2013, 19 (6): 562–566. WU Y S, YU R B, ZHU C J, et al. Heat resistance of cured arylacetylene modified by siloxane[J]. Journal of Shanghai University (Natural Science), 2013, 19 (6): 562–566. |
| [8] | 宋宁. 含硅、氮、硼元素耐高温芳基乙炔树脂及其复合材料的研究[D]. 上海: 华东理工大学, 2012. SONG N. Study on high-temperature resistant aryl-acetylene resins containing silicon, nitrogen and boron elements and their composites[D]. Shanghai: East China University of Science and Technology, 2012. http://cdmd.cnki.com.cn/article/cdmd-10251-1012338087.htm |
| [9] | 戴泽亮, 陈麒, 倪礼忠. 双(N-间乙炔基苯基邻苯二甲酰亚胺)醚改性甲基二苯乙炔基硅烷[J]. 复合材料学报, 2005, 22 (5): 89–93. DAI Z L, CHEN Q, NI L Z. Di-N-m-accetylenephenylphthalimide-ether modifying methyl-di-phenylacetylene-silane[J]. Acta Materiae Compositae Sinica, 2005, 22 (5): 89–93. |
| [10] | 颜梅, 江金强, 施伟, 等. 有机硅耐烧蚀材料的研究进展[J]. 有机硅材料, 2001, 15 (2): 24–27. YAN M, JIANG J Q, SHI W, et al. Research advance of the silicone ablative material[J]. Silicone Material, 2001, 15 (2): 24–27. |
| [11] | 刘衍兵, 郭康康, 齐会民, 等. 聚硅烷改性含硅芳炔树脂的耐热性能研究[J]. 化工新型材料, 2010, 38 (4): 84–88. LIU Y B, GUO K K, QI H M, et al. Thermal stability of blends of polysilane and silicon-containing arylacetylene resin[J]. New Chemical Materials, 2010, 38 (4): 84–88. |
| [12] | KOWNACKI I, ORWAT B, MARCINIEC B, et al. A new and efficient route for the synthesis of alkynyl functionalized silicon derivatives[J]. Tetrahedron Letters, 2014, 55 (2): 548–550. DOI: 10.1016/j.tetlet.2013.11.103 |
| [13] | LIU H Q, HARROD J F. Copper (I) chloride catalyzed cross-dehydrocoupling reactions between silanes and ethynyl compounds a new method for the copolymerization of silanes and alkynes[J]. Canadian Journal of Chemistry, 1990, 68 (7): 1100–1105. DOI: 10.1139/v90-170 |
| [14] | MAIENTHAL M, HELLMANN M, HABER C P, et al. The preparation of some aryl silanes1[J]. Journal of the American Chemical Society, 1954, 76 (24): 6392–6393. DOI: 10.1021/ja01653a043 |
| [15] | ISHIKAWA J, ITOH M. Dehydrogenative coupling between hydrosilanes and alkynes catalyzed by alkoxides, alkylmetals, and metalamides[J]. Journal of Catalysis, 1999, 185 (2): 454–461. DOI: 10.1006/jcat.1999.2530 |
| [16] | 陈明锋, 周权, 倪礼忠, 等. 含苯乙炔基共轭单体的合成及荧光性能[J]. 高分子材料科学与工程, 2013, 29 (12): 1–4. CHEN M F, ZHOU Q, NI L Z, et al. Synthesis and fluorescence properties of conjugated monomers containing phenylacetylene[J]. Polymer Materials Science & Engineering, 2013, 29 (12): 1–4. |
| [17] | TAN D, WANG Y, LI Z, et al. Synthesis and cure kinetics of diphenyl (diphenylethynyl) silane monomer[J]. Research on Chemical Intermediates, 2013, 39 (7): 3427–3440. DOI: 10.1007/s11164-012-0855-8 |
| [18] | 王艳丽, 谭德新, 于峰, 等. 聚苯基三苯乙炔基硅烷树脂的非等温热分解过程研究[J]. 功能材料, 2014, 45 (21): 21040–21044. WANG Y L, TAN D X, YU F, et al. The non-isothermal thermal decomposition process of poly(phenyltri(phenylethynyl)silane)s[J]. Journal of Functional Materials, 2014, 45 (21): 21040–21044. DOI: 10.3969/j.issn.1001-9731.2014.21.009 |
| [19] | SUN Y J, JIANG J C, WANG Y J, et al. Kinetic analysis of biomass and coal mono-pyrolysis as well as co-pyrolysis by Coats-Redfern[J]. Chemistry & Industry of Forest Products, 2014, 34 (5): 8–14. |
| [20] | YAO X D, FANG R N, PANG H J, et al. Preparation and non-isothermal kinetics analysis of N-[(4-bromo-3, 5-difluorine) phenyl] acrylamide[J]. Advanced Materials Research, 2013, 781 : 580–584. |
| [21] | BLAINE R L, KISSINGER H E. Homer kissinger and the kissinger equation[J]. Thermochimica Acta, 2012, 540 : 1–6. DOI: 10.1016/j.tca.2012.04.008 |
| [22] | 杭祖圣, 谈玲华, 居法银, 等. 非等温热重分析三聚氰胺热分解动力学[J]. 分析科学学报, 2011, 27 (3): 279–283. HANG Z S, TAN L H, JU F Y, et al. Non-isothermal kinetic studies on the thermal decomposition of melamine by thermogravimetric analysis[J]. Journal of Analytical Science, 2011, 27 (3): 279–283. |
| [23] | ZHU L, WANG X, WU L, et al. Thermal decomposition properties of cross-linked polycarbonate derived from carbon dioxide, propylene oxide and pyromellitic dianhydride[J]. Materials Letters, 2014, 128 : 396–399. DOI: 10.1016/j.matlet.2014.04.057 |
| [24] | ZHANG S, SHI H S, HUANG S W, et al. Dehydration characteristics of struvite-K pertaining to magnesium potassium phosphate cement system in non-isothermal condition[J]. Journal of Thermal Analysis and Calorimetry, 2013, 111 (1): 35–40. DOI: 10.1007/s10973-011-2170-9 |
| [25] | 卢林刚, 韩中凯, 杨守生. 新型无卤阻燃剂双酚S-二(5, 5-二甲基-1, 3-二氧杂己内磷酸酯)的热分解动力学研究[J]. 分子科学学报, 2010, 26 (4): 261–265. LU L G, HAN Z K, YANG S S. Study on thermal decomposition kinetics of novel halogen-free flame retardant from bisphenol s-bis(5, 5-dimethyl-1, 3-dioxaphosphorinanyl-2-oxy)[J]. Journal of Molecular Science, 2010, 26 (4): 261–265. |
| [26] | 胡拥鹏, 赵旭芳, 赵宁宁, 等. DNGTz的非等温热分解动力学及热安全性[J]. 含能材料, 2014, 22 (6): 767–773. HU Y P, ZHAO X F, ZHAO N N, et al. Non-isothermal thermal decomposition kinetics and thermal safety of DNGTz[J]. Chinese Journal of Energetic Materials, 2014, 22 (6): 767–773. DOI: 10.11943/j.issn.1006-9941.2014.06.011 |
| [27] | 胡荣祖, 高胜利, 赵凤起, 等. 热分析动力学[M]. 2版. 北京: 科学出版社, 2008: 55-117. HU R Z, GAO S L, ZHAO F Q, et al. Thermal Analysis Kinetics[M]. 2nd ed. Beijing: Science Press, 2008: 55-117. |
 2017, Vol. 45
2017, Vol. 45


