文章信息
- 冯倩倩, 申向, 何洋, 赵义平, 颜范勇, 陈莉
- FENG Qian-qian, SHEN Xiang, HE Yang, ZHAO Yi-ping, YAN Fan-yong, CHEN Li
- 交联剂对PVDF-g-PACMO共聚物膜抗污染性的影响
- Effect of Cross-linking on Antifouling Properties for PVDF-g-PACMO Membranes
- 材料工程, 2017, 45(7): 34-40
- Journal of Materials Engineering, 2017, 45(7): 34-40.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2015.000939
-
文章历史
- 收稿日期: 2015-07-30
- 修订日期: 2017-02-21
聚偏氟乙烯(PVDF)是一种广泛使用的分离膜材料,已被应用到微滤、超滤、纳滤等各个领域[1, 2],它具有优良的耐气候性、耐热性、化学性能和力学性能[3]。此外,PVDF表面能较低, 与水没有氢键作用, 故有极强的疏水性, 因此在水相分离时, 易吸附蛋白质、胶体粒子等疏水性的物质[4]而导致膜孔堵塞[5], 造成膜污染[6]。因此,需要对PVDF膜进行亲水改性,以提高PVDF膜的抗污性能[7]。Li等[8]将γ-Al2O3与PVDF粉末共混,改善了PVDF膜的亲水性,使PVDF膜通量衰减率降低,抗蛋白质能力提高。
丙烯酰吗琳(ACMO)是一种新型的两亲性高分子材料, 具有亲水的吗琳基团和疏水的碳链结构,溶于水,也溶于大多数有机溶剂,并且还具有免疫原性较低、无毒和生物相容性良好等特点,因此它在生物医药领域引起人们的高度关注[9, 10]。Jo等[11]研究了聚丙烯酰吗啉改性药物,提高了药物与生物组织的相容性。Belffort等[12]用丙烯酰吗啉改性PES膜,提高了PES膜的抗蛋白质吸附性能。本课题组已成功合成PVDF-g-PACMO共聚物膜,提高了PVDF膜的亲水性,改善了PVDF膜的抗污染性能[13]。
乙二醇二甲基丙烯酸酯(EGDMA)是一种常见的交联剂。寇星等[14]以红霉素为模板分子、甲基丙烯酸为功能单体、EGDMA为交联剂,采用沉淀聚合的方法制备红霉素纳米分子印迹聚合物微球,提高了红霉素的吸附能力。蒋旭红等[15]采用二乙烯基苯和EGDMA作为混合交联剂,乙腈为溶剂,偶氮二异丁腈为引发剂,以甲基丙烯酸为功能单体,采用沉淀聚合法制备了单分散或窄分散的、表面具有羧基的交联聚合物微球。卢圣国等[16]在常规液相色谱柱内,选用4-乙烯基苯硼酸为亲和单体、乙二醇/二甘醇为致孔剂,以EGDMA为交联剂,利用原位聚合法,制备硼酸整体柱。本研究选用EGDMA作为交联剂,使PVDF-g-PACMO共聚物膜的亲水性进一步提高,抗蛋白质污染性显著提高。
1 实验 1.1 试剂与仪器聚偏氟乙烯(PVDF):工业品,比利时Solvay公司;丙烯酰吗啉(ACMO):分析纯,嘉兴思诚化工有限公司;乙二醇二甲基丙烯酸酯(EGDMA):分析纯,上海阿拉丁生化科技股份有限公司;偶氮二异丁腈(AIBN):分析纯,上海试四赫维化工有限公司;聚乙二醇(PEG,10000),N, N-二甲基甲酰胺(DMF)和氢氧化钾(KOH):分析纯,天津科密欧化学试剂有限公司;牛血清蛋白(BSA,67000):分析纯,北京索莱宝科技有限公司。
傅里叶变换红外光谱仪(FT-IR):TENSOR37;X射线光电子能谱仪(XPS):GENESIS 60S;场发射扫描电镜(SEM):s-4800;接触角测试仪:DSA100。
1.2 实验过程 1.2.1 合成PVDF-g-PACMO共聚物首先配置2.5mol/L的KOH溶液,然后将KOH溶液放入大烧杯中,在60℃水浴中加热,加入71.425g的PVDF粉末,11.2mL无水乙醇,搅拌10min,抽滤,将滤液倒入废液瓶中,4次水洗,4次抽滤,得到紫色固体放在表面皿中于烘箱中烘干待用。称取10g碱处理的PVDF粉末,放入含有120mL DMF溶液的三口烧瓶中,在70℃恒温水浴锅搅拌使其溶解,通入N2 20min,加入10g ACMO,0.168g AIBN,不同含量的EGDMA,继续通N2 15min,然后恒温搅拌12h,反应后的溶液用过量的甲醇沉淀并抽滤,产物4次水洗4次抽滤,除去未反应的单体及均聚物,然后置于恒温干燥箱中烘干。反应体系中各组成比例如表 1所示。
| Group | PVDF/g | DMF/g | ACMO/g | AIBN/g | EGDMA/PVDF |
| C1-1 | 10 | 120 | 10 | 0.168 | 0 |
| C1-2 | 10 | 120 | 10 | 0.168 | 0.2 |
| C1-3 | 10 | 120 | 10 | 0.168 | 0.4 |
| C1-4 | 10 | 120 | 10 | 0.168 | 0.6 |
称取6g PVDF-g-PACMO共聚物、3g PEG溶解于37.5g DMF溶液中,在60℃恒温水浴条件下机械搅拌6~7h使其完全溶解。随后静置脱泡,得到铸膜液。采用浸没沉淀相转化法制备共聚物平板膜,凝固浴为纯水,凝固浴温度为25℃。用刮膜棒将铸膜液刮成平板膜。然后将膜浸泡在去离子水中,24h换一次水,除去残留的溶剂及致孔剂,48h后将膜浸泡在纯水中待用。由共聚物C1-1, C1-2, C1-3, C1-4制备得到的平板膜分别编号为M1-1, M1-2, M1-3, M1-4。
1.3 性能测试 1.3.1 FI-IR测试将不同EGDMA含量制备得到的PVDF-g-PACMO共聚物(C1-1, C1-2, C1-3, C1-4) 干燥,利用溴化钾压片法用TENSOR37型傅里叶变换红外光谱仪对样品进行红外测试表征。
1.3.2 XPS测试采用GENESIS60S型X射线光电子能谱仪,以AlKα (1486.6 eV)为X光源,以C1s(284.6eV)为内标,分别对PVDF-g-PACMO共聚物膜(M1-1, M1-2, M1-3, M1-4) 进行全谱和C1s谱测试,确定膜表面化学组成。
1.3.3 SEM测试将M1-1, M1-2, M1-3, M1-4干燥后制成表面样品,并用液氮脆断得到断面样品,样品喷金后采用s-4800型场发射扫描电镜来表征膜表面和断面形貌。
1.3.4 接触角测试将M1-1, M1-2, M1-3, M1-4干燥后,分别剪成1cm×4cm,用双面胶贴在载玻片上,用DSA100型接触角测试仪对膜样品进行动态接触角测试,以此来表征不同膜表面之间的亲疏水性。
1.3.5 静态蛋白吸附测试利用牛血清蛋白(BSA)静态吸附实验来考察膜抗污染的能力。首先配制成0.5g/L的BSA溶液。将M1-1, M1-2, M1-3, M1-4剪成2.5cm×2.5cm的膜试样,之后将膜试样浸泡在BSA溶液中,在25℃恒温条件下放入恒温振荡器中振荡24h以达到吸附平衡,通过测定吸附前后BSA溶液的蛋白质浓度来计算蛋白质在膜表面的静态吸附量(Q),计算公式如下:
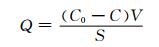
|
(1) |
式中:C0为吸附前BSA溶液的初始浓度;C为吸附平衡后BSA溶液的浓度;S为膜样的有效吸附面积;V为BSA溶液的体积。BSA溶液的浓度由BSA浓度与吸光度的标准曲线获得。
1.3.6 渗透实验测试用实验室自制的过滤装置分别对M1-1, M1-2, M1-3, M1-4进行蛋白质溶液的循环过滤实验。首先将膜放置在过滤元件中,0.2MPa下利用纯水对膜预压1h,使通量达到稳定状态;调节压力至0.1MPa,每隔10min测定一次渗透液的质量,测量5次,得到稳定的纯水通量JW;将料液换成1g/L的BSA溶液,加压后立即开始测定通量,每隔10min测定一次渗透液的质量,测量5次,此时通量为JB;再将料液换成纯水,再次测量其纯水通量Jr。通量恢复率(FRR)的计算公式如下:
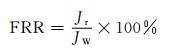
|
(2) |
通量恢复率高表明膜的抗污染能力较强,反之,则较差。
采用总污染指数(Rt)、可逆污染指数(Rr)和不可逆污染指数(Rir)来分别评价膜上发生的总污染、可逆污染和不可逆污染。Rt,Rr,Rir的计算公式如下:
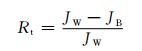
|
(3) |
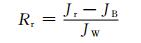
|
(4) |
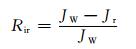
|
(5) |
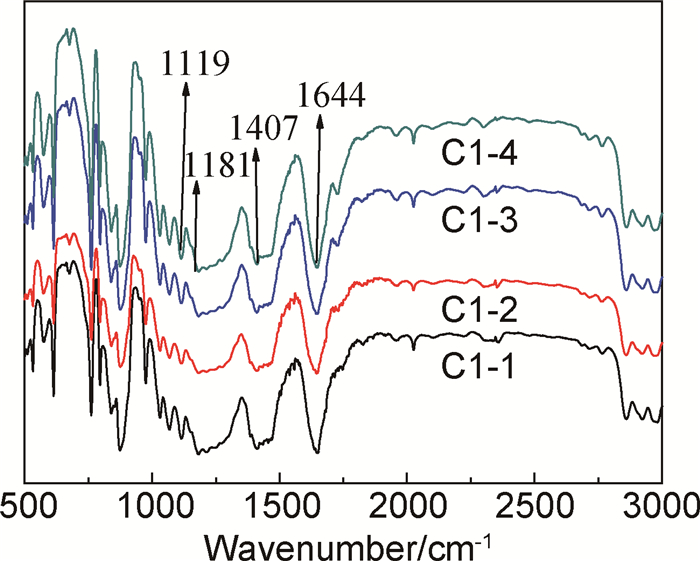
为了验证是否合成了PVDF-g-PACMO共聚物,对反应体系中添加的不同含量EGDMA制备得到的PVDF-g-PACMO共聚物(C1-1, C1-2, C1-3, C1-4) 进行红外测试。图 1为PVDF-g-PACMO共聚物(C1-1, C1-2, C1-3, C1-4) 的FT-IR图。从FT-IR谱可以看出,4种共聚物在1119,1644cm-1均出现吸收峰,分别对应的是接枝ACMO上的C—O—C和C=O的特征吸收峰;而且在1181cm-1和1407cm-1也出现吸收峰,分别是PVDF上CF2—和CH2—的特征吸收峰,FT-IR谱图表明ACMO成功接枝到PVDF粉末上。
|
图 1 PVDF-g-PACMO共聚物的红外光谱图 Fig. 1 FT-IR spectra of PVDF-g-PACMO copolymers |
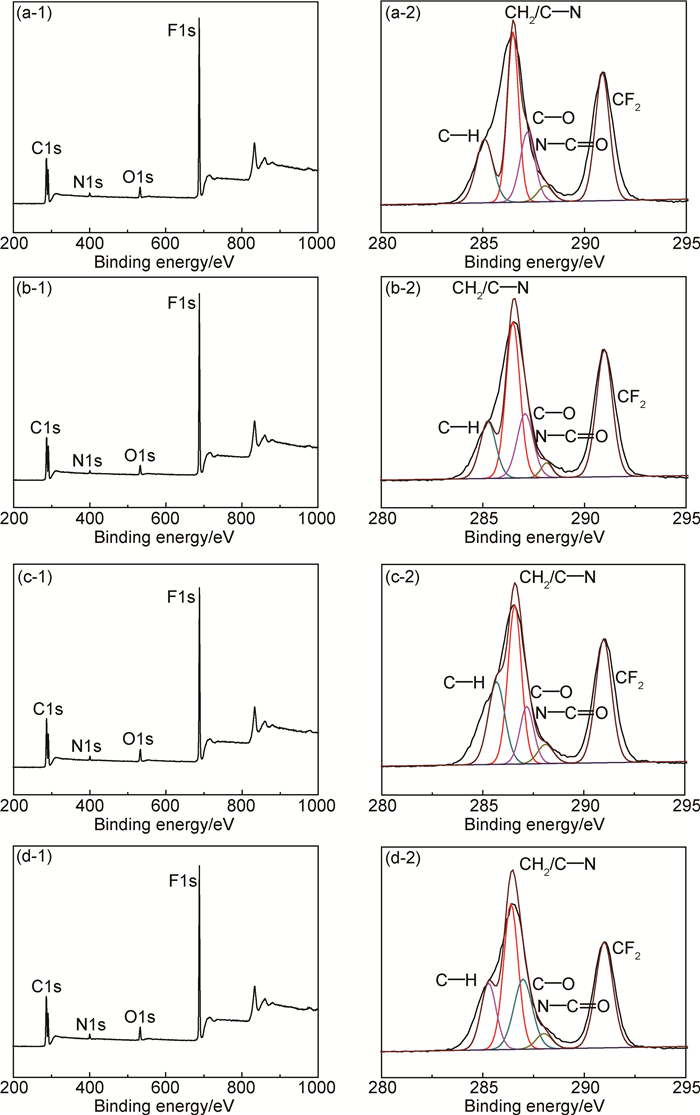
为了测定PVDF-g-PACMO共聚物膜表面接枝的PACMO含量,对共聚物膜进行XPS测试,如图 2所示。由全谱可以看出随着EGDMA含量的增多,N元素的峰强增大,表明PACMO接枝量增多。由C1s谱图可以看出,C1s峰的结合能为284.95,286.35,286.92,288.01 eV和290.60 eV,分别对应CH,CH2/C—N,C—O,N—C=O和CF2。C—O,N-C=O来自于共聚物膜表面上的PACMO,N—C=O与C—O的峰面积比接近1,与ACMO的化学结构相符。
|
图 2 PVDF-g-PACMO共聚物膜的XPS全谱谱图(1) 和C1s谱图(2) (a)M1-1;(b)M1-2;(c)M1-3;(d)M1-4 Fig. 2 XPS wide-scan and C1s score-level spectra of PVDF-g-PACMO membranes (a)M1-1;(b)M1-2;(c)M1-3;(d)M1-4 |
表 2是PVDF-g-PACMO共聚物膜(M1-1, M1-2, M1-3, M1-4) 的膜表面化学组成,通过C和N的摩尔比可计算共聚物膜表面PACMO的接枝率,计算公式如下:
| Membrane | Atom fraction/% | GD/% | |||
| C | N | O | F | ||
| M1-1 | 57.33 | 1.69 | 4.84 | 36.14 | 7.43 |
| M1-2 | 56.81 | 1.77 | 3.58 | 37.85 | 7.97 |
| M1-3 | 57.30 | 1.92 | 3.78 | 37.00 | 8.76 |
| M1-4 | 58.41 | 2.27 | 4.54 | 34.78 | 10.68 |
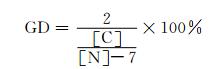
|
(6) |
式中:[C]和[N]分别为共聚物膜表面C和N元素的摩尔比,参数2代表PVDF主链上重复结构单元中有两个C原子,参数7代表ACMO单体中有7个C原子。由表 2看出,体系中添加交联剂EGDMA含量为0时,N元素的含量是1.69,接枝率为7.43%;体系中交联剂EGDMA含量为0.6%,N元素的含量最多,为2.27,接枝率为10.68%。随着体系中交联剂含量的增多,N元素的含量增多,PACMO的接枝率增多,这是因为反应体系中加少量的交联剂时,PACMO除了直接与PVDF主链接枝外,ACMO还可通过交联剂的交联作用与接枝到PVDF主链上的PACMO侧链连接,间接地与PVDF主链连接。XPS结果表明,体系中添加的交联剂EGDMA含量越多,PACMO接枝率提高。
2.3 SEM分析共聚物膜(M1-1, M1-2, M1-3, M1-4) 表面和断面形貌如图 3所示。体系中不加交联剂时,膜表面的膜孔数量较少,体系中添加交联剂含量为0.6%,膜表面的膜孔数量最多。随着反应体系中添加的交联剂含量增多,共聚物膜表面的膜孔数量增多,孔径增大,这归因于膜表面PACMO接枝率的增多,在成膜过程中,亲水性的PACMO和疏水性的PVDF主链相容性较差,PACMO链段向膜表面迁移,伸展的PACMO链段塌陷于PVDF主链上,在膜表面形成微孔。因此随着反应体系中添加的交联剂含量越多,膜表面的膜孔数量越多,孔径越大。共聚物膜的断面图呈典型的非对称结构,包括致密的顶层和指状大孔结构,这是液液相分离时发生的瞬时分相所导致的。随着交联剂添加量的增多,膜的断面结构没有显著性变化。

|
图 3 PVDF-g-PACMO共聚物膜的表面(1) 和断面形貌(2) (a)M1-1;(b)M1-2;(c)M1-3;(d)M1-4 Fig. 3 SEM images of top surface and cross-sectional morphology to PVDF-g-PACMO membranes (a)M1-1;(b)M1-2;(c)M1-3;(d)M1-4 |
采用接触角测试来表征PVDF-g-PACMO共聚物膜表面的亲疏水性。图 4为PVDF-g-PACMO共聚物膜(M1-1, M1-2, M1-3, M1-4) 的动态接触角随时间的变化情况。体系中添加交联剂EGDMA含量为0时,膜表面接触角是79.6°,体系中交联剂EGDMA含量为0.6%,接触角为76.1°。随着体系中添加的EGDMA含量越多,接触角降低,这是因为体系中添加的EGDMA含量越多,使PACMO的接枝率提高,膜表面的亲水性提高,接触角下降。膜表面的膜孔结构及亲疏水性影响接触角随时间下降的速率。体系中添加的EGDMA含量越高,膜表面的接触角随时间下降的越快,这是因为EGDMA含量越高,PACMO的接枝率提高,使得膜表面的亲水性提高,水滴易在膜表面铺展,此外PACMO接枝率的提高使膜表面膜孔数量增多,孔径增大,加速了水滴在膜表面的渗透速率,进而加速了接触角的下降[17]。
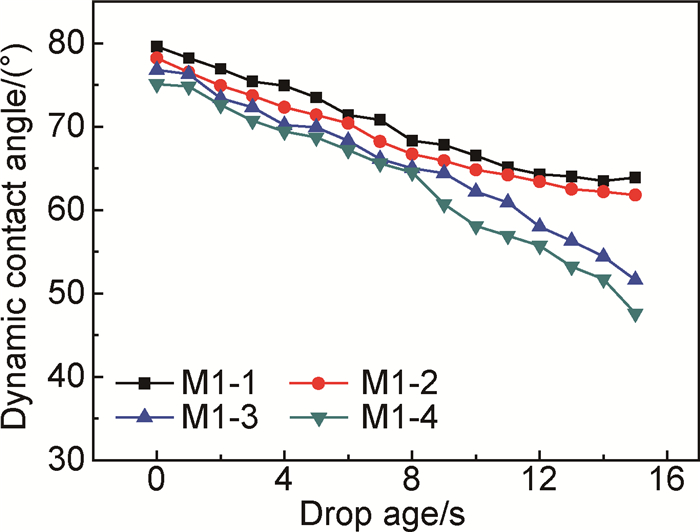
|
图 4 PVDF-g-PACMO共聚物膜的动态接触角 Fig. 4 Water contact angle of PVDF-g-PACMO membranes |
通过静态蛋白质吸附实验可以初步衡量膜表面的抗污染能力。图 5为PVDF-g-PACMO共聚物膜(M1-1, M1-2, M1-3, M1-4) 的静态蛋白质吸附量。由图 5可以看出,M1-1, M1-2, M1-3, M1-4的静态蛋白吸附量分别为31.7,27.2,25.3μg/cm2和20.5μg/cm2。随着EGDMA含量增多,共聚物膜表面的蛋白质吸附量逐渐降低。这是因为随着EGDMA含量增多,共聚物中PACMO接枝率提高,使得膜表面的亲水性提高,膜表面亲水性的PACMO链段可以吸附大量的水分子形成水化层[18],这种水化层可阻碍BSA与膜表面的接触,进而抑制BSA在膜表面的吸附,使BSA吸附量下降。
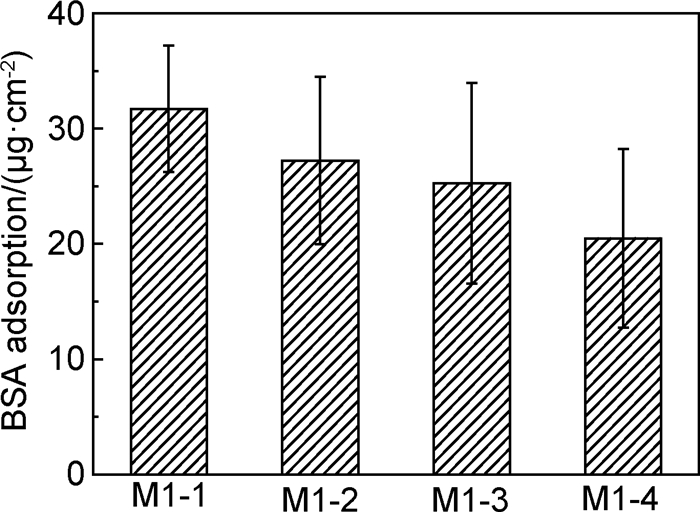
|
图 5 PVDF-g-PACMO共聚物膜的静态蛋白质吸附量 Fig. 5 Amount of adsorbed BSA to PVDF-g-PACMO membranes |
图 6为PVDF-g-PACMO共聚物膜(M1-1, M1-2, M1-3, M1-4) 在BSA蛋白质溶液循环过滤实验时的通量变化。由图 6可以看出,随着EGDMA含量的增多,共聚物膜表面透过的纯水通量增多。这是因为EGDMA含量的增多,使共聚物膜表面的亲水性提高,增强了膜表面和水分子的亲和性,此外PACMO接枝率提高,使膜表面膜孔数量增多,孔径增大,进而使透过的水通量增多。当料液由纯水换成BSA溶液时,共聚物膜的通量急剧下降,可归因于蛋白质分子沉积和吸附在膜孔或者膜表面,阻塞膜孔,使通量显著下降。为了定量计算共聚物膜的抗污染性,引入总污染指数Rt,可逆污染指数Rr,不可逆污染指数Rir和通透恢复率FRR。
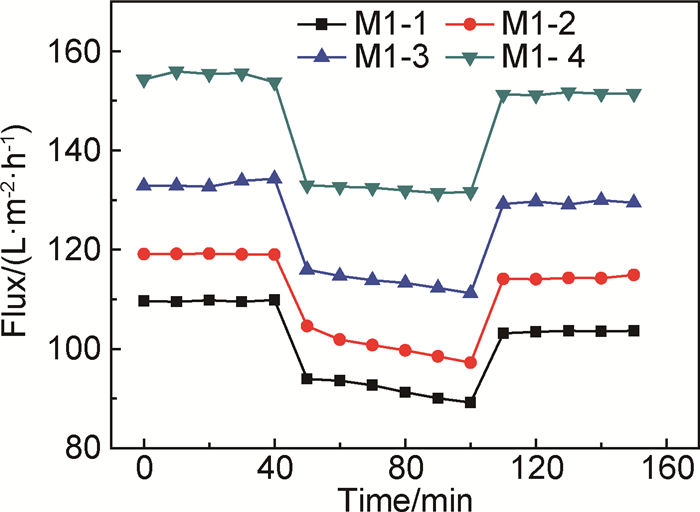
|
图 6 PVDF-g-PACMO共聚物膜在蛋白质溶液循环过滤实验时的通量变化 Fig. 6 Time-dependent flux of PVDF-g-PACMO membranes of BSA solution filtration |
图 7为循环过滤实验中PVDF-g-PACMO共聚物膜的Rt,Rr,Rir和FRR。由图 7可以看出,M1-1的Rt最高,为0.163,M1-4的Rt最小,为0.146。随着体系中添加的EGDMA含量增多,Rt下降,Rr上升,Rir下降。因此体系中EGDMA含量增多,膜表面抗蛋白质污染能力提高。由图 7还可以看出,M1-1的FRR为94.315%,M1-4的FRR为97.733%。体系中添加的EGDMA含量越多,FRR越大,表明膜表面的抗蛋白质污染能力越好。
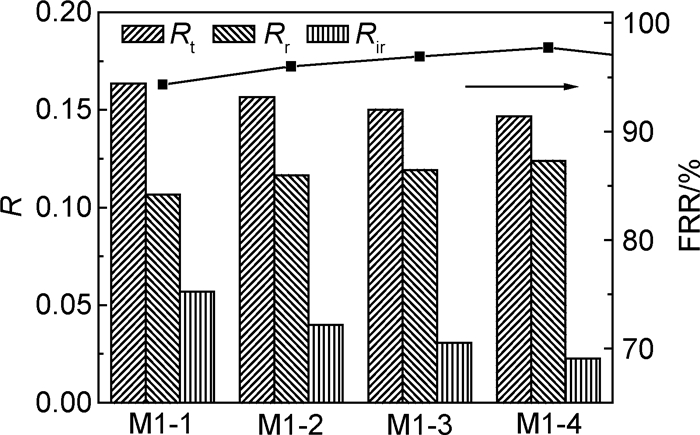
|
图 7 循环过滤实验中PVDF-g-PACMO共聚物膜的Rt,Rr,Rir和FRR Fig. 7 Rt, Rr, Rir and FRR of PVDF-g-PACMO membranes during multi-cycle filtration |
(1) 采用液-液相分离法成功地制备一系列EGDMA含量的PVDF-g-PACMO共聚物膜。
(2) 随着反应体系中交联剂EGDMA含量增多,共聚物膜表面PACMO接枝率提高,膜孔数量增多,孔径增大,膜表面亲水性提高,静态蛋白吸附量下降。
(3) 蛋白质溶液循环过滤实验结果表明随着EGDMA含量增多,透过的纯水通量增多,总污染指数下降,通量恢复率提高,膜表面的抗蛋白质污染能力提高。
| [1] | SU Y L, LIANG Y G, MU C X, et al. Improved performance of poly(vinylidence fluoride) microfiltration membranes prepared by freeze and immersion precipitation coupling method[J]. Industrial & Engineering Chemistry Research, 2011, 50 (18): 10525–10532. |
| [2] | HASHIM N, LIU Y T, LI K. Preparation of PVDF hollow fiber membranes using SiO2 particles: the effect of acid and alkali treatment on the membrane performances[J]. Industrial & Engineering Chemistry Research, 2011, 50 (5): 3035–3040. |
| [3] | MOGHAREH M R, KUMBHARKAR S C, GROTH A M, et al. Economical production of PVDF-g-POEM for use as a blend in preparation of PVDF based hydrophilic hollow fiber membrane[J]. Separation Purification Technology, 2013, 106 (14): 47–55. |
| [4] | ZhANG G, JI S, GAO X, et al. Adsorptive fouling of extracellular polymeric substances with polymeric ultrafiltration membranes[J]. Journal of Membrane Science, 2008, 309 (1-2): 28–35. DOI: 10.1016/j.memsci.2007.10.012 |
| [5] | WANG Y N, TANG C Y. Protein fouling of nanofiltration, reverse osmosis, and ultrafiltration membranes-the role of hydrodynamic conditions, solution chemistry, and membrane properties[J]. Journal of Membrane Science, 2011, 376 (1-2): 275–282. DOI: 10.1016/j.memsci.2011.04.036 |
| [6] | HAO Y, LIANG C, MORIYA A, et al. Visualization of protein fouling inside a hollow fiber ultrafiltration membrane by fluorescent microscopy[J]. Industrial & Engineering Chemistry Research, 2012, 51 (45): 14850–14858. |
| [7] | ZHU L P, XU Y Y, ZHU B K, et al. Surface modification of PVDF porous membranes via poly(DOPA) coating and heparin immobilization[J]. Colloids and Surfaces B: Biointerfaces, 2009, 69 : 152–155. DOI: 10.1016/j.colsurfb.2008.11.011 |
| [8] | LIU F, MOGHAREH M R, LI K, et al. Preparation and characterization of poly(vinylidene fluoride)(PVDF) based ultrafiltration membranes using nano γ-Al2O3[J]. Journal of Membrane Science, 2011, 366 (1-2): 97–103. DOI: 10.1016/j.memsci.2010.09.044 |
| [9] | TAKAHASHI H, NAKAYAMA M, ITOGA K, et al. Micropatterned thermoresponsive polymer brush surfaces for fabricating cell sheets with well-controlled orientational structures[J]. Biomacromolecules, 2011, 12 (5): 1414–1418. DOI: 10.1021/bm2000956 |
| [10] | LI W, NAKAYAMA M, AKIMOTO J, et al. Effect of block compositions of amphiphilic block copolymers on the physicochemical properties of polymeric micelles[J]. Polymer, 2011, 52 (17): 3783–3790. DOI: 10.1016/j.polymer.2011.06.026 |
| [11] | JO Y S, VLIES A J, HUBBELL J A, et al. Micelles for delivery of nitric oxide[J]. Journal of American Chemical Socciety, 2009, 131 (40): 14413–14418. DOI: 10.1021/ja905123t |
| [12] | ZHOU M Y, LIU H W, BELFORT G, et al. High throughput synthesis and screening of new protein resistant surfaces for membrane filtration[J]. Aiche Journal, 2010, 56 (7): 1932–1945. |
| [13] | LIU J, SHEN X, ZHAO Y P, et al. Acryloylmorpholine-grafted PVDF membrane with improved protein fouling resistance[J]. Industrial & Engineering Chemistry Research, 2013, 52 : 18392–18400. |
| [14] | 寇星, 耿立媛, 雷建都, 等. 红霉素分子印迹聚合物纳米微球的制备及其吸附特性[J]. 过程工程学报, 2011, 11 (3): 481–486. KOU X, GENG L Y, LEI J D, et al. Preparation andadsorptionproperties oferythromycinmolecularly imprinted polymernanospheres[J]. The Chinese Journal of Process Engineering, 2011, 11 (3): 481–486. |
| [15] | 蒋旭红, 刘展眉, 涂伟萍. 沉淀聚合法Poly(DVB-co-EGDMA-co-MAA)功能聚合物微球的制备及表征[J]. 高分子学报, 2012 (6): 633–639. JIANG X H, LIU Z M, TU W P. Preparation and characterization of Poly(DVB-co-EGDMA-co-MAA)functional polymermicrospheresvia precipitation polymerization[J]. Acta Polymerica Sinica, 2012 (6): 633–639. |
| [16] | 卢圣国, 段许佳, 罗芳, 等. 硼酸亲和整体柱的制备及其在液相色谱中的应用[J]. 南京工业大学学报(自然科学版), 2015, 37 (1): 27–31. LU S G, DUAN X J, LUO F, et al. Preparation and application in liquid chromatography of boronic acidaffinitymonolithic column[J]. Journal of Nanjing Tech University (Natural Science Edition), 2015, 37 (1): 27–31. |
| [17] | LI M Z, LI J H, XU X P, et al. Grafting zwitterionic brush on the surface of PVDF membrane using physisorbed free radical grafting technique[J]. Journal of Membrane Science, 2012, 405-406 : 141–148. DOI: 10.1016/j.memsci.2012.02.062 |
| [18] | QIN H, SUN C C, HE C, et al. High efficient protocol for the modification of polyethersulfone membranes with anticoagulant and antifouling properties via in situ cross-linked copolymerization[J]. Journal of Membrane Science, 2014, 468 (20): 172–183. |
 2017, Vol. 45
2017, Vol. 45


