文章信息
- 齐美丽, 肖桂勇, 吕宇鹏
- QI Mei-li, XIAO Gui-yong, LYU Yu-peng
- 氨基酸对水热合成羟基磷灰石纤维形貌的影响
- Effect of Amino Acids on Morphology of Hydrothermally Synthesized Hydroxyapatite Fibers
- 材料工程, 2017, 45(5): 46-51
- Journal of Materials Engineering, 2017, 45(5): 46-51.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2016.000994
-
文章历史
- 收稿日期: 2016-08-22
- 修订日期: 2017-03-15
2. 山东大学 材料科学与工程学院, 济南 250061;
3. 山东大学 苏州研究院, 江苏 苏州 215123
2. School of Materials Science and Engineering, Shandong University, Jinan 250061, China;
3. Suzhou Institute, Shandong University, Suzhou 215123, Jiangsu, China
羟基磷灰石(Hydroxyapatite,HA)是组成人体骨骼和牙齿主要的无机成分,因具有优异的生物相容性、骨传导性、生物活性及安全无毒性等诸多优点,被广泛应用于硬组织缺损的修复与再生以及载药释药等领域[1-4]。众所周知,HA属于生物陶瓷,其脆性低这一致命缺陷极大地限制了其应用。通过控制HA基生物材料的尺寸和形貌进而改变材料的柔韧性等力学性能是一种可行的方法。但是,如何攻克尺寸瓶颈,制备出具有较好柔韧性且均匀连续的HA超长纤维是一个具有很大挑战性的难题。目前,制备HA纤维的方法主要有固相法[5]、熔盐法[6]、水热法[7]、溶剂热法[8]、静电纺丝法[9]等。其中,水热法在得到结晶度高、粒度均一、形态规则的粒子上具有其他方法无可比拟的优越性[10],材料的尺寸和形貌的“人为控制”一直是材料研究者的理想目标。除了调控水热物化参数(温度、压力、反应物浓度、pH值等)形成合适反应环境来合成不同结晶形态的粒子外[11],表面活性剂的添加为实现HA晶粒尺寸及形貌等的调控提供了一种有效途径[12-15]。然而,表面活性剂分子对HA表面的特定吸附引入了一些有毒物相,另外有机溶剂的添加产生了如环保、健康等问题;因此,适宜的调节剂可以从生物体内寻找启发。
采用氨基酸调控HA晶体的生长是一种自然选择,因为氨基酸是人体的生理物质,能够通过血液循环在人体的所有组织中自由运动[16],是HA成核生长的有效调节剂。一般认为离子通过扩散、吸附等形式在晶体的表面沉积从而实现晶体的生长,而有机/无机的界面给生物矿化创造了十分重要的活化点,活化点的存在使得生物分子控制晶体生长成为可能[17]。前期研究表明:氨基酸通过静电引力和氢键作用可以对HA晶体表面产生特定的吸附,从而阻碍HA的生长[18-22]。然而,系统地研究不同种类的氨基酸对HA晶体形貌影响的报道较少。
本工作旨在研究酸性氨基酸L-谷氨酸(Glu)、中性氨基酸L-苯丙氨酸(Phe)和碱性氨基酸L-赖氨酸(Lys)对水热法合成HA纤维形貌的影响,在反应时间与反应温度为定值的情况下,分别观察在加入不同量的同一种氨基酸大分子物质时合成的HA晶体的形貌特点,为不同形貌和尺寸的HA晶体的制备以及更好地满足不同性能要求提供了实验依据。
1 实验材料与方法Ca(NO3)2·4H2O,(NH4)2HPO4,尿素,Glu,Phe和Lys均购自国药集团化学试剂有限公司,分析纯。按照Ca/P=1.8配制Ca(NO3)2·4H2O和(NH4)2HPO4两种溶液后与1mol/L的尿素溶液混合,分别加入Glu,Phe和Lys后用体积比为1:1的硝酸调节溶液的pH后磁力搅拌30min。Glu的加入量为0.2060,0.6180,1.0299g,Phe的加入量为0.2313,0.6938,1.5363g,Lys的加入量为0.2047,0.6140,1.0233g。将上述前驱体溶液倒入聚四氟乙烯内衬的不锈钢反应釜中,控制填充度为80%,反应温度设定为180℃,保温时间5h后自然冷却至室温。最后将产物离心,得白色沉淀,用去离子水清洗1次、无水乙醇清洗两次后放入鼓风干燥箱中干燥,得到最终产物。
采用Rigaku D/max-γB型X射线衍射仪(XRD)对产物的相组成进行检测分析,测试条件:铜靶(CuKα);管电压和管电流分别为40kV和100mA,扫描速率为4(°)/min,扫描范围10°~60°。采用场发射扫描电镜(FE-SEM)对产物的表面形貌进行分析,加速电压和加速电流分别设定为5kV和10μA,测试前进行喷金处理。
2 结果与分析 2.1 物相分析图 1是未添加任何种类的氨基酸与分别添加不同量的Glu,Phe和Lys后制备的产物的XRD图谱及HA的标准图谱(JCPDS No. 09-0432)。由图 1可知,添加3种氨基酸前后得到的产物都是HA,衍射峰的相对强度值有所差异,这与其他文献报道相似[23-25],推测是由晶体的择优取向不同导致的。经计算,添加0.2060,0.6180g和1.0299g Glu后衍射峰强度比I(300):I(211)分别为1.064,0.703和0.705,最强峰由(211) 晶面转变为(300) 晶面,推断产物的形貌应该有显著变化。添加0.2313, 0.6938g和1.5363g Phe后衍射峰强度比I(300):I(211)分别为1.095,1.036和1.174,两晶面的峰强相当。而添加0.2047, 0.6140g和1.0233g Lys后衍射峰强度比I(300):I(211)分别为1.502,1.115和2.293,(300) 晶面的峰值明显增强,产物沿c轴的择优生长现象显著。此外,添加Phe和Lys后在29.5°左右出现了一个较强峰,分析是有少量CaCO3生成。CO32-的出现一方面是在高压釜装封时空气中CO2的进入,另一方面尿素在高温分解产生的CO2中有一小部分溶于反应体系中,这部分CO32-极易取代HA晶体中的部分阴离子或与Ca2+结合生成CaCO3[26]。由图 1可知,本工作分别添加3种类型的氨基酸得到的产物主晶相都是HA,择优取向发生了较明显的变化。
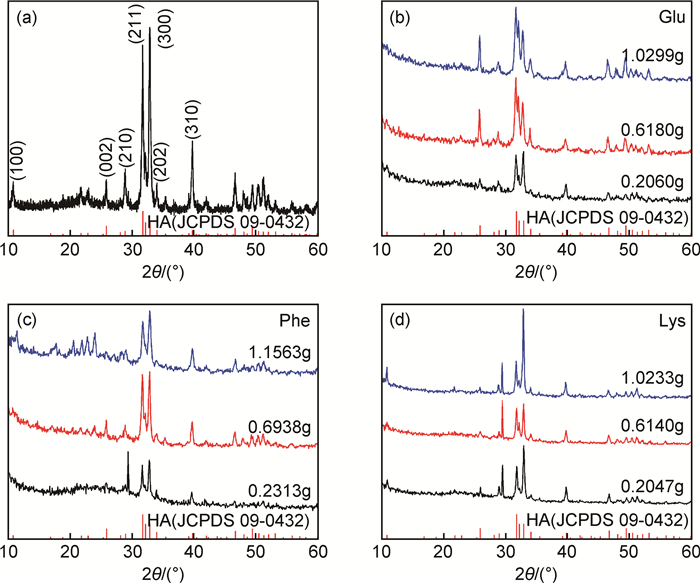
|
图 1 未添加及分别添加不同量的氨基酸后制备产物的XRD图 (a)无添加剂;(b)添加0.2060,0.6180g和1.0299g谷氨酸;(c)添加0.2313, 0.6938g和1.1563g苯丙氨酸;(d)添加0.2047, 0.6140g和1.0233g赖氨酸 Fig. 1 XRD patterns of the products synthesized with and without the addition of different amounts of amino acids (a)without any addition; (b) with addition of Glu at 0.2060, 0.6180g and 1.0299g;(c)with addition of Phe at 0.2313, 0.6938g and 1.1563g; (d)with addition of Lys at 0.2047, 0.6140g and 1.0233g |
本工作用到的氨基酸的等电点以及反应前后溶液的pH值总结见表 1,可知反应前后溶液的pH均为碱性(8.4~9.1),氨基酸的加入对反应后溶液的pH值影响不大。
| Amino acid | pI | pH value | |
| Before reaction | After reaction | ||
| Glu | 3.22 | 3.030 | 8.904 |
| 3.048 | 8.455 | ||
| 3.015 | 8.748 | ||
| Phe | 5.48 | 3.515 | 8.896 |
| 3.498 | 8.945 | ||
| 3.485 | 8.806 | ||
| Lys | 9.74 | 3.515 | 9.067 |
| 3.516 | 8.970 | ||
| 3.518 | 8.891 | ||
图 2是添加不同量的Glu后制备的产物SEM照片,其中图 2(a)为无添加剂的原始试样形貌,图 2(b), (c), (d)分别为添加0.2060,0.6108g和1.0299g的Glu后得到的产物形貌。可以看出,未添加任何种类氨基酸后反应得到的产物从一个形核点出发生长,微观形貌呈带状;添加Glu后部分带状纤维从形核点处脱落;随着Glu添加量的增加,产物形貌变化较大,趋近于花瓣状微球,这与XRD测试结果相一致。

|
图 2 添加不同量的Glu后制备的产物SEM照片 (a)0g;(b)0.2060g;(c)0.6108g;(d)1.0299g Fig. 2 SEM images of the products with addition of different amounts of Glu (a)0g;(b)0.2060g;(c)0.6108g;(d)1.0299g |
Glu能够对HA形貌产生明显的影响,特别是当浓度增加时,其影响的效果尤为显著,其主要原因是Glu能够影响HA晶体的生长过程。通常认为,酸性氨基酸对结晶的影响与静电作用和氨基酸的螯合作用有关。在HA成核初期,Glu就会对其产生影响。亚稳态的磷酸八钙OCP(Ca8H2(PO4)6·5H2O)首先形核,然后OCP水解转化为HA晶体[27]。含有羧基基团的Glu优先吸附在片状OCP晶体的(100) 面,是一种固定吸附,在OCP的(100) 面转化成HA的(100) 面后,这种吸附作用仍然存在,致使其在很大程度上影响了OCP的形貌以及后续向HA的转变[16]。随着水热反应的进行,尿素不断分解,溶液成碱性,在静电引力的作用下,Glu将主要吸附在(100) 面,阻碍HA晶体在a,b面的生长。此外,Glu与HA表面强烈的化学键作用也是Glu阻碍HA生长的一大因素,二者最终导致产物呈花瓣状的微球。
2.2.2 Phe对产物形貌的影响图 3分别为添加0.2313(图 3(a), (b)), 0.6938g(图 3(c))和1.5363g(图 3(d))Phe后得到的产物SEM照片。可以看出,加入0.2313g的Phe反应得到的HA部分保留了团聚体形貌,纤维从形核点处脱落,随Phe浓度的增加,团聚现象逐渐减弱,纤维呈棒状,分散性较好。

|
图 3 添加不同量的Phe后制备的产物SEM照片 (a), (b)0.2313g;(c)0.6938g;(d)1.5363g Fig. 3 SEM images of the products with addition of different amounts of Phe (a), (b)0.2313g;(c)0.6938g;(d)1.5363g |
氨基酸和HA表面的相互作用主要是通过—COO-和Ca2+的共价键实现的[22, 28, 29]。Phe属于中性氨基酸,分子中碱性的—NH2与酸性的—COOH数目相等,呈非极性。其中的阴离子链可与OH-竞争吸附Ca2+位,在HA表面的吸附可能性随氨基浓度的增高而增大。初始溶液pH值为酸性,偶极离子中的—COO-接受质子因而形成正离子;随着溶液pH值逐渐升至碱性,偶极离子中的—NH3+提供质子从而生成负离子,最终形成了分散性较好的棒状HA。
2.2.3 Lys对产物形貌的影响图 4(a), (b), (c), (d)分别为添加0.2047,0.6140g和1.0233g的Lys后得到的产物SEM照片。可以看出,加入0.2047g的Lys反应得到的HA部分保留了团聚体形貌。随Lys浓度的增加,团聚体的形貌逐渐消失,带状纤维有断裂的现象,纤维尺寸不均匀。

|
图 4 添加不同量的Lys后制备的产物SEM照片 (a),(b)0.2047g;(c)0.6140g;(d)1.0233g Fig. 4 SEM images of the products with addition of different amounts of Lys (a), (b)0.2047g;(c)0.6140g;(d)1.0233g |
由HA的晶体结构可知,c轴方向存在P点吸附位置,Ca2+在溶液当中P点偶尔会出现空缺,这就导致P点位置带负电荷,从而易于吸附带有正电荷的离子,促进HA形核[30, 31]。在实验条件下,反应液pH值一直小于Lys的等电点(如表 1所示),因此在整个反应过程中Lys带正电荷,可以取代HA晶体表面的结构水从而吸附在(001) 面带负电荷的P位置,故HA晶体c轴方向生长受阻,a,c面的相对叠加速率发生改变[16];当Lys含量增加到一定程度后,这种吸附引起的抑制作用逐渐增强,HA各晶面都将吸附不同数量的Lys,这就导致图 4中出现的颗粒在大小和形状的均匀性上出现差异,Lys对HA的吸附是通过NH3+基团与HA表面自由PO43-的静电作用实现的。
3 结论(1) 采用酸性的L-谷氨酸(Glu)、中性的L-苯丙氨酸(Phe)和碱性的L-赖氨酸(Lys)作为调节剂,调控水热反应过程中HA纤维的生长。
(2) 添加3种氨基酸后得到的样品主晶相都是HA,部分样品含少量碳酸钙;不同氨基酸的加入导致晶体择优取向发生了变化,从Glu,Phe到Lys的加入,晶体从(211) 晶面逐渐转变为(300) 晶面择优生长。
(3) 不同种类的氨基酸对HA晶体的吸附位置不一样从而对各个晶面产生不同的影响,故而得到了不同的形貌。Glu对形貌的影响主要是羧基的吸附作用实现的;Phe在HA表面的吸附可能性随氨基浓度的增高而增大;而Lys对HA的吸附是通过NH3+基团与HA表面的自由PO43-的静电作用实现的。
| [1] | KOMLEV V S, BARINOV S M, KOPLIK E V. A method to fabricate porous spherical hydroxyapatite granules intended for time-controlled drug release[J]. Biomaterials, 2002, 23 (16): 3449–3454. |
| [2] | SADAT-SHOJAI M, MOHAMMAD-TAGHI K, EHSAN DINPANAH-KHOSHDARGI, et al. Synthesis methods for nanosized hydroxyapatite with diverse structures[J]. Acta Biomaterialia, 2013, 9 (8): 7591–7621. |
| [3] | QI M L, XIAO G Y, SHOKUHFAR T, et al. Flexible hydroxyapatite fiber precipitated by urea via hydrothemal route[J]. Surface Innovation, 2017 . DOI: 10.1680/jsuin.16.00024 |
| [4] | 龙剑平, 郝孝丽, 林金辉. 氟磷灰石的微乳液法制备及其表征[J]. 材料工程, 2013 (7): 83–86. LONG J P, HAO X L, LIN J H. Preparation and characterization of fluoroapatite particles via microemulsion[J]. Journal of Materials Engineering, 2013 (7): 83–86. |
| [5] | OTA Y, IWASHITA T, KASUGA T, et al. Novel preparation method of hydroxyapatite fibers[J]. Journal of the American Ceramic Society, 1998, 81 (6): 1665–1668. |
| [6] | TAS A C. Molten salt synthesis of calcium hydroxyapatite whiskers[J]. Journal of the American Ceramic Society, 2001, 84 (2): 295–300. |
| [7] | QI M L, XIAO G Y, LU Y D. Rapid hydrothermal synthesis of submillimeter ultralong flexible hydroxyapatite fiber using different pH regulators[J]. Acta Metallurgica Sinica (English Letters), 2016, 29 (7): 609–613. |
| [8] | ZHANG Y G, ZHY Y J, CHEN F. Highly porous ceramics based on ultralong hydroxyapatite nanowires[J]. RSC Advances, 2016, 6 (104): 102003–102009. |
| [9] | FRANCO P Q, JOÃO C F C, SILVA J C, et al. Electrospun hydroxyapatite fibers from a simple sol-gel system[J]. Materials Letters, 2012, 67 (1): 233–236. |
| [10] | 仲维卓, 罗豪, 黄宣威, 等. 磷酸盐晶体中络阴离子结晶方位与晶体形态[J]. 无机材料学报, 1999, 14 (2): 223–227. ZHONG W Z, LUO H, HUANG X W, et al. Crystallographic orientation and morphology of anion coordination phosphate crystals[J]. Journal of Inorganic Materials, 1999, 14 (2): 223–227. |
| [11] | AN L, LI W, XU Y, et al. Controlled additive-free hydrothermal synthesis and characterization of uniform hydroxyapatite nanobelts[J]. Ceramics International, 2015, 42 (2): 3104–3112. |
| [12] | YAN L, LI Y D, DENG Z X, et al. Surfactant-assisted hydrothermal synthesis of hydroxyapatite nanorods[J]. International Journal of Inorganic Materials, 2001, 3 (7): 633–637. |
| [13] | WANG Y J, CHEN J D, WEI K, et al. Surfactant-assisted synthesis of hydroxyapatite particles[J]. Materials Letters, 2006, 60 (27): 3227–3231. |
| [14] | NGA N K, GIANG L T, HUY T Q, et al. Surfactant-assisted size control of hydroxyapatite nanorods for bone tissue engineering[J]. Colloids and Surfaces B Biointerfaces, 2014, 116 (14): 666–673. |
| [15] | 高珊. 表面活性剂对羟基磷灰石纳米线合成的影响研究[D]. 山东: 山东大学, 2012. GAO S. Study on the effect of surfactants on the synthesis of hydroxyapatite nanowire[D].Shandong:Shandong University, 2012. |
| [16] | 张海斌. 羟基磷灰石晶粒/粒子的水热控制合成[D]. 长沙: 中南大学, 2011. ZHANG H B.Study on controlled synthesis of hydroxyapatite crystal/particle under hydrothermal condition[D].Changsha:Central South University, 2011. |
| [17] | GAO W M, RUAN C X, CHEN Y F. Effects of acidic amino acids on hydroxyapatite morphology[J]. Key Engineering Materials, 2007, 336-338 : 2096–2099. |
| [18] | MATSUMOTOA T, OKAZAKIB M, INOUE M, et al. Crystallinity and solubility characteristics of hydroxyapatite adsorbed amino acid[J]. Biomaterials, 2002, 23 (10): 2241–2247. |
| [19] | KOUTSOPOULOS S, DALAS E. Inhibition of hydroxyapatite formation in aqueous solutions by amino acids with hydrophobic side groups[J]. Langmuir, 2000, 16 (16): 6739–6744. |
| [20] | KOUTSOPOULOS S, DALAS E. The effect of acidic amino acids on hydroxyapatite crystallization[J]. Journal of Crystal Growth, 2000, 217 (4): 410–415. |
| [21] | SPANOS N, KLEPETANIS P G, KOUTSOUKOS P G. Model studies on the interaction of amino acids with biominerals: the effect of L-serine at the hydroxyapatite-water interface[J]. Journal of Colloid and Interface Science, 2001, 236 (2): 260–265. |
| [22] | JACK K S, TIMOTHY G V, TRAU M. Characterization and surface properties of amino-acid-modified carbonate-containing hydroxyapatite particles[J]. Langmuir, 2007, 23 (24): 12233–12242. |
| [23] | ROEDER K R, CONVERSE G L, LENG H, et al. Kinetic effects on hydroxyapatite whiskers synthesized by the chelate decomposition method[J]. Journal of the American Ceramic Society, 2006, 89 (7): 2096–2104. |
| [24] | VISWANATH B, RAVISHANKAR N. Controlled synthesis of plate-shaped hydroxyapatite and implications for the morphology of the apatite phase in bone[J]. Biomaterials, 2008, 29 (36): 4855–4863. |
| [25] | ZHANG H G, ZHU Q S, WANG Y. Morphologically controlled synthesis of hydroxyapatite with partial substitution of fluorine[J]. Chemistry of Materials, 2005, 17 (23): 5824–5830. |
| [26] | 齐美丽, 亓佳, 肖桂勇, 等. 表面活性剂对羟基磷灰石纤维形貌的影响[J]. 无机材料学报, 2016, 31 (7): 726–730. QI M L, QI J, XIAO G Y, et al. Effect of surfactants on the morphology of hydroxyapatite fibers[J]. Journal of Inorganic Materials, 2016, 31 (7): 726–730. |
| [27] | QI M L, QI J, XIAO G Y, et al. One-step hydrothermal synthesis of carbonated hydroxyapatite porous microspheres with a large and uniform size regulated by L-glutamic acid[J]. Crystengcomm, 2016, 18 (31): 5876–5884. |
| [28] | BARTH A. The infrared absorption of amino acid side chains[J]. Progress in Biophysics and Molecular Biology, 2000, 74 (3): 141–173. |
| [29] | PALAZZON B, WALSH D, LAFISCO M, et al. Amino acid synergetic effect on structure, morphology and surface properties of biomimetic apatite nanocrystals[J]. Acta Biomaterialia, 2009, 5 (4): 1241–1252. |
| [30] | KOUTSOPOULOS S, DALAS E. The crystallization of hydro-xyapatite in the presence of lysine[J]. Journal of Colloid and Interface Science, 2000, 231 (2): 207–212. |
| [31] | YANG X D, XIE B Q, WANG L J, et al. Influence of magnesium ions and amino acids on the nucleation and growth of hydroxyapatite[J]. Crystengcomm, 2011, 13 (4): 1153–1158. |
 2017, Vol. 45
2017, Vol. 45


