文章信息
- 王贝, 许立宁, 李东阳, 路民旭
- WANG Bei, XU Li-ning, LI Dong-yang, LU Min-xu
- O2/CO2共存环境下缓蚀剂抑制碳钢腐蚀的机理研究
- Corrosion Inhibition Mechanism of Carbon Steel in O2/CO2 Coexisting Environment
- 材料工程, 2017, 45(5): 38-45
- Journal of Materials Engineering, 2017, 45(5): 38-45.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2015.000439
-
文章历史
- 收稿日期: 2015-04-20
- 修订日期: 2016-09-08
CO2腐蚀是油气田生产过程中最为常见的一种腐蚀形式,然而在实际油气田管道中,一些因素会导致油气管线内部含有O2,形成O2/CO2腐蚀环境。引入O2的途径多种多样,比如:加注缓蚀剂、pH稳定剂、阻垢剂等药剂时,药剂里混有的O2将被带入管线[1];海管试压时,注入的海水中如果O2未除净也会带入O2;此外,加注CO2驱油、回注采出水、管道泄漏、维修等[2]都会在管线内引入O2。据相关文献报道[3-5],在井口处O2含量最高可以达到7×10-6,在其余部位有时也能达到1×10-7~2×10-6。但是由于实际管道中,低浓度氧含量的检测非常困难,导致实际管道中很难发现微量溶解氧的问题,所以O2的问题长期以来并不被人们所重视[6, 7]。
缓蚀剂作为一种简单有效且价格低廉的抑制CO2腐蚀的措施,被广泛应用于油气田生产过程中。缓蚀剂的作用效果不仅受温度、CO2分压、水介质成分的影响,O2对其也有重要影响。但是,到目前为止,O2对缓蚀剂抑制CO2腐蚀的具体影响机制在国内外尚未展开系统的研究。
Wang[1]研究在含O2环境下碳钢的腐蚀,发现在O2/CO2共存环境下,碳钢自腐蚀电位要比纯CO2环境下正,且腐蚀形貌由均匀腐蚀变成了局部腐蚀,并出现了点蚀坑,甚至,可能由于不同部位O2含量的不同,产生严重的电偶腐蚀。Gulbrandsen等[8]利用旋转圆柱电极研究了不同O2含量对缓蚀剂抑制碳钢CO2腐蚀的影响,发现O2的存在的确导致了缓蚀剂作用效果的减弱。O2之所以能减弱缓蚀剂作用效果的主要原因是O2渗透缓蚀剂吸附膜的能力要远比其他腐蚀介质强,从而导致缓蚀剂吸附膜的屏蔽作用明显减弱。
本工作利用腐蚀电化学方法,结合扫描电镜等手段,研究O2对缓蚀剂抑制碳钢CO2腐蚀的影响,从O2影响缓蚀剂分子吸附能力的角度提出了O2减弱缓蚀剂缓蚀效果的作用机制。
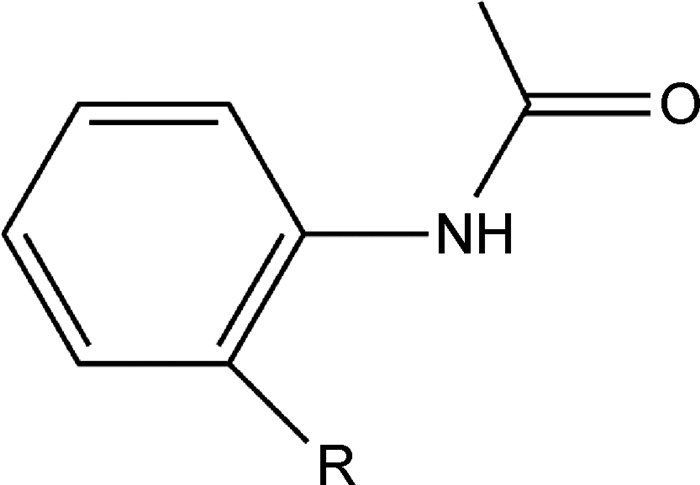
1 实验材料与方法本实验使用的缓蚀剂为工业用缓蚀剂A,其主要成分为酰胺类有机物,其分子结构如图 1所示。实验所用工作电极材料为X70管线钢,其化学成分如表 1所示。所用溶液为某气田采出液模拟溶液,其成分如表 2所示。
|
图 1 缓蚀剂A主要成分 Fig. 1 The major component of inhibitor A |
| C | Si | Mn | P | Mo | Ti | Fe |
| 0.06 | 0.21 | 1.61 | 0.01 | 0.19 | 0.012 | Bal |
| Ca2+ | Mg2+ | Na+ | K+ | Cl- | SO42- | CO32- | NO3- |
| 511.6 | 49.2 | 117.3 | 194.9 | 1631.9 | 115.2 | 302.1 | 463.1 |
实验在常压下进行,测试温度分别为25℃和60℃。溶液配好后通CO2气体除氧8h。进行纯CO2条件下实验时,向溶液里持续缓慢通入纯CO2气体,使溶液保持CO2饱和状态,并防止测试过程中溶解氧进入;进行O2/CO2共存环境下的实验时,向溶液里持续缓慢地通入O2:CO2(体积比)为1:8的混合气体,此时溶解氧含量经溶氧仪测量约1.4×10-6。
使用PARSTAT MODEL 616A型旋转圆盘电极进行实验,转速为1000r/min,实验采用三电极体系。工作电极为有效面积1cm2的圆盘状试样。测试前,用砂纸将试样打磨到2000#,依次用丙酮除油,去离子水冲洗,酒精清洗,冷风吹干。所用辅助电极为铂电极,参比电极为饱和甘汞电极(SCE)。
进行不同缓蚀剂浓度下的缓蚀剂电化学性能测试时,测试温度为25℃,先稳定开路电位30min,然后测试交流阻抗,最后再测极化曲线。电化学测试所用仪器为PARSTAT 4000电化学工作站。交流阻抗测试频率范围100kHz至10mHz,交流信号幅值为5mV。动电位极化曲线以0.5mV·s-1扫描速率从-0.35V扫至0.35V(相对于开路电位)。
进行8×10-5缓蚀剂浓度下EIS连续监测实验时,测试温度为60℃,测试开始后,每隔一段时间测试一次EIS,连续测试30h。30h测试结束后,取出试样,依次用去离子水,酒精清洗,冷风吹干。利用TTR3X射线衍射仪分析含氧条件下试样表面腐蚀产物的组成,使用LEO1450扫描电子显微镜观察腐蚀产物膜的微观形貌。
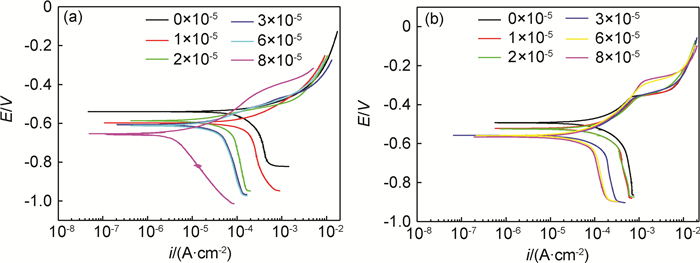
2 结果与分析 2.1 不同缓蚀剂浓度下极化曲线分析图 2为加入不同浓度缓蚀剂A后碳钢的极化曲线。图 2(a)为25℃,通CO2气体至饱和,1000r/min转速下,加入不同浓度的缓蚀剂A后所测得的极化曲线。图 2(b)为相同条件下通入11.12%O2后所测极化曲线。由图 2可见,随着缓蚀剂浓度的增加,极化曲线的阴阳极Tafel斜率都发生了改变,而自腐蚀电位负移,可见此种缓蚀剂是以抑制阴极反应为主的混合型缓蚀剂[9]。利用Tafel曲线外推法,计算出各种条件下的自腐蚀电流密度icorr和缓蚀效率η,结果如表 3所示。当体系中混入O2以后,在各个缓蚀剂浓度下,自腐蚀电流密度icorr都明显增大,腐蚀速率变大。同时,随着缓蚀剂浓度的增加,纯CO2环境下,icorr迅速下降,当缓蚀剂浓度到达8×10-5时,缓蚀效率达到了98%以上。而当混入O2以后,最高缓蚀效率只有80%左右。
|
图 2 不同缓蚀剂浓度下的极化曲线 (a)CO2环境;(b)O2/CO2环境 Fig. 2 Polarization curves with different inhibitor concentrations (a)CO2 environment; (b)O2/CO2 environment |
| Concentration/10-5 | icorr/(μA·cm-2) | η/% | |||
| CO2 | O2/CO2 | CO2 | O2/CO2 | ||
| 0 | 204.0 | 402.0 | — | — | |
| 1 | 166.0 | 277.0 | 18.6 | 31.1 | |
| 2 | 69.1 | 246.0 | 66.2 | 38.7 | |
| 3 | 45.1 | 136.0 | 77.9 | 66.1 | |
| 6 | 42.5 | 86.9 | 79.2 | 78.4 | |
| 8 | 3.41 | 79.3 | 98.3 | 80.3 | |
由图 2(a)可见,缓蚀剂浓度增加后,阴极Tafel曲线明显变平,缓蚀剂的加入极大地阻滞了阴极过程,从而导致自腐蚀电流密度迅速下降。对比图 2(b)含氧环境下的极化曲线,发现随着缓蚀剂浓度的增加,阴极Tafel斜率并无明显改变,只是整个极化曲线向左平移,因此自腐蚀电流密度icorr减小的程度远不如纯CO2条件下的明显。
对比阳极极化曲线,有氧和无氧条件下都出现了明显的平台区,这是阳极极化电位达到一定程度时,试样表面Fe溶解,导致吸附在上面的缓蚀剂脱附所致。平台区电位即为缓蚀剂脱附电位[10]。当缓蚀剂浓度较低时,脱附电位并无明显差异,当缓蚀剂浓度达到8×10-5时,脱附电位明显变正。
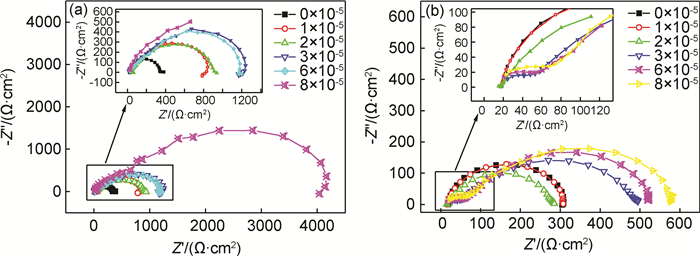
2.2 不同缓蚀剂浓度下阻抗谱分析图 3为纯CO2和O2/CO2环境下所测得的阻抗谱。由图 3可知,两种条件下,不含缓蚀剂及含较低浓度缓蚀剂时,阻抗谱由一个容抗弧构成。当缓蚀剂浓度增加时,阻抗谱由双容抗弧组成。在纯CO2环境下,当缓蚀剂达到8×10-5时,低频区还出现了一个小感抗弧,这是缓蚀剂吸附过程所致,而O2/CO2环境下则没有出现。
|
图 3 不同缓蚀剂浓度下的EIS结果 (a)CO2环境;(b)O2/CO2环境 Fig. 3 EIS results with various inhibitor concentrations (a)CO2 environment; (b)O2/CO2 environment |
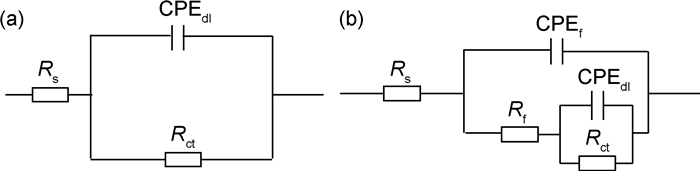
利用阻抗谱拟合软件Zsimpwin进行拟合,所得结果如表 4,5所示。缓蚀剂浓度较低时,利用图 4(a)所示的等效电路进行拟合,其中Rs为溶液电阻,CPE为常相位角元件,它包括两个参数:Y0和n,其阻抗如公式(1) 所示:
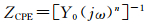
|
(1) |
| Concentration/ 10-5 |
Rs/ (Ω·cm2) |
CPEf | Rf/ (Ω·cm2) |
CPEdl | Rct/ (Ω·cm2) |
Cdl/ (10-5F·cm-2) |
||
| Y1/(10-5Ω-1·cm-2sn) | n1 | Y2/(10-5Ω-1·cm-2sn) | n2 | |||||
| 0 | 25.94 | — | — | — | 35.86 | 0.8789 | 323.5 | 26.65 |
| 1 | 22.66 | — | — | — | 9.107 | 0.6809 | 926.1 | 2.858 |
| 2 | 26.53 | 0.2146 | 0.9963 | 44.79 | 10.72 | 0.6859 | 884.0 | 3.643 |
| 3 | 18.48 | 0.2527 | 0.9761 | 178.1 | 3.623 | 0.7677 | 1030 | 1.339 |
| 6 | 30.39 | 0.9670 | 0.8251 | 209.3 | 3.505 | 0.7782 | 974.5 | 1.338 |
| 8 | 59.28 | 0.8689 | 1.000 | 604.1 | 1.834 | 0.7902 | 3544 | 0.8876 |
| Concentration/ 10-5 |
Rs/ (Ω·cm2) |
CPEf | Rf/ (Ω·cm2) |
CPEdl | Rct/ (Ω·cm2) |
Cdl/ (10-5F·cm-2) |
||
| Y1/(10-5Ω-1·cm-2sn) | n1 | Y2/(10-5Ω-1·cm-2sn) | n2 | |||||
| 0 | 18.13 | — | — | — | 33.62 | 0.9111 | 293.5 | 26.82 |
| 1 | 17.39 | — | — | — | 43.42 | 0.8984 | 294.9 | 26.38 |
| 2 | 17.10 | — | — | — | 45.77 | 0.7712 | 272.2 | 24.67 |
| 3 | 14.24 | 3.838 | 0.6391 | 50.53 | 23.10 | 0.7139 | 435.7 | 9.204 |
| 6 | 10.37 | 1.481 | 0.7241 | 60.31 | 20.10 | 0.7402 | 470.8 | 8.786 |
| 8 | 8.396 | 3.636 | 0.6135 | 89.19 | 10.30 | 0.7778 | 496.1 | 4.404 |
|
图 4 拟合EIS结果的等效电路图 (a)较低浓度缓蚀剂;(b)较高浓度缓蚀剂 Fig. 4 Equivalent circuits used for fitting the EIS results (a)at low inhibitor concentration; (b)at high inhibitor concentration |
Rct为电荷转移电阻。高缓蚀剂浓度时,利用图 4(b)所示的等效电路进行拟合,其中Rf为试样表面各种物质形成的膜的电阻,Rct为电荷转移电阻[11]。
电荷转移电阻Rct能够反映缓蚀剂吸附膜屏蔽腐蚀介质,阻碍腐蚀反应进行的能力,Rct越大,表示缓蚀效果越好,腐蚀速率越低。由表 4可知,在纯CO2环境下,加入缓蚀剂以后,Rct迅速变大,同时,Rct随着缓蚀剂浓度的增加也基本保持变大趋势,到8×10-5时,Rct急剧变大,达到3544 Ω·cm2,缓蚀效率达到最高。但是,在O2/CO2共存环境下,由表 5知,加入较低浓度的缓蚀剂(1×10-5和2×10-5)后,Rct基本保持不变,甚至在2×10-5时还略有减小。这可能是因为,一方面,加入缓蚀剂以后自腐蚀电位变负,试样腐蚀的倾向变大,而另一方面,缓蚀剂的浓度增加导致缓蚀剂吸附量增大,吸附膜覆盖率增加,而在2×10-5时,电位变负占据主导地位,从而导致在2×10-5时Rct反常减小。当加入的缓蚀剂浓度达到3×10-5以上时,Rct开始明显变大,且随着缓蚀剂浓度的增加而变大,但是与CO2环境中同缓蚀剂浓度下的Rct相比,仍然要小得多。
酰胺类缓蚀剂的吸附是缓蚀剂分子中N原子上的孤对电子与钢表面Fe原子上的d轨道结合,从而取代试样与溶液界面双电层中吸附的水分子的一个过程[12]。电容器的电容值C与介电常数ε,真空介电常数ε0,电容器面积S,电容器厚度d存在如公式(2) 所示的关系。由于缓蚀剂分子的介电常数要小于水分子的介电常数,且缓蚀剂分子的长度要比水分子长,所以当缓蚀剂在试样表面吸附后,就会导致双电层电容Cdl急剧下降。因此,可以从Cdl的数值来判断缓蚀剂吸附膜在钢表面的覆盖程度[13]。双电层电容Cdl由公式(3) 计算得出。
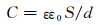
|
(2) |
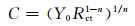
|
(3) |
如表 4所示,在CO2环境下,Cdl随着缓蚀剂浓度的增加而急剧下降。当缓蚀剂浓度达到8×10-5时,Cdl从0时的2.665×10-4F·cm-2降低到了8.88×10-6 F·cm-2。同时从极化曲线计算的缓蚀效率来看,8×10-5时达到98.33%,说明此时缓蚀剂分子在试样表面吸附量很大,吸附膜覆盖十分完整,缓蚀效果好。
对比O2/CO2环境下,如表 5所示,缓蚀剂溶度为0时由于表面无缓蚀剂吸附,所以两种条件下Cdl相近。而当缓蚀剂添加到1×10-5和2×10-5时,由于添加的缓蚀剂浓度比较低,含氧条件下,试样表面所吸附的缓蚀剂分子极少,双电层中的水分子只有极少量被取代,所以Cdl基本保持不变。而当缓蚀剂浓度继续增加时,缓蚀剂分子吸附量增加,取代的水分子越来越多,Cdl开始逐渐降低,直到8×10-5,双电层电容降为4.40×10-5 F·cm-2,但仍远大于纯CO2环境下的Cdl。显然,加入O2以后,试样表面吸附的缓蚀剂分子减少了,吸附膜覆盖度减少,即使在8×10-5条件下,其缓蚀效率也只有80.27%,远低于纯CO2环境下的缓蚀剂作用效果。
2.3 缓蚀剂的吸附模型由于缓蚀剂A为吸附膜型有机缓蚀剂,因此,其双电层电容Cdl与吸附膜覆盖率θ存在如公式(4) 和(5) 的关系,其中,C0为不加缓蚀剂时的双电层电容,Cs代表θ为1时的双电层电容值,为一个常量,又由于当基体表面积一定时,缓蚀剂的吸附量Γ与吸附膜的覆盖率θ呈线性关系,如公式(6) 所示,其中,k,λ为常数,所以,缓蚀剂在钢表面的吸附量可以用(1-(Cdl/C0))表示。
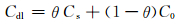
|
(4) |
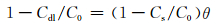
|
(5) |
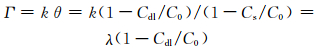
|
(6) |
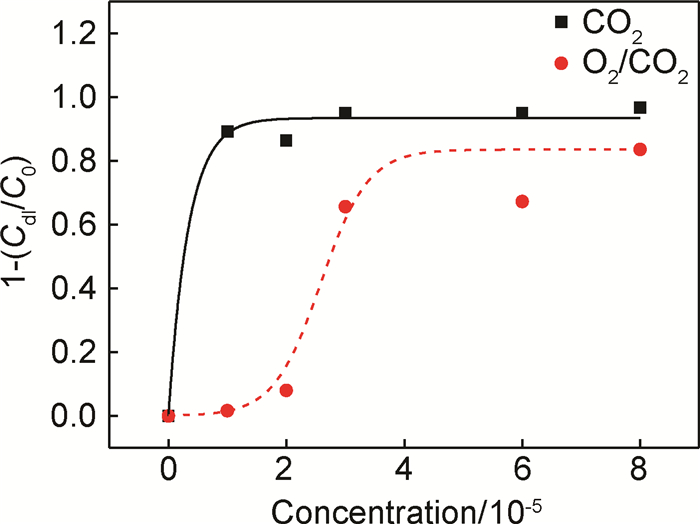
因此,可以用缓蚀剂浓度及(1-(Cdl/C0))做出缓蚀剂分子在溶液中吸附在Fe表面的吸附等温曲线,如图 5所示。
|
图 5 缓蚀剂的吸附等温曲线 Fig. 5 Adsorption isothermal curves of inhibitor |
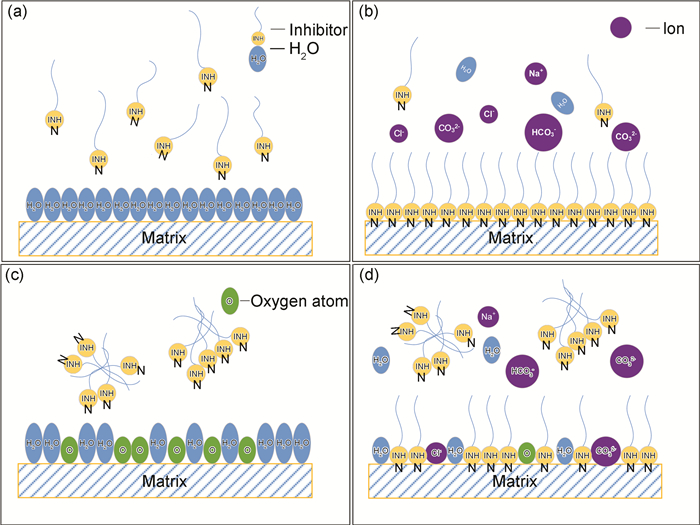
由图 5可以看出,CO2环境下缓蚀剂的吸附等温曲线为典型的L型曲线,随着缓蚀剂浓度的增大,其吸附量迅速增大。说明在CO2环境下缓蚀剂分子在试样表面的吸附能力非常强,且溶剂分子对基体表面的吸附位没有强烈的竞争。其作用过程如图 6(a), (b)所示,缓蚀剂分子可以很好地分散在溶液中,不断取代金属基体表面的水分子,当缓蚀剂浓度合适时,可以形成完整的屏蔽层,很好地阻隔腐蚀介质。
|
图 6 缓蚀剂分子吸附过程 (a), (b) CO2环境;(c), (d) O2/CO2环境 Fig. 6 Adsorption process of inhibitor molecules (a), (b)CO2 environment; (c), (d)O2/CO2 environment |
而O2/CO2环境下的吸附等温曲线则为典型的S形曲线,说明当有O2存在情况下,溶液中其他粒子对基体上的吸附位竞争很强,缓蚀剂分子与基体表面的相互作用力变得非常弱,而缓蚀剂分子之间的相互作用力则相对来说变得比较强,缓蚀剂分子更趋向于自身分子之间的结合[14-17]。
其作用过程如图 6(c), (d)所示,当水中的溶解氧在基体表面解离成氧原子并吸附在基体表面时,不仅会占据部分缓蚀剂分子的吸附位,同时基体的表面状态也随之发生改变,于是导致了缓蚀剂分子与基体表面的相互作用力变弱,缓蚀剂分子之间互相纠缠结合在一起,从而变得不容易吸附在基体表面[18],吸附量远不如CO2环境。
2.4 8×10-5缓蚀剂下不同腐蚀时间的EIS结果为了研究清楚含氧环境下缓蚀剂在钢表面的有效作用时间变化,进行了不同腐蚀时间下EIS连续监测。图 7为60℃条件下,分别在纯CO2和O2/CO2条件下连续测试30h所得的交流阻抗谱。
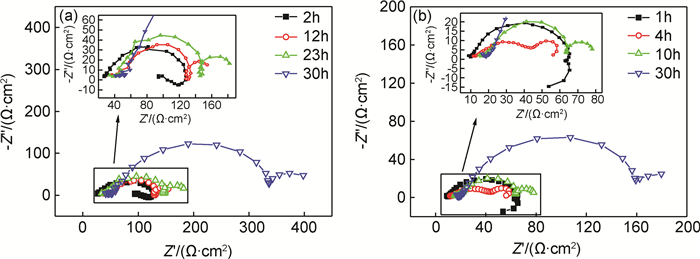
|
图 7 不同时间下的EIS结果 (a)CO2环境;(b)O2/CO2环境 Fig. 7 EIS results obtained at various time (a)CO2 environment; (b)O2/CO2 environment |
由图 7(a)知,纯CO2环境下,2h之内阻抗谱由一个高频容抗弧和一个低频感抗弧组成,其中低频感抗弧的出现与缓蚀剂分子在试样表面的吸附过程有关。2h之后,随着腐蚀过程的不断进行,腐蚀产物FeCO3不断在试样表面沉积,使得裸露在外面的Fe面积越来越小,缓蚀剂的吸附区域越来越小,导致阻抗谱中感抗弧不断萎缩,并且出现了第二个容抗弧。随后,高频容抗弧逐渐变大,感抗弧消失,阻抗谱最终由双容抗弧组成,说明产物膜在不断增厚变致密。
由图 7(b)知,O2/CO2环境下,1h之内阻抗谱由一个高频容抗弧和一个低频感抗弧组成,其中低频感抗弧的出现与缓蚀剂分子在试样表面的吸附过程有关。由于O2的存在,氧原子在钢表面吸附,导致缓蚀剂分子吸附能力减弱,缓蚀剂对试样的保护作用减弱。同时,一定浓度的O2具有加速腐蚀的作用。因此,试样的腐蚀速率及腐蚀产物的沉积速率也要远快于纯CO2环境下,所以阻抗谱在4h的时候,低频感抗弧就已经消失,观察不到缓蚀剂的吸附过程了,并且阻抗谱变为由双容抗弧组成,表明形成了腐蚀产物膜。而缓蚀剂分子在腐蚀产物膜上的吸附能力要远小于在金属清洁表面上的吸附能力[19],特别是含N大分子缓蚀剂,一方面无法很好的吸附在腐蚀产物上,另一方面很难进入腐蚀产物膜的微孔,并吸附在基体的活性位置上[20],造成缓蚀剂的保护效果减弱,进而缩短了缓蚀剂的有效作用时间。
对比两种条件下的阻抗弧大小,在整个测试过程中,含氧条件下的阻抗弧始终比纯CO2条件下的小,说明含氧条件下腐蚀速度快,腐蚀反应阻力小,形成的缓蚀剂吸附层及腐蚀产物层无法起到像无氧条件下那样很好的保护作用。直到30h,两种条件下的阻抗谱形状基本一致,但是纯CO2环境下的阻抗弧要远比O2/CO2环境下的大,表明含氧条件下最终形成的腐蚀产物膜致密性差,阻碍继续腐蚀的能力弱,无法起到良好的保护作用。
利用XRD及扫描电镜对O2/CO2环境中腐蚀产物膜的成分及微观形貌进行了分析。图 8为O2/CO2环境中,经30h浸泡之后试样表面腐蚀产物的XRD图谱,经分析知,O2/CO2环境中的腐蚀产物主要由Fe2O3及FeO(OH)组成,同时含有少量的FeCO3。图 9(a)为产物膜的截面形貌。由图 9(a)可知,腐蚀产物膜分为两层,其中外层疏松多孔,内层则较为致密,但在基体中可见明显的点蚀坑,证明O2/CO2环境下形成的腐蚀产物膜确实不具备很好的保护作用。图 9(b)为外层腐蚀产物膜的微观形貌,EDS能谱分析表明其原子数之比Fe:O约为2:3,结合XRD分析结果,可知此种条件下形成的外层腐蚀产物膜为疏松多孔的Fe2O3,对基体的保护作用确实比较弱。图 9(c)为外层腐蚀产物膜部分脱落后,内层坑状部位腐蚀产物的形貌图,图中方块状物质的EDS能谱分析表明其原子数之比Fe:O约为1:2,结合XRD分析结果,可知其主要为FeO(OH)。
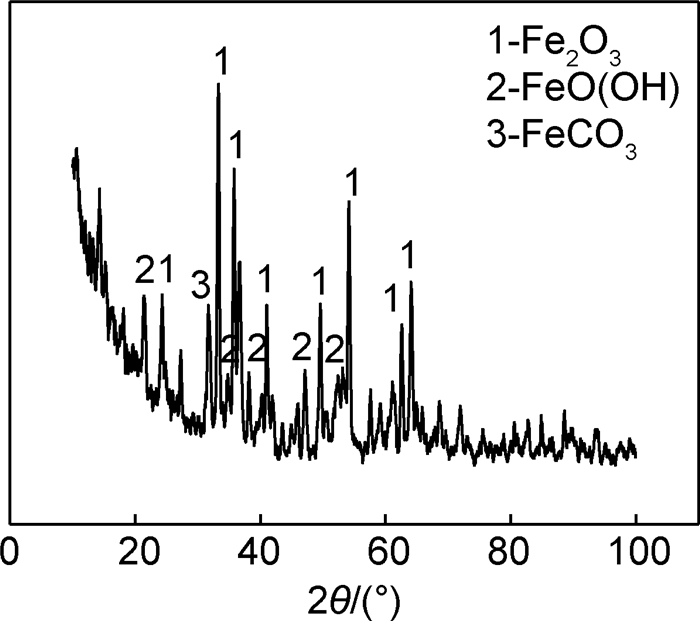
|
图 8 O2/CO2环境下腐蚀产物膜XRD谱 Fig. 8 XRD spectrum of the corrosion product film in O2/CO2 environment |

|
图 9 O2/CO2环境下腐蚀产物膜微观形貌图 (a)截面形貌;(b)外层膜;(c)内层膜 Fig. 9 Micro morphologies of corrosion product film in O2/CO2 environment (a)cross-section morphology; (b)outer layer; (c)inner layer |
(1) 缓蚀剂A对于碳钢的CO2腐蚀具有良好的缓蚀作用,其缓蚀效率在8×10-5浓度下可以达到98.3%,但是加入O2后会明显降低其缓蚀效率,缓蚀效率在8×10-5浓度下也仅有80.3%。
(2) O2的混入,会使缓蚀剂更倾向于缓蚀剂分子与缓蚀剂分子之间的结合,而其吸附在碳钢表面的能力则大幅度减弱,导致无法形成完整的缓蚀剂吸附膜,使得缓蚀剂屏蔽腐蚀介质的作用减弱,缓蚀效果变差。
(3) O2的混入,使得碳钢腐蚀速率变大,碳钢表面腐蚀产物膜生成速度变快,导致缓蚀剂的有效作用时间变短,生成的腐蚀产物主要由Fe2O3及FeO(OH)组成,且腐蚀产物膜疏松多孔,无法像纯CO2环境下的产物膜一样对基体起到很好的保护作用,同时会导致明显的点蚀出现。
| [1] | WANG S. Effect of oxygen on CO2 corrosion of mild steel[D]. Ohio: Ohio University, 2009. |
| [2] | AL-SHAMARI A R, KUMAR G S, GUPTA A, et al. Choking of oxygen scavenger injection quills[C]//Corrosion 2014. Texas: NACE International, 2014:3837. |
| [3] | WANG H, WYLDE J J. Corrosion inhibitor development for a slightly sour environment with an oxygen intrusion issue[J]. Journal of Materials Science and Engineering, 2011, 5 (1): 41–55. |
| [4] | MARTIN R L. Corrosion consequences of oxygen entry into oilfield brines[C]//Corrosion 2002. Houston: NACE International, 2002: 02270. |
| [5] | NOR R R, YOON-SEAK C, DAVID Y.Impact of oxygen ingress in CO2 corrosion of mild steel[C]//Corrosion 2014. Texas: NACE International, 2014:4299. |
| [6] | LERBSCHER J, WAMBURI W, BOJES J. Galvanic probes: a versatile Monitoring technique to detect oxygen ingress PH excursions and other events in laboratory studies[C]//Corrosion 2012. Utah: NACE International, 2012:1198. |
| [7] | 李天成. 榆济天然气管道内腐蚀原因[J]. 腐蚀与防护, 2014, 35 (3): 282–285. LI T C. Internal corrosion causes of Yu-Ji natural gas transmission pipeline[J]. Corrosion and Protection, 2014, 35 (3): 282–285. |
| [8] | GULBRANDSEN E, KVAREKVAL J, MILAND H. Effect of oxygen contamination on the inhibition of CO2 corrosion[C]//Corrosion 2001. Houston: NACE International, 2001: 01054. |
| [9] | 张天胜, 张浩, 高红. 缓蚀剂[M]. 北京: 化学工业出版社, 2008. ZHANG T S, ZHANG H, GAO H. Inhibitor[M]. Beijing: Chemical Industry Press, 2008. |
| [10] | 王佳, 曹楚南, 陈家坚, 等. 缓蚀剂阳极脱附现象的研究-缓蚀剂阳极脱附现象[J]. 中国腐蚀与防护学报, 1995, 15 (4): 241–245. WANG J, CAO C N, CHEN J J, et al. Anodic desorption of inhibitors—The phenomenon of anodic desorption of inhibitors[J]. Journal of Chinese Society for Corrosion and Protection, 1995, 15 (4): 241–245. |
| [11] | GALVAN-MARTINEZ R, OROZCO-CRUZ R, TORRES-SANCHEZ R, et al. Corrosion study of the X52 steel immersed in seawater with a corrosion inhibitor using a rotating cylinder electrode[J]. Materials and Corrosion, 2010, 61 (10): 872–876. DOI: 10.1002/maco.v61:10 |
| [12] | 曹楚南. 腐蚀电化学原理[M]. 北京: 化学工业出版社, 2008: 208. CAO C N. Electrochemical Corrosion Theory[M]. Beijing: Chemistry Industry Press, 2008: 208. |
| [13] | KERN P, LANDOLT D. Adsorption of a bromine labeled carboxylic acid corrosion inhibitor on iron measured with EQCM, EIS and XPS[J]. Corrosion Science, 2002, 44 (8): 1809–1824. DOI: 10.1016/S0010-938X(01)00156-1 |
| [14] | 何余生, 李忠, 奚红霞, 等. 气固吸附等温线的研究进展[J]. 离子交换与吸附, 2004, 20 (4): 376–384. HE Y S, LI Z, XI H X, et al. Research progress of gas-solid adsorption isotherms[J]. Ion Exchange and Adsorption, 2004, 20 (4): 376–384. |
| [15] | 近藤精一, 石川达一, 安部郁夫. 吸附科学[M]. 李国希, 译. 北京: 化学工业出版社, 2006. 135-137. SEIICHI K, ISHIKAWA, IKUO A. Adsorption Science[M]. LI G X, Trans.Beijing:Chemical Industry Press, 2006.135-137. |
| [16] | SAMUELSSON J, UNDIN T, FORNSTEDT T J. Expanding the elution by characteristic point method for determination of various types of adsorption isotherms[J]. Journal of Chromatography A, 2011, 1218 (24): 3737–3742. DOI: 10.1016/j.chroma.2011.04.035 |
| [17] | CHAKRABORTY A, SUN B. An adsorption isotherm equation for multi-types adsorption with thermodynamic correctness[J]. Applied Thermal Engineering, 2014, 72 (2): 190–199. DOI: 10.1016/j.applthermaleng.2014.04.024 |
| [18] | 李狄. 电化学原理[M]. 北京: 北京航空航天大学出版社, 1999: 128-129. LI D. Electro Chemical Principle[M]. Beijing: Beijing University of Aeronautics and Astronautics Press, 1999: 128-129. |
| [19] | 李爱魁, 李国敏, 郭兴蓬. 缓蚀剂在N80钢上吸附行为研究[J]. 电化学, 2003, 9 (3): 314–319. LI A K, LI G M, GUO X P. Study on adsorption behavior of inhibitors on N80 steel[J]. Electro Chemistry, 2003, 9 (3): 314–319. |
| [20] | 李爱魁, 李国敏, 郭兴蓬. 低铬钢上缓蚀剂的缓蚀行为及其与腐蚀产物膜的协同作用[J]. 材料保护, 2003, 36 (5): 11–13. LI A K, LI G M, GUO X P. Inhibition behavior and synergistic effect of inhibitor with corrosion product scale on low Cr steel in CO2-saturated solution[J]. Materials Protection, 2003, 36 (5): 11–13. |
 2017, Vol. 45
2017, Vol. 45


