文章信息
- 周和荣, 姚望, 宋述鹏, 吴润
- ZHOU He-rong, YAO Wang, SONG Shu-peng, WU Run
- 羟烷基酰胺固化聚酯粉末涂层在海洋环境中的腐蚀行为
- Corrosion Behavior of Primid Solidified Polyester Powder Coating in Marine Environment
- 材料工程, 2017, 45(4): 90-95
- Journal of Materials Engineering, 2017, 45(4): 90-95.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2016.000559
-
文章历史
- 收稿日期: 2016-05-10
- 修订日期: 2016-12-15
羟烷基酰胺固化聚酯粉末涂料是一种环保、利用率高的固态涂料,广泛应用于汽车、家电、建筑等行业,是我国粉末涂料行业未来重要的发展趋势之一。金属材料经过前处理后表面喷涂聚酯粉末涂料,然后经过熔融和固化后形成粉末涂层,粉末涂层和金属之间附着力良好,是目前常用的防腐蚀方法之一[1, 2]。羟烷基酰胺固化聚酯粉末涂层/金属体系是一个复杂的物理、化学体系,但是聚酯粉末涂层属于有机涂层,本身含有许多缺陷如空隙等,聚酯粉末涂层的高分子结构在服役过程中容易老化,且在水、腐蚀性离子和空气作用下涂层与基底金属结合力减弱,导致粉末涂层对金属材料的防腐蚀效果下降或丧失[1, 2]。有机涂层下金属电化学腐蚀过程如下:水、腐蚀性介质和氧在涂层中扩散,水和离子通过涂层和涂层缺陷处到达界面,离子或水与金属基材发生腐蚀反应。其中,水、腐蚀性介质和氧在涂层中的扩散是腐蚀过程发生的前提条件,直接导致涂层/金属体系的失效,一方面引起涂层的宏观破坏,如粉化、开裂等导致涂层丧失保护性能;另一方面虽未发生上述宏观破坏,但腐蚀介质渗入到涂层,在涂层与金属界面发生膜下金属的腐蚀,使涂层发生凸起、起泡等现象[3-8]。
研究涂层体系腐蚀过程和腐蚀行为的方法较多,目前主要采用浸泡实验、中性盐雾实验、CASS实验、交流阻抗和扫描电化学等方法[9-24]。如Li等[10]采用AFM和EIS研究了溶剂型醇酸涂料的腐蚀行为。Fedrizzi等[15]采用盐雾实验和EIS研究了金属基材表面沉积ZrO2后涂层体系的防护性能,并与磷化处理进行比较。Reddy等[25]采用扫描开尔文研究了涂层的破损行为。上述实验方法主要是针对溶剂型涂料涂层下的腐蚀行为进行研究,目前国内针对粉末涂层下金属腐蚀行为的研究工作较少,且羟烷基酰胺固化聚酯粉末涂料是环保粉末涂料的主要发展方向,其服役环境中海洋大气环境是主要环境因素之一,研究海洋大气环境对涂层及涂层下金属的腐蚀行为和腐蚀过程,探讨其腐蚀机制,有利于羟烷基酰胺固化聚酯粉末涂料在海洋大气环境中的服役。本工作采用CASS实验、浸泡实验、交流阻抗和扫描开尔文等方法研究常用羟烷基酰胺固化聚酯粉末涂层及涂层下铝合金在模拟海洋大气环境中的腐蚀行为和腐蚀过程。
1 实验方法试样基材为6063铝合金,规格为150 mm×75 mm×1 mm。涂料为羧基饱和聚酯采用羟烷基酰胺固化形成的粉末涂料。6063铝合金试片前处理采用铬酸钝化,然后采用静电喷涂粉末涂料并固化涂层,涂层厚度为60~80μm。试样制备好后放置于干燥器中保存备用。
CASS实验参照标准GB/T 10125—2012《人造气氛腐蚀试验—盐雾试验》中铜加速乙酸盐雾实验 (CASS实验) 方法执行,溶液为50 g/L NaCl+0.205 g/L CuCl2水溶液,溶液用去离子水和分析纯试剂配置,25 ℃时pH值控制为3.0~3.1。实验前,依据ASTM D1654标准在试样表面中部划“X”字形划痕,划痕长度约为4~6 cm,尽量保证划痕宽度一致,测量和记录划痕的宽度和长度。CASS实验时间为240 h,每天检查一次,并定期采用数码相机拍摄试样表面形貌,拍照时间为0,24,48,96,168,240 h。实验结束后仔细检查试样,观察试样表面的变化,重点是划痕腐蚀、隆起和剥落等缺陷。
涂层浸泡实验采用上述划“X”字形划痕,溶液为0.6 mol/L NaCl,温度为室温,浸泡时间为360 h;取样周期分别为24,120,240,360h,每次取平行试样2片,一片用于观察腐蚀形貌,一片备用。同时连续测试浸泡试样的电化学交流阻抗谱和划痕附近的表面电位变化。电化学交流阻抗采用三电极体系测试,工作电极为研究材料,辅助电极为Pt电极,参比电极为饱和甘汞电极 (SCE);测量仪器为273A电化学工作站,测试频率范围为100 kHz~0.1 Hz,扫频方向为从高频到低频,阻抗测量信号幅值为20 mV,实验温度为 (25±4) ℃。表面电位测试采用SKP370开尔文扫描振动探针系统,测试时间分别为24,48,96,168,240,360 h,实验结束后,用光学金相显微镜和扫描电子显微镜观察分析样品表面腐蚀产物形貌及表面形态的变化情况。
2 结果及讨论 2.1 盐雾实验腐蚀形貌观察图 1为羧基饱和聚酯涂层试片经过不同时间CASS实验后划痕处腐蚀形貌。图中显示划痕处腐蚀产物随盐雾时间的延长不断增多,24 h时划痕内有少量白色腐蚀产物,96 h划痕处腐蚀产物增多,划痕边沿有轻微翘起, 168 h划痕内已经堆满灰白色腐蚀产物,240 h划痕内沉积较多腐蚀产物,边沿有少量起泡,最大单边腐蚀宽度小于0.5 mm,非划痕区域无缺陷。粉末涂层经240 h CASS实验后表面附着力为0级,漆膜硬度无变化,但涂层光泽和色差发生了变化。从腐蚀形貌显示涂层试片耐蚀性能良好。

|
图 1 缺陷粉末涂层划痕处盐雾实验不同时间的宏观形貌 (a) 24 h; (b) 96 h; (c) 168 h; (d) 240 h Fig. 1 Morphologies of defect powder coating immersed for different time (a) 24 h; (b) 96 h; (c) 168 h; (d) 240 h |
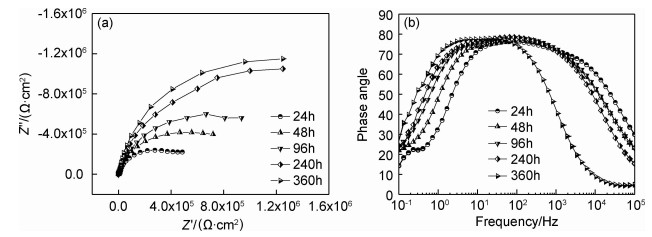
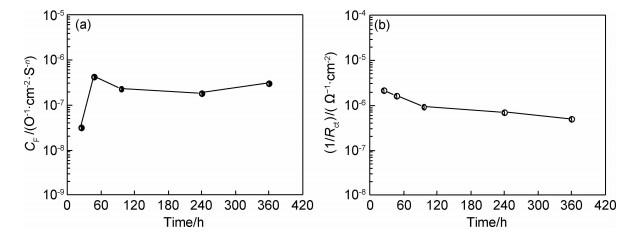
划痕粉末涂层在0.6 mol/L NaCl溶液中的交流阻抗图谱如图 2所示。其Niquist曲线包含2个容抗弧,其阻抗值随浸泡时间的延长不断增大,依据粉末涂层划痕结构提出等效电路模型 (如图 3所示)。依据等效电路模型拟合数据结果见图 4,拟合结果显示双电层电容数值在浸泡初期先增大,然后逐渐趋于稳定;双电层电阻值则随浸泡时间的延长不断增加,浸泡后期阻抗趋于稳定,显示涂层下铝合金腐蚀速率随浸泡时间延长不断减小,腐蚀趋势逐渐减弱,说明铝合金经过铬酸钝化后形成的钝化膜延缓了腐蚀,降低了铝合金的腐蚀速率,具有较好的耐蚀性能。
|
图 2 缺陷粉末涂层浸泡不同时间的EIS图谱 (a) Niquist; (b) bode Fig. 2 EIS of defect powder coating immersed for different time (a) Niquist; (b) bode |

|
图 3 缺陷粉末涂层表面等效电路模型 Fig. 3 Equivalent circuit model for EIS of defect powder coating |
|
图 4 缺陷粉末涂层界面双电层拟合参数 (a) 电容; (b) 腐蚀速率 (1/Rct) Fig. 4 Fitting parameter of defect powder coating for double layer (a) capacitance; (b) corrosion rate (1/Rct) |
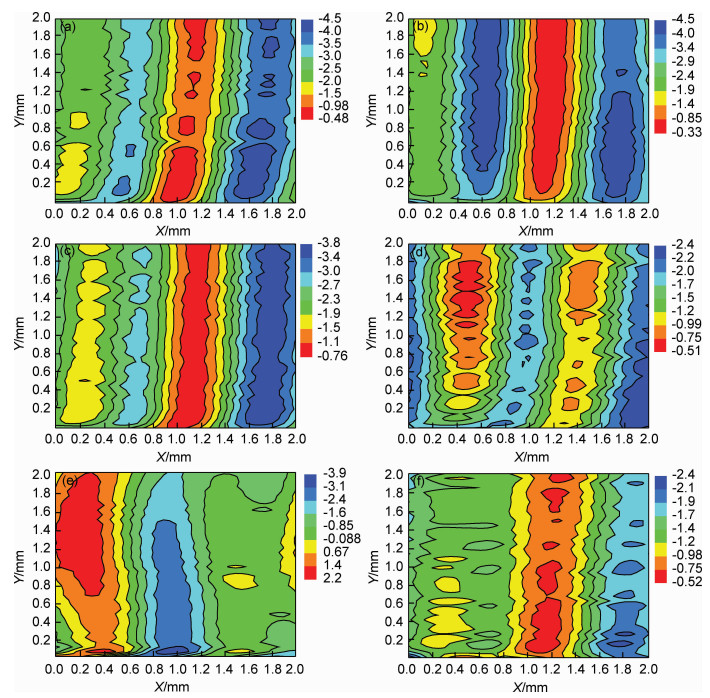
图 5为羧基饱和聚酯涂层划痕处在3.5% (质量分数,下同) NaCl溶液中浸泡不同时间后的电位分布图。浸泡24 h时,划痕处的电位较正 (-1.5~-0.48 V),划痕两侧涂层膜下的电位由高向低逐渐下降,测试区域最右侧的涂层膜下出现电位较负的阳极区 (-4.5~-3.5 V),与划痕处电位呈现较大的电位梯度;划痕左侧的涂层膜下出现电位不同的阳极区域,与中心缺陷处的电位梯度较小,整个测试区域电位呈条带分布。这与预期的结果相反,缺陷处并不是阳极区,相对于邻近涂层膜下电位更正,是阴极区。浸泡48 h后,划痕处电位变为-1.4~-0.33 V,呈增大趋势;缺陷左侧涂层膜下的电位由-3.5~-2.5 V变负为-4.5~-3.4 V,与划痕处的电位梯度增大;划痕右侧涂层膜下的电位保持不变。浸泡96 h时,划痕处电位变为-1.5~-0.76 V;划痕两侧涂层膜下的电位变正,最右侧变为-3.8~-3.0 V,左侧电位也增加。依据文献[14]的解释,溶液介质向涂层左侧渗透并引起涂层与基材的结合力下降,阴极区扩展并出现新的阳极区。浸泡168 h以后 (图 5 (e),(f)),划痕处电位变为-1.2~-0.75 V;划痕两侧涂层膜下电位进一步变正,最右侧的电位变为-2.4~-2.0 V;左侧的电位也增加,并出现典型阴极条带,电位为-0.99~-0.51 V,且该阴极带左边出现蓝色的阳极条带。浸泡240 h以后 (图 5 (d)),划痕处电位变为-0.98~-0.52 V,划痕最右侧电位变为-2.4~-2.0 V,左侧相同电位区域面积增加,电位为-1.9~-0.98 V。
|
图 5 粉末涂层缺陷处在3.5% NaCl溶液中的SKP图谱 (a) 24 h; (b) 48 h; (c) 96 h; (d) 168 h; (e) 240 h; (f) 360 h Fig. 5 SKP maps of powder coating defects in 3.5% NaCl solution (a) 24 h; (b) 48 h; (c) 96 h; (d) 168 h; (e) 240 h; (f) 360 h |
图 6为粉末涂层划痕处经过360 h浸泡后的微观形貌,划痕缝隙填充了部分絮状腐蚀产物,划痕边沿涂层形貌发生变化,涂层光泽下降,边缘局部有金属腐蚀产物覆盖在涂层表面,显示涂层与基材的结合力下降;完整涂层表面有零星腐蚀产物,局部有轻微缺陷。

|
图 6 粉末涂层在溶液中浸泡360 h后划痕处形貌 Fig. 6 Morphology of the powder coating in the solution after 360h immersion |
羟烷基酰胺固化形成的聚酯粉末涂层作为一种典型的高聚物薄膜涂层,能不同程度地阻缓H2O,O2和离子的渗透,H2O,O2和离子通过涂层宏观或微观缺陷渗透到涂层/金属界面后,形成腐蚀性介质,涂层/金属界面的不均匀性使阳极区和阴极区得以形成,从而发生电化学腐蚀,基体为铝合金时的电化学反应为[16]:

|
(1) |
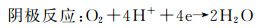
|
(2) |
聚酯粉末涂层划痕处腐蚀是由于水及腐蚀性离子通过人工缺陷直接到达金属表面。在浸泡初期,裸露的铝合金为阳极,划痕附近完整涂层为阴极,电化学反应的动力是划痕处和距划痕一定距离完整涂层膜下存在的高电位差;划痕处铝合金在腐蚀介质的浸泡下直接发生溶解,铝被氧化为Al3+,电子传递到邻近的完整涂层界面处,同时氧分子和水还可通过涂层的微孔到达完整涂层界面,氧分子还原的吸氧反应产生碱性物质 (或酸性环境中形成水),碱性物质的产生趋向于抑制此处产生阳极溶解,水的产生趋向于促进此处产生阳极溶解,但都使得金属与涂层之间的附着力下降,导致缺陷周围涂层脱粘;还有可能产生渗透压导致水的集聚形成涂层起泡。一旦金属表面开始阳极溶解,涂层下阴极区的氧分子发生还原反应并会维持阳极反应的进行[23]。Leng等[24, 26]认为吸氧反应形成的氧化性产物而非碱性物质攻击涂层是导致涂层与基体界面剥离的原因,并证明在氧化还原反应中形成的中间活泼产物对界面的氧化层的破坏具有主要作用[2]。
随着浸泡时间的延长,涂层下金属由于水和腐蚀介质的浸入开始发生溶解,溶液介质渗透处发生金属的溶解最迅速,其腐蚀电位降低,成为新的阳极;而涂层划痕处由于腐蚀产物的沉积以及溶解速度的变慢导致腐蚀电位升高,成为阴极 (图 5 (a))。随着浸泡时间的不断增加,腐蚀介质堆积在划痕处以及涂层下形成的腐蚀产物,导致划痕边沿涂层翘起,涂层和基体结合力逐渐减弱 (图 5 (b), (c))。随着水和腐蚀介质不断向涂层下金属扩散,在翘起涂层附近形成新的阳极,而涂层翘起位置由原来的阳极转变为阴极 (图 5 (d), (e))。粉末涂层下金属的腐蚀扩展过程如上所述,不断沿划痕涂层两侧扩散。Reddy等[25]研究了含颜料的环氧涂层钢板在3% NaCl溶液中浸泡两天后的结果,缺陷处相对于周围的涂层电位较正为阴极,最大阳极电流出现在邻近缺陷的膜下位置。Doherty等[7]采用SKP方法研究了涂有环氧石碳酸漆膜的镀铬低碳钢板经0.17 mol/L NaCl溶液浸泡48 h后的腐蚀行为,SKP分析显示缺陷处仅在40~180 min保持为阳极,180 min后最初作为阳极的缺陷中心采用SKP无法探测到,52h后缺陷处转变为较弱的阴极区,94h变为很强的阴极区。Grundmeier等[2]采用SKP技术研究带有人工缺陷的涂层在氧存在的情况下界面处电位分布情况,结果表明紧靠缺陷处的电位很负,而远离缺陷处的完整涂层具有高的电位。本论文结果与上述文献类似。对于大部分涂层,距离缺陷一定距离的位置电极电位出现急剧变化,因此存在高电位差区域意味着涂层与界面剥离的前沿。Leng指出电极电位突然变化的物理根源是由于离子由缺陷处向界面的迁移导致了极化的界面变化[24, 26],阴极区向外扩展出现新的阳极区;另外随浸泡时间的延长,氧、水分子可通过完整涂层中的微孔或伴随腐蚀性离子通过缺陷处的界面向膜下扩散,这种离子由缺陷处向界面的迁移产生了电极电位的显著变化;电位梯度显著变化的部位意味着腐蚀区域的前沿,即在此处涂层与界面上又产生阳极攻击和腐蚀产物而降低涂层与基体之间的附着力,产生新的阴极和阳极。这些过程循环进行,涂层逐渐失效,新的阴极区的形成也表明此处涂层附着力的损失。因此随浸泡时间的延长,SKP显示缺陷附近的涂层膜下新阳极区形成并扩大,又逐渐变为阴极区,腐蚀向膜下扩展。由于涂层不透明,但划痕缺陷下有较多腐蚀产物沉积 (图 1和图 6),可以间接印证结果。
3 结论(1) 羟烷基酰胺固化聚酯粉末涂层经240 h CASS实验后划痕边沿有少量起泡,最大单边腐蚀宽度小于0.5 mm,表面附着力为0级,表面光泽和色差发生了变化,漆膜硬度无变化。
(2) 划痕涂层在0.6 mol/L NaCl溶液中EIS图谱显示浸泡360 h涂层下铝合金腐蚀速率随浸泡时间延长不断降低并逐渐趋于稳定。
(3) 扫描开尔文图谱显示聚酯粉末涂层下金属的腐蚀沿划痕处向涂层两侧不断扩散,其阳极和阴极交替变化,导致涂层下腐蚀面积扩大,划痕边沿凸起。
| [1] | LEENA K P, JAMES W M, ROBERT O W. Electrostatic powder coating: principles and pharmaceutical applications[J]. International Journal of Pharmaceutics, 2016, 505 (1-2): 289–302. DOI: 10.1016/j.ijpharm.2016.04.016 |
| [2] | GRUNDMEIER G, SCHMIDT W, STRATMANN M. Corrosion protection by organic coatings: electrochemical mechanism and novel methods of investigation[J]. Electrochimica Acta, 2000, 45 (15-16): 2515–2533. DOI: 10.1016/S0013-4686(00)00348-0 |
| [3] | POSNER R, WAPNER K, STRATMANN M, et al. Transport processes of hydrated ions at polymer/oxide/metal interfaces Part 1. Transport at interfaces of polymer coated oxide covered iron and zinc substrates[J]. Electrochimica Acta, 2009, 54 : 891–899. DOI: 10.1016/j.electacta.2008.06.074 |
| [4] | POSNER R, TITZ T, WAPNER K, et al. Transport processes of hydrated ions at polymer/oxide/metal interfaces Part 2. Transport on oxide covered iron and zinc surfaces[J]. Electrochimica Acta, 2009, 54 : 900–908. DOI: 10.1016/j.electacta.2008.07.011 |
| [5] | MORCILLO M, RODRIGUEZ F J, BASTIDAS J M. The influence of chlorides, sulphates and nitrates at the coating-steel interface on underfilm corrosion[J]. Progress in Organic Coatings, 1997, 31 (3): 245–353. DOI: 10.1016/S0300-9440(97)00083-0 |
| [6] | WAPNER K, STRATMANN M, GRUNDMEIER G. Structure and stability of adhesion promoting aminopropyl phosphonate layers at polymer/aluminium oxide interfaces[J]. International Journal of Adhesion & Adhesives, 2007, 28 (1): 59–70. |
| [7] | DOHERTY M, SYKES J M. Micro-cells beneath organic lacquers: a study using scanning kelvin probe and scanning acoustic microscopy[J]. Corrosion Science, 2004, 46 (5): 1265–1289. DOI: 10.1016/j.corsci.2003.09.016 |
| [8] | 胡吉明, 张鉴清, 谢德明. 水在有机涂层中的传输Ⅰ:Fick扩散过程[J]. 中国腐蚀与防护学报, 2002, 22 (5): 311–316. HU J M, ZHANG J Q, XIE D M. Water transport in organic coatingⅠ: Fickian diffusion[J]. Journal of Chinese Society for Corrosion and Protection, 2002, 22 (5): 311–316. |
| [9] | BASTIDAS J M, MORCILLO M, RODRIGUEZ F J. Mild steel corrosion in saline solutions: comparison between bulk solutions and steel-coating interfacial solutions[J]. Journal of Coatings Techno1ogy, 1998, 70 (882): 61–66. |
| [10] | LI J, ECCO L, FEDEL M, et al. In-situ AFM and EIS study of a solventborne alkyd coating with nanoclay for corrosion protection of carbon steel[J]. Progress in Organic Coatings, 2015, 87 : 179–188. DOI: 10.1016/j.porgcoat.2015.06.003 |
| [11] | FURBETH W, STRATMANN M. The delamination of polymeric coatings from electrogalvanised steel—a mechanistic approach[J]. Corrosion Science, 2001, 43 : 207–243. DOI: 10.1016/S0010-938X(00)00047-0 |
| [12] | SCHMIDT W, STRATMANN M. Scanning Kelvin probe investigations of filiform corrosion on aluminum alloy 2024-t3[J]. Corrosion Science, 1998, 40 (8): 1441–1447. DOI: 10.1016/S0010-938X(98)00044-4 |
| [13] | DEFLORIAN F, ROSSI S, FEDEL M, et al. Study of the effect of corrosion inhibitors on powder coatings applied on steel[J]. Progress in Organic Coatings, 2014, 77 (12): 2133–2139. DOI: 10.1016/j.porgcoat.2014.03.014 |
| [14] | DONG C F, FU A Q, LI X G, et al. Localized EIS characterization of corrosion of steel at coating defect under cathodic protection[J]. Electrochimica Acta, 2008, 54 (2): 628–633. DOI: 10.1016/j.electacta.2008.07.016 |
| [15] | FEDRIZZI L, RODRIGUEZ F J, ROSSI S, et al. The use of electrochemical techniques to study the corrosion behavior of organic coatings on steel pretreated with sol-gel zirconia films[J]. Electrochimica Acta, 2001, 46 (24): 3715–3724. |
| [16] | GRAEDEL T E. Corrosion mechanisms for aluminum exposed to the heat atmosphere[J]. Journal of the Electrochemical Society, 1989, 136 (4): 204–212. DOI: 10.1149/1.2096869 |
| [17] | OH S J, COOK D C, TOWNSEND H E. Atmospheric corrosion of different steels in marine, rural and industrial environments[J]. Corrosion Science, 1999, 41 (9): 1687–1702. DOI: 10.1016/S0010-938X(99)00005-0 |
| [18] | WAPNER K, STRATMANN M, GRUNDMEIER G. In situ infrared spectroscopic and scanning kelvin probe measurements of water and ion transport at polymer/metal interfaces[J]. Electrochimica Acta, 2006, 51 (16): 3303–3315. DOI: 10.1016/j.electacta.2005.09.024 |
| [19] | LIU S, GU L, ZHAO H C, et al. Corrosion resistance of graphene-reinforced waterborne epoxy coatings[J]. Journal of Materials Science & Technology, 2016, 32 (5): 425–431. |
| [20] | WANG Z Y, MA T, HAN W, et al. Corrosion behavior on aluminum alloy LY 12 in simulated atmospheric corrosion process science[J]. Transactions of Nonferrous Metals Society of China, 2007, 17 (2): 326–334. DOI: 10.1016/S1003-6326(07)60093-4 |
| [21] | HUTTUNEN-SAARIVIRTA E, YUDIN V E, MYAGKOVA L A. Corrosion protection of galvanized steel by polyimide coatings: EIS and SEM investigations[J]. Progress in Organic Coatings, 2011, 72 (3): 269–278. DOI: 10.1016/j.porgcoat.2011.04.015 |
| [22] | MORCILLO M. Soluble salts: their effects on premature degradation of anticorrosive paints[J]. Progress in Organic Coatings, 1999, 36 (3): 137–147. DOI: 10.1016/S0300-9440(99)00036-3 |
| [23] | LENG A, STRECKELA H, STRATMANN M. The delamination of polymeric coatings from steel, PartⅠ:calibration of the Kelvin probe and basic delamination mechanism[J]. Corrosion Science, 1998, 41 (3): 547–578. DOI: 10.1016/S0010-938X(98)00166-8 |
| [24] | LENG A, STRECKELA H, STRATMANN M. The delamination of polymeric coatings from steel Part Ⅱ: first stage of delamination, effect of type and concentration of canons on delamination, chemical analysis of the interface[J]. Corrosion Science, 1998, 41 (3): 579–597. DOI: 10.1016/S0010-938X(98)00167-X |
| [25] | REDDY B, DOHERTY M J, SYKES J M. Breakdown of organic coatings in corrosive environments examined by scanning kelvin probe and scanning acoustic microscopy[J]. Electrochimica Acta, 2004, 49 (17-18): 2965–2972. DOI: 10.1016/j.electacta.2004.01.055 |
| [26] | LENG A, STRECKELA H, HOFMANN K, et al. The delamination of polymeric coatings from steel Part 3: effect of the oxygen partial pressure on the delamination reaction and current distribution at the metal/polymer interface[J]. Corrosion Science, 1998, 41 (3): 599–620. DOI: 10.1016/S0010-938X(98)00168-1 |
 2017, Vol. 45
2017, Vol. 45


