文章信息
- 余煜玺, 朱孟伟
- YU Yu-xi, ZHU Meng-wei
- 高球形度、高比表面积SiO2/TiO2气凝胶小球的制备和表征
- Preparation and Characterization of Highly Spherical Silica-titania Aerogel Beads with High Surface Area
- 材料工程, 2017, 45(2): 7-11
- Journal of Materials Engineering, 2017, 45(2): 7-11.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2015.000780
-
文章历史
- 收稿日期: 2015-06-17
- 修订日期: 2016-10-25
气凝胶是一种具有纳米多孔网络结构的材料,具有低密度(0.003g/cm3)、高比表面积(500~1200m2/g)、高孔隙率(80%~99.8%)、低介电常数(k = 1.0~2.0)、低热导率(0.005W·m-1·K-1)、低折射率(1.05)等物理特性[1],在保温绝热、防火阻燃、隔音、光学、电学等领域有着广泛的应用前景[2-4]。在实际的填充应用中,人们常将气凝胶制备成粉体或者小块体进行使用,但是气凝胶粉体存在流动性差,气凝胶小块体存在填充不均匀等问题,使得有必要寻求更好的填充方式来获得最佳的填充效果。球形气凝胶流动性好,填充到材料中时应力应变均匀,不易引起应力集中,可改善弹塑性变形能力及提高使用效率[5, 6],同时粒径可控的球形气凝胶可直接应用于特殊精密仪器或者再加工,大大提高了气凝胶的应用价值[7]。目前,制备气凝胶小球主要有两种方式,即球滴法[6]和模具法。在球滴法中,凝胶小球的转化以逐滴的方式进行,效率低,同时由于凝胶时间短,使用的氨水量高,制备出的凝胶小球的外表面容易缩聚为白色沉淀,引起品质下降,凝胶小球最终堆落在油相和氨水溶液之间,不方便取出,难以形成连续化生产[8-11]。在模具法中,微型模具的制造和设计费用昂贵、耗时长、产量低,且制备出的醇凝胶小球容易表面开裂,因此迫切需要一种快速高效的制备气凝胶小球的方法。
本工作以TEOS和TBT为共前驱体、EtOH为溶剂、HAC和NH3·H2O为催化剂,快速制备高质量、高球形度的SiO2/TiO2气凝胶小球。利用共水解醇盐以及快速溶胶-凝胶工艺,通过控制凝胶时间,使溶胶在油相中顺利转化成凝胶并形成小球,优化物料配比得到高比表面积的球形气凝胶,同时进一步研究样品的微观结构、化学组成及热稳定性。
1 实验材料与方法 1.1 SiO2/TiO2气凝胶小球的制备正硅酸乙酯(TEOS)、钛酸丁酯(TBT)、乙醇(EtOH)、乙酸(HAC)和氨水(NH3·H2O)均来自国药集团化学试剂有限公司,分析纯。实验用水为去离子水。
常温下,按摩尔比EtOH:H2O:HAC:TEOS:TBT= 50:8:1.2:4:1依次加入并快速混合均匀,搅拌10min,常温放置1h,即得到SiO2/TiO2复合溶胶。配置质量分数为0.6%的氨水溶液,使其与制备好的上述溶胶溶液均匀混合,凝胶时间为20s。通过蠕动泵将溶胶溶液和氨水溶液在静态混合器内充分混合,然后在挤压力的作用下经多孔喷头(内径d为0.41mm)流出,通过调节流速使小球在油相中部发生凝胶反应。使用筛网将油相分离掉,同时将获取的SiO2/TiO2醇凝胶小球放入乙醇中老化一段时间,每6h换一次乙醇,置换3次。
将清洗后的SiO2/TiO2醇凝胶小球放入高温高压釜中,冲扫氮气10min,并将釜内压强提高至1.0MPa。设置加热电压为150V,以1℃/min的速率升温至260℃,保温60min,此时高压釜压强为13MPa左右。然后以0.2MPa/min的速率进行卸压,卸压后冲扫氮气60min。自然冷却至50℃以下,即可得到SiO2/TiO2气凝胶小球。
1.2 表征测量小球横轴和纵轴的比值,取测量100次的平均值,得到小球圆度值;使用X射线衍射仪(XRD,X’pert PRO)分析气凝胶的结晶形态;使用场发射扫描电子显微镜(SEM,SU70)和高分辨透射电子显微镜(TEM,JEM-2100)观察气凝胶小球的微观形貌;使用全自动比表面及孔隙分析仪(BET&BJH,TristarⅡ3020)测试气凝胶小球的比表面积及孔径分布;使用傅里叶红外光谱仪(FT-IR,Avatar 360)测试分析气凝胶的化学键与官能团,波数范围为4000~400cm-1;在空气气氛条件下,使用热分析仪(TG-DTA,STA 409EP DSC 204C)分析气凝胶的热稳定性,测试温度从室温到1200℃,升温速率为10℃/min。
2 结果与分析 2.1 SiO2/TiO2气凝胶小球的形貌分析图 1为SiO2/TiO2醇凝胶小球和SiO2/TiO2气凝胶小球的光学实物图。可以看出,SiO2/TiO2醇凝胶小球并不像SiO2醇凝胶晶莹剔透,而是明显地呈现淡蓝色,这是由于TiO2具有的双折射性质,不同厚度的TiO2可以表现出不同的颜色,因而粒径约为4mm的SiO2/TiO2醇凝胶小球呈现出蓝色(图 1(a))。SiO2/TiO2气凝胶部分小球呈现淡黄色不透明状,具有很好的球形度且表面光滑(图 1(b))。

|
图 1 SiO2/TiO2醇凝胶小球(a)和SiO2/TiO2气凝胶小球(b)的光学实物图 Fig. 1 Images of silica-titania alcogel beads(a) and silica-titania aerogel beads(b) |
图 2为SiO2/TiO2气凝胶小球的微观形貌图。由2图(a)可看出,气凝胶小球内部存在大量的孔洞,具有典型的三维网络结构,同时表面存在部分大孔。由图 2(b)500℃热处理后的透射电镜图可看出,SiO2/TiO2气凝胶小球内部结构由孔洞、SiO2和TiO2粒子构成。TiO2颗粒较均匀地分布于气凝胶结构中,粒径约为4nm,同时少量存在TiO2粒子的团聚现象。

|
图 2 SiO2/TiO2气凝胶小球的SEM(a)和TEM图(b) Fig. 2 SEM image(a) and TEM image(b) of silica-titania aerogel beads |
图 3为SiO2/TiO2气凝胶小球的FT-IR谱图。 分析可知,在波长3643cm-1和1651cm-1附近出现Si-OH键的伸缩振动和弯曲振动[12],在波长1080cm-1和454cm-1附近出现的峰则是由 Si-O-Si的反对称伸缩振动和弯曲振动引起的[13]。对应微观形貌图可知,经过水解和缩聚反应,前驱体单体中的硅原子之间通过Si-O-Si键形成网络结构,构成基本骨架结构。在波长960cm-1附近对应Si-O-Ti振动峰[14],说明在共水解缩聚过程中,硅钛原子通过化学键得到结合,制备得到了复合体系。
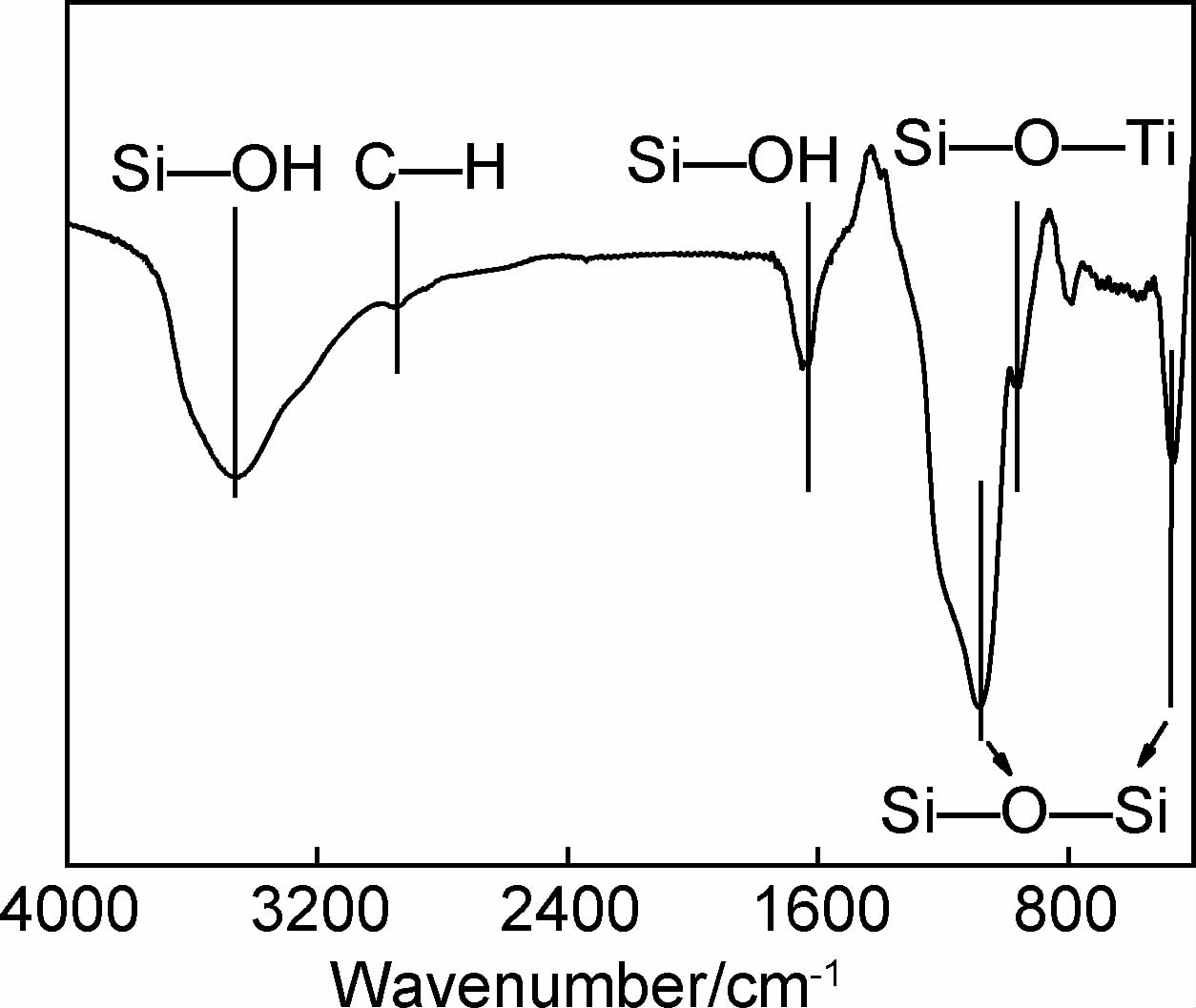
|
图 3 SiO2/TiO2气凝胶小球的FT-IR谱图 Fig. 3 FT-IR spectrum of silica-titania aerogel beads |
图 4为SiO2/TiO2气凝胶小球的氮气吸附-脱附等温曲线及孔径D分布图。由图 4(a)可知,等温曲线为Ⅰ型、Ⅱ型和Ⅳ型等温线的混合形式。在低 P/P0 区间,氮气在微孔处发生吸附,此阶段属于Ⅰ型;接着,在较高 P/P0 区间中孔处发生氮气吸附,此段等温线属于Ⅱ型;最后,在高P/P0区间发生毛细血管作用形成 H2 型回滞环,使吸附分支在 P/P0>0.8 时陡峭上升,此段等温线属于典型的Ⅳ型[15]。在发生毛细血管作用的开始阶段,吸附量V快速增加,同时也说明在超临界干燥后SiO2/TiO2气凝胶小球的孔洞保持完整[16]。由BET和BJH算法计算得到SiO2/TiO2气凝胶小球的比表面积和平均孔径分别为914.5m2/g和9.06nm,故可知 SiO2/TiO2气凝胶小球具有典型的气凝胶结构。从其孔径分布图还可看出,孔径大致分布在10~50nm之间。
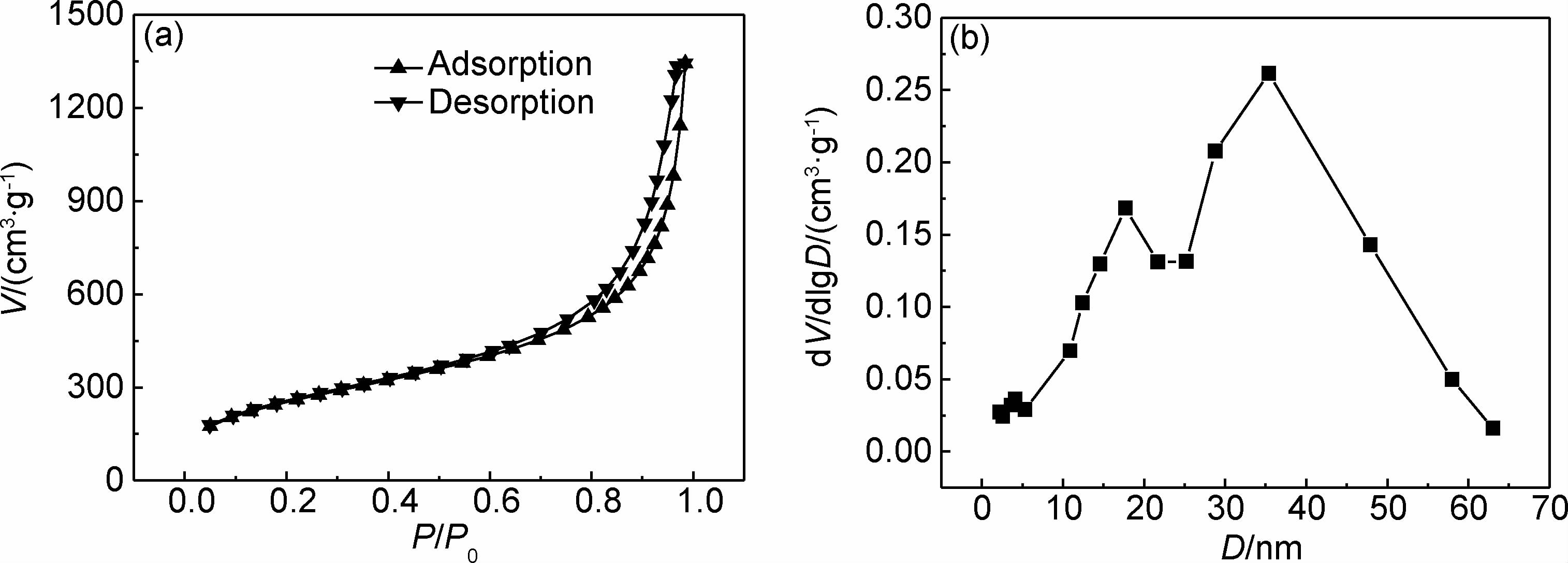
|
图 4 SiO2/TiO2气凝胶小球的氮气吸附-脱附曲线(a)和孔径分布图(b) Fig. 4 Nitrogen adsorption-desorption isotherms(a) and pore diameter distribution(b) of silica-titania aerogel beads |
本实验以豆油作为固定相、溶胶作为流动相,利用两相密度差及不相容性原理,溶胶在挤压力作用下注入到油相中并上升,上升过程中经凝胶反应及表面张力的作用形成小球。通过调节溶胶的凝胶时间使溶胶在豆油的中部位置完成溶胶-凝胶的转变。在溶胶向醇凝胶转变的过程中,固定凝胶时间为20s,则转变的位置可由流速来调节。由于溶胶向醇凝胶小球的转变过程在很短的时间内完成,故尽量保持溶胶溶液和氨水溶液体积进料,防止两者混合不均匀而发生凝胶堵塞。溶胶发生凝胶转变的位置可由公式(1)有效控制。
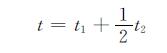
|
(1) |
式中:t为凝胶时间;t1为溶胶溶液和氨水溶液混合后到流出喷头之前的时间;t2为溶胶在油相中的上升时间。
随机选取部分制备得到的SiO2/TiO2气凝胶小球样品(123.5g),利用球体的流动性进行分筛,统计得到: 97.6%(质量分数,下同) 的原材料可以制备成SiO2/TiO2气凝胶小球(圆度值≤2),其中83.5%的原材料可以成功制备成高球形度的SiO2/TiO2气凝胶小球(圆度值≤1.2)。SiO2/TiO2气凝胶小球的粒径分布情况如表 1所示。可知,气凝胶小球粒径分布在1~8mm,平均粒径为3.5mm左右,其中55.5% 的小球粒径在3.35~4.75mm。这是因为:溶胶在离喷头出口一定距离处开始形成一个不稳定的圆柱状液流,当某处液流的直径小于平均值时便在此处形成较薄的液膜,由于薄液膜处受到的表面张力的作用比厚液膜大得多;因此,薄的部分所含的溶胶体就转移到了厚的部分,使得液流断开并分裂为大小不同的球滴,最后制备出不同粒径大小的SiO2/TiO2气凝胶小球。
| Mesh No | Diameter/mm | Mass fraction/% |
| 2#-4# | 4.75-8.00 | 5.2 |
| 4#-6# | 3.35-4.75 | 55.5 |
| 6#-8# | 2.36-3.35 | 23.9 |
| 8#-10# | 1.70-2.36 | 8.4 |
| 10#-12# | 1.40-1.70 | 4.7 |
| 12#-14# | 1.18-1.40 | 1.8 |
| 14#-16# | 1.00-1.18 | 0.4 |
空气气氛下从室温缓慢加热到1200℃,SiO2/TiO2气凝胶小球的TG-DTA图如图 5所示。由图 5可以看出,当温度从室温加热到100℃时,质量损失仅为0.3%,同时DTA曲线在100℃有一个很小的吸热峰,这主要是由于乙醇和水挥发热所引起的。在500~700℃阶段,质量损失较多,达到3.5%左右,同时在 585℃处DTA曲线出现陡峭的放热峰,质量损失主要是由于残余有机物的分解所引起的,放热峰主要是来自于气凝胶中有机基团(甲基、乙基、亚甲基等)的氧化分解,以及TiO2从无定型态到锐钛矿型的转变。整个过程质量损失仅为5.0%,具有较好的热稳定性。
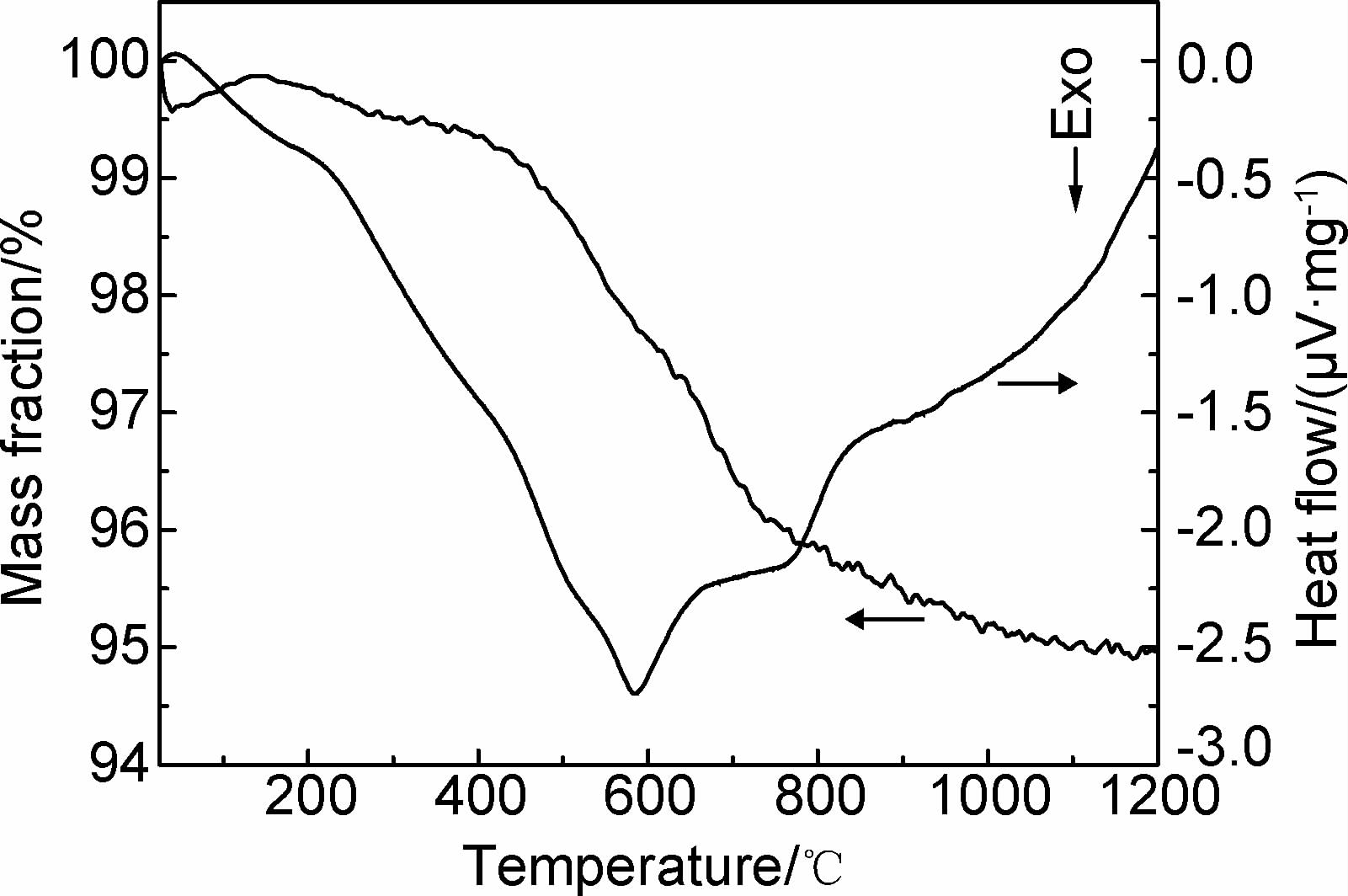
|
图 5 SiO2/TiO2气凝胶小球的TG-DTA 图 Fig. 5 TG-DTA curves of silica-titania aerogel beads |
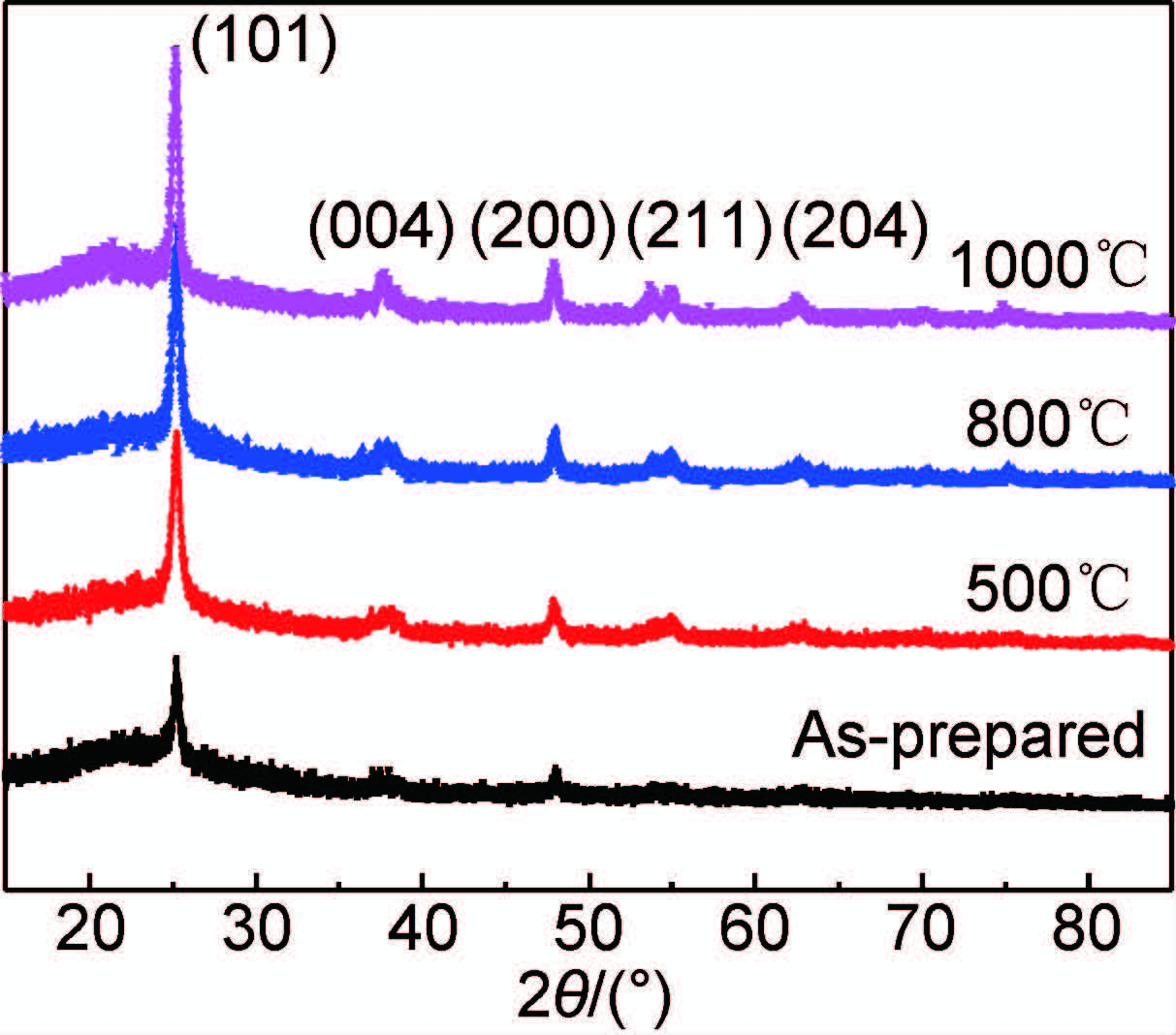
为了进一步研究温度对SiO2/TiO2气凝胶小球结构或性能的影响,对样品进行不同温度的热处理,得到如图 6所示的XRD衍射图谱。可知,在2θ=20°~25°存在较宽的弥散峰,对应于无序的非晶SiO2[17]。同时没有经过热处理的气凝胶小球,TiO2所对应的衍射峰呈现较弱的锐钛矿衍射峰,这说明经过溶胶-凝胶及超临界干燥制备出的SiO2/TiO2气凝胶小球中已有TiO2析晶产物存在,样品经过500℃煅烧处理后,在2θ=25.5°处可以观察到锐钛矿衍射峰明显增强[18],同时在2θ≈37.8°,48.0°处归属于锐钛矿(004),(200)晶面的典型特征峰也显著增强,表明锐钛矿型的TiO2 转变更加完善。随着热处理温度的进一步升高至1000℃,锐钛矿衍射峰进一步增强,但在2θ≈27.5°,36.1°,41.2°处与金红石晶型的(110),(101),(111)相对应的衍射峰并未出现,这是由于引入SiO2后,由于Si4+进入到TiO2晶格中取代了部分钛离子,一方面,导致局部晶格畸变,这种畸变所形成的应力场阻止晶界的移动;另一方面,由于SiO2/TiO2气凝胶小球结构中SiO2与TiO2之间的相互作用存在于TiO2的结晶过程中,Si-O-Ti键对TiO2的锐钛矿晶型起稳定作用,使得TiO2在高温处理下仍保持锐钛矿相,TiO2由锐钛矿型向金红石转变将更加困难[17-19]。因此,SiO2/TiO2复合气凝胶经过1000℃煅烧处理后,TiO2仍主要以锐钛矿相存在,说明复合体系使得TiO2具有较好的热稳定性。
|
图 6 不同温度时SiO2/TiO2气凝胶小球的XRD图 Fig. 6 XRD patterns of silica-titania aerogel beads at different temperatures |
(1) 提出了一种制备高球形度和高比表面积SiO2/TiO2气凝胶小球的方法。通过控制溶胶向醇凝胶小球的转变过程,可实现快速制备高质量、高球形度的SiO2/TiO2气凝胶小球。
(2) 物料配比EtOH:H2O:HAC:TEOS:TBT=50:8:1.2:4:1条件下制备的SiO2/TiO2气凝胶小球具有高的比表面积(914.5m2/g),其中97.6%的SiO2/TiO2气凝胶为球形颗粒,83.5%的SiO2/TiO2气凝胶为高球形度(圆度值≤1.2)的小球。
(3) 制备出的SiO2/TiO2气凝胶小球粒径为1~8mm,平均粒径约为3.5mm,其中55.5%小球的粒径为3.35~4.75mm。SiO2/TiO2气凝胶小球具有较好的热稳定性,TiO2粒子在1000℃下依旧保持着锐钛矿晶型。
| [1] | DORCHEH A S, ABBASI M H. Silica aerogel:synthesis,properties and characterization[J]. Journal of Materials Processing Technology, 2008, 199 (1): 10–26. |
| [2] | HRUBESH L W. Aerogel applications[J]. Journal of Non-Crystalline Solids, 1998, 225 : 335–342. DOI: 10.1016/S0022-3093(98)00135-5 |
| [3] | 张志华, 王文琴, 祖国庆, 等. SiO2气凝胶材料的制备、性能及其低温保温隔热应用[J]. 航空材料学报, 2015, 35 (): 87–96. ZHANG Z H, WANG W Q, ZU G Q, et al. Silica aerogel materials:preparation,properties,and applications in low-temperature thermal insulation[J]. Journal of Aeronautical Materials, 2015, 35 (1): 87–96. |
| [4] | 余煜玺, 吴晓云, 伞海生. 常压干燥制备疏水性SiO2-玻璃纤维复合气凝胶及表征[J]. 材料工程, 2015, 43 (): 31–36. YU Y X, WU X Y, SAN H S. Preparation and characterization of hydrophobic SiO2-glass fibers aerogels via ambient pressure drying[J]. Journal of Materials Engineering, 2015, 43 (8): 31–36. |
| [5] | ALNAIEF M, SMIRNOVA I. In situ production of spherical aerogel microparticles[J]. The Journal of Supercritical Fluids, 2011, 55 (3): 1118–1123. DOI: 10.1016/j.supflu.2010.10.006 |
| [6] | HONG S K, YOON M Y, HWANG H J. Fabrication of spherical silica aerogel granules from water glass by ambient pressure drying[J]. Journal of the American Ceramic Society, 2011, 94 (10): 3198–3201. DOI: 10.1111/j.1551-2916.2011.04765.x |
| [7] | REIM M, REICHENAUER G, KÖRNER W, et al. Silica-aerogel granulate-structural,optical and thermal properties[J]. Journal of Non-Crystalline Solids, 2004, 350 : 358–363. DOI: 10.1016/j.jnoncrysol.2004.06.048 |
| [8] | 贾云砚, 甘礼华, 王玉栋, 等. SiO2气凝胶小球的制备及表征[J]. 化工科技, 2005, 12 (): 6–9. JIA Y Y, GAN L H, WANG Y D, et al. Preparation and characterization of SiO2 aerogel balls[J]. Science & Technology in Chemical Industry, 2005, 12 (6): 6–9. |
| [9] | XU Z, GAN L, JIA Y, et al. Preparation and characterization of silica-titania aerogel-like balls by ambient pressure drying[J]. Journal of Sol-Gel Science and Technology, 2007, 41 (3): 203–207. DOI: 10.1007/s10971-006-1500-z |
| [10] | SARAWADE P B, KIM J K, HILONGA A, et al. Synthesis of sodium silicate-based hydrophilic silica aerogel beads with superior properties:effect of heat-treatment[J]. Journal of Non-Crystalline Solids, 2011, 357 (10): 2156–2162. DOI: 10.1016/j.jnoncrysol.2011.02.022 |
| [11] | SARAWADE P B, KIM J K, HILONGA A, et al. Production of low-density sodium silicate-based hydrophobic silica aerogel beads by a novel fast gelation process and ambient pressure drying process[J]. Solid State Sciences, 2010, 12 (5): 911–918. DOI: 10.1016/j.solidstatesciences.2010.01.032 |
| [12] | REN C, QIU W, CHEN Y. Physicochemical properties and photocatalytic activity of the TiO2/SiO2 prepared by precipitation method[J]. Separation and Purification Technology, 2013, 107 : 264–272. DOI: 10.1016/j.seppur.2013.01.037 |
| [13] | INGALE S V, WAGH P B, TRIPATHI A K, et al. Physico-chemical properties of silica aerogels prepared from TMOS/MTMS mixtures[J]. Journal of Porous Materials, 2011, 18 (5): 567–572. DOI: 10.1007/s10934-010-9410-4 |
| [14] | CHENG S, LIU X, YUN S, et al. SiO2/TiO2 composite aerogels:preparation via ambient pressure drying and photocatalytic performance[J]. Ceramics International, 2014, 40 (9): 13781–13786. DOI: 10.1016/j.ceramint.2014.05.093 |
| [15] | SHAO G N, HILONGA A, JEON S J, et al. Influence of titania content on the mesostructure of titania-silica composites and their photocatalytic activity[J]. Powder Technology, 2013, 233 : 123–130. DOI: 10.1016/j.powtec.2012.08.025 |
| [16] | SING K S W, EVERETT D H, HAUL R A W, et al. Physical and biophysical chemistry division commission on colloid and surface chemistry including catalysis[J]. Pure and Applied Chemistry, 1985, 57 (4): 603–619. |
| [17] | KWON Y G, CHOI S Y, KANG E S, et al. Ambient-dried silica aerogel doped with TiO2 powder for thermal insulation[J]. Journal of Materials Science, 2000, 35 (24): 6075–6079. DOI: 10.1023/A:1026775632209 |
| [18] | 赵斌, 林琳, 陈超, 等. 焙烧处理下二氧化钛/钛酸盐纳米材料晶型和形貌的变化规律研究[J]. 化学学报, 2012, 71 (): 93–101. ZHAO B, LIN L, CHEN C, et al. Research on the phase transition and morphological evolution behaviors of titania/titanate nanomaterials by calcination treatment[J]. Acta Chimica Sinica, 2012, 71 (1): 93–101. |
| [19] | KUMAR S R, SURESH C, VASUDEVAN A K, et al. Phase transformation in sol-gel titania containing silica[J]. Materials Letters, 1999, 38 (3): 161–166. DOI: 10.1016/S0167-577X(98)00152-9 |
 2017, Vol. 45
2017, Vol. 45


