文章信息
- 冷从斌, 季旭, 罗熙, 李明, 余琼粉, 徐永锋
- LENG Cong-bin, JI Xu, LUO Xi, LI Ming, YU Qiong-fen, XU Yong-feng
- Na2SO4·10H2O/EG复合相变材料的制备与性能分析
- Preparation and Performance Analysis of Na2SO4·10H2O/EG Composite Phase-change Materials
- 材料工程, 2017, 45(1): 58-64
- Journal of Materials Engineering, 2017, 45(1): 58-64.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2015.000073
-
文章历史
- 收稿日期: 2015-01-14
- 修订日期: 2016-07-11
2. 浙江省太阳能产品质量检验中心, 浙江 海宁 314400
2. Solar Product Quality Inspection Center in Zhejiang Province, Haining 314400, Zhejiang, China
相变材料(Phase-change Material,PCM)可以将暂时不用的热量储存起来,待需要时再释放出来,从而达到“移峰填谷”的作用[1]。结晶水合盐是无机相变储能材料中典型的一类[2]。结晶水合盐一般为中性,价格便宜,导热系数、体储能密度大,而且具有合适的熔点和凝固点,是中、低温相变材料中的重要一类;但结晶水合盐存在过冷和相分离问题。通过大量的研究发现,添加成核剂[3]或是采用冷指法[4]可有效降低过冷度,相分离问题通过添加黏稠剂或晶体结构改性剂[5],也可采用薄层容器盛装来解决,但这些方法存在长期不稳定的问题,经过一段时间的储/放热循环后,其性能就会降低,而且存在液相易泄漏问题,封装使用不便。
Na2SO4·10H2O是国内外学者研究最早、最多、最深入的结晶水合盐相变储能材料[6]。美国Telkes博士利用Na2SO4·10H2O相变储能材料于1983年在马萨诸塞州建造了世界上第一座相变材料被动太阳房[7]。García-Romero等[8]对典型的无机水合盐Na2SO4·10H2O进行了系统研究,并较好地解决了无机水合盐的过冷现象;Wu等[9]采用Na2SO4·10H2O与Na2HPO4·12H2O按1:1配比后,与多孔的二氧化硅基体按7:3制备的复合PCM过冷度小,潜热值达106.2kJ·kg-1,经30次循环性能无衰减。李慧星等[10]研究发现在Na2SO4·10H2O中添加硼砂和羧甲基纤维素钠等添加剂后,可缓解Na2S04·10H2O过冷度大和相液分离问题。满亚辉等[11]构建了Na2SO4·10H2O潜热计算理论,其与实验值只有2%的误差;刘欣等[12]以3%(质量分数,下同)的硼砂为成核剂,六偏磷酸钠为晶型改变剂,SiO2为悬浮剂,以聚丙烯酰胺作为增稠剂制备的改性十水硫酸钠相变蓄热材料,不仅过冷度小而且能保持较大的相变焓值,但多次循环后相变潜热有所下降。复合相变材料可在一定程度解决单一相变材料的不足[13],因此相变材料的研究主要集中于复合相变材料方面。
膨胀石墨(Expanded Graphite,EG)是天然鳞片石墨经插层、水洗、干燥、高温膨化后得到的蠕虫状疏松多孔物质;经高温膨化后,石墨原先的平面层裂开并产生不均匀变形,平面层卷曲为网状孔型结构[14]。本工作采用真空吸附法制备十水合硫酸钠/膨胀石墨复合相变储能材料(Na2SO4·10H2O/EG),并对其融化-凝固、相分离、过冷、潜热等热物性进行研究和分析,以期能克服单一相变材料的相分离、过冷、导热率低等问题,并防止相变后泄漏的发生。
目前,利用膨胀石墨与结晶水合盐制备复合相变储能材料还鲜有报道,该方法对解决结晶水合盐类的过冷和相分离及强化传热具有一定意义。
1 实验 1.1 原料十水硫酸钠(Na2SO4·10H2O),天津市大茂化学试剂厂,分析纯;硼砂,阿拉丁,分析纯;膨胀石墨,膨胀倍率250mL·g-1,粒度80目,青岛金日来石墨有限公司,工业级。
1.2 材料的制备 1.2.1 未添加硼砂的Na2SO4·10H2O/EG复合PCM的制备按Na2SO4·10H2O:EG质量比为90:10,92:8,95:5称取一定质量的Na2SO4·10H2O和EG,并加入膨胀石墨质量1.5倍的去离子水(补充加热吸附过程中散失的水分和吸附于膨胀石墨中不能参与Na2SO4·10H2O重结晶的水分),于45℃恒温下真空吸附4h,期间不时进行搅拌和摇晃,以使其充分吸附、混合。
1.2.2 添加硼砂的Na2SO4·10H2O/EG复合PCM的制备按硼砂:EG:Na2SO4·10H2O质量比为2:5:93,2:8:90,2:10:88制备Na2SO4·10H2O/EG复合PCM样品,其步骤同1.2.1节。
1.3 性能测试与表征差式扫描量热仪(DSC)取样较少(≤10mg),复合材料混合的非均匀性会导致较大的测量误差,因此本工作采用如图 1所示的装置测量复合材料的相变潜热和比热容。恒温筒内置100W电加热管和K型温度传感器Ⅰ,C3W-221型温控仪与传感器Ⅰ相连并可根据温度来控制电加热管的工作,使用JCYJ-96W3Y精密电表记录加热管的耗电量。温度传感器Ⅱ位于玻璃样品管中央,样品管置于保温筒的中心处,其温度变化由Agilent34970A数据采集仪记录。

|
图 1 热性能测试装置示意图 Fig. 1 Diagram of thermal performance characterization equipment |
当填充有相变材料的样品管置于恒温筒内时,由于PCM温度低于恒温筒内温度,PCM吸热,恒温筒内温度降低。此温度低于预设温度时,电加热管开始工作,达到设定温度时停止,以此不断循环,直到相变储能材料的温度和预设温度一致。加热管消耗的电能转变为热能,部分被PCM和样品管吸收,另一部分散失到环境中。
步冷曲线和储/放热性能的测定利用K型热电偶,使用Agilent32970A数据采集仪采集数据,采集时间间隔为2s。表观形貌采用Leica DM6000M金相显微镜观测。
1.3.1 Na2SO4·10H2O/EG复合PCM比热容测定与计算 1.3.1.1 固态比热容cs恒温筒初始温度为T1,℃;当样品由初始温度T0升高至T1时(T1 < Tf,Tf为相变储能材料的熔点,℃),用时t1,s;样品管质量m0, kg, 加PCM后总质量m1,kg;电加热管消耗电量Q1,kJ;系统T1温度时的散热量qT1,kJ;则PCM的吸热量等于消耗的电量与T1温度时系统散热量及样品管吸热量之差,即
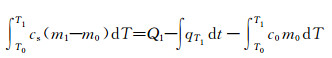
|
(1) |
整理得
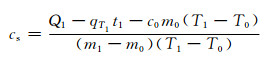
|
(2) |
式中:c0为玻璃(样品管)比热容,c0=0.84kJ·(kg·℃)-1;cs为复合相变储能材料固态比热容,kJ·(kg·℃)-1。
1.3.1.2 液态比热容cl同理恒温筒初始温度为T3,当样品由温度T2升高至T3时,(Tf < T2 < T3),用时t3,加热管消耗电量Q3,系统T3温度时的散热量qT3,则PCM的吸热量等于消耗的电量与T3温度时系统散热量及样品管吸热量之差,即
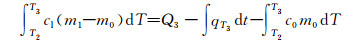
|
(3) |
整理得

|
(4) |
式中cl为复合相变储能材料液态比热容,kJ·(kg·℃)-1。
1.3.2 Na2SO4·10H2O/EG复合PCM相变潜热Hf恒温筒初始温度为T2,当PCM由初始温度T0升至T2时,用时t2,电加热管消耗电量Q2,恒温筒T2温度时的散热量qT2,则相变潜热为加热管耗电量与恒温筒散热量、PCM显热、潜热之差。即
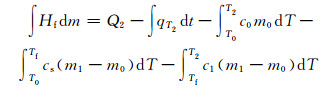
|
(5) |
整理得
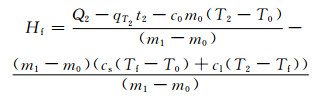
|
(6) |
式中Hf为复合相变储能材料相变潜热,kJ·kg-1。
实验时设T0=0℃,T1=28℃,T2=33℃,T3=65℃,Tf=30.1℃,c0=0.84kJ·(kg·℃)-1;样品管的质量m0=43.58g。
1.3.3 T温度时系统散热量的测定恒温筒初始温度为T,将空样品管放置于恒温筒内,温度稳定后开始计时,经过一段时间Δt后,消耗的电量为ΔQ,则系统在该温度T时的散热量qT为
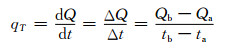
|
(7) |
式中:qT为温度T时系统散热量,J/min;Qa为ta时刻电表读数,kJ;Qb为tb时刻电表读数,kJ;实验时根据硫酸钠的相变温度分别选取T1=26℃,T2=33℃,T3=65℃3个温度点进行系统散热量的测定。上述实验均多次测试取平均值。
2 结果与分析 2.1 Na2SO4·10H2O/EG复合PCM表观形貌图 2为不同配比Na2SO4·10H2O/EG复合相变储能材料表观形貌。从图 2(a)可以看出膨胀石墨具有丰富的空隙结构,它由片状石墨层相互粘连、叠合在一起构成,其微孔可以吸附大量的小分子物质。图 2(b)中可见Na2SO4·10H2O未被EG完全吸附,表面还残留有过量的Na2SO4·10H2O结晶,这说明Na2SO4·10H2O过量;图 2(c)中膨胀石墨的微空隙刚好被Na2SO4·10H2O完全填充,外面也未见过剩Na2SO4·10H2O残留,比例合适;图 2(d)中能看到膨胀石墨还有部分空隙未被填充,说明膨胀石墨过量;因此Na2SO4·10H2O与EG的最优配比为92:8,将在2.2.3节中作进一步分析。
Na2SO4·10H2O/EG复合相变PCM的过冷和相分离结果如表 1所示。表 1中对不同组成的样品分别编号为1#,2#,3#,4#,其具体配比见表 1。
| Sample | Mass fraction of Na2SO4· 10H2O/% |
Mass fraction of EG/% |
Mass fraction of borax/% |
Melting point/ ℃ |
Freezing point/ ℃ |
Supercooling degree/℃ |
Phase separation |
| 1# | 100 | 0 | 0 | 31.8 | 31.2 | 13.6 | Serious |
| 2# | 98 | 0 | 2 | 31.5 | 31.1 | 0.3 | Slight |
| 3# | 95 | 5 | 0 | 30.3 | 28.8 | 2.5 | Slight |
| 4# | 93 | 5 | 2 | 30.1 | 28.4 | 0-0.6 | Slight |
从表 1中可以看出添加EG及硼砂后Na2SO4·10H2O的相分离和过冷度均有明显的改善,取得了较好的效果。
2.2.1 Na2SO4·10H2O/EG复合PCM的相分离Na2SO4·10H2O/EG复合PCM的相分离如图 3所示。

|
图 3 不同配比的Na2SO4·10H2O/EG复合PCM相分离照片 Fig. 3 Photo of phase separation of Na2SO4·10H2O/EG composite PCM with different proportions |
从图 3中可看到在未添加成核剂硼砂时,Na2SO4·10H2O融化后,冷却时只在未溶解的Na2SO4固体与其溶液的边界层有少量结晶,于15℃水浴中静置12h后,边界层及管壁出现大量结晶,但仍有部分未结晶的液态。当添加2%硼砂后,冷却降温时即有明显结晶,静置12h后,结晶量可达90%。
上述两组实验均存在明显的相分离现象。这主要是因为20℃时,Na2SO4溶解度只有19.5g,溶解量只占其溶液总质量的16.32%,而Na2SO4·10H2O自身含水量为55.90%,不溶固形物Na2SO4占Na2SO4·10H2O总质量的34.98%,即使40℃时,最大溶解度50g,不溶性固形物Na2SO4也占25.47%。残留固形物因密度大,在重力作用下,沉降到试管底部,冷却时首先在固形物与饱和溶液的边界发生结晶;当饱和溶液中的Na2SO4不断析出时,溶液浓度也不断变稀,而析出的结晶堆积在固形物表层,阻断了固形物与水的接触,使得底部沉积的固形物不能与上层清液接触重新生成Na2SO4·10H2O,也就不再有潜热的存储和释放,从而失效。加入成核剂硼砂后,加快了Na2SO4的结晶速率,在降温形成的微对流过程中即开始结晶,产生的大量晶核在重力作用下缓慢下沉,起到搅拌的作用,从而结晶量增加,清液减少。根据晶体生长理论,晶核越多晶体生长越快,故添加硼砂后可生成大量细小的Na2SO4·10H2O晶体,降低结晶水合盐由液相转变为固相的推动力,进而减小Na2SO4·10H2O的过冷度,但因存在相分离,结晶仍不完全。
2.2.2 Na2SO4·10H2O/EG复合PCM的过冷添加EG后,由于EG的疏松多孔性,使融化后的Na2SO4·10H2O溶液被EG的空隙吸附,即使未溶解的Na2SO4固体也黏附于EG表面,阻碍其沉降到底部,从而起到防止相分离的作用。同时,添加的EG还充当成核剂,为Na2SO4·10H2O的结晶提供外源晶核,加快Na2SO4·10H2O的结晶,使Na2SO4·10H2O的过冷度从13.6℃降低到2.5℃,而且冷凝结晶后无液态残留,结晶较完全。当再加入2%的硼砂后,可使过冷度降低到0.6℃以下,如表 1和图 4所示。
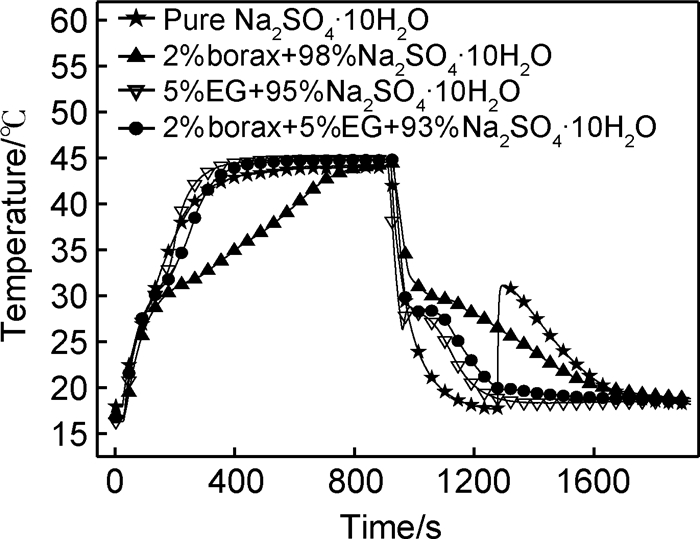
|
图 4 不同配比的Na2SO4·10H2O/EG复合PCM步冷曲线 Fig. 4 Cooling curves of Na2SO4·10H2O/EG composite PCM with different proportions |
从图 3和表 1中可看出添加5%EG的Na2SO4·10H2O/EG复合PCM,冷凝结晶完全,但加热融化后有少量Na2SO4溶液渗出,存在轻微的相分离,说明添加的EG不足。
当EG添加量为8%时,Na2SO4·10H2O/EG复合PCM相变时不再有液态渗出,而且放热时复合PCM恒温时间较长,如图 5所示,说明其放热较多,相变潜热较大。此外,储/放热时间与10%EG相当,即添加8%EG复合PCM的热导率与10%EG添加量相当;因此,Na2SO4·10H2O/EG复合PCM中,EG的最优添加量为8%。此结果与图 2表观形貌分析相符。
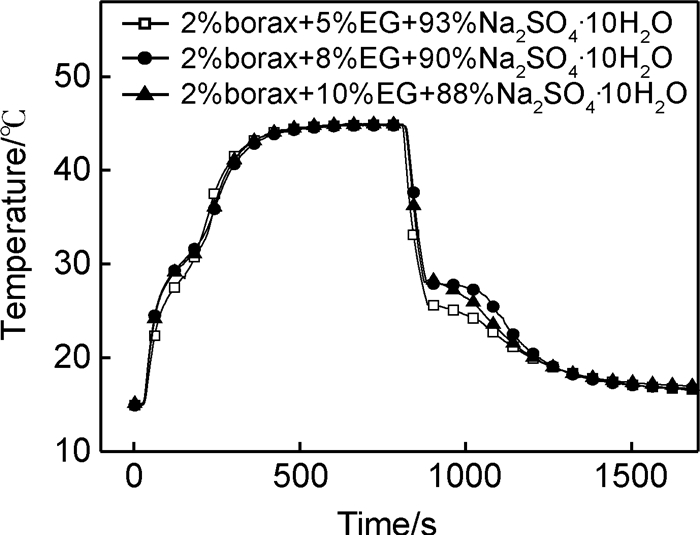
|
图 5 不同EG含量的Na2SO4·10H2O/EG复合PCM融化凝固曲线 Fig. 5 Melt solidification curves of Na2SO4·10H2O/EG composite PCM with different EG contents |
膨胀石墨具有极高的导热性,室温下膨胀石墨的导热系数可达300W·(m·K)-1左右[16],添加EG后能显著提高Na2SO4·10H2O的热导率,缩短储/放热时间。结合图 4和图 5可求出添加8%的EG后,Na2SO4·10H2O/EG复合PCM与只添加硼砂的Na2SO4·10H2O PCM相比,储热时间缩短52.6%,放热时间缩短55.1%。
2.3 Na2SO4·10H2O/EG复合PCM的热物性表 2为不同配比的Na2SO4·10H2O/EG复合PCM的储热性能,由表 2可见Na2SO4·10H2O/EG复合PCM的比热容和相变潜热值均较大。随着EG添加量的增加,Na2SO4·10H2O/EG复合PCM的密度,固、液比热容,相变潜热和体储能密度均逐渐降低,但其相变潜热值均在200kJ·kg-1以上,体储能密度也均大于200MJ·m-3。EG的最优添加量为8%时,相变潜热、体储能密度分别为225.77kJ·kg-1,218.09MJ·m-3,分别达到纯Na2SO4·10H2O PCM理论值的88.89%和57.82%。
| Composition | Solid-state heat capacity/ (kJ·kg-1·℃-1) |
Specific heat capacity/ (kJ·kg-1·℃-1) |
Latent heat/ (kJ·kg-1) |
Density/ (kg·m-3) |
Energy density/ (MJ·m-3) |
| Pure Na2SO4·10H2O | 1.76[17] | 3.3[17] | 254[18] | 1485[19] | 377.19 |
| 5%EG+2%borax+93%Na2SO4·10H2O | 2.56 | 3.71 | 234.33 | 1034 | 242.29 |
| 8%EG+2%borax+90%Na2SO4·10H2O | 2.58 | 3.54 | 225.77 | 966 | 218.09 |
| 10%EG+2%borax+88%Na2SO4·10H2O | 2.47 | 3.34 | 215.21 | 941 | 202.51 |
Na2SO4·10H2O/EG复合PCM经过500次激烈热冲击循环后,其储/放热性能未出现明显衰减,热稳定性良好,如图 6所示。
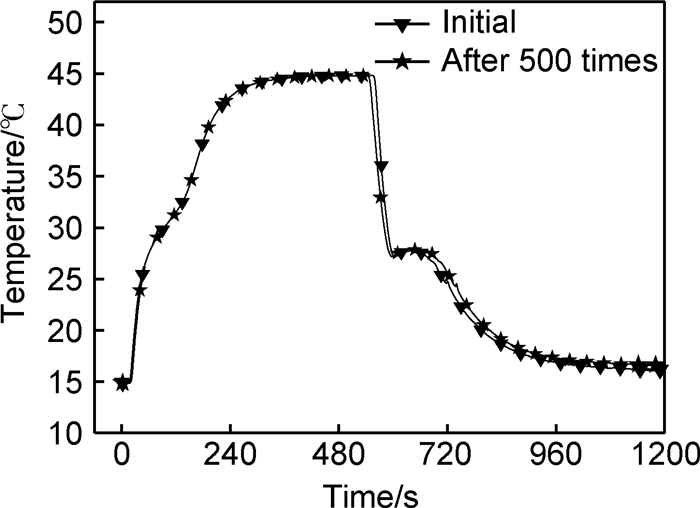
|
图 6 Na2SO4·10H2O/EG复合PCM稳定性测试 Fig. 6 Stability test curves of Na2SO4·10H2O/EG composite PCM |
(1)添加5%的EG可使Na2SO4·10H2O的过冷度从13.6℃降低到2.5℃,再添加2%硼砂后可使过冷度降低到0.6℃以下。当EG添加量为8%,硼砂为2%时,Na2SO4·10H2O/EG是理想的复合固-固相变储能材料。
(2) EG的最优添加量为8%,此时,复合相变材料的相变潜热和体储能密度分别为225.77kJ·kg-1和218.09MJ·m-3,相比于只添加硼砂的Na2SO4·10H2O PCM,储热时间可缩短52.6%,放热时间缩短55.1%。经过500次储热/放热循环后,性能无明显衰减。
| [1] | JAMEKHORSHID A, SADRAMELI S M, FARID M. A review of microencapsulation methods of phase change materials (PCMs) as a thermal energy storage (TES) medium[J]. Renewable and Sustainable Energy Reviews,2014, 31 : 531–542. DOI: 10.1016/j.rser.2013.12.033 |
| [2] | 路宽.复合相变储能材料的制备及其性能研究[D].新乡:河南师范大学, 2012. LU K.Preparation and performance of composite phase change materials[D]. Xinxiang:Henan Normal University, 2012. |
| [3] | ZALBA B, MARIN J M, CABEZA L F, et al. Review on thermal energy storage with phase change materials heat transfer analysis and applications[J]. Applied Thermal Engineering,2003, 23 (3): 251–283. DOI: 10.1016/S1359-4311(02)00192-8 |
| [4] | 李晶.相变蓄热材料及其相变特性的研究[D].北京:北京工业大学, 2005. LI J. Study on phase change heat storage material and transformation characteristics[D].Beijing:Beijing University of Technology, 2005. |
| [5] | 李晓辉. 相变储能材料的研究进展[J]. 河北省科学院学报,2012, 29 (2): 58–62. LI X H. Research progress in phase change materials[J]. Journal of the Hebei Academy of Sciences,2012, 29 (2): 58–62. |
| [6] | EFIMOVA A, PINNAU S, MISCHKE M, et al. Development of salt hydrate eutectics as latent heat storage for air conditioning and cooling[J]. Thermochimica Acta,2014, 575 : 276–278. DOI: 10.1016/j.tca.2013.11.011 |
| [7] | 培克曼G, 吉利P V. 蓄热技术及其应用[M]. 北京: 机械工业出版社, 1989 : 45 -76. BECKMANN G, GILLI P V. Thermal Energy Storage:Basics Design Applications to Power Generation and Heatsupply[M]. Beijing: China Machine Press, 1989 : 45-76. |
| [8] | GARCÍA-ROMERO A, DIARCE G, IBARRETXE J, et al. Influence of the experimental conditions on the subcooling of Glauber's salt when used as PCM[J]. Solar Energy Materials and Solar Cells,2012, 102 : 189–195. DOI: 10.1016/j.solmat.2012.03.003 |
| [9] | WU Y, WANG T. Preparation and characterization of hydratedsalts/silica composite as shape-stabilized phase change material via sol-gel process[J]. Thermochimica Acta,2014, 591 : 10–15. DOI: 10.1016/j.tca.2014.07.012 |
| [10] | 李慧星, 赫娜, 陈其针, 等. 新型Na2SO4·10H2O相变储能体系的制备[J]. 沈阳建筑大学学报(自然科学版),2013, 29 (3): 513–518. LI H X, HE N, CHEN Q Z, et al. The preparation of Na2SO4·10H2O phase change energy storage system[J]. Journal of Shenyang Jianzhu University (Natural Science),2013, 29 (3): 513–518. |
| [11] | 满亚辉, 吴文健. Na2SO4·10H2O相变过程及其相变潜热的计算[J]. 国防科技大学学报,2009, 32 (2): 41–43. MAN Y H, WU W J. Analysis of phase change for Na2SO4·10H2O and calculation on latent heat[J]. Journal of National University of Defense Technology,2009, 32 (2): 41–43. |
| [12] | 刘欣.十水硫酸钠相变蓄热材料的改性及其在模拟机房中的应用[D].广州:华南理工大学, 2013. LIU X.Modification of sodium sulfate decahydrate phase change thermal storage materials and application in communication base station energy conservation[D]. Guangzhou:South China University of Technology, 2013. |
| [13] | 刘菁伟, 杨文彬, 谢长琼, 等. HDPE/EG/石蜡导热定形相变材料的制备及性能[J]. 材料工程,2015, 43 (4): 42–46. LIU J W, YANG W B, XIE C Q, et al. Preparation and properties of HDPE/EG/paraffin thermal conducting shape-stabilized phase change material[J]. Journal of Materials Engineering,2015, 43 (4): 42–46. |
| [14] | 吕学文, 考宏涛, 李敏. 膨胀石墨/石蜡复合相变材料相变过程的热分析[J]. 材料导报,2011, 25 (2): 131–133. LU X W, KAO H T, LI M. Thermal analysis in phase transition process of expanded graphite/paraffin wax composite phase change materials[J]. Materials Review,2011, 25 (2): 131–133. |
| [15] | KIM S, DRZAL L T. High latent heat storage and high thermal conductive phase change materials using exfoliated graphite nanoplatelets[J]. Solar Energy Materials Solar Cells,2009, 93 (1): 136–142. DOI: 10.1016/j.solmat.2008.09.010 |
| [16] | 张焘, 曾亮, 张东. 膨胀石墨、石墨烯改善无机盐相变材料热物性能[J]. 无机盐工业,2010, 42 (5): 24–26. ZHANG T, ZENG L, ZHANG D. Improvement of thermal properties of hybrid inorganic salt phase change materials by expanded graphite and graphene[J]. Inorganic Chemicals Industry,2010, 42 (5): 24–26. |
| [17] | 张寅平, 胡汉平, 孔祥冬, 等. 相变贮能:理论和应用[M]. 合肥: 中国科学技术大学出版社, 1996 : 341 . ZHANG Y P, HU H P, KONG X D, et al. Phase Change Energy Storage:Theory and Applications[M]. Hefei: University of Science and Technology of China Press, 1996 : 341. |
| [18] | HAWES D W, FELDMAN D, BANU D. Latent heat storage in building materials[J]. Energy and Buildings,1993, 20 (1): 77–86. DOI: 10.1016/0378-7788(93)90040-2 |
| [19] | ABHAT A. Low temperature latent heat thermal energy storage:heat storage materials[J]. Solar Energy,1983, 30 (4): 313–332. DOI: 10.1016/0038-092X(83)90186-X |
 2017, Vol. 45
2017, Vol. 45



