文章信息
- 钱春香, 王欣, 於孝牛. 2015.
- QIAN Chun-xiang, WANG Xin, YU Xiao-niu. 2015.
- 微生物水泥研究与应用进展
- Research and Application Development of Microbe Cement
- 材料工程, 43(8): 92-103
- Journal of Materials Engineering, 43(8): 92-103.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2015.08.015
-
文章历史
- 收稿日期:2014-11-11
- 修订日期:2015-01-13
2. 东南大学 绿色建材技术研究所, 南京 211189
2. Research Institute of Green Construction Materials, Southeast University, Nanjing 211189
随着城市人口的急剧增加,基础设施的相对不足逐渐成为不容忽视的社会问题。对于中国而言,每年约1000万人从乡村转移至全国各大城市,基础设施的需求显得越来越突出。然而,基础设施的新建或扩建很大程度上会受限于其下地基土的工程性质。同时,诸如全球变暖所引起的海平面上升此类环境问题也在逐渐压缩人类的生存空间[1]。
当前大多数地基处理技术是利用大型机械及人工合成材料,其在机械设备的安装及操作过程或人工合成材料生产过程中都需要消耗大量的能量。常见的方法是将人造材料(如水泥、环氧树脂、硅酸钠、聚氨酯等)注入土壤孔隙中达到黏结加固效果。而化学注浆法中除了硅酸钠外的所有化学浆体都是有毒的[2],因此,其所带来的环境隐患令人担忧。水泥作为常用灌浆材料,虽然具有较好地基加固效果,但生产过程中会伴随着大量矿石燃料的燃烧,即温室气体的释放,因其能耗高、污染环境等缺点而面临着严重挑战。此外,当前所有的注浆方法执行力较差,即未必能按设计目的在场地产生较理想的处理效果。一般来说,化学处理方法只在灌浆点附近1~2m 范围内有效[3],而且施工过程中的质量控制是主要局限于注射体积和压力监测,没有针对地下实际变化的实时监控,考虑到诸多不确定性只能选择偏保守的设计,也造成了不必要的成本。因此,开发一种新型、可持续发展的土壤改性加固方法迫在眉睫。
近年来,随着微生物学、地球化学、土木工程等学科间的交叉研究的不断发展,微生物诱导碳酸钙沉积技术(MICP)逐步应用于各相关领域,如污水处理、钙质石材修复等,此外,它也被用于软土地基强度与稳定性的改善,相比于通常对环境污染的化学灌浆,此法更具环境友好性[1]。微生物诱导碳酸钙沉积是一项具有前景的生物介导的土壤改良技术,目前在岩土界被广泛研究。本文回顾了近年来微生物诱导沉积碳酸钙在岩土工程应用中的最新研究进展,分别从微生物矿化胶结机理,应用研究以及存在的问题等方面予以论述。
1 微生物诱导沉积碳酸钙(MICP) 1.1 MICP矿化机制与其他生物矿化过程类似,碳酸钙沉积机制可分为生物控制和生物诱导两种。在生物控制矿化中,微生物高度控制矿物颗粒的成核与生长过程,与外界环境无关,如趋磁细菌形成磁铁矿过程以及单细胞藻类的二氧化硅沉积等。然而,细菌作用下的碳酸钙沉积一般认为是由诱导机制控制,因为矿物类型很大程度上取决于环境因素。在不同环境中,微生物种类以及非生物因素(如浓度和培养基组成等)都会影响碳酸钙的形成方式。
通常而言,碳酸钙的沉积过程主要由四个关键因素控制[4]:①Ca2+浓度;②溶解无机碳浓度;③pH;④有效的成核位点。碳酸钙沉淀需要足够浓度的Ca2+和CO2-3,以使离子活度积(Ion Activity Product,IAP)超过溶解平衡常数(Kso)。定义饱和度为Ω,离子活度为α,当Ω>1时,即系统达到过饱和状态,则碳酸钙沉淀有可能发生,如式(1),(2)所示。

反应体系中的碳酸根浓度与既定反应环境中的溶解无机碳浓度和pH有关,同时,无机碳浓度取决于温度,湿度以及二氧化碳分压等环境参数。式(3)~(6)给出了25℃、一个大气压下的二氧化碳在水中溶解过程中的平衡反应及对应平衡常数。

微生物通过自养或异养途径,利用自身生理活动提供有利于碳酸钙沉淀的碱性环境。Hamdan[5]研究表明,在醋酸盐和硝酸根存在的条件下,脱氮假单胞菌(Psedomonas Denitrificans)利用代谢作用使硝酸根成为电子受体而被还原成氮气,同时消耗体系中的H+,导致环境pH升高,并生成CO2(式(7))。Paassen等[6]利用从土壤分离得到的反硝化细菌处理松散砂粒,成功胶结出具有一定力学性能的砂柱。
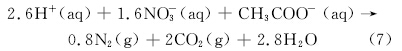
Rodriguez等[7, 8, 9]发现,黄色粘细菌(Myxococcus Xanthus)在其新陈代谢过程中分解,如式(8)~(10)所示。
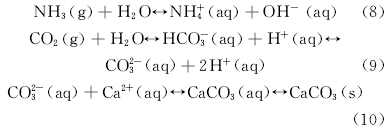
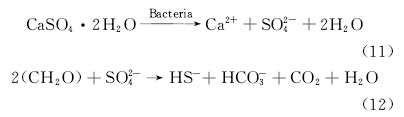
自然界中还存在一种硫酸盐还原菌(Sulphate Reducing Bacteria,SRB),在厌氧环境中可将硫酸盐作为电子受体而被还原成H2S,并从溶液体系中逃逸,导致环境pH升高,为碳酸钙沉积提供了有利条件(式(11)~(12))。 David等[10, 11]对南澳大利亚库荣地区地层的研究表明,硫酸盐还原菌对地层中白云石矿物的沉积起到重要作用,同时还从湖底沉积物中分离出此类微生物,并在模拟厌氧条件下诱导沉积出白云石矿物。
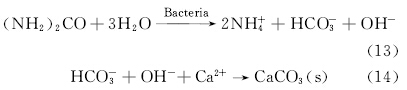
另一种微生物诱导碳酸钙沉积则是以微生物参与的尿素水解为机制的一系列生物化学反应。以芽孢杆菌为主的产脲酶菌,在其新陈代谢活动中分泌脲酶,水解环境中的尿素产生NH3和CO2,并使得反应体系呈碱性,在外界Ca2+的存在条件下析出碳酸钙晶体,(式(13)~(14))。
Jahns[12]揭示了微生物水解尿素过程与ATP生成的耦合关系(图1):①胞内外浓度梯度促使尿素扩散至胞内;②脲酶水解尿素产生NH+4,导致细胞液碱化,胞内外pH差下降;③胞内外NH+4浓度梯度使得排出至胞外,同时引起膜电位的增大;④质子逆浓度梯度进入胞内以降低膜电位,这一过程产生了ATP。
许多微生物过程都能产生碳酸钙沉淀,但并不都适合应用于岩土工程。Paassen等[6]给出了微生物诱导碳酸钙沉积适用性的评价标准:①混合溶液(反应物)的溶解性;②碳酸钙沉积速率;③混合溶液(反应物)的用量;④副产物的类型与产量。由于微生物酶解高效性和反应物的高溶解性,尿素水解参与的MICP被作为主流方式而被广泛研究。
1.2 MICP胶结机理在岩土应用中,微生物诱导碳酸钙沉积的作用环境主要是松散砂土,由于微生物分泌的胞外聚合物及其双电层结构的存在,微生物趋向吸附于颗粒表面,如图2所示[1],除了通过新陈代谢活动提供碱性环境外,微生物由于细胞壁表面一般带有大量负电官能基团(如羟基、胺基、酰胺基、羧基等)而吸附溶液中的Ca2+,作为形核位点,有利于异质成核[13, 14]式(15)。
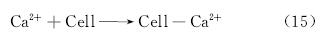
Muynck等[15]描述了微生物诱导生成碳酸钙沉淀的过程(图3),可知,①溶液中的Ca2+吸附于带负电荷的微生物细胞壁,同时通过尿素水解,CO2-3和NH+4被释放至微生物局部环境中;②在Ca2+存在下,可能导致溶液局部过饱和,碳酸钙沉淀于细胞壁;③随着碳酸钙晶体的不断生长,微生物逐渐被包裹,限制营养物质的传输,导致细胞死亡;④微生物在碳酸钙晶体上留下印迹。许多研究人员发现微生物诱导生成的碳酸钙上存在类似的坑蚀[16, 17, 18, 19]。
正是松散颗粒间不断诱导沉积的碳酸钙,最终将松散颗粒胶结成为整体,并赋予其一定的力学性能。一般而言,材料内部生成碳酸钙含量越多,其内部孔隙减小越显著,宏观表现出来的力学性能(如强度、刚度、渗透性等)就越优异。Chu等[20]在微生物灌浆加固砂土研究中发现,处理后砂土的无侧限抗压强度(S)和渗透系数(K)与砂土内的碳酸钙含量(C/%,质量分数)具有较强的线性相关(式(16),(17))。

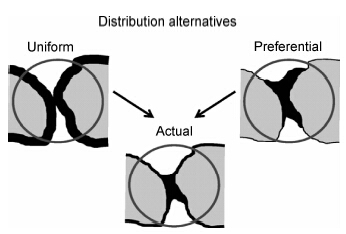
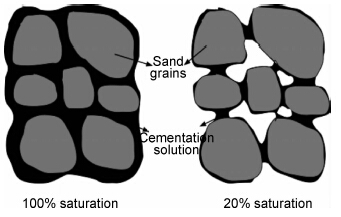
然而,相同碳酸钙含量的情况下,胶结砂土的力学性能也会存在较大差异,这是由碳酸钙的不同分布状态所导致的。Dejong等[1]认为碳酸钙主要分布在颗粒接触点附近,而不是均匀沉积于颗粒表面或仅在颗粒接触点处沉积,如图4所示,这是由于微生物趋于吸附在较小表面物体上的生物特性以及其过滤作用,颗粒接触点附近区域的微生物浓度较高,导致碳酸钙主要在此区域沉积。Cheng等[21]比较了非饱和砂土中的碳酸钙沉积,结果发现,在碳酸钙含量相近的情况下,饱和度越低的砂土,其胶结强度越高。这种结果主要是砂土内的孔隙溶液分布差异导致的,如图5所示,饱和状态下,溶液完全占据整个孔隙,碳酸钙晶体不受位置及尺寸的限制而自由沉积于颗粒表面及孔隙处,而非饱和砂土中的溶液主要以弯液面形式存在于颗粒接触点处,极大地限制了碳酸钙晶体沉积位置。
由此可知,松散颗粒接触点附近处有效沉积的碳酸钙是微生物胶结作用实现的关键。钱春香等[22]通过红外光谱测试发现,微生物诱导沉积的碳酸钙中出现有机物多肽的振动频率,且石英砂中Si-O键的对称收缩振动频率也有明显的变化,说明碳酸钙中的有机成分(羟基)与石英砂中Si-O键中的O原子发生较强的分子间氢键作用,使得体系能量降低。同时,29Si化学位移的变化也进一步证实了氢键的作用,揭示了微生物诱导碳酸钙沉积具有胶结作用的本质。
2 MICP应用研究现状早在1992年,Kantzas等[23]就已将微生物诱导沉积碳酸钙作为新型胶凝材料,使松散砂颗粒成功胶结为整体,显著地降低了砂体的孔隙率,渗透系数下降近90%。Ferris 和Setehmeir[24]在石油开采中,利用MICP技术有效地封堵砂土层中的孔隙,降低其渗透性,提高从油藏开采石油的能力。Stocks等[25]利用嗜碱土壤微生物巴氏芽胞杆菌(Bacillus Pasteurii)在砂土环境沉积实验中,诱导沉积出具有胶结作用的碳酸钙沉淀。Nemati等[26, 27]利用微生物灌浆技术有效降低了多孔介质的渗透性,其渗透率由394.4mD下降至31.3mD,降低约92%。此后,微生物诱导沉积碳酸钙受到了更多学者的广泛研究。
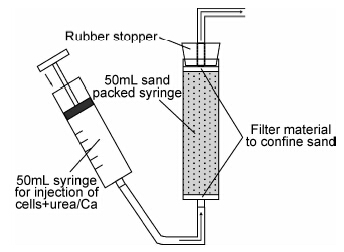
Whiffin[28]从土壤中分离得到两种不同产脲酶能力的微生物(Sporosarcina Pasteurii和Proteus Vulgaris),并研究了不同培养条件对两种脲酶活性的影响,发现在未对细菌进行浓缩或裂解等额外处理的条件下,单位生物量的巴氏芽孢杆菌(Sporosarcina Pasteurii)的脲酶活性可达29U。同时,还研究了胶结溶液中的尿素、Ca2+、NH3/NH4+、NO-3、Cl-等浓度对脲酶水解尿素能力的影响,结果发现巴氏芽孢杆菌的耐受能力较高,可承受的尿素浓度和Ca2+浓度分别为3mol/L和2mol/L,保证了微生物胶结处理的高效性。还采用塑料注射器(50mL)为砂土胶结试模,并以注射方式将菌液及尿素/钙离子混合液注入松散砂体的工艺进行微生物胶结砂土实验,如图6所示。值得关注的是,Whiffin提出利用超声波速变化对微生物胶结全部过程进行实时监测,如图7所示,以反映微生物处理对砂体性质的影响过程,实验发现,随着微生物处理次数的增加,超声波速逐渐增大,微生物处理后砂体的强度也随之增大,说明超声波速与砂体强度之间具有相关性,这与McNally[29]的研究结果一致,因此使用这种无损检测方法具有合理性。经微生物处理后砂体的抗剪强度可达1.8MPa,刚度超过250MPa。在上述研究基础上,Whiffin等[30]进一步扩大胶结尺寸,利用微生物诱导沉积碳酸钙成功胶结出长5m、直径66mm的砂柱。实验采用低压灌浆(水力梯度< 1,流速约7m/d)方式依次将菌液,固定液(0.05mol/L Ca2+)及胶结液(尿素/钙离子)注入砂柱,同时对砂柱不同位置处流出液的NH+4及Ca2+的浓度变化进行监测,加固处理124h后对砂柱切样(5m砂柱切成20段长25cm砂柱)进行分析。碳酸钙含量测试结果表明,砂柱内的碳酸钙分布不均匀,近注射口附近碳酸钙含量相对较高,而远离注射口处则较低,离注射口1m处碳酸钙含量最高,达到105kg/m3。Whiffin等认为,尿素水解速率与流速(反应物的供应速率)间的失衡是造成整个砂柱中碳酸钙分布不均匀的可能原因。固结排水实验表明,砂样的抗压强度同样分布不均,而且与碳酸钙含量对比发现,较低的碳酸钙含量(低于60kg/m3)对砂体抗压强度的提高并不明显,而当微生物诱导生成的碳酸钙含量较高时,砂体抗压强度得到显著改善。常水头渗透实验表明,渗透系数由处理前的1.92×10-5m/s下降为处理后的8.10×10-6m/s,保持了良好的土壤渗透性能。
Al-thawadi[31]通过添加镍离子、提高酵母提取物浓度等对微生物产酶条件进行优化,结果表明,添加10μmol/LNi+以及提高培养基中酵母提取物浓度至20g/L等有利于提高微生物脲酶活性。同时,还通过降低钙离子浓度、连续浇注等条件得到胶结程度较均匀的1m长的砂柱,砂样强度约为5.8MPa。
Dejong等[32]也开展MICP的应用研究,从岩土与生物两方面分析了土壤内的微生物矿化的主要影响因素,微生物在松散颗粒间的传输与吸附行为很大程度上取决于土壤孔喉相对大小、颗粒表面的电化学性质以及孔隙溶液的化学性质等。一般,微生物难以通过小于0.4μm以下的孔喉,而能在大于6μm的孔喉中自由移动[33]。碱性环境和有效的成核位点是碳酸钙结晶过程中不可或缺的重要条件,而这些都依赖于土壤内的微生物数量与活性。Dejong等[32]在14cm长砂柱(直径为7.2cm)中进行了诱导碳酸钙沉积实验,同样为了实时监测砂土内MICP过程,采用剪切波速无损检测方法,并与石膏处理砂样进行对比。由于石膏的快速水化作用,反应1.2h后砂土的砂样剪切波速可达600m/s,而经过MICP连续处理28h后,砂土的剪切波速为540m/s,分别是未处理饱和砂土的3.2倍和2.8倍。通过固结不排水三轴剪切实验发现,与未处理的松散砂样相比,微生物诱导沉积碳酸钙可以显著提高砂土的剪切刚度和极限承载力,且砂土试件剪切破坏时有明显的应变软化行为,这与传统胶凝材料-石膏处理相似。
实际环境中土壤状况错综复杂,MICP技术能否适应是MICP现场应用无法逃避的问题。Dejong等[34]认为土壤的变异性与异质性,如土壤颗粒尺寸、土壤矿物等,会影响生物化学反应。微生物及营养物质的传输很大程度上取决于土壤内的水文边界条件和孔隙几何形状,而孔隙水中的溶液、溶质等也会对反应物的扩散混合有较大影响。利于微生物传输的较大孔喉与更多颗粒间接触点数间的平衡问题也是MICP有效改善土壤性能的关键。同时研究了土壤矿物类型对MICP的影响,实验中采用富含二氧化硅、碳酸钙、氧化铁等矿物的不同砂土作为碳酸钙沉积场所,结果表明,微生物在上述环境中均能诱导沉积出碳酸钙,但胶结效果不尽相同。因为土壤矿物能直接影响沉淀-溶解反应的热力学平衡,为碳酸钙沉积提供更有利的成核位点,对于本身含碳酸钙的砂土则能为碳酸钙晶体生长提供理想表面。土壤内孔隙水盐度越高,微生物处理砂体的剪切波速增加越显著,这是因为高盐度孔隙溶液中含有更高浓度、可供微生物产生的碳酸根沉淀的阳离子。
Lee等[35]利用巨大芽孢杆菌(B. Megaterium)诱导碳酸钙沉积处理马来西亚地区的残积土(砂质粉土),有效提高了残积土的抗剪强度和抗渗性。实验发现,MICP对残积土的抗剪强度的提高比砂样更显著,渗透系数的降低却小于砂样。同时残积土干容重越大,其抗剪强度及抗渗性提高得就越多,而砂样却表现出相反的变化趋势。残积土的粒径范围较大,尺寸较小颗粒能够填充到较大颗粒间的孔隙中,使得颗粒间的接触点增加,而且残积土干容重越大,有效接触点越多,更有利于颗粒接触点处碳酸钙的沉积。Lee等[36]还进一步研究了微生物处理后残积土的应力-变形及压缩特性,发现残积土经过微生物加固处理后呈现典型的脆性特征,即当应力达到峰值强度后出现明显大幅度下降。土壤压缩特性主要由压缩指数(Cc)、次压缩系数(Cr)、先期固结应力(Pc)及总固结沉降量(Sc)四个参数评价(表1),其中次压缩系数与诱导生成的碳酸钙含量具有较好的线性关系,土壤的次压缩系数、先期固结应力、总固结沉降量随碳酸钙生成量的增加而变小,且与未处理土相比,总固结沉降量减少约2%~23%,但在高应力(超过土壤屈服应力)条件下,MICP对土壤压缩特性的影响不明显。Lee等[37]通过控制菌液浓度、胶结液的浓度以及灌浆压力等条件对残积土灌浆工艺进一步优化,使得固化后土壤的抗剪强度增幅高达100%,渗透系数下降90%。实验中还发现,过高的灌浆压力(如2×105Pa)可能会导致土壤孔隙水压力的累积,并破坏土体结构,从而对土壤性能造成不利影响,而过低的灌浆压力(如2×104Pa)会使碳酸钙在近注射口附近沉积而限制灌浆深度,因此,建议在MICP处理残积土时必须考虑合适的灌浆压力。
| Compressibility characteristic | Linear correlation with the calcite contentC | R2 |
| Cc | Cc=-0.010C +0.208 | 0.231 |
| Cr | Cr=-0.024C +0.141 | 0.938 |
| Pc/(kN·m-2) | Pc =16.63C +24.65 | 0.707 |
| Sc/mm | Sc =-0.35C+3.462 | 0.719 |
Cheng等[38]提出采用表面渗流方式处理非饱和砂土,这与绝大多数研究者采用的灌浆方法不同。实验中采用多层交替方法将菌液、胶结溶液等从砂土表面渗流入砂体,如图8所示,结果发现碳酸钙沿砂柱分布并不均匀,远离注射口处碳酸钙含量较高,砂柱底部碳酸钙沉积量约为顶部的3倍,但砂柱局部强度并未与碳酸钙含量成比例增加,而是保持相对恒定。根据非饱和土力学理论,砂柱中体积含水率存在梯度,顶部含水率约为7%,孔隙水以弯液面形式存在于颗粒接触区域,而底部含水率近39%,处于完全饱和状态。碳酸钙晶体只可能从胶结液中析出,故在砂柱顶部处的碳酸钙被限制在颗粒间接触区域沉积,有效提高了砂土的强度,单位质量碳酸钙的强度提高2倍。由此可知,在满足工程性能的前提下,可以通过减少化学物质和水的使用量,降低MICP应用成本。
为了进一步研究土壤颗粒尺寸以及孔隙对微生物胶结过程的影响,Kim等[39]选用不同相对密实度的砂、不同相对压实度的粉土以及不同孔径分布的风化土作为胶结对象。比较各砂样发现,相对密实度为60%的砂样试件中的碳酸钙含量最高,由此推断在较松散(40%)或较密实(60%)状态下都不利于碳酸钙生成。而对于粉土组,在相对压实度为90%的粉土中碳酸钙沉积量最多。另外,级配不良的风化土中碳酸钙的沉积量约为级配良好的5倍,说明土壤内孔隙越均匀,越有利于碳酸钙在土壤内的沉积。
由Whiffin等[30]的MICP胶结实验结果可知,砂土内的碳酸钙沉积(分布)并不均匀,尤其当胶结体积较大时,这种不均匀性表现得更加明显,这也导致了MICP改善后砂土的工程性质的异质性,如强度分布不均匀等。针对这一问题,Harkes等[40]从微生物砂土内的分布考虑,通过控制流速、固定液组成及浓度等条件对微生物灌浆工艺进行优化,以改善微生物分布不均的问题。微生物在多孔介质中的传输性能,其影响因素主要有流体性质(溶液的化学性质、流型等)、细胞壁性质(疏水性、表面电荷等)以及固体性质(颗粒尺寸、表面纹理、矿物类型等)。实验中采用CaCl2溶液、NaCl溶液、去离子水及地表淡水等作为固定液,研究离子浓度对微生物在砂柱内分布的影响,如表2所示,实验发现,50mmol/L CaCl2溶液使微生物全部滞留在砂柱内,而经去离子水冲刷后的砂柱内几乎不存在微生物,由此可知,高离子浓度的冲刷液可以促进微生物在砂柱中的吸附,当离子浓度较低时,会使得原来吸附在固体颗粒表面上的微生物发生脱附而进入溶液中,有利于微生物在砂柱内的传输,减少由于微生物在注射口附近聚集而引发堵塞的发生。同时,循环注射可以有效补偿微生物分布不均问题。Harkes等[40]认为灌浆速率必须高于尿素在砂柱内的分解速率,而且每次灌浆间隔时间要足够长,以保证反应物即使在脲酶活性较低的阶段也完全转化完全,砂柱内碳酸钙的分布则相对均匀。
| No. | Fixation fluid | Injected bacteria/mL(OD/activity) | Flow rate/(mL·h-1) | OD retained/activity retained |
| 1 | 50mmol/L CaCl2 | 270(0.29/0.51) | 220 | 0.14/0.17 |
| 2 | 50mmol/L CaCl2 | 30(3.78/2.15) | 220 | 0.99/0.10 |
| 3 | 50mmol/L CaCl2 | 30(3.00/0.96) | 660 | 0.79/0.72 |
| 4 | Demineralised water | 30(4.04/2.20) | 220 | 0.00/0.00 |
| 5 | Fresh surface water | 30(3.44/1.64) | 220 | 0.36/0.74 |
| 6 | 9g/L NaCl | 30(3.51/2.06) | 220 | 0.92/0.93 |
Chu等[20]则研究了不同生物液(如细菌培养液、细菌悬浮液以及上清液等)对微生物诱导沉积碳酸钙的影响,实验发现,使用细菌悬浮液处理砂土1h后,有效细菌吸附率约为89%~100%,是上清液的5~8倍,而且上清液中含有蛋白酶,对砂体内的脲酶有不利作用。同时,还对砂体进行阳离子(Ca2+,Al3+,Fe3+等)预处理,使砂土颗粒表面正电荷位点数目增加,有效提高微生物的吸附量(增加29%~37%)。
Soga等[41, 42]通过控制胶结溶液浓度、反应停留时间以及有效注入速率等条件,提高巴氏芽孢杆菌(Sporosarcina Pasteurii)在砂柱内诱导沉积碳酸钙的效率。结果表明,当胶结液(尿素/氯化钙溶液)注入速率低于0.042mol/L/h时,碳酸钙沉积效率可达100%;而较高的注入速率会降低碳酸钙沉积效率,主要受尿素水解速率的影响。值得关注的是,在适宜流速下,胶结液浓度(0.1~1.0mol/L)对碳酸钙沉积量并不影响,但对孔隙尺度下碳酸钙的分布格局有显著影响,如图9所示[42],当浓度较低(0.25mol/L)时,碳酸钙晶体小且空间分布均匀;而浓度较高(0.5~1.0mol/L)时,碳酸钙尺寸较大且不均匀,呈空间随机分布,由此可知,在实际微生物灌浆时,无论从碳酸钙沉积效率,还是从碳酸钙分布均匀性问题上考虑,合理的灌浆速率是不容忽视的环节。
Tobler等[43]采用分段灌浆与并行灌浆两种灌浆方式对砂土进行加固处理。结果表明,同时注入菌液和胶结溶液会使碳酸钙分布不均匀,而且在注射口附近沉积,易造成堵塞现象;而菌液和胶结溶液依次注入后砂土内的碳酸钙分布较均匀,循环注射更有利于分布均匀性的提高。与前者相比,处理后砂土的孔隙率降低得更多,近54%。Barkouki等[44]则比较了间歇式与连续式两种注入方式下0.5m长的砂柱内碳酸钙沉积均匀性差异。实验中灌浆液由尿素/菌混合液与尿素/氯化钙混合液两部分组成,首先以10mL/min的流速从砂柱顶部向下注入尿素/菌混合液,然后从砂柱底部向上(反向)注入尿素/氯化钙混合液。其中连续式采用2mL/min的流速连续注入,而间歇式则以10mL/min的流速注入后停滞3h,两种方式下的总注入流量保持相同。结果表明,间歇式灌浆方式更有利于获得均匀分布的碳酸钙沉积。
Qian等[45]研究了不同灌浆条件对MICP胶结砂土的影响,结果表明,采用较低流速(5mL/min)注入菌液,使微生物更加均匀地分布于颗粒表面与颗粒间,而较高流速(10mL/min)注入尿素/氯化钙胶结溶液,可以避免碳酸钙在注射口处过早沉积而导致堵塞,最终砂柱的强度高达12.0MPa,高于压力成型和不连续无压成型等方式。
Zhao等[46]研究了细菌浓度、胶结液浓度、反应时间等因素对微生物砂体工程性能的影响。实验表明,微生物砂体强度随菌液浓度、胶结液浓度以及反应时间的增加而显著提高。同时,还比较了不同养护条件下的砂体强度,发现置于30℃空气自然干燥的砂体抗压强度最高,约为1.36MPa,当温度降至-18℃时,强度为1.29MPa,下降约5.14%,而湿度达100%时,砂体强度则损失约11.03%,说明养护条件对微生物砂土的工程性能影响有限。Soga等[42]研究发现胶结溶液浓度较高(如1mol/L)时,会导致局部堵塞,砂基的渗透性在处理早期急剧减弱,而低浓度胶结溶液处理后,砂基的渗透性下降缓慢均匀,且在相同碳酸钙含量下,其无侧限抗压强度更高。
钙源是微生物灌浆中的重要组成部分,其种类与浓度对MICP的影响也被广泛研究。荣辉[47]研究了溶解度较高的氯化钙,硝酸钙和溴化钙三种钙源,实验表明,随着钙源浓度的增加,生成的碳酸钙量呈现先增后减的趋势,在较高浓度的钙源中,Cl-,NO-3,Br-等阴离子浓度过高抑制了微生物的脲酶活性,产生CO2-3浓度较低,导致相同时间内生成的碳酸钙较少。比较三种阴离子可知,NO-3和Br-离子对微生物酶活性的抑制作用较强,使得诱导生成的碳酸钙低于氯化钙,因此从经济成本上考虑,建议使用氯化钙作为MICP的钙源。Abo-El-Enein等[48]研究表明,沉积碳酸钙晶体的尺寸、形貌以及结晶度等与钙源种类有关,且采用氯化钙作为钙源,碳酸钙的生成量及结晶度都高于醋酸钙和硝酸钙,其对应的力学性质(更高的抗压强度和更低的吸水率)最优。其中,NO-3离子对脲酶活性有明显的抑制作用。然而,Cheng等[49]发现,使用醋酸钙处理后砂土强度高达28.8MPa,比氯化钙和醋酸钙高出40%,且处理后砂土的最可几孔径尺寸较大(23μm),孔径分布更加均匀。
Burbank等[50]在利用土著微生物的尿素酶解作用处理砂土,原位培养微生物96h后,分次注入胶结溶液(每次间隔2~3d),处理后砂土内的碳酸钙含量约为20~48kg/m3,其静力触探锥尖阻力最大提高约2.2倍,说明土体的抗液化能力得到有效提高。圆锥贯入实验结果表明,与未处理砂土相比,微生物诱导沉积方解石可显著增大圆锥探针贯入时的阻力,且随处理次数的增加而增大;通过动三轴剪切实验发现,当砂土中生成方解石含量为3.8%~7.4%时,循环剪切应力与初始有效垂直应力的比值是未处理砂土的4.3~5.1倍[51, 52]。程晓辉等[53]利用MICP灌浆处理液化砂土,先将脲酶活性达17.33U的菌液注入砂柱,随即连续注入0.5mol/L尿素/氯化钙营养液。标准动三轴实验结果表明,固化砂样在液化应力比(Cyclic Stress Ratio,CSR)为0.45和0.4 时,能够抵抗十多次的加载才液化破坏,说明MICP 灌浆加固砂样的抗液化性能有大幅提高。同时,振动台模型实验结果表明,MICP 灌浆处理在中强震中抗液化能力较强,有效抑制了土层对地震波的放大作用。
Montoya等[54]利用土工离心模型实验研究了微生物胶结体对循环载荷的响应。结果发现,在不同离心加速度水平下,MICP砂基均降低动载荷作用下产生的超孔隙水压力,减少位移沉降,且有更高的地面峰值加速度。说明MICP处理能够提高循环载荷作用下砂基的强度与刚度,显著改善砂基可液化性能。同时还研究了单剪或动态剪切下胶结退化砂体性能的复原。在砂基已有微生物作用下,再次注入胶结溶液(尿素/氯化铵/氯化钙)可以恢复受损砂体的胶结性能。通过不排水单剪及离心实验发现,恢复后砂体可降低20%~60%的超孔隙水压力及55%的沉降位移,达到原有MICP胶结后砂基的力学性能。
Chu等[56]从不同气候带砂土中分离出3种耐盐嗜碱的产脲酶菌株,研究发现,其具有相似的形态和生理特性,且可用于微生物胶结砂土。当砂基内的含钙量约为12.4g/kg,其渗透系数下降至初始的1%,无侧限抗压强度约为454kPa。Stabnikov等[57]利用球形芽孢杆菌(Bacillus sp. VS1)在砂土表面形成具有防渗性的碳酸钙薄层,有效降低了砂土的渗透性,渗透系数由原来的10-4m/s降低为1.6×10-7m/s,同时其抗折强度达35.9MPa。Chu等[58]利用MICP可提高砂土强度及减少渗透性等特点,构建了48cm×38cm×20cm大小的水池模型(图10),水池内壁及底面的含钙量约为2.1kg/m2。砂基的渗透系数由10-4数量级下降至10-7数量级,无侧限抗压强度为215~93kPa,抗弯强度为90~256kPa。
Cheng等[59, 60]采用低压灌浆方式,通过降低胶结液浓度及多次灌浆等条件制备出高强度的微生物砂浆,其最大单轴抗压强度高达55MPa。通过劈裂实验,单轴压缩疲劳实验及循环载荷压缩实验发现,微生物砂浆的强度与耐久性能均优于普通混合砂浆。
为了进一步分析微生物灌浆处理过程,不少学者开始建立描述MICP过程的数学模型。Wijngaarden等[61]利用多孔材料中的对流-扩散方程,基于假设条件下推导出微生物化学反应过程中固液相主要成分的偏微分方程,建立了微生物灌浆模型。同时,利用伽辽金有限元法对一维、二维结构中微生物灌浆过程进行了模拟,并对恒定流体压力(压力驱动式)与恒定流速(流速驱动式)两种灌浆方式进行研究,结果表明,流速驱动式中碳酸钙沉积总量随时间呈线性增长,而压力驱动式呈现较均匀的碳酸钙分布。荣辉[47]采用平流-扩散方程、达西定律以及康采尼-卡曼(KC)方程等建立了微生物水泥胶结松散砂颗粒的数学模型。同时与灌浆10次的0.5m×0.5m×0.5m砂堆实验结果进行对比发现,砂体内碳酸钙含量及抗压强度分布的模拟值与实验值基本符合,这说明该模型的准确性较好(图11)。
Dejong等[62, 63]利用反应传输程序(TOUGHREACT)与反码耦合确定了动力学控制的尿素水解及碳酸钙沉淀的表观反应速率,这个速率是基于简化的反应动力学方程,将颗粒表面以及微生物只作为成核位点或晶体生长基底考虑,忽略其他具体作用。与长0.5m砂柱的胶结实验数据对比发现,该模型能够合理预测砂柱内碳酸钙沉淀、瞬时溶液的pH以及浓度(Ca2+,NH+4)的变化趋势。Fauriel等[64, 65]利用质量、动量守恒等宏观平衡方程、应力-应变本构方程建立了描述多孔介质中MICP过程的生物-化学-水力-力学耦合数学模型。通过有限元法,推导关于溶质的传输方程以及流动与平衡方程。同时,数值模拟平流前沿的扩展及方解石沉积,并得到了砂柱实验的验证。
上述MICP应用研究还仅局限于实验室条件,为推动MICP在岩土领域的规模化应用,Paassen等[66]开展了大尺度原位砂基灌浆加固实验研究,首先进行1m3砂堆实验,采用单点注入方式,以恒定流速从立方体砂堆中心依次注入菌液及胶结液,持续处理40d后砂体内沉积碳酸钙的平均含量为100kg/m3,砂体取样的单轴抗压强度最高为9MPa。同时,考察了注射口所在横截面处的碳酸钙分布,结果发现,在注射口附近及沿流动轴区域处沉积的碳酸钙含量较低,这是由于较快流速及较短水力停留时间所产生上述区域内细菌滞留量低导致的。而在砂堆下部角落区域碳酸钙含量较多,可达250kg/m3。在此基础上,进行了100m3大体积灌浆实验[67],设置三个注射井及三个抽水井,以同样组成的灌浆液连续处理16d后得到40m3清晰可见胶结砂体,外观呈楔形状(主要受诱导水文流场限制),其中平均碳酸钙沉积量为110kg/m3,取样试块的单轴抗压强度为0.7~12.4MPa,砂基平均剪切波速为300m/s。值得注意的是,胶结砂体上具有清晰可辨的流线(特别是靠近抽水井附近),且沿流线方向碳酸钙沉积分布相当均匀,而垂直流线方向碳酸钙含量变化显著。同时,利用原位地球物理勘测(剪切波速)和实验室岩土工程测试(无侧限抗压强度)评价胶结效果,得到砂基的剪切刚度处于同一数量级,说明两者均可用于评估处理砂基的胶结程度。
Paassen等[68]通过对100m3大体积砂基钻取样进行单轴、三轴抗压、巴西圆盘拉伸等实验,结果表明,砂基内碳酸钙含量、干容重以及不同围压下的强度值间具有较好相关性。微生物胶结砂体在低应变时,泊松比趋近于零,不同于自然土壤或岩石,主要是成岩机理上的差异。利用霍克-布朗破坏准则推算出砂基试样的摩擦角和黏聚力,微生物处理后砂基的黏聚力可达920kPa,摩擦角约50°,给出了工程设计中的重要参数。
3 结束语微生物水泥(MICP)在岩土工程领域有着广泛的应用前景,可用于软土路基加固、易液化砂土处理、边坡加固以及生物封堵等,且社会经济价值显著。然而,就目前MICP技术研究现状而言,仍存在一些亟需解决的问题。(1)对于MICP处理后砂土的工程性质(如强度、刚度、渗透性等)的研究比较深入,而其长期耐久性能未能得到相应的关注,仅有少数学者[22, 69]对MICP处理后砂土的抗酸性、抗冻性以及抗冲刷性等耐久性能进行了初步研究。实际环境状况的多样性与复杂性要求MICP技术必须具备相应的适应性。(2)对于大体积砂土的MICP处理而言,关键的难点在于如何有效解决砂体性能异质性问题。尽管许多学者针对砂体内的碳酸钙或微生物分布均匀性问题做了大量研究,也取得一定进展,但仅局限于小尺寸砂土实验。当微生物灌浆应用于实际的开放体系时,控制微生物活性原位分布及相应砂土工程性能将是更大的挑战。(3)目前MICP灌浆模型建立相对简单,尽管可以预测MICP处理砂土后的碳酸钙含量及相应砂土的力学行为,但对诸如小尺度下的生物化学过程(包括微生物生长、吸附-脱附、酶解过程等)、土壤孔隙及饱和度的局部变化以及土壤颗粒的空间变异性等问题考虑不足。(4)MICP技术的经济及环境可行性还待探讨。微生物灌浆大规模应用时可以考虑更加廉价的营养物质,如工业废水、乳糖母液及玉米浆[70, 71]等,从而降低经济成本。而尿素水解反应副产物-NH3/NH+4可能是MICP实际应用面临的一大挑战。
| [1] | DEJONG J T, MORTENSEN B M, MARTINEZ B C, et al. Bio-mediated soil improvement[J]. Ecological Engineering,2010,36(2):197-210. |
| [2] | KAROL R H. Chemical Grouting and Soil Stabilization, Revised and Expanded[M]. Boca Raton:CRC Press,2003. |
| [3] | 成虎林.水电工程化学灌浆对浆液扩散有效半径的控制方法[J].西北水电,2006,(1):33-34.CHENG Hu-lin. Chemical grouting to control effective diffusion radius of slurry in hydropower projects[J].Northwest Hydropower,2006,(1):33-34. |
| [4] | HAMMES F, VERSTRAETE W. Key roles of pH and calcium metabolism in microbial carbonate precipitation[J]. Reviews in Environmental Science and Biotechnology,2002,1(1):3-7. |
| [5] | HAMDAN N. Carbonate mineral precipitation for soil improvement through microbial denitrification.Tempe,Arizona State:Arizona State University,2013. |
| [6] | PAASSEN V L A, DAZA C M, STAAL M, et al. Potential soil reinforcement by biological denitrification[J]. Ecological Engineering,2010,36(2):168-175. |
| [7] | RODRIGUEZ N C, RODRIGUEZ G M, CHEKROUN K B, et al. Conservation of ornamental stone by Myxococcus xanthus-induced carbonate biomineralization[J]. Applied and Environmental Microbiology,2003,69(4):2182-2193. |
| [8] | CHEKROUN K B, RODRIGUEZ N C, GONZALEZ M M T, et al. Precipitation and growth morphology of calcium carbonate induced by Myxococcus xanthus: implications for recognition of bacterial carbonates[J]. Journal of Sedimentary Research,2004,74(6):868-876. |
| [9] | JIMENEZ-LOPEZ C, JROUNDI F, PASCOLINI C, et al. Consolidation of quarry calcarenite by calcium carbonate precipitation induced by bacteria activated among the microbiota inhabiting the stone[J]. International Biodeterioration & Biodegradation,2008,62(4):352-363. |
| [10] | DAVID T, WRIGHT, DAVID W. Precipitation of dolomite using sulphate-reducing bacteria from the Coorong region, South Australia: significance and implications[J]. Sedimentology, 2005,52(5):987-1008. |
| [11] | DAVID W, DAVID T W, ADRIAN J B. A stable isotope study of microbial dolomite formation in the Coorong region, South Australia[J]. Chemical Geology,2007,244(1-2):155-174. |
| [12] | JAHNS T. Ammonium/urea-dependent generation of a proton electrochemical potential and synthesis of ATP in Bacillus pasteurii[J]. Journal of Bacteriology,1996,178(2):403-409. |
| [13] | DOUGLAS S, BEVERIDGE T J. Mineral formation by bacteria in natural microbial communities[J]. FEMS Microbiol Ecol,1998,26(2):79-88. |
| [14] | BAUERLEIN E. Biomineralization of unicellular organisms: an unusual membrane biochemistry for the production of inorganic nano-and microstructures[J]. Angewandte Chemie International Edition,2003,42(6):614-641. |
| [15] | De MUYNCK W, De BELIE N, VERSTRAETE W. Microbial carbonate precipitation in construction materials: a review[J]. Ecological Engineering,2010,36(2):118-136. |
| [16] | DITTRICH M, KURZ P, WEHRLIL B. The role of autotrophic picocyanobacteria in calcite precipitation in an oligotrophic lake[J]. Geomicrobiology Journal,2004,21(1):45-53. |
| [17] | 荣辉,钱春香,李龙志. 微生物水泥胶结机理[J]. 硅酸盐学报,2013,41(3):314-319. RONG Hui,QIAN Chun-xiang,LI Long-zhi. Cementation mechanism of microbe cement[J]. Journal of the Chinese Ceramic Society,2013,41(3):314-319. |
| [18] | QIAN C, WANG R, CHENG L, et al. Theory of microbial carbonate precipitation and its application in restoration of cement-based materials defects[J]. Chinese Journal of Chemistry,2010,28(5):847-857. |
| [19] | MAHANTY B, KIM S, KIM C G. Assessment of a biostimulated or bioaugmented calcification system with Bacillus pasteurii in a simulated soil environment[J]. Microbial Ecology,2013,65(3):679-688. |
| [20] | CHU J, IVANOV V, NAEIMI M, et al. Optimization of calcium-based bioclogging and biocementation of sand[J]. Acta Geotechnica,2014,9(2):277-285. |
| [21] | CHENG L, CORD-RUWISCH R, MOHAMED A S. Cementation of sand soil by microbially induced calcite precipitation at various degrees of saturation[J]. Canadian Geotechnical Journal,2013,50(1):81-90. |
| [22] | 荣辉, 钱春香, 李龙志. 微生物水泥基材料的红外光谱研究[J]. 功能材料,2013,21(44):2741-2744. RONG Hui,QIAN Chun-xiang,LI Long-zhi. The study of microbe cementitious materials by FTIR spectroscopy[J]. Journal of Functional Materials,2013,21(44):2741-2744. |
| [23] | KANTZAS A, FERRIS F G, JHA K N, et al. A novel method of sand consolidation through bacteriogenic mineral plugging[A]. Proc of CIM Annual Technical Conference[C]. Calgary, Canada:Petroleum Society of Canada,1992. |
| [24] | FERRIS F G, SETEHMEIR L G. Bacteriogenic mineral plugging[P].USA Patent:664769,1992. |
| [25] | STOCKS F S, GALINAT J K, BANG S S. Microbiological precipitation of CaCO3[J]. Soil Biol Biochem,1999,31(11):1563-1571. |
| [26] | NEMATI M, VOORDOUW G. Modification of porous media permeability, using calcium carbonate produced enzymatically in situ[J]. Enzyme and Microbial Technology,2003,33(5):635-642. |
| [27] | NEMATI M, GREENE E A, VOORDOUW G. Permeability profile modification using bacterially formed calcium carbonate: comparison with enzymic option[J]. Process Biochemistry,2005,40(2):925-933. |
| [28] | WHIFFIN V S. Microbial CaCO3 precipitation for the production of biocement[D]. Western Australia:Murdoch University, 2004. |
| [29] | MCNALLY G H. Estimation of coal measures rock strength using sonic and neutron logs[J]. Geoexploration,1987,24(4/5):381-395. |
| [30] | WHIFFIN V S, VAN PAASSEN L A, HARKE M P. Microbial carbonate precipitation as a soil improvement technique[J]. Geomicrobiology Journal,2007,24(5):417-423. |
| [31] | AL-THAWADI S. High strength in-situ biocementation of soil by calcite precipitating locally isolated ureolytic bacteria[D]. Western Australia:Murdoch University,2008. |
| [32] | DEJONG J T, FRITZGES M B, NUSSLEIN K. Microbially induced cementation to control sand response to undrained shear[J]. Journal of Geotechnical and Geoenvironmental Engineering,2006,132(11):1381-1392. |
| [33] | MITCHELL J K, SANTAMARINA J C. Biological considerations in geotechnical engineering[J]. Journal of Geotechnical and Geoenvironmental Engineering,2005,131(10):1222-1233. |
| [34] | DEJONG J T, MARTINEZ B C, MORTENSEN B M, et al. Upscaling of bio-mediated soil improvement[A]. Proc 17th Int Conf on Soil Mechanics and Geotechnical Engineering[C]. Rotterdam,the Netherlands:Millpress Science Publishers,2009. |
| [35] | SOON N W, LEE L M, KHUN T C, et al. Improvements in engineering properties of soils through microbial-induced calcite precipitation[J]. KSCE Journal of Civil Engineering,2013,17(4):718-728. |
| [36] | LEE M L, NG W S, TANAKA Y. Stress-deformation and compressibility responses of bio-mediated residual soils[J]. Ecological Engineering,2013,60:142-149. |
| [37] | SOON N W, LEE L M, KHUN T C, et al. Factors affecting improvement in engineering properties of residual soil through microbial-induced calcite precipitation[J].Journal of Geotechnical and Geoenvironmental Engineering,2014,140(5):04014006. |
| [38] | CHENG L, CORD-RUWISCH R. In situ soil cementation with ureolytic bacteria by surface percolation[J]. Ecological Engineering,2012,42:64-72. |
| [39] | KIM D, PARK K, KIM D. Effects of ground conditions on microbial cementation in soils[J]. Materials,2013,7(1):143-156. |
| [40] | HARKES M P, VAN PAASSEN L A, BOOSTER J L, et al. Fixation and distribution of bacterial activity in sand to induce carbonate precipitation for ground reinforcement[J]. Ecological Engineering,2010,36(2):112-117. |
| [41] | QABANY A A, SOGA K, SANTANARINA C. Factors affecting efficiency of microbially induced calcite precipitation[J]. Journal of Geotechnical and Geoenvironmental Engineering,2011,138(8):992-1001. |
| [42] | QABANY A A, SOGA K. Effect of chemical treatment used in MICP on engineering properties of cemented soils[J]. Géotechnique,2013,63(4):331-339. |
| [43] | TOBLER D J, MACLACHLAN E, PHOENIX V R. Microbially mediated plugging of porous media and the impact of differing injection strategies[J].Ecological Engineering,2012,42:270-278. |
| [44] | BARKOUKI T H, MARTINEZ B C, MORTENSEN B M, et al. Forward and inverse bio-geochemical modeling of microbially induced calcite precipitation in half-meter column experiments[J]. Transport in Porous Media,2011,90(1):23-39. |
| [45] | RONG H, QIAN C X, LI L Z. Influence of molding process on mechanical properties of sandstone cemented by microbe cement[J].Construction and Building Materials,2012,28(1):238-243. |
| [46] | ZHAO Q, LI L, LI C, et al. Factors affecting improvement of engineering properties of MICP-treated soil catalyzed by bacteria and urease[J]. J Mater Civ Eng,2014,26(12):04014094.. |
| [47] | 荣辉.微生物水泥的研制及其胶结机理[D].南京:东南大学, 2014. RONG Hui. Preparation and binding mechanism of microbe cement[D]. Nanjing:Southeast University,2014. |
| [48] | ABO-EL-ENEIN S A, ALI A H, TALKHAN F N, et al. Utilization of microbial induced calcite precipitation for sand consolidation and mortar crack remediation[J]. HBRC Journal,2012,8(3):185-192. |
| [49] | ZHANG Y, GUO H X, CHENG X H. Influences of calcium sources on microbially induced carbonate precipitation in porous media[J]. Materials Research Innovations,2014,18(Suppl 2):79-84. |
| [50] | BURBANK M B, WEAVER T J, GREEN T L, et al. Precipitation of calcite by indigenous microorganisms to strengthen liquefiable soils[J].Geomicrobiology Journal,2011,28(4):301-312. |
| [51] | BURBANK M B, WEAVER T, LEWIS R, et al. Geotechnical tests of sands following bioinduced calcite precipitation catalyzed by indigenous bacteria[J]. Journal of Geotechnical and Geoenvironmental Engineering,2012,139(6):928-936. |
| [52] | CRAWFORD R L, BURBANK M B, WEAVER T J, et al. In situ precipitation of calcium carbonate (CaCO3) by indigenous microorganisms to improve mechanical properties of a geomaterial.USA Patent:8420362,2013-04-16. |
| [53] | 程晓辉, 麻强, 杨钻, 等. 微生物灌浆加固液化砂土地基的动力反应研究[J]. 岩土工程学报,2013,35(8):1486-1495. CHENG Xiao-hui, MA Qiang, YANG Zuan, et al. Dynamic response of liquefiable sand foundation improved by bio-grouting[J]. Chinese Journal of Geotechnical Engineering,2013,35(8):1486-1495. |
| [54] | MONTOYA B M, DEJONG J T, BOULANGER R W. Dynamic response of liquefiable sand improved by microbial-induced calcite precipitation[J]. Géotechnique,2013,63(4):302-312. |
| [55] | MONTOYA B M, DEJONG J T. Healing of biologically induced cemented sands[J].Géotechnique Letters,2013,3(3):147-151. |
| [56] | CHU J, STABNIKOV V, IVANOV V. Microbially induced calcium carbonate precipitation on surface or in the bulk of soil[J]. Geomicrobiology Journal,2012,29(6):544-549. |
| [57] | STABNIKOV V, NAEIMI M, IVANOV V, et al. Formation of water-impermeable crust on sand surface using biocement[J]. Cement and Concrete Research,2011,41(11):1143-1149. |
| [58] | CHU J, IVANOV V, STABNIKOV V, et al. Microbial method for construction of an aquaculture pond in sand[J]. Géotechnique,2013,63(10):871-875. |
| [59] | YANG Z, CHENG X. A performance study of high-strength microbial mortar produced by low pressure grouting for the reinforcement of deteriorated masonry structures[J]. Construction and Building Materials,2013,41:505-515. |
| [60] | CHENG X, WANG H, YANG Z. Experimental study on performance of high strength microbial mortar[J]. Materials Research Innovations,2014,18(Suppl 2):90-94. |
| [61] | WIJNGAARDEN V W K, VERMOLEN F J, MEURS V G A M, et al. Modelling biogrout: a new ground improvement method based on microbial-induced carbonate precipitation[J]. Transport in Porous Media,2011,87(2):397-420. |
| [62] | MARTINEZ B C, BARKOUKI T H, DEJONG J D, et al. Upscaling microbial induced calcite precipitation in 0.5m columns: experimental and modeling results[A]. Proc Geo-Frontiers 2011: Advances in Geotechnical Engineering[C]. Dallas,USA:ASCE,2011.4049-4059. |
| [63] | MARTINEZ B C, DEJONG J T, GINN T R. Bio-geochemical reactive transport modeling of microbial induced calcite precipitation to predict the treatment of sand in one-dimensional flow[J]. Computers and Geotechnics,2014,58:1-13. |
| [64] | FAURIEL S, LALOUI L. A bio-hydro-mechanical model for propagation of biogrout in soils[A]. Proc Geo-Frontiers 2011: Advances in Geotechnical Engineering[C]. Dallas,USA:ASCE, 2011.4041-4048. |
| [65] | FAURIEL S, LALOUI L. A bio-chemo-hydro-mechanical model for microbially induced calcite precipitation in soils[J]. Computers and Geotechnics,2012,46:104-120. |
| [66] | PAASSEN V L A, HARKES M P, ZWIETEN V G A, et al. Scale up of biogrout: a biological ground reinforcement method[A].Proceedings of the 17th International Conference on Soil Mechanics and Geotechnical Engineering[C]. Netherlands:IOS Press,2009.2328-2333. |
| [67] | PAASSEN V L A, GHOSE R, LINDEN V D, et al. Quantifying biomediated ground improvement by ureolysis: large-scale biogrout experiment[J]. Journal of Geotechnical and Geoenvironmental Engineering,2010,136(12):1721-1728. |
| [68] | PAASSEN V L A, PIERON M, MULDER A, et al. Strength and deformation of biologically cemented sandstone[A].Proceedings of the ISRM Regional Conference EUROCK[C]. London: Taylor & Francis Group,2009.405-410. |
| [69] | 荣辉, 钱春香, 王欣. 微生物水泥基材料抗冻性和抗冲刷性[J]. 功能材料,2014,45(11):11091-11095. RONG Hui,QIAN Chun-xiang,WANG Xin.Performance of microbe cementitious materials[J]. Journal of Functional Materials,2014,45(11):11091-11095. |
| [70] | ACHAL V, MUKHERJEE A, BASU P C, et al. Lactose mother liquor as an alternative nutrient source for microbial concrete production by Sporosarcina pasteurii[J]. Journal of Industrial Microbiology & Biotechnology,2009,36(3):433-438. |
| [71] | ACHAL V, MUKHERIEE A, REDDY M S. Effect of calcifying bacteria on permeation properties of concrete structures[J]. Journal of Industrial Microbiology & Biotechnology,2011,38(9):1229-1234. |