文章信息
- 韩全勇, 朱燕娟, 苗成成, 罗洁, 张伟, 赵腾起, 张春华. 2015.
- HAN Quan-yong, ZHU Yan-juan, MIAO Cheng-cheng, LUO Jie, ZHANG Wei, ZHAO Teng-qi, ZHANG Chun-hua. 2015.
- 阴离子(NO3-/Cl-/SO42-)对Ni(OH)2晶型及其结构稳定性的影响
- Effect of Anion(NO3-/Cl-/SO42-) on Crystal Type and Structural Stability of Ni(OH)2
- 材料工程, 43(8): 25-30
- Journal of Materials Engineering, 43(8): 25-30.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2015.08.005
-
文章历史
- 收稿日期:2014-05-09
- 修订日期:2014-12-09
2. 深圳豪鹏科技有限公司, 广东 深圳 516000
2. Shenzhen Haopeng Science & Technology Co., Ltd., Shenzhen 516000, Guangdong, China
Ni(OH)2作为镍氢电池的正极活性材料,对于提高镍氢电池的电化学性能起到关键作用[1]。Ni(OH)2具有α-Ni(OH)2和β-Ni(OH)2两种晶型,相对于β-Ni(OH)2的理论比容量286mAh·g-1,α-Ni(OH)2具有较高的理论比容量(482mAh·g-1)和较优异的电化学性能,但其结构在碱液中不稳定,该现象引起众多科学家的关注[2, 3, 4, 5]。Dixit等[6]研究了Zn取代形成Ni1-xZn2x(OH)2(CO3)x·nH2O水合物,与纯α-Ni-(OH)2具有类似的晶体结构,水合物的结构呈无序状,当Zn取代量大于25%(摩尔分数,下同)时所制得的样品在强碱环境下有较好的稳定性。张红兵等[7]认为,Al/Zn二元共同掺杂产生“晶格畸变互补效应”,使α-Ni(OH)2结构更稳定。Dai等[8]采用化学沉淀法合成结构为Ni1-xAlx(OH)2·(CO3)x/2·nH2O的Al取代α相纳米氢氧化镍,当取代量为20%时,产物为纯α-Ni(OH)2。Wu等[9]用化学共沉淀法制备了Mn3+替代 Ni2+的α-Ni(OH)2,镍电极电化学循环稳定性好,具有较高的析氧电位和质子扩散系数。
提高α-Ni(OH)2稳定性的原理是,掺杂的高电荷金属离子或稀土元素进入Ni(OH)2晶格部分取代Ni2+后,晶胞的正电荷过剩,库仑力的作用将吸引更多的阴离子嵌入NiO2层间,使层间距增大,从而形成α-Ni(OH)2,并保持晶相结构稳定。因此,阴离子和掺杂的阳离子一样,是影响α-Ni(OH)2结构的重要因素。本工作在单掺杂,二元掺杂和不掺杂三种情况下,以不同镍盐为原料,采用超声波辅助沉淀法[10]制备了多个系列Ni(OH)2样品,研究不同阴离子NO-3/Cl-/SO2-4对Ni(OH)2的晶型及其结构稳定性的影响。
1 实验 1.1 样品制备分别以硫酸镍、氯化镍、硝酸镍为镍源,以硫酸钴为掺杂原料,按摩尔比Ni2+:Co2+=1:0.20配料,配制浓度为0.2mol·L-1的镍盐溶液100mL,加入2%(质量分数)的吐温-80作分散剂。配制一定浓度的碱液100mL,添加3mL氨水和0.5g无水碳酸钠作缓冲剂。以并流滴加方式将上述两种溶液缓慢滴入装有300mL母液(去离子水)的反应容器中,反应容器置于功率60W、频率40kHz的超声波清洗仪振动腔内,并不断搅拌溶液,同时控制搅拌及滴加速率,保持反应温度(50±1)℃和pH=9.00±0.10稳定。待反应完全后,继续在超声波作用下搅拌5h,然后将反应液置入水浴锅陈化12h,经洗涤干燥制得纳米粉体,其样品标记为a1,b1,c1。在Ni2+:Co2+:Cu2+摩尔比为1:0.15:0.05的条件下,按上述相同步骤,分别制备出镍源为硫酸镍、氯化镍、硝酸镍的样品a2,b2,c2。在未掺杂情况下,以上述相同的条件和方法制备出三种不同镍源的样品,依次标记为a,b,c。
1.2 结构表征采用D/max-ⅢA全自动X射线衍射仪表征样品结构,Cu靶Kα为辐射源,波长为0.15406nm,工作电压为36kV,电流为20mA,扫描范围为7~70°,扫描速率为2(°)/s;采用Nicolet 6700傅里叶变换红外光谱仪表征样品晶型及所含阴离子成分,KBr压片,分辨率为4cm-1。
2 结果与讨论 2.1 阴离子对样品晶型的影响 2.1.1 阴离子对未掺杂样品晶型的影响图1是不同镍源在未掺杂情况下制备的各样品XRD图谱。可知,以氯化镍为镍源的样品b除了在衍射角2θ为19.1,33.3,38.5,52.2,59.3,62.8°出现了与β-Ni(OH)2标谱JCPDS74-2075一致的衍射峰外,还在16.5°处出现了叠加峰,该峰是α-Ni(OH)2在11.5°的特征峰和β-Ni(OH)2在19.1°的特征峰叠加的结果,表明样品b以β-Ni(OH)2晶相为主,但也含有少量的α-Ni(OH)2成分。样品a,c在2θ为11.5,34.3,60.1°出现了衍射峰,峰位与α-Ni(OH)2标谱JCPDS38-0715一致,同时在2θ为19.1,38.5,52.2°也出现了β-Ni(OH)2的特征峰,说明样品a,c均为α和β混合相氢氧化镍。由图1中还可以看出,样品a,c,b在19.1,38.5,52.2°的衍射峰峰强依次增强,说明β-Ni(OH)2比例依次增大,α-Ni(OH)2比例依次减少,其中硫酸镍为镍源的样品a中α-Ni(OH)2所含比例较高。阴离子(SO2-4,NO-3,Cl-)Stokes半径是依次减小的,即r(SO2-4)=0.230nm>r(NO-3)=0.129nm>r(Cl-)=0.121nm[11],可见,阴离子的半径大小对Ni(OH)2晶型结构有一定影响,半径较大的阴离子有利于α-Ni(OH)2生成。
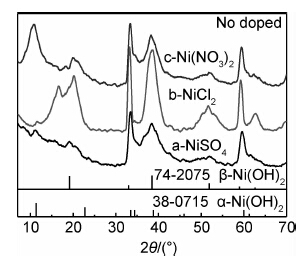 |
图 1 未掺杂情况下不同镍源制备的样品XRD图谱 Fig.1 XRD patterns of no doped samples with different nickel sources |
图2是样品a,b,c和样品d(β球镍,商用微米级β-Ni(OH)2)的傅里叶变换红外光谱图。可知,3446.6cm-1处为缔合羟基吸收峰,1630~1636cm-1处为水的面内弯曲振动吸收峰,这两个峰位为α-Ni-(OH)2的特征吸收峰,在3642.6cm-1附近为β-Ni-(OH)2的非氢键的游离羟基特征峰[12]。a,b,c三个样品在3446.6cm-1处的缔合羟基吸收峰峰强以a>c>b的顺序依次减弱,样品b在该处的峰强很弱,而在3642.6cm-1处的非氢键游离羟基吸收峰却很强,表明三个样品的α-Ni(OH)2含量以a>c>b的顺序依次减少,样品b主要以β-Ni(OH)2为主,这与图1的结果一致。
 |
图 2 未掺杂情况下不同镍源制备的样品FTIR图谱 Fig.2 FTIR spectra of no doped samples with different nickel sources |
图2中在619.8,1115.7cm-1附近的吸收峰是嵌入α-Ni(OH)2层间的SO2-4的振动吸收峰[13];在1384.3cm-1附近的吸收峰为NO-3的振动吸收峰[14]。样品a出现了两个SO2-4的振动吸收峰,样品c出现了NO-3的振动吸收峰,但样品b在该波数范围(400~4000cm-1)未出现Cl-的振动吸收峰,原因是NaCl等卤化物只有一种原子的阴离子和阳离子组成的化合物,在中红外区没有吸收谱带,在远红外区才出现晶格振动谱带[15]。由此表明,镍源中的阴离子SO2-4,NO-3能有效地嵌入NiO2层间,从而使a,c样品生成的α-Ni-(OH)2比例较高,而样品b在图1和图2中出现的α-Ni(OH)2特征峰很弱,这也表明了嵌入NiO2层间的Cl-很少。
可知,在未掺杂情况下,随着阴离子半径的增大,所制备的样品中α-Ni(OH)2含量增大,半径较大的阴离子SO2-4有利于α-Ni(OH)2的生成。
2.1.2 阴离子对Co掺杂样品晶型的影响图3是单元掺杂Co(Ni2+:Co2+=1:0.20)制备的样品a1,b1,c1的XRD图谱。可知,样品a1,b1在2θ为11.5,20.5,34.1,38.5,52.5,59.5,62.3°处均出现了衍射峰,样品c1在11.5,20.5,34.1,38.5,52.5,60.5°处出现了衍射峰,其中,11.5,34.1,60.5°处的衍射峰为α-Ni(OH)2特征峰,38.5,52.5,59.5,62.3°处的衍射峰是β-Ni(OH)2特征峰,20.5°处混合峰是由23°对应的α-Ni(OH)2特征衍射峰和19°对应的β-Ni(OH)2特征衍射峰叠加的结果,表明样品a1,b1,c1均为α和β相混合结构的氢氧化镍,其中样品a1,b1以β-Ni(OH)2为主,样品c1则是以α-Ni(OH)2为主。这说明在单掺杂Co的情况下,NO-3最有利于α-Ni(OH)2的形成。
 |
图 3 钴掺杂不同镍源制得的样品XRD图谱 Fig.3 XRD patterns of Co doped samples with different nickel sources |
上述阴离子的影响规律与2.1.1节未掺杂情况下的阴离子影响规律不一致,原因是Co掺杂后,部分Co2+以替位式取代Ni2+,另一部分Co2+则以间隙式嵌入NiO2层间,这部分嵌入层间的Co2+占据了Ni-(OH)2晶胞的相当大空间,从而不利于离子半径较大的SO2-4嵌入层间,而有利于离子半径较小的NO-3嵌入,正负离子嵌入层间使层间距增大,从而形成α-Ni-(OH)2,导致c1样品的α-Ni(OH)2比例远高于样品a1。对于样品b1,其镍源的阴离子Cl-半径比NO-3小,理论上更容易嵌入Ni(OH)2晶体层间,但小半径的Cl-电负性较大,一方面嵌入层间更容易,另一方面对Co2+的引力也比NO-3大,这样,溶液中大量的Cl-对Co2+的吸引,使嵌入层间的Co2+减少,导致样品b1的α-Ni(OH)2低于样品c1。由此可见,掺杂情况下,阴离子要与掺杂阳离子达到半径和电负性的匹配才能有利于α-Ni(OH)2的生成。
图4是样品a1,b1,c1及商用β球镍d的傅里叶变换红外光谱图。可知,前三个样品在1415cm-1处均出现了一定强度的振动吸收峰,此峰为CO2-3的振动吸收峰[16],表明源自缓冲剂的CO2-3已经嵌入各样品的晶体层间;样品c1在1384.3cm-1附近的相对吸收峰较强,说明有较多的NO-3嵌入层间;样品a1在1115.7cm-1附近出现了振动吸收峰,表明样品中有SO2-4嵌入。这三个样品在3642.6cm-1处的β-Ni-(OH)2非氢键游离羟基吸收峰峰强以b1> a1> c1的顺序依次减弱,在3446.6cm-1处c1的α-Ni(OH)2缔合羟基吸收峰最强,样品a1和b1峰强较弱,表明样品中α-Ni(OH)2比例以c1> a1> b1的顺序依次减少。这说明,在掺杂Co的情况下,阴离子NO-3有利于α-Ni(OH)2的形成,其次是SO2-4,Cl-相对较差。
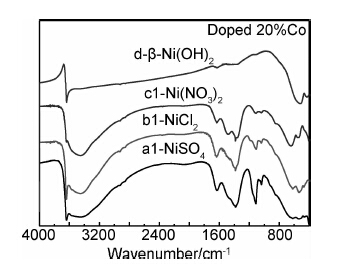 |
图 4 Co掺杂不同镍源制得的样品FTIR图谱 Fig.4 FTIR spectra of Co doped samples with different nickel sources |
共掺杂Co/Cu(Ni2+:Co2+:Cu2+=1:0.15:0.05)的情况下,以不同镍源制备的样品a2,b2,c2的XRD图谱如图5所示。三个样品在2θ为11.3,23.5,34.7,60.8°处均出现了α-Ni(OH)2特征衍射峰,说明样品a2,b2,c2均为α-Ni(OH)2结构。c2在11.3°处的衍射峰相对强度远远高于a2,b2,且半峰宽较窄,表明样品c2结晶度较高,而a2衍射峰明显宽化,特别是在2θ为11.3°和23.5°的衍射峰表现出与b2和c2的显著差别,表明样品a2的结晶度较差。
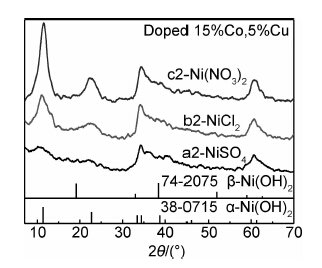 |
图 5 Co/Cu共掺杂不同镍源所得样品XRD图谱 Fig.5 XRD patterns of Co/Cu co-doped samples with different nickel sources |
图6为样品a2,b2,c2的傅里叶变换红外光谱图。可知,样品a2和样品b2,c2一样,只出现了α-Ni(OH)2特征吸收峰(3446cm-1和1630cm-1),前三个样品均未在3642.6cm-1处出现β-Ni(OH)2特征吸收峰,说明其均为α-Ni(OH)2结构,该结果与图5的结果一致。
 |
图 6 Co/Cu共掺杂不同镍源所得样品FTIR图谱 Fig.6 FTIR spectra of Co/Cu co-doped samples with different nickel sources |
值得注意的是,复合掺杂Co/Cu(Ni2+:Co2+:Cu2+=1:0.15:0.05)制备的三种镍源样品a2,b2,c2与单掺杂Co(Ni2+:Co2+=1:0.20)制备的三种镍源样品a1,b1,c1,虽然掺杂量相等,但同种镍源的a2与a1,b2与b1,c2与c1的晶相结构和结晶度都存在很大差异,说明样品的结构及结晶度不仅与掺杂元素有关,还与阴离子种类密切相关。只有当掺杂元素与阴离子半径及价态相匹配时,才能使阳离子与阴离子有效嵌入晶体NiO2层间而形成α-Ni(OH)2晶相并提高其结晶度。由2.1.2节和2.1.3节可知,在掺杂情况下,NO-3有利于α-Ni(OH)2生成并使晶体结晶度提高。
2.2 阴离子对α-Ni(OH)2结构稳定性的影响将Co掺杂样品a1,b1,c1和Co/Cu复合掺杂样品a2,b2,c2分别置于6.0mol·L-1KOH和0.35mol·L-1LiOH混合的电解液中浸泡三周,经过滤、洗涤、干燥,制得样品分别标记为a1-3,b1-3,c1-3和a2-3,b2-3,c2-3。将浸泡后的样品进行X射线衍射测试和傅里叶变换红外光谱测试,并与浸泡前的样品进行比较。
2.2.1 阴离子对Co掺杂样品结构稳定性的影响样品a1,b1,c1,a1-3,b1-3,c1-3的XRD图谱如图7所示。可知,以硫酸镍和氯化镍为镍源的混合相样品a1和b1,经碱液浸泡三周后变成了纯β相Ni(OH)2(a1-3和b1-3),因为在2θ为19.5,34.1,38.5,52.5,59.5,62.3°处出现了β-Ni(OH)2的所有特征峰。图8的红外吸收光谱也表明,样品a1-3和b1-3在波数为3446.6cm-1的α-Ni(OH)2缔合羟基特征峰峰强变得很弱,几近平坦,而在3642.6cm-1处β-Ni(OH)2的非氢键游离羟基吸收峰却明显强于样品a1和b1。因此,镍源为硫酸镍和氯化镍的样品a1和b1在碱液中的稳定性较差。
 |
图 7 Co掺杂样品浸泡前后的XRD图谱 Fig.7 XRD patterns of Co doped samples before and after being soaked |
由图7还可看出,镍源为硝酸镍的样品c1经碱液浸泡三周后,没有全部变成β-Ni(OH)2,而是仍然为混合相结构(c1-3),但c1-3在2θ为11.5,34.1,38.5°处的α-Ni(OH)2特征峰峰强比c1减弱,在19.1,52.5,59.3,62.3°处的β-Ni(OH)2的特征峰峰强增强。另外,样品c1-3在11.5°处的α相Ni(OH)2的第一特征峰和19.1°处的β相Ni(OH)2第一特征峰的峰强相当,由此可见,样品c1-3中α-Ni(OH)2比例和β-Ni(OH)2比例相近。这也表明样品c1经碱液浸泡三周后,虽然有一定量的α-Ni(OH)2晶型发生转变,但仍有接近50%的α-Ni(OH)2没有变相。
由图8可知,样品c1-3在3446.6cm-1处α-Ni-(OH)2的特征峰峰强明显比样品a1-3和b1-3强,而在波数3642.6cm-1处β-Ni(OH)2的特征峰峰强明显弱于a1-3和b1-3,该变化规律与图7一致。
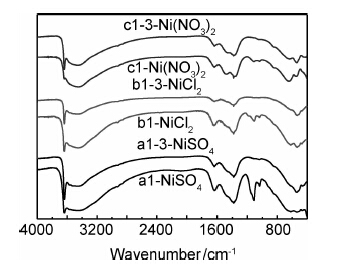 |
图 8 Co掺杂样品浸泡前后的FTIR图谱 Fig.8 FTIR spectra of Co doped samples before and after being soaked |
在单掺杂钴的情况下,相对于硫酸镍和氯化镍,以硝酸镍为镍源制备的样品c1稳定性较好,阴离子NO-3有利于α-Ni(OH)2形成和结构稳定。
2.2.2 阴离子对Co/Cu共掺杂样品结构稳定性的影响图9是样品a2,b2,c2和经碱液浸泡三周后的样品a2-3,b2-3,c2-3的XRD图谱。可知,a2-3在2θ为19.1,34.5,38.1,52.5,59.2,62.8°处出现了β-Ni(OH)2的所有特征衍射峰,表明样品a2(α-Ni(OH)2结构)经三周碱液浸泡后已全部转变成了β-Ni(OH)2,说明SO2-4不利于α-Ni(OH)2结构的稳定。
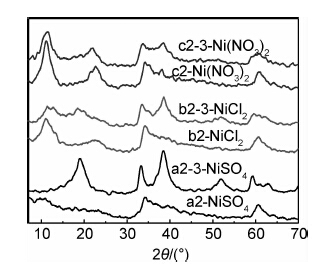 |
图 9 Co/Cu共掺杂样品浸泡前后的XRD图谱 Fig.9 XRD patterns of Co/Cu co-doped samples before and after being soaked |
图9的b2-3在11.5°出现的α-Ni(OH)2特征峰和在19.1°处出现的β-Ni(OH)2特征峰峰强相对强度相近,表明样品b2-3为混合相结构,且β-Ni(OH)2和α-Ni(OH)2的比例相差无几。因此,样品b2(α-Ni-(OH)2结构)经碱液浸泡三周后,约有50%比例的α-Ni(OH)2转变成了β-Ni(OH)2。
相对于a2-3和b2-3,c2-3在11.5°和59.5°处有较强的α-Ni(OH)2衍射峰出现,其21.8°的峰是由α-Ni(OH)2在19.1°的特征峰和β-Ni(OH)2在23.6°的特征峰的叠加而成的,表明样品c2-3为α-Ni(OH)2和β-Ni(OH)2混合结构,但以α-Ni(OH)2结构为主。图9中c2-3和c2(α-Ni(OH)2结构)各峰峰位基本一致(除21.8°峰以外),但c2-3表征α-Ni(OH)2结构的主要特征峰(11.5°衍射峰)峰强低于c2,表明样品c2经碱液浸泡后发生了少量的晶型转变。
在Co/Cu共掺杂情况下,以硝酸镍为镍源制备的纳米α-Ni(OH)2在碱液中的稳定性较高,氯化镍次之,硫酸镍较差。
图10是Co/Cu共掺杂样品浸泡前后的红外吸收光谱。可见,样品a2-3在3642.6cm-1处的吸收峰较强,此峰为β-Ni(OH)2的非氢键振动吸收峰,在3446.6cm-1处的吸收峰几乎消失,且没有出现SO2-4的振动吸收峰,表明样品a2-3为β-Ni(OH)2结构。此外,样品a2-3,b2-3,c2-3的非氢键振动吸收峰峰强依次减弱,而表征α-Ni(OH)2的缔合羟基吸收峰依次增强,其中样品b2-3在3642.6cm-1处和在3446.6cm-1处出现的吸收峰相对强度几乎相等,表明样品b2-3的α-Ni(OH)2和β-Ni(OH)2比例相近,而样品c2-3仍以α-Ni(OH)2为主,这与图9的XRD结果一致。
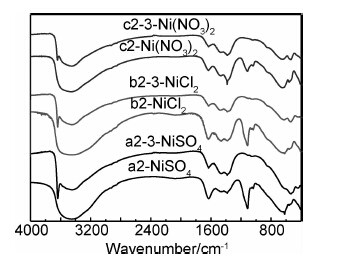 |
图 10 Co/Cu共掺杂样品浸泡前后的FTIR图谱 Fig.10 FTIR spectra of Co/Cu co-doped samples before and after being soaked |
图10中c2-3在1384.3cm-1处仍有NO-3的振动吸收峰,但峰强比c2稍弱,说明样品c2中α-Ni(OH)2晶胞内的层间阴离子NO-3经碱液浸泡后,大部分仍存在于氢氧化镍晶胞内,只有部分NO-3在碱液浸泡过程中被析出层间,这部分析出NO-3的晶胞转化成了β-Ni(OH)2晶相,没有析出层间NO-3的晶胞仍为α-Ni(OH)2晶相。
3 结论(1)在未掺杂情况下,半径较大的阴离子SO2-4有利于α-Ni(OH)2的形成。
(2)在单掺杂Co(Ni2+:Co2+=1:0.20)的情况下,阴离子NO-3不仅有利于α-Ni(OH)2的形成,且可以使α-Ni(OH)2在碱液中保持较高的稳定性。
(3)在共掺杂Co/Cu(Ni2+:Co2+:Cu2+=1:0.15:0.05)的情况下,三种镍源均可以制备出纯α-Ni(OH)2,但三种阴离子对α-Ni(OH)2结构稳定性的影响程度差异较大,以硝酸镍为镍源的α-Ni(OH)2在碱液中的结构稳定性较高,氯化镍次之,硫酸镍较差。
(4)α-Ni(OH)2晶型及其结构稳定性不仅与掺杂的金属离子有关,而且与阴离子种类密切相关。
| [1] | 刘长久,吴华斌,李延伟,等. La(Ⅲ)与Sr(Ⅱ)复合掺杂非晶态氢氧化镍电化学性能研究[J]. 材料工程,2008,(10):68-75.LIU Chang-jiu, WU Hua-bin, LI Yan-wei, et al. Investigations on electrochemical performance of La(Ⅲ) and Sr(Ⅱ) codoped amorphous nickel hydroxide[J]. Journal of Materials Engineering, 2008,(10):68-75. |
| [2] | JAYASHREE R S, VISHNU K P. Layered double hydroxides of Ni with Cr and Mn as candidate electrode materials for alkaline secondary cells[J]. Journal of Power Sources,2002,107(1):120-124. |
| [3] | 伍尚改,朱燕娟,张仲举,等. 超声波功率和pH值对Y掺杂纳米Ni(OH)2结构与性能的影响[J]. 材料工程,2011,(6):27-31.WU Shang-gai, ZHU Yan-juan, ZHANG Zhong-ju, et al. Effect of supersonic power and pH value on the structure and electrochemical performance of Y doped nano-Ni(OH)2[J]. Journal of Materials Engineering,2011,(6):27-31. |
| [4] | ZHANG H B, LIU H S, CAO X J, et al. Preparation and properties of the aluminum-substituted α-Ni(OH)2[J]. Materials Chemistry and Physics,2003,79(1):37-42. |
| [5] | BAO J, ZHU Y J, ZHANG Z J, et al. Structure and electrochemical properties of nanometer Cu substituted α-nickel hydroxide[J]. Materials Research Bulletin,2013,48(2):422-428. |
| [6] | DIXIT M, KAMATH P V, GOPALAKRISHNAN J. Zinc-substituted α-nickel hydroxide as an electrode material for alkaline secondary cells[J]. Journal of the Electrochemical Society, 1999,146(1):79-82. |
| [7] | 张红兵, 浦坦, 李道火. Al3+、Zn2+ 替代镍离子的纳米氢氧化镍电极材料[J]. 电源技术,2004,28(5):276-281. ZHANG Hong-bing, PU Tan, LI Dao-huo. Research on nanostructure Al3+,Zn2+ instituted Ni(OH)2 electrode materials[J]. Chinese Journal of Power Sources,2004,28(5):276-281. |
| [8] | DAI J X, LI SAM F Y, XIAO T D, et al. Structural stability of aluminum stabilized alpha nickel hydroxide as a positive electrode material for alkaline secondary batteries[J]. Journal of Power Sources,2000,89(1):40-45. |
| [9] | WU M Y, WANG J M, ZHANG J Q, et al. Structure and electrochemical performance of Mn-substituted nickel hydroxide[J]. Acta Physicochimica Sinica,2005,21(5):523-527. |
| [10] | ZHANG Z J, ZHU Y J, BAO J, et al. Electrochemical performance of multi-element doped α-nickel hydroxide prepared by supersonic co-precipitation method[J]. Journal of Alloys and Compounds,2011,509(25):7034-7037. |
| [11] | 许庆胜, 朱燕娟, 赵汝冬, 等. 制备条件对 Ni(OH)2 晶相的影响[J]. 人工晶体学报,2012,41(5):1232-1236. XU Qing-sheng, ZHU Yan-juan, ZHAO Ru-dong, et al. Effect of preparation conditions on the phase of Ni(OH)2[J]. Journal of Synthetic Crystals,2012,41(5):1232-1236. |
| [12] | LEE J W, CHOI W C, KIM J D. Size-controlled layered zinc hydroxide intercalated with dodecyl sulfate:effect of alcohol type on dodecyl sulfate template[J]. Cryst Eng Comm,2010,12(10):3249-3254. |
| [13] | SUN D, ZHANG J L, REN H J, et al. Influence of OH- and SO42- anions on morphologies of the nanosized nickel hydroxide[J]. The Journal of Physical Chemistry C,2010,114(28):12110-12116. |
| [14] | SONG X F, GAO L. Facile synthesis and hierarchical assembly of hollow nickel oxide architectures bearing enhanced photocatalytic properties[J]. The Journal of Physical Chemistry C,2008,112(39):15299-15305. |
| [15] | 翁诗甫. 傅里叶变换红外光谱仪[M]. 北京:化学工业出版社,2005.283-286. WENG Shi-fu. Fourier Transform Infrared Spectroscopy[M]. Beijing:Chemical Industry Press,2005.283-286. |
| [16] | KOAOVA N V, DEVYATKINA E T, KAICHEV V V. Mixed layered Ni-Mn-Co hydroxides:crystal structure, electronic state of ions,and thermal decomposition[J]. Journal of Power Sources,2007,174(2):735-740. |




