文章信息
- 林仕宏, 叶宝芳, 王永净
- LIN Shihong, YE Baofang, WANG Yongjing
- 疏水磁性碳酸钙的制备及其除油特性
- Preparation of hydrophobic magnetic calcium carbonate and its oil removal properties
- 材料工程, 2022, 50(1): 138-144
- Journal of Materials Engineering, 2022, 50(1): 138-144.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000079
-
文章历史
- 收稿日期: 2020-02-03
- 修订日期: 2021-10-15
2. 厦门大学 近海海洋环境科学国家重点实验室, 福建 厦门 361101
2. State Key Laboratory of Marine Environmental Science, Xiamen University, Xiamen 361101, Fujian, China
石油及其副产品为当今社会不可或缺的工业原料。然而石油在水路运输过程中发生的意外漏油事件给水体环境造成了巨大的威胁。针对这一问题,一般会使用吸附除油法作为海上溢油事故处理的应急对策。吸油材料的种类繁多,但其选择的主要依据是需要材料表面具有疏水亲油基团,以满足高效的油水分离需求。
目前最常见的吸油剂是疏水性能高的有机高分子类材料[1-3],例如各类天然纤维素,其价格低廉而且具有较好的亲油效果,但不足的是,这类材料的油水分离效率比较低,若不经过表面处理,其在吸油的同时还会吸入大量的水分,大大降低了处理效率。在高分子材料中,除了天然纤维素,还有人工合成的高分子材料例如聚苯乙烯或碳纳米管对除油具有一定的效果。此外,还有研究者对膜材料(例如PVDF膜)的除油性能进行了研究[4-6]。为了提高油水分离效率,常常需要使用表面改性的方法,让材料表面包覆憎水剂或者键合一些憎水基团[7]。而作为应急环境材料,其表面改性方法还需要满足无毒、易合成和价格低廉等要求。
天然的无机矿物一般为亲水材料,通常不会用来处理含油废水。但是近期的研究发现,将无机矿物表面改性后也可以获得良好的除油效果[8-11],其中方解石作为制备和加工方法较为成熟的传统无机材料,其在除油领域的潜在应用性受到了一些研究者的关注[12-13]。例如,Sarkar等[14]研究表明采用月桂酸原位合成改性的CaCO3,与水的接触角可达140°,此外,Sarkar等[15]还研究将油酸作为添加剂原位合成改性的CaCO3,其与水的接触角最大可达到155°;Hu等[16]以硬脂酸作为表面改性剂来包覆预成型的CaCO3颗粒表面,改性后的碳酸钙与水的接触角可达164°[17-18]。
虽然改性后的碳酸钙具有较高的吸油效率,但由于是粉体材料,其回收较为困难。如果能将碳酸钙与磁性颗粒有效复合,则有可能实现粉体在海域的回收。文献中有单独使用Fe3O4或与其他材料复合用于除油的报道[19-22]。对于Fe3O4和碳酸钙的复合材料的应用研究多为将其作为药物载体[23-24],而有关磁性CaCO3吸油材料的制备却少有报道,将其应用于除油领域的研究也较少。本工作以硬脂酸为疏水改性剂,采用共混法制备易收集的疏水磁性CaCO3,并将其负载在聚氨酯(PU) 海绵上,探讨其除油性能及水中磁性分离的性能。与其他同类成果比较,本工作所合成的磁性疏水CaCO3合成成本低廉,工艺简单,且对环境无毒无害,不易造成二次污染。通过磁性改性并负载在PU海绵上,增强了回收过程中实际操作的可行性。
1 实验材料与方法 1.1 原料和试剂六水合氯化铁(FeCl3·6H2O),七水合硫酸亚铁(FeSO4·7H2O),氨水(NH3·H2O), 硬脂酸(CH3(CH2)16COOH), 二水合柠檬酸钠(Na3C6H5O7·2H2O),苏丹红Ⅳ,正己烷(C6H14),碳酸钙(方解石,CaCO3)。以上试剂均为化学纯,购自天津市副晨化学试剂厂。
1.2 疏水磁性碳酸钙合成称取FeCl3·6H2O(13.5 g),与FeSO4·7H2O(8.34 g)一起溶于50 mL纯水中,滴加氨水调节溶液pH值至9,最后置于水浴锅加热溶液至80 ℃,持续搅拌30 min后,则生成泥状Fe3O4,用磁铁分离Fe3O4后,离心、洗涤备用。将1 g硬脂酸加入20 mL纯水中, 加热至约98 ℃溶解,备用。
Fe3O4分散于20 mL浓度为0.08 mol/L柠檬酸钠溶液,然后向分散液中加入方解石粉末,得到的悬浊液在约98 ℃加热条件下持续搅拌1 h。之后加入硬脂酸溶液,继续在100 ℃水浴锅中持续搅拌1 h。最后离心分离取水面疏水层再用磁铁分离,用乙醇和纯水反复清洗样品3遍后,在60 ℃下干燥12 h。按固体样品中总铁(TFe)、碳酸钙(CaCO3)和硬脂酸(Ste)的质量比不同分别得到样品HMC-1和HMC-2,其中,HMC-1的TFe∶CaCO3∶Ste质量比为0.172∶10∶1;HMC-2的TFe∶CaCO3∶Ste质量比为0.145∶2.5∶1。
1.3 改性PU海绵的制备裁剪2 cm×2 cm×0.5 cm市售PU海绵(孔径40~75 μm,壁厚8~12 μm,质量约80 mg),在纯水下超声清洗30 min。称取0.1 g HMC-2,倒入含有丙酮的50 mL离心管中,并置于超声机中均匀分散15 min,然后放入已清洗好的PU海绵,置于摇床中在300 r/min下震荡30 min后,取出已改性的PU海绵在室温下干燥24 h。
1.4 除油实验(1)含油模拟废水的制备:用量筒分别量取90 mL纯水及10 mL正己烷,正己烷投入少量的苏丹红Ⅳ染料染色。
(2)疏水磁性CaCO3除油实验:往含油模拟废水中投入与正己烷等质量的疏水磁性CaCO3后,用磁铁将除油剂与水分离。
(3)改性PU海绵除油实验:用量筒分别量取99 mL纯水及1 mL正己烷,正己烷投入少量的苏丹红Ⅳ染料染色,用改性PU海绵去除含油模拟废水中表面浮油,即海绵吸油后,挤出油。再循环吸附、挤出, 将挤出的油回收至烧杯中。
1.5 表征方法采用MiniFlex 600型X射线衍射仪(XRD)测定样品的晶型结构。采用supra 55 sapphire场发射扫描电镜(SEM)对样品的形貌进行表征。采用AVAT -AR 360型傅里叶变换红外光谱仪分析样品化学键及官能团。采用DSC214差示扫描量热仪对样品进行热重分析。水的接触角测试使用型号为OSA200的光学接触角/表界面张力测量仪,每个样品选取不同的5个测量点,测量水(液滴)在其表面的静态接触角,液滴下落30 s后读取接触角数值,液滴体积4 μL,取其平均值。
2 结果与分析 2.1 疏水磁性碳酸钙的结构表征本工作中所提及的疏水磁性碳酸钙HMC-1和HMC-2, 两者在合成上的主要差别在于复合材料中的Fe3O4,CaCO3和硬脂酸的配比不同,HMC-2中的CaCO3的用量较HMC-1有所降低。
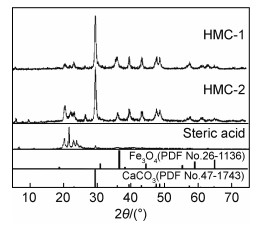
图 1为HMC-1和HMC-2的XRD图。可以明显看到方解石的衍射峰(PDF No.47-1743)。方解石的衍射略有宽化现象,说明方解石粉体中含有细颗粒。Fe3O4的最强衍射峰的位置在35.45°,由于与方解石(110)晶面衍射(35.9°)位置相近,并且Fe3O4为纳米颗粒,衍射峰强度较弱,因此Fe3O4的衍射峰并不明显。衍射角2θ在20°~30°区域内的衍射峰与硬脂酸的衍射峰相符,说明复合材料中的硬脂酸可能在Fe3O4或CaCO3表面形成包裹层,这个包裹层在材料洗涤过程中并未被有机溶剂去除。另外HMC-2中的硬脂酸衍射峰更强,这是由于合成时硬脂酸用量增加所导致的。
|
图 1 疏水磁性碳酸钙HMC-1和HMC-2的XRD谱图 Fig. 1 XRD patterns of the hydrophobic magnetic CaCO3 HMC-1 and HMC-2 |
利用扫描电子显微镜(SEM)可以进一步认识疏水磁性碳酸钙的微观结构。图 2为原料及合成后样品的微观结构。从图 2(a)可以看出原料CaCO3的尺寸分布不均,小颗粒的尺寸约为1 μm,大颗粒尺寸为5~10 μm。图 2(e)中合成的Fe3O4尺寸较小,SEM下观测为纳米团簇体。图 2(b)中HMC-1 CaCO3和Fe3O4的复合效果不理想。图 2(c),(d)为图 2(b)中所示位置的局部放大图。由图可见,CaCO3表面光滑,Fe3O4并没有均匀地负载在CaCO3表面,而是散落地形成了颗粒团聚体(图 2(c))。CaCO3表面可以观测到一层被硬脂酸包覆的膜(图 2(d)中的白色箭头所指之处)。相比而言图 2(f)中HMC-2里CaCO3与Fe3O4的复合更为均匀。由图 2(g)可以看到一些尺寸较大的CaCO3颗粒,其表面粗糙,并均匀负载着Fe3O4纳米颗粒。而对于小尺寸的CaCO3颗粒,硬脂酸可以将其完全包裹,在其表面形成一层褶皱层(图 2(h))。未观测到Fe3O4的颗粒聚集体,说明其可能均匀负载在碳酸钙表面,被硬脂酸包裹,由于硬脂酸层形成褶皱而不易观测。

|
图 2 原料与合成样品的SEM图 (a)原料方解石CaCO3;(b)HMC-1;(c)图(b)中c位置放大图;(d)图(b)中d位置放大图;(e)Fe3O4;(f)HMC-2;(g)负载着Fe3O4的CaCO3;(h)硬脂酸包覆的CaCO3 Fig. 2 SEM images of raw material and synthetic samples (a)raw material calcite CaCO3;(b)HMC-1;(c)enlarged view of position c in fig.(b);(d)enlarged view of position d in fig.(b);(e)Fe3O4;(f)HMC-2;(g)CaCO3 loaded with Fe3O4;(h)CaCO3 coated with stearic acid |
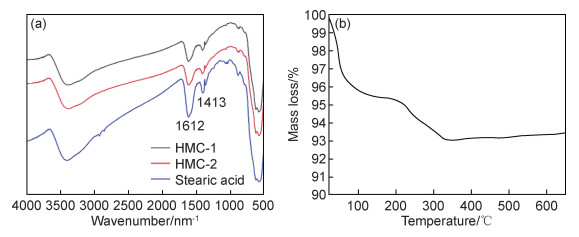
图 3为合成的疏水磁性碳酸钙FTIR光谱及热重分析曲线。如图 3(a)所示,整体上看HMC-1与HMC-2并无太大的差别。在波数为1612 nm-1处为羧酸盐离子的反对称伸缩振动吸收;在1413 nm-1处为羟基面内振动吸收,这两处吸收峰与硬脂酸的红外吸收峰相符。此外,还对HMC-2样品进行了热重分析。图 3(b)可以看出,在110 ℃前失重4.3%,主要是由于样品内水分的去除。样品在110~230 ℃范围内质量基本保持不变,说明其在230 ℃前较为稳定。在230~350 ℃范围内失重2.7%,这主要是由于硬脂酸的分解造成的。从侧面说明硬脂酸已经复合到样品中。在350~600 ℃范围内还未到达碳酸钙分解温度,质量基本保持不变。
|
图 3 疏水磁性碳酸钙HMC-1及HMC-2的FTIR光谱(a)及HMC-2样品TG曲线(b) Fig. 3 FTIR spectra of HMC-1 and HMC-2 (a) and TG curve of HMC-2 (b) |
通过测定材料表面与水滴的接触角可以判断其疏水性能。图 4显示了HMC-1和HMC-2与水的接触角。由图 4(a-1),(b-1)可见,在水滴落下30 s后HMC-1和HMC-2的接触角分别为148.4°和150.5°。接触角大于150°的材料为超疏水性材料[16],可见这两个样品均具有很好的疏水性能。但是进一步测量发现,当水滴在样品表面停留时间持续30 min后,两个样品的接触角表现出明显的差异,如图 4(a-2),(b-2)所示,HMC-1由原来的148.4°降低至92.8°,而HMC-2的接触角并未发生明显变化,仅从原来的150.5°降至149.7°。这说明HMC-2具有更稳定的疏水性能。从结构表征可以看出,HMC-1中硬脂酸对CaCO3和Fe3O4并没有形成完整的包覆层,从而导致其疏水性能不稳定;而HMC-2中硬脂酸与CaCO3和Fe3O4形成了较好的包覆,因此具有优越的疏水性。

|
图 4 HMC-1(a), HMC-2(b)在水滴落下30 s(1)以及30 min(2)与水的接触角示意图 Fig. 4 Schematic diagrams of the contact angle of HMC-1(a), HCM-2(b) with water dropping after 30 s (1) and after 30 min (2) |
以HMC-1和HMC-2作为除油剂,考察其对水中正己烷的去除效果。图 5为HMC-1及HMC-2除油并与水分离后的照片。将这两种除油材料投入水和正己烷的混合液中,两者都显示出较好的除油效果。其中HMC-1投入水中后,漂浮在油层,并且在磁力驱动下,油层自动团聚。用强磁铁增加磁场后,磁性CaCO3被吸引到烧杯壁上,并达到从水中分离的目的(图 5(a))。但分离后水中仍含有少量的黄色杂质,经检测,水中的总铁浓度为11.07 mg·L-1,占HMC-1中Fe含量的0.64%,而该材料中总铁与CaCO3的质量比为1.72∶100,说明CaCO3负载的Fe的量并非过量,而是因为其最外层的疏水层并未均匀包覆导致,进一步证明其疏水性能不稳定。

|
图 5 HMC-1(a)和HMC-2(b) 除油并与水分离后的图片 Fig. 5 Pictures of HMC-1 (a) and HMC-2 (b) after oil removal and separation from water |
相比而言,HMC-2在投入油水混合液之后,可以在1 s内迅速被油包覆,吸附速率比HMC-1高。另外,用磁铁将其和水分离后,得到的水无色透明(图 5(b)),经检测水溶液中无铁离子残留。说明HMC-2中的Fe3O4在CaCO3的内部形成较均匀的负载,并且在硬脂酸形成的保护层有效阻止了Fe3O4纳米颗粒在水中的分散。在HMC-2中,Fe3O4含量相较HMC-1增加明显,其疏水性能以及磁性能相较HMC-1提升较大,说明提升总铁含量对最终的除油效果有促进作用。
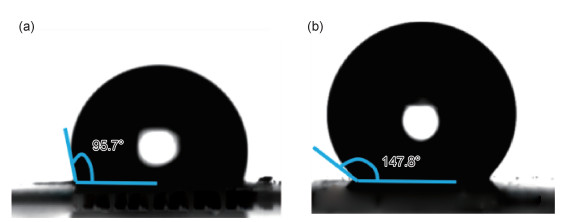
图 6为对除油实验后HMC-1和HMC-2与水的接触角示意图。结果表明除油后的HMC-1与水的接触角降至95.7°(图 6(a)),而HMC-2接触角依然可以达到147.8°(图 6(b)),说明HMC-2的疏水性能更加稳定。
|
图 6 除油实验后HMC-1(a)和HMC-2(b)与水的接触角示意图 Fig. 6 Schematic diagrams of contact angle of HMC-1 (a) and HMC-2 (b) after oil removal experiment |
上述实验证实,HMC-2是一种性能优良的便于收集的磁性除油材料,为了进一步提高其循环复用性能,将其与PU海绵结合,验证其重复利用的效果。同时与PU海绵负载后,可防止粉末因海风吹动而飘散[23]。以改性前的PU海绵做吸油的空白对照实验,结果表明其既可以吸水也可以吸油,不能实现油水分离。因为油是浮油,因此吸附的水和油的比例随着吸附的不同位置而不同,因此无法定性地描述其除油特性。PU海绵负载HMC-2以后,其磁性和除油效率得到了明显的改善。图 7为负载有HMC-2的PU海绵及吸油前后的溶液实物图。由图 7(a)可见,改性后的PU海绵可直接被强磁铁吸引,说明改性PU海绵具有磁性。图 7(b)为水和已染色油的混合液,将水滴和染色的油滴同时滴入功能性PU海绵,如图 7(c)所示,水滴(红色圈内)仍停留在PU海绵的表面,而油滴(白圈内)已溶入PU海绵内,说明其具有优越的疏水性能。将改性后的PU海绵用于吸油处理的循环实验表明,重复进行吸油处理20次后,油水分离效果很好,烧杯里为澄清的水,而玻璃皿中为回收的油类(图 7(d))。

|
图 7 负载有HMC-2的PU海绵及除油效果图 (a)HMC-2改性PU海绵被磁铁吸引的照片;(b)油水混合液;(c)改性后PU海绵被滴入油滴和水滴后的照片;(d)改性后PU海绵分离20次后油与水的分离液照片 Fig. 7 Photos of PU sponge loaded with HMC-2 and oil removal effect (a)HMC-1 modified PU sponge attracted by magnets;(b)oil-water mixed liquid;(c)oil drops and water drops being dropped into modified PU sponge;(d)oil and water separation liquid separated 20 times by modified PU sponge |
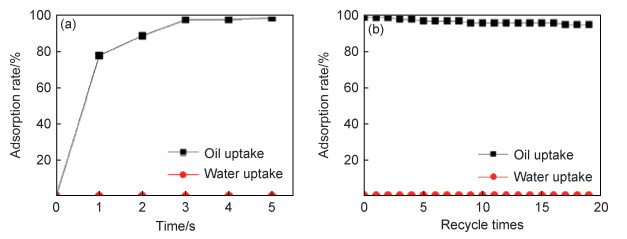
当PU海绵中有效除油剂的质量为0.1 g时,除去油的体积约为20 mL,约为13.2 g,吸油倍率(油质量/吸附剂质量)大于100,使用时只需将油从海绵中反复挤出便可。通过进一步水分平衡分析可知,被分离的油含水量极低,约0.1%(质量分数)。此外,改性后的PU海绵的吸油速率也非常快。图 8为改性PU海绵除油(水)率随时间变化曲线和循环复用除油率曲线。从图 8(a)可以看出,其在3 s内可去除98%的油,在5 s内去除率为99%。图 8(b)显示了改性PU海绵循环使用20次的油水分离率,其在循环使用20次后,仍能达到95%以上的除油率。由此可见,HMC-2改性后的PU海绵具有优异的循环使用性能。
|
图 8 改性PU海绵除油(水)率随时间变化(a)和循环复用除油率曲线(b) Fig. 8 Curves of oil(water) removal rate-time (a) and oil removal rate-recycle times (b) of modified PU sponge |
(1)以硬脂酸为疏水改性剂,将其与Fe3O4纳米颗粒和市售CaCO3共混,成功制备了均匀负载且吸油性能稳定的疏水磁性材料HMC-2。HMC-2具有稳定的水接触角,约为150°,并且可以磁性回收。除油后该材料没有出现类似HMC-1的铁渗出现象。
(2)将HMC-2负载在市售PU海绵上,改性PU海绵呈现出3个重要特征:疏水性、快速吸油和磁驱动自聚集,在3 s内可去除98%油水混合液中的油,99%的油在5 s内被除去,重复吸油20次仍能达到95%以上的除油率,吸油倍率大于100,具有较好的循环复用性能。
| [1] |
JOHNSON R F, MANJREKER T G, HALLIGAN J E. Removal of oil from water surfaces by sorption on unstructured fibers[J]. Environmental Science & Technology, 1973, 7(5): 439-443. |
| [2] |
DESCHAMPS G, CARUEL H, BORREDON M, et al. Oil removal from water by selective sorption on hydrophobic cotton fibers. 1. study of sorption properties and comparison with other cotton fiber-based sorbents[J]. Environmental Science & Technology, 2003, 37(5): 1013-1015. |
| [3] |
ZHU X, WANG X, LIU Y, et al. Efficient adsorption of oil in water by hydrophobic nonwoven fabrics coated with cross-linked polydivinylbenzene fibers[J]. Journal of Chemical Technology & Biotechnology, 2019, 94(1): 128-135. |
| [4] |
KONG J, LI K. Oil removal from oil-in-water emulsions using PVDF membranes[J]. Separation and Purification Technology, 1999, 16(1): 83-93. DOI:10.1016/S1383-5866(98)00114-2 |
| [5] |
KAYVANI F A, RHADFI T, MCKAY G, et al. Enhancing oil removal from water using ferric oxide nanoparticles doped carbon nanotubes adsorbents[J]. Chemical Engineering Journal, 2016, 293: 90-101. DOI:10.1016/j.cej.2016.02.040 |
| [6] |
WANG G, YU B, CHEN S, et al. Template-free synthesis of polystyrene monoliths for the removal of oil-in-water emulsion[J]. Scientific Reports, 2017, 7(1): 6534. DOI:10.1038/s41598-017-06572-7 |
| [7] |
WANG J, ZHENG Y, WANG A. Superhydrophobic kapok fiber oil-absorbent: preparation and high oil absorbency[J]. Chemical Engineering Journal, 2012, 213: 1-7. DOI:10.1016/j.cej.2012.09.116 |
| [8] |
WANG J, ZHENG Y, KANG Y, et al. Investigation of oil sorption capability of PBMA/SiO2 coated kapok fiber[J]. Chemical Engineering Journal, 2013, 223: 632-637. DOI:10.1016/j.cej.2013.03.007 |
| [9] |
YUAN D, ZHANG T, GUO Q, et al. A novel hierarchical holl-ow SiO2@MnO2 cubes reinforced elastic polyurethane foam for the highly efficient removal of oil from water[J]. Chemical Engineering Journal, 2017, 327: 539-547. DOI:10.1016/j.cej.2017.06.144 |
| [10] |
GUO F, WEN Q, PENG Y, et al. Multifunctional hollow super-hydrophobic SiO2 microspheres with robust and self-cleaning and separation of oil/water emulsions properties[J]. Journal of Colloid and Interface Science, 2017, 494: 54-63. DOI:10.1016/j.jcis.2017.01.070 |
| [11] |
LI Z, SHI T, ZHANG T, et al. Hierarchical Al2O3/SiO2 fiber membrane with reversible wettability for on-demand oil/water separation[J]. Korean Journal of Chemical Engineering, 2019, 36(1): 92-100. DOI:10.1007/s11814-018-0183-9 |
| [12] |
ZHANG Y, CUI H, YI W, et al. Highly effective decarboxylation of the carboxylic acids in fast pyrolysis oil of rice husk towards ketones using CaCO3 as a recyclable agent[J]. Biomass and Bioenergy, 2017, 102: 13-22. DOI:10.1016/j.biombioe.2017.04.004 |
| [13] |
MELBIAH J S B, NITHYA D, MOHAN D. Surface modification of polyacrylonitrile ultrafiltration membranes using amphiphilic pluronic F127/CaCO3 nanoparticles for oil/water emulsion separation[J]. Colloids and Surfaces, 2017, 516: 147-160. DOI:10.1016/j.colsurfa.2016.12.008 |
| [14] |
SARKAR A, GHOSH K A, MAHAPATRA S. Lauric acid triggered in situ surface modification and phase selectivity of calcium carbonate: its application as an oil sorbent[J]. Journal of Materials Chemistry, 2012, 22(22): 11113-11120. DOI:10.1039/c2jm30778b |
| [15] |
SARKAR A, MAHAPATRA S. Novel hydrophobic vaterite particles for oil removal and recovery[J]. Journal of Materials Chemistry A, 2014, 2(11): 3808. DOI:10.1039/c3ta14450j |
| [16] |
HU Z, DENG Y. Superhydrophobic surface fabricated from fatty acid-modified precipitated calcium carbonate[J]. Industrial & Engineering Chemistry Research, 2010, 49(12): 5625-5630. |
| [17] |
ARBATAN T, FANG X, SHEN W. Superhydrophobic and oleophilic calcium carbonate powder as a selective oil sorbent with potential use in oil spill clean-ups[J]. Chemical Engineering Journal, 2011, 166(2): 787-791. DOI:10.1016/j.cej.2010.11.015 |
| [18] |
MANOJ P, KHANINDRA P, RAJAKUMAR A. A facile prepa-ration of superhydrophobic and oleophilic precipitated calcium carbonate sorbent powder for oil spill clean-ups from water and land surfaces[J]. RSC Advances, 2015, 5(97): 79852-79859. DOI:10.1039/C5RA13847G |
| [19] |
WU L, LI L, LI B, et al. Magnetic, durable, and superhydrophobic polyurethane@Fe3O4@SiO2@fluoropolymer sponges for selective oil absorption and oil/water separation[J]. ACS App-lied Materials & Interfaces, 2015, 7(8): 4936-4946. |
| [20] |
YU L, HAO G, GU J, et al. Fe3O4/PS magnetic nanoparticles: synthesis, characterization and their application as sorbents of oil from waste water[J]. Journal of Magnetism and Magnetic Materials, 2015, 394: 14-21. DOI:10.1016/j.jmmm.2015.06.045 |
| [21] |
ZHU L, LI C, WANG J, et al. A simple method to synthesize modified Fe3O4 for the removal of organic pollutants on water surface[J]. Applied Surface Science, 2012, 258(17): 6326-6330. DOI:10.1016/j.apsusc.2012.03.031 |
| [22] |
ZHANG D, TONG Z, LI S, et al. Fabrication and characterization of hollow Fe3O4 nanospheres in a microemulsion[J]. Materials Letters, 2008, 62(24): 4053-4055. DOI:10.1016/j.matlet.2008.05.023 |
| [23] |
SEROV N, PRILEPSKII A, SOKOLOV A, et al. Synthesis of plasmin-loaded Fe3O4@CaCO3nanoparticles: towards next-gene-ration thrombolytic drugs[J]. ChemNanoMat, 2019, 5(10): 1267-1271. DOI:10.1002/cnma.201900359 |
| [24] |
ZHAO Y, LU Y, HU Y, et al. Synthesis of superparamagnetic CaCO3 mesocrystals for multistage delivery in cancer therapy[J]. Small, 2010, 6(21): 2436-2442. DOI:10.1002/smll.201000903 |
 2022, Vol. 50
2022, Vol. 50


