文章信息
- 王裕超, 李倩, 曾坚, 唐帅豪, 郑焕然, 许梁, 陈志彦, 雷永鹏
- WANG Yuchao, LI Qian, ZENG Jian, TANG Shuaihao, ZHENG Huanran, XU Liang, CHEN Zhiyan, LEI Yongpeng
- 超薄材料电催化CO2还原合成液体燃料
- Ultra-thin materials for electrocatalytic CO2 reduction to prepare liquid fuels
- 材料工程, 2022, 50(1): 56-66
- Journal of Materials Engineering, 2022, 50(1): 56-66.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2021.000191
-
文章历史
- 收稿日期: 2021-03-14
- 修订日期: 2021-11-02
2. 中南大学 粉末冶金国家重点实验室, 长沙 410083;
3. 江西理工大学 能源与机械工程学院, 南昌 330013
2. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China;
3. School of Energy and Mechanical Engineering, Jiangxi University of Science and Technology, Nanchang 330013, China
近些年,工业文明的发展消耗了过量的化石燃料,造成大量CO2的排放,由此带来了温室效应和能源短缺等问题,不利于社会的可持续发展。电催化二氧化碳还原反应(CO2RR)提供了一种有效的解决方案[1]。利用清洁电能(风能、太阳能、潮汐能等转化的电能)在室温下驱动CO2分子的还原,可以得到各种高价值的含碳燃料,如一碳产物(CO,CH4,HCOO-)、二碳产物(C2H4,CH3CH2OH)、三碳产物(CH3COCH3)等,前景广阔[2-3]。然而,电催化CO2RR的研究面临着诸多挑战。首先,CO2RR涉及多个电子的转移和质子的偶合,反应动力学迟缓,需要施加较高的过电位[4];其次,CO2RR目前多在水系溶液中进行,反应过程中伴随着H2析出反应(HER),极大降低了反应选择性,而且水溶液中CO2分子的溶解度很小,反应的电流密度低[5];此外,CO2RR对催化剂的选择有依赖性,不同金属电极的还原产物差异巨大[6]。为了提高CO2RR的产率和选择性,研究者们开发了一系列的催化剂,如Cu基材料还原CO2制备多碳产物、主族金属及其化合物产HCOOH、贵金属/单原子催化剂产CO等[7]。
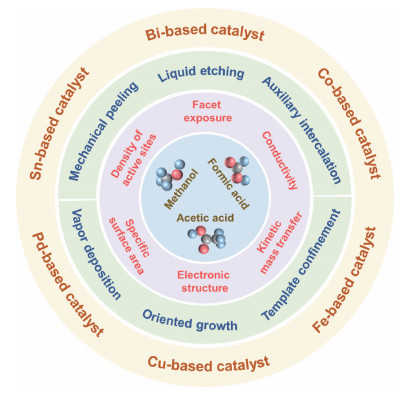
二维超薄纳米材料是指一个维度在纳米尺度的材料,其厚度在原子/分子级水平,导致材料的比表面积增大、表面裸露的原子数目增加、物理化学性能发生变化[8]。将超薄材料应用到电催化CO2RR中可以发挥其独特的物理、化学、电学特性。大的比表面积有利于扩大电极材料和电解液的接触面积并提高活性位点数目,增强的扩散行为将会促进电子传递和反应物分子迁移,最终提高CO2RR的反应速率[9]。因此,本文以不同的液相还原产物为导向,包括甲酸、甲醇和乙酸(图 1),系统介绍了超薄材料在电催化CO2RR中的应用,指出超薄催化剂相较于块体催化剂的优势,并总结了目前CO2RR的发展水平,提出一些未来发展建议。
|
图 1 用于电催化CO2RR超薄催化剂的种类、合成、优势及其液体产物 Fig. 1 Types, synthesis, advantages and liquid products of ultra-thin catalysts for electrocatalytic CO2RR |
2004年,Geim等用机械剥离法首次从石墨中剥离出二维石墨烯[10]。随后,超薄纳米材料的种类不断拓展,主要可分为两大类。其中一类包括石墨烯及其衍生物、过渡金属硫化物、层状金属氢氧化物/氧化物和金属碳氮化物等,它们都具有类似的层状结构[11];另一类超薄材料包括非层状的金属有机骨架、共价有机骨架、聚合物等。虽然这些材料原子的结合方式和空间分布各不相同,但是都具有超薄的结构特征,暴露出高比例的表面原子。表面裸露的原子具有不饱和的配位结构,不仅可以充当反应活性位点[12],而且有利于对超薄材料进行改性,实现原子尺度的电子结构调控以及性能优化[13]。比如,引入杂原子可以诱导材料内部的电子转移,提高活性位点的本征活性[14];诱导缺陷可以暴露更多的反应吸附位点,提高活性位点密度[15];构造合金或异质结能够实现不同组分间的协同,增强催化活性[16]。而且,超薄材料还可以作为载体,大的比表面积有利于提高活性组分的负载量,超薄的特征有助于载流子的传输,提高材料导电性[17]。
1.2 超薄材料的制备随着超薄材料种类的增多,新的合成方法也不断出现并完善[18]。总体来看,超薄材料的制备手段包括自上而下和自下而上的策略,这些方法各有优缺点及其适用场合,实现超薄材料大批量的制备仍具挑战性。
自上而下的策略是指利用机械剥离、液相剥离等方法,将三维的体相材料剥离为单层或多层的二维超薄材料。该方法适用的前提是体相材料具有层状结构,通过施加外力破坏层与层之间的弱相互作用,得到超薄的纳米片层[19]。机械剥离法具有操作简单、条件温和的优点,但制备效率低,不利于大规模的应用。液相剥离是将待刻蚀的材料分散于溶剂中,施加超声、搅拌、加热等操作实现材料的裂解和降维。为了提高剥离的效率,溶剂中往往会添加一定浓度的插层剂来减弱层间相互作用。液相剥离所需技术、设备简单,剥离速度较快,但是针对非层状超薄材料的制备暴露出局限性。
自下而上的策略包括化学气相沉积(CVD)、小分子/有机配体辅助的定向生长、模板限域等方法[20-21]。CVD技术控制小分子均匀沉积在衬底表面,生产效率高、可控性强,但是需要昂贵的设备,能耗和成本较高。小分子辅助的定向生长法适用于非层状超薄材料的合成,CO,H2O2和卤素离子等选择性地吸附在晶体的特定晶面上,抑制该方向上晶体的外延,实现二维化生长。有机配体辅助法则是利用有机配体和金属离子间的配位效应,直接调控二维纳米晶的各向异性生长,堆积成具有超薄特征的络合物前驱体。模板限域法是指在基底的表面或夹层中原位生长超薄材料[22],该方法制备的超薄材料尺寸、结构不易调控,而且面临着基底的分离难题。此外,拓扑转化可实现不同超薄材料间的转化,也是一种有效策略[23]。
2 超薄材料电催化CO2RR产液体燃料迄今为止,超薄纳米材料在电催化CO2RR领域已经取得了一些进展[24-26],表 1[27-48]总结了近4年里用来制取液体燃料的超薄催化剂,并列举了不同催化剂的主要还原产物、最大法拉第效率(FE)、电流密度以及工作稳定性(若无特别说明,文中涉及电位均为相对于可逆氢电极(RHE)的电位)。可以看出,目前大部分超薄材料的液体还原产物是甲酸,主要通过主族的Bi,Sn基化合物或Co基材料还原CO2合成,并实现了较高的催化选择性。相较而言,深度还原产物(甲醇)或多碳产物(乙酸)的研究较少,且面临着选择性差、电流密度低等问题。另外,目前用于CO2RR的催化剂稳定工作时间普遍较短,严重阻碍了其工业化生产[49],需要着重关注。
| Catalyst | Product | Electrolyte | FE/% | Current density/(mA·cm-2) | Stability | Reference |
| N-Sn(S) | Formate | 0.1 mol·L-1 KHCO3 (flow cell) | 93.3(-0.7 V) | ≈30(-0.7 V) | 20 h | [27] |
| Bi2O3-NGQDs | Formate | 0.5 mol·L-1 KHCO3 | ≈100(-0.9V) | ≈16(-0.9V) | 15 h | [28] |
| Bi nanosheets | Formate | 0.1 mol·L-1 KHCO3 | 86.0(-1.1 V) | 14.2(-1.1 V) | 10 h | [29] |
| Bi nanoflake | Formate | 0.1 mol·L-1 KHCO3 | ≈100(-0.6 V) | ≈20.2(-0.6 V) | 10 h | [30] |
| BiNS | Formate | 0.5 mol·L-1 NaHCO3 | ≈100(-1.05 V) | ≈22(-1.05 V) | 10 h | [31] |
| BiOBr | Formate | 0.1 mol·L-1 KHCO3 | >99(-0.95 V) | ≈60(-0.95 V) | 65 h | [32] |
| Bismuthene | Formate | 0.5 mol·L-1KHCO3 | 99(-0.58 V) | ≈15(-0.58 V) | 75 h | [33] |
| Bi-ene | Formate | 0.5 mol·L-1 KHCO3 | >97(-1.18 V) | 72.04(-1.18 V) | 12 h | [34] |
| SnS NSs | Formate | 0.5 mol·L-1 KHCO3 | 82.1(-1.1 V) | 18.9(-1.1 V) | 10 h | [35] |
| SnOx nanoflake | Formate | 0.5 mol·L-1 KHCO3 | 90.8(-1.37 V) | 40.9(-1.37 V) | 10 h | [36] |
| mp-SnO2 | Formate | 0.5 mol·L-1 NaHCO3 | 83(-0.9 V) | ≈14(-0.9 V) | 12 h | [37] |
| 5%Ni-SnS2 | Formate | 0.1 mol·L-1 KHCO3 | 80(-0.9 V) | 15.7(-0.9 V) | 8 h | [38] |
| SnS2/rGO | Formate | 0.5 mol·L-1 NaHCO3 | 84.5(-0.75 V) | 11.7(-0.75 V) | 14 h | [39] |
| Sn quantum sheets | Formate | 0.1 mol·L-1 NaHCO3 | 89(-1.15 V) | 18.8(-1.15 V) | 50 h | [40] |
| Single atom Snδ+ | Formate | 0.25 mol·L-1 KHCO3 | 74.3(-0.95 V) | 8.7(-0.95 V) | 200 h | [41] |
| SbNS-G | Formate | 0.5 mol·L-1 NaHCO3 | 88.5(-0.96 V) | ≈7.5(-0.96V) | 12 h | [42] |
| Co3O4 layers | Formate | 0.1 mol·L-1 KHCO3 | 64.3(-0.23 V) | ≈0.4(-0.23 V) | 20 h | [43] |
| Partially oxidized Co | Formate | 0.1 mol·L-1 Na2SO4 | 90.1(-0.2 V) | 9.5(-0.2 V) | 40 h | [44] |
| VO-rich Co3O4 | Formate | 0.1 mol·L-1 KHCO3 | 87.6(-0.22 V) | 2.4(-0.22 V) | 40 h | [45] |
| Pd/SnO2 NSs | Methanol | 0.1 mol·L-1 NaHCO3 | 54.8(-0.24 V) | ≈0.8(-0.24 V) | 24 h | [46] |
| Fe2P2S6 nanosheet | Methanol | 0.5mol·L-1 KHCO3 | 65.2(-0.2 V) | ≈0.2(-0.2 V) | 30 h | [47] |
| Cu nanosheets | Acetic acid | 2 mol·L-1 KOH (flow cell) | 48(-0.74 V) | 131(-0.74 V) | 3 h | [48] |
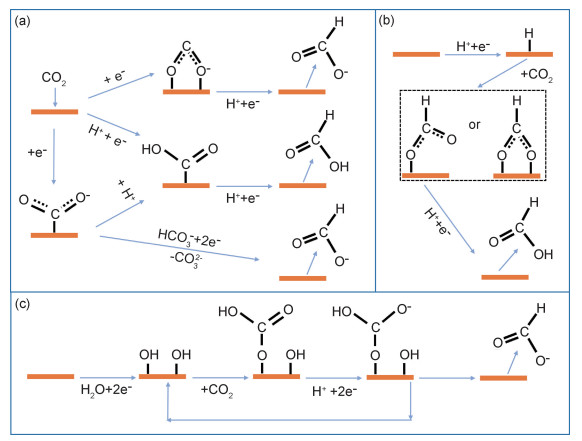
甲酸是一种重要的工业原料,可作为燃料电池的燃料,工业生产/有机合成的原料等[36]。电催化CO2RR制取甲酸涉及两个电子的转移,由于CO2分子在活性位点上吸附方式的不同可导致不同的反应路径[27, 50],其中几条典型的甲酸生成路径如图 2所示[25]。常见CO2RR产甲酸的金属电极有Pb,Hg,Cd,Sn,Bi等,考虑到重金属的毒性和环境破化性,廉价且无毒的主族金属产甲酸更为可行[28]。
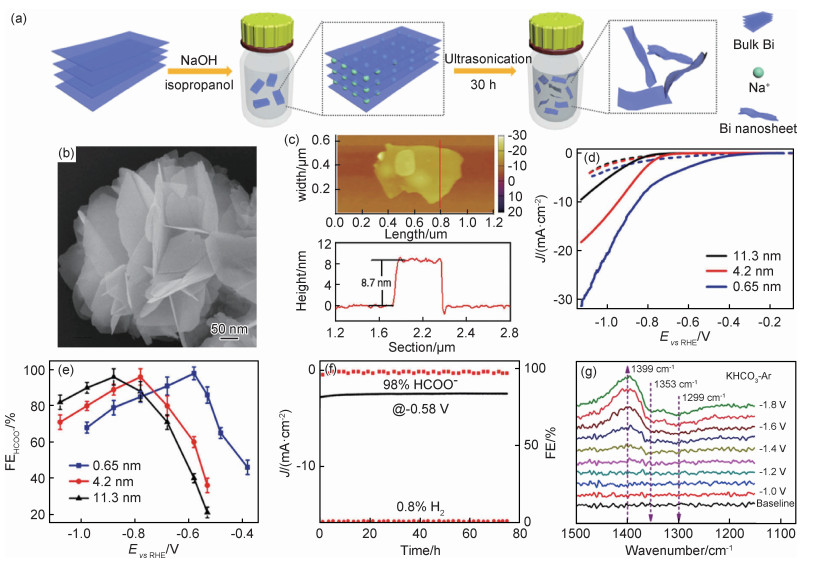
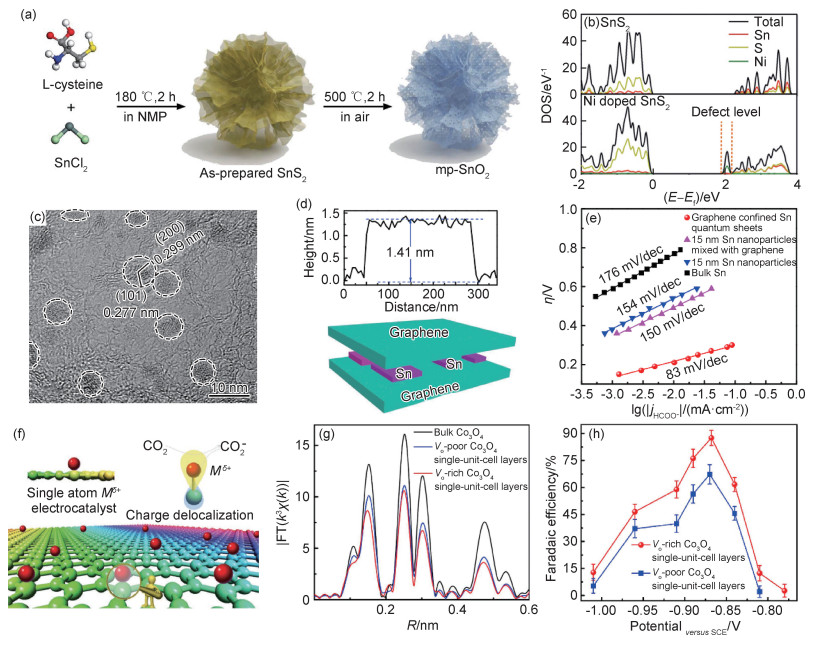
金属Bi的结构类似于黑磷,呈现蜂窝状的堆叠结构,通过适当手段对其刻蚀可以得到超薄的Bi纳米片。Zhang等[29]通过液相刻蚀由块状的金属Bi得到了二维的Bi纳米片(图 3(a)),平均厚度在1.2~1.5 nm。相较于块体材料,Bi纳米片具有更大的电化学活性表面积和更高的电导率,暴露丰富的边缘位点。理论计算表明,边缘位点处Bi原子的吉布斯自由能(ΔG)比晶面内Bi原子的ΔG低,有利于*OCOH中间体的生成,因此提高了催化活性。在0.1 mol·L-1的KHCO3中,Bi纳米片在-1.1 V(相对于可逆氢电极)时表现出最高的产甲酸FE(86%),对应的电流密度达到14.2 mA·cm-2,远远优于块状的金属Bi。Li等[42]也利用液相刻蚀块状的金属Sb得到超薄Sb纳米片,并实现了88.5%的产甲酸选择性。不同于以往的电沉积方法得到的纳米点或纳米树突,Kim等[30]采用脉冲电沉积在Cu载体表面沉积了Bi纳米片。该纳米片暴露出丰富的边缘位点,具有更高的局部电子密度,有利于电荷从催化剂向电解液的转移,因此加快了CO2分子的活化,并降低了反应过电势。超薄催化剂对于特定位点或特定晶面的选择性暴露是块体材料所欠缺的,因此在催化选择性方面占据优势。
|
图 3 超薄Bi基催化剂用于电催化CO2还原 (a)液相刻蚀制备Bi纳米片[29];(b)BiOI的扫描电镜(SEM)图[31];(c)BiOI的原子力显微镜(AFM)照片[31];(d)不同厚度Bi纳米片的线性扫描伏安曲线[33];(e)不同厚度Bi纳米片的甲酸FE对比[33];(f)铋烯的稳定性曲线[33];(g)原位红外光谱[34] Fig. 3 Ultra-thin Bi-based catalysts for electrocatalytic CO2 reduction (a)preparation of Bi nanosheets by liquid phase etching[29]; (b)scanning electron microscope (SEM) image of BiOI[31]; (c)atomic force microscope (AFM) image of BiOI[31]; (d)linear scanning voltammetry curves of Bi nanosheets with different thicknesses[33]; (e)comparison of formic acid FE of Bi nanosheets with different thicknesses[33]; (f)stability curve of bismuthene[33]; (g)in-situ infrared spectra[34] |
Bi的卤氧化物是一类常见的超薄材料,其衍生物已被应用到CO2RR中,表现出高的甲酸选择性。Han等[31]通过电化学还原的方法,将超薄的BiOI原位拓扑还原为金属Bi纳米片。制备的Bi纳米单晶延续了前驱体的二维形貌特征(图 3(b)),平均厚度在9 nm左右(图 3(c))。以0.5 mol·L-1的NaHCO3作为电解液,BiNS在一个较宽的电压区间(-1.7~-1.5 V,相对于饱和甘汞电极SCE)内保持大于95%的甲酸FE,部分电流密度在-1.74 V(vs SCE)时达到24 mA·cm-2。经过10 h的电解(-1.5V vs SCE),该BiNS催化剂保持二维结构,总的甲酸FE为95%。此外,将BiNS和商业Ir/C偶联可以实现CO2RR和氧析出反应的联用,电能到甲酸化学能的转换效率达到了47%。Sargent等[32]将BiOBr涂覆在碳纸上,通过电还原得到超薄的Bi/Bi2O3电极。掠入射广角X射线散射(GIWAXS)测试证实了负电位下催化剂表面结构的重建,(110)晶面是还原后Bi主要暴露的晶面。根据理论计算的结果,该晶面CO2RR的ΔG低于HER的ΔG,抑制了析氢。在流动池中,催化剂实现200 mA·cm-2的电流密度,甲酸FE仍可达到90%。可见,这种模板衍生的策略在制备活性组分的同时可以维持其超薄的特征,有助于活性位点的暴露和催化电流密度的提高。
为了探究厚度对Bi基材料催化性能的影响,Yang等[33]利用硼氢化钠还原Bi3+制备了一系列不同厚度的Bi纳米片。其中,单层铋烯平均厚度仅为0.65 nm,在400 ℃氧化后结构保持不变。测试发现,随着厚度降低,CO2RR的起始电位和电流密度都增大(图 3(d))。单层的铋烯在-0.58 V时甲酸FE达到了98%(图 3(e)),而且可以稳定工作75 h(图 3(f))。性能的提升一方面归因于大的活性表面积、丰富的活性位点和低的电荷传输阻力,另一方面归因于选择性的晶面暴露。计算表明,铋烯暴露的(111)晶面更倾向于CO2RR的发生,而且有利于反应物的脱附,避免了活性位点的毒化。Cao等[34]则利用Bi基金属有机层的原位电化学还原制备了平均厚度1.4 nm的铋烯。该催化剂在-1.18~-0.83 V宽的电压窗口内保持大于97%的甲酸FE,而且在-1.18 V时部分电流密度高达72.04 mA·cm-2,应用于流动池时实现了200 mA·cm-2(-0.75 V)的高电流密度,无论是选择性还是活性都优于块体的Bi材料。原位红外光谱结果表明OCHO*为甲酸生成的前驱体,而且溶液中的HCO3-可作为碳源参与反应(图 3(g))。
总体来看,Bi基金属/氧化物是目前研究的产甲酸活性/选择性较高的材料,通过各种手段构筑的超薄Bi基催化剂表现出块体材料难以比拟的优势,主要反映在催化剂的各向异性对催化性能的影响。为了进一步深化反应机理,原位表征技术结合DFT有利于揭示CO2RR的路径,可以指导高性能催化剂的合成。
2.1.2 Sn基催化剂主族金属Sn的硫化物也属于一种典型的片状材料,对其进行刻蚀、氧化、掺杂等处理,可以得到超薄的Sn基金属或复合物,具有CO2RR产甲酸的能力。Chen等[35]通过固相反应合成了块状的SnS,然后利用电化学刻蚀得到了超薄的SnS纳米片(5 nm)。在0.5 mol·L-1的KHCO3中,SnS NSs产甲酸的FE达到82.1%(-1.1 V),对应的部分电流密度为18.9 mA·cm-2,分别是未刻蚀块状SnS的2.78和4倍。Han等[37]以溶剂热法合成的超薄SnS2纳米花为模板,在空气中氧化得到具有丰富介孔的SnO2纳米片,而且保留了纳米片堆积的分级结构(图 4(a))。mp-SnO2在-0.9 V时实现了83%的甲酸FE和约14 mA·cm-2的部分电流密度。分级结构和丰富的介孔不仅提高了活性位点的数目,而且促进了动力学传质,赋予催化剂突出的CO2RR性能。元素掺杂是调节催化剂内部电子结构并影响宏观催化活性的重要手段[51],Zhang等[38]在SnS2纳米片(1.2 nm)中掺杂微量的Ni来提高反应的活性和选择性,掺杂的Ni在纳米片中均匀分布,并没有影响SnS2的晶体结构和二维形貌。当Ni的原子分数为5%时,Ni掺杂的SnS2催化剂表现出最高的甲酸选择性(80%),部分电流密度为15.7 mA·cm-2。机理研究表明,Ni的掺杂降低了SnS2纳米片的功函数(图 4(b)),有利于CO2分子的化学吸附和活化,促进CO2到甲酸的转化。
|
图 4 超薄Sn,Co基催化剂用于电催化CO2还原 (a)介孔SnO2纳米片的制备[37];(b)态密度的比较[38];(c)石墨烯限域Sn量子片的高分辨TEM照片[40];(d)石墨烯限域Sn量子片的AFM照片[40];(e)甲酸生成的塔菲尔点[40];(f)石墨烯负载的Sn单原子[41];(g)傅里叶变换的X射线吸收精细结构能谱[45];(h)产甲酸的FE[45] Fig. 4 Ultra-thin Sn-based and Co-based catalysts for electrocatalytic CO2 reduction (a)preparation process of mesoporous SnO2 nanosheets[37]; (b)comparison of density of states[38]; (c)high-resolution TEM image of graphene confined Sn quantum sheets[40]; (d)AFM image of graphene confined Sn quantum sheets[40]; (e)Tafel points for formic acid production[40]; (f)Sn single atom supported by graphene[41]; (g)Fourier-transform X-ray absorption fine structure spectra[45]; (h)FE of formic acid production[45] |
石墨烯作为一种典型的二维材料,导电性能良好,与Sn复合后可以提高稳定性并调节活性中心的电子结构[39]。Xie等[40]制备了石墨烯限域的Sn量子片,石墨烯层有效减弱了活性金属在空气中的氧化,并避免了金属的团聚以维持其量子片形态(图 4(c))。这种三明治结构平均厚度约1.4 nm(图 4(d)),石墨烯的大比表面积有利于电解质扩散,高导电性促进了电子转移,有利于CO2-中间体的生成。此外,Sn量子片暴露出很多低配位的金属原子,表面丰富的悬挂键有利于稳定CO2-中间体。因此,在0.1 mol·L-1 NaHCO3中,石墨烯限域的Sn量子片催化CO2还原的活性远高于单独的Sn纳米颗粒或块状的Sn,最大甲酸FE达到89%,对应的部分电流密度为18.8 mA·cm-2,塔菲尔斜率仅为83 mV·dec-1(图 4(e)),而且能够持续电解50 h。除了Sn量子片,Xie等[41]还在石墨烯中引入了Sn单原子(Sn-N2C2)(图 4(f)),其CO2还原的起始电位仅60 mV,甲酸的转换频率在-1.8 V (vs SCE)时达到11930 h-1。
通过形貌调控、元素掺杂和异质结构建等策略可提高Sn基催化剂的甲酸选择性和活性,加快发生在三相界面的动力学传质并调控电子结构,提高Sn基超薄催化剂的电催化CO2RR性能。
2.1.3 Co基催化剂除了主族金属及其化合物,超薄过渡金属Co及其氧化物也具有甲酸的催化性能[43]。借助配体限域生长的策略,Xie等[44]构建了具有4个原子层厚度的部分氧化Co纳米片,平均厚度为0.84 nm。在0.1 mol·L-1的Na2SO4溶液中,该催化剂在-0.24 V时就达到了10.59 mA·cm-2的电流密度,甲酸的选择性达到90.1%,远高于未氧化的Co纳米片。Xie等[45]还制备了表面有丰富氧空位的超薄Co3O4纳米片(0.84 nm)。同步辐射发现,Co—O配位数明显降低(图 4(g)),证明存在氧空位和表面悬挂键。在-0.87 V (vs SCE)时的甲酸FE为87.6%(图 4(h)),持续电解40 h后FE仍大于85%,优于氧空位含量低的样品。理论计算表明,氧空位不仅增大了电化学活性表面积和CO2吸附容量,而且有助于稳定HCOO-*中间体,促进了H+的转移并降低反应能垒,最终提高了CO2还原速率。
综上可知,主族金属及其化合物是电催化CO2RR产甲酸的主要催化剂,尤其是Bi基超薄材料,表现出大于90%的甲酸选择性以及流动池中几百毫安的电流密度,这可能是由于Bi基材料对HER的抑制作用。相对于块体材料,二维超薄催化剂的优势体现在选择性和电流密度方面。针对甲酸生成,未来应当着重关注催化材料的催化活性和稳定性,提高电流密度和电极催化剂的工作时间以降低成本。
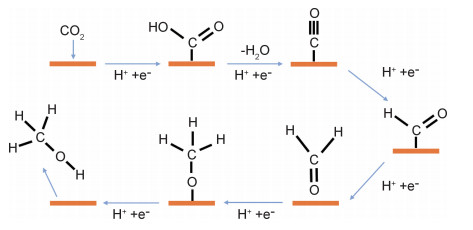
2.2 超薄催化剂用于电催化CO2RR产甲醇甲醇是结构最为简单的醇类,其质量能量密度高,既可作为各种常用化学品的前驱体,又可作为一种便于储存的能量载体,用于汽车内燃机/燃料电池等[52]。通过电催化CO2RR制取甲醇需要转移6个电子,其在Cu电极表面可能的反应路径如图 5所示[53]。
Pd基纳米材料的CO2RR产物通常为CO或甲酸[54]。为了得到高价值的深度还原产物,Zhang等[46]以Pd纳米片(4~6 nm)作为载体,通过湿化学方法均匀负载了细小的SnO2纳米颗粒,构建了具有分级结构的Pd-SnO2界面。在0.1 mol·L-1的NaHCO3溶液中,Pd/SnO2NSs的CO2还原活性远大于单独的Pd纳米片或SnO2纳米颗粒,可归因于其大的电化学活性表面积和低的电荷传输阻力。而且,CO2RR的主要产物是甲醇,在-0.24 V时实现了54.8%的FE,可持续电解24 h。Pd-O-Sn界面的构建对于甲醇的生成起到关键作用,一方面,SnO2促进了CO2分子的吸附和CO*中间体的生成,这些中间体进一步被还原生成甲醇;另一方面,SnO2还弱化了CO对Pd纳米片的毒化,从而保证活性位点的充分暴露。这种金属-氧化物异质界面的构建对多电子转移路径的发生和CO2的深度还原具有借鉴意义。
Ji等[47]合成了块状的Fe2P2S6,然后通过液相刻蚀得到厚度约为1.3 nm的Fe2P2S6纳米片。该催化剂用于CO2RR的主要还原产物为醇类,在-0.2 V时,甲醇的FE达到65.2%(图 6(a)),乙醇的FE为23.1%,副产物只有H2。同位素控制实验证明醇的来源是CO2分子(图 6(b))。而且,Fe2P2S6纳米片在-0.5 V的电压下稳定电解30 h后仍可维持其活性和超薄的结构,具有出色的耐久性。理论计算表明,CO2分子倾向于吸附在Fe原子上,Fe原子贡献出电子实现CO2到甲醇的还原。这项工作表明Fe基纳米材料具有催化CO2RR产醇类的能力,相关的Fe基活性位点用于CO2RR的活性/选择性调控仍需要研究。
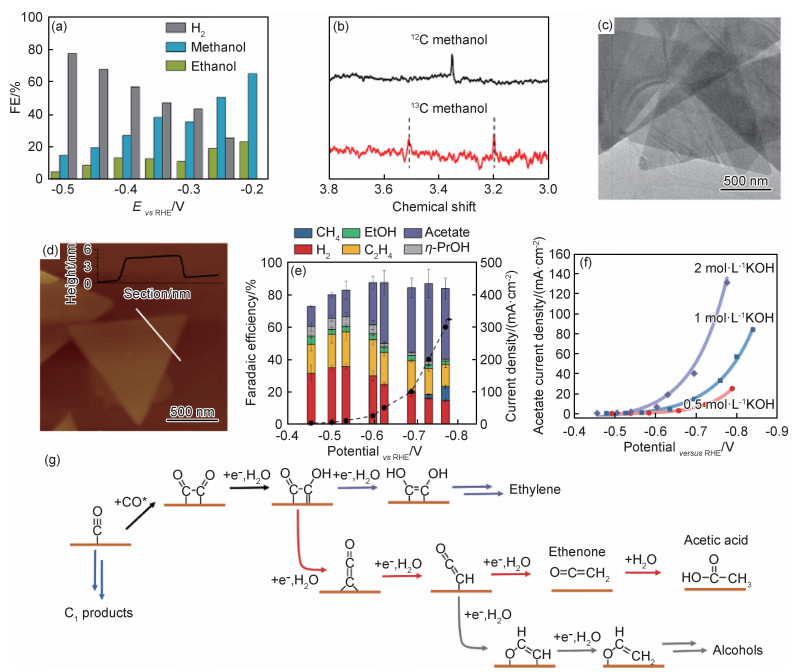
|
图 6 超薄材料催化CO2深度还原 (a)Fe2P2S6纳米片不同产物的FE[47];(b)同位素标记实验的核磁结果[47];(c)三角形Cu纳米片的TEM图[48];(d)三角形Cu纳米片的AFM照片[48];(e)各种产物的FE[48];(f)不同碱度电解液中的电流密度差异[48];(g)C2+产物的反应机理[48] Fig. 6 Ultra-thin materials catalyze deep reduction of CO2 (a)FE of different products of Fe2P2S6 nanosheets[47]; (b)NMR results of isotope labeling experiment[47]; (c)TEM image of triangular Cu nanosheets[48]; (d)AFM image of triangular Cu nanosheets[48]; (e)FE of various products[48]; (f)different current densities in electrolytes with different alkalinity[48]; (g)reaction mechanism of C2+ products[48] |
由于转移的电子数更多,生成甲醇的反应路径相较于甲酸更为复杂,导致反应速率、电流密度低。发展高效CO2RR催化剂制甲醇不仅要提高反应选择性、简化产物分离过程,更要充分发挥超薄催化剂导电性好、活性位点丰富等优势,提高电流密度。
2.3 超薄催化剂用于电催化CO2RR产乙酸乙酸是重要的有机酸,在化学生产、食品工业和化学防腐等领域发挥着重要的作用[55]。乙酸的制备包括细菌发酵和人工合成,近年来电催化CO2RR提供了一条新的合成路径。目前,可以催化CO2或CO分子还原为多碳产物的催化剂主要局限于Cu基催化剂[56],然而,如何控制Cu基催化剂暴露特定的晶面以实现高的产物选择性仍然充满了挑战。
为了进一步研究Cu基催化剂表面特征和产物选择性的关联,明确构效关系,Kang等[48]采用化学还原的策略合成了主要暴露晶面为(111)的Cu纳米片。该纳米片形状为三角形(图 6(c)),平均边长约1.7 μm,厚度约5 nm(图 6(d))。还原试剂、配体和表面活性剂对催化剂的合成影响很大,能够有效地维持其金属价态并诱导(111)晶面的暴露。以CO为反应气体,在含有2 mol·L-1 KOH溶液的流动池中,该Cu纳米片产C2+产物的FE达到70%。其中,最大的乙酸FE在-0.74 V时达到48%(图 6(e)),对应的部分电流密度为131 mA·cm-2。更换电解液后发现碱性更高的环境下有利于乙酸的生成(图 6(f))。同位素标记实验证明,生成乙酸分子中的O原子一个来自CO分子,另一个来自电解液,进而说明了电解液碱度对反应效率的影响。通过与商业的Cu纳米颗粒的性能对比,可以看出(111)晶面更倾向于还原CO生成乙酸,而不是乙炔和乙醇,因此解释了Cu纳米片高的乙酸选择性。结合同位素标记实验,乙酸的形成可能遵循烯酮中间体的反应路径(图 6(g)),DFT对自由能的计算也证实了该反应路径在热力学上的可行性。
作为CO2RR产C2+产物的主要材料,Cu基催化剂的制备与测试大多集中在纳米晶或氧化物。通过形貌的调控,超薄Cu基催化剂用于多碳产物的生成也具有广阔的发展空间,有待研究者们进一步的开发和探索。
3 结束语本文总结了近4年来还原CO2制备液体含碳燃料的超薄催化剂,涉及反应机理,并指出了超薄催化剂相对于块体材料的优势。超薄催化剂报道最多的还原产物是甲酸,二维的主族金属Bi,Sn及其化合物,尤其是Bi基催化剂,可以实现较高的甲酸FE,但是还原电流密度仍然较低,难以满足工业化生产的需求。另外,用于电催化CO2RR的催化剂的稳定性普遍较差,亟需开发更耐久的催化剂或建立更完善的电解系统以实现持续的固碳。相比之下,电催化CO2RR产甲醇等深度还原产物的催化性能不尽如人意,值得着重关注来提高反应的活性和选择性。为此,应当进一步拓宽超薄材料体系,尤其是Cu基二维催化剂,以制备更为多样化的液相产物,相应的合成方法学亟需跟进。未来的研究可考虑以下方面:
(1) 超薄材料具有大的比表面积和出色的导电、载流子传输性能,以其作为载体可以提高活性组分的负载量,促进扩散传质。然而,目前报道的用于电催化CO2RR的超薄材料大多为单一组分,当超薄材料作为载体负载金属纳米颗粒/团簇/单原子或构建异质结构时有望发挥金属-载体相互作用,通过调节电子结构、暴露活性位点来优化催化活性和选择性。
(2) 针对CO2RR这种复杂的反应,尤其是多碳产物的生成,应当注重反应机理的分析。可借助于原位表征技术监测反应过程中活性位点的吸脱附行为,追踪反应路径,结合理论计算明确催化机理,进而指导超薄催化剂的设计与合成。除了催化电极的优化,还需注重反应装置的改进,通过研究固态电解液、加快CO2传质等措施提高电流密度,简化操作流程或产物分离过程等,推进其大规模应用。
(3) 相较于实验室中试错式的催化剂合成与测试,理论预测和模拟将极大地提高催化剂设计的效率。最近,基于高通量DFT计算的机器学习已应用于催化材料的自动筛选和优化,可以实现特定元素或者配位结构的快速匹配,以达到反应路径选择以及反应产物预测的目的。因此,未来可以将机器学习应用到CO2RR超薄材料的设计中,预测具有不同组分、不同形态、不同暴露晶面等超薄材料的催化活性、选择性乃至稳定性。
| [1] |
WANG Y C, LIU Y, LIU W, et al. Regulating the coordination structure of metal single atoms for efficient electrocatalytic CO2 reduction[J]. Energy & Environmental Science, 2020, 13(12): 4609-4624. |
| [2] |
WANG L M, CHEN W L, ZHANG D D, et al. Surface strategies for catalytic CO2 reduction: from two-dimensional materials to nanoclusters to single atoms[J]. Chemical Society Reviews, 2019, 48(21): 5310-5349. DOI:10.1039/C9CS00163H |
| [3] |
ZHANG S, FAN Q, XIA R, et al. CO2 reduction: from homogeneous to heterogeneous electrocatalysis[J]. Accounts of Chemical Research, 2020, 53(1): 255-264. DOI:10.1021/acs.accounts.9b00496 |
| [4] |
CHANG C J, LIN S C, CHEN H C, et al. Dynamic reoxidation/reduction-driven atomic interdiffusion for highly selective CO2 reduction toward methane[J]. Journal of the American Chemical Society, 2020, 142(28): 12119-12132. DOI:10.1021/jacs.0c01859 |
| [5] |
XIE J F, ZHAO X T, WU M X, et al. Metal-free fluorine-doped carbon electrocatalyst for CO2 reduction outcompeting hydrogen evolution[J]. Angewandte Chemie International Edition, 2018, 57(31): 9640-9644. DOI:10.1002/anie.201802055 |
| [6] |
WANG X, WANG Z Y, ARQUER F P G, et al. Efficient electrically powered CO2-to-ethanol via suppression of deoxygenation[J]. Nature Energy, 2020, 5(6): 478-486. DOI:10.1038/s41560-020-0607-8 |
| [7] |
CHOI C, KWON S, CHENG T, et al. Highly active and stable stepped Cu surface for enhanced electrochemical CO2 reduction to C2H4[J]. Nature Catalysis, 2020, 3(10): 804-812. DOI:10.1038/s41929-020-00504-x |
| [8] |
MEI J, LIAO T, KOU L Z, et al. Two-dimensional metal oxide nanomaterials for next-generation rechargeable batteries[J]. Advanced Materials, 2017, 29(48): 1700176. DOI:10.1002/adma.201700176 |
| [9] |
LIU J L, GUO C X, VASILEFF A, et al. Nanostructured 2D materials: prospective catalysts for electrochemical CO2 reduction[J]. Small Methods, 2017, 1(2): 1600006. |
| [10] |
NOVOSELOV K S, GEIM A K, MOROZOV S V, et al. Electric field effect in atomically thin carbon films[J]. Science, 2004, 306(5696): 666-669. DOI:10.1126/science.1102896 |
| [11] |
XIONG P, WU Y Y, LIU Y F, et al. Two-dimensional organic-inorganic superlattice-like heterostructures for energy storage applications[J]. Energy & Environmental Science, 2020, 13(12): 4834-4853. |
| [12] |
DENG P M, NING H L, XIE W G, et al. Research progress in stannous oxide thin film transistors[J]. Journal of Materials Engineering, 2020, 48(4): 83-88. |
| [13] |
ZENGJ, XU L, LUO X, et al. A novel design of SiH/CeO2(111) van der Waals type-Ⅱ heterojunction for water splitting[J]. Physical Chemistry Chemical Physics, 2021, 23(4): 2812-2818. DOI:10.1039/D0CP05238H |
| [14] |
ZHOU Y S, CHE F L, LIU M, et al. Dopant-induced electron localization drives CO2 reduction to C2 hydrocarbons[J]. Nature Chemistry, 2018, 10(9): 974-980. DOI:10.1038/s41557-018-0092-x |
| [15] |
PANG Y J, LI J, WANG Z Y, et al. Efficient electrocatalytic conversion of carbon monoxide to propanol using fragmented copper[J]. Nature Catalysis, 2019, 2(3): 251-258. DOI:10.1038/s41929-019-0225-7 |
| [16] |
WANG Y C, LIU B, LIU Y, et al. Accelerating charge transfer to enhance H2 evolution of defect-rich CoFe2O4 by constructing a Schottky junction[J]. Chemical Communications, 2020, 56(90): 14019-14022. DOI:10.1039/D0CC05656A |
| [17] |
YAN J Q, KONG L Q, JI Y J, et al. Single atom tungsten doped ultrathin α-Ni(OH)2 for enhanced electrocatalytic water oxidation[J]. Nature Communications, 2019, 10: 2149. DOI:10.1038/s41467-019-09845-z |
| [18] |
ZHAO Y, TAN X, YANG W F, et al. Surface reconstruction of ultrathin palladium nanosheets during electrocatalytic CO2 reduction[J]. Angewandte Chemie International Edition, 2020, 59(48): 21493-21498. DOI:10.1002/anie.202009616 |
| [19] |
南文争, 燕绍九, 彭思侃, 等. 石墨烯的液相剥离制备及在磷酸铁锂正极中的应用[J]. 材料工程, 2020, 48(11): 108-115. NAN W Z, YAN S J, PENG S K, et al. Preparation of graphene based on liquid phase exfoliation and its application on LiFePO4 electrode for lithium ion battery[J]. Journal of Materials Engineering, 2020, 48(11): 108-115. |
| [20] |
JEONG G H, SASIKALA S P, YUN T, et al. Nanoscale assembly of 2D materials for energy and environmental applications[J]. Advanced Materials, 2020, 32(35): 1907006. DOI:10.1002/adma.201907006 |
| [21] |
WANG Q C, LEI Y P, WANG Y C, et al. Atomic-scale engineering of chemical-vapor-deposition-grown 2D transition metal dichalcogenides for electrocatalysis[J]. Energy & Environmental Science, 2020, 13(6): 1593-1616. |
| [22] |
WU Q M, DENG D K, HE Y L, et al. Fe/N-doped mesoporous carbons derived from soybeans: a highly efficient and low-cost non-precious metal catalyst for ORR[J]. Journal of Central South University, 2020, 27(2): 344-355. DOI:10.1007/s11771-020-4300-7 |
| [23] |
ZHAO C M, LUO G, LIU X K, et al. In situ topotactic transformation of an interstitial alloy for CO electroreduction[J]. Advanced Materials, 2020, 32(39): 2002382. DOI:10.1002/adma.202002382 |
| [24] |
LI X D, WANG S M, LI L, et al. Opportunity of atomically thin two-dimensional catalysts for promoting CO2 electroreduction[J]. Accounts of Chemical Research, 2020, 53(12): 2964-2974. DOI:10.1021/acs.accounts.0c00626 |
| [25] |
SUN Z Y, MA T, TAO H C, et al. Fundamentals and challenges of electrochemical CO2 reduction using two-dimensional materials[J]. Chem, 2017, 3(4): 560-587. DOI:10.1016/j.chempr.2017.09.009 |
| [26] |
SHI R, GUO J H, ZHANG X R, et al. Efficient wettability-controlled electroreduction of CO2 to CO at Au/C interfaces[J]. Nature Communications, 2020, 11(1): 3028. DOI:10.1038/s41467-020-16847-9 |
| [27] |
CHENG H, LIU S, ZHANG J D, et al. Surface nitrogen-injection engineering for high formation rate of CO2 reduction to formate[J]. Nano Letters, 2020, 20(8): 6097-6103. DOI:10.1021/acs.nanolett.0c02144 |
| [28] |
CHEN Z P, MOU K W, WANG X H, et al. Nitrogen-doped graphene quantum dots enhance the activity of Bi2O3 nanosheets for electrochemical reduction of CO2 in a wide negative potential region[J]. Angewandte Chemie International Edition, 2018, 57(39): 12790-12794. DOI:10.1002/anie.201807643 |
| [29] |
ZHANG W J, HU Y, MA L B, et al. Liquid-phase exfoliated ultrathin Bi nanosheets: uncovering the origins of enhanced electrocatalytic CO2 reduction on two-dimensional metal nanostructure[J]. Nano Energy, 2018, 53: 808-816. DOI:10.1016/j.nanoen.2018.09.053 |
| [30] |
KIM S, DONG W J, GIM S, et al. Shape-controlled bismuth nanoflakes as highly selective catalysts for electrochemical carbon dioxide reduction to formate[J]. Nano Energy, 2017, 39: 44-52. DOI:10.1016/j.nanoen.2017.05.065 |
| [31] |
HAN N, WANG Y, YANG H, et al. Ultrathin bismuth nanosheets from in situ topotactic transformation for selective electrocatalytic CO2 reduction to formate[J]. Nature Communications, 2018, 9: 1320. DOI:10.1038/s41467-018-03712-z |
| [32] |
ARQUER F P G, BUSHUYEV O S, LUNA P D, et al. 2D metal oxyhalide-derived catalysts for efficient CO2 electroreduction[J]. Advanced Material, 2018, 30(38): 1802858. DOI:10.1002/adma.201802858 |
| [33] |
YANG F, ELNABAWY A O, SCHIMMENTI R, et al. Bismuthene for highly efficient carbon dioxide electroreduction reaction[J]. Nature Communications, 2020, 11(1): 1088. DOI:10.1038/s41467-020-14914-9 |
| [34] |
CAO C S, MA D D, GU J F, et al. Metal-organic layers leading to atomically thin bismuthene for efficient carbon dioxide electroreduction to liquid fuel[J]. Angewandte Chemie International Edition, 2020, 59(35): 15014-15020. DOI:10.1002/anie.202005577 |
| [35] |
CHEN H L, CHEN J X, SI J C, et al. Ultrathin tin monosulfide nanosheets with exposed (001) plane for efficient electrocatalytic conversion of CO2 into formate[J]. Chemical Science, 2020, 11(15): 3952-3958. DOI:10.1039/C9SC06548B |
| [36] |
YUAN T B, HU Z, ZHAO Y X, et al. Two-dimensional amorphous SnOx from liquid metal: mass production, phase transfer, and electrocatalytic CO2 reduction toward formic acid[J]. Nano Letters, 2020, 20(4): 2916-2922. DOI:10.1021/acs.nanolett.0c00844 |
| [37] |
HAN N, WANG Y Y, DENG J, et al. Self-templated synthesis of hierarchical mesoporous SnO2 nanosheets for selective CO2 reduction[J]. Journal of Materials Chemistry A, 2019, 7(3): 1267-1272. DOI:10.1039/C8TA10959A |
| [38] |
ZHANG A, HE R, LI H P, et al. Nickel doping in atomically thin tin disulfide nanosheets enables highly efficient CO2 reduction[J]. Angewandte Chemie International Edition, 2018, 57(34): 10954-10958. DOI:10.1002/anie.201806043 |
| [39] |
LI F W, CHEN L, XUE M Q, et al. Towards a better Sn: efficient electrocatalytic reduction of CO2 to formate by Sn/SnS2 derived from SnS2 nanosheets[J]. Nano Energy, 2017, 31: 270-277. DOI:10.1016/j.nanoen.2016.11.004 |
| [40] |
LEI F C, LIU W, SUN Y F, et al. Metallic tin quantum sheets confined in graphene toward high-efficiency carbon dioxide electroreduction[J]. Nature Communications, 2016, 7: 12697. DOI:10.1038/ncomms12697 |
| [41] |
ZU X L, LI X D, LIU W, et al. Efficient and robust carbon dioxide electroreduction enabled by atomically dispersed Snδ+ sites[J]. Advanced Materials, 2019, 31(15): 1808135. DOI:10.1002/adma.201808135 |
| [42] |
LI F W, XUE M Q, LI J Z, et al. Unlocking the electrocatalytic activity of antimony for CO2 reduction by two-dimensional engineering of the bulk material[J]. Angewandte Chemie International Edition, 2017, 56(46): 14718-14722. DOI:10.1002/anie.201710038 |
| [43] |
GAO S, JIAO X C, SUN Z T, et al. Ultrathin Co3O4 layers realizing optimized CO2 electroreduction to formate[J]. Angewandte Chemie International Edition, 2016, 55(2): 698-702. DOI:10.1002/anie.201509800 |
| [44] |
GAO S, LIN Y, JIAO X C, et al. Partially oxidized atomic cobalt layers for carbon dioxide electroreduction to liquid fuel[J]. Nature, 2016, 529(7584): 68-71. DOI:10.1038/nature16455 |
| [45] |
GAO S, SUN Z T, LIU W, et al. Atomic layer confined vacancies for atomic-level insights into carbon dioxide electroreduction[J]. Nature Communications, 2017, 8: 14503. DOI:10.1038/ncomms14503 |
| [46] |
ZHANG W Y, QIN Q, DAI L, et al. Electrochemical reduction of CO2 to CH3OH on hierarchical Pd/SnO2 nanosheets with abundant Pd-O-Sn interfaces[J]. Angewandte Chemie International Edition, 2018, 57(30): 9475-9479. DOI:10.1002/anie.201804142 |
| [47] |
JI L, CHANG L, ZHANG Y, et al. Electrocatalytic CO2 reduction to alcohols with high selectivity over a two-dimensional Fe2P2S6 nanosheet[J]. ACS Catalysis, 2019, 9(11): 9721-9725. DOI:10.1021/acscatal.9b03180 |
| [48] |
LUC W, FU X B, SHI J J, et al. Two-dimensional copper nanosheets for electrochemical reduction of carbon monoxide to acetate[J]. Nature Catalysis, 2019, 2(5): 423-430. DOI:10.1038/s41929-019-0269-8 |
| [49] |
MA W C, XIE S J, LIU T T, et al. Electrocatalytic reduction of CO2 to ethylene and ethanol through hydrogen-assisted C-C coupling over fluorine-modified copper[J]. Nature Catalysis, 2020, 3(6): 478-487. DOI:10.1038/s41929-020-0450-0 |
| [50] |
GONG Q F, DING P, XU M Q, et al. Structural defects on converted bismuth oxide nanotubes enable highly active electrocatalysis of carbon dioxide reduction[J]. Nature Communications, 2019, 10: 2807. DOI:10.1038/s41467-019-10819-4 |
| [51] |
LIU Y, FENG Q G, LIU W, et al. Boosting interfacial charge transfer for alkaline hydrogen evolution via rational interior Se modification[J]. Nano Energy, 2021, 81: 105641. DOI:10.1016/j.nanoen.2020.105641 |
| [52] |
REN D, GAO J, PAN L F, et al. Atomic layer deposition of ZnO on CuO enables selective and efficient electroreduction of carbon dioxide to liquid fuels[J]. Angewandte Chemie International Edition, 2019, 58(42): 15036-15040. DOI:10.1002/anie.201909610 |
| [53] |
YANG D X, ZHU Q G, CHEN C J, et al. Selective electroreduction of carbon dioxide to methanol on copper selenide nanocatalysts[J]. Nature Communications, 2019, 10: 677. DOI:10.1038/s41467-019-08653-9 |
| [54] |
XIE J F, WANG X Y, LV J Q, et al. Reversible aqueous zinc-CO2 batteries based on CO2-HCOOH interconversion[J]. Angewandte Chemie International Edition, 2018, 57(52): 16996-17001. DOI:10.1002/anie.201811853 |
| [55] |
GENOVESE C, SCHUSTER M E, GIBSON E K, et al. Operando spectroscopy study of the carbon dioxide electro-reduction by iron species on nitrogen-doped carbon[J]. Nature Communications, 2018, 9: 935. DOI:10.1038/s41467-018-03138-7 |
| [56] |
WANG H X, TZENG Y K, JI Y F, et al. Synergistic enhancement of electrocatalytic CO2 reduction to C2 oxygenates at nitrogen-doped nanodiamonds/Cu interface[J]. Nature Nanotechnology, 2020, 15(2): 131-137. DOI:10.1038/s41565-019-0603-y |
 2022, Vol. 50
2022, Vol. 50