文章信息
- 何汉兵, 付国友, 张丽, 曾婧, 王于思, 龙红明, 樊友奇, 郑雅杰, 马英
- HE Han-bing, FU Guo-you, ZHANG Li, ZENG Jing, WANG Yu-si, LONG Hong-ming, FAN You-qi, ZHENG Ya-jie, MA Ying
- CTAB改性钒硅分子筛对CO-SCR低温催化脱硝性能的影响
- Effect of CO-SCR by CTAB modified vanadosilicate molecular sieve on low temperature catalytic denitrification
- 材料工程, 2021, 49(12): 115-122
- Journal of Materials Engineering, 2021, 49(12): 115-122.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.001076
-
文章历史
- 收稿日期: 2020-11-19
- 修订日期: 2021-09-10
2. 中南大学 冶金与环境学院, 长沙 410083;
3. 武汉科技大学 国家环境保护矿冶资源利用与污染控制重点实验室, 武汉 430081;
4. 永清环保股份有限公司, 长沙 410001
2. School of Metallurgy and Environment, Central South University, Changsha 410083, China;
3. National Key Laboratory of Environmental Protection Mining and Metallurgy Resources Utilization and Pollution Control, Wuhan University of Science and Technology, Wuhan 430081, China;
4. Yonker Environmental Protection Co., Ltd., Changsha 410001, China
氮氧化物(NOx)排放对环境影响日益严重,会引起诸如光化学烟雾、温室效应、酸雨、臭氧消耗和细颗粒物超标等。在烟气处理方法中,选择性催化还原(SCR)被广泛用于控制NOx排放[1]。选择性催化还原脱硝的关键在于找到合适的催化剂材料,沸石材料因具有独特的骨架结构和组成、均匀的孔隙、阳离子交换选择性和良好的热稳定性,已被广泛用作商业脱硝催化剂[2]、离子交换剂和吸附剂[3]。研究者们常将V2O5负载在大比表面积的多孔材料上以获得更高的催化活性,但难以在载体的内表面实现均匀分散[4-5]。将钒的催化性能与分子筛均匀的孔径相结合,或能取得十分优异的催化性能。Rocha等[6]首次报告了新型的含有六配位钒并具有与ETS-10相同结构的大孔钒硅酸盐,并将这种材料命名为AM-6(AveiroManchester)。
钒硅酸盐AM-6是具有混合晶体结构的多孔材料,AM-6是由角共享的VO6八面体和角共享的SiO4四面体组成的沸石型微孔钒硅酸盐。AM-6的框架包含由共享角的VO6六面体构成的半导体V-O-V链,这些链在两个正交方向上延伸,并通过由角共享SiO4四面体组成的硅酸盐基质有效地彼此隔离,AM-6中钒的电子和几何结构的实验和理论研究表明,V4+位于链的主体中,而V5+优先位于链末端的骨架中和外部晶体中的晶体缺陷位点表面[7-9]。这表明AM-6具有潜在的脱硝活性。因此钒硅分子筛AM-6可作为负载型V2O5的可靠替代催化剂。
物质的晶体结构和形状大小在很大程度上决定其物理化学性质[10]。受天然矿物矿化过程的启发,表面活性剂或有机添加剂可以用来控制微粒的成核、生长和排列,以形成理想的晶体。相比于溶胶凝胶法、共沉淀法等方法,水热法有利于得到缺陷极少、取向好的晶体,并且水热法制得的产物杂质引入较少、颗粒团聚较轻。许多研究表明,最终产物的形态和结构很大程度上取决于水热反应中使用的表面活性剂、溶剂和矿化剂的类型[11]。十六烷基三甲基溴化铵(CTAB)具有两亲分子结构,为阳离子活性剂,可以通过化学吸附或物理吸附实现固体表面改性[12]。已有研究使用表面活性剂CTAB对V2O5进行改性,证明改性后样品具有更好的催化性能[13]。
本工作利用水热法制备AM-6,加入表面活性剂CTAB对AM-6分子筛进行改性。采用多种物理化学手段考察了催化剂在模拟气氛下的选择催化还原的反应性能,以及催化剂的结构、表面性质与反应性能之间的关系。
1 实验材料与方法 1.1 催化剂制备利用表面活性剂辅助水热法合成AM-6,具体过程如下:4.05 g氢氧化钠、16.57 g硅酸钠溶液、70 g水和1.3 g硫酸混合,作为溶液A;4.50 g硫酸、1.4 g五氧化二钒、10 g水和4 g乙醇混合,作为溶液B,将溶液B在80 ℃水浴锅中搅拌反应25 min;将溶液A和溶液B混合后,加入3.24 g二水合氟化钾,4.8 g水,CTAB,混合均匀;室温下老化24 h,之后放入反应釜中,反应釜放在烘箱中,升温至220 ℃,恒温16 h,反应结束后,冷却,倒掉上清液,下层物质经过滤、洗涤、干燥后研磨得到紫色固体产物,即钒硅分子筛AM-6。对添加表面活性剂CTAB辅助合成的AM-6命名,记为AM-6(xCTAB)(x=0,1/12,1/6,1/4,1/3,其中x为CTAB与V的摩尔比)。
1.2 催化剂物化性能表征采用JSM-6360LV型扫描电子显微镜对材料进行表面微观形貌观察和能谱面扫描元素成分分析。扫描电镜工作条件为:电子加速电压20.0 kV,放大倍数0~10000倍。采用TTR Ⅲ型X射线衍射仪(XRD)对所合成的材料进行物相结构的检测,Cu靶(λ=0.15406 nm),工作电压40.0 kV,扫描步长为0.02°,扫描范围2θ为10°~80°,扫描速度为10(°)/min。采用Nicolet6700傅里叶红外光谱仪(FT-IR)对分子结构进行定性定量分析。采用HORIBA evolution拉曼分析仪对材料进行表征。采用ESCALAB Xi+X射线光电子能谱仪(XPS)测定固体表面的电子结构和表面组成的化学成分。以AlKα为辐射源,扫描通过能30 eV,步长0.1 eV,扫描次数15次,内标为C1s结合能(284.6 eV)。
1.3 催化剂脱硝性能表征通过实验室自制装置对合成的催化剂进行脱硝性能检测实验(图 1)。实验体系由配气系统、催化系统、检测系统3个部分组成,配气系统由装有CO,NO标准气的钢瓶和配气仪组成,催化系统由固定反应器和管式电阻炉组成,检测系统为VARIO PLUS型增强型烟气分析仪。采用抗高温石英棉将0.5 g催化剂固定于石英管中部,放置于程序控温的管式电阻炉中进行反应。在设定活化温度下,1%CO+99%N2微还原气氛中,进行催化剂预处理。然后通入反应气体, CO∶NO=1∶1,平衡气氛为氮气,再经程序性升温控制以5 ℃/min的速度从50 ℃升至需要温度进行脱硝率测试。利用烟气分析仪检测并实时记录出口处NO浓度。脱硝率η计算公式见式(1)。

|
图 1 催化剂脱硝性能检测系统 Fig. 1 Detecting system of catalytic denitrification performance |
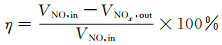
|
(1) |
式中: VNO, in为进口处NO浓度; VNOx,out为出口处NOx浓度, 包括NO和NO2。
2 结果与分析 2.1 AM-6(xCTAB)的扫描电子显微镜分析图 2为AM-6(xCTAB)的扫描电镜图,样品为截取顶端的双锥体,颗粒呈细长状,晶体的尺寸为微米级[14],合成条件的差异会导致样品形貌不同。在完整的晶体周围,可观察到少量未结晶物质,呈球状或其他不规则形貌,这与产物中存在少量杂质有关,在AM-6的制备合成中,石英为较为常见的杂质。

|
图 2 AM-6(xCTAB)的SEM照片 (a)AM-6;(b)AM-6(1/12CTAB);(c)AM-6(1/6CTAB);(d)AM-6(1/4CTAB);(e)AM-6(1/3CTAB) Fig. 2 SEM images of AM-6(xCTAB) (a)AM-6;(b)AM-6(1/12CTAB); (c)AM-6(1/6CTAB); (d)AM-6(1/4CTAB); (e)AM-6(1/3CTAB) |
添加不同含量的CTAB的样品形状基本保持一致,为一维菱形棒状结构。AM-6(1/12CTAB)样品结晶状况未得到改善;继续增加CTAB含量至1/6,形貌相比于前两者更规整,杂质减少;AM-6(1/4CTAB)中完整晶体较多,未结晶颗粒状杂质较少,且截取顶端双锥体大小均匀;含量为1/3时,CTAB不能对AM-6合成起到促进作用,形成大量絮状未结晶杂质。
CTAB可以吸附在颗粒表面并降低表面能,这有利于防止聚集、调节粒径和形状,同时,该溶液可以获得较低的过饱和度,这有利于晶体的各向异性或一维生长[11]。CTAB是两亲性偶联剂,其中一端为亲水性而另一端为疏水性,因此CTAB在热液系统中表现出自团聚行为。解离的CTAB保持了表面活性剂的性能,适用于分散和产生孔隙。但是CTAB添加剂的积极影响取决于其含量。图 3为面扫描图谱,检测到AM-6(1/4CTAB)的主要元素Na,K,V,Si,O。说明CTAB的添加未引入其他杂质元素,并且元素分布均匀。

|
图 3 AM-6(1/4CTAB)的面扫图谱 Fig. 3 SEM-EDAX mapping of AM-6(1/4CTAB) |
图 4(a)为AM-6的XRD图谱及根据文献模拟的衍射图谱,这与先前有关的报道一致[15]。AM-6的XRD图谱在12.3°,12.9°,20.1°,23.8°,24.7°,25.8°,27.1°,31.8°,35.3°,35.6°,36.5°,37.0°处出现衍射峰,分别对应AM-6的(101),(004),(105),(200),(202),(116),(204),(109),(217),(208),(224),(110)晶面[16]。所有样品的峰宽均一,表明构架未发生可测量的变形,只有石英是唯一的杂质相。图 4(b)是AM-6(xCTAB)样品XRD图谱,从图谱可以看出,在CTAB辅助水热合成过程中,位于24.7°衍射峰的强度随着CTAB比例增加而呈现减弱趋势,表明表面活性剂对AM-6晶体的结晶度有影响。图中位于20.1°与23.8°之间的石英杂质峰在添加比例达到1/4时基本消失,表明受表面活性剂影响的溶液体系将阻碍杂质的生长,有利于形成纯度更高的样品。图谱中所有衍射峰的位置与钒硅酸盐AM-6的衍射峰一致,只有少量石英是唯一的杂质相。添加比例达到1/3时,由于CTAB过量,XRD结果显示,已无法得到AM-6产品。
|
图 4 AM-6(a)和AM-6(xCTAB)(b)样品的XRD图谱 Fig. 4 XRD patterns of AM-6 (a) and AM-6 (xCTAB) (b) sample |
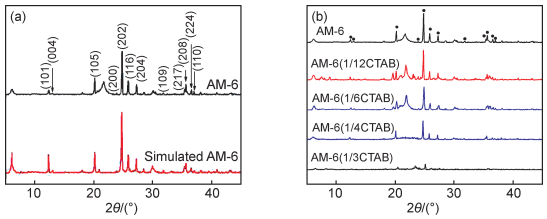
图 5(a)是AM-6(xCTAB)样品IR图谱。图谱存在与硅物种相关的谱带,其中549.62 cm-1对应于Si—O振动特征峰。FT-IR数据还提供了钒在晶体结构中掺入的证据,V—O键的拉伸振动导致中心带位于873.60 cm-1处,与V4+中心参与八面体配位有关[17],而以1033.68 cm-1为中心的谱带被分配给位于晶体缺陷区域或外部区域的钒基,即归因于VO拉伸,因为通常将在氧钒(Ⅳ)络合物中910~1035 cm-1范围内发现的IR谱带指定为这种振动模式[18]。1637.30 cm-1的吸收峰以及从3200 cm-1到3600 cm-1的宽峰分别是水分子伸缩振动特征峰和弯曲振动特征峰。所有钒硅酸盐AM-6(xCTAB)的IR光谱均显示出相同的吸收带,并且与先前报道的AM-6的数据一致。
|
图 5 AM-6(xCTAB)的IR图(a)和AM-6(xCTAB)的拉曼光谱图(b) Fig. 5 IR curves of AM-6(xCTAB) (a) and Raman spectra of AM-6(xCTAB) (b) |
拉曼位移对键长非常敏感,因此拉曼光谱可以被用于确认XPS结果中钒氧化态的趋势。对AM-6进行拉曼检测,其拉曼光谱图如图 5(b)所示。AM-6的光谱显示了在860 cm-1处的拉曼带,归因于AM-6链中一个相对未失真的[VO6]八面体的V—O拉伸振动的特征峰[19-20]。AM-6中特征谱带的宽度,是由于在钒硅酸盐中较少的堆垛层错所致,表明生成结构更有序,同时峰的窄度也可能表明VO振动的分子特性较大。在图中不存在钒氧化物(如VO2和V2O5)的拉曼活性带(838 cm-1和605 cm-1),表明这些化合物没有作为杂质相分离或浸出,与XRD结果一致。AM-6(xCTAB)样品拉曼光谱位置相同,这与XRD和XPS一致,并辅助证实了1/12~1/4CTAB比例的表面活性剂加入对结构没有显著影响。AM-6(1/3CTAB)在860 cm-1处的谱带强度降低,V—O谱带的衰减与XRD及SEM结果相对应,表明过量表面活性剂存在条件下会影响AM-6的合成,无法形成AM-6晶体结构。
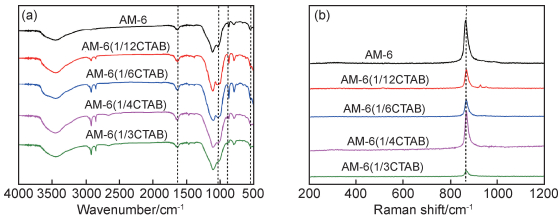
2.4 AM-6(xCTAB)的XPS分析为了阐明CTAB对催化剂的价态和表面组成的影响,采用X射线光电子能谱(XPS)对其进行了表征,结果如图 6所示。同时计算了表面原子浓度,结果列于表 1中。图 6是AM-6(xCTAB)的V2p光谱。根据晶胞公式((Na, K)2VSi5O13·xH2O),理想AM-6中每个V原子的价态必须为+4。然而文献研究证明AM-6中的钒原子是+4价态及+5价态共存的形式[21-22]。所得样品的V2p3/2的XPS光谱的拟合数据表明该骨架包含+4和+5价态的钒。由于V2p3/2核心能级的结合能取决于V阳离子的价态[23],因此V2p3/2的XPS信号曲线拟合可用于检测钒氧化物中存在的不同钒阳离子价态[24-25]。V2p3/2出现在约516.5 eV的峰。V2p3/2谱带可拟合成两个平均结合能为516.2 eV和517.1 eV的峰。516.2 eV的峰归因于V4+价态[26],517.1 eV的峰归因于V5+价态[27]。位于516.2 eV和517.1 eV的峰的结合能分别归属于VO2氧化物(515.7~516.2eV)和V2O5氧化物(516.9~517.2eV)的峰[28-29],即分别为V4+和V5+[30-31]。已知混合价态V4+/V5+的平衡比率对于提高脱硝性能至关重要[32]。混合的V4+和V5+的存在有利于表面催化反应的发生,因为它可以提升电导率从而提高脱硝率[33]。同样,V4+/V5+的比例实际上是整个SCR反应中的速控步骤[34]。
|
图 6 AM-6(xCTAB)中V元素的XPS曲线 (a)AM-6;(b)AM-6(1/12CTAB); (c)AM-6(1/6CTAB); (d)AM-6(1/4CTAB); (e)AM-6(1/3CTAB) Fig. 6 XPS curves of V element in AM-6(xCTAB) (a)AM-6;(b)AM-6(1/12CTAB); (c)AM-6(1/6CTAB); (d)AM-6(1/4CTAB); (e)AM-6(1/3CTAB) |
| Sample | Atom fraction of V4+/% |
Atom fraction of V5+/% |
Ratio of V5+ to V4+ |
| AM-6 | 58.15 | 41.85 | 0.72 |
| AM-6(1/12CTAB) | 59.37 | 40.63 | 0.68 |
| AM-6(1/6CTAB) | 55.13 | 44.87 | 0.81 |
| AM-6(1/4CTAB) | 51.78 | 48.22 | 0.93 |
| AM-6(1/3CTAB) | 80.09 | 19.91 | 0.25 |
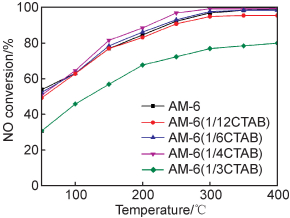
图 7是AM-6(xCTAB)催化剂在50~400 ℃的脱硝活性曲线,不同表面活性剂添加比例的AM-6 (xCTAB)样品的脱硝性能均随着温度的升高呈增强趋势。
|
图 7 AM-6(xCTAB)的脱硝曲线 Fig. 7 Denitrification results of AM-6(xCTAB) |
AM-6与AM-6(1/12CTAB)的脱硝率相比未发生明显变化,AM-6(1/6CTAB)的脱硝率明显提高,在AM-6(1/4CTAB)中的脱硝率达到最高为93%,AM-6(1/3CTAB)中的脱硝率下降,这与前面表征结果吻合,即过多表面活性剂的加入不利于形成结构良好的AM-6样品。
钒催化剂优选通过氧化还原循环,催化NOx向N2的选择性转化。因此,在文献中已确定钒物种需要多种氧化态的存在,以提高催化性能,这归因于钒的快速氧化还原循环。混合价态V5+/V4+的共存有利于提高脱硝性能的另一个原因是,当V4+和V5+同时存在时,V的不饱和化合价可促进氧的吸附并形成活性氧,从而加速NOx的还原过程并增加脱硝活性[35]。
对比发现,在50~400 ℃范围内,AM-6(xCTAB)样品脱硝活性顺序为:AM-6(1/4CTAB)>AM-6(1/6CTAB)>AM-6>AM-6(1/12CTAB)>AM-6(1/3CTAB)。AM-6(1/4CTAB)脱硝活性较其他样品更高,150 ℃时AM-6(1/4CTAB)脱硝活性达到81.54%,之后脱硝率持续上升,在200 ℃达88.46%,在250~400 ℃保持在95%以上;AM-6(1/6CTAB)脱硝活性在200 ℃达86.15%;AM-6在200 ℃达84.62%;AM-6(1/12CTAB)脱硝活性在200 ℃达83.15%;脱硝活性最低的样品为AM-6(1/3CTAB)在200 ℃达67.69%,之后保持在70%~80%。
由脱硝性能对比可以看出表面活性剂对催化剂的改性主要体现在低温脱硝性能的提高。AM-6(1/4 CTAB)相比于AM-6脱硝活性达到80%的温度约提前50 ℃,在150~300 ℃脱硝率提高4%~5%。
2.6 催化机理探讨根据以前的研究,在钒基催化剂的表面上发现了布朗斯台德和路易斯酸位点。在NH3—SCR中,催化循环包括四个步骤[35]:首先,将NH3吸附在布朗斯台德酸位(V—OH)上以形成—NH4+。其次,通过相邻的V5+O将—NH4+氧化形成—NH3+,并将V5+O还原为V4+—OH。第三,使NH3+与气相NO反应生成—NH3+NO,并将—NH3+NO分解为N2和H2O。最后,V4+—OH被O2再氧化为V5+O。因此V4+/V5+的氧化还原对的存在对SCR反应的进行起着重要作用。
当催化剂与反应气体NO和CO接触时,NO分子优先吸附在活性部位上,形成不同的吸附NO物种。这些吸收的NO种类被诱导解离为N和O,然后解离的N原子与NO分子结合形成N2O(NO→N+O,NO+N→N2O)[36]。NO的解离是通过CO去除NO的关键步骤,氧空位可以激活N—O键以促进这种解离。最后,CO分子和中间产物N2O转变为气态CO2及最终产品N2。表面氧空位对N2O分解具有很高的反应性。样品中V4+/V5+比例的平衡有利于氧的吸附并形成活性氧,从而提高脱硝活性。因此AM-6催化CO-NO还原反应可以归因于以下反应:
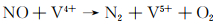
|
(2) |
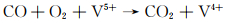
|
(3) |
催化剂的混合价态在氧化还原中起着至关重要的作用,催化剂之间电子转移的效率通常取决于不同价态的阳离子之间的关系。在AM-6的脱硝过程中,CO和NO在AM-6的活性位点V4+和V5+上发生吸附,形成活化的吸附物种,从而促进CO和NOx生成CO2和N2。
3 结论(1) 当添加CTAB比例为1/4时,得到的AM-6(1/4CTAB)晶体结构更完整,XRD几乎检测不到石英杂质,表面形貌得到改善。
(2) 在50~400 ℃范围内,表面活性剂改性AM-6(xCTAB)样品脱硝活性顺序为:AM-6(1/4CTAB)> AM-6(1/6CTAB)>AM-6>AM-6(1/12CTAB)>AM-6(1/3CTAB)。AM-6(1/4CTAB)脱硝活性最高,150 ℃时AM-6(1/4CTAB)脱硝活性达到81.54%,之后脱硝率持续上升,在200 ℃时达88.46%。
(3) AM-6(xCTAB)的价态研究中发现,在最佳添加比例(1/4)下,V5+/V4+的比例最高,V4+和V5+比例的平衡有利于氧的吸附并形成活性氧,从而加速还原过程并提高脱硝活性。
| [1] |
FORZATTI P. Present status and perspectives in de-NOx SCR catalysis[J]. Applied Catalysis A, 2001, 222(1): 221-236. |
| [2] |
刘津, 唐富顺, 陈彦宏, 等. 富氧条件下Co/ZSM-5催化剂对C3H8选择还原NOx的性能[J]. 无机化学学报, 2014, 30(8): 1790-1800. LIU J, TANG F S, CHEN Y H, et al. Performance of selective catalytic reduction of NOx by C3H8 over Co/ZSM-5 catalysts under excess oxygen[J]. Chinese Journal of Inorganic Chemistry, 2014, 30(8): 1790-1800. |
| [3] |
MOHAN S, DINESHA P, KUMAR S. NOx reduction behaviour in copper zeolite catalysts for ammonia SCR systems: a review[J]. Chemical Engineering Journal, 2020, 384: 123253. DOI:10.1016/j.cej.2019.123253 |
| [4] |
WU K, LI B, HAN C, et al. Synthesis, characterization of MCM-41 with high vanadium content in the framework and its catalytic performance on selective oxidation of cyclohexane[J]. Applied Catalysis A, 2014, 479: 70-75. DOI:10.1016/j.apcata.2014.04.004 |
| [5] |
ZHAO J, ZHANG Y, XU L, et al. Weak base favoring the synthesis of highly ordered V-MCM-41 with well-dispersed vanadium and the catalytic performances on selective oxidation of benzyl alcohol[J]. Chinese Journal of Chemical Engineering, 2020, 28(5): 1424-1435. DOI:10.1016/j.cjche.2020.02.027 |
| [6] |
ROCHA J, BRANDĀO P, LIN Z, et al. The first large-pore vanadosilicate framework containing hexacoordinated vanadium[J]. Angewandte Chemie International Edition in English, 1997, 36(1/2): 100-102. |
| [7] |
SHOUGH A M, LOBO R F, DOREN D J. A visible light photocatalyst: effects of vanadium substitution on ETS-10[J]. Physical Chemistry Chemical Physics, 2007, 9(37): 5096-5104. DOI:10.1039/b703187d |
| [8] |
NASH M J, RYKOV S, LOBO R F, et al. Photocatalytic activity of vanadium-substituted ETS-10[J]. The Journal of Physical Chemistry C, 2007, 111(19): 7029-7037. DOI:10.1021/jp067259+ |
| [9] |
KUZYAKA D, GALIOGLU S, ALTIN Î, et al. The effect of microporous vanadosilicate AM-6 thin films as photocatalysts for the degradation of methylene blue[J]. Journal of Photochemistry and Photobiology A, 2018, 366: 127-135. DOI:10.1016/j.jphotochem.2018.03.041 |
| [10] |
GU H, WANG J, WANG Z, et al. Preparation of novel mesoporous GdVO4: Eu3+ crystals by CTAB-SDS micellar-assisted hydrothermal method in wide pH range[J]. Optical Materials, 2019, 96: 109254. DOI:10.1016/j.optmat.2019.109254 |
| [11] |
WANG J, HOJAMBERDIEV M, XU Y. CTAB-assisted hydrothermal synthesis of YVO4: Eu3+ powders in a wide pH range[J]. Solid State Sciences, 2012, 14(1): 191-196. DOI:10.1016/j.solidstatesciences.2011.10.019 |
| [12] |
ASIM N, RADIMAN S, YARMO M A, et al. Vanadium pentoxide: synthesis and characterization of nanorod and nanoparticle V2O5 using CTAB micelle solution[J]. Microporous and Mesoporous Materials, 2009, 120(3): 397-401. DOI:10.1016/j.micromeso.2008.12.013 |
| [13] |
ZABRODINA G, MAKAROV S, KREMLEV K, et al. Novel hybrid materials based on the vanadium oxide nanobelts[J]. Applied Surface Science, 2016, 368: 395-402. DOI:10.1016/j.apsusc.2016.02.011 |
| [14] |
GUO M, PIDKO E A, FAN F, et al. Structure and basicity of microporous titanosilicate ETS-10 and vanadium-containing ETS-10[J]. The Journal of Physical Chemistry C, 2012, 116(32): 17124-17133. DOI:10.1021/jp305543m |
| [15] |
CONTRO J, PAULA A S, MEDEIROS V L, et al. Synthesis of ETS-10-like vanadosilicates using 2, 6-dimethylpiperidinium cation derivatives as organic templates[J]. Inorganic Chemistry Communications, 2020, 112: 107724. DOI:10.1016/j.inoche.2019.107724 |
| [16] |
TEKIN R, WARZYWODA J, SACCO A Jr. The effect of gaseous ammonia treatment of AM-6 crystallized in the presence of tetramethylammonium cations on their removal from the crystal pores, and the crystal quality and structure of AM-6[J]. Microporous and Mesoporous Materials, 2017, 251: 94-104. DOI:10.1016/j.micromeso.2017.05.051 |
| [17] |
BRANDAO P, VALENTE A, PHILIPPOU A, et al. Hydrothermal synthesis and characterisation of two novel large-pore framework vanadium silicates[J]. European Journal of Inorganic Chemistry, 2003, 2003(6): 1175-1180. DOI:10.1002/ejic.200390151 |
| [18] |
ISMAIL M N, FRAIMAN N D, CALLAHAN D M Jr, et al. First unseeded hydrothermal synthesis of microporous vanadosilicate AM-6[J]. Microporous and Mesoporous Materials, 2009, 120(3): 454-459. DOI:10.1016/j.micromeso.2008.12.020 |
| [19] |
YEATES R M, MURDOCH M J, SOUTHON P D, et al. AM-6: a microporous one-dimensional ferromagnet[J]. Dalton Transactions, 2009, 38: 8025-8032. |
| [20] |
ISMAIL M N, IBE U K, CHERNENKO T, et al. Synthesis and characterization of vanadosilicate AM-6 with transition metal ions isomorphously substituted in the framework[J]. Microporous and Mesoporous Materials, 2011, 145(1/3): 118-123. |
| [21] |
DATTA S J, YOON K B. Synthesis of ideal AM-6 and elucidation of V4+-to-O charge transfer in vanadate quantum wires[J]. Angewandte Chemie International Edition, 2010, 49(29): 4971-4975. DOI:10.1002/anie.200907088 |
| [22] |
ZHOU Z, CAO T, LIU X, et al. Vanadium silicate (EVS)-supported silver nanoparticles: a novel catalytic sorbent for elemental mercury removal from flue gas[J]. Journal of Hazardous Materials, 2019, 375: 1-8. DOI:10.1016/j.jhazmat.2019.04.062 |
| [23] |
BARBERO B P, CADU'S L E, HILAIRE L. XPS studies for vanadium pentoxide along the catalytic bed: oxidative dehydrogenation of propane[J]. Applied Catalysis A, 2003, 246(2): 237-242. DOI:10.1016/S0926-860X(03)00025-5 |
| [24] |
SILVERSMIT G, DEPLA D, POELMAN H, et al. Determination of the V2p XPS binding energies for different vanadium oxidation states (V5+ to V0+)[J]. Journal of Electron Spectroscopy and Related Phenomena, 2004, 135(2-3): 167/175. |
| [25] |
TIAN Y P, BAI P, LIU S M, et al. VOx-K2O/γ-Al2O3 catalyst for nonoxidative dehydrogenation of isobutane[J]. Fuel Processing Technology, 2016, 151: 31-39. DOI:10.1016/j.fuproc.2016.05.024 |
| [26] |
ZHONG W, QIAO T, DAI J, et al. Visible-light-responsive sulfated vanadium-doped TS-1 with hollow structure: enhanced photocatalytic activity in selective oxidation of cyclohexane[J]. Journal of Catalysis, 2015, 330: 208-221. DOI:10.1016/j.jcat.2015.06.013 |
| [27] |
PRICE N J, REITZ J B, MADIX R J, et al. A synchrotron XPS study of the vanadia-titania system as a model for monolayer oxide catalysts[J]. Journal of Electron Spectroscopy and Related Phenomena, 1999, 98: 257-266. |
| [28] |
ALOV N, KUTSKO D, SPIROVOVA I, et al. XPS study of vanadium surface oxidation by oxygen ion bombardment[J]. Surface Science, 2006, 600(8): 1628-1631. DOI:10.1016/j.susc.2005.12.052 |
| [29] |
DEMETER M, NEUMANN M, REICHELT W. Mixed-valence vanadium oxides studied by XPS[J]. Surface Science, 2000, 454: 41-44. |
| [30] |
MENDIALDUA J, CASANOVA R, BARBAUX Y. XPS studies of V2O5, V6O13, VO2 and V2O3[J]. Journal of Electron Spectroscopy and Related Phenomena, 1995, 71(3): 249-261. DOI:10.1016/0368-2048(94)02291-7 |
| [31] |
BIESINGER M C, LAU L W, GERSON A R, et al. Resolving surface chemical states in XPS analysis of first row transition metals, oxides and hydroxides: Sc, Ti, V, Cu and Zn[J]. Applied Surface Science, 2010, 257(3): 887-898. DOI:10.1016/j.apsusc.2010.07.086 |
| [32] |
CHA W, LE H A, CHIN S, et al. Enhanced low-temperature NH3-SCR activity of a V2O5/TiO2 composite prepared via chemical vapor condensation and impregnation method[J]. Materials Research Bulletin, 2013, 48(10): 4415-4418. DOI:10.1016/j.materresbull.2013.06.048 |
| [33] |
CHA W, CHIN S, PARK E, et al. Effect of V2O5 loading of V2O5/TiO2 catalysts prepared via CVC and impregnation methods on NOx removal[J]. Applied Catalysis B, 2013, 140: 708-715. |
| [34] |
KWON D W, PARK K H, HONG S C. The influence on SCR activity of the atomic structure of V2O5/TiO2 catalysts prepared by a mechanochemical method[J]. Applied Catalysis A, 2013, 451: 227-235. DOI:10.1016/j.apcata.2012.09.050 |
| [35] |
TOPSØE N Y. Mechanism of the selective catalytic reduction of nitric oxide by ammonia elucidated by in situ on-line Fourier transform infrared spectroscopy[J]. Science, 1994, 265(5176): 1217-1219. DOI:10.1126/science.265.5176.1217 |
| [36] |
ZHANG Y, ZHAO L, DUAN J, et al. Insights into deNOx processing over Ce-modified Cu-BTC catalysts for the CO-SCR reaction at low temperature by in situ DRIFTS[J]. Separation and Purification Technology, 2020, 234: 116081. DOI:10.1016/j.seppur.2019.116081 |
 2021, Vol. 49
2021, Vol. 49


