文章信息
- 阴明, 孙俊丽, 鲍同尧, 刘笑达, 杜华云, 卫英慧, 侯利锋
- YIN Ming, SUN Jun-li, BAO Tong-yao, LIU Xiao-da, DU Hua-yun, WEI Ying-hui, HOU Li-feng
- 合金元素对镁合金耐腐蚀性能影响的研究进展
- Research progress in effect of alloying elements on corrosion resistance of magnesium alloys
- 材料工程, 2021, 49(12): 28-39
- Journal of Materials Engineering, 2021, 49(12): 28-39.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2021.000289
-
文章历史
- 收稿日期: 2021-03-31
- 修订日期: 2021-05-24
2. 山西省金属材料腐蚀与防护工程技术研究中心, 太原 030024
2. Corrosion and Protection Engineering Technology Research Center of Shanxi Province, Taiyuan 030024, China
镁资源丰富,对环境友好,密度仅为1.74 g/cm3,相当于铁的四分之一或铝的三分之二[1-3]。纯镁质地柔软,但力学性能较差,抗拉强度仅20 MPa[1]。因此,人们一直在努力开发不同用途的镁合金。随着镁合金生产成本的降低和纯净化技术的提高,为满足商品轻量化和节能降耗的迫切需要,越来越多的镁合金用在交通运输领域,以减轻车辆的质量,提高燃料的效率并减少温室气体的排放[1, 4-5]。镁合金还可以作为化学电源的负极(或阳极),这主要是因为金属镁具有较负的标准电极电位(镁的标准电极电位为-2.37 V vs SHE)、较大的理论比容量和较小的相对密度[6-11]。此外,由于镁具有良好的生物相容性和生物可降解性等优点,作为医用植入体材料具有巨大的潜力和应用前景[12-15]。尽管镁合金拥有优越和独特的性能以及巨大的应用前景,但较差的耐蚀性限制了其大规模的应用。镁合金在潮湿的环境或水溶液中很容易被腐蚀,特别是在含有Cl-的溶液中会被快速腐蚀[16-19]。其主要原因如下[19-23]:(1)镁具有很负的电化学势,在工程金属中最低;(2)在镁合金表面上形成的腐蚀膜层的稳定性较差,不能像铝或不锈钢的表面膜一样致密和稳定;(3)Mg容易和第二相或如Fe,Ni,Cu等比镁惰性的杂质发生电偶腐蚀。
如何提高镁的耐蚀性已成为世界性的难题。为提高镁合金的耐蚀性,人们进行了大量尝试。通常的方法包括:合金化[19, 24-26],化学转化涂层[27-29],电化学镀[30-31],阳极氧化[32]和添加剂缓蚀剂[33]等。其中合金化是一种广泛使用的方法,可以从根本上提高镁合金的耐蚀性。不同合金元素对镁合金耐蚀性的影响表现不同,为了区分这些元素的作用,本文将从合金元素对镁及其合金腐蚀行为的影响方面进行阐述,在此基础上提供一些可供参考的合金化元素,以期对不同应用领域的镁合金材料的设计提供探索方向。
1 镁合金腐蚀机理 1.1 镁腐蚀机理镁及其合金的耐蚀性较差主要有两个关键因素[17, 19]:(1)Mg的电化学势很低。即使在没有氧气的情况下,腐蚀也能继续进行,这使得析氢反应占主导地位;(2)纯Mg表面上形成的MgO和Mg(OH)2在中性和酸性水溶液中几乎是没有保护性的。
镁合金的腐蚀是一种电化学过程,其中镁与水性环境中的电解质发生作用而被氧化[17]。该过程通过电子在镁表面处的转移来发生,并且镁原子失去电子形成镁离子,同时释放电子。其半反应为:
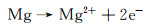
|
(1) |
由于镁失去的电子必须被其他物质消耗,以保持电中性。因此,该阳极半反应必须伴随有阴极反应,一般是氢离子获得电子而降低其氧化态[1]。对于镁的阴极反应而言,由于其电极电位远远低于氢反应的平衡电极电位,所以析氢反应是主要的阴极反应。
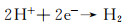
|
(2) |
因此,Mg整体的腐蚀反应为:
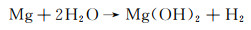
|
(3) |
此外,生成的氢氧化镁也会发生溶解(根据反应式(4))导致电解质溶液的pH值增加:
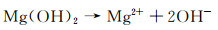
|
(4) |
因此,由于浸泡在水中的Mg(OH)2“准钝化”膜发生溶解而使基体暴露于溶液中[1]。由于镁具有较强的活性,在表面会被迅速氧化形成较薄的膜。镁发生腐蚀的电化学动力学很大程度上取决于这层膜的性质。镁表面膜在热力学上可形成Mg(OH)2和MgO。在水溶液中Mg(OH)2比MgO更稳定,故常常认为表面膜为Mg(OH)2。这里的Mg(OH)2一部分是由氧化镁直接转化而来,一部分是由氧化镁溶解后镁离子与氢氧根结合而沉积在镁表面,所以这层膜是疏松多孔的[17]。在含Cl-的溶液中存在Cl-和CO2,所以镁表面层除了含有氢氧化镁外,还会存在MgCl2和MgCO3。当然,这些物质在水溶液中也具有可溶性,所以它们并不能长期有效地保护镁基体。此外,溶液的pH值对镁表面膜的稳定性至关重要。图 1为Mg-O-H系统的E-pH关系图[34],从图 1可以看出,当溶液的pH低于11.7时,氢氧化镁不能稳定存在,而pH值高于11.7时,氢氧化镁的热力学是完全稳定的。但这并不意味着氢氧化镁膜层具有较好的保护性,而膜层的保护性更多取决于其致密性。
使用Pilling-Bedworth比(P-B比)可以衡量保护膜的致密性[35-36]。就金属腐蚀而言,P-B比是指金属氧化物膜中的晶胞体积Voxide与该金属中的晶胞体积Vmetal之比,P-B比计算按式(5)进行。
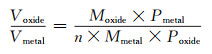
|
(5) |
式中:M是分子质量或原子质量;n是每一个氧化物分子含有的金属原子数;V是摩尔值;P是密度。通过P-B可以确定金属是否可以在干燥空气存在的条件下进行钝化[36]。
金属的P-B值可以分为以下3种情况(表 1[35]):如果P-B小于1,则氧化膜太薄并且很可能会分解,例如Mg和K;如果P-B大于2,则氧化膜会剥落并且无法提供保护,例如Fe,V和W;如果P-B大于1且小于2,则氧化膜会钝化,并提供保护以防止表面氧化,例如Ti,Cr和Al。
| Metal element | P-B | Metal element | P-B | Metal element | P-B | ||
| Be | 1.59 | K | 0.45 | Cu | 1.68 | ||
| Al | 1.28 | Cd | 1.21 | Cr | 1.99 | ||
| Mn | 1.79 | Mo | 3.40 | Fe | 2.17 | ||
| Co | 1.99 | Sb | 2.35 | Ni | 1.52 | ||
| Pd | 1.60 | Ta | 2.33 | Pb | 1.40 | ||
| Ce | 1.16 | V | 3.18 | Ag | 1.59 | ||
| Ti | 1.95 | Hf | 2.61 | W | 3.40 | ||
| U | 3.05 | Mg | 0.81 | In | 1.01 |
镁表面的氧化物(MgO)的P-B <1,这使得氧化物在其表面不能完全覆盖。对于在水溶液中形成的Mg(OH)2更是如此。此外,由式(4)可知,Mg(OH)2在水溶液中也具有一定的可溶性,所以即使长期处于水溶液中而形成足够厚的Mg(OH)2膜层也不能有效地保护镁基体。
1.2 异常析氢为了全面了解镁腐蚀机理,必须考虑在阳极极化的镁表面处发生的异常析氢。析氢反应是镁腐蚀中的主要阴极反应,在非极化状态下会在镁表面自发产生。但是,当在镁合金表面进行阳极极化时,会导致较高的溶解速率,同时还会观察到增加的析氢反应[1, 17]。这种镁异常析氢的现象与活化控制的动力学表达式Butler-Volmer方程相矛盾[1],如式(6)所示。
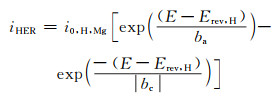
|
(6) |
式中:iHER是与析氢反应相关的电流密度,A/cm2;i0, H, Mg是析氢的交换电流密度,A/cm2;E是电极电位,V;Erev, H是HER的可逆电位,V;ba是阳极Tafel斜率的值;|bc|是阴极Tafel斜率的绝对值。
目前主要存在3种理论解释镁的异常析氢现象,分别是单价镁离子(Mg+)理论,杂质表面富集和催化活性增强机理。单价镁离子理论目前被广泛研究和讨论,最初是由Petty等[37]在1954年提供了Mg+中间体间接存在的实验证据。在此基础上,Song和Atrens等[38-41]提出了单价镁离子机制来解释镁及镁合金的异常析氢现象。该理论认为Mg在溶解过程中会经历两个步骤,首先有一部分Mg失去一个电子生成Mg+,然后Mg+与水发生反应生成Mg2+和H2。反应方程式如下:
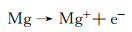
|
(7) |
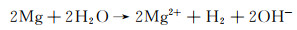
|
(8) |
根据这一理论可知,随着阳极极化程度的增加,会产生更多的Mg+,从而导致析氢速率增加。
另一种观点认为镁的异常析氢是由镁表面杂质引起的。在镁腐蚀实验的观察中,许多学者发现存在深色的腐蚀产物膜层的区域比未腐蚀区域表现出更高的腐蚀速率[42-44]。Curioni[45]研究表明,镁在溶解时的深色膜是阴极反应的主要部位;如果腐蚀区域随着阳极极化的增加以更快的速度在整个表面上扩展,那么它们可能是Mg在阳极溶解过程中表现出阴极活性增强的原因。但是,随着腐蚀区域覆盖率的增加,析氢的增强需要这些腐蚀产物来维持,而这与Tafel动力学的表现相反。除此之外,Williams等[44]用SVET研究了开路条件下深色腐蚀产物在Mg表面的扩展并发现腐蚀产物中存在杂质Fe。由于Mg在开路腐蚀或阳极极化过程中会优先溶解,杂质(例如Fe)会聚集于腐蚀膜中或位于腐蚀层之下,使得镁及其合金表面上的杂质含量远高于其本身的杂质含量。Lysne等[46]构建了一个在阳极溶解时Mg表面富集Fe的模型,并指出Fe的富集效率很差,并且不是造成析氢率升高的主要原因。正如Lysne等[46]和Birbilis等[47]研究镁溶解过程中的表面杂质富集现象,他们均发现尽管杂质的含量明显增加,但富集效率仍然很低。虽然在深色腐蚀膜处比未腐蚀的表面处析氢更快,但在阳极极化过程中其对总析氢速率的影响很小[42]。
虽然Fe杂质的富集效率很低,但这并不能否认Fe杂质对异常析氢的影响。Höche等[48]针对异常析氢现象提出了另一种解释,即存在于Mg样品中的Fe杂质会随着周围Mg基体的溶解先离开表面,然后待其溶解后重新沉积在Mg表面上,如图 2所示。Lamaka等[23]进一步研究了杂质铁再沉积的影响,并支持了惰性杂质元素在腐蚀过程中的作用。这也表明,阳极极化下析氢的增加速率仍可以用Fe杂质溶解再沉积来解释。尽管这种Fe溶解再沉积的机理可以解释开路条件下Mg溶解过程中析氢速率增加的现象,但它也与阳极极化过程中在Mg表面观察到的析氢速率不一致。因此,需要更多的研究来验证异常析氢的机制。
另外一个被广泛讨论的理论是由Frankel等[49]提出,有关阳极极化Mg表面的催化活性增强机理,即析氢反应的交换电流密度随着阳极极化的增加而增加,且析氢反应速率的增加遵循Tafel动力学。有关Tafel动力学方程如下:
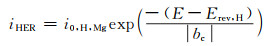
|
(9) |
研究表明,Erev, H和bc的变化对析氢的影响很小[49]。因此,镁合金的析氢交换电流密度的改变将会影响析氢速率。式(9)可以通过i0, H, Mg的增加来表示经过阳极极化的Mg表面催化活性的增强。Mg在阳极溶解时的腐蚀产物和表面杂质富集均对析氢反应具有较强的催化作用[45, 50-51],因此镁及其合金随着阳极极化程度的增加,析氢速率增加。
2 合金元素对镁腐蚀的影响长期以来,人们已经知道比镁(基本上包括所有过渡金属)惰性的元素对其腐蚀行为的影响[1]。由于Mg在开路腐蚀或阳极极化过程中会优先溶解,杂质(例如Fe)会聚集于腐蚀膜中或腐蚀层之下。抑制有害元素和开发有利元素对镁合金耐蚀性的发展至关重要。尽管有很多学者已经开展研究镁合金腐蚀的工作,耐腐蚀镁合金的开发仍未得到广泛关注。但是近些年来,大量研究已经阐明了合金元素对镁合金腐蚀的作用。
2.1 元素在镁中的固溶度镁合金的腐蚀性能主要取决于镁合金本身和冶炼过程两个方面。在制备镁合金时所加入的合金元素可以直接影响镁合金的化学成分。有很多元素在纯镁的固溶度 < 0.01%(原子分数),这些元素可以认为不溶于Mg。图 3总结了元素在镁中的固溶度情况。Gusieva等[52]指出了镁合金化时元素的几种不溶形式。这些性质概括为:(1)完全不溶性(如Mg-Ge,Mg-Fe和Mg-As);(2)不溶且立即会形成Mg-X的金属间化合物(如Mg-Si);(3)具有少量的溶解度,之后完全不溶(如Mg-Zr)。对于镁合金来说,由于固溶度有限而很难像不锈钢一样在铁基体中加入大量的铬元素来提高其耐蚀性。即使存在这种元素,也会由于大量引入而使得镁合金失去了质轻等优势。此外,镁的电化学性质极其活泼,引入电位比镁高的惰性元素会加速镁合金的腐蚀。所以在设计镁合金时,需综合考虑合金化的影响。

|
图 3 元素在Mg中的固溶度 Fig. 3 Solid solubility of elements in Mg |
不同的元素对镁合金的成分、相组织与微观结构都能产生较大的影响,从而显著影响镁合金的腐蚀性能。如镁与合金元素或者第二相与基相之间的相互作用可以影响腐蚀性能[53-54]。这包括相的组成和相的数量以及大小与分布等。近年来,有大量学者研究了合金元素对镁腐蚀的影响,按照不同元素所产生的保护机理,主要从以下8个方面进行阐述。
(1) 结构优化保护。结构优化保护主要包括两种,一是调整第二相,二是改善元素偏析。镁合金中第二相的电位通常比镁基体的电位高而引起电偶腐蚀,因此合理调整第二相的分布和体积分数可以显著地提高镁合金的耐蚀性。
一般而言,第二相的体积分数越大或第二相的分布越分散,镁合金的耐蚀性越差。Song等[55]通过研究AZ21,AZ50和AZ91合金在氯化钠溶液的腐蚀行为,认为Mg17Al12作为阻挡相和阴极相对腐蚀具有两种作用:一种是体积分数较小的Mg17Al12相可以形成较多的阴极相而加速基体的腐蚀,另一种是较高体积分数的Mg17Al12相可以充当腐蚀屏障的作用而抑制镁铝合金的腐蚀。Ge对Mg-Al合金的腐蚀也具有类似的影响[56-57]。Liu等[56]研究了Mg-3Al-xGe(x=1,3,5)合金在铸态和固溶态中的腐蚀行为,发现在铸态合金中,当Ge含量较低时,显微组织为不连续的棒状形貌(图 4),此时腐蚀速率较高;当Ge含量较高时,合金显微组织具有连续网状分布,此时的腐蚀速率显著降低,腐蚀速率最低为23.1 mm/a;随着Ge含量进一步增加,大块的富Ge相呈零星分布,显著加速了腐蚀。这说明Mg2Ge相的形态随Ge含量的变化而变化,并影响了镁锗合金的耐腐蚀性能。除此之外,稀土元素可以改善镁铝系合金的微观结构,形成更均匀的β-Mg17Al12相网络状形貌,从而抑制腐蚀扩展[58-60]。
改变元素含量还可以调整偏析来改善合金的耐蚀性,这样可以通过“定制”合金的微观结构以增强耐腐蚀性,减缓由偏析导致的腐蚀。如Hou等[19]在研究In对Mg-Sn合金耐蚀性的影响时,通过调整In元素在晶界处的偏析,形成花瓣状Mg-1Sn-2In合金显微组织,合金具有较好的耐蚀性。图 5为铸态Mg-Sn-In合金的光学显微组织[19]。如图 5所示,铸态Mg-Sn-In合金的微观结构随着In含量的变化而呈现不同的形貌,这是合金在凝固过程中遵循最优结晶方向的结果。凝固结构的特征取决于冷却条件和合金成分[61]。由于In和Sn在Mg熔体中的流动扩散比例不一致,而且在凝固过程中合金不断释放的潜热不同,所以会导致晶界的枝晶偏析程度不同。在Mg-Sn-In合金中,随着In含量从0%(质量分数,下同)增加到2.5%,显微组织从“点”状或“条”状逐步转变为“花”状为主。同时,偏析区的偏析相含量有所增加。花瓣状的显微组织能有效阻止腐蚀的扩展,这种改变偏析行为来提高耐蚀性的机理与改变第二相分布情况的机理类似。
(2) 牺牲阳极相保护。牺牲阳极相的保护方法可以使镁基体不受腐蚀侵害,一定程度上也会保护镁合金。Yang等[62]研究了Ca的添加对Mg-Al-Mn合金腐蚀行为的影响,结果表明添加2% Ca的合金表现出最佳的耐蚀性。他们认为这归因于氧化膜和不连续分布在晶界上的(Mg, Al)2Ca相的影响。这些相充当了微观的阳极相,并且这些阳极相会优先受到腐蚀以保护镁基体,这与Cao等[63]和Jeong等[64]研究的Ca提高镁合金耐蚀性的机制相一致。Kim等[65]研究了不超过2%的Ca添加量对Mg-5Al合金的腐蚀行为,发现析出相(即Mg2Ca和Al2Ca)可作为抑制合金基体腐蚀的障碍,从而降低镁合金的腐蚀扩展。
(3) 降低杂质含量。Fe是镁合金中最常见的杂质,很容易在铸造过程中被引入。根据经验,Mg中Fe的容许极限为170 mg/dm3,Fe的含量一旦超过这个浓度,镁合金腐蚀速率急剧增加。同样,一些杂质的容许极限(如Cu和Ni)也需严格控制。Hanawalt等[66]建立了一些杂质元素的容许极限,如Cu的容许极限为1000 mg/dm3,Ni的容许极限为5 mg/dm3。
降低杂质元素的含量可以显著提高镁合金的耐蚀性。其主要原理包括添加的合金元素与杂质结合而降低杂质的不利影响,纯化熔体和提高杂质的容许极限。在AZ系合金中,Fe通过与Al和Mn形成金属间化合物,可降低Fe的有害影响,从而降低其腐蚀速率[67-68]。Fe和Mn的含量关系显示于图 6,当Fe含量增加时,必须有相应的Mn含量与之相匹配以降低Fe的杂质效应[67]。Candan等[69]研究了Ti对AZ91镁合金腐蚀行为的影响,发现Ti可以清除超过Mg固溶极限的Fe和Si等有害杂质。
|
图 6 由经验数据得出的等值线图,表明0.1 mol/L氯化钠中的腐蚀电流密度在铁和锰含量的一定范围内的变化,其中x轴上的铁含量代表 0~500 mg/dm3[67] Fig. 6 Contour plot derived from empirical data indicating the variation in corrosion current density in 0.1 mol/L NaCl over a finite range of Fe and Mn content, whereby the Fe content on the x-axis represents 0-500 mg/dm3[67] |
通过在熔体中添加纯化熔体的合金元素来降低杂质含量也有一定的作用。杂质(特别是Fe和Ni)可以与Zr结合形成不溶的沉淀物,从而提高合金的纯度并显著降低腐蚀速率[70]。因此,含Zr的镁合金一般都有较高的耐蚀性,且对Fe,Ni杂质不敏感。
提高杂质的容许极限可以降低杂质含量的影响,如Mn对杂质Ni的容许极限有一定的作用[1, 17]。加入0.2%的Mn能稍微提高Ni杂质的容许极限;而加入1%就可以显著提高杂质Ni的容许极限。Zn也可以通过提高容许极限而减少杂质元素的含量,如提高Fe,Ni等在镁中的容许极限。
(4) 阴极毒化法。通过添加微量的合金元素砷(As)可以显著提高Mg的耐蚀性。原因主要是As可以大幅度抑制阴极动力学。Birbilis等[71]研究发现在镁中添加As可以干扰氢原子的重组,从而降低阴极动力学并显著提高镁的耐蚀性。这种阴极毒化抑制也适用于Ge元素[72-73],且Ge对人体是无毒的,所以研究Ge的阴极毒化机制仍是值得关注的。
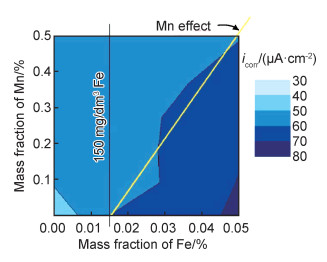
(5) 改变镁表面膜层。通常来说,添加合金元素会改变腐蚀层的致密性,不同的添加量也会影响膜层的致密程度。在腐蚀过程中,合金元素会以某种形式(氧化物或者氢氧化物等)存在于疏松的氢氧化镁膜层中,从而使腐蚀层变得更加致密来达到提高耐蚀性的目的。这里将改变镁表面膜层的影响分为两类,一类是添加少量的合金元素使膜层致密,另一类是通过添加大量合金元素来改变表面膜层结构。研究[74-77]发现,Mg-Sn合金中的Sn元素可以在腐蚀反应过程中以单质或化合物的形式存在于Mg(OH)2膜层中,从而增加腐蚀层的致密性,阻挡腐蚀的进一步发生。一些研究指出[74-75],在镁合金基体的表面可能会形成富锡层,抑制阴极析氢并显著降低腐蚀速率,但没有给出直接证据。而铟(In)元素也可以形成In(OH)3填充疏松的氢氧化镁腐蚀层[5, 19]。Hou等[5]通过控制铟(In)的添加量,构建了自生的双层Mg-In合金的腐蚀层。图 7显示了Mg-In合金腐蚀过程中双层膜形成机理[5]。腐蚀层呈现出内层的富In层和外层致密的氢氧化镁层,其中,外层由交替或者夹层分布的In/In(OH)3填充。这种新型界面结构显著增强了Mg-In合金的耐蚀性,并在腐蚀过程中表现出自修复功能,即使合金受到划伤或磨损,这种自修复双重保护层仍然有效。
|
图 7 Mg-In合金腐蚀过程中的横截面示意图[5] (a)In在Mg表面上的吸附和置换反应;(b)浸泡25天后形成的腐蚀层;(c)浸泡200天后形成的腐蚀层 Fig. 7 Schematic diagrams of the cross-sectional mechanism during corrosion of Mg-In alloys[5] (a)corrosion process such as adsorption and replacement reaction of In ions on Mg surface; (b)corrosion layer formed after a short period (25 days) immersion; (c)corrosion layer formed after a long period (200 days) immersion |
另外,稀土元素也可以改变腐蚀层的性质[59, 78-79],如Nd的添加会增加表面膜的钝化并抑制微电偶腐蚀,从而提高镁合金的耐蚀性。稀土元素可以进入到镁合金的表面膜中,降低表面的水合作用,进而使表面膜更加稳定[80-81]。但是,添加稀土元素还面临成本相对较高和稳定性较低的问题。
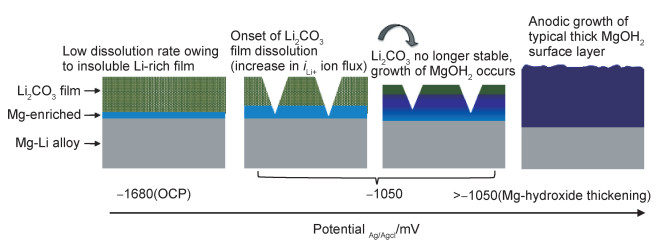
通过在镁合金中添加大量的Li元素来改变腐蚀层的结构[82-83]。Hou等[82]研究了Mg-33%Li(原子分数,下同)合金在NaCl溶液中的钝化和溶解行为,发现添加Li可以抑制阳极反应的动力学。同时,表面形成的腐蚀产物膜层由外层的Li2CO3和内层的Mg(OH)2组成,可以长期稳定地保护腐蚀膜层免于腐蚀介质的侵蚀(图 8)。
(6) 提高基体的惰性。通常来说,提高基体的惰性就是提高基体的电位。基体电位的提高可以降低与析出相之间的电位差,从而降低电偶腐蚀。所以固溶处理一般能提高镁合金的耐蚀性[13]。虽然固溶处理会牺牲镁合金的力学性能,但是对于耐蚀性的提高是非常重要的。Al除了能形成Mg17Al12相来调整微观组织和稳定镁表面膜外,也可以提高基相钝性[39]。然而,在基相中并非铝的含量越多越好,镁中铁杂质的容许极限几乎是随着铝的加入呈线性下降。因此,当铝含量较高时,会降低铁杂质的容许极限,致使腐蚀速率反而升高。另外,固溶于基体中的Zr对基体惰性的提高也有显著作用,它能较好地稳定α-Mg相,使耐蚀性提高[70]。
(7) 抑制镁的异常析氢。加入高析氢过电位元素可使镁合金的析氢反应降低,从而在一定程度上抑制镁合金的腐蚀。例如,添加Sn可以降低镁合金的析氢速率[74]。Ha等[74]研究了Sn在挤压Mg-5%Sn(质量分数,下同)合金的腐蚀和钝化行为中的作用,将这种降低析氢的现象归因于钝化膜与基体之间形成了Sn积累层。Hou等[84]通过恒电流极化测试和集气法研究了Mg-xIn合金在不同阳极电流密度下的析氢速率,结果表明3种Mg-xIn合金均存在较强的异常析氢现象,且析氢速率随着阳极电流密度的增加而增加。但是与高纯镁相比[51],在相同阳极电流密度下,Mg-xIn合金的析氢速率较低,且负差数率也较低。这说明In的加入可以降低镁合金的负差数效应。在阳极恒电流极化下测得的析氢速率明显依赖于Mg合金中In的含量,异常析氢的速率随In含量的增加而降低。3种Mg-xIn合金在相同外加阳极电流密度下的析氢交换电流密度均比纯镁低约1~2个数量级[42]。
(8) 细化晶粒。通常,细化晶粒不仅可以提高强韧性,也可以提高合金的耐蚀性,这已经被很多研究人员所证实[79, 85]。当第二相含量较多时,细化晶粒可以使沿晶界分布的第二相形成更多的屏障。稀土元素可以细化晶粒[26],Zr也是镁合金最有效的晶粒细化剂[70]。Homayun等[86]的研究表明添加3%的Al可以细化晶粒尺寸并提高Mg-Zn-Al-Ca合金的耐腐蚀性。Alvarez-Lopez等[87]研究了不同晶粒度的AZ31镁合金在模拟生物流体中的腐蚀行为,发现最小晶粒尺寸的AZ31合金表现出最佳的腐蚀行为。
综上所述,合金元素对镁腐蚀性能的影响因素多种多样。很多合金元素并不是单独地发挥上述作用,而是多重作用机制并存共同影响镁合金的腐蚀。例如,添加不同含量的Al既可以改变第二相的分布又可以提高镁基体的惰性,还可以改善膜层表面的稳定性。稀土元素既可以稳定镁的表面膜层也可以净化熔体。单一元素的多种作用相互影响使得元素对镁的腐蚀性能影响变得复杂。当在镁中添加多种合金元素时,不同元素之间的交互作用会产生更为复杂的情况。所以,研究合金元素对镁合金耐蚀性的影响及腐蚀机理仍是一个长期的过程。
本文介绍了一些合金元素对镁及其合金的几种腐蚀保护机制。一般而言,合金元素影响归因于:合金元素与镁基体的电位差;合金元素与镁形成第二相的种类与大小;合金元素在镁中的固溶度;合金元素对镁阴极和阳极的促进与抑制行为;合金元素与杂质的相互作用及合金元素是否具有细化晶粒的作用。这些因素均会影响保护机制的类型(保护机制的转变以及多种保护机制共存的情况)以及保护的程度。另外,抑制镁的异常析氢与阴极毒化和提高基体惰性的机理相似,但又有所差别。一般而言,提高基体的惰性可以抑制镁的异常析氢,但抑制镁的异常析氢却不一定可以提高基体的惰性。如As元素可以强烈地抑制阴极析氢反应,但As在镁中的固溶度极低,并未起到提高基体惰性的作用。关于有益合金元素对镁及其合金的相关保护机制和特征的内容列于表 2[1, 5, 19, 55-86]中,这些元素对设计新型耐蚀镁合金起到一定的指导性。通过元素之间的协同作用也可以开发出多元镁合金,使不同机制可以协同提高镁合金的耐蚀性。而有害元素一般为不溶于镁合金或固溶度极低的一类杂质元素,如Fe,Ni,Cu,Co,Sr,Ag,Au,Si等。通常在合金熔炼过程中应避免此类元素的引入。
| Protection mechanism | Related alloying element | Elemental characteristic |
| Microstructure optimization | Al,Ge,In,Sn | The alloying elements can form a second phase with Mg or form a segregation |
| Sacrificial protection of theanode phase | Ca | The formed second phase potential is lower than that of the Mg matrix |
| Reduction of impurity content | Mn,Ti,Zr,Zn,Be | Elements can bind to impurities, purify the melt and increase the tolerance limits of impurities |
| Cathodic poisoning | As,Ge | The element can strongly inhibit the cathodic reaction |
| Change of surface layer | Li,In,Sn,Al,Zn,RE | Reaction products of alloying elements can fill or build up corrosion layers |
| Improvement of matrix inertia | Al,Zr,In,Zn,Sn,Pb | The introduced elements can increase the matrix potential |
| Inhibition of anomaloushydrogen evolution | Sn,In,Al,Zn,Pb,Mn | The element has the ability to increase the hydrogen evolution overpotential of Mg |
| Grain refinement | Zr,RE,Al,Y,Sn,In,Sb,Ca | Alloying elements can refine the microstructure |
(1) 新型镁合金的开发。虽然有大量学者已经对镁合金耐蚀性的影响进行了大量研究,但是采用合金化方法使镁合金具有较好的耐蚀性仍是一个棘手的问题,很难做到“不锈镁”。这是因为镁的电极电位很低,与第二相之间的电位差很大。如果能通过添加合金元素使其与第二相之间的电位差趋于零,这样就不会发生电化学腐蚀。另外,镁合金表面氧化物/氢氧化物膜较疏松,若采用不同元素配合改变表面膜层的结构,就能使镁合金与腐蚀介质隔离,提高镁合金的耐蚀性。因此,有关添加合金元素对镁合金腐蚀理论的研究仍然是一个漫长的过程。
(2) 镁纳米复合材料。镁基复合材料具有较好的力学性能,但是使用增强材料会导致基体产生更快的腐蚀。例如,在用碳纤维和碳纳米管增强的镁合金中由于存在电偶腐蚀,腐蚀速率非常大。这需要考虑基体/增强相界面处的异质性以及周围基体的改性。今后的研究可集中在廉价和化学相容的合金和增强材料上,并改善基体与增强相界面的抗腐蚀能力,减小电偶腐蚀效应。
| [1] |
ESMAILY M, SVENSSON J E, FAJARDO S, et al. Fundamentals and advances in magnesium alloy corrosion[J]. Progress in Materials Science, 2017, 89(1): 92-193. |
| [2] |
ZHONG L, WANG Y, LUO H, et al. Influence of aging prior to extrusion on the microstructure and corrosion resistance of Mg-8Sn-2Zn-0.2Mn alloy[J]. Journal of Alloys and Compounds, 2019, 780: 783-791. DOI:10.1016/j.jallcom.2018.11.400 |
| [3] |
ZHAO Y C, ZHAO M C, XU R, et al. Formation and characteristic corrosion behavior of alternately lamellar arranged α and β in as-cast AZ91 Mg alloy[J]. Journal of Alloys and Compounds, 2019, 770: 549-558. DOI:10.1016/j.jallcom.2018.08.103 |
| [4] |
POLLOCK T M. Weight loss with magnesium alloys[J]. Science, 2010, 328: 986-987. DOI:10.1126/science.1182848 |
| [5] |
YIN M, HOU L, WANG Z, et al. Self-generating construction of applicable corrosion-resistant surface structure of magnesium alloy[J]. Corrosion Science, 2021, 184: 109378. DOI:10.1016/j.corsci.2021.109378 |
| [6] |
WANG N, MU Y, XIONG W, et al. Effect of crystallographic orientation on the discharge and corrosion behaviour of AP65 magnesium alloy anodes[J]. Corrosion Science, 2018, 144: 107-126. DOI:10.1016/j.corsci.2018.08.003 |
| [7] |
NAZER N S, DENYS R V, ANDERSEN H F, et al. Nanostructured magnesium silicide Mg2Si and its electrochemical performance as an anode of a lithium ion battery[J]. Journal of Alloys and Compounds, 2017, 718(17): 478-491. |
| [8] |
DENG M, HÖCHE D, LAMAKA S V, et al. Mg-Ca binary alloys as anodes for primary Mg-air batteries[J]. Journal of Power Sources, 2018, 396: 109-118. DOI:10.1016/j.jpowsour.2018.05.090 |
| [9] |
LIU X, LIU S, XUE J. Discharge performance of the magnesium anodes with different phase constitutions for Mg-air batteries[J]. Journal of Power Sources, 2018, 396: 667-674. DOI:10.1016/j.jpowsour.2018.06.085 |
| [10] |
SCHLOFFER D, BOZORGI S, SHERSTNEV P, et al. Manufacturing and characterization of magnesium alloy foils for use as anode materials in rechargeable magnesium ion batteries[J]. Journal of Power Sources, 2017, 367: 138-144. DOI:10.1016/j.jpowsour.2017.09.062 |
| [11] |
曾静, 武东政, 庄奕超, 等. 镁电池正极材料性能提升策略的研究进展[J]. 材料工程, 2021, 49(2): 10-20. ZENG J, WU D Z, ZHUANG Y C, et al. Research progress in strategies for improving performance of cathode materials for magnesium batteries[J]. Journal of Materials Engineering, 2021, 49(2): 10-20. |
| [12] |
LI L Y, CUI L Y, ZENG R C, et al. Advances in functionalized polymer coatings on biodegradable magnesium alloys-a review[J]. Acta Biomater, 2018, 79: 23-36. DOI:10.1016/j.actbio.2018.08.030 |
| [13] |
PANEMANGALORE D B, SHABADI R, GUPTA M, et al. Effect of fluoride coatings on the corrosion behavior of Mg-Zn-Er alloys[J]. Surfaces and Interfaces, 2019, 14: 72-81. DOI:10.1016/j.surfin.2018.11.007 |
| [14] |
CHENG W L, MA S C, BAI Y, et al. Corrosion behavior of Mg-6Bi-2Sn alloy in the simulated body fluid solution: the influence of microstructural characteristics[J]. Journal of Alloys and Compounds, 2018, 731: 945-954. DOI:10.1016/j.jallcom.2017.10.073 |
| [15] |
万天, 宋述鹏, 王今朝, 等. 生物医用镁合金腐蚀行为的研究进展[J]. 材料工程, 2020, 48(1): 19-26. WAN T, SONG S P, WANG J Z, et al. Research progress in corrosion behavior of biomedical magnesium alloys[J]. Journal of Materials Engineering, 2020, 48(1): 19-26. |
| [16] |
NORDLIEN J H, ONO S, MASUKO N, et al. A TEM investigation of naturally formed oxide films on pure magnesium[J]. Corrosion Science, 1997, 39(8): 1397-1414. DOI:10.1016/S0010-938X(97)00037-1 |
| [17] |
LING S G, ANDREJ A. Corrosion mechanisms of magnesium alloys[J]. Advanced Engineering Materials, 1999, 1(1): 11-33. DOI:10.1002/(SICI)1527-2648(199909)1:1<11::AID-ADEM11>3.0.CO;2-N |
| [18] |
FUGGLE J C, WATSON L M, FABIAN D J, et al. X-ray photoelectron studies of the reaction of clean metals (Mg, Al, Cr, Mn) with oxygen and water vapour[J]. Surface Science, 1975, 49(1): 61-76. DOI:10.1016/0039-6028(75)90328-3 |
| [19] |
YIN M, HOU L, LIU X, et al. Tailoring the micromorphology of the as-cast Mg-Sn-In alloys to corrosion-resistant microstructures via adjusting In concentration[J]. Journal of Alloys and Compounds, 2019, 811: 152024. DOI:10.1016/j.jallcom.2019.152024 |
| [20] |
LIAO J, HOTTA M, MORI Y. Improved corrosion resistance of a high-strength Mg-Al-Mn-Ca magnesium alloy made by rapid solidification powder metallurgy[J]. Materials Science and Engineering: A, 2012, 544: 10-20. DOI:10.1016/j.msea.2012.02.046 |
| [21] |
ATRENS A, SONG G L, CAO F, et al. Advances in Mg corrosion and research suggestions[J]. Journal of Magnesium and Alloys, 2013, 1(3): 177-200. DOI:10.1016/j.jma.2013.09.003 |
| [22] |
THOMAS S, MEDHEKAR N V, FRANKEL G S, et al. Corrosion mechanism and hydrogen evolution on Mg[J]. Current Opinion in Solid State and Materials Science, 2015, 19(2): 85-94. DOI:10.1016/j.cossms.2014.09.005 |
| [23] |
LAMAKA S V, HÖCHE D, PETRAUSKAS R P, et al. A new concept for corrosion inhibition of magnesium: suppression of iron re-deposition[J]. Electrochemistry Communications, 2016, 62: 5-8. DOI:10.1016/j.elecom.2015.10.023 |
| [24] |
SONG Y, SHAN D, CHEN R, et al. Effect of second phases on the corrosion behaviour of wrought Mg-Zn-Y-Zr alloy[J]. Corrosion Science, 2010, 52(5): 1830-1837. DOI:10.1016/j.corsci.2010.02.017 |
| [25] |
MIAO H, HUANG H, SHI Y, et al. Effects of solution treatment before extrusion on the microstructure, mechanical properties and corrosion of Mg-Zn-Gd alloy in vitro[J]. Corrosion Science, 2017, 122: 90-99. DOI:10.1016/j.corsci.2017.01.001 |
| [26] |
YIN Z, CHEN Y, YAN H, et al. Effects of the second phases on corrosion resistance of AZ91-xGd alloys treated with ultrasonic vibration[J]. Journal of Alloys and Compounds, 2019, 783: 877-885. DOI:10.1016/j.jallcom.2019.01.002 |
| [27] |
HOU L, LI Y, SUN J, et al. Enhancement corrosion resistance of Mg Al layered double hydroxides films by anion-exchange mechanism on magnesium alloys[J]. Applied Surface Science, 2019, 487: 101-108. DOI:10.1016/j.apsusc.2019.05.048 |
| [28] |
ASCENCIO M, PEKGULERYUZ M, OMANOVIC S. Corrosion behaviour of polypyrrole-coated WE43 Mg alloy in a modified simulated body fluid solution[J]. Corrosion Science, 2018, 133: 261-275. DOI:10.1016/j.corsci.2018.01.044 |
| [29] |
MISKOVIC D M, POHL K, BIRBILIS N, et al. Formation of a phosphate conversion coating on bioresorbable Mg-based metallic glasses and its effect on corrosion performance[J]. Corrosion Science, 2017, 129: 214-225. DOI:10.1016/j.corsci.2017.10.014 |
| [30] |
YANG H, GUO X, WU G, et al. Electrodeposition of chemically and mechanically protective Al-coatings on AZ91D Mg alloy[J]. Corrosion Science, 2011, 53(1): 381-387. DOI:10.1016/j.corsci.2010.09.047 |
| [31] |
YANG H, GUO X, CHEN X, et al. A homogenisation pre-treatment for adherent and corrosion-resistant Ni electroplated coatings on Mg-alloy AZ91D[J]. Corrosion Science, 2014, 79: 41-49. DOI:10.1016/j.corsci.2013.10.024 |
| [32] |
MOON S, NAM Y. Anodic oxidation of Mg-Sn alloys in alkaline solutions[J]. Corrosion Science, 2012, 65: 494-501. DOI:10.1016/j.corsci.2012.08.050 |
| [33] |
HOU L, DANG N, YANG H, et al. A combined inhibiting effect of sodium alginate and sodium phosphate on the corrosion of magnesium alloy AZ31 in NaCl solution[J]. Journal of the Electrochemical Society, 2016, 163(8): C486-C494. DOI:10.1149/2.0941608jes |
| [34] |
MAKAR GL, KRUGER J. Corrosion of magnesium[J]. International Materials Reviews, 1993, 38(3): 138-153. DOI:10.1179/imr.1993.38.3.138 |
| [35] |
习小明. 多相氧化还原法制备超微粉末的理论分析[J]. 新余高专学报, 2009, 14(6): 12-15. XI X M. Theoretic analysis of preparation of ultramicro powder through multi-phase oxidation reduction[J]. Journal of Xinyu College, 2009, 14(6): 12-15. DOI:10.3969/j.issn.2095-3054.2009.06.003 |
| [36] |
CAO F, SONG G L, ATRENS A. Corrosion and passivation of magnesium alloys[J]. Corrosion Science, 2016, 111: 835-845. DOI:10.1016/j.corsci.2016.05.041 |
| [37] |
PETTY R L, DAVIDSON A W, KLEINBERG J. The anodic oxidation of magnesium metal: evidence for the existence of unipositive magnesium1, 2[J]. Journal of the American Chemical Society, 1954, 76(2): 363-366. DOI:10.1021/ja01631a013 |
| [38] |
ATRENS A, SONG G L, LIU M, et al. Review of recent developments in the field of magnesium corrosion[J]. Advanced Engineering Materials, 2015, 17(4): 400-453. DOI:10.1002/adem.201400434 |
| [39] |
SONG G, ATRENS A. Understanding magnesium corrosion-a framework for improved alloy performance[J]. Advanced Engineering Materials, 2003, 5(12): 837-858. DOI:10.1002/adem.200310405 |
| [40] |
SONG G, ATRENS A. Recent insights into the mechanism of magnesium corrosion and research suggestions[J]. Advanced Engineering Materials, 2007, 9(3): 177-183. DOI:10.1002/adem.200600221 |
| [41] |
ATRENS A, LIU M, ZAINAL ABIDIN N I. Corrosion mechanism applicable to biodegradable magnesium implants[J]. Materials Science and Engineering: B, 2011, 176(20): 1609-1636. DOI:10.1016/j.mseb.2010.12.017 |
| [42] |
BIRBILIS N, KING A D, THOMAS S, et al. Evidence for enhanced catalytic activity of magnesium arising from anodic dissolution[J]. Electrochimica Acta, 2014, 132: 277-283. DOI:10.1016/j.electacta.2014.03.133 |
| [43] |
SALLEH S H, THOMAS S, YUWONO J A, et al. Enhanced hydrogen evolution on Mg (OH)2 covered Mg surfaces[J]. Electrochimica Acta, 2015, 161: 144-152. DOI:10.1016/j.electacta.2015.02.079 |
| [44] |
WILLIAMS G, BIRBILIS N, MCMURRAY H N. Controlling factors in localised corrosion morphologies observed for magnesium immersed in chloride containing electrolyte[J]. Faraday Discuss, 2015, 180: 313-330. DOI:10.1039/C4FD00268G |
| [45] |
CURIONI M. The behaviour of magnesium during free corrosion and potentiodynamic polarization investigated by real-time hydrogen measurement and optical imaging[J]. Electrochimica Acta, 2014, 120: 284-292. DOI:10.1016/j.electacta.2013.12.109 |
| [46] |
LYSNE D, THOMAS S, HURLEY M F, et al. On the Fe enrichment during anodic polarization of Mg and its impact on hydrogen evolution[J]. Journal of The Electrochemical Society, 2015, 162(8): 396-402. DOI:10.1149/2.0251508jes |
| [47] |
BIRBILIS N, CAIN T, LAIRD J S, et al. Nuclear microprobe analysis for determination of element enrichment following magnesium dissolution[J]. ECS Electrochemistry Letters, 2015, 4(10): 34-37. DOI:10.1149/2.0081510eel |
| [48] |
HÖCHE D, BLAWERT C, LAMAKA S V, et al. The effect of iron re-deposition on the corrosion of impurity-containing magnesium[J]. Physical Chemistry Chemical Physics, 2016, 18(2): 1279-1291. DOI:10.1039/C5CP05577F |
| [49] |
FRANKEL G S, SAMANIEGO A, BIRBILIS N. Evolution of hydrogen at dissolving magnesium surfaces[J]. Corrosion Science, 2013, 70: 104-111. DOI:10.1016/j.corsci.2013.01.017 |
| [50] |
WILLIAMS G, BIRBILIS N, MCMURRAY H N. The source of hydrogen evolved from a magnesium anode[J]. Electrochemistry Communications, 2013, 36: 1-5. DOI:10.1016/j.elecom.2013.08.023 |
| [51] |
FAJARDO S, FRANKEL G S. Effect of impurities on the enhanced catalytic activity for hydrogen evolution in high purity magnesium[J]. Electrochimica Acta, 2015, 165: 255-267. DOI:10.1016/j.electacta.2015.03.021 |
| [52] |
GUSIEVA K, DAVIES C H J, SCULLY J R, et al. Corrosion of magnesium alloys: the role of alloying[J]. International Materials Reviews, 2014, 60(3): 169-194. |
| [53] |
HU Z, LIU R L, KAIRY S K, et al. Effect of Sm additions on the microstructure and corrosion behavior of magnesium alloy AZ91[J]. Corrosion Science, 2019, 149: 144-152. DOI:10.1016/j.corsci.2019.01.024 |
| [54] |
CAO F F, DENG K K, NIE K B, et al. Microstructure and corrosion properties of Mg-4Zn-2Gd-0.5Ca alloy influenced by multidirectional forging[J]. Journal of Alloys and Compounds, 2019, 770: 1280-1220. |
| [55] |
SONG G L, ATAENS A, WU X L, et al. Corrosion behaviour of AZ21, AZ501 and AZ91 in sodium chloride[J]. Corrosion Science, 1998, 40(10): 1769-1791. DOI:10.1016/S0010-938X(98)00078-X |
| [56] |
LIU X, YIN M, ZHANG S, et al. Corrosion behavior of the as-cast and as-solid solution Mg-Al-Ge alloy[J]. Materials, 2018, 11(10): 1812-1821. DOI:10.3390/ma11101812 |
| [57] |
JIANG P, BLAWERT C, HOU R, et al. Microstructural influence on corrosion behavior of MgZnGe alloy in NaCl solution[J]. Journal of Alloys and Compounds, 2019, 783: 179-192. DOI:10.1016/j.jallcom.2018.12.296 |
| [58] |
FAN Y, WU G, ZHAI C. Influence of cerium on the microstructure, mechanical properties and corrosion resistance of magnesium alloy[J]. Materials Science and Engineering: A, 2006, 433(1): 208-215. |
| [59] |
ZHANG J, WANG J, QIU X, et al. Effect of Nd on the microstructure, mechanical properties and corrosion behavior of die-cast Mg-4Al-based alloy[J]. Journal of Alloys and Compounds, 2008, 464(1): 556-564. |
| [60] |
ZHANG J, NIU X, QIU X, et al. Effect of yttrium-rich misch metal on the microstructures, mechanical properties and corrosion behavior of die cast AZ91 alloy[J]. Journal of Alloys and Compounds, 2009, 471(1): 322-330. |
| [61] |
MEN H, FAN Z. Effects of solute content on grain refinement in an isothermal melt[J]. Acta Materialia, 2011, 59(7): 2704-2712. DOI:10.1016/j.actamat.2011.01.008 |
| [62] |
YANG J, PENG J, NYBERG E A, et al. Effect of Ca addition on the corrosion behavior of Mg-Al-Mn alloy[J]. Applied Surface Science, 2016, 369: 92-100. DOI:10.1016/j.apsusc.2016.01.283 |
| [63] |
CAO F, SHI Z, SONG G L, et al. Corrosion behaviour in salt spray and in 3.5% NaCl solution saturated with Mg(OH)2 of as-cast and solution heat-treated binary Mg-X alloys: X=Mn, Sn, Ca, Zn, Al, Zr, Si, Sr[J]. Corrosion Science, 2013, 76: 60-97. DOI:10.1016/j.corsci.2013.06.030 |
| [64] |
JEONG Y S, KIM W J. Enhancement of mechanical properties and corrosion resistance of Mg-Ca alloys through microstructural refinement by indirect extrusion[J]. Corrosion Science, 2014, 82: 392-403. DOI:10.1016/j.corsci.2014.01.041 |
| [65] |
KIM K H, NAM N D, KIM J G, et al. Effect of calcium addition on the corrosion behavior of Mg-5Al alloy[J]. Intermetallics, 2011, 19(12): 1831-1838. DOI:10.1016/j.intermet.2011.07.024 |
| [66] |
MCNULTY R E, HANAWALT J D. Some corrosion characteristics of high purity magnesium alloys[J]. Transactions of the Electrochemical Society, 1942, 81(1): 423-433. DOI:10.1149/1.3071389 |
| [67] |
SIMANJUNTAK S, CAVANAUGH M K, GANDEL D S, et al. The influence of iron, manganese, and zirconium on the corrosion of magnesium: an artificial neural network approach[J]. Corrosion, 2015, 71(2): 199-208. DOI:10.5006/1467 |
| [68] |
NAM N D, MATHESH M, FORSYTH M, et al. Effect of manganese additions on the corrosion behavior of an extruded Mg-5Al based alloy[J]. Journal of Alloys and Compounds, 2012, 542: 199-206. DOI:10.1016/j.jallcom.2012.07.083 |
| [69] |
CANDAN S, UNAL M, KOC E, et al. Effects of titanium addition on mechanical and corrosion behaviours of AZ91 magnesium alloy[J]. Journal of Alloys and Compounds, 2011, 509(5): 1958-1963. DOI:10.1016/j.jallcom.2010.10.100 |
| [70] |
CHANG J W, FU P H, GUO X W, et al. The effects of heat treatment and zirconium on the corrosion behaviour of Mg-3Nd-0.2Zn-0.4Zr (wt.%) alloy[J]. Corrosion Science, 2007, 49(6): 2612-2627. DOI:10.1016/j.corsci.2006.12.011 |
| [71] |
BIRBILIS N, WILLIAMS G, GUSIEVA K, et al. Poisoning the corrosion of magnesium[J]. Electrochemistry Communications, 2013, 34: 295-298. DOI:10.1016/j.elecom.2013.07.021 |
| [72] |
LIU R L, HURLEY M F, KVRYAN A, et al. Controlling the corrosion and cathodic activation of magnesium via microalloying additions of Ge[J]. Scientific Reports, 2016, 6: 28747. DOI:10.1038/srep28747 |
| [73] |
LIU R L, ZENG Z R, SCULLY J R, et al. Simultaneously improving the corrosion resistance and strength of magnesium via low levels of Zn and Ge additions[J]. Corrosion Science, 2018, 140: 18-29. DOI:10.1016/j.corsci.2018.06.027 |
| [74] |
HA H Y, KANG J Y, YANG J, et al. Role of Sn in corrosion and passive behavior of extruded Mg-5wt%Sn alloy[J]. Corrosion Science, 2016, 102: 355-362. DOI:10.1016/j.corsci.2015.10.028 |
| [75] |
YANG J, YIM C D, YOU B S. Effects of Sn in α-Mg matrix on properties of surface films of Mg-xSn (x=0, 2, 5wt%) alloys[J]. Materials and Corrosion, 2016, 67(5): 531-541. DOI:10.1002/maco.201508585 |
| [76] |
CAIN T W, GLOVER C F, SCULLY J R. The corrosion of solid solution Mg-Sn binary alloys in NaCl solutions[J]. Electrochimica Acta, 2019, 297: 564-575. DOI:10.1016/j.electacta.2018.11.118 |
| [77] |
METALNIKOV P, BEN-HAMU G, ELIEZER D, et al. Role of Sn in microstructure and corrosion behavior of new wrought Mg-5Al alloy[J]. Journal of Alloys and Compounds, 2019, 777: 835-849. DOI:10.1016/j.jallcom.2018.11.003 |
| [78] |
NAYYERI M J, KHOMAMIZADEH F. Effect of RE elements on the microstructural evolution of as cast and SIMA processed Mg-4Al alloy[J]. Journal of Alloys and Compounds, 2011, 509(5): 1567-1572. DOI:10.1016/j.jallcom.2010.10.147 |
| [79] |
ARRABAL R, PARDO A, MERINO M C, et al. Effect of Nd on the corrosion behaviour of AM50 and AZ91D magnesium alloys in 3.5wt.% NaCl solution[J]. Corrosion Science, 2012, 55: 301-312. DOI:10.1016/j.corsci.2011.10.033 |
| [80] |
WU L, LI H. Effect of selective oxidation on corrosion behavior of Mg-Gd-Y-Zn-Zr alloy[J]. Corrosion Science, 2018, 142: 238-248. DOI:10.1016/j.corsci.2018.07.026 |
| [81] |
JIA R, YU S, LI D, et al. Study on the effect of mischmetal (La, Ce) on the micro-galvanic corrosion of AZ91 alloy using multiscale methods[J]. Journal of Alloys and Compounds, 2019, 778: 427-438. DOI:10.1016/j.jallcom.2018.11.030 |
| [82] |
HOU L, RAVEGGI M, CHEN X B, et al. Investigating the passivity and dissolution of a corrosion resistant Mg-33at.% Li alloy in aqueous chloride using online ICP-MS[J]. Journal of the Electrochemical Society, 2016, 163(6): 324-329. DOI:10.1149/2.0871606jes |
| [83] |
XU W, BIRBILIS N, SHA G, et al. A high-specific-strength and corrosion-resistant magnesium alloy[J]. Nat Mater, 2015, 14(12): 1229-1235. DOI:10.1038/nmat4435 |
| [84] |
BAO T, HOU L, SUN J, et al. Effect of indium on the negative difference effect for magnesium alloy[J]. Journal of the Electrochemical Society, 2021, 168(3): 031515. DOI:10.1149/1945-7111/abee5c |
| [85] |
ZHANG J L, LIU Y L, ZHOU J, et al. Kinetic study on the corrosion behavior of AM60 magnesium alloy with different Nd contents[J]. Journal of Alloys and Compounds, 2015, 629: 290-296. DOI:10.1016/j.jallcom.2014.12.143 |
| [86] |
HOMAYUN B, AFSHAR A. Microstructure, mechanical properties, corrosion behavior and cytotoxicity of Mg-Zn-Al-Ca alloys as biodegradable materials[J]. Journal of Alloys and Compounds, 2014, 607: 1-10. DOI:10.1016/j.jallcom.2014.04.059 |
| [87] |
ALVAREZ-LOPEZ M, PEREDA M D, del VALLE J A, et al. Corrosion behaviour of AZ31 magnesium alloy with different grain sizes in simulated biological fluids[J]. Acta Biomater, 2010, 6(5): 1763-1771. DOI:10.1016/j.actbio.2009.04.041 |
 2021, Vol. 49
2021, Vol. 49