文章信息
- 张少威, 蒲秀好, 万艳红, 祝康, 夏长荣
- ZHANG Shao-wei, PU Xiu-hao, WAN Yan-hong, ZHU Kang, XIA Chang-rong
- 掺杂对Sr2Fe1.5Mo0.5O6-δ阳极材料电化学性能影响研究进展
- Research progress in effect of element doping on electrochemical properties of Sr2Fe1.5Mo0.5O6-δ based anode materials
- 材料工程, 2021, 49(9): 1-13
- Journal of Materials Engineering, 2021, 49(9): 1-13.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.001139
-
文章历史
- 收稿日期: 2020-12-16
- 修订日期: 2021-01-23
2. 安徽壹石通材料科技股份有限公司 能源材料中心, 合肥 230088
2. Energy Materials Center, Anhui Estone Materials Technology Co., Ltd., Hefei 230088, China
固体氧化物燃料电池(solid oxide fuel cell,SOFC)是一种将燃料中的化学能直接转化为电能的高效发电装置,具有燃料使用范围广(H2,CO,CH4等)、工作温度高(一般大于600 ℃)、能量转化率高(实际效率达63%,热电联产效率高达85%)、全固态等特点,被称为“吃杂粮的大力士”,一直被广泛研究[1-2]。SOFC的单电池由多孔的阳极、致密的电解质和多孔的阴极三部分组成,工作原理概括为三方面。(1)阴极还原。空气中的氧气分子吸附在阴极材料表面,得到外电路中的电子,被还原成O2-。(2)离子传导。在氧化学位差的驱动下,O2-通过致密的电解质,到达阳极侧。(3)阳极氧化。O2-在阳极侧氧化燃料气体,如H2,CO,CH4等,生成H2O和CO2,并释放电子到外电路[1, 3]。以H2燃料为例,反应可用式(1)~(3)表示:
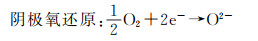
|
(1) |

|
(2) |
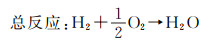
|
(3) |
其中阳极是燃料转化的场所,除了发生氧化反应外,还可能发生碳氢化合物如甲烷的裂解反应。阳极材料应该满足多方面要求,包括在高温和还原气氛下的良好化学稳定性,高的催化氧化活性,高的氧离子和电子电导率,与电解质材料之间的良好热匹配性和化学兼容性等[4]。阳极材料一般采用金属Ni和固体电解质组成的金属陶瓷复合材料[5-8],这类材料具有很高的催化活性,并满足电导率、化学兼容性等要求。然而,金属Ni基阳极在SOFC的实际应用中遇到了很多问题,当使用碳氢燃料时,容易积碳[9];当燃料气中含有杂质时(如硫元素),容易使催化剂发生硫中毒现象[10-12];电池的热循环和氧化还原循环性能较差[13]。近年来,具有钙钛矿结构的氧化物陶瓷材料被广泛研究,以能弥补Ni基阳极的不足。钙钛矿阳极材料主要基于Mn,Fe,Cr,Ti和Mo等过渡金属元素,例如La1-xSrxCr1-yMnyO3-δ[14-16],La1-xSrxCr1-yFeyO3-δ[17-19],La1-xSrxTi1-yFeyO3-δ[20-22],PrBaMn2O6-δ[23-24],Sr2Mg1-xMnxMoO6-δ[25-26]和Sr2Fe2-xMoxO6-δ[27-28]等。其中,组成为Sr2Fe1.5Mo0.5O6-δ(SFM)的材料在氧化和还原气氛中均稳定,具有相对较高的电导率、较好的稳定性和非常优异的电化学性能[29],是一种非常有应用前景的SOFC阳极材料,自2010年首次被Chen等[27]报道后,备受关注,一直被广泛研究。
由于SFM阳极材料在SOFC领域表现出极大的应用前景,特别是通过掺杂改性后,其综合性能得到进一步优化。对SFM掺杂改性研究的总结有利于加强其结构与性能关系的理解,并将有效推动相关材料的基础研究和应用研究。该综述详细介绍了SFM钙钛矿阳极材料的物理、化学性质,并根据ABO3型钙钛矿可掺杂的位置,重点讨论了A位、B位和O位掺杂对SFM的容忍因子、晶体结构、稳定性、电导率、热膨胀系数和电化学性能等的影响,最后展望了未来的研究方向。
1 Sr2Fe1.5Mo0.5O6-δ钙钛矿阳极 1.1 晶体结构钙钛矿的结构一般可用ABO3的通式来描述,理想的钙钛矿为立方结构,通过A位、B位或O位的元素掺杂,可以改变钙钛矿的对称性,从而影响材料的使用性能。为了描述钙钛矿结构对称性,Goldschmidt提出了容忍因子t的概念,可用式(4)表示:
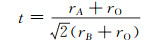
|
(4) |
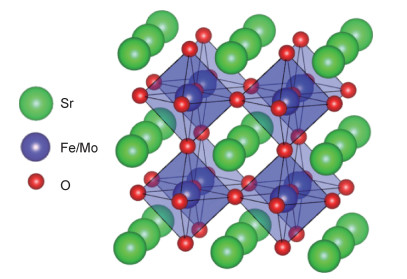
式中:rA代表A位离子12配位时的半径;rB代表B位离子6配位时的半径;rO代表氧离子6配位时的半径。当t=1时,钙钛矿为理想的立方结构。掺杂可以改变t值,使钙钛矿材料发生结构畸变,并呈现出立方、三方、正交等多种晶系。SFM的容忍因子t=0.989[30],非常接近1,因此,通常认为SFM为立方钙钛矿结构,这与Liu等[27]通过实验测得的结果一致。SFM的晶胞结构如图 1所示,其中B位元素Fe/Mo与O元素形成Fe/Mo-O6正八面体结构,配位数为6。A位元素Sr占据八面体之间的间隙,配位数为12。
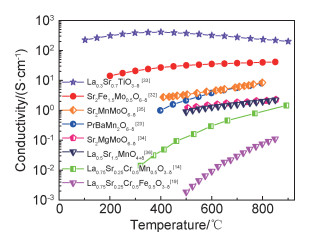
SOFC钙钛矿阳极材料包括载流子为电子空穴的p型半导体氧化物和载流子为电子的n型半导体氧化物,在阳极的还原气氛中,p型半导体材料的电导率相对较低,一般低于10 S/cm;n型半导体如掺杂的SrTiO3,Sr2MgMoO6,Sr2FeMoO6等,它们在还原气氛中电导率较高[31]。SFM作为一种新型的钙钛矿阳极材料,在阳极工作气氛中转变为n型半导体,电导率较高,根据合成条件的不同,SFM的电导率在几十到几百之间均有报道,例如,在H2气氛中,800 ℃时的电导率为39.9 S/cm[32](图 2),低于La0.3Sr0.7TiO3-δ[33],高于其他阳极材料;在800 ℃时,双钙钛矿Sr2MgMoO6-δ(SMgM)[34],Sr2MnMoO6-δ(SMnM)[35]和PrBaMn2O6-δ(PBM)[23]的电导率分别为2.13,8.1 S/cm和8.16 S/cm,Ruddlesden-Popper(R-P)相La0.5Sr1.5MnO4+δ(LSM)[36]的电导率为1.98 S/cm,以及钙钛矿La0.75Sr0.25Cr0.5Mn0.5O3-δ(LSCrM)[14]和La0.75Sr0.25Cr0.5Fe0.5O3-δ(LSCrF)[19]的电导率分别为0.89 S/cm和0.073 S/cm。除了高的电子电导率,800 ℃时,SFM氧离子电导率也高达0.13 S/cm[37],因此,SFM是一种理想的混合电子-离子导体材料。
在氧化和还原气氛中,SFM均有很好的化学稳定性,即使在干燥的氢气中,1000 ℃下处理24 h,也没有检测到杂相的生成[27]。同时,也有文献报道[32],在湿氢气中,800 ℃下还原5 h,检测到了极少量的Fe,原因可能与SFM粉体制备条件和工艺有关。值得一提的是,即使有少量Fe析出,SFM依旧保持钙钛矿结构的稳定性,可能是Mo6+/Mo5+与Fe3+/Fe2+的交互作用,使得铁不被进一步还原,保证了SFM在H2气氛中结构稳定。因此,可以认为在SOFC阳极工作条件下,SFM是稳定的[32]。同时,SFM与常用的电解质La0.9Sr0.1Ga0.8Mg0.2O3-δ(LSGM),Sm0.2Ce0.8O2-δ(SDC) 和BaZr0.1Ce0.7Y0.2O3-δ (BZCY)有很好的化学兼容性,即使在1400 ℃下处理24 h,也不会发生固相反应,但是在1000 ℃下,就会和Y0.16Zr0.84O2-δ(YSZ)反应,生成SrZrO3等杂相[27]。因此,使用YSZ电解质时,需要制备氧化铈阻隔层,防止YSZ与SFM反应。SFM在50~950 ℃范围内的热膨胀系数(TEC)为16.33×10-6 K-1,比常用电解质的TEC稍大,例如电解质LSGM的TEC为12.17×10-6 K-1,电解质YSZ的TEC为10.8×10-6 K-1[38]。
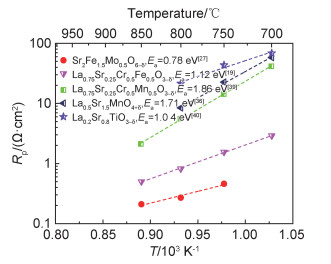
1.4 电化学性能DFT计算表明[29],在SFM中,Fe的3d轨道与O的2p轨道具有强杂化作用,电子主要通过Fe—O—Fe键迁移,SFM具有极低的氧空位形成能,氧空位的形成利于氧离子迁移;此外,实验结果也表明SFM具有较高的氧离子和电子电导率[27, 37]。因此,SFM具有非常优异的电催化性能,例如,在800 ℃和湿H2气氛下,SFM/LSGM/SFM对称电池的极化阻抗仅为0.27 Ω·cm2(图 3),此性能与经典的Ni-YSZ阳极性能相当[27],比常用的钙钛矿阳极材料性能好几到几十倍[19, 36, 39],例如,在800 ℃,LSCrF[19],LSCrM[39],LSM[36]和La0.2Sr0.8TiO3-δ(LST)[40]的极化阻抗分别为0.80,5.60,8.70 Ω·cm2和21.45 Ω·cm2。此外,SFM电极反应的活化能为0.78 eV[27],低于其他Fe基和Ti基材料,如LSCrF(Ea=1.12 eV)[19]和LST(Ea=1.04 eV)[40],远低于Mn基材料的活化能,如LSCrM(Ea=1.86 eV)[39]和LSM(Ea=1.71 eV)[36]。因此,在中低温下,SFM的电化学性能相对更好,是一种极有希望的SOFC钙钛矿阳极材料。
通过电池结构设计,可以提高SFM的电化学性能[41],例如,与金属Ni[42]和电解质SDC[28, 43]组成复合电极,采用浸渍制备纳米结构[44]等。为了提高电化学性能,SFM的掺杂改性被更广泛研究。容忍因子t在0.89~1.06之间,钙钛矿均可稳定存在[45],通过掺杂,可以调控SFM的相结构、稳定性、电导率、热膨胀系数和电催化活性等性能。根据t值的计算,SFM的A位可掺杂Ca,Ba,Sm和K等元素,B位可掺杂Nb,Ti,Bi,Al,Mg,Sn,Ga,Sc,Ni和Co等元素,O位可掺杂F和Cl等元素,下面将分别从A位、B位和O位掺杂予以讨论。
2 A位掺杂A位掺杂会引起容忍因子t的变化,因而影响钙钛矿的晶体结构,同时影响晶胞体积、B位元素的价态、氧空位浓度、电导率以及电化学性能,还可以改变材料的热膨胀系数。因此,SFM的A位掺杂被广泛研究,包括A位同价掺杂(如Ca,Ba)和A位高价掺杂(如Sm)。
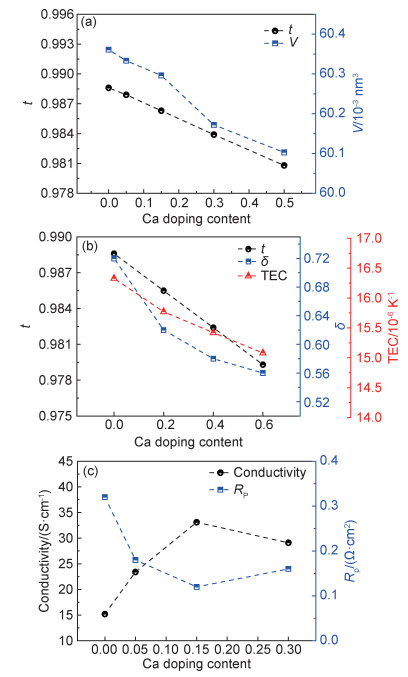
2.1 A位同价掺杂同为碱土元素,Ca2+与Sr2+的价态相同,但Ca2+的半径(0.135 nm)比Sr2+(0.144 nm)的要小,因此,A位Ca掺杂会降低容忍因子t。如图 4(a)所示[46],当Ca的掺杂量由x=0增加至0.5时,容忍因子t由0.989降低至0.981。Osinkin等[46]通过XRD精修发现,晶胞体积V也由0.06036 nm3减小至0.06010 nm3。少量的Ca掺杂不会改变晶体结构,SFM和Ca掺杂SFM均为立方钙钛矿结构,当掺杂量x=0.5时,会产生SrFe2O5杂相。Ca掺杂会改变B位Fe2+/Fe3+和Mo5+/Mo6+的比例,进而引起SFM氧空位浓度、热膨胀等一系列物理化学性质的改变。如图 4(b)所示[38],当Ca的掺杂量由x=0增加至0.6时,在空气中,氧的非化学计量δ值由0.72减少至0.56,TEC由16.33×10-6 K-1降低至15.08×10-6 K-1,TEC的降低增加了电极与电解质的热匹配性。值得一提的是,Ca掺杂极大地提高了材料的电导率,如图 4(c)所示[46],当Ca掺杂量由x=0增加至0.15时,在800 ℃时和氢气气氛下,电导率提升一倍,即由15.2 S/cm提升至33.1 S/cm,离子半径较小的Ca导致B位Fe的3d轨道和O的2p轨道重叠程度增加,促进了电子在Fe—O—Fe键间的跳跃,提高了电子电导率,但当掺杂量进一步增加至0.3时,电导率略微降低至29.1 S/cm,这可能是材料结构进一步变化造成的。当掺杂量x=0.15时,获得了最优的电化学性能,以Ca0.15Sr1.85Fe1.5Mo0.5O6-δ为电极,在氢气气氛中,800 ℃时的极化阻抗仅为0.12 Ω·cm2,在相同测试条件下,此值只有SFM(Rp=0.32 Ω·cm2)的37.5%。本课题组[32]也研究了Ca掺杂SFM(CaxSr2-xFe1.5Mo0.5O6-δ,x=0,0.25,0.5,0.75和1.0),并应用于对称SOFC电极材料。Ca掺杂量同样提高了材料的电导率和电极催化活性,但与Osinkin等[46]不同的是,Ca的掺杂量可更高,当掺杂量x=1.0时,才有杂相生成。这可能与粉体制备方法和工艺优化有关,且当掺杂量x=0.25时,获得了最优的电化学性能,以H2为燃料,在800 ℃下,具有对称结构的单电池即Ca0.25Sr1.75Fe1.5Mo0.5O6-δ/LSGM(430 μm)/Ca0.25Sr1.75Fe1.5Mo0.5O6-δ的最大功率密度达709 mW/cm2(表 1[32, 46-47]),表现出非常好的稳定性,在280 h的恒电流放电过程中,性能没有明显衰减。因此,Ca掺杂SFM是一种很有前途的对称SOFC电极材料。
| Anode | Electrolyte/cathode | PPD/(mW·cm-2) | Remark | Reference |
| Ca0.25Sr1.75Fe1.5Mo0.5O6-δ | LSGM(430 μm)/Ca0.25Sr1.75Fe1.5Mo0.5O6-δ | 709 with H2 480 with Syngas 392 with CO |
≈280 h, stable - - |
[32] [32] [32] |
| Sr1.85Ca0.15Fe1.5Mo0.5O6-δ Sr1.7Ca0.3Fe1.5Mo0.5O6-δ Sr1.85Ca0.15Fe1.5Mo0.5O6-δ |
LSGM(1500 μm)/Pr0.9Y0.1BaCo2O6-δ-SDC LSGM(1500 μm)/Pr0.9Y0.1BaCo2O6-δ-SDC LSGM(1500 μm)/Ca0.15Sr1.85Fe1.5Mo0.5O6-δ |
≈180 with H2 ≈150 with H2 ≈145 with H2 |
- - - |
[46] [46] [46] |
| Sr1.8Sm0.2Fe1.5Mo0.5O6-δ | LSGM(300 μm)/Ba0.5Sr0.5Co0.8Fe0.2O3 | 594 with H2 | - | [47] |
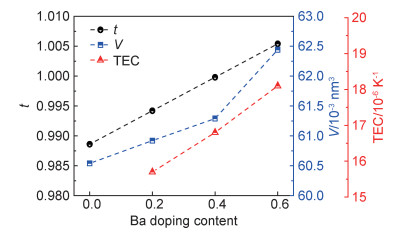
除了Ca掺杂之外,同族的Ba2+与Sr2+的价态也相同,但Ba2+的半径(0.160 nm)比Sr2+(0.144 nm)的要大,Ba在SFM材料A位的固溶度大于40%,与Ca掺杂不同的是,Ba掺杂增加了材料的TEC,如图 5所示[48],当掺杂量由x=0.2增加至x=0.4时,材料在40~1000 ℃的平均TEC由15.7×10-6 K-1增加至18.1×10-6 K-1,同时,Ba掺杂使得材料的容忍因子t增加,当掺杂量由x=0增加至x=0.6时,容忍因子由0.989增加至1.005,晶胞体积V也由0.06054 nm3增加至0.06244 nm3,值得一提的是,容忍因子越接近1,使其结构更接近理想立方钙钛矿,晶胞体积适当的增加也有利于体相氧离子传导,因此,当掺杂量x=0.2时,Ba0.2Sr1.8Fe1.5Mo0.5O6-δ获得了最优的氧化还原反应(ORR)性能,进一步增加Ba的量,反而使得性能下降。
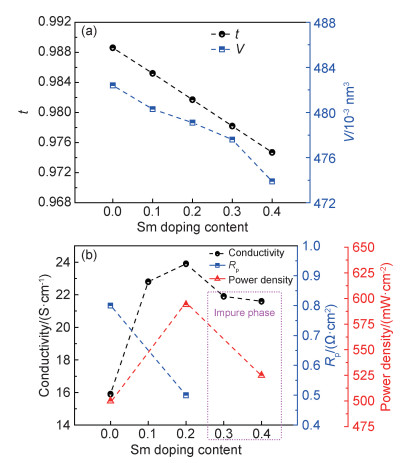
Sm3+的价态高,离子半径(0.124 nm)比Sr2+(0.144 nm)的要小,Sm掺杂降低了材料的容忍因子,见图 6(a),Wang等[47]用固相反应方法,合成了Sm掺杂的SFM(SmxSr2-xFe1.5Mo0.5O6-δ),当掺杂量由x=0增加至x=0.4时,晶胞体积V由0.4824 nm3减小至0.4739 nm3。XRD分析表明,当掺杂量x≥0.2时,在空气气氛中会产生SrMoO4杂相,说明Sm在SFM的A位固溶度小于10%,杂相的含量随掺杂量x的增加而增加。值得一提的是,在还原气氛中处理后,对于x=0.2的样品,SrMoO4杂相会完全消失,杂相的消失与高价Mo的还原有关,因此,掺杂量x≤0.2的材料均可用于SOFC阳极材料。根据固体化学原理,Sm掺杂可用缺陷方程(5)表示:
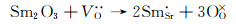
|
(5) |
其中Vö和OO×分别代表氧空位和晶格氧。因此Sm掺杂降低了氧空位浓度,同时也降低了B位元素的平均价态。例如,当掺杂量x由0增加至0.2时,XPS分析表明,Fe2+/(Fe2++Fe3+)的比例由59.4%增加至62.0%,Mo5+/(Mo5++Mo6+)的比例由20.1%增加至37.4%。在H2气氛中,Sm掺杂SFM仍为n型半导体,Sm掺杂可提高材料的电子电导率,如图 6(b)所示[47],当掺杂量由x=0增加至x=0.2时,800 ℃下,电导率由15.9 S/cm增加至23.9 S/cm,当掺杂量继续增加至0.3和0.4时,SrMoO4杂相的生成降低了电导率。虽然Sm掺杂降低了氧空位浓度,少量Sm掺杂提高了阳极的电子电导率和电催化活性,其中掺杂量x=0.2的组分,即Sm0.2Sr1.8Fe1.5Mo0.5O6-δ性能最佳。在氢气气氛中,800 ℃的极化阻抗由纯SFM的0.80 Ω·cm2降低至0.5 Ω·cm2,同时,以LSGM电解质支撑的单电池,功率由500 mW/cm2提升至594 mW/cm2(表 1)。性能的提升可能与电导率的提升和B位元素电子结构的调整有关,同时也说明SFM的性能与其电子结构是一个复杂的关系,值得进一步深入研究。
3 B位掺杂B位元素一般与钙钛矿材料的电导率和电催化活性直接相关。B位元素掺杂不仅会改变SFM材料的容忍因子和晶胞参数,同时也会直接影响SFM的稳定性、热膨胀、电导率、氧空位浓度和电催化活性等物理化学性质。因此,SFM的B位元素掺杂改性比A位掺杂研究得更加广泛,例如Nb,Ti,Bi,Al,Mg,Sn,Ga,Sc,Ni和Co等元素均可用于B位的掺杂。这些掺杂大致可分为两类,即B位一般掺杂和B位脱溶掺杂,脱溶掺杂是将Ni,Co和Fe等活性金属元素掺杂进入SFM的B位晶格,然后在还原气氛中退火,Ni,Co和Fe会还原析出为金属单质或合金,原位构建“金属单质/合金-SFM”高催化活性的异质结结构。
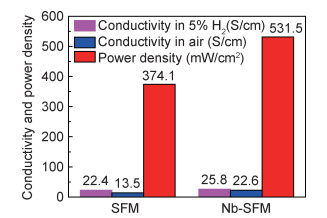
3.1 B位一般掺杂Nb5+的半径(0.064 nm)与Fe3+(0.0645 nm)和Mo6+(0.059 nm)的相差不大,Nb掺杂SFM既可以取代Fe,也可以取代Mo。Gou等[49]报道了Nb取代Fe,采用溶胶-凝胶法合成了Sr2Fe1.4Nb0.1Mo0.5O6-δ(Nb-SFM),由于Nb5+与Fe3+的半径非常接近,且实验结果也表明[49],SFM与Nb-SFM均为立方钙钛矿结构,Nb掺杂没有改变立方结构,推测掺杂对容忍因子t的影响较小。高价Nb的掺杂增加了材料在阳极条件下的稳定性,Nb掺杂也提高了材料在氧化和还原气氛中的电导率,如图 7所示[49],在800 ℃时,空气中的电导率由13.5 S/cm提升至22.6 S/cm,在5%(体积分数,下同)H2气氛中的电导率由22.4 S/cm提升至25.8 S/cm。Nb掺杂同时提高了阳极和阴极的反应活性,在800 ℃,LSGM(≈240 μm)电解质支撑的对称单电池的最大功率密度由374.1 mW/cm2提升至531.5 mW/cm2(表 2[49-56]),且获得了120 h的短期稳定性,Nb-SFM电极即使经过10次氧化还原循环,性能也不会衰减。
| Anode | Electrolyte/cathode | PPD/(mW·cm-2) | Remark | Reference |
| Sr2Fe1.4Nb0.1Mo0.5O6-δ | LSGM(243 μm)/Sr2Fe1.4Nb0.1Mo0.5O6-δ | 531.5 with H2 | 120 h, stable | [49] |
| Sr2FeNb0.2Mo0.8O6-δ | LSGM(≈200 μm)/PrBaCo2O5+δ | 520 with H2 380 with CH4 |
≈200 h, stable ≈180 h, stable |
[50] |
| Sr2Fe0.5TiMo0.5O6-δ | SDC/LSGM(200 μm)/NdBaCo2/3Fe2/3Cu2/3O5+δ | 547 with H2 215 with syngas |
-55 h, stable | [51] |
| Sr2Fe1.4Bi0.1Mo0.5O6-δ Sr2Fe1.4Al0.1Mo0.5O6-δ Sr2Fe1.4Mg0.1Mo0.5O6-δ |
LSGM(400 μm)/La0.6Sr0.4Co0.2Fe0.8O3 | 399 with carbon 293 with carbon 181 with carbon |
15 h, stable - - |
[52] |
| Sr2Fe1.4Ni0.1Mo0.5O6-δ | LSGM(310 μm)/Sr2Fe1.4Ni0.1Mo0.5O6-δ | 530 with H2 | 15 h, stable | [53] |
| Sr1.95Fe1.4Ni0.1Mo0.5O6-δ | LSGM(300 μm)/La0.6Sr0.4Co0.2Fe0.8O3 | 606 with H2 | - | [54] |
| Sr2FeCo0.5Mo0.5O6-δ | LSGM(300 μm)/Sr2Fe1.0Co0.5Mo0.5O6-δ | 42.6 with 0.5%H2S-3%H2 | - | [55] |
| Sr2FeCo1/3Mo2/3O6-δ | LDC/LSGM(250 μm)/La0.58Sr0.4Co0.2Fe0.8O3 | 1100 with H2 | 150 h, stable | [56] |
Nb取代B位的Mo与取代Fe不同,Nb5+的半径比Mo6+的略大,且是低价掺杂。如图 8(a)所示[57],随着Nb掺杂量由x=0增加至x=0.2时,容忍因子由0.989略微降低至0.986,且热膨胀系数逐渐增加,由14.9×10-6 K-1增加至16.7×10-6 K-1。适量的Nb掺杂可增加材料的氧空位浓度,如图 8(b)所示[57],空气气氛中材料氧的非化学计量δ值随着Nb掺杂量的增加先增加后减小,当掺杂量x=0.1时,δ值达到最大为0.855,此时,材料的电导率也最高,800 ℃电导率最大为19.2 S/cm。通常,高的氧空位浓度有利于氧离子迁移,高的电导率有利于电子转移,因此,当掺杂量x=0.1时,材料的电化学性能最优,在空气中,对称电池的极化阻抗最低,为0.068 Ω·cm2。综上所述,Nb掺杂SFM可同时提高阳极和阴极的催化活性,可用作对称电池的电极材料。
Ti4+的半径(0.0605 nm)比Fe3+(0.0645 nm)的小,Niu等[51]通过固相反应法,合成了Sr2Fe0.5TiMo0.5O6-δ(Ti-SFM),Ti-SFM的容忍因子t为0.998,此值比SFM(t=0.989)更接近1,可推断Ti-SFM为立方钙钛矿结构,这和XRD测得的结果一致。由于Ti—O键比Fe—O键更强,Ti-SFM稳定性更佳,与电解质LSGM有非常好的化学和物理兼容性,在5% H2/Ar气氛中,平均热膨胀系数为11.2×10-6 K-1,低于其他SFM基材料,且与电解质的基本相等。800 ℃时,Ti-SFM在H2中的电导率为22.3 S/cm,基本满足SOFC阳极对电导率的要求[58]。分别使用H2和含5×10-6 H2S的合成气作燃料,电解质LSGM(200 μm)支撑的单电池在800 ℃时的最大功率密度分别为547 mW/cm2和215 mW/cm2(表 2),并在含H2S的合成气中具有较好的稳定性,是一种稳定的抗积碳和耐硫中毒的阳极材料。
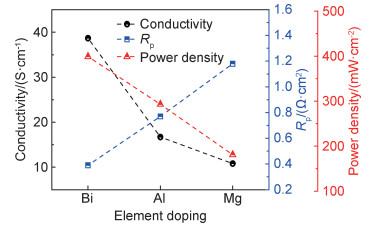
SOFC具有燃料的灵活性,直接使用碳作燃料也是SOFC的巨大优势之一,Bi, Al和Mg掺杂SFM(Sr2Fe1.4X0.1Mo0.5O6-δ,X=Bi, Al和Mg)可用于直接碳燃料电池的阳极材料[52]。Bi, Al和Mg均可取代B位的Fe成功掺杂进入SFM晶格,进一步在800 ℃,5%H2/Ar气氛中还原20 h后,掺杂后的材料均会转变为R-P相,同时有少量Fe析出。掺杂也影响B位Fe3+/Fe2+和Mo6+/Mo5+的比例,从而影响电导率和电化学性能。如图 9所示[52],Bi,Al和Mg掺杂的SFM在800 ℃,5%H2中的电导率分别为38.68,16.71 S/cm和10.81 S/cm,当直接使用碳为燃料,Bi,Al和Mg掺杂的SFM在800 ℃的功率密度分别为399,293 mW/cm2和181 mW/cm2(表 2)。其中,Bi掺杂SFM具有最高的电导率、最小的极化阻抗和最优的性能,是一种有应用前景的直接碳燃料电池阳极材料。
SFM除了广泛用于阳极材料,也是一种潜在的阴极材料,但作为阴极材料的性能远低于常用的La0.6Sr0.4Co0.2Fe0.8O3-δ,Ba0.5Sr0.5Co0.8Fe0.2O3-δ,Sm0.6Sr0.4CoO3-δ和PrBaCo2O6-δ等阴极材料[59]。He等[59]发现Sn掺杂可降低氧空位形成能和氧还原反应的极化阻抗Rp,提高阴极材料的性能。Sun等[60]发现Sc掺杂也可有效地提高SFM的阴极性能,在800 ℃的极化阻抗Rp降低至0.12 Ω·cm2,功率密度为1230 mW/cm2。Xu等[61]发现Ga掺杂不仅可以提高氧离子传输能力和阴极性能,而且Ga掺杂可增强阴极材料对CO2的抗性。
3.2 B位脱溶掺杂掺杂的目的是为了原位脱溶反应,称为脱溶掺杂。通常是将催化活性金属(Ni,Co和Fe等)掺入钙钛矿的B位,在空气下形成固溶体氧化物,然后在化学还原或者电还原的驱动下,活性金属被还原,从氧化物表面析出,并锚定在钙钛矿氧化物的表面,形成“金属-金属氧化物”的异质结结构,该过程即脱溶掺杂,如图 10所示。这种设计理念首先被Nishihata等[62-63]提出,并用于汽车尾气CH,CO,NOx和SOx的催化转化,后来被Barnett等[64-65]用于SOFC领域。原位脱溶出的金属(单质或合金)为纳米颗粒,能够提高催化活性,由于其特殊的“锚定”结构,与传统浸渍法修饰的电极相比,纳米催化剂在钙钛矿表面分布更加均匀,具有更强的抗团聚能力。
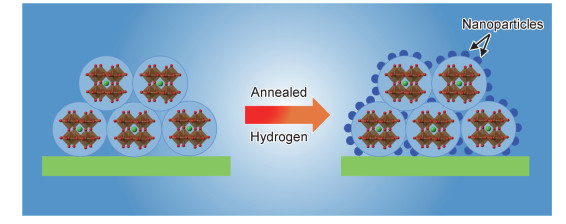
|
图 10 钙钛矿氧化物催化剂的脱溶示意图 Fig. 10 Schematic diagram of exsolution from perovskite oxide |
在钙钛矿氧化物中,氧化态的Ni易被还原为金属态,且金属Ni对H2的吸附和解离具有非常强的促进作用,因此,Ni掺杂的阳极材料被广泛研究[36, 53-54, 66]。Ni2+(0.0690 nm)的半径比Fe3+(0.0645 nm)的略大,因此,如图 11(a)所示[53],Ni取代Fe使得容忍因子t逐渐降低,当掺杂量x≤0.4时,均可获得立方结构的纯相,但当掺杂量x增至0.5时,会有NiO杂相生成,所以Ni在SFM材料B位的固溶度大概为20%。Ni掺杂极大地提升了阳极的电化学性能,如图 11(b)所示[53],随着Ni掺杂量由x=0增加至x=0.1时,材料在H2中的电导率在800 ℃时,由16.0 S/cm增加至20.6 S/cm,对称电池在H2中的极化阻抗降低了62%,由1.72 Ω·cm2降低至0.65 Ω·cm2,单电池的最大功率密度提升了一倍以上,由262 mW/cm2增加至530 mW/cm2(表 2)。然而,随着Ni掺杂量的进一步提高,材料在还原气氛下的稳定性逐渐降低,并产生Sr3FeMoO6.5等相,大量的Ni被还原析出导致钙钛矿B位缺陷,降低了钙钛矿结构的稳定性。如图 11(c),(d)所示[53],掺杂量x=0.2的组分在还原气氛中处理后,通过SEM和TEM可观察到大量的Ni脱溶析出,并牢牢附着在母体材料表面,这些金属Ni对阳极反应有很强的催化活性,但伴随产生的Sr富集相则对阳极反应有害。因此在设计Ni掺杂的钙钛矿作SOFC阳极时,既要保证Ni的脱溶以提供高的催化活性,也要兼顾材料的还原稳定性。
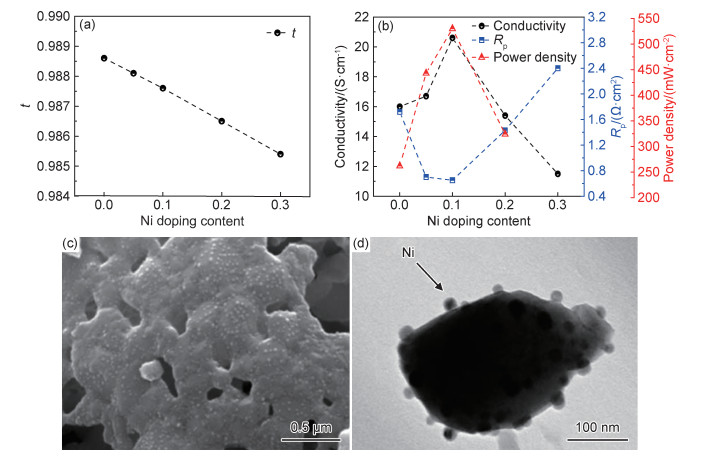
|
图 11 Sr2Fe1.5-xNixMo0.5O6-δ系列材料的容忍因子(a),H2气氛中的电导率、对称电池阻抗Rp和单电池最大功率密度(800 ℃)(b)及Sr2Fe1.3Ni0.2Mo0.5O6-δ(x=0.2)粉体在H2中还原后的SEM(c)和TEM图(d)[53] Fig. 11 t(a), conductivity, Rp of symmetrical cells and PPD of single cells at 800 ℃ in H2 atmosphere(b) for Sr2Fe1.5-xNixMo0.5O6-δ, and the SEM(c) and TEM(d) images for Sr2Fe1.3Ni0.2Mo0.5O6-δ(x=0.2) powder after reduction in H2[53] |
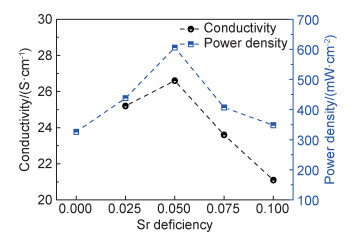
为了克服B位Ni析出导致的A位Sr富集,Feng等[54]设计A位缺位的Ni掺杂SFM,采用燃烧法合成Sr2-xFe1.4Ni0.1Mo0.5O6-δ(x=0,0.025,0.05,0.075和0.1)。A位缺位会影响B位Fe3+/Fe2+和Mo6+/Mo5+离子对的比例,进而影响材料的电导率和电化学性能。当A位缺位x=0.05时,Fe3+/Fe2+的比例达最高,而Mo6+/Mo5+的比例达最低,可认为Fe2+ + Mo6+→Fe3+ + Mo5+反应向右进行的程度最大,此时,材料的电导率最大,如图 12所示[54],在5%H2气氛中,800 ℃时的电导率达26.6 S/cm。进一步增加A位缺位的程度,电导率反而降低。A位过量缺位造成了FeO6八面体的倾斜,使Fe—O—Fe偏离理想的180o,这限制了电子传导,另外,A位缺位导致氧空位浓度增加,这对电荷传导也有一定的阻碍作用。同时,当A位缺位x=0.05时,Sr1.95Fe1.4Ni0.1Mo0.5O6-δ具有最佳的性能,在800 ℃,LSGM(300 μm)支撑的单电池功率高达606 mW/cm2(表 2)。在脱溶掺杂研究中,A位缺位的设计思路是一种提高材料稳定性和性能的有效方法。
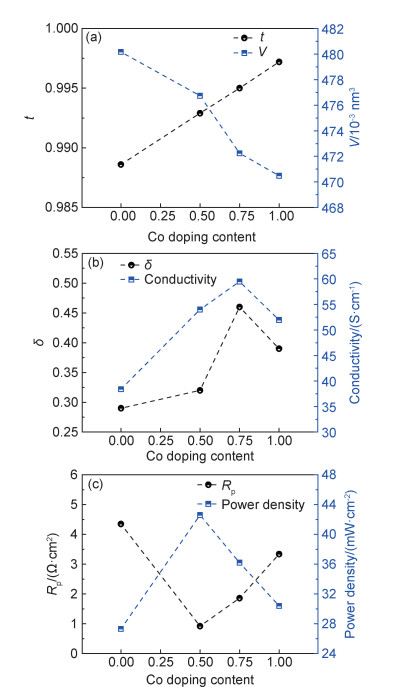
Co基材料通常用作高性能的阴极材料,如La0.6Sr0.4Co0.2Fe0.8O3-δ,Ba0.5Sr0.5Co0.8Fe0.2O3-δ和Sm0.6Sr0.4CoO3-δ等,近年来,随着脱溶技术在SOFC领域的广泛应用,通过掺杂,高催化活性的Co也可被引入作阳极材料。Song等[55]研究了Co掺杂SFM(Sr2Fe1.5-xCoxMo0.5O6-δ,x=0,0.5,0.75和1.0),即使当Co的掺杂量x达1.0,XRD也没有检测到杂相,因此,Co在SFM材料B位的固溶度大于50%,这比Ni的固溶度20%要大,Co的掺杂没有改变材料的晶体结构,掺杂前后均为立方钙钛矿。由于Co3+的半径(0.0610 nm)比Fe3+(0.0645 nm)的小,随着Co掺杂量由x=0逐渐增加至x=1.0,如图 13(a)所示[55],材料的容忍因子t由0.989逐渐增大至0.997,晶胞体积V由0.48017 nm3逐渐减小至0.47048 nm3。碘滴定并结合光致发光光谱表明,随着Co掺杂量的增加,如图 13(b)所示[55],氧空位浓度逐渐增加,并在掺杂量x=0.75时达到最大,此时氧的非化学计量δ值最大,为0.46,材料在空气气氛中的电导率也最高,750 ℃时为59.48 S/cm,由于Co2+/Co3+的平均价态比Fe3+要低,Co掺杂的缺陷方程可用式(6)表示,因此,Co掺杂使得氧空位浓度增加。值得一提的是,虽然Co掺杂量在x=0.75时,材料的氧空位浓度最高,电导率也最高,然而,却是掺杂量x=0.5时单电池的性能最佳。如图 13(c)所示[55],当掺杂量x=0.5时,电极在H2/H2S气氛中的极化阻抗值最小,800 ℃时,Rp为0.92 Ω·cm2,与没有Co掺杂的SFM(Rp= 4.35 Ω·cm2)相比,提升因子约为4.7,LSGM(200 μm)支撑的单电池在0.5%H2S-3%H2燃料中的功率密度最大,为42.6 mW/cm2(表 2)。
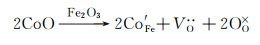
|
(6) |
对于结构通式为ABO3的钙钛矿材料,除了常见的A位和B位掺杂,近年来O位掺杂也被广泛研究。阴离子F-(0.133 nm),Cl-(0.181 nm)和N3-(0.146 nm)的半径与O2-(0.140 nm)的离子半径相近,因此可掺杂取代钙钛矿的O位。研究人员发现F-[67-71],Cl-[70, 72]和N3-[73]等阴离子掺杂策略也可以提升某些钙钛矿材料的催化性能,有些甚至优于A位和B位掺杂。
本课题组研究了F掺杂SFM(Sr2Fe1.5Mo0.5O6F0.1,F-SFM)[74],F掺杂没有改变材料的晶体结构,SFM与F-SFM均为立方钙钛矿结构,由于F-的半径(0.133 nm)比O2-(0.140 nm)略小,F掺杂使得晶胞体积略微收缩。当F部分取代SFM晶格中的O后,由于F的电负性(χ=3.98)比O(χ=3.44)的大,F的吸电子能力远大于O,导致O周围的电子云密度降低,由此削弱了O与B位金属离子的库仑力,因此,F掺杂活化了晶格氧,促进了氧离子传导,这与Zhang等[71]的结论一致。
Cl与F属于同一主族元素,且Cl-与F-的价态相同,Zhang等研究了Cl掺杂SFM (Sr2Fe1.5Mo0.5O6-δClx)[72]。当掺杂量0≤x≤0.2时,均可获得纯相,由于掺杂量较少,Cl掺杂不影响晶体结构,SFM和Cl掺杂的SFM均为立方钙钛矿结构;但当掺杂量x≥0.3时,会生成SrMoO4杂相。在0≤x≤0.2范围内,由于Cl-的半径(0.181 nm)大于O2-(0.140 nm),随着Cl掺杂量的增加,容忍因子逐渐降低,晶胞体积逐渐增大,且当掺杂量x=0.2时,对称电池在空气中的极化阻抗最低,电化学性能最优。进一步研究表明,Cl掺杂促进了氧离子迁移,因而提高了ORR活性。值得一提的是,对于阴离子掺杂,如何准确控制和确定阴离子实际的掺杂量依旧是个难题,而阴离子是如何影响材料物理化学性质的理论机制依旧需要进一步研究。
5 结束语作为SOFC的阳极材料,钙钛矿氧化物Sr2Fe1.5Mo0.5O6-δ具有较好的综合性能,包括电导率、稳定性和催化活性。本文分别从A位、B位和O位掺杂,总结了元素掺杂对SFM的容忍因子、晶体结构、稳定性、电导率、热膨胀系数和电化学性能等的影响。SFM的容忍因子为0.989,非常接近1,为立方钙钛矿结构,少量的掺杂一般不会改变其立方结构,若掺杂量过多,则会晶格畸变。A位掺杂改变SFM晶胞体积和B位价态比例(Fe2+/Fe3+和Mo5+/Mo6+),进而影响电导率和电化学性能。同价离子,当半径较小时,如Ca掺杂SFM,一般会减小晶胞体积,从而提高SFM基材料的电子电导率,降低热膨胀系数;高价离子,如Sm掺杂SFM,一般会提高SFM基材料在阳极的电导率,但高价元素在SFM的A位的固溶度较低。B位掺杂直接影响材料的稳定性和催化活性,当增加Mo与Fe的比例,材料在还原气氛中的稳定性增加,反之降低;高价离子,如Nb和Ti掺杂,可提高材料稳定性;Ga掺杂对抗CO2有利;Ni和Co在B位的催化活性远高于其他掺杂元素。O位掺杂也可以提升SFM的催化性能,甚至优于A位和B位掺杂,F掺杂活化了晶格氧,极大地提高了材料的电化学性能;Cl掺杂促进了氧离子的迁移,提高了氧离子电导率。以上元素掺杂策略极大地推进了SFM基钙钛矿阳极材料的发展,然而,仍需进一步改进才能满足产业化应用的要求,未来发展方向主要有以下5个方面:(1) 单一元素掺杂通常对SFM某一性能有显著影响和改善,这仍无法满足SOFC阳极材料复杂的工作环境,基于A位、B位和O位的共掺杂可调控SFM材料的综合性能,共掺杂是提高SFM综合性能的重要解决方案;(2) O位阴离子掺杂表现出极大优势,F,Cl,N和S等的掺杂在SOFC领域会越来越得到重视;(3) SFM可同时用于SOFC阳极和阴极,具有对称结构的电池和电解池的掺杂改性研究,会越来越受到研究者的青睐;(4) 元素掺杂影响SFM材料物理化学性质的理论机制依旧需要进一步深入研究,将实验(如单晶薄膜的生长)与理论模拟(如DFT计算)结合可进一步阐明其作用机制,此方法会随着计算化学的发展得到更加广泛的应用;(5) 基于本工作总结的元素掺杂对SFM的影响规律,这些策略亦可用于调控其他钙钛矿结构材料的电化学性能,如LSCrM,LSCrF,LST和PBM等。
| [1] |
ORMEROD R M. Solid oxide fuel cells[J]. Chemical Society Reviews, 2003, 32(1): 17-28. DOI:10.1039/b105764m |
| [2] |
ADAMS T A, NEASE J, TUCKER D, et al. Energy conversion with solid oxide fuel cell systems: a review of concepts and outlooks for the short- and long-term[J]. Industrial & Engineering Chemistry Research, 2013, 52(9): 3089-3111. |
| [3] |
JACOBSON A J. Materials for solid oxide fuel cells[J]. Chemistry of Materials, 2010, 22(3): 660-674. DOI:10.1021/cm902640j |
| [4] |
KAUR G. Intermediate temperature solid oxide fuel cells: electrolytes, electrodes and interconnects[M]. Amsterdam: Elsevier, 2020.
|
| [5] |
RUIZ-MORALES J C, MARRERO-LOPEZ D, GALVEZ-SANCHEZ M, et al. Engineering of materials for solid oxide fuel cells and other energy and environmental applications[J]. Energy & Environmental Science, 2010, 3(11): 1670-1681. |
| [6] |
QIAO J, ZHANG N, WANG Z, et al. Performance of mix-impregnated CeO2-Ni/YSZ anodes for direct oxidation of methane in solid oxide fuel cells[J]. Fuel Cells, 2009, 9(5): 729-739. DOI:10.1002/fuce.200800104 |
| [7] |
RINGUEDE A, BRONINE D, FRADE J R. Ni1-xCox/YSZ cermet anodes for solid oxide fuel cells[J]. Electrochimica Acta, 2002, 48(4): 437-442. DOI:10.1016/S0013-4686(02)00689-8 |
| [8] |
PAPAEFTHIMIOU V, SHISHKIN M, NIAKOLAS D K, et al. On the active surface state of nickel-ceria solid oxide fuel cell anodes during methane electrooxidation[J]. Advanced Energy Materials, 2013, 3(6): 762-769. DOI:10.1002/aenm.201200727 |
| [9] |
PARK M, LEE J G, JEON O S, et al. Coke-tolerant La2Sn2O7-Ni-Gd0.1Ce0.9O1.95 composite anode for direct methane-fueled solid oxide fuel cells[J]. Journal of Electroceramics, 2018, 40: 323-331. DOI:10.1007/s10832-018-0133-2 |
| [10] |
CHENG Z, WANG J H, CHOI Y M, et al. From Ni-YSZ to sulfur-tolerant anode materials for SOFCs: electrochemical behavior, in situ characterization, modeling, and future perspectives[J]. Energy & Environmental Science, 2011, 4(11): 4380-4409. |
| [11] |
WANG W, SU C, WU Y Z, et al. Progress in solid oxide fuel cells with nickel-based anodes operating on methane and related fuels[J]. Chemical Reviews, 2013, 113(10): 8104-8151. DOI:10.1021/cr300491e |
| [12] |
BOLDRIN P, RUIZ-TREJO E, MERMELSTEIN J, et al. Strategies for carbon and sulfur tolerant solid oxide fuel cell materials, incorporating lessons from heterogeneous catalysis[J]. Chemical Reviews, 2016, 116(22): 13633-13684. DOI:10.1021/acs.chemrev.6b00284 |
| [13] |
EBBESEN S D, JENSEN S H, HAUCH A, et al. High temperature electrolysis in alkaline cells, solid proton conducting cells, and solid oxide cells[J]. Chemical Reviews, 2014, 114(21): 10697-10734. |
| [14] |
TAO S W, IRVINE J T S. A redox-stable efficient anode for solid-oxide fuel cells[J]. Nature Materials, 2003, 2(5): 320-323. DOI:10.1038/nmat871 |
| [15] |
TAO S W, IRVINE J T S, KILNER J A. An efficient solid oxide fuel cell based upon single-phase perovskites[J]. Advanced Materials, 2005, 17(14): 1734-1737. DOI:10.1002/adma.200402007 |
| [16] |
ZHANG S, WAN Y, XU Z, et al. Bismuth doped La0.75Sr0.25Cr0.5Mn0.5O3-δ perovskite as novel redox-stable efficient anode for solid oxide fuel cell[J]. Journal of Materials Chemistry A, 2020, 8: 11553-11563. DOI:10.1039/D0TA03328F |
| [17] |
RAMOS T, ATKINSON A. Oxygen diffusion and surface exchange in La1-xSrxFe0.8Cr0.2O3-δ (x=0.2, 0.4 and 0.6)[J]. Solid State Ionics, 2004, 170(3/4): 275-286. |
| [18] |
FOWLER D E, HAAG J M, BOLAND C, et al. Stable, low polarization resistance solid oxide fuel cell anodes: La1-xSrxCr1-xFexO3-δ (x = 0.2-0.67)[J]. Chemistry of Materials, 2014, 26(10): 3113-3120. DOI:10.1021/cm500423n |
| [19] |
WAN Y, XING Y, XU Z, et al. A-site bismuth doping, a new strategy to improve the electrocatalytic performances of lanthanum chromate anodes for solid oxide fuel cells[J]. Applied Catalysis B, 2020, 269: 118809. DOI:10.1016/j.apcatb.2020.118809 |
| [20] |
TSVETKOVA Y, KOZHUKHAROV V. Synthesis and study of compositions of the La-Sr-Ti-O system for SOFCs anode development[J]. Materials & Design, 2009, 30(1): 206-209. |
| [21] |
WANG Z, MORI M, ITOH T. Thermal expansion properties of Sr1-xLaxTiO3 (0≤x≤0.3) perovskites in oxidizing and reducing atmospheres[J]. Journal of the Electrochemical Society, 2010, 157(12): B1783. DOI:10.1149/1.3481458 |
| [22] |
ZHOU X, YAN N, CHUANG K T, et al. Progress in La-doped SrTiO3(LST)-based anode materials for solid oxide fuel cells[J]. RSC Advance, 2014, 4(1): 118-131. DOI:10.1039/C3RA42666A |
| [23] |
SENGODAN S, CHOI S, JUN A, et al. Layered oxygen-deficient double perovskite as an efficient and stable anode for direct hydrocarbon solid oxide fuel cells[J]. Nature Materials, 2015, 14(2): 205-209. DOI:10.1038/nmat4166 |
| [24] |
CHOI S, SENGODAN S, PARK S, et al. A robust symmetrical electrode with layered perovskite structure for direct hydrocarbon solid oxide fuel cells: PrBa0.8Ca0.2Mn2O5+δ[J]. Journal of Materials Chemistry A, 2016, 4(5): 1747-1753. DOI:10.1039/C5TA08878J |
| [25] |
TRONCOSO L, MARTINEZ-LOPE M, ALONSO J, et al. Evaluation of Sr2MMoO6 (M=Mg, Mn) as anode materials in solid-oxide fuel cells: a neutron diffraction study[J]. Journal of Applied Physics, 2013, 113(2): 023511. DOI:10.1063/1.4774764 |
| [26] |
VASALA S, LEHTIMAKI M, HUANG Y, et al. Degree of order and redox balance in B-site ordered double-perovskite oxides, Sr2MMoO6-δ (M= Mg, Mn, Fe, Co, Ni, Zn)[J]. Journal of Solid State Chemistry, 2010, 183(5): 1007-1012. DOI:10.1016/j.jssc.2010.03.004 |
| [27] |
LIU Q A, DONG X H, XIAO G L, et al. A novel electrode material for symmetrical SOFCs[J]. Advanced Materials, 2010, 22(48): 5478-5482. DOI:10.1002/adma.201001044 |
| [28] |
HE B B, ZHAO L, SONG S X, et al. Sr2Fe1.5Mo0.5O6-δ-Sm0.2Ce0.8O1.9 composite anodes for intermediate-temperature solid oxide fuel cells[J]. Journal of the Electrochemical Society, 2012, 159(5): B619-B626. DOI:10.1149/2.020206jes |
| [29] |
MUNOZ-GARCIA A B, BUGARIS D E, PAVONE M, et al. Unveiling structure-property relationships in Sr2Fe1.5Mo0.5O6-δ, an electrode material for symmetric solid oxide fuel cells[J]. Journal of the American Chemical Society, 2012, 134(15): 6826-6833. DOI:10.1021/ja300831k |
| [30] |
MUNOZ-GARCIA A B, PAVONE M. First-principles design of new electrodes for proton-conducting solid-oxide electrochemical cells: A-site doped Sr2Fe1.5Mo0.5O6-δ perovskite[J]. Chemistry of Materials, 2016, 28(2): 490-500. DOI:10.1021/acs.chemmater.5b03262 |
| [31] |
MAHATO N, BANERJEE A, GUPTA A, et al. Progress in material selection for solid oxide fuel cell technology: a review[J]. Progress in Materials Science, 2015, 72: 141-337. |
| [32] |
XU Z, HU X, WAN Y, et al. Electrochemical performance and anode reaction process for Ca doped Sr2Fe1.5Mo0.5O6-δ as electrodes for symmetrical solid oxide fuel cells[J]. Electrochimica Acta, 2020, 341: 136067. DOI:10.1016/j.electacta.2020.136067 |
| [33] |
DU Z, ZHAO H, ZHOU X, et al. Electrical conductivity and cell performance of La0.3Sr0.7Ti1-xCrxO3-δ perovskite oxides used as anode and interconnect material for SOFCs[J]. International Journal of Hydrogen Energy, 2013, 38(2): 1068-1073. DOI:10.1016/j.ijhydene.2012.10.099 |
| [34] |
VASALA S, LEHTIMAKI M, HAW S C, et al. Isovalent and aliovalent substitution effects on redox chemistry of Sr2MgMoO6-δ SOFC-anode material[J]. Solid State Ionics, 2010, 181(15/16): 754-759. |
| [35] |
HUANG Y H, DASS R I, XING Z L, et al. Double perovskites as anode materials for solid-oxide fuel cells[J]. Science, 2006, 312(5771): 254-257. DOI:10.1126/science.1125877 |
| [36] |
XU Z, LI Y, WAN Y, et al. Nickel enriched Ruddlesden-Popper type lanthanum strontium manganite as electrode for symmetrical solid oxide fuel cell[J]. Journal of Power Sources, 2019, 425: 153-161. DOI:10.1016/j.jpowsour.2019.04.005 |
| [37] |
LIU Q, BUGARIS D E, XIAO G L, et al. Sr2Fe1.5Mo0.5O6-δ as a regenerative anode for solid oxide fuel cells[J]. Journal of Power Sources, 2011, 196(22): 9148-9153. DOI:10.1016/j.jpowsour.2011.06.085 |
| [38] |
QIAO J, CHEN W, WANG W, et al. The Ca element effect on the enhancement performance of Sr2Fe1.5Mo0.5O6-δ perovskite as cathode for intermediate-temperature solid oxide fuel cells[J]. Journal of Power Sources, 2016, 331: 400-407. DOI:10.1016/j.jpowsour.2016.09.082 |
| [39] |
ZHU S, DING D, LI M, et al. Effect of samaria doped ceria impregnation on the electrochemical performance of strontium doped lanthanum chromium manganite anode for solid oxide fuel cells[J]. Journal of the Electrochemical Society, 2017, 164(9): 916-922. DOI:10.1149/2.0591709jes |
| [40] |
LEE M J, SHIN J H, JI M J, et al. Fabrication and electrochemical performance of nickel-and gadolinium-doped ceria-infiltrated La0.2Sr0.8TiO3 anodes for solid oxide fuel cells[J]. Journal of Power Sources, 2018, 374: 181-187. DOI:10.1016/j.jpowsour.2017.11.023 |
| [41] |
YANG Z B, PANG Z H, ZHU T L, et al. Fabrication and performance of ceramic anode-supported solid oxide fuel cells[J]. ECS Transactions, 2013, 57(1): 549-554. DOI:10.1149/05701.0549ecst |
| [42] |
XIAO G L, JIN C, LIU Q, et al. Ni modified ceramic anodes for solid oxide fuel cells[J]. Journal of Power Sources, 2012, 201: 43-48. DOI:10.1016/j.jpowsour.2011.10.103 |
| [43] |
OSINKIN D A, LOBACHEVSKAYA N I, SUNTSOV A Y. The electrochemical behavior of the promising Sr2Fe1.5Mo0.5O6-δ+ Ce0.8Sm0.2O1.9-δ anode for the intermediate temperature solid oxide fuel cells[J]. Journal of Alloys and Compounds, 2017, 708: 451-455. DOI:10.1016/j.jallcom.2017.03.057 |
| [44] |
HAN Z, WANG Y, YANG Y, et al. High-performance SOFCs with impregnated Sr2Fe1.5Mo0.5O6-δ anodes toward sulfur resistance[J]. Journal of Alloys and Compounds, 2017, 703: 258-263. DOI:10.1016/j.jallcom.2017.01.341 |
| [45] |
AFROZE S, KARIM A, CHEOK Q, et al. Latest development of double perovskite electrode materials for solid oxide fuel cells: a review[J]. Frontiers in Energy, 2019, 13(4): 770-797. DOI:10.1007/s11708-019-0651-x |
| [46] |
OSINKIN D A, BERESNEV S M, KHODIMCHUK A V, et al. Functional properties and electrochemical performance of Ca-doped Sr2-xCaxFe1.5Mo0.5O6-δ as anode for solid oxide fuel cells[J]. Journal of Solid State Electrochemistry, 2018, 23(2): 627-634. DOI:10.1007/s10008-018-04169-2 |
| [47] |
WANG Y, LI P, LI H, et al. Synthesis and enhanced electrochemical performance of Sm-doped Sr2Fe1.5Mo0.5O6[J]. Fuel Cells, 2014, 14(6): 973-978. DOI:10.1002/fuce.201300250 |
| [48] |
DAI N, WANG Z, JIANG T, et al. A new family of barium-doped Sr2Fe1.5Mo0.5O6-δ perovskites for application in intermediate temperature solid oxide fuel cells[J]. Journal of Power Sources, 2014, 268: 176-182. DOI:10.1016/j.jpowsour.2014.05.146 |
| [49] |
GOU M, REN R, SUN W, et al. Nb-doped Sr2Fe1.5Mo0.5O6-δ electrode with enhanced stability and electrochemical performance for symmetrical solid oxide fuel cells[J]. Ceramics International, 2019, 45(12): 15696-15704. DOI:10.1016/j.ceramint.2019.03.130 |
| [50] |
DING H, TAO Z, LIU S, et al. A redox-stable direct-methane solid oxide fuel cell (SOFC) with Sr2FeNb0.2Mo0.8O6-δ double perovskite as anode material[J]. Journal of Power Sources, 2016, 327: 573-579. DOI:10.1016/j.jpowsour.2016.07.101 |
| [51] |
NIU B, JIN F, YANG X, et al. Resisting coking and sulfur poisoning of double perovskite Sr2TiFe0.5Mo0.5O6-δ anode material for solid oxide fuel cells[J]. International Journal of Hydrogen Energy, 2018, 43(6): 3280-3290. DOI:10.1016/j.ijhydene.2017.12.134 |
| [52] |
SUN K, LIU J, FENG J, et al. Investigation of B-site doped perovskites Sr2Fe1.4X0.1Mo0.5O6-δ (X= Bi, Al, Mg) as high-performance anodes for hybrid direct carbon fuel cell[J]. Journal of Power Sources, 2017, 365: 109-116. DOI:10.1016/j.jpowsour.2017.08.083 |
| [53] |
FENG J, YANG G Q, DAI N N, et al. Investigation into the effect of Fe-site substitution on the performance of Sr2Fe1.5Mo0.5O6-δ anodes for SOFCs[J]. Journal of Materials Chemistry A, 2014, 2(41): 17628-17634. DOI:10.1039/C4TA03216K |
| [54] |
FENG J, QIAO J, WANG W, et al. Development and performance of anode material based on A-site deficient Sr2-xFe1.4Ni0.1Mo0.5O6-δ perovskites for solid oxide fuel cells[J]. Electrochimica Acta, 2016, 215: 592-599. DOI:10.1016/j.electacta.2016.08.088 |
| [55] |
SONG Y, ZHONG Q, TAN W, et al. Effect of cobalt-substitution Sr2Fe1.5-xCoxMo0.5O6-δ for intermediate temperature symmetrical solid oxide fuel cells fed with H2-H2S[J]. Electrochimica Acta, 2014, 139: 13-20. DOI:10.1016/j.electacta.2014.07.022 |
| [56] |
XI X, CAO Z S, SHEN X Q, et al. In situ embedding of CoFe nanocatalysts into Sr3FeMoO7 matrix as high-performance anode materials for solid oxide fuel cells[J]. Journal of Power Sources, 2020, 459: 228071. DOI:10.1016/j.jpowsour.2020.228071 |
| [57] |
HOU M, SUN W, LI P, et al. Investigation into the effect of molybdenum-site substitution on the performance of Sr2Fe1.5Mo0.5O6-δ for intermediate temperature solid oxide fuel cells[J]. Journal of Power Sources, 2014, 272: 759-765. DOI:10.1016/j.jpowsour.2014.09.043 |
| [58] |
ATKINSON A, BARNETT S, GORTE R J, et al. Advanced anodes for high-temperature fuel cells[J]. Nature Materials, 2004, 3(1): 17-27. DOI:10.1038/nmat1040 |
| [59] |
HE B, GONG C, WANG Z, et al. Novel, cobalt-free, and highly active Sr2Fe1.5Mo0.5-xSnxO6-δ cathode materials for intermediate temperature solid oxide fuel cells[J]. International Journal of Hydrogen Energy, 2017, 42(15): 10308-10316. |
| [60] |
SUN W, LI P, XU C, et al. Investigation of Sc doped Sr2Fe1.5Mo0.5O6 as a cathode material for intermediate temperature solid oxide fuel cells[J]. Journal of Power Sources, 2017, 343: 237-245. |
| [61] |
XU C, SUN K, YANG X, et al. Highly active and CO2-tolerant Sr2Fe1.3Ga0.2Mo0.5O6-δ cathode for intermediate-temperature solid oxide fuel cells[J]. Journal of Power Sources, 2020, 450: 227722. |
| [62] |
NISHIHATA Y, MIZUKI J, AKAO T, et al. Self-regeneration of a Pd-perovskite catalyst for automotive emissions control[J]. Nature, 2002, 418(6894): 164. |
| [63] |
TANAKA H, TANIGUCHI M, UENISHI M, et al. Self-regenerating Rh-and Pt-based perovskite catalysts for automotive-emissions control[J]. Angewandte Chemie International Edition, 2006, 45(36): 5998-6002. |
| [64] |
MADSEN B D, KOBSIRIPHAT W, WANG Y, et al. Nucleation of nanometer-scale electrocatalyst particles in solid oxide fuel cell anodes[J]. Journal of Power Sources, 2007, 166(1): 64-67. |
| [65] |
KOBSIRIPHAT W, MADSEN B D, WANG Y, et al. La0.8Sr0.2Cr1-xRuxO3-δ-Gd0.1Ce0.9O1.95 solid oxide fuel cell anodes: Ru precipitation and electrochemical performance[J]. Solid State Ionics, 2009, 180(2/3): 257-264. |
| [66] |
XUE S, SHI N, WAN Y, et al. Novel carbon and sulfur-tolerant anode material FeNi3@PrBa(Fe, Ni)1.9Mo0.1O5+δ for intermediate temperature solid oxide fuel cells[J]. Journal of Materials Chemistry A, 2019, 7(38): 21783-21793. |
| [67] |
SU F, XIA C, PENG R. Novel fluoride-doped barium cerate applied as stable electrolyte in proton conducting solid oxide fuel cells[J]. Journal of the European Ceramic Society, 2015, 35(13): 3553-3558. |
| [68] |
DAI H, NG C, AU C. Perovskite-type halo-oxide La1-xSrxFeO3-δXσ (X= F, Cl) catalysts selective for the oxidation of ethane to ethene[J]. Journal of Catalysis, 2000, 189(1): 52-62. |
| [69] |
ZHANG Z, ZHU Y, ZHONG Y, et al. Anion doping: a new strategy for developing high-performance perovskite-type cathode materials of solid oxide fuel cells[J]. Advanced Energy Materials, 2017, 7(17): 1700242. |
| [70] |
WANG Y, WANG H, LIU T, et al. Improving the chemical stability of BaCe0.8Sm0.2O3-δ electrolyte by Cl doping for proton-conducting solid oxide fuel cell[J]. Electrochemistry Communications, 2013, 28: 87-90. |
| [71] |
ZHANG L, SUN W, XU C, et al. Attenuating a metal-oxygen bond of a double perovskite oxide via anion doping to enhance its catalytic activity for the oxygen reduction reaction[J]. Journal of Materials Chemistry A, 2020, 8(28): 14091-14098. |
| [72] |
ZHANG Y, ZHU Z, GU Y, et al. Effect of Cl doping on the electrochemical performance of Sr2Fe1.5Mo0.5O6-δ cathode material for solid oxide fuel cells[J]. Ceramics International, 2020, 46(14): 22787-22796. |
| [73] |
YAJIMA T, TAKEIRI F, AIDZU K, et al. A labile hydride strategy for the synthesis of heavily nitridized BaTiO3[J]. Nature Chemistry, 2015, 7(12): 1017-1023. |
| [74] |
LI Y, LI Y, WAN Y, et al. Perovskite oxyfluoride electrode enabling direct electrolyzing carbon dioxide with excellent electrochemical performances[J]. Advanced Energy Materials, 2019, 9(3): 1803156. |
 2021, Vol. 49
2021, Vol. 49