文章信息
- 施琦, 丁龙, 龙红明, 王毅璠, 春铁军
- SHI Qi, DING Long, LONG Hong-ming, WANG Yi-fan, CHUN Tie-jun
- 纳米形貌对Ce-V催化剂降解氯苯活性影响
- Effect of nanostructure on catalytic degradation of chlorobenzene over Ce-V catalysts
- 材料工程, 2021, 49(8): 162-168
- Journal of Materials Engineering, 2021, 49(8): 162-168.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.001111
-
文章历史
- 收稿日期: 2019-12-02
- 修订日期: 2020-04-10
2. 安徽工业大学 冶金工程与资源综合利用安徽省重点实验室, 安徽 马鞍山 243002
2. Anhui Province Key Laboratory of Metallurgy Engineering&Resources Recycling, Maanshan 243002, Anhui, China
二氧化铈(CeO2)作为稀土催化材料中的重要组成成分,由于具有未充满电子的4f轨道和镧系收缩等特征,CeO2表现出优异的氧化还原性能、较高的储/释氧容量以及良好的Ce3+/Ce4+切换能力,在催化降解含氯挥发性有机污染物(CVOCs)等领域有着广泛的应用[1]。在水热合成法过程中,通过添加表面活性剂或者修饰剂,可获得不同纳米结构的CeO2[2]。纳米级CeO2具有特殊的性能及应用,纳米形貌的变化对性能影响较大[3]。例如,纳米球状CeO2具有较高的热稳定性和良好的导电性等电化学性能;纳米棒状、线状或纤维状CeO2具有较大的比表面积和较小的孔径结构,可改善催化剂的活性和储氧能力;纳米管状CeO2具有较高的催化性能和氧化还原能力,可用作高效催化剂[4-5]。
在催化降解CVOCs过程中,单组分CeO2易被催化产物中的氯元素毒化失活,影响其催化活性[6]。一般将其与另外一种或者多种金属氧化物复合,以获得更优异的低温活性。其中,V2O5具有较高的抗氯中毒能力[7]。通过向CeO2中掺杂过渡金属钒,能有效提高催化剂的低温活性。当前,Ce-V催化剂降解氯苯的研究主要为活性组分添加比例和制备方法。Huang等[1]向CeO2中添加不同比例的V,研究了活性组分比例对催化剂活性的影响,发现引入质量分数为2.1%的V对催化剂活性提升效果最明显。Guan等[8]研究发现,不同制备方法合成的Ce-V催化剂降解氯苯的活性存在差异。而通过控制纳米形貌,提升催化剂低温活性的研究鲜有报道。
本工作通过添加表面修饰剂、调节溶液离子状态等不同制备条件,控制Ce-V催化剂的微观纳米结构,探索在不同化学环境下Ce-V催化剂纳米形貌的变化规律,从微观角度对Ce-V催化剂晶粒的纳米形貌进行调控。通过考察其低温活性,比较微观形貌控制对催化剂降解活性的影响,提高催化剂低温降解活性。并构建动力学模型,揭示微观形貌与Ce-V催化剂的降解活性之间的关系。
1 实验材料与方法 1.1 Ce-V催化剂合成 1.1.1 实验材料六水硝酸铈(Ce(NO3)3·6H2O,化学纯,国药集团化学试剂有限公司),P123(三嵌段共聚物聚氧乙烯-聚氧丙烯-聚氧乙烯PEO-PPO-PEO,分子量5800,分析纯,阿拉丁化学试剂有限公司),偏钒酸铵(NH4VO3,化学纯,国药集团化学试剂有限公司),草酸(C2H2O4·2H2O,化学纯,国药集团化学试剂有限公司),无水乙醇(CH3CH2OH,分析纯,国药集团化学试剂有限公司),氢氧化钠(NaOH,化学纯,国药集团化学试剂有限公司),氨水(NH4OH,化学纯,国药集团化学试剂有限公司),去离子水(自制)。
1.1.2 Ce-V催化剂的制备本工作采用水热法制备不同纳米形貌的CeO2。将1.86 g的Ce(NO3)3·6H2O加入到20 mL乙醇和20 mL去离子水形成的混合溶液中,以200 r/min转速搅拌;再添加5.8 g的P123,并添加NaOH溶液(浓度约为6 mol·L-1)或者氨水(约3 mL)调节pH值至9~10,产生红色絮状沉淀,再搅拌30 min。将混合液(混合溶液总体积约为40 mL)倒入50 mL聚四氟乙烯高压反应釜中,100 ℃反应10 h后自然冷却至室温。离心洗涤得到黄色沉淀,经过多次抽滤、洗涤(水洗2次,醇洗2次),60 ℃干燥12 h,得到黄色粉末状产物。所得黄色粉末状沉淀为CeO2,是制备Ce-V催化剂的前驱物。
利用浸渍法制备Ce-V催化剂。将所得黄色CeO2与一定量NH4VO3溶于60 ℃热水中,搅拌30 min后90 ℃蒸干,所得黄褐色固体沉淀于60 ℃干燥12 h。然后经一定焙烧条件焙烧。设定焙烧的程序以5 ℃/min从50 ℃升温至450 ℃,保温4 h后冷却至室温。所得催化剂经压片后研磨至60目备用,记为Ce-V催化剂。利用NaOH溶液调节pH值的Ce-V催化剂记为CV-1;利用氨水溶液调节pH值的Ce-V催化剂记为CV-2;添加P123模板添加剂并利用氨水溶液调节pH值的Ce-V催化剂记为CV-3;3种Ce-V催化剂中Ce的质量分数为15%,V的质量分数为2.5%。
1.2 Ce-V催化剂的表征与活性检测 1.2.1 催化剂表征采用D8ADVANCE型X射线衍射仪测定催化剂的相组成;采用JEM-2100型环境透射电子显微镜观察催化剂的微观结构;采用ASAP-2020型比表面积和孔径测定仪测定催化剂的孔结构。
1.2.2 催化剂活性检测Ce-V催化剂活性测试在自行设计的固定反应床反应器中进行,装置如图 1所示。该活性评价系统中催化剂填装量为200 mg,反应空速比(GHSV)为30 000 h-1。将催化剂试样装填在石英反应管中,打开N2,O2,氯苯(chlorobenzene,CB)等反应气体管路,升温至100 ℃后保持N2吹扫1 h,稳定气路后检测未经过催化剂的气体中氯苯体积分数。切换气路为反应气路,检测不同温度段(100~400 ℃,间隔50 ℃)气路中氯苯体积分数。活性评价实验中气体组成为O2 20%(体积分数,下同),氯苯8%,N2为平衡气体,气体总流量为100 mL·min-1。反应前后气体中氯苯利用GC-9860气相色谱仪在线分析。催化剂活性评价方式,主要通过测量氯苯在不同催化剂上的转化率ηCB,其转化率按下式计算:
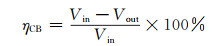
|
(1) |
|
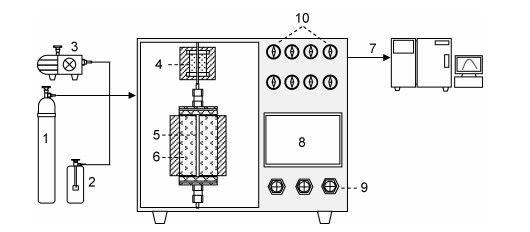
图 1 催化剂活性测试-反应装置图 Fig. 1 Diagram of catalyst activity test system 1 gas cylinder; 2 CB generator; 3 air pumps; 4 preheating furnaces; 5 silica tube; 6 holding furnace; 7 gas chromatograph (GC); 8 controlling panel; 9 controlling valve; 10 pressure gages |
式中,Vin和Vout分别是反应器进出口的氯苯体积分数。
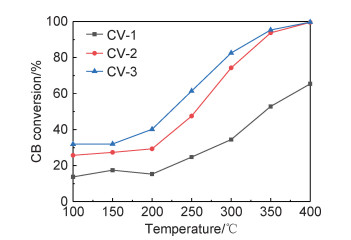
2 结果与分析 2.1 Ce-V催化剂降解氯苯活性图 2是不同纳米形貌的Ce-V催化剂在100~400 ℃内催化降解氯苯活性的曲线图。由图可见,3种Ce-V催化剂降解氯苯活性均随着反应温度的升高而升高;200 ℃以后,反应温度对催化剂活性影响更为显著。其中催化剂CV-3的降解活性最高,100 ℃能达到约30%的降解率,200 ℃能达到约40%的降解率,300 ℃能实现80%以上的降解率。其次是催化剂CV-2,200 ℃能实现30%的降解率,300 ℃能实现70%的降解率。催化剂CV-1的活性最低,200 ℃时降解率为10%,400 ℃时为60%。
|
图 2 Ce-V催化剂的氯苯转化率 Fig. 2 Catalytic conversion of CB over Ce-V catalysts |
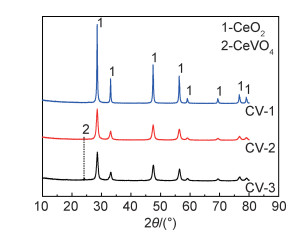
图 3是Ce-V催化剂XRD图谱。由图可见,在10°~80°范围内3种Ce-V催化剂XRD图谱上均存在立方萤石结构CeO2(JCPDF 01-089-8436)衍射峰[9]。CV-2和CV-3催化剂在XRD图谱上位于24°处出现了一个微弱的CeVO4的特征衍射峰[10]。固溶体CeVO4的形成有利于VOx在Ce原子表面扎钉,造成CeO2晶格畸变,因而在催化剂表面形成更多的缺陷[11]。表面缺陷会促使催化剂表面活性位点富集,有利于提升催化剂的降解活性。3种Ce-V催化剂的XRD图谱中并没有观察到VOx的特征衍射峰,这可以归因于,VOx在CeO2表面高度分散,导致结晶度下降所致[1]。研究发现,高度分散的钒氧化物可以增加催化剂中活性氧的数量,活性氧有利于催化剂的氧化还原循环反应,从而提升催化剂的低温活性[12]。
|
图 3 Ce-V催化剂的XRD图谱 Fig. 3 XRD patterns of Ce-V catalysts |
图 4是催化剂Ce-V的TEM照片,从图中可观察到分布均匀的纳米立方状、纳米颗粒状和纳米短棒状CeO2。图 4(a)是利用NaOH溶液调节pH值制备的催化剂CV-1,其微观形貌是纳米立方状。改用氨水调节pH值后,溶液化学环境改变,溶液中的Ce(OH)3沿着(001)面结晶,最后形成纳米颗粒状CeO2,如图 4(b)所示。当添加一定浓度的模板剂P123后,Ce(OH)3沿着(001)面结晶受限,此时溶液中的Ce(OH)3沿着相反面结晶生长,最后形成棒状CeO2,如图 4(c)所示[13]。

|
图 4 Ce-V催化剂的TEM照片 (a)CV-1;(b)CV-2;(c)CV-3 Fig. 4 TEM images of Ce-V catalysts (a)CV-1;(b) CV-2;(c)CV-3 |
不同微观形貌的催化剂,其比表面积、孔容和孔径大小不同。表 1列出了Ce-V催化剂的比表面积、孔容和孔径大小。催化剂CV-1的比表面积为36.66 m2/g,孔容为0.196 cm3/g,孔径为47.16 nm。当改用氨水调节pH值后,催化剂CV-2的比表面积增大为66.66 m2/g,与此同时总孔容和平均孔径都有所下降,分别为0.118 cm3/g和12.87 nm。在氨水调节pH值的基础上,添加P123模板剂后,比表面积继续增大到90.63 m2/g,孔容为0.133 cm3/g,平均孔径8.77 nm。较大的比表面积可提升催化剂的物理吸附能力,有利于催化剂表面氯苯分子的吸附,并延长吸附时间[14]。此外,比表面积不同,催化剂表现出不同的储/释氧能力。储/释氧能力的差异性则会决定催化剂表面的氧空位数量,并最终影响催化降解活性的高低[15]。图 5是Ce-V催化剂孔径分布图。由图可见,氨水调节pH值后的催化剂孔径集中分布在50 nm以内,添加表面抑制剂的Ce-V催化剂中孔径大小在10~20 nm的微孔数量更多。研究表明,催化剂中孔数量越多,越有利于提高催化剂的氯苯吸附率,促进氯苯在催化剂表面的催化降解[16]。因此,优化制备条件,控制催化剂的微观形貌,可提高低温条件下Ce-V催化剂的降解活性。
| Sample | Surface area/(m2·g-1) | Pore volume/(cm3·g-1) | Pore diameter/nm |
| CV-1 | 36.66 | 0.196 | 47.16 |
| CV-2 | 66.66 | 0.118 | 12.87 |
| CV-3 | 90.63 | 0.133 | 8.77 |

|
图 5 Ce-V催化剂孔径分布图 Fig. 5 Pore diameter distribution of Ce-V catalysts |
对于催化循环反应,催化剂氧化能力决定了其催化活性。在氯苯降解过程中,Ce-V催化剂表面CeO2的氧化性越强,催化剂活性就越高。一般认为CeO2表面氧主要包括以下两类:(1)吸附态的氧,主要是表面吸附的分子氧;(2)晶格氧,主要为CeO2中较难还原的晶格氧[17]。两种不同状态的氧在适当的条件下可以相互转化,氧的数量决定了CeO2的氧化性能差异。
立方萤石结构的CeO2微观结构中有3个低指数面,分别是非常稳定的中性面{111}面,不太稳定的{110}面和高表面能的{001}面[18]。而CeO2表面的氧空位的形成与该表面的稳定性有关。表面越稳定,该面上的反应能越低,能形成的氧空位越少。CeO2中3种表面的稳定性排序为:{111}>{110}>{001},晶面{111}的表面固有反应能最低,且可形成的氧空位最少[19-21]。此外,有研究表明,CeO2中的面{111}和{110}上具有不同吸附特征,其中面{111}上仅有弱吸附,而面{110}上既存在弱吸附也存在强吸附[22]。因此,如果催化剂中暴露的晶面具有较高的表面能,就能在催化反应过程中产生更多的活性位点。通过控制催化剂的制备过程,可影响催化剂的形核方式,获得更多不稳定晶面,从而增加催化剂表面的氧空位和活性位点,获得更好的降解活性。
图 6是利用氨水调节pH值制备的Ce-V催化剂高倍透射电镜(HRTEM)照片、微观结构模型及其形核机制。由图 6(a)可见,纳米颗粒状CV-2催化剂中,{111}晶面为主要暴露晶面,其次为{001}晶面[18]。因此,推测纳米颗粒状的CV-2催化剂的微观结构模型如图 6(b)所示,一共有两个晶体模型,分别是8个{111}晶面组成八面体,以及8个{111}晶面和6个{001}晶面组成的异形八面体[23]。图 6(c)是纳米短棒状CV-3催化剂HRTEM照片。由该照片可以看出,CV-3催化剂为单晶纳米棒状,沿{100}面生长[15, 24-26]。因此推测其微观结构为立方长方体,主要由两个{001}晶面和两个{110}晶面构成。纳米棒状的CV-3催化剂的微观结构模型如图 6(d)所示。添加表面抑制剂后,Ce(OH)4形核方向在{110}面受到限制,沿{100}继续生长,最终形成棒状的纳米结构。通过上述分析,可得出催化剂CV-3比CV-2中存在的{001}晶面要多的结论。由于该晶面的不稳定性和强吸附性,在催化剂CV-3表面可形成更多的氧空位和活性位点。这对催化反应均有提高作用。

|
图 6 氨水调节pH值的CV催化剂HRTEM照片和微观结构模型 (a)催化剂CV-2的HRTEM照片;(b)催化剂CV-2的微观结构模型;(c)催化剂CV-3的HRTEM照片;(d)催化剂CV-3的微观结构模型 Fig. 6 HRTEM image and microstructural models of CV catalysts with ammonia adjusting the pH value (a)HRTEM image of CV-2 catalysts; (b)microstructural models of the CV-2 catalysts; (c)HRTEM image of CV-3 catalysts; (d)microstructural models of the CV-3 catalysts |
在100~250 ℃范围内,等温检测催化剂的降解活性,并将结果带入式(2)计算氯苯催化降解速率rCB:

|
(2) |
式中:k为氯苯催化降解速率常数;CCBm表示某一时刻下氯苯的浓度;CO2n表示氧气浓度。实验中CO2>>CCB,因此认为氧气浓度为常数。又因催化降解是燃烧反应,该过程属于一级反应,m=1,n=0,式(2)可简化为式(3):
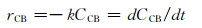
|
(3) |
通过对等式变形化简后:
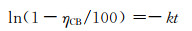
|
(4) |
式中k为:
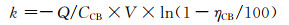
|
(5) |
式中:Q为反应物的流量,mol·s-1;CCB是反应物的初始浓度,mol·cm-3;V是催化剂体积,cm3。将各个催化剂不同温度下的氯苯转化率带入式(5)中,可计算得到催化剂CV-1,CV-2和CV-3在100~250 ℃温度范围内的反应速率常数kCV-1,kCV-2和kCV-3,具体数值见表 2。
| Temperature/℃ | kCV-1 | kCV-2 | kCV-3 |
| 100 | 3.93 | 7.93 | 10.25 |
| 150 | 5.12 | 8.52 | 10.28 |
| 200 | 4.42 | 9.24 | 13.70 |
| 250 | 7.57 | 17.19 | 25.39 |
由表 2可以看出,同一温度下催化剂CV-3的反应速率常数kCV-3最大,是催化剂CV-1的反应速率常数kCV-1的3~4倍。这主要归因于催化剂CV-3具有更高的吸附能力和催化活性。表观活化能Ea与反应速率常数k可代入阿伦尼乌斯方程(Arrhenius equation)[27]:

|
(6) |
式中:R为气体常数,R=8.314 J/(K·mol);T为气体温度,K;C为常数。反应所需表观活化能可通过绘制-lnk∝1000/T曲线,由曲线斜率(Ea/R)换算获得,计算结果如表 3。
| Sample | Apparent activation energy/(kJ·mol-1) |
| CV-1 | 5.60±3.01 |
| CV-2 | 7.30±3.56 |
| CV-3 | 9.26±3.76 |
根据阿伦尼乌斯方程绘制曲线如图 7所示。-lnk与1000/T表现出很好的线性关系,拟合相关系数r在0.7~0.9之间。催化剂CV-1,CV-2和CV-3的氯苯降解表观活化能分别为(5.60±3.01),(7.30±3.56) kJ·mol-1和(9.26±3.76) kJ·mol-1。根据阿伦尼乌斯方程,表观活化能越大,反应速率越大,因此催化反应越容易进行。催化剂CV-3的反应速率和表观活化能均大于CV-1和CV-2,因此催化剂CV-3上的催化降解反应比催化剂CV-1和CV-2更容易发生。
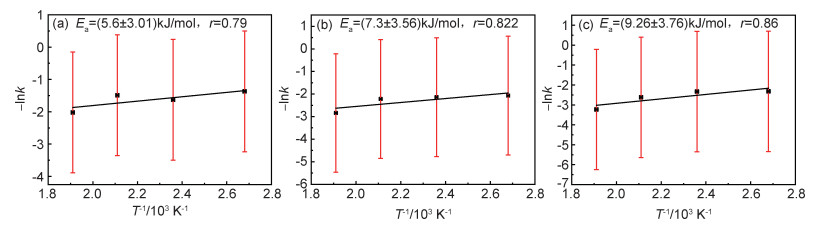
|
图 7 催化剂Ce-V阿伦尼乌斯曲线 (a)CV-1;(b)CV-2;(c)CV-3 Fig. 7 Arrhenius curves of Ce-V catalysts (a)CV-1;(b)CV-2;(c)CV-3 |
(1) 催化剂制备方法决定了其晶体形态的差异。水热法制备的Ce-V催化剂均为纳米结构,其中NaOH溶液调节pH值得到的Ce-V催化剂为纳米立方状;氨水调节pH值得到的Ce-V催化剂为纳米颗粒状;在氨水调节pH值的基础上添加表面修饰剂P123,可得到纳米棒状Ce-V催化剂。不同纳米结构Ce-V催化剂,纳米颗粒大小顺序为:CV-1>CV-2>CV-3,降解氯苯活性顺序为:CV-3>CV-2>CV-1。
(2) 利用氨水调节pH值的Ce-V催化剂中出现了新物相CeVO4。CeVO4能缓解VOx在催化剂表面团聚,也能造成CeO2晶格畸变,增加催化剂表面的氧空位和活性氧数量,从而有利于催化剂表面氯苯的降解。
(3) 动力学计算分析表明,反应速率常数随着温度升高而逐渐增大,且3种Ce-V催化剂的反应速率常数顺序为:CV-3>CV-2>CV-1;其氯苯降解表观活化能分别为(5.60±3.01),(7.30±3.56) kJ·mol-1和(9.26±3.76) kJ·mol-1,与催化剂活性检测结果一致。
| [1] |
HUANG H, GU Y, ZHAO J, et al. Catalytic combustion of chlorobenzene over VOx/CeO2 catalysts[J]. Journal of Catalysis, 2015, 326: 54-68. DOI:10.1016/j.jcat.2015.02.016 |
| [2] |
MAI H, SUN L, ZHANG Y, et al. Shape-selective synthesis and oxygen storage behavior of ceria nanopolyhedra, nanorods, and nanocubes[J]. The Journal of Physical Chemistry: B, 2005, 109(51): 24380-24385. DOI:10.1021/jp055584b |
| [3] |
LI J, ZHANG Z, TIAN Z, et al. Low pressure induced porous nanorods of ceria with high reducibility and large oxygen storage capacity: synthesis and catalytic applications[J]. Journal of Materials Chemistry: A, 2014, 2: 16459-16466. DOI:10.1039/C4TA03718A |
| [4] |
ZHANG H, FANG Y. Temperature dependent photoluminescence of surfactant assisted electrochemically synthesized ZnSe nanostructures[J]. Journal of Alloys and Compounds, 2019, 781: 201-208. DOI:10.1016/j.jallcom.2018.11.375 |
| [5] |
HOU X J, WANG Y, YANG Y L, et al. Microstructure evolution and controlled hydrolytic hydrogen generation strategy of Mg-rich Mg-Ni-La ternary alloys[J]. Energy, 2019, 188: 116081-116091. DOI:10.1016/j.energy.2019.116081 |
| [6] |
YANG S, ZHAO H, DONG F, et al. Highly efficient catalytic combustion of o-dichlorobenzene over three-dimensional ordered mesoporous cerium manganese bimetallic oxides: a new concept of chlorine removal mechanism[J]. Molecular Catalysis, 2019, 463: 119-129. DOI:10.1016/j.mcat.2018.12.006 |
| [7] |
GANNOUN C, DELAIGLE R, DEBECKER D P, et al. Effect of support on V2O5 catalytic activity in chlorobenzene oxidation[J]. Applied Catalysis: A, 2012, 447/448(24): 1-6. |
| [8] |
GUAN Y, LI C. Effect of CeO2 redox behavior on the catalytic activity of a VOx/CeO2 catalyst for chlorobenzene oxidation[J]. Chinese Journal of Catalysis, 2007, 28(5): 392-394. DOI:10.1016/S1872-2067(07)60033-3 |
| [9] |
XIANG X, SHENG Z, LIU Y, et al. Low-temperature selective catalytic reduction of NOx with NH3 over a manganese and cerium oxide/graphene composite prepared by a hydrothermal method[J]. Catalysis Science & Technology, 2015, 6(5): 1507-1514. |
| [10] |
COUSIN R, COURCOT D, ABI-AAD E, et al. 51 V MAS NMR characterization of V-Ce-O catalysts[J]. Colloids & Surfaces: A, 1999, 158(1/2): 43-49. |
| [11] |
WU Z, RONDINONE A J, OVERBURY S H. Structure of vanadium oxide supported on ceria by multiwavelength ramanspectroscopy[J]. Journal of Physical Chemistry: C, 2011, 115(51): 25368-25378. DOI:10.1021/jp2084605 |
| [12] |
MILLER D D, CHUANG S S C. In situ infrared study of NO reduction over Pd/Al2O3 and Ag-Pd/Al2O3 catalysts under H2-rich and lean-burn conditions[J]. Journal of the Taiwan Institute of Chemical Engineers, 2009, 40(6): 613-621. DOI:10.1016/j.jtice.2009.04.006 |
| [13] |
SHI Q, DING L, LONG H M, et al. Study of catalytic combustion of dioxins on Ce-V-Ti catalysts modified by graphene oxide in simulating iron ore sintering flue gas[J]. Materials, 2020, 13: 125. |
| [14] |
ZHOU X J, BUEKENS A, LI X D, et al. Adsorption of polychlorinated dibenzo-p-dioxins/dibenzofurans on activated carbon from hexane[J]. Chemosphere, 2016, 144: 1264-1269. DOI:10.1016/j.chemosphere.2015.10.003 |
| [15] |
MAI H X, SUN L D, ZHANG Y W, et al. Shape-selective synthesis and oxygen storage behavior of ceria nanopolyhedra, nanorods, and nanocubes[J]. Journal of Physical Chemistry: B, 2005, 109(51): 24380-24385. DOI:10.1021/jp055584b |
| [16] |
LEE J H, KIM S. The determination of the adsorption performance of graphite for VOCs and formaldehyde[J]. Energy & Buildings, 2012, 46(4): 56-61. |
| [17] |
LIN H L, WU C Y, CHIANG R K. Facile synthesis of CeO2 nanoplates and nanorods by [100] oriented growth[J]. Journal of Colloid & Interface Science, 2010, 341(1): 12-17. |
| [18] |
ZHANG F, JIN Q, CHAN S W. Ceria nanoparticles: size, size distribution, and shape[J]. Journal of Applied Physics, 2004, 95(8): 4319-4326. DOI:10.1063/1.1667251 |
| [19] |
SAYLE D C, MAICANEANU S A, WATSON G W. Atomistic models for CeO2(111), (110), and (100) nanoparticles, supported on yttrium-stabilized zirconia[J]. Journal of the American Chemical Society, 2002, 124(38): 11429-11439. DOI:10.1021/ja020657f |
| [20] |
SKÅRMAN B, NAKAYAMA T, GRANDJEAN D, et al. Morphology and structure of CuOx/CeO2 nanocomposite catalysts produced by inert gas condensation: an HREM, EFTEM, XPS, and high-energy diffraction study[J]. Chemistry of Materials, 2002, 14(9): 3686-3699. DOI:10.1021/cm021101u |
| [21] |
LUNDBERG M, SKÅRMAN B, WALLENBERG L R. Crystallography and porosity effects of CO conversion on mesoporous CeO2[J]. Microporous & Mesoporous Materials, 2004, 69(3): 187-195. |
| [22] |
YANG Z, WOO T K, HERMANSSON K. Strong and weak adsorption of CO on CeO2 surfaces from first principles calculations[J]. Chemical Physics Letters, 2004, 396(4): 384-392. |
| [23] |
WANG Z L, FENG X. Polyhedral shapes of CeO2 nanoparticles[J]. Journal of Physical Chemistry: B, 2003, 107(49): 13563-13566. DOI:10.1021/jp036815m |
| [24] |
SU D S, CHEN X, WEINBERG G, et al. Hierarchically structured carbon: synthesis of carbon nanofibers nested inside or immobilized onto modified activated carbon[J]. Angewandte Chemie, 2010, 44(34): 5488-5492. |
| [25] |
KUNG H H, KUNG M C. Heterogeneous catalysis: what lies ahead in nanotechnology[J]. Applied Catalysis: A, 2003, 246(2): 193-196. DOI:10.1016/S0926-860X(03)00023-1 |
| [26] |
ZHOU K, XUN W, SUN X, et al. Enhanced catalytic activity of ceria nanorods from well-defined reactive crystal planes[J]. Journal of Catalysis, 2005, 229(1): 206-212. DOI:10.1016/j.jcat.2004.11.004 |
| [27] |
YANG C C, SHU H C, BAO Z H, et al. Innovative PCDD/F-containing gas stream generating system applied in catalytic decomposition of gaseous dioxins over VO-WO/TiO-based catalysts[J]. Chemosphere, 2008, 73(6): 890-895. DOI:10.1016/j.chemosphere.2008.07.027 |
 2021, Vol. 49
2021, Vol. 49


