文章信息
- 刘剑桥, 刘佳, 唐毓金, 王立强
- LIU Jian-qiao, LIU Jia, TANG Yu-jin, WANG Li-qiang
- 钛合金在骨科植入领域的研究进展
- Research progress in titanium alloy in the field of orthopaedic implants
- 材料工程, 2021, 49(8): 11-25
- Journal of Materials Engineering, 2021, 49(8): 11-25.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000380
-
文章历史
- 收稿日期: 2020-04-28
- 修订日期: 2020-06-18
2. 上海交通大学 材料科学与工程学院 金属基复合材料国家重点实验室, 上海 200240
2. State Key Laboratory of Metal Matrix Composites, School of Materials Science and Engineering, Shanghai Jiao Tong University, Shanghai 200240, China
生物材料因其良好的综合力学性能及优异的生物相容性,现已广泛应用于骨科、口腔科、皮肤组织工程、心血管等领域[1],在疾病的诊断治疗、创伤的替换修复或诱导再生等方面应用广泛[2]。生物材料在骨科疾病治疗中发挥重要作用,常见植入物材料包括生物陶瓷、不锈钢、钛、镁、钴合金、医用超高分子量聚乙烯材料等。
钛是一种重要的金属元素,密度为4.51 g/cm3,接近人体硬组织,且其生物相容性、耐腐蚀性和抗疲劳性能优于不锈钢材料、钴合金材料等。钛合金是目前最佳的金属医用材料之一,在骨科领域有广泛应用。然而,作为骨科常用植入物材料,钛及钛合金依然存在许多不足,比如:“应力遮挡”效应[3],强度较低、表面耐磨性能较差,Ti-6Al-4V等传统钛合金中所含的铝、钒等元素对机体存在潜在危害[4]等,因此,仍需要开发高性能的生物医用钛合金来满足临床应用需求。本文从钛及钛合金力学性能、耐腐蚀耐磨性能、成骨性能、抗菌性能等方面阐述钛及钛合金最新研究进展,并对未来生物医用钛合金研究方向进行展望。
1 微观结构特点及发展阶段自20世纪以来,金属植入物已在医学领域广泛应用。作为体内临时或永久植入物,金属材料成为骨科手术中不可分割的组成部分。金属材料与其他非金属材料相比,具有许多优点:高拉伸强度、高韧性,较好的耐冲击性、延展性及成型加工性能,性能稳定等。因此,将金属材料作为植入物材料的趋势不会改变。
钛作为一种双相的同素异形体,在室温时,以密排六方(HCP)结构形式存在,称为α型;在883 ℃时,转变为β型体心立方(BCC)结构。钛合金的平衡和亚稳定状态分为5种合金类别:近α、α、α+β、近β和β。
医用钛及钛合金发展可分为3个阶段:初始阶段以纯钛和Ti-6Al-4V合金为代表。纯钛具有α型结构,20世纪40年代,研究人员发现纯钛植入老鼠股骨后未引起不良反应,后进一步证实纯钛具有良好生物相容性。20世纪60年代,纯钛作为口腔植入物应用于临床,后作为外科植入物材料不断发展。但由于纯钛强度较低,耐磨损性能差,影响了其在较大承载力部位的应用。Ti-6Al-4V合金组织类型是α+β型,起初应用于航空航天领域,在20世纪70年代被制成接骨板、髓内钉、关节置换物等材料用于外科创伤修复或关节替换。Ti-6Al-4V合金较纯钛强度更高,同时具有良好的加工性能,被广泛用于生物医用领域。但是,Ti-6Al-4V合金材料中所含的铝、钒元素被认为对生物具有危害性。研究显示,钒化物可影响各种三磷酸腺苷酶、蛋白激酶、核糖核酸酶和磷酸酯酶活性[5],铝元素可导致骨软化病或引起贫血、神经紊乱等症状[6],同时以铝盐形式造成器官损伤。植入钛合金发展的第2阶段以Ti-6Al-7Nb和Ti-5Al-2.5Fe为代表,组织类型为新型α+β型合金。这类新型合金以铁、铌元素取代了有毒性的钒元素,弹性模量与纯钛和Ti-6Al-4V相近,强度也有所提高。1985年瑞士Sulzar公司利用Ti-6Al-7Nb合金制造了髋关节假体股骨柄,在临床得以应用。而Ti-5Al-2.5Fe合金因冶金质量、加工性能欠佳等问题而在应用方面受到局限。第3阶段为不含铝、钒元素的低弹性模量新型β型钛合金材料,包括以Ti-13Nb-13Zr,Ti-12Mo-6Zr-2Fe和Ti-15Mo为代表的β型或近β型钛合金。它们具有强度高、生物相容性好、弹性模量更接近人体骨骼等优点。1994年,美国研制的Ti-13Nb-13Zr合金是最早被正式列入国际标准的近β型医用钛合金,随后又研制出亚稳态β型Ti-12Mo-6Zr-2Fe合金,在2000年被Strker公司用作制备髋关节假体的股骨柄,并在临床中应用。除此之外,有多种新型β型钛合金材料用作制备人工牙齿根、螺钉、接骨板、植入棒等植入材料。目前临床仍以纯钛和Ti-6Al-4V合金为主流应用材料,但新型β型钛合金因具有更低的弹性模量和更好的生物相容性成为研究的热点,是最有应用前景的生物医用钛合金。
2 力学性能特点钛合金作为常用的骨科植入物材料,与不锈钢材料和钴合金材料相比,弹性模量有所降低,但和骨骼相比仍较高。植入体内后仍存在“应力遮挡”效应,会引起骨密度降低并增加植入物植入失败风险。为满足骨科领域对植入物材料低弹性模量需求,研究人员进行大量研发工作,制备了具有优异综合性能的钛合金材料。
2.1 低弹性模量钛合金合金化处理是改善医用钛合金力学性能的主要方法,选择添加元素需要遵守的原则有:元素无毒性、不致敏性并且可改善合金的力学性能。近年来所研发的新型β钛合金主要有Ti-Nb系合金、Ti-Mo系合金、Ti-Zr系合金和Ti-Ta系合金。与其他体系β钛合金相比,这些体系的β钛合金弹性模量更低,更接近于人骨的弹性模量。它们用生物相容性好,无毒的Nb,Mo,Zr,Ta等元素取代了Al和V,更适合作为骨科植入物材料。已研制成功的部分医用钛合金有:Ti-13 Nb-13Zr,Ti-20Nb-0.5Ru,Ti-20Nb-1.0Ru,Ti-24Nb-4Zr-8Sn,Ti-25Nb,Ti-25Nb-1Sn-2Cr,Ti-29Nb-2Mo-6Zr,Ti-30Nb-32Zr,Ti-32Nb-2Sn,Ti-35Nb-7Zr-5Ta,Ti-35Nb-2Ta-3Zr,Ti-7Mo,Ti-15Zr-15Mo,Ti-15Zr-20Mo,Ti-20Zr-10Mo,Ti-10Fe-10Ta等。合金材料制备工艺及力学性能见表 1[7-21]。
| Material | Preparation process | Alloy type | Elastic modulus/GPa | Yield strength/MPa | Tensile strength/MPa | Hardness/GPa | Ref |
| Cortical bone | - | - | 15-30 | 30-70 | 70-150 | - | [7] |
| Ti-13Nb-13Zr | High-pressure torsion | β+α | 59.6 | - | - | 3.73 | [8] |
| Ti-20Nb-0.5Ru | Cold crucible levitation melting | β | 70±1 | 780±20 | 900±100 | 4.90±0.08 | [9] |
| Ti-20Nb-1Ru | Cold crucible levitation melting | β | 60.5±0.5 | 920±60 | 810±90 | 4.29±0.05 | [9] |
| Ti-24Nb-4Zr-8Sn | Powder metallurgy+quenching | β | 56.9±1.1 | - | 760±7 | 2.16±0.04 | [10] |
| Ti-25Nb | Pressure-assisted sintering | β | 80 | - | - | 3.1 | [11] |
| Ti-25Nb-1Sn-2Cr | Cold crucible levitation melting | β | 66±2 | 463±30 | - | 2.36±0.13 | [12] |
| Ti-29Nb-2Mo-6Zr | Arc melting+quenching+cold rolling+annealing+quenching | β+α | 79.32±0.55 | - | - | 2.84±0.03 | [13] |
| Ti-30Nb-32Zr | Cold crucible levitation melting+solution treating+20% cold rolling reduction rate | β+α | 57±2 | 629±10 | 692±18 | - | [14] |
| Ti-30Nb-32Zr | Cold crucible levitation melting+solution treating+86% cold rolling reduction rate | β | 69±5 | 899±38 | 961±50 | - | [14] |
| Ti-30Nb-32Zr | Cold crucible levitation melting+solution treating+86% cold rolling reduction rate+annealing | β | 62±3 | 710±10 | 722±11 | - | [14] |
| Ti-32Nb-2Sn | Solution treating +quenching | β | 60±2 | 665±25 | 780±5 | 2.6±0.1 | [15] |
| Ti-32Nb-2Sn | Solution treating +quenching +500 ℃ aging treatment | β+α | 82±2 | 960±5 | 1070±15 | 3.2±0.2 | [15] |
| Ti-32Nb-2Sn | Solution treating +quenching +600 ℃ aging treatment | β+α | - | 560±30 | 685±20 | 2.4±0.2 | [15] |
| Ti-35Nb-7Zr-5Ta | High-pressure torsion | β | 43.6 | - | - | 3.06 | [8] |
| Ti-35Nb-2Ta-3Zr | Arc melting+cold rolling+annealing | β+α | 55 | - | - | - | [16] |
| Ti-35Nb-2Ta-3Zr | Laser-remelting | β+α | - | - | - | 2.53 | [17] |
| Ti-7Mo | Directed energy deposition | β+α | 105 | 579 | 686 | - | [18] |
| Ti-15Zr-15Mo | Argon arc melting+hot rolling+annealing+water quenching+aging treatment | β | 71.0±3.1 | - | - | 3.94±0.17 | [19] |
| Ti-15Zr-20Mo | Argon arc melting+hot rolling +annealing+water quenching +aging treatment | β | 80.1±5.1 | - | - | 3.01±0.17 | [19] |
| Ti-20Zr-10Mo | Argon arc melting+hot rolling | β | 79±4 | - | - | 3.65±0.03 | [20] |
| Ti-10Fe-10Ta | Cold crucible levitation melting | β+α | 92.5 | - | - | 3.38 | [21] |
长期以来,Ti-Nb系合金由于高生物相容性、低弹性模量等特点使其作为骨科植入物候选材料而引起关注。Nb作为合金元素加入,可使Ti-Nb合金弹性模量降低。基于Ti-Nb系统,通过添加不同含量及不同种类的β相稳定元素,研制出三元、四元Ti-Nb合金。它们具有不同的弹性模量、抗拉强度等力学性能。虽然研究人员对Mo元素的生物相容性存在担忧[22],但是Mo元素作为β相稳定剂,可制备出具有高拉伸强度和较低弹性模量的Ti-Mo合金。除此之外,添加了无毒元素Fe和Ta的Ti-10Fe-10Ta合金,由于Ta元素的添加,合金材料同样显示出较低的弹性模量。
2.2 多孔钛合金制备具有优异综合力学性能的钛合金材料,除加入不同合金化元素外,还可通过制备多孔结构来达到这一目的。常用的制备多孔材料方法包括:发泡法、粉末冶金法、纤维烧结法、等离子喷涂法、凝胶注模成型法、激光打孔技术[23]、3D打印技术[24]等。制备多孔钛合金材料时,应在降低钛合金材料弹性模量同时保证其具有适宜的强度。目前,研究者研发出如Ti-6Al-4V多孔合金、Ti-3Cu多孔合金、Ti-Ag/Ti径向梯度多孔复合材料、Ti-2Cu-4Ca多孔合金、Ti-35Zr-28Nb多孔合金等,不难看出,此类材料显示出比合金化处理更低的弹性模量,见表 2[25-32]。
| Material | Preparation process | Alloy type | Pore size/μm | Porosity/% | Elastic modulus/GPa | Compressive strength/MPa | Compression yield strength/ MPa | Ref |
| Porous Ti-3Cu | Microwave sintering | α | ≈130 | 21.08-27.25 | 7.02-11.94 | 488.51-1062.34 | - | [25] |
| Radial gradient porous Ti-Ag/Ti | Spark plasma sintering | α+β | ≈105 | 13-49 | 16.8±1.6 | 1248±42 | - | [26] |
| Porous Ti-2Cu-4Ca | Spark plasma sintering | α | ≈460 | 43±5 | (6.2±0.1)- (12.2±0.1) | (206±10)- (325±10) | - | [27] |
| Porous Ti-35Zr-28Nb | Powder metallurgy | β | (229.9±5.6)- (427.4±10.1) | (51.4±1.1)- (64.9±1.6) | (1.8±0.5)- (6.9±0.6) | - | (79.7±3.5)- (230.5±7.6) | [28] |
| Porous Ti | Ink jet 3D printing | - | 97±26 | 41.34 | 4.5±1.0 | - | 126±12 | [29] |
| Porous Ti-6Al-4V ELI | Selective laser melted | - | 305±11 | 45.5±0.01 | 10.4±0.2 | - | 146.6±2.8 | [30] |
| Porous Ti | Selective laser melted | - | 459.5±27.9 | 60.6±3.9 | 5.42±0.07 | - | - | [31] |
| Porous Ti-6Al-4V | 3D inkjet printing | - | 8.9 | 0.52 | 4.1±0.3 | 222.6±32.2 | - | [32] |
除此之外,Guo等[33]通过放电等离子体烧结技术,将Ti和磷酸三钙(α-TCP)混合粉末覆盖在Ti网孔上,制备了Ti/α-TCP/Ti网状复合材料,实验结果显示Ti含量为70%(质量分数,下同)的Ti/α-TCP具有最佳的力学性能,70Ti/α-TCP/Ti网状复合材料的弹性模量为30 GPa,抗压强度为589 MPa。α-TCP作为一种促进新骨形成的添加剂,显示出良好的生物活性及生物相容性,使该复合材料作为植入物材料方面具有良好潜在应用价值。
临床中采用的固定骨折部位的接骨板常具有较高的弹性模量和较高强度,钛合金作为常用材料能够为骨折组织提供稳定力学支撑,防止损伤的再次发生。从表 1可看出人骨组织具有较低的弹性模量,传统钛合金因弹性模量远大于骨组织将会承担较多的载荷,骨组织将会长期处于较低的应力水平,骨折康复的后期,骨组织如得不到足够的力学刺激而导致骨质疏松,从而易再次发生骨折。从生物力学性能角度考虑,钛合金材料与人骨组织模量和强度越接近,“应力遮挡”效应越小,越有利于骨组织的修复和重建[34-37]。钛合金材料中,Ti-13Nb-13Zr,Ti-30Nb-32Zr,Ti-35Nb-2Ta-3Zr,Ti-35Nb-7Zr-5Ta等材料具有低于60 GPa的弹性模量。多孔结构钛合金材料,如:多孔Ti、多孔Ti-6Al-4V、多孔Ti-3Cu、多孔Ti-2Cu-4Ca、多孔Ti-35Zr-28Nb、径向梯度多孔Ti-Ag/Ti等材料具有1.8~16.8 GPa的弹性模量。图 1中为通过3D打印技术制备多孔Ti-6Al-4V材料的数据重建图像。值得一提的是,3D打印技术制备多孔钛合金材料是目前研究的一个热点,通过3D打印技术可对多孔结构孔径和孔隙率进行精确控制,这些因素可使其弹性模量处于更低的水平。
钛合金表面通常会生成稳定、结合牢固的氧化膜,这是钛合金具有耐腐蚀性能的主要原因。由于植入体内环境复杂,体液中存在的氯离子及蛋白质等物质可对氧化膜造成腐蚀,引起溶解和剥离,从而影响钛合金耐腐蚀性。因此,提高钛合金的耐腐蚀性能,同时避免改变钛合金自身的力学性能,对其进行表面改性处理成为目前研究热点。
电泳沉积法是材料表面制备涂层的常用方法。根据沉积过程中悬浮胶液的组成和工作面所带电荷的不同可分为阳极电沉积和阴极电沉积,阴极电泳沉积可以制备出有优异耐腐蚀性能的涂层。Mahlooji等[38]通过在Ti-6Al-4V表面用电泳沉积法制备壳聚糖(CS)-生物活性玻璃(BG)复合涂层,以增强钛合金表面的耐腐蚀性能及生物活性。结果显示,与CS-0.5 g/L BG和CS-1 g/L BG涂层相比,CS-1.5 g/L BG涂层显示出最高的腐蚀电位(+(0.22±0.1)V)和最小的钝化电流密度((2±0.32)×10-7A/cm2)。研究证实,该涂层可有效提高Ti-6Al-4V的耐腐蚀性。Singh等[39]利用电泳沉积法在Ti-13Nb-13Zr表面制备掺有羟基磷灰石(HA)、壳聚糖(CS)的氧化铁(Fe3O4)复合涂层。在添加不同质量分数(1%,3%和5%)Fe3O4的HA-Fe3O4-CS复合涂层中,HA-1Fe3O4-CS复合涂层显示出最好的耐腐蚀性能,具有最高的腐蚀电位(-309 mV)和最低的腐蚀电流密度(0.059×10-6μA/cm2)。
此外,也有研究人员通过在NiTi合金表面利用电泳沉积法制备了氧化石墨烯/银(GO-Ag)纳米复合涂层[40],该涂层相比裸露的NiTi合金表面及氧化石墨烯纳米涂层,显示出低的腐蚀电流密度(0.02 μA/cm2)以及较高的腐蚀电位(0.08 V),说明GO-Ag纳米复合涂层相比裸露的NiTi合金表面具有更好的耐腐蚀性、更低的腐蚀速率和更高的保护效率。Chellapa等[41]利用同种方法制备SiO2-ZnO复合涂层,相比于对照组Ti-6Al-4V表面,该复合涂层显示出优秀的耐腐蚀性能,其腐蚀电位达到3.673 mV,腐蚀电流密度达到0.051 mA/cm2。
碳类材料制成的薄膜因其优秀的生物相容性、耐腐蚀性以及化学惰性而被广泛应用于生物医学领域[42-43]。Yang等[44]先使用了微弧氧化(MAO)技术在钛基底上制备了MAO涂层结构,后在此基础上应用混合束磁控溅射技术、电磁过滤阴极电弧复合溅射技术、等离子体增强化学气相沉积技术分别制备了类金刚石碳薄膜(DLC)、类石墨碳(GLC)薄膜、厚类金刚石碳(PE-DLC)薄膜。各材料的极化曲线如图 2所示。从图中可以看出,GLC薄膜腐蚀电位达到-0.018 V,腐蚀电流密度为2.38×10-9A/cm2,与其他实验组相比,显示出最好的潜在耐腐蚀倾向。
除上述方法制备耐腐蚀涂层外,有研究通过化学气相沉积法、离子束沉积法、阳极氧化法等在钛合金表面制备不同成分的涂层或膜结构,这些涂层或膜结构显示出对基底材料耐腐蚀性能不同程度的改善,见表 3[38-41, 44-48]。从表中可以看出,最新研究中主要通过表面改性技术来抑制基底材料在溶液中的腐蚀速率,从而降低在植入生物体初期腐蚀过程过快发生,避免对基底材料造成机械应力的损失,进而能够更好地应用于生物环境。衡量耐腐蚀性能的有效指标有腐蚀电流密度和腐蚀电位,降低材料表面的腐蚀电流密度、提高腐蚀电位是制备耐腐蚀材料研究的关键。
| Coating | Base material | Method | Ecorr/V | Icorr/(μA·cm-2) | Ref |
| CS-BG | Ti-6Al-4V | Cathodic electrophoretic deposition | 0.22±0.1 | - | [38] |
| HA-1Fe3O4-CS | Ti-13Nb-13Zr | Electrophoretic deposition | ―0.309 | 0.059×10-6 | [39] |
| GO-Ag | Ni-Ti | Electrophoretic deposition | 0.08 | 0.02 | [40] |
| SiO2-ZnO | Ti-6Al-4V | Electrophoretic deposition | 0.003673 | 51 | [41] |
| MAO-GLC | Cp-Ti | Microarc oxidation+magnetic filter cathodic arc composite sputtering | ―0.018 | 2.38×10-3 | [44] |
| Graphene | Ti-6Al-4V | Chemical vapor deposition | ―(0.13±0.12) | 0.16±0.03 | [45] |
| Carbon and polytetrafluoroethylene | Cp-Ti | Hydrothermal and impregnation | 0.19 | 4.5×10-3 | [46] |
| TiO2 | Cp-Ti | Anodization | ―(0.09±0.03) | 0.26×10-3 | [47] |
| Ti-Al-N | Ti-6Al-4V | Magnetron sputtering | 0.023 | 0.25×10-3 | [48] |
医用钛合金材料表面与组织接触后,在分子和细胞水平上完成骨整合、骨生长。钛合金材料材质、表面构型均可对细胞的黏附、分化及生长产生影响。相关研究表明,可在钛合金表面进行功能化改性来促进成骨过程,可添加物质有无机材料、有机材料、药物等。还可通过改变钛合金表面构型促进成骨。
4.1 无机材料 4.1.1 镁镁近年得到了广泛的关注和研究。镁离子可促进植入部位骨再生,并可在体内降解。研究表明镁离子可通过诱导成骨细胞增殖、分化,提高碱性磷酸酶活性及加速矿物质沉积促进骨形成,同时可抑制破骨细胞的分化和活性[49]。Abdal-hay等[50]利用旋涂技术在碱处理后的钛表面上制备镁/聚氨酯涂层(G6)并通过细胞增殖和碱性磷酸酶活性测定实验证实:G6样品与单纯碱处理的样品(G2)和碱处理后涂覆聚氨酯的样品(G4)相比,5天后,G6样品的MC3T3-E1细胞光密度值(1.390±0.006)显著高于G2样品(1.070±0.025)和G4样品(1.190±0.005)。说明G6样品MC3T3-E1细胞显著增加(P<0.05)。经8天和14天后G6样品碱性磷酸酶定量结果分别为(0.400±0.007) U/mg和(0.630±0.006) U/mg,该样品显示出最高的成骨活性(P<0.05)。以上结果证明涂层中释放的镁离子对MC3T3-E1细胞的增殖和分化具有积极促进作用。
4.1.2 锶锶离子可通过激活Wnt/β-catenin和Ras/MAPK信号通路促进间充质干细胞中ERK1/2和p38的磷酸化,上调成骨细胞标记基因(Runx2,BMP-2,OCN,OPN等)表达,并提高碱性磷酸酶活性及细胞外基质矿化,进而促进间充质干细胞的成骨分化。
Zhang等[51]研究了掺入锶元素的仿生介孔涂层(MPs-Sr)的成骨特性,通过高电流阳极氧化法制备二氧化钛介孔结构,并以不同的水热处理时间控制Sr的负载量。在150 ℃下加热20,40,90 min后样品分别标记为MPs-Sr20,MPs-Sr40,MPs-Sr90。实验结果显示,负载Sr的介孔结构可促进MC3T3-E1细胞的附着和扩散。对各样品上MC3T3-E1细胞胶原蛋白分泌量和细胞外基质矿化进行定量分析,以光密度值表示。MPs-40Sr涂层显示出最高的成骨细胞Ⅰ型胶原蛋白分泌水平(7天:0.30±0.02;14天:0.70±0.04)和成骨细胞胞外基质矿化(7天:0.71±0.06;14天:1.22±0.11),表明MPs-Sr40样品促进骨整合作用最强(P<0.05)。因此,推测锶有促进骨愈合及骨生长的可能。
4.1.3 硅硅元素可影响骨基质中胶原蛋白和细胞外基质蛋白的分泌,硅离子可诱导成骨细胞分化并促进成骨细胞分泌Ⅰ型胶原蛋白,并通过激活AMPK/ERK2/3和PI3K/Akt通路促进成骨及血管生成。
Wang等[52]采用阳极氧化法在钛基底上制备二氧化钛纳米管结构,后基于不同的处理时间(2,5,8 min),采用电子束蒸发(EBE)技术在二氧化钛纳米管圆盘上涂覆硅酸盐,制备了EBE-2,EBE-5,EBE-8 3种样品,硅元素质量分数分别为0.81%,4.13%,5.93%。结果显示,7天后,与其他材料相比,MC3T3-E1细胞在EBE-8样品表面具有最高的数量(P<0.05),光密度值为1.80±0.13。EBE-8样品与纯钛相比,成骨相关基因mRNA表达水平更高(P<0.01),以GAPDH标准化后,ALP,Runx2,Col-1,OPN,OCN在14天时表达量分别为:0.75±0.11,0.74±0.06,1.02±0.04,1.20±0.09,1.56±0.15。该结果表明涂覆硅元素的二氧化钛纳米管结构具有刺激MC3T3-E1细胞的成骨分化的能力,其中EBE-8样品成骨活性最佳。
Li等[53]通过电化学沉积方法在钛植入物表面覆盖SiC-HA纳米颗粒。实验结果显示,相比于二氧化钛表面,SiC-HA涂覆的二氧化钛表面可有效促进成骨细胞的黏附。SiC-HA涂层材料使细胞外基质中钙离子的沉积量((16.0±1.5) mg/dL)及骨钙素生成量((61.7±3.1) ng/mL)相比二氧化钛表面((11.0±1.4) mg/dL,(13.9±0.7) ng/mL)显著增加。骨髓间充质干细胞在SiC-HA涂覆的二氧化钛表面接种后,碱性磷酸酶、骨形态发生蛋白和Runx2的mRNA表达水平(4.69±0.20,4.69±0.20,4.09±0.19)比对照组(1.52±0.13,1.30±0.14,1.82±0.13)显著升高。进行鼠类实验后,通过3D断层摄影技术,对21天和54天后相对骨体积/总体积(BV/TV)、骨小梁数(Tb.N)、骨小梁分离度(Tb.Sp)、骨小梁厚度(Tb.Th)进行定量测定,分别为:((36.0±1.8)%,(50.7±2.7%)),((3.18±0.15),(4.07±0.20) mm-1),((193±10),(118±6) μm),((208±12),(287±16) μm),相比于对照组:((13.0±0.8)%,(21.0±1.2)%),((1.49±0.09),(2.58±0.15) mm-1),((416±24),(326±16) μm),((209±11),(130±7) μm)有明显变化。证明SiC-HA涂层材料可有效促进骨整合。
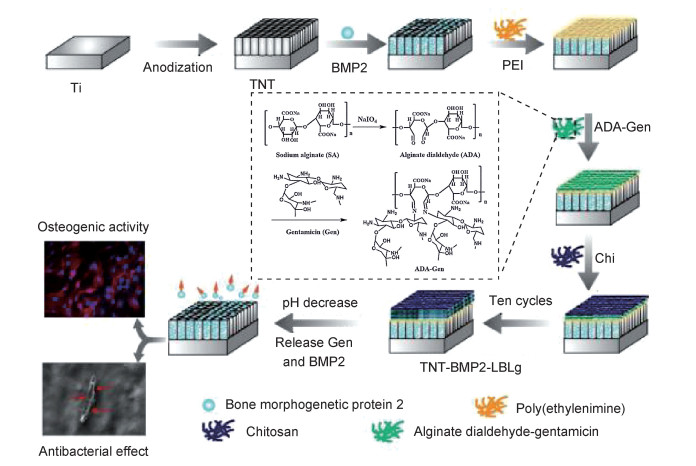
4.2 有机材料骨形态发生蛋白作为重要的骨生长因子,在增强骨整合、诱导骨和软骨形成中具有重要作用。骨形态发生蛋白-2(BMP-2)已被证明可以有效刺激成骨细胞分化,并促进骨愈合。Tao等[54]利用BMP-2的成骨特性,制备了TNT-BMP2-LBLg复合材料。先在二氧化钛纳米管上负载BMP-2,再利用逐层组装技术在表面覆盖海藻酸二醛-硫酸庆大霉素/壳聚糖(ADA-Gen/Chi)多层膜结构,见图 3。实验结果表明,负载了BMP-2和ADA-Gen/Chi多层膜结构的二氧化钛纳米管有利于成骨细胞的铺展,成骨细胞相关基因mRNA表达水平较纯钛更高(P<0.01)。标准化后,TNT-BMP2-LBLg复合材料表面培养成骨细胞,Runx2,ALP,Col-1,OPN,OCN在14天后表达量分别为:2.50±0.13,2.50±0.24,2.30±0.22,2.60±0.10,2.87±0.20。证明了TNT-BMP2-LBLg复合材料对成骨细胞分化有刺激作用。
LL-37是一种人体内具有抗菌能力的肽类,在宿主防御和损伤修复过程中发挥作用。近年来,LL-37促进骨再生的功能受到关注。He等[55]采用微弧氧化和水热处理两步法制备含有羟基磷灰石沉积的钛基底结构,并在钛基底上负载LL-37并包覆多巴胺。研究结果显示,被LL-37修饰的钛基底在体外有利于骨髓间充质干细胞的黏附、迁移及成骨分化。在骨缺损的大鼠模型中,用HE染色法和马松三色染色法对动物骨形成进行观察,并对新骨形成量进行定量分析。4周后,植入了经LL-37修饰的钛基底材料的动物,新骨形成范围为(37.3±3.2)%和(35.2±2.0)%,与羟基磷灰石沉积钛基底材料((26.4±2.0)%和(29.8±2.4)%)相比,有效促进新骨的形成(P<0.05)。
除了对促进骨整合、骨再生的蛋白或肽类进行研究外,探索抑制骨形成蛋白的抗体也是成骨性能研究的可行方向。骨硬化蛋白是一种骨形成的负调控因子,高水平的骨硬化蛋白表达可抑制骨形成,加速骨吸收,导致骨形成和骨吸收的失衡,骨硬化蛋白可通过Wnt信号通路在成骨分化过程中发挥作用。Chen等[56]对骨硬化蛋白抗体进行了研究,研究人员先在钛基底上制备二氧化钛纳米管结构,用多巴胺将硬化蛋白抗体偶联到二氧化钛纳米管表面得到硬化蛋白抗体偶联的二氧化钛纳米管结构(TNTs-scl),后在其表面进行鼠类骨样细胞(MLO-Y4)培养。结果显示,TNTs-scl与MLO-Y4细胞有良好的生物相容性,同时可减少MLO-Y4细胞硬化蛋白的分泌量。硬化蛋白在Wnt信号传导中起负性调节作用,硬化蛋白抗体使硬化蛋白分泌量降低,极大刺激了Wnt信号传导,从而促进骨相关蛋白的表达及成骨细胞分化,进而促进骨形成和骨修复。
4.3 药物去铁胺(DFO)在临床上常用于急性铁中毒和慢性铁蓄积引起的疾病,有证据表明[57-58]DFO通过激活缺氧诱导因子-1α(HIF-1α)信号通路促进成骨分化和血管生成反应。Ran等[59]研究了二氧化钛纳米管上负载DFO,然后通过逐层组装(LBL)技术沉积壳聚糖(CHI)和明胶(Gel)后,得到装载药物的TNT-DFO-LBL多层结构。实验结果表明,TNT-DFO-LBL多层结构可有效提高间充质干细胞的黏附、增殖以及成骨分化、血管分化,同时调节了人脐静脉内皮细胞生长。与Ti和TNT两组相比较,TNT-DFO组和TNT-DFO-LBL组HIF-1α有更高的蛋白质表达水平(P<0.05)。TNT-DFO-LBL组较其他组成骨相关基因及血管生成相关基因的表达水平也有提高(P<0.05)。证明了DFO通过激活HIF-1α信号通路上调血管生成因子的表达,促进成骨分化相关基因的表达,进而促进间充质干细胞的成骨分化和血管生成。
阿仑膦酸盐(Aln)和雷洛昔芬(Ral)是治疗骨质疏松药物。Mu等[60]将雷洛昔芬储存于二氧化钛纳米管中,通过旋涂逐层组装技术在二氧化钛纳米管表面覆盖阿仑膦酸盐接枝透明质酸多层膜结构,制备了TNT/Ral/LBL-Aln药物输送系统。实验结果显示TNT/Ral/LBL-Aln系统能显著提高成骨细胞的增殖分化,同时有效抑制破骨细胞的成熟和分化。在骨质疏松兔模型中,Micro-CT和组织学分析显示出TNT/Ral/LBL-Aln植入物比纯钛和二氧化钛纳米管有更好的成骨性能(P<0.01)。TNT/Ral/LBL-Aln植入物材料BV/TV和Tb.TH定量分析结果为:(26.3±2.2)%,(0.148±0.007) mm。
4.4 构型促进成骨通过对钛合金进行的微米级和纳米级表面改性,可以促进植入物周围的成骨过程。有证据表明对钛金属表面进行纳米尺度修饰,可以增加蛋白质的吸附并刺激成骨细胞迁移,从而加快骨整合速度[61-62]。Shin等[63]在纯钛表面制备了高为120 nm凹坑中孔径为10 nm孔的纳米图案(ENF),见图 4。在该材料表面进行人骨髓间充质干细胞培养后发现,与对照组相比,ENF表面可促进人骨髓间充质干细胞成骨分化(P<0.05)。14天后,通过光密度法对ALP和OCN表达量进行定量测定,实验组相比对照组增加率为:(784±15)%,(1358±366)%,证实ENF表面人骨髓间充质干细胞中ALP和OCN的表达水平显著提高(P < 0.05),ENF表面可有效促进骨髓间充质干细胞成骨分化。
为研究经过表面改性的各样品成骨性能,Huang等[64]使用水热法分别在浓度为1,5,10 mol/L NaOH溶液中制备了纳米结构表面,并命名为Ti-1,Ti-5和Ti-10,Ti组作为对照组,表面平整,Ti-1表现出纳米线形态,Ti-5和Ti-10表现出纳米花瓣状结构,见图 5。实验结果显示,样品Ti-5最有利于MG63细胞的成骨分化。与纯钛相比,Ti-5显示高水平碱性磷酸酯酶活性(P<0.01)和成骨基因(ALP,Runx-2,OPG)表达上调(P<0.05)。在1天、3天、7天ALP,Runx-2,OPG的表达量分别为2.18±0.17,2.84±0.26,1.53±0.18;2.19±0.10,1.50±0.13,1.44±0.12;1.86±0.10,1.65±0.06,1.55±0.14。在兔股骨髁缺损模型中,12周后,Ti-5组骨再生水平(BV/TV:(18.0±0.8)%,Tb.Th:(0.155±0.006) mm)相比对照组显著升高(P<0.01)。
Li等[65]则评估了人骨髓间充质干细胞在不同直径纳米管表面上的成骨分化能力,研究人员通过电化学阳极氧化方法在Ti-6Al-4V ELI合金表面上制备高度有序的纳米管结构。在20 V和40 V阳极氧化后,所制备纳米管直径约为39 nm和83 nm。通过观察人骨髓间充质干细胞在材料表面形态及黏附力、定量检测成骨分化相关蛋白(骨钙蛋白、骨桥蛋白)和矿化标记物表达情况。21天后,直径为39 nm的纳米管骨钙蛋白、骨桥蛋白、二甲酚橙荧光强度定量值为19670±2330,13809±1446,13919±3154,表明其对人骨髓间充质干细胞促进成骨分化能力最强。
从以上研究成果中可以看出,医用钛合金材料促进骨整合、骨生长的最新研究进展中,主要通过在钛或钛合金表面制备功能涂层,而鲜有研究通过加入合金元素制备新型钛合金材料,可能原因:(1)利用具有潜在成骨性能的合金元素进行新型钛合金研发,由于元素互不熔混,如Ti和Mg元素[66]不能形成固溶体,导致性能不稳定,无法作为植入物材料得到应用;(2)添加具有潜在成骨性能的元素可能改变钛及钛合金材料原有力学性能指标,如加入Si元素的Ti-Si合金[67]弹性模量大幅升高,达到306.9 GPa,不再适宜作为植入物材料;(3)材料表面制备具有成骨性能涂层,可研究范围广,不局限于利用无机元素,可加入更多的成骨物质,如有机物质、药物等;(4)材料表面制备涂层结构,方便控制促成骨物质的储存和释放速率,能更有效促进骨整合和骨生长。除此之外,具有潜在成骨性能纳米结构表面,也为该方向的研究提供了新的思路。
5 抗菌性能研究植入物相关感染是植入失败的主要原因之一,制备有抗菌性能的钛合金材料,以减少细菌黏附及发挥有效杀菌性能是研究的关键。预防感染有多种策略,添加抗菌金属元素、抗生素、抗菌肽等对钛合金进行表面修饰,以及钛合金表面制备抗菌复合涂层、抗菌结构均可达到不同程度的抗菌效果。
5.1 金属元素此类抗菌剂为金属及其化合物,主要为Ag, Cu, Zn元素,它们的抗菌性能依次减弱,不同元素的抗菌机制,见表 4[68-73]。其中银作为抗菌剂已得到广泛研究。
| Metal | Antibacterial mechanism | Ref |
| Ag | Silver ions can destroy the structure of bacterial membranes, release silver ions and generate ROS to destroy enzymes in the oxidation respiratory chain, and regulate the signal transduction pathway of bacteria | [68-69] |
| Cu | Copper ions can catalyze the formation of ROS and destroy the permeability of bacterial membranes, resulting in the leakage of reducing sugars and proteins from cells | [70-71] |
| Zn | Zinc ions can destroy bacterial membranes and promote the formation of ROS | [72-73] |
Sarraf等[74]通过物理气相沉积法和两步阳极氧化在Ti-6Al-4V合金上制备负载氧化银纳米颗粒的Ta2O5纳米管结构,赋予其抗菌性能,并在其表面进行大肠杆菌培养。结果显示,负载氧化银纳米颗粒的Ta2O5纳米管结构在2 h内即可完全杀死大肠杆菌,并且在细菌培养24 h后,仍无细菌生长。证明所制备材料具有良好抗菌性能。在该材料表面进行人成骨细胞培养1天、3天和7天后进行阿尔玛蓝测定。结果显示,负载氧化银纳米颗粒的Ta2O5纳米管和Ta2O5纳米管吸光度值分别为:(22.9±3.1)%,(42.0±3.8)%,(82.0±5.6)%和(20.0±2.5)%,(38.1±3.3)%,(75.0±4.2)%。提示负载氧化银纳米颗粒的Ta2O5纳米管和Ta2O5纳米管吸光度值无统计学意义,证明氧化银纳米颗粒对细胞活性无显著影响。Yuan等[75]在钛基底上制备载银纳米颗粒的二氧化钛纳米管阵列(TNT-Ag),再采用逐层自组装技术在二氧化钛纳米管上沉积壳聚糖和海藻酸双醛生物活性多层膜结构(TNT-Ag-LBL),用以控制银离子的释放。细菌培养6 h后,用细菌计数法测定了TNT-Ag,TNT-Ag-LBL对黏附细菌的抗菌率,两种材料对金黄色葡萄球菌和大肠杆菌的抗菌率分别为98%,93%和96%,87%,抗菌能力较TNT显著提高。分别在TNT和TNT-Ag-LBL表面培养成骨细胞4天和7天,通过CCK-8实验定量评估了成骨细胞的生存力。结果显示,两种材料表面光密度值分别为0.66±0.07,1.27±0.13和0.73±0.12,1.13±0.09,两者之间没有统计学意义。说明TNT-Ag-LBL释放的银离子对成骨细胞生长没有不良影响,具有良好的生物相容性。
除利用Ag制备抗菌涂层外,通过优化工艺,制备具备长效抗菌效果的Ti-Ag合金是研究的主要方向。Lei等[76]采用放电等离子烧结技术制备了不同Ag含量的Ti-Ag烧结合金,Ag含量为0%,1%,3%和5%的合金材料分别称为s-Ti,Ti-1Ag,Ti-3Ag和Ti-5Ag,后用氢氟酸和硝酸酸刻蚀合金材料得到s-Ti(AE),Ti-1Ag(AE),Ti-3Ag(AE)和Ti-5Ag(AE)。在材料表面进行金黄色葡萄球菌培养,利用平板计数法评价抗菌效果。结果显示,1天后,Ti-3Ag(AE)和Ti-5Ag(AE)合金材料抗菌率达到97.13%和99.10%,酸刻蚀处理后的样品较处理前抗菌能力明显增强(P<0.01),并且在30天后,Ti-3Ag(AE)和Ti-5Ag(AE)样品的抑菌率仍能保持在较高水平,分别为96.53%和99.04%。由于酸蚀刻处理导致在合金材料表面上形成多孔和颗粒结构,根据X射线能谱分析结果,通过酸蚀刻产生的颗粒包含高浓度的Ag,可能是使它们具有长期有效的抗菌活性的原因。不同材料表面进行MC3T3-E1细胞培养,进行细胞活力及细胞毒性评估,结果显示:3天和7天后,各Ti-Ag(AE)材料表面的细胞活力与纯钛表面无统计学意义(P>0.05),证明该合金材料无细胞毒性。
5.1.2 铜Huang等[77]通过在钛基底上用微弧氧化(MAO)技术制备含铜陶瓷涂层,制备过程中添加CuSO4·5H2O,用0,0.2,2 mmol/L CuSO4·5H2O处理的样品分别称为MAO,Cu(L)-MAO和Cu(H)-MAO。实验结果显示,与Cu(L)-MAO相比Cu(H)-MAO表面可进一步极化巨噬细胞为M1表型[78],这可能是由Cu(H)-MAO表面释放了较高浓度铜离子所致。与MAO和Cu(L)-MAO两组相比,在Cu(H)-MAO表面培养的巨噬细胞对细菌的摄取和杀灭率((86.5±4.8)%)均有提高(P<0.01)。在Cu(H)-MAO/巨噬细胞条件培养基上培养的成骨样细胞胶原蛋白合成量(0.186±0.07)和细胞外基质矿化量(1.419±0.018)较MAO样品组有显著的升高(P<0.01),表明Cu(H)-MAO表面可有效提高巨噬细胞的杀菌能力,无细胞毒性且具有成骨作用。Huang等[79]同样采用微弧氧化的方法,在钛基底上制备含铜的微/纳米形生物陶瓷(Cu-Hier-Ti)表面结构。结果表明,通过钙黄绿素-AM染色法和CCK-8法评估材料表面巨噬细胞活力和增殖,与钛表面相比,巨噬细胞在Cu-Hier-Ti表面第1天的活力和增殖稍有增强(P<0.05)。在Cu-Hier-Ti表面生长的巨噬细胞其杀菌作用比钛表面的巨噬细胞杀菌作用更强(P<0.01),杀菌率达到了(72.0±5.3)%。上述结果提示将铜掺入生物材料可以赋予材料炎症调节特性,通过激活巨噬细胞,增强成骨作用和杀菌性能。
Wang等[80]通过电弧熔炼技术制备了含3%,5%和7%Cu的二元Ti-Cu合金,并设计不同的退火工艺,分别在740,830 ℃和910 ℃下退火。在各材料表面进行金黄色葡萄球菌培养,24 h后,采用平板计数法进行细菌菌落计数。结果显示,以纯钛作为对照组,740 ℃下退火的Ti-3Cu,Ti-5Cu和Ti-7Cu合金均显示出较好的抗菌效果,抗菌率达到95%以上。其他Ti-Cu样品的抗菌率也可达到90%以上,表明Ti-Cu合金中Cu元素的添加可以有效起到杀菌作用,并可通过制备工艺对抗菌效果进行调节。
5.1.3 锌Deng等[81]在乙基纤维素辅助下通过溶胶凝胶和碱热处理组合技术构建了掺锌的纳米网状结构,将添加不同浓度(0,0.1,0.3 mol/L和0.4 mol/L)的ZnCl2所制备的样品表示为Ti-Zn0, Ti-Zn0.1, Ti-Zn0.3和Ti-Zn0.4。使用分光光度计测量不同样本上4天和7天后成骨细胞的细胞活力。结果发现Ti-Zn0.3相比其他样品和纯钛具有更高的细胞活力(P<0.01),测量值分别为0.87±0.09,1.20±0.10。将不同样品在PBS溶液中浸泡不同的时间(0,1,4天和7天),金黄色葡萄球菌和大肠杆菌培养结果显示,与Ti,Ti-Zn0,Ti-Zn0.1相比,Ti-Zn0.3和Ti-Zn0.4具有更强的抗菌潜能。相比其他三组样品,Ti-Zn0.3和Ti-Zn0.4可分别保持4天(P<0.01)和7天(P<0.01)的抗菌性能,分光光度计下金黄色葡萄球菌和大肠杆菌测量值分别为:Ti-Zn0.3(4天:0.85±0.06,0.86±0.04),Ti-Zn0.4(7天:0.79±0.08,0.85±0.05)。
5.2 抗生素抗生素在处理细菌引起的感染中发挥重要作用,制备表面含有抗生素的钛合金材料,在预防以及治疗植入物相关感染具有独特优势。根据常见致病细菌种类,选用细菌敏感的抗生素可达到良好的抗菌效果,常选用的抗生素包括:万古霉素、庆大霉素、头孢他啶等。
Fathi等[82]通过电化学阳极氧化法在钛基底上制备二氧化钛纳米管结构,直径为110~120 nm,长度为40 μm,在二氧化钛纳米管结构中加入万古霉素,再将丝素蛋白纳米纤维覆盖在二氧化钛纳米管的表面,用以控制万古霉素的释放。研究表明,含有万古霉素的纳米管可有效减少金黄色葡萄球菌的细菌黏附,通过调节丝素蛋白纳米纤维的尺寸(样品A:(345.584±98.174) nm,样品B:(283.641±64.279) nm,样品C:(176.362±34.216) nm)调节万古霉素释放时间。样品C在24 h后对金黄色葡萄球菌的抑菌圈直径为11±2 nm。样品C可以使万古霉素6 h爆发释放量由81%下降到29%,释放天数可至30天以上,可达到更好的持续抗菌效果。David等[83]制备了明胶-锶复合羟基磷灰石(HG)支架,将负载0.5%和1%万古霉素的壳聚糖-明胶聚电解质复合物与明胶-锶复合羟基磷灰石支架结合称为HV1和HV2,通过多巴胺处理将支架锚定在钛金属表面上。实验结果显示,HV1支架对耐甲氧西林金黄色葡萄球菌菌株的细菌生长能力有明显的抑制作用,抑制率达到85.47%。而HV2支架对耐甲氧西林金黄色葡萄球菌和甲氧西林敏感金黄色葡萄球菌菌株的抑制率分别为99.45%和98.22%。说明HV2支架对耐甲氧西林金黄色葡萄球菌和甲氧西林敏感金黄色葡萄球菌均具有良好的抗菌效果。另通过测定不同支架上大鼠脂肪间充质干细胞的活力发现,HV2支架的细胞活力((126.12±50.9)%)明显高于HV1((116.36±1.06)%),HG((97.59±14.86)%)和纯钛((95.59±3.12)%)样品,说明万古霉素对细胞无毒性作用。
Liu等[84]在钛衬底上用阳极氧化方法制备了二氧化钛纳米管阵列,用以负载庆大霉素,后采用逐层自组装技术将壳聚糖/海藻酸钠多层膜覆盖在二氧化钛纳米管阵列上。实验结果显示,通过CCK-8法测定纯钛、二氧化钛纳米管和装载了庆大霉素并用生物活性膜密封的二氧化钛纳米管的细菌生存力和细胞活力。结果显示,与纯钛、二氧化钛纳米管相比,金黄色葡萄球菌和大肠杆菌的细菌活力在与装载庆大霉素的多层膜二氧化钛纳米管表面接触后明显降低(P < 0.01),光密度值为0.248±0.062,0.319±0.044。另外,通过LIVE /DEAD染色测定和CLSM图像证实实验所制备的复合材料具有抗菌活性。3种材料表面分别培养成骨细胞,4天后,二氧化钛纳米管和装载庆大霉素的多层膜二氧化钛纳米管表面的成骨细胞活力比纯钛表面更高(P<0.05),光密度值分别为:0.660±0.071,0.638±0.061,0.540±0.057。7天后三组之间成骨细胞活力没有统计学差异。
Lee等[85]将聚乙烯亚胺(PEI)引入到聚多巴胺(PDA)修饰的钛基底上,得到富含胺的材料表面,然后表面用头孢他啶(CFT)进行修饰,得到Ti-PDA-PEI-CFT结构。结果显示,体外细菌培养24 h后,Ti-PDA-PEI-CFT材料表面铜绿假单胞菌和金黄色葡萄球菌细菌存活数量分别为18,(174±10) mm-2,相比于纯钛表面细菌存活明显减少(P<0.001)。Ti-PDA-PEI-CFT材料表面进行脂肪源干细胞培养1天、3天和7天后,细胞存活率((107.6±1.1)%,(172.9±2.8)%,(294.0±15.6)%)相比于纯钛表面的细胞存活率((100±3.2)%,(136.7±1.1)%,(254±15.7)%)有显著的提高(P<0.001),说明该材料无细胞毒性。
5.3 仿生结构近几年来,利用纳米结构给予细菌足够的机械作用力以导致其死亡并阻止生物膜形成受到广泛关注,这种纳米结构是受到蝉翼、蜻蜓翼等昆虫翅膀上发现的纳米表面结构可有效杀死各种细菌的启发[86-87],许多研究尝试使用不同的方法和材料来制备这种仿生材料。
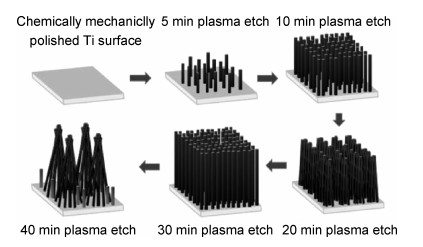
Sjöström等[88]用热氧化方法在Ti-6Al-4V合金表面制备直径约20 nm的纳米钉结构。与对照组相比,LIVE/DEAD染色结果显示纳米钉表面上更多的大肠杆菌死亡,纳米钉表面细菌悬浮液培养发现细菌生存能力降低了40%,证明纳米钉表面结构由于其尖锐的尖端或边缘,对大肠杆菌有杀菌作用,从而减少细菌定殖。Linklater等[89]在钛基底上通过离子蚀刻方法制备了微柱状阵列,经过不同的刻蚀时间处理,基底表面呈现出不同的结构,见图 6。经过30 min蚀刻的钛基底表面对铜绿假单胞菌具有最高抗菌效率,为(87.0±2.0)%,经过40 min刻蚀的钛基底表面具有对金黄色葡萄球菌最高抗菌效率,为(72.5±13.0)%。实验结果提示,经过40 min蚀刻的材料对革兰氏阳性菌和革兰氏阴性菌均有良好杀菌效果。
医用钛及钛合金由于其良好的性能作为骨科植入物材料发挥着重要的作用,但因具有较高弹性模量,以及在生物体内耐腐蚀、耐磨性较弱,作为植入物材料存在一定局限性。优化或改善钛及钛合金相关生物学性能,解决材料存在的问题,探索方向主要集中在以下4个方面:
(1) 开发新型β钛合金,合理添加合金元素、优化合金元素组成,改善合金材料力学性能,降低其弹性模量,增强硬度和强度等指标。
(2) 加强表面改性方向研究,提高医用钛合金材料生物活性,增强耐腐蚀性、耐磨性以适应体内复杂环境。
(3) 制备具有复合性能的医用植入物材料,使其在临床中具有更加优秀的综合应用价值。
(4) 开发低成本β钛合金植入物材料,使普通人群能够承受相关费用以得到广泛应用。
| [1] |
PARK J B, BRONZINO J D. Biomaterials: principles and applications[M]. New York: Chemical Rubber Company Press, 2002.
|
| [2] |
KARGOZAR S, RAMAKRISHNA S, MOZAFARI M. Chemistry of biomaterials: future prospects[J]. Current Opinion in Biomedical Engineering, 2019, 10: 181-190. DOI:10.1016/j.cobme.2019.07.003 |
| [3] |
FROST H M. A 2003 update of bone physiology and Wolff's Law for clinicians[J]. The Angle Orthodontist, 2004, 74(1): 3-15. |
| [4] |
COSTA B C, TOKUHARA C K, ROCHA L A, et al. Vanadium ionic species from degradation of Ti-6Al-4V metallic implants: in vitro cytotoxicity and speciation evaluation[J]. Materials Science and Engineering: C, 2019, 96: 730-739. DOI:10.1016/j.msec.2018.11.090 |
| [5] |
刘理, 刘军. 钒: 一种具有非典型生物学意义的元素[J]. 国外医学(医学地理分册), 2006(3): 114-116. LIU L, LIU J. Vanadium: an element with atypical biological significance[J]. Foreign Medical Sciences (Section of Medgeography), 2006(3): 114-116. DOI:10.3969/j.issn.1001-8883.2006.03.007 |
| [6] |
ZHANG Y, GUO T, LI Z. The researches on titanium and titanium alloy in dental use[J]. Journal of Biomedical Engineering, 2000, 17(2): 206-208. |
| [7] |
樊晓霞, 任浩浩, 陈抒天, 等. 不同来源天然骨磷灰石的材料学性能比较研究[J]. 生物医学工程学杂志, 2014, 31(2): 352-356. FAN X X, REN H H, CHEN S T, et al. Comparative studies on the material performances of natural bone-like apatite from different bone sources[J]. Journal of Biomedical Engineering, 2014, 31(2): 352-356. |
| [8] |
PÉREZ D A G, JORGE Jr A M, ROCHE V, et al. Severe plastic deformation and different surface treatments on the biocompatible Ti13Nb13Zr and Ti35Nb7Zr5Ta alloys: microstructural and phase evolutions, mechanical properties, and bioactivity analysis[J]. Journal of Alloys and Compounds, 2020, 812: 152116. DOI:10.1016/j.jallcom.2019.152116 |
| [9] |
BIESIEKIERSKI A, LIN J, LI Y, et al. Impact of ruthenium on mechanical properties, biological response and thermal processing of β-type Ti-Nb-Ru alloys[J]. Acta Biomaterialia, 2017, 48: 461-467. DOI:10.1016/j.actbio.2016.09.012 |
| [10] |
LI X, YE S, YUAN X, et al. Fabrication of biomedical Ti-24Nb-4Zr-8Sn alloy with high strength and low elastic modulus by powder metallurgy[J]. Journal of Alloys and Compounds, 2019, 772: 968-977. DOI:10.1016/j.jallcom.2018.08.262 |
| [11] |
KARRE R, KODLI B K, RAJENDRAN A, et al. Comparative study on Ti-Nb binary alloys fabricated through spark plasma sintering and conventional P/M routes for biomedical application[J]. Materials Science and Engineering: C, 2019, 94: 619-627. DOI:10.1016/j.msec.2018.10.006 |
| [12] |
JAWED S F, RABADIA C D, LIU Y J, et al. Mechanical characterization and deformation behavior of β-stabilized Ti-Nb-Sn-Cr alloys[J]. Journal of Alloys and Compounds, 2019, 792: 684-693. DOI:10.1016/j.jallcom.2019.04.079 |
| [13] |
VIEIRA N A R, BORBOREMA S, ARAÚJO L S, et al. Influence of thermo-mechanical processing on structure and mechanical properties of a new metastable β Ti-29Nb-2Mo-6Zr alloy with low Young's modulus[J]. Journal of Alloys and Compounds, 2020, 820: 153078. DOI:10.1016/j.jallcom.2019.153078 |
| [14] |
OZAN S, LI Y, LIN J, et al. Microstructural evolution and its influence on the mechanical properties of a thermomechanically processed β Ti-32Zr-30Nb alloy[J]. Materials Science and Engineering: A, 2018, 719: 112-123. DOI:10.1016/j.msea.2018.02.034 |
| [15] |
BAHL S, KRISHNAMURTHY A S, SUWAS S, et al. Controlled nanoscale precipitation to enhance the mechanical and biological performances of a metastable β Ti-Nb-Sn alloy for orthopedic applications[J]. Materials & Design, 2017, 126: 226-237. |
| [16] |
CHEN J, MA F, LIU P, et al. Effects of different processing conditions on super-elasticity and low modulus properties of metastable β-type Ti-35Nb-2Ta-3Zr alloy[J]. Vacuum, 2017, 146: 164-169. DOI:10.1016/j.vacuum.2017.09.047 |
| [17] |
ZHANG T, FAN Q, MA X, et al. Effect of laser remelting on microstructural evolution and mechanical properties of Ti-35Nb-2Ta-3Zr alloy[J]. Materials Letters, 2019, 253: 310-313. DOI:10.1016/j.matlet.2019.06.105 |
| [18] |
KANG N, LIN X, MANSORI M E, et al. On the effect of the thermal cycle during the directed energy deposition application to the in-situ production of a Ti-Mo alloy functionally graded structure[J]. Additive Manufacturing, 2020, 31: 100911. DOI:10.1016/j.addma.2019.100911 |
| [19] |
CORREA D R N, KURODA P A B, LOURENÇO M L, et al. Microstructure and selected mechanical properties of aged Ti-15Zr-based alloys for biomedical applications[J]. Materials Science and Engineering: C, 2018, 91: 762-771. DOI:10.1016/j.msec.2018.06.017 |
| [20] |
KURODA P A B, LOURENÇO M L, CORREA D R N, et al. Thermomechanical treatments influence on the phase composition, microstructure, and selected mechanical properties of Ti-20Zr-Mo alloys system for biomedical applications[J]. Journal of Alloys and Compounds, 2020, 812: 152108. DOI:10.1016/j.jallcom.2019.152108 |
| [21] |
EHTEMAM-HAGHIGHI S, CAO G, ZHANG L. Nanoindentation study of mechanical properties of Ti based alloys with Fe and Ta additions[J]. Journal of Alloys and Compounds, 2017, 692: 892-897. DOI:10.1016/j.jallcom.2016.09.123 |
| [22] |
EISENBARTH E, VELTEN D, MÜLLER M, et al. Biocompatibility of β-stabilizing elements of titanium alloys[J]. Biomaterials, 2004, 25(26): 5705-5713. DOI:10.1016/j.biomaterials.2004.01.021 |
| [23] |
刘辉, 杨冠军, 于振涛, 等. 生物医用多孔钛合金材料的制备[J]. 钛工业进展, 2010, 27(1): 9-15. LIU H, YANG G J, YU Z T, et al. Preparation of porous titanium alloy materials for biomedical application[J]. Titanium Industry Progress, 2010, 27(1): 9-15. DOI:10.3969/j.issn.1009-9964.2010.01.002 |
| [24] |
NI J, LING H, ZHANG S, et al. Three-dimensional printing of metals for biomedical applications[J]. Materials Today Bio, 2019, 3: 100024. DOI:10.1016/j.mtbio.2019.100024 |
| [25] |
TAO S C, XU J L, YUAN L, et al. Microstructure, mechanical properties and antibacterial properties of the microwave sintered porous Ti-3Cu alloys[J]. Journal of Alloys and Compounds, 2020, 812: 152142. DOI:10.1016/j.jallcom.2019.152142 |
| [26] |
ZHANG L, TAN J, MENG Z D, et al. Low elastic modulus Ti-Ag/Ti radial gradient porous composite with high strength and large plasticity prepared by spark plasma sintering[J]. Materials Science and Engineering: A, 2017, 688: 330-337. DOI:10.1016/j.msea.2017.02.025 |
| [27] |
ZHANG L, HE Z Y, TAN J, et al. Designing a multifunctional Ti-2Cu-4Ca porous biomaterial with favorable mechanical properties and high bioactivity[J]. Journal of Alloys and Compounds, 2017, 727: 338-345. DOI:10.1016/j.jallcom.2017.08.145 |
| [28] |
XU W, TIAN J, LIU Z, et al. Novel porous Ti35Zr28Nb scaffolds fabricated by powder metallurgy with excellent osteointegration ability for bone-tissue engineering applications[J]. Materials Science and Engineering: C, 2019, 105: 110015. DOI:10.1016/j.msec.2019.110015 |
| [29] |
MEENASHISUNDARAM G K, WANG N, MASKOMANI S, et al. Fabrication of Ti +Mg composites by three-dimensional printing of porous Ti and subsequent pressureless infiltration of biodegradable Mg[J]. Materials Science and Engineering: C, 2020, 108: 110478. DOI:10.1016/j.msec.2019.110478 |
| [30] |
KELLY C N, EVANS N T, IRVIN C W, et al. The effect of surface topography and porosity on the tensile fatigue of 3D printed Ti-6Al-4V fabricated by selective laser melting[J]. Materials Science and Engineering: C, 2019, 98: 726-736. DOI:10.1016/j.msec.2019.01.024 |
| [31] |
WANG H, SU K, SU L, et al. Comparison of 3D-printed porous tantalum and titanium scaffolds on osteointegration and osteogenesis[J]. Materials Science and Engineering: C, 2019, 104: 109908. DOI:10.1016/j.msec.2019.109908 |
| [32] |
BARUI S, PANDA A K, NASKAR S, et al. 3D inkjet printing of biomaterials with strength reliability and cytocompatibility: quantitative process strategy for Ti-6Al-4V[J]. Biomaterials, 2019, 213: 119212. DOI:10.1016/j.biomaterials.2019.05.023 |
| [33] |
GUO Y, TAN Y, LIU Y, et al. Low modulus and bioactive Ti/α-TCP/Ti-mesh composite prepared by spark plasma sintering[J]. Materials Science and Engineering: C, 2017, 80: 197-206. DOI:10.1016/j.msec.2017.05.014 |
| [34] |
GUO Y, CHEN D, LU W, et al. Corrosion resistance and in vitro response of a novel Ti35Nb2Ta3Zr alloy with a low Young's modulus[J]. Biomed Mater, 2013, 8(5): 55004. DOI:10.1088/1748-6041/8/5/055004 |
| [35] |
SHI L, SHI L, WANG L, et al. The improved biological performance of a novel low elastic modulus implant[J]. PLoS One, 2013, 8(2): 55015. DOI:10.1371/journal.pone.0055015 |
| [36] |
NUNE K C, MISRA R D K, LI S J, et al. Osteoblast cellular activity on low elastic modulus Ti-24Nb-4Zr-8Sn alloy[J]. Dental Materials, 2017, 33(2): 152-165. DOI:10.1016/j.dental.2016.11.005 |
| [37] |
ZHAN X, LI S, CUI Y, et al. Comparison of the osteoblastic activity of low elastic modulus Ti-24Nb-4Zr-8Sn alloy and pure titanium modified by physical and chemical methods[J]. Materials Science and Engineering: C, 2020, 113: 111018. DOI:10.1016/j.msec.2020.111018 |
| [38] |
MAHLOOJI E, ATAPOUR M, LABBAF S. Electrophoretic deposition of bioactive glass-chitosan nanocomposite coatings on Ti-6Al-4V for orthopedic applications[J]. Carbohydrate Polymers, 2019, 226: 115299. DOI:10.1016/j.carbpol.2019.115299 |
| [39] |
SINGH S, SINGH G, BALA N. Electrophoretic deposition of hydroxyapatite-iron oxide-chitosan composite coatings on Ti-13Nb-13Zr alloy for biomedical applications[J]. Thin Solid Films, 2020, 697: 137801. DOI:10.1016/j.tsf.2020.137801 |
| [40] |
SRIMANEEPONG V, ROKAYA D, THUNYAKITPISAL P, et al. Corrosion resistance of graphene oxide/silver coatings on Ni-Ti alloy and expression of IL-6 and IL-8 in human oral fibroblasts[J]. Sci Rep, 2020, 10(1): 3247. DOI:10.1038/s41598-020-60070-x |
| [41] |
CHELLAPPA M, VIJAYALAKSHMI U. Electrophoretic deposition of silica and its composite coatings on Ti-6Al-4V, and its in vitro corrosion behaviour for biomedical applications[J]. Materials Science and Engineering: C, 2017, 71: 879-890. DOI:10.1016/j.msec.2016.10.075 |
| [42] |
HE D, ZHENG S, PU J, et al. Improving tribological properties of titanium alloys by combining laser surface texturing and diamond-like carbon film[J]. Tribology International, 2015, 82: 20-27. DOI:10.1016/j.triboint.2014.09.017 |
| [43] |
ALEXEEV A M, ISMAGILOV R R, OBRAZTSOV A N. Structural and morphological peculiarities of needle-like diamond crystallites obtained by chemical vapor deposition[J]. Diamond and Related Materials, 2018, 87: 261-266. DOI:10.1016/j.diamond.2018.06.017 |
| [44] |
YANG W, GAO Y, GUO P, et al. Adhesion, biological corrosion resistance and biotribological properties of carbon films deposited on MAO coated Ti substrates[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2020, 101: 103448. DOI:10.1016/j.jmbbm.2019.103448 |
| [45] |
MALHOTRA R, HAN Y M, MORIN J, et al. Inhibiting corrosion of biomedical-grade Ti-6Al-4V alloys with graphene nanocoating[J]. J Dent Res, 2020, 99(3): 285-292. DOI:10.1177/0022034519897003 |
| [46] |
GAO M, WU X, GAO P, et al. Properties of hydrophobic carbon-PTFE composite coating with high corrosion resistance by facile preparation on pure Ti[J]. Transactions of Nonferrous Metals Society of China, 2019, 29(11): 2321-2330. DOI:10.1016/S1003-6326(19)65138-1 |
| [47] |
KRISHNA N G, GEORGE R P, PHILIP J. Anomalous enhancement of corrosion resistance and antibacterial property of commercially pure titanium (CP-Ti) with nanoscale rutile titania film[J]. Corrosion Science, 2020, 172: 108678. DOI:10.1016/j.corsci.2020.108678 |
| [48] |
BONU V, JEEVITHA M, PRAVEEN KUMAR V, et al. Solid particle erosion and corrosion resistance performance of nanolayered multilayered Ti/TiN and TiAl/TiAlN coatings deposited on Ti6Al4V substrates[J]. Surface and Coatings Technology, 2020, 387: 125531. DOI:10.1016/j.surfcoat.2020.125531 |
| [49] |
KIM H K, HAN H S, LEE K S, et al. Comprehensive study on the roles of released ions from biodegradable Mg-5wt% Ca-1wt% Zn alloy in bone regeneration[J]. Journal of Tissue Engineering and Regenerative Medicine, 2017, 11(10): 2710-2724. DOI:10.1002/term.2166 |
| [50] |
ABDAL-HAY A, AGOUR M, KIM Y, et al. Magnesium-particle/polyurethane composite layer coating on titanium surfaces for orthopedic applications[J]. European Polymer Journal, 2019, 112: 555-568. DOI:10.1016/j.eurpolymj.2018.10.012 |
| [51] |
ZHANG M, HUANG X, HANG R, et al. Effect of a biomimetic titania mesoporous coating doped with Sr on the osteogenic activity[J]. Materials Science and Engineering: C, 2018, 91: 153-162. DOI:10.1016/j.msec.2018.05.036 |
| [52] |
WANG T, QIAN S, ZHA G, et al. Synergistic effects of titania nanotubes and silicon to enhance the osteogenic activity[J]. Colloids and Surfaces B, 2018, 171: 419-426. DOI:10.1016/j.colsurfb.2018.07.052 |
| [53] |
LI T, LI X, HU S, et al. Enhanced osteoporotic effect of silicon carbide nanoparticles combine with nano-hydroxyapatite coated anodized titanium implant on healthy bone regeneration in femoral fracture[J]. Journal of Photochemistry and Photobiology B, 2019, 197: 111515. DOI:10.1016/j.jphotobiol.2019.111515 |
| [54] |
TAO B, DENG Y, SONG L, et al. BMP2-loaded titania nanotubes coating with pH-responsive multilayers for bacterial infections inhibition and osteogenic activity improvement[J]. Colloids and Surfaces B, 2019, 177: 242-252. DOI:10.1016/j.colsurfb.2019.02.014 |
| [55] |
HE Y, MU C, SHEN X, et al. Peptide LL-37 coating on micro-structured titanium implants to facilitate bone formation in vivo via mesenchymal stem cell recruitment[J]. Acta Biomaterialia, 2018, 80: 412-424. DOI:10.1016/j.actbio.2018.09.036 |
| [56] |
CHEN M, HU Y, LI M, et al. Regulation of osteoblast differentiation by osteocytes cultured on sclerostin antibody conjugated TiO2 nanotube array[J]. Colloids and Surfaces B, 2019, 175: 663-670. DOI:10.1016/j.colsurfb.2018.12.023 |
| [57] |
WAN C, GILBERT S R, WANG Y, et al. Activation of the hypoxia-inducible factor-1α pathway accelerates bone regeneration[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(2): 686-691. DOI:10.1073/pnas.0708474105 |
| [58] |
LI J, FAN L, YU Z, et al. The effect of deferoxamine on angiogenesis and bone repair in steroid-induced osteonecrosis of rabbit femoral heads[J]. Experimental Biology and Medicine, 2015, 240(2): 273-280. DOI:10.1177/1535370214553906 |
| [59] |
RAN Q, YU Y, CHEN W, et al. Deferoxamine loaded titania nanotubes substrates regulate osteogenic and angiogenic differentiation of MSCs via activation of HIF-1α signaling[J]. Materials Science and Engineering: C, 2018, 91: 44-54. DOI:10.1016/j.msec.2018.04.098 |
| [60] |
MU C, HU Y, HUANG L, et al. Sustained raloxifene release from hyaluronan-alendronate-functionalized titanium nanotube arrays capable of enhancing osseointegration in osteoporotic rabbits[J]. Materials Science and Engineering: C, 2018, 82: 345-353. DOI:10.1016/j.msec.2017.08.056 |
| [61] |
SOUZA J C M, SORDI M B, KANAZAWA M, et al. Nano-scale modification of titanium implant surfaces to enhance osseointegration[J]. Acta Biomaterialia, 2019, 94: 112-131. |
| [62] |
BRAMMER K S, FRANDSEN C J, JIN S. TiO2 nanotubes for bone regeneration[J]. Trends in Biotechnology, 2012, 30(6): 315-322. DOI:10.1016/j.tibtech.2012.02.005 |
| [63] |
SHIN Y C, PANG K, HAN D, et al. Enhanced osteogenic differentiation of human mesenchymal stem cells on Ti surfaces with electrochemical nanopattern formation[J]. Materials Science and Engineering: C, 2019, 99: 1174-1181. DOI:10.1016/j.msec.2019.02.039 |
| [64] |
HUANG Y, HE S, GUO Z, et al. Nanostructured titanium surfaces fabricated by hydrothermal method: influence of alkali conditions on the osteogenic performance of implants[J]. Materials Science and Engineering: C, 2019, 94: 1-10. DOI:10.1016/j.msec.2018.08.069 |
| [65] |
LI J, MUTREJA I, TREDINNICK S, et al. Hydrodynamic control of titania nanotube formation on Ti-6Al-4V alloys enhances osteogenic differentiation of human mesenchymal stromal cells[J]. Materials Science and Engineering: C, 2020, 109: 110562. DOI:10.1016/j.msec.2019.110562 |
| [66] |
HUANG C, LIU H, LIU R, et al. Simulation study of effects of Ti content on microstructure evolution and elastic constants of immiscible Mg-Ti alloys during rapid quenching process[J]. Materials Letters, 2018, 220: 253-256. DOI:10.1016/j.matlet.2018.02.127 |
| [67] |
孙彩红, 武敏, 安博. B2型TiSi合金点缺陷结构和力学性能的第一性原理研究[J]. 井冈山大学学报(自然科学版), 2014, 35(6): 77-80. SUN C H, WU M, AN B. First-principle study on the point defective structures and mechanical property of B2-TiSi alloy[J]. Journal of Jinggangshan University(Natural Science), 2014, 35(6): 77-80. DOI:10.3969/j.issn.1674-8085.2014.06.016 |
| [68] |
TANG S, ZHENG J. Antibacterial activity of silver nanoparticles: structural effects[J]. Advanced Healthcare Materials, 2018, 7(13): 1701503. DOI:10.1002/adhm.201701503 |
| [69] |
PARK H, KIM J Y, KIM J, et al. Silver-ion-mediated reactive oxygen species generation affecting bactericidal activity[J]. Water Research, 2009, 43(4): 1027-1032. DOI:10.1016/j.watres.2008.12.002 |
| [70] |
RAUF A, YE J, ZHANG S, et al. Copper(ii)-based coordination polymer nanofibers as a highly effective antibacterial material with a synergistic mechanism[J]. Dalton Transactions, 2019, 48(48): 17810-17817. DOI:10.1039/C9DT03649K |
| [71] |
TRIPATHI B N, GAUR J P. Relationship between copper- and zinc-induced oxidative stress and proline accumulation in scenedesmus sp[J]. Planta, 2004, 219(3): 397-404. |
| [72] |
PRADO-PRONE G, SILVA-BERMUDEZ P, ALMAGUER-FLORES A, et al. Enhanced antibacterial nanocomposite mats by coaxial electrospinning of polycaprolactone fibers loaded with Zn-based nanoparticles[J]. Nanomedicine, 2018, 14(5): 1695-1706. DOI:10.1016/j.nano.2018.04.005 |
| [73] |
YU F, FANG X, JIA H, et al. Zn or O? an atomic level comparison on antibacterial activities of zinc oxides[J]. Chemistry-A European Journal, 2016, 22(24): 8053-8058. DOI:10.1002/chem.201601018 |
| [74] |
SARRAF M, DABBAGH A, ABDUL RAZAK B, et al. Silver oxide nanoparticles-decorated tantala nanotubes for enhanced antibacterial activity and osseointegration of Ti6Al4V[J]. Materials & Design, 2018, 154: 28-40. |
| [75] |
YUAN Z, LIU P, HAO Y, et al. Construction of Ag-incorporated coating on Ti substrates for inhibited bacterial growth and enhanced osteoblast response[J]. Colloids and Surfaces B, 2018, 171: 597-605. DOI:10.1016/j.colsurfb.2018.07.064 |
| [76] |
LEI Z, ZHANG H, ZHANG E, et al. Antibacterial activities and biocompatibilities of Ti-Ag alloys prepared by spark plasma sintering and acid etching[J]. Materials Science and Engineering: C, 2018, 92: 121-131. DOI:10.1016/j.msec.2018.06.024 |
| [77] |
HUANG Q, LI X, ELKHOOLY T A, et al. The Cu-containing TiO2 coatings with modulatory effects on macrophage polarization and bactericidal capacity prepared by micro-arc oxidation on titanium substrates[J]. Colloids and Surfaces B, 2018, 170: 242-250. DOI:10.1016/j.colsurfb.2018.06.020 |
| [78] |
SHI M, CHEN Z, FARNAGHI S, et al. Copper-doped mesoporous silica nanospheres, a promising immunomodulatory agent for inducing osteogenesis[J]. Acta Biomaterialia, 2016, 30: 334-344. DOI:10.1016/j.actbio.2015.11.033 |
| [79] |
HUANG Q, OUYANG Z, TAN Y, et al. Activating macrophages for enhanced osteogenic and bactericidal performance by Cu ion release from micro/nano-topographical coating on a titanium substrate[J]. Acta Biomaterialia, 2019, 100: 415-426. DOI:10.1016/j.actbio.2019.09.030 |
| [80] |
WANG J, ZHANG S, SUN Z, et al. Optimization of mechanical property, antibacterial property and corrosion resistance of Ti-Cu alloy for dental implant[J]. Journal of Materials Science & Technology, 2019, 35(10): 2336-2344. |
| [81] |
DENG C, SHEN X, YANG W, et al. Construction of zinc-incorporated nano-network structures on a biomedical titanium surface to enhance bioactivity[J]. Applied Surface Science, 2018, 453: 263-270. DOI:10.1016/j.apsusc.2018.05.097 |
| [82] |
FATHI M, AKBARI B, TAHERIAZAM A. Antibiotics drug release controlling and osteoblast adhesion from titania nanotubes arrays using silk fibroin coating[J]. Materials Science and Engineering: C, 2019, 103: 109743. DOI:10.1016/j.msec.2019.109743 |
| [83] |
DAVID N, NALLAIYAN R. Biologically anchored chitosan/gelatin-SrHAP scaffold fabricated on titanium against chronic osteomyelitis infection[J]. International Journal of Biological Macromolecules, 2018, 110: 206-214. DOI:10.1016/j.ijbiomac.2017.11.174 |
| [84] |
LIU P, HAO Y, ZHAO Y, et al. Surface modification of titanium substrates for enhanced osteogenetic and antibacterial properties[J]. Colloids and Surfaces B, 2017, 160: 110-116. DOI:10.1016/j.colsurfb.2017.08.044 |
| [85] |
LEE J S, LEE S J, YANG S B, et al. Facile preparation of mussel-inspired antibiotic-decorated titanium surfaces with enhanced antibacterial activity for implant applications[J]. Applied Surface Science, 2019, 496: 143675. DOI:10.1016/j.apsusc.2019.143675 |
| [86] |
BANDARA C D, SINGH S, AFARA I O, et al. Bactericidal effects of natural nanotopography of dragonfly wing on escherichia coli[J]. ACS Applied Materials & Interfaces, 2017, 9(8): 6746-6760. |
| [87] |
BHADRA C M, KHANH TRUONG V, PHAM V T H, et al. Antibacterial titanium nano-patterned arrays inspired by dragonfly wings[J]. Scientific Reports, 2015, 5(1): 16817. |
| [88] |
SJÖSTRÖM T, NOBBS A H, SU B. Bactericidal nanospike surfaces via thermal oxidation of Ti alloy substrates[J]. Materials Letters, 2016, 167: 22-26. |
| [89] |
LINKLATER D P, JUODKAZIS S, CRAWFORD R J, et al. Mechanical inactivation of staphylococcus aureus and pseudomonas aeruginosa by titanium substrata with hierarchical surface structures[J]. Materialia, 2019, 5: 100197. |
 2021, Vol. 49
2021, Vol. 49