文章信息
- 晏秘, 薛云, 申妍铭, 程琥, 庄金亮
- YAN Mi, XUE Yun, SHEN Yan-ming, CHENG Hu, ZHUANG Jin-liang
- 分级结构苯并噻二唑聚合物应用于可见光诱导硫醚选择性氧化
- Visible-light induced selective oxidation of sulfides by hierarchical benzothiadiazole-based polymers
- 材料工程, 2021, 49(7): 64-70
- Journal of Materials Engineering, 2021, 49(7): 64-70.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.001202
-
文章历史
- 收稿日期: 2020-12-28
- 修订日期: 2021-04-14
亚砜类化合物作为一种重要的有机反应中间体,被广泛应用于医药、农药、稀有金属萃取、有机合成等行业[1]。利用含锰、铬等过渡金属强氧化剂将硫醚直接氧化成亚砜是制备亚砜的方法之一[2-3]。然而该方法环境污染较严重,亚砜易被进一步氧化生成砜,产物选择性较差,且获得的产物常伴随痕量重金属,不适用于药物中间体的合成[4]。因此,开发一种高效、绿色、不含重金属和贵金属的催化体系将硫醚选择性氧化成亚砜具有重要的研究意义。
可见光诱导催化由于具有反应条件温和、清洁、高效等优点,近年来得到了极大的发展[5-8]。Liang等[9]利用Zn(Ⅱ)和蒽类羧酸配体通过溶剂热法合成出具有可见光催化活性的Zn(ADBEB) 金属有机聚合物并应用可见光催化氧化苯甲硫醚。2, 1, 3-苯并噻二唑(2, 1, 3-benzothiadiazole, BT)是一种强吸电子基团,具有较强的电子亲和势、较高的氧化电位和良好的稳定性,分子结构小,易于功能化,在可见光区具有较宽的吸收光谱等特点,是理想的可见光小分子催化基团[10-11]。共轭微孔聚合物(conjugated microporous polymers, CMPs)是一类具有π-共轭体系且骨架具有永久微孔结构的有机多孔聚合物,具有骨架易于功能化、化学稳定性高、合成路线简单等特点,被广泛应用于吸附分离、异相催化、传感器等领域[12-15]。将2, 1, 3-苯并噻二唑基团的光电特性与CMPs特有的多孔性相结合,合成2, 1, 3-苯并噻二唑功能化的CMPs,能有效提高CMPs可见光区域的光吸收效率并产生光生载流子,被广泛应用于光催化、锂离子电池等领域[16-18]。
本工作选择4, 7-二溴-2, 1, 3-苯并噻二唑作为构筑CMPs的功能化分子砌块,选择1, 3, 5-三乙炔苯作为CMPs桥连基团,利用Sonogashira偶联反应,合成具有分级结构的苯并噻二唑功能化共轭微孔聚合物CMP-3-BT作为可见光催化氧化硫醚的异相催化剂。利用扫描电子显微镜(SEM)、透射电镜(TEM)、傅里叶红外光谱(FT-IR)、X射线衍射仪(XRD)和紫外-可见漫反射谱(UV-vis DRS)等技术探究CMP-3-BT的形貌和结构特征,并将其作为光催化剂,探究CMP-3-BT光催化氧化苯甲硫醚转化为甲基苯基亚砜的性能。
1 实验材料与方法 1.1 主要原料1,4-二氮双环[2, 2, 2]辛烷(DABCO),2, 2, 6, 6-四甲基哌啶(TEMP),5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO),4, 7-二溴-2, 1, 3-苯并噻二唑,三乙胺,碘化亚铜,对硝基苯,四(三苯基磷)钯,苯甲硫醚,4-甲氧基茴香硫醚,4-溴茴香硫醚,1, 4-苯醌(BQ),4-甲基茴香硫醚,4-氟茴香硫醚,1, 3, 5-三乙炔苯,分析纯,百灵威;甲苯,无水甲醇,乙酸乙酯,三氯甲烷,氯仿,丙酮,过氧化氢,分析纯,国药。
1.2 CMP-3-BT的合成将三乙胺(10 mL)和甲苯(10 mL)鼓氮气1 h,称取1, 3, 5-三乙炔苯(75 mg,0.5 mmol)与4, 7-二溴-2, 1, 3-苯并噻二唑(220.48 mg,0.75 mmol)及四(三苯基磷)钯(24.84 mg,0.021 mmol)、碘化亚铜(12.38 mg,0.065 mmol)于带支口反应瓶中,抽放气3次,然后在氮气保护下加入经脱气处理的甲苯和三乙胺。反应瓶置于油浴中,搅拌升温至80 ℃后停止搅拌,反应72 h。反应结束后,冷却至室温,将产物分别依次用氯仿、甲醇、丙酮和乙酸乙酯洗涤,直至滤液无色,将产物于氯仿中回流12 h,最后将产物用甲醇索氏提取12 h, 真空干燥得到土黄色固体(149 mg)。
1.3 CMP-3-BT的表征及光催化性能测试利用扫描电子显微镜(HITACHI S-4800)和透射电子显微镜(JEM-2100)分析样品的形貌及尺寸;采用X射线粉末衍射分析仪(CuKα射线源,Rigaku Ultima Ⅳ XRD)表征所合成的样品结晶度;利用气相色谱-质谱联用仪(GC-MS-QP2010 Plus)分析硫醚的转化率及选择率;利用比表面积测定仪(ASAP2460)测定样品的BET及孔道尺寸;利用元素分析仪(Flash 2000)测定样品中C,N,S,H四种元素的含量;利用紫外光谱仪(Shimadzu UV-2450)测定样品的可见光吸收范围;利用傅里叶变换红外光谱仪(Nicolet IR 200)、固态核磁波谱(AVANCE Ⅲ)表征样品的结构特征,利用电子顺磁共振(MS-5000)检测样品中的活性物种(1O2,O2·-)。
以苯甲硫醚氧化为甲基苯基亚砜为例,在10 mL鸡心瓶中加入CMP-3-BT (10 mg),苯甲硫醚(0.26 mmol),甲醇(0.5 mL),H2O2 (10 μL),插入氧气球,蓝光LED灯(425 nm,3 W)照射反应瓶,室温搅拌至特定时间段后取出样品离心分离,取上清液加入对硝基苯(26 μL)为内标物,利用气-质联用色谱仪(GC-MS)分析检测反应液,通过计算各峰面积得到苯甲硫醚转化为甲基苯基亚砜的转化率和选择率。
2 结果与讨论 2.1 CMP-3-BT共轭微孔聚合物的表征图 1为CMP-3-BT的扫描电子显微镜(SEM)和透射电子显微镜(TEM)图。从SEM (图 1(a))和TEM照片(图 1(b))可以观察到CMP-3-BT具有复杂的分级结构,即微球表面包裹了大量弯曲丝状纳米带,其中微球尺寸为1~2 μm。高倍TEM图清晰显示了弯曲丝状纳米带的直径约为20 nm,微球通过丝状纳米带相互连接。此外,高倍TEM图片显示丝状纳米带具有一定的孔结构。

|
图 1 CMP-3-BT的SEM图(a)和TEM图(b), (c), (d) Fig. 1 SEM (a) and TEM (b), (c), (d) images of CMP-3-BT |
为了进一步研究CMP-3-BT的结构特征,测试了CMP-3-BT的粉末X射线衍射(XRD)、红外光谱(FT-IR)、固态核磁碳谱、N2吸/脱附以及紫外-可见漫反射谱。从XRD图谱(图 2(a))可知CMP-3-BT为非晶态。对比单体1 (1, 3, 5-三乙炔基苯)和单体2(4, 7-二溴-2, 1, 3-苯并噻二唑)的FT-IR谱图(图 2(b)),聚合产物CMP-3-BT谱图中未观察到芳香炔C—H伸缩振动峰(3278 cm-1)和C—Br的伸缩振动(586 cm-1),表明CMP-3-BT是由炔烃和卤素发生Sonagashira偶联反应聚合而成,且聚合程度较高。此外,CMP-3-BT谱图还可观察到CN伸缩振动峰(1578 cm-1),表明2, 1, 3-苯并噻二唑基团成功引入CMPs骨架。紫外-可见漫反射光谱图(图 2(c))表明CMP-3-BT在可见光区具有较宽的吸收带,利用Tauc plot公式:
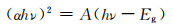
|
(1) |
|
图 2 CMP-3-BT结构表征 (a)粉末XRD图;(b)FT-IR红外谱图;(c)紫外-可见漫反射谱图;(d)(αhν)2-hν图 Fig. 2 Characterization of CMP-3-BT (a)XRD; (b)FT-IR; (c)UV-vis diffuse reflectance spectrum; (d)(αhν)2-hν curve |
式中:α为光吸收系数,cm-1;h为普朗克常数,eV·s;ν为光频率,Hz;A为常数;Eg为禁带宽度,eV。可计算出CMP-3-BT的半导体的禁带宽度2.24 eV[19]。
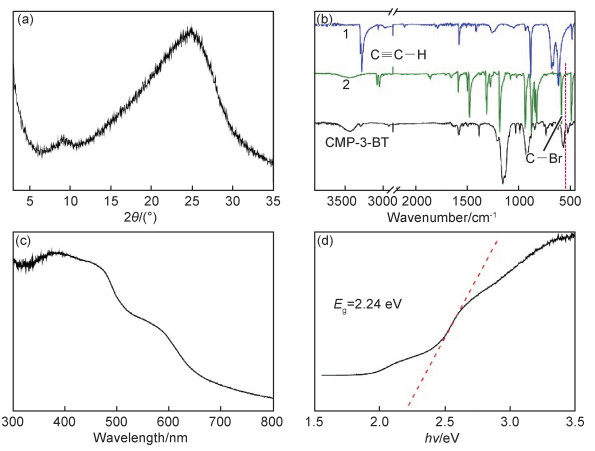
利用固体核磁13C CP-MAS谱进一步分析了CMP-3-BT成键特征。如图 3(a)所示,对应的CP-MAS谱峰与两个单体发生Sonogashira偶联后聚合产物单元一一对应,其中110~150的峰可归属于CMP-3-BT骨架的苯环碳,80~100为碳碳三键碳。77 K时氮气吸附-脱附曲线(图 3(b))表明CMP-3-BT的BET比表面积为50 m2/g,DFT法计算孔径主要分布在10~20 nm之间(图 3(c)),主要为介孔结构。该结果与Wang等合成的苯并噻二唑功能化的CMPs具有相似的孔径分布[20]。
|
图 3 CMP-3-BT表征 (a)固体核磁13C CP-MAS谱;(b)N2吸附-脱附曲线;(c)孔径分布图 Fig. 3 Characterization of CMP-3-BT (a)solid state 13C CP-MAS NMR spectrum; (b)N2 absorption-desorption isotherm; (c)pore width distribution |
元素分析测试结果表明CMP-3-BT含N和S质量分数分别为9.12%和8.17%,因此可计算出10 mg的CMP-3-BT聚合物中苯并噻二唑基团的物质的量为0.026 mmol。
2.2 CMP-3-BT共轭微孔聚合物光催化性能测试为了测试CMP-3-BT的可见光催化性能,以苯甲硫醚选择性氧化为甲基苯基亚砜为模型反应。反应条件如下:苯甲硫醚(0.26 mmol),CMP-3-BT(10 mg,苯并噻二唑基团物质的量为0.026 mmol),甲醇(0.5 mL),反应瓶充氧气球,室温,蓝光LED灯(425 nm,3 W),过氧化氧(26 μL),结果如表 1所示。
| No | Catalyst | Solvent | H2O2/μL | LED | Time/h | Conversion/% | Selectivity*/% |
| 1 | CMP-3-BT | Methanol | - | LED | 9 | 45 | >99 |
| 2 | CMP-3-BT | Methanol | - | Dark | 9 | 0 | 0 |
| 3 | CMP-3-BT | Methanol | 10 | LED | 9 | 100 | >99 |
| 4 | - | Methanol | 10 | LED | 9 | 21 | >99 |
| 5 | CMP-3-BT | CPME* | 10 | LED | 9 | 23 | >99 |
| 6 | CMP-3-BT | Acetone nitrile | 10 | LED | 9 | 25 | >99 |
| 7 | CMP-3-BT | [BMIM]BF4* | 10 | LED | 9 | 19 | >99 |
| 8 | CMP-3-BT | DCE* | 10 | LED | 9 | 34 | >99 |
| 9 | CMP-3-BT | Toluene | 10 | LED | 9 | 0 | 0 |
| 10 | CMP-3-BT | Ph-CF3* | 10 | LED | 9 | 3 | >99 |
| 11a | CMP-3-BT | Methanol | 10 | LED | 9 | 47 | >99 |
| 12b | CMP-3-BT | Methanol | 10 | LED | 9 | 31 | >99 |
| aReaction conditions: BQ(0.26 mmol);bReaction conditions: DABCO(0.26 mmol); CPME: cyclopentyl methyl ether; [BMIM]BF4: 1-butyl-3-methylimidazolium tetrafluoroborate; Ph-CF3: benzotrifluoride; DCE: 1, 2-dichloroethane; selectivity: benzyl methyl sulfoxide as a product. | |||||||
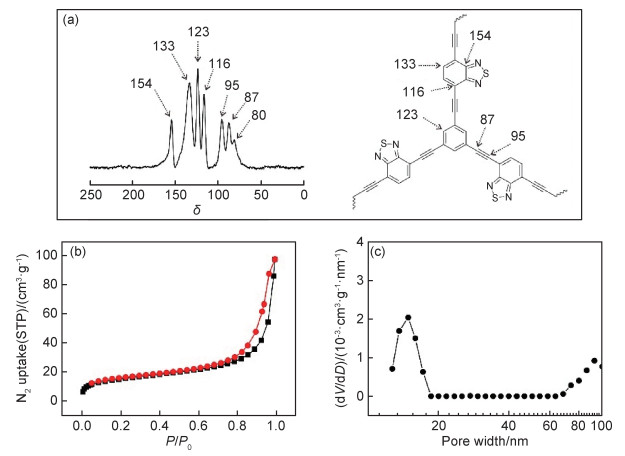
从表 1可以看出,以甲醇为溶剂,单独以CMP-3-BT作为光催化剂,光照9 h,尽管苯甲硫醚转化为甲基苯基亚砜的选择性优异,但转化率仅为45 %(No 1)。将该反应置于黑暗条件下,发现苯甲硫醚未发生转化,证明CMP-3-BT为光催化活性物质(No 2)。当在上述反应体系加入少量的H2O2(10 mL,0.1 mmol),光照9 h后,发现苯甲硫醚完全转化为甲基苯基亚砜(No 3),且产物中未检测出过氧化产物,表明CMP-3-BT在H2O2的辅助下,具有优异光催化氧化苯甲硫醚性能。为了考察H2O2自身对苯甲硫醚的氧化效果,反应体系移除CMP-3-BT, 仅含有H2O2时,苯甲硫醚的转化率仅为21% (No 4),表明CMP-3-BT的光催化氧化是驱动苯甲硫醚转化成甲基苯基亚砜的主要因素。H2O2的主要作用是有效转移CMP-3-BT产生的光生电子,降低光生电子与空穴的复合。此外,H2O2接收光生电子后产生OH·自由基,进一步提高了苯甲硫醚的氧化效率。溶剂筛选结果表明甲醇是该光催化反应的最佳溶剂,在甲氧基环戊烷、乙腈、[BMIM]BF4离子液体和二氯乙烷等溶剂中苯甲硫醚的转化率大大降低,而当甲苯和三氟甲苯作为溶剂时,反应几乎不进行。以氧气为氧化剂的光催化反应的活性中间物种通常可以是单线态氧(1O2)或是超氧自由基(O2·-)。上述两种活性氧可分别通过在反应体系添加单线态氧抑制剂(如三乙烯二胺,DABCO)和超氧自由基捕获剂(如苯醌,BQ)加以鉴别[21]。在No 3反应条件下,无论添加BQ (No 11) 或者DABCO (No 12),苯甲硫醚的转化率均大幅下降,表明单线态氧和超氧自由基均是该反应的活性氧。为了进一步验证光催化反应过程中产生1O2和O2·-,以2, 2, 6, 6-四甲基哌啶(TEMP)和5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO)分别作为上述活性氧的捕获剂,利用电子顺磁共振(electron paramagnetic resonance, EPR)研究了CMP-3-BT在黑暗和光照条件下的EPR谱图。如图 4所示,在黑暗条件下,未检测出自由基信号;当体系光照后,EPR谱图证实该光催化过程产生1O2(图 4(a))和O2·-(图 4(b))。
|
图 4 不同条件下CMP-3-BT电子顺磁共振谱(a)CMP-3-BT和TEMP的甲醇溶液;(b)CMP-3-BT和DMPO的甲醇溶液 Fig. 4 EPR spectra of CMP-3-BT under various conditions (a)CMP-3-BT and TEMP in MeOH; (b)CMP-3-BT and DMPO in MeOH |
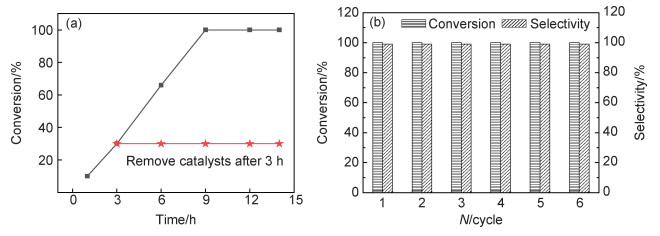
不同时间段CMP-3-BT对苯甲硫醚的催化氧化反应动力学(图 5(a))表明苯甲硫醚的转化率随反应时间线性增加,反应6 h时,苯甲硫醚的转化率为66%;反应至9 h时,苯甲硫醚完全氧化为甲基苯基亚砜。继续延长反应时间至14 h,未检测出过氧化产物苯基甲基砜,表明CMP-3-BT具有优异的选择性。反应进行至3 h,将CMP-3-BT催化剂滤除,滤液在相同条件下继续反应至14 h,苯甲硫醚的转化率未继续增加,证明CMP-3-BT为异相催化剂,且反应过程中未发生苯并噻二唑活性基团泄露。为了考察CMP-3-BT的循环催化性能,将反应后的CMP-3-BT离心分离,无水乙醇洗涤烘干,在相同催化条件下直接用于下一轮催化反应。循环性能测试结果表明经过6次循环使用后,CMP-3-BT的催化性能未见明显降低(图 5(b))。上述结果表明CMP-3-BT是一种结构稳定、性能优异、可多次循环利用的异相可见光催化剂。
|
图 5 CMP-3-BT在可见光下催化氧化苯甲硫醚 (a)苯甲硫醚随时间的转化率;(b)CMP-3-BT循环利用性能 Fig. 5 Visible light mediated oxidation of thioanisole by CMP-3-BT (a)conversion of thioanisole versus time; (b)reusability of CMP-3-BT |
为了研究CMP-3-BT作为可见光异相催化剂氧化硫醚的普适性,对反应底物进行了拓展,通过选用对位不同取代基的硫醚为底物,探究CMP-3-BT对硫醚的普适性,其反应式如式(2)所示。

|
(2) |
从表 2中可以看出,在蓝光LED的照射下,延长反应时间至13 h,CMP-3-BT在H2O2辅助下可将对位取代的(吸电子基团和供电子基团)苯甲硫醚氧化成相应的亚砜类产物,且反应具有良好的选择性。
| No | R1 | Time/h | Conversion/% | Selectivity/% |
| 1 | H | 9 | 100 | >99 |
| 2 | p-F | 13 | 100 | >96 |
| 3 | p-Br | 13 | 100 | >99 |
| 4 | p-Me | 13 | 100 | >97 |
| 5 | p-OMe | 13 | 100 | >99 |
| Note: sulfides (0.26 mmol); nitrobenzene (0.26 mmol) was used as an internal standard. | ||||
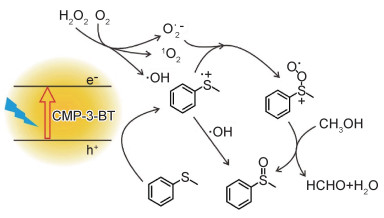
基于上述CMP-3-BT与H2O2组成的复合体系可见光催化氧化苯甲硫醚的实验结果可推断出该反应的催化机理,如图 6所示。在蓝光LED照射下,CMP-3-BT苯并噻二唑基团吸收光形成激发态CMP-3-BT*,并产生光生电子和空穴对;空穴可将苯甲硫醚氧化成自由基正离子中间体,氧气被活化形成单线态氧(1O2) 和超氧自由基(O2·-),上述苯甲硫醚中间体继续氧化成苯甲硫醚过氧化中间体,且在甲醇溶剂分子辅助下分解成甲基苯基亚砜,该过程伴随着甲醛和水的产生。当体系加入少量H2O2,由于H2O2能够将光生电子迅速转移并产生OH·自由基,降低CMP-3-BT光生电子/空穴复合概率,有效增加空穴浓度,提高了苯甲硫醚氧化效率;同时OH·自由基也可参与氧化苯甲硫醚,进一步提高苯甲硫醚氧化为甲基苯基亚砜的效率。
|
图 6 CMP-3-BT可见光催化氧化硫苯甲醚机理 Fig. 6 Proposed mechanism for visible light mediated oxidation of thioanisole by CMP-3-BT |
(1) 以4, 7-二溴-2, 1, 3-苯并噻二唑为光活性有机单体,将其与1, 3, 5-三乙炔苯通过Sonogashira偶联反应,成功合成具有分级结构、苯并噻二唑功能化的共轭微孔聚合物CMP-3-BT。
(2) CMP-3-BT为无定形多孔有机聚合物,由微球和弯曲丝状纳米带组成,具有复杂的分级结构。CMP-3-BT含有光活性苯并噻二唑基团,禁带宽度为2.24 eV。
(3) 以蓝光LED灯(425 nm,3 W)为光源,过氧化氢作为辅助剂,在室温和氧气氛围下,CMP-3-BT共轭微孔聚合物可将各种取代基苯甲硫醚高效、高选择氧化成相应的甲基苯基亚砜。电子顺磁共振谱表明上述光催化过程产生的1O2和O2·-是氧化苯甲硫醚的主要活性物种。
(4) CMP-3-BT经过6次循环使用后催化性能未发生明显改变,表明CMP-3-BT具有优异的结构稳定性和循环催化性能,是一种绿色、高效、高选择性氧化硫醚的异相催化剂。
| [1] |
CARRENO M C. Applications of sulfoxides to asymmetric synthesis of biologically active compounds[J]. Chemical Reviews, 1996, 95(6): 1717-1760. |
| [2] |
KAMATA K, SUGAHARA K, KATO Y, et al. Heterogeneously catalyzed aerobic oxidation of sulfides with a BaRuO3nanoperovskite[J]. ACS Applied Materials & Interfaces, 2018, 10(28): 23792-23801. |
| [3] |
TANAKA H. Photopromoted Ru-catalyzed asymmetric aerobic sulfide oxidation and epoxidation using water as a proton transfer mediator[J]. Journal of the American Chemical Society, 2010, 132(34): 12034-12041. DOI:10.1021/ja104184r |
| [4] |
刘课艳, 偶辉, 石先莹, 等. 过氧化氢选择性氧化硫醚的研究进展[J]. 有机化学, 2014, 34(4): 681-692. LIU K Y, OU H, SHI X Y, et al. Recent progress in the selective oxidation of sulfides with hydrogen peroxide[J]. Chinese Journal of Organic Chemistry, 2014, 34(4): 681-692. |
| [5] |
李贺希, 陈静飞, 卢聪, 等. 光催化降解化学毒剂研究进展[J]. 材料工程, 2020, 48(11): 9-24. LI H X, CHEN J F, LU C, et al. Research progress in photocatalytic degradation of chemical warfare agents[J]. Journal of Materials Engineering, 2020, 48(11): 9-24. DOI:10.11868/j.issn.1001-4381.2020.000422 |
| [6] |
ZHUANG J L, SHEN Y M, XUE Y, et al. Electrochemical deposition of perylene-based thin films from aqueous solution and studies of visible-light-driven oxidation of alcohols[J]. ACS Applied Energy Materials, 2020, 3(9): 9098-9106. DOI:10.1021/acsaem.0c01475 |
| [7] |
WANG C, LU Z. Catalytic enantioselective organic transformations via visible light photocatalysis[J]. Organic Chemistry Frontiers, 2015, 2(2): 179-190. DOI:10.1039/C4QO00306C |
| [8] |
赵燕茹, 马建中, 刘俊莉. 可见光响应型ZnO基纳米复合光催化材料的研究进展[J]. 材料工程, 2017, 45(6): 129-137. ZHAO Y R, MA J Z, LIU J L. Research progress on visible-light responding ZnO-based nanocomposite photocatalyst[J]. Journal of Materials Engineering, 2017, 45(6): 129-137. |
| [9] |
LIANG X, GUO Z, WEI H, et al. Selective photooxidation of sulfides mediated by singlet oxygen using visible-light-responsive coordination polymers[J]. Chemical Communications, 2018, 54(92): 13002-13005. DOI:10.1039/C8CC07585A |
| [10] |
WANG Z J, GHASIMI S, LANDFESTER K, et al. Highly porous conjugated polymers for selective oxidation of organic sulfides under visible light[J]. Chemical Communications, 2014, 50(60): 8177-8180. DOI:10.1039/C4CC02861A |
| [11] |
WANG G B, LI S, YAN C X, et al. A benzothiadiazole-based covalent organic framework for highly efficient visible-light driven hydrogen evolution[J]. Chemical Communications, 2020, 83(56): 12612-12615. |
| [12] |
王晨, 毛会玲, 薛云, 等. TEMPO功能化共轭微孔聚合物催化氧化醇性能[J]. 精细化工, 2019, 36(12): 2447-2451. WANG C, MAO H L, XUE Y, et al. TEMPO radical functionalized conjugated microporous polymer for selective oxidation of alcohols[J]. Fine Chemicals, 2019, 36(12): 2447-2451. |
| [13] |
胡孝文, 王海鸽, 何颜, 等. 共轭微孔聚合物的制备及应用研究进展[J]. 中国材料进展, 2019, 38(4): 365-374. HU X W, WANG H G, HE Y, et al. Research progress in preparation and applications of conjugated microporous polymers[J]. Materials China, 2019, 38(4): 365-374. |
| [14] |
杨光, 王千, 李青音, 等. 三嗪基共轭微孔聚合物的合成及其光催化产氢性能研究[J]. 功能高分子学报, 2021, 34(1): 66-73. YANG G, WANG Q, LI Q Y, et al. Synthesis and photocatalytic hydrogen evolution study of triazine-based conjugated microporous polymers[J]. Journal of Functional Polymers, 2021, 34(1): 66-73. |
| [15] |
ZHANG S, HUANG W, HU P, et al. Conjugated microporous polymers with excellent electrochemical performance for lithium and sodium storage[J]. Journal of Materials Chemistry A, 2015, 5(3): 1896-1901. |
| [16] |
LI R, BYUN J, HUANG W, et al. Poly-benzothiadiazoles and their derivatives as heterogeneous photocatalysts for visible light-driven chemical transformations[J]. ACS Catalysis, 2018, 8(6): 4735-4750. DOI:10.1021/acscatal.8b00407 |
| [17] |
JIANG J X, REN S B, MA W Y, et al. Exploiting polythiophenyl-triazine-based conjugated microporous polymer with superior lithium storage performance[J]. ChemSusChem, 2020, 9(13): 2295-2302. |
| [18] |
GISBERTZ S, PIEBER B. Heterogeneous photocatalysis in organic synthesis[J]. Chem Photo Chem, 2020, 4: 456-475. |
| [19] |
WANG F, REN F, MU P, et al. Hierarchical porous spherical-shaped conjugated microporous polymers for the efficient removal of antibiotics from water[J]. Journal of Materials Chemistry A, 2017, 22(5): 11348-11356. |
| [20] |
WANG S, YANG H, HOU H, et al. Highly efficient visible light induced photocatalytic activity of a novel in situ synthesized conjugated microporous poly(benzothiadiazole)-C3N4 composite[J]. Catalysis Science & Technology, 2017, 2(7): 418-426. |
| [21] |
WEI H, GUO Z, LIANG X, et al. Selective photooxidation of amines and sulfides triggered by a superoxide radical using a novel visible-light-responsive metal-organic framework[J]. ACS Applied Materials & Interfaces, 2019, 11(3): 3016-3023. |
 2021, Vol. 49
2021, Vol. 49


