文章信息
- 孙丽娟, 苏义平, 赵志成, 魏启亮, 李颖楷, 李顺
- SUN Li-juan, SU Yi-ping, ZHAO Zhi-cheng, WEI Qi-liang, LI Ying-kai, LI Shun
- 光热协同增强氮化碳锚定FeOx纳米复合材料催化活化过一硫酸盐降解罗丹明B
- Photothermal-assisted activation of peroxymonosulfate with FeOx nanoparticles anchored on carbon nitride for degradation of RhB
- 材料工程, 2021, 49(6): 156-163
- Journal of Materials Engineering, 2021, 49(6): 156-163.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000858
-
文章历史
- 收稿日期: 2020-09-11
- 修订日期: 2021-03-01
2. 佛山(华南)新材料研究院, 广东 佛山 528200;
3. 南方科技大学前沿与交叉科学研究院, 广东 深圳 518055
2. Foshan(Southern China) Institute for New Materials, Foshan 528200, Guangdong, China;
3. Academy for Advanced Interdisciplinary Studies, Southern University of Science and Technology, Shenzhen 518055, Guangdong, China
近年来,由于染料等持久性有机基质持续排入到水体中,使得地下水资源的污染日趋严重。纺织业产生的印染废水排放是这类水污染的重要源头。废水中的有机染料经历化学和生物转变,消耗了水体中大量的溶解氧,破坏水生植物,进而危害人体健康。因此,非常有必要对这类废水进行前置处理[1-2]。高级氧化技术(advanced oxidation processes, AOPs)被认为是处理这类生化性较差的有机污染物的有效手段[3]。近年来,硫酸根自由基氧化技术成为一种新型处理有机污染物的方法[4]。与羟基自由基对比,硫酸根自由基具有更高的氧化电势(2.5~3.1 V vs NHE)、更宽的pH值(2~8)和更长的存在时间(30~40 μs)[5]。在高级氧化过程中,过一硫酸盐(HSO5-, peroxymonosulfate,PMS)经常用于活化产生硫酸根自由基[6]。常规活化方法有热活化、超声、半导体材料、碳基材料、电化学方法等[7]。然而,有毒金属离子的溶出常常发生在过渡金属基反应过程中,限制了这类催化剂在实际水处理中的应用[8]。因此,开发具有高效PMS活化能力的非金属基催化剂对氧化去除水中有机污染物至关重要。
光催化是一种简单有效去除有机污染物的方法[9]。半导体光催化剂可以大幅度提高PMS的活化效率[10]。此外,在各种活化PMS的方法中,热活化尤其受到青睐[11]。提高活化温度可以局部提高反应温度,从而增强反应速率,加速污染物去除。此外,过硫酸分子经过热解可以形成均裂的过氧根分子,进而氧化污染物。对比其他活化技术,热活化的优势在于无须添加其他化学品,能最小化使用过硫酸盐。热活化过硫酸盐在诸多污染物体系中(双酚A[12],全氟羧酸[13],除草剂[14],药物[15-16])都被证明具有高效氧化去除效果。之前的研究表明,纳米FeOx在光热的辅助下可促进催化活性,提高降解效率[17]。基于此,本工作结合溶胶化-热解法制备一种新型氮化碳锚定FeOx纳米复合物(FeOx/CN)类芬顿催化剂,并对复合材料的形貌、结构和组分进行详细表征。以有机染料罗丹明B(rhodamine B,RhB)为模型污染物,考察FeOx/CN复合材料光热辅助活化PMS催化氧化性能,并深入探讨光热辅助活化PMS催化降解RhB的反应机理。
1 实验材料与方法 1.1 材料制备采用热解法制备FeOx/CN基复合材料。称取一定量(0.5,1,2 mmol)的Fe(NO3)3, 2 g尿素和2 g聚乙烯醇(平均分子质量1750),溶解在20 mL去离子水中,在70 ℃水浴3 h,得到棕黄色的凝胶溶液,冷却至室温。将凝胶溶液置于液氮中迅速冷冻,5 min后移至冷冻干燥机中冻干96 h。将得到的干凝胶放于管式炉中,在空气气氛中加热至550 ℃,保温1 h,随炉自然冷却到室温,得到黄色粉末样品氮化碳锚定FeOx复合材料(FeOx/CN),添加1 mmol Fe(NO3)3的样品标记为FCN,未添加铁盐的对比样品标记为CN。将FCN样品放置在炉子内,在H2含量为10%的Ar气氛下400 ℃还原1 h,得到的样品标记为FCNH。
1.2 材料表征采用Rigaku SmartLab型X射线粉晶衍射仪(XRD)对样品的晶体结构进行表征;采用Zeiss Merlin型扫描电子显微镜(SEM)观察样品表面形貌;采用FEI F30型透射电子显微镜(TEM)对样品的尺寸、形貌、表面元素进行分析,工作电压为200 kV;采用PHI 5000 Versaprobe Ⅲ型X射线光电子能谱(XPS)对样品表面的元素、价态进行分析表征;采用Micromeritics ASAP 2020M型物理吸附仪进行氮气吸附-脱附测试,并根据Brunauer-Emmett-Teller(BET)公式计算样品的比表面积,使用Barrett-Joyner-Halenda(BJH)公式进行孔径分析;采用Lambda 750S型紫外可见近红外分光光度计(UV/VIS/NIR)对样品的光吸收性质进行测量,测试范围为250~800 nm。
1.3 催化性能测试将10 mg催化剂样品加入到100 mL罗丹明B(RhB)溶液(10 mg/L)中,使用四硼酸钠溶液调节RhB溶液初始pH值。在避光条件下磁力搅拌60 min,使RhB和样品达到吸附-脱附平衡。催化反应在氙灯照射下进行(PLS-SXE300/300UV,300 W,光功率密度200 mW/cm2),通过配备紫外截止滤光片得到可见光(λ>420 nm)。每隔一段时间取2.5 mL的反应溶液,用0.22 μm Millipore滤膜过滤,澄清液待检测。采用安捷伦(Cary 5000)可见分光光度计测量RhB溶液在554 nm处的吸光度值,计算RhB的降解率: [(C0-C)/C0]×100%,其中C0和C分别为初始和降解单位时间后的浓度,mg/L。
2 结果与分析 2.1 结构与微观形貌图 1为FCN和FCNH样品的XRD谱图。可以看出,FCN样品主要是Fe3O4,Fe2O3和石墨氮化碳复合物,FCNH样品出现了Fe单质的峰。样品在2θ为18.31°,30.12°,35.48°,43.12°,53.50°,57.03°,62.63°处出现了Fe3O4的特征衍射峰,分别对应(111),(220),(311),(400),(422),(511)和(440)晶面,这与Fe3O4的标准卡片(PDF No. 75-0033)一致;在2θ为32.4°出现了Fe2O3(PDF No.76-1821)的特征衍射峰(111),在2θ为44.68°出现了金属Fe(PDF No.87-0721)的特征衍射峰(110)。此外,在两个样品中均发现了20°~30°之间的宽化峰,对应无定型氮化碳[18]。
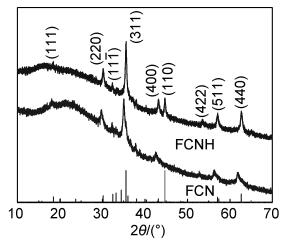
|
图 1 FCN和FCNH样品的XRD谱图 Fig. 1 XRD patterns of FCN and FCNH samples |
图 2为FCNH样品表面微观形貌。图 2(a), (b)显示,大量的颗粒嵌入褶皱状的片层结构中。表明经过热解后,形成了氧化物颗粒和多孔结构。从图 2(c)的TEM图中可以发现,颗粒之间的孔隙很大,可以为催化反应中的污染物和催化剂提供良好的接触界面。由图 2(d)的HAADF-STEM图可以看到,大量的FeOx纳米颗粒密实堆积在多孔氮化碳基材料中。此外,图 2(e)~(h)中对应的元素面扫描图证实Fe,O,C和N四种元素均匀地分布在FCNH样品中。

|
图 2 FCNH样品的FESEM图(a)~(b),TEM图(c),HAADF-STEM图(d)和各元素能谱图(e)~(h) Fig. 2 FESEM(a)-(b), TEM(c), HAADF-STEM(d) and EDX mapping images(e)-(h) of Fe, O, C and N element of FCNH samples |
图 3为FCNH样品的TEM和HRTEM图。从图 3(a)中可以观察到,FeOx颗粒均匀地分布在多孔片状氮化碳材料中,证实合成了FeOx/CN复合材料。从图 3(b)的HRTEM图中可以看到清晰的晶格衍射条纹。对①②两个区域进行放大分析(图 3(c), (d)),发现间距0.253 nm及0.296 nm的衍射条纹分别对应于Fe3O4的(311)和(220)晶面,间距为0.203 nm的衍射条纹对应于Fe单质的(110)晶面,间距为0.276 nm的衍射条纹对应于Fe2O3的(111)晶面。该表征与XRD的分析结果基本一致。
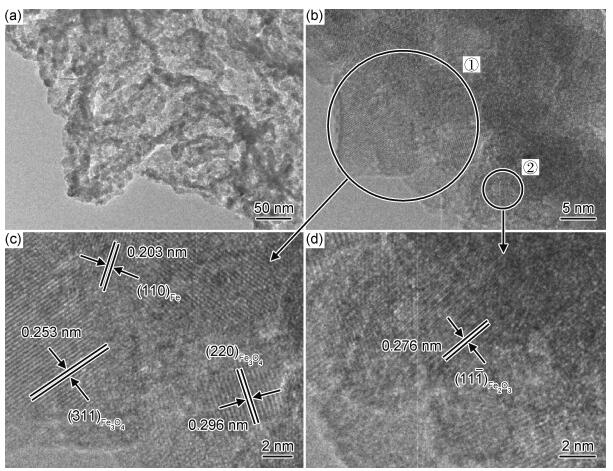
|
图 3 FCNH样品的TEM图(a)和HRTEM图(b)~(d) Fig. 3 TEM(a) and HRTEM images(b)-(d) of FCNH samples |
通过XPS对FCN和FCNH样品表面各元素的化学价态进行分析,如图 4所示。从图 4(a)中可以看出,样品中含有Fe,C和N元素,与能谱表征结果一致。图 4(b)中,FCN和FCNH样品的C峰都可以分解为3个峰,分别代表C=C(284.7 eV), C—O和C=N(286.2 eV), C—O—C和C—N(289.1 eV)[19]。氢气还原得到的FCNH样品的C=C峰强度变高,而其他峰变弱。图 4(c)中观察到,N1s峰经过分峰后,得到结合能在407.0 eV的—NO2键[20],在399.8 eV的sp3杂化峰[21],还原后的氧化峰逐渐消失。从图 4(d)的Fe2p谱图中可以看出,FCN和FCNH样品中的铁元素含量基本相同。FCNH样品的Fe2p3/2峰经拟合分解后,得到结合能在707.7, 710.2 eV和712.5 eV的精细峰,分别对应于Fe0,Fe2+和Fe3+[22]。对比还原前的FCN样品,FCNH样品中的二价铁含量升高,且具有新的零价铁的峰,说明在经氢气还原处理后,样品存在铁单质成分,这与XRD的分析基本一致。
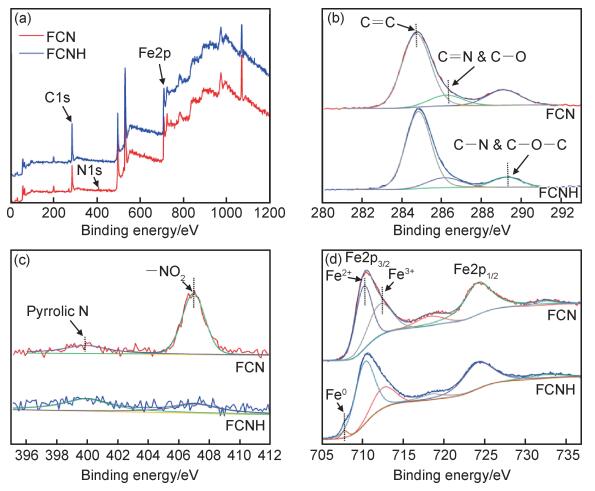
|
图 4 FCN和FCNH样品的全谱图(a),C1s(b),N1s(c)和Fe2p(d)谱图 Fig. 4 XPS survey scan spectra(a), C1s(b), N1s(c) and Fe2p(d) spectra of FCN and FCNH samples |
图 5为FCN和FCNH样品的N2吸附-脱附曲线。可以看出, FCN和FCNH样品的吸附-脱附等温曲线形状相似,根据IUPAC判断属于典型的Ⅳ型,两个样品均出现了由于毛细管凝聚产生的H3型滞后环[23]。由孔径分布曲线可知, FCN和FCNH样品的孔径分布均较宽,平均孔径分别在28.0 nm和39.0 nm左右。对比了两个样品的比表面积、平均孔径和孔体积。FCN和FCNH样品的比表面积分别为17.6 m2/g和12.9 m2/g,平均孔径分别为28.0 nm和39.0 nm,孔体积分别为0.109 cm3/g和0.061 cm3/g。由此可知,在氢气还原过程中,复合材料的比表面积和孔体积均未发生大的变化。
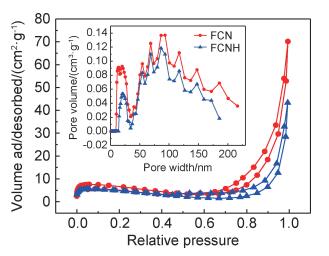
|
图 5 FCN和FCNH样品的N2吸附-脱附曲线(小图为孔径分布曲线) Fig. 5 N2 adsorption-desorption curves of FCN and FCNH samples(inset shows the pore size distribution curves) |
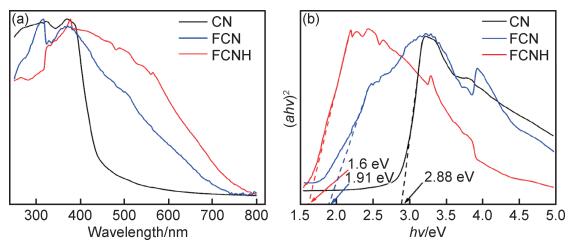
图 6为CN,FCN和FCNH样品的紫外-可见吸收光谱图。由图 6(a)可知,纯CN样品的光吸收范围主要集中在紫外区(250~450 nm)。而FCN和FCNH的吸收带边发生了明显的红移,延伸到可见光区范围。由此可见,FeOx颗粒增加了氮化碳对可见光的吸收能力。根据(αhν)2-hν曲线可估算出各样品的光学带隙Eg(图 6(b)),CN,FCN和FCNH样品的Eg分别为2.88,1.91 eV和1.6 eV,与文献报道的数值接近[24]。由此可知,相比CN和FCN材料,FCNH样品具有很好的可见光响应,更容易被可见光激发产生光生电子-空穴对,因此有望具有更高的光辅助催化活性。
|
图 6 CN,FCN和FCNH样品的紫外-可见吸收光谱图(a)及计算带隙的Tauc图(b) Fig. 6 UV-vis absorbance spectra(a) and bandgap calculation by Tauc plot(b) of CN, FCN and FCNH samples |
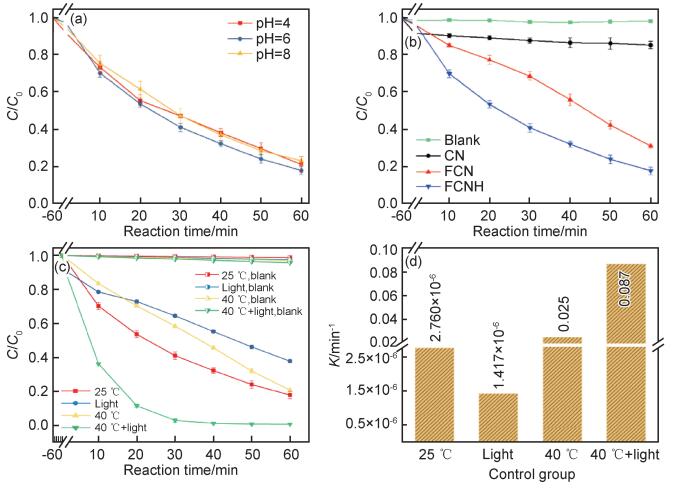
将制备好的样品用于光热辅助催化活化PMS去除代表性有机染料RhB。在催化降解之前,将催化剂和RhB在黑暗下搅拌达到吸附平衡。图 7为各样品催化降解RhB的曲线。首先,研究了不同pH值下催化剂活化PMS降解性能(图 7(a)),可以看出,pH值为中性时催化活性更高,这与FeOx活化PMS的相关报道结果一致。因此,之后的催化实验选择在pH值为6下进行。图 7(b)为25 ℃室温条件下不同样品活化PMS催化降解RhB曲线。可以看出,没有催化剂时,RhB的浓度基本没有变化;在CN的作用下,去除性能较弱,在活化PMS作用下,污染物浓度变化不大;FCN样品活化PMS的作用非常明显。经过热还原后得到的FCNH样品中,由于存在铁单质,活化PMS的作用更加明显[25-26]。随后研究了不同实验条件下FCNH样品的催化活性。如图 7(c)所示,不同温度下罗丹明B的自降解非常微弱。在可见光(λ>420 nm)照射下,没有添加PMS时,60 min内RhB的去除率为62.1%;在水浴40 ℃的条件下,由于热活化PMS的作用,60 min内降解了79.2%;在40 ℃水浴和可见光协同作用下,活化PMS催化降解RhB的效率显著提高,在30 min内降解率达到了98.0%,60 min内RhB则被完全矿化,降解率达到了99.8%。经拟合计算得到了不同条件下FCNH催化降解反应速率K(图 7(d)),分别为2.760×10-6 min-1(25 ℃),1.417×10-6 min-1(可见光),0.025 min-1(40 ℃)和0.087 min-1(40 ℃+可见光)。可以明显看出,在光热协同作用下,催化剂的活性最高。
|
图 7 不同pH值下FCNH活化PMS降解RhB效率图(25 ℃)(a), 不同样品(CN,FCN和FCNH)活化PMS降解RhB效率图(25 ℃,pH=6)(b),FCNH在不同条件下活化PMS降解RhB效率图(pH=6)(c)及速率对比图(d) (催化剂浓度为0.1 g/L,PMS为0.2 g/L,初始RhB为10 mg/L,100 mL) Fig. 7 RhB degradation curves under different pH values with FCNH(25 ℃)(a), PMS activation for RhB degradation curves using different catalysts(CN, FCN and FCNH)(pH=6, 25 ℃)(b), PMS activation for RhB degradation curves under different conditions with FCNH(pH=6)(c), degradation rate under different conditions for FCNH(d)(catalyst: 0.1 g/L, PMS: 0.2 g/L, initial RhB: 10 mg/L, 100 mL) |
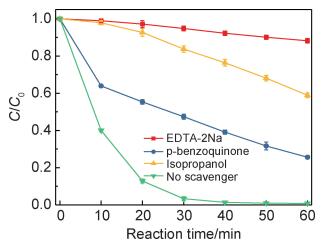
为了评估各活性物种在催化降解RhB中的作用,在光热共同作用下,通过加入特定的自由基捕获剂研究对污染物降解的影响,如图 8所示。EDTA-2Na显著阻滞了催化过程,在反应60 min后对RhB的去除仅为22.3%;加入异丙醇后,在60 min内去除率为41.1%;加入对苯醌后,在60 min内去除率为74.4%。由以上结果可知,在PMS活化过程中,空穴(h+)和羟基自由基(OH·)起到主要作用。
|
图 8 自由基捕获剂对光热协同活化PMS氧化RhB过程的影响 Fig. 8 Effect of the radical scavengers on RhB oxidation under photothermal-assisted activation of PMS |
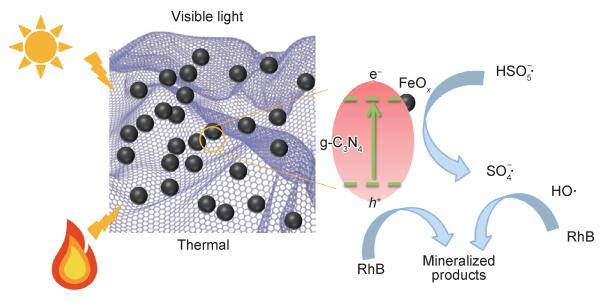
图 9为催化降解机理图。一方面,在可见光照射下,FCNH催化剂中的氮化碳和FeOx产生大量电子-空穴对。同时,FeOx中的Fe0,Fe2+和Fe3+提供了低价铁到Fe3+氧化还原对,从而活化PMS,产生大量的活性物种(式(1)~(13))使得RhB降解;另一方面,热辅助下可以产生羟基和硫酸根自由基(式(14)),也能触发后续的氧化反应(式(10),(11),(13)),进而氧化污染物[27-28]。在光热协同作用下,大量的空穴(h+)、羟基自由基(OH·)和少量超氧负离子(O2-·)共同矿化分解RhB(式(2))。
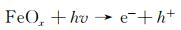
|
(1) |
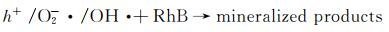
|
(2) |
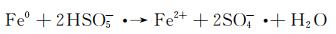
|
(3) |
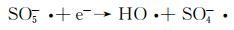
|
(4) |
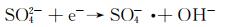
|
(5) |
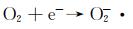
|
(6) |
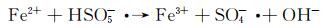
|
(7) |
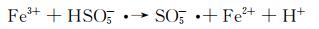
|
(8) |
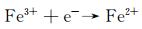
|
(9) |
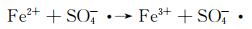
|
(10) |

|
(11) |
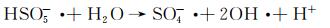
|
(12) |
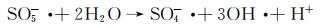
|
(13) |
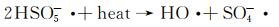
|
(14) |
|
图 9 催化降解机理示意图 Fig. 9 Schematic diagram of degradation mechanism using FCNH |
(1) 采用凝胶-热解法成功制备FeOx/CN纳米复合材料。FeOx纳米颗粒沉积在多孔氮化碳基材料中,相比于纯的氮化碳,复合材料具有更宽的可见光吸收范围。
(2) 光热辅助可以加速PMS活化催化降解效率。在水浴40 ℃,λ>420 nm的光热协同条件下(pH=6),30 min内RhB的降解率达到了98.0%。
(3) 空穴(h+)和羟基(OH·)的相关基团在RhB降解过程中起到主要作用。
| [1] |
CHEN S Q, DI Y T, LI Y, et al. Removal of RhB from aqueous solutions by two polyoxometalates adsorbents[J]. Journal of Inorganic and Organometallic Polymers and Materials, 2019, 29(3): 1048-1055. DOI:10.1007/s10904-018-1045-y |
| [2] |
NATARAJAN S, BAJAJ H C, TAYADE R J. Recent advances based on the synergetic effect of adsorption for removal of dyes from waste water using photocatalytic process[J]. Journal of Environmental Sciences, 2018, 65: 201-222. DOI:10.1016/j.jes.2017.03.011 |
| [3] |
NIDHEESH P V, RAJAN R. Removal of rhodamine B from a water medium using hydroxyl and sulphate radicals generated by iron loaded activated carbon[J]. RSC Advances, 2016, 6(7): 5330-5340. DOI:10.1039/C5RA19987E |
| [4] |
ANIPSITAKIS G P, DIONYSIOU D D. Degradation of organic contaminants in water with sulfate radicals generated by the conjunction of peroxymonosulfate with cobalt[J]. Environmental Science & Technology, 2003, 37(20): 4790-4797. |
| [5] |
OLMEZ-HANCI T, ARSLAN-ALATON I. Comparison of sulfate and hydroxyl radical based advanced oxidation of phenol[J]. Chemical Engineering Journal, 2013, 224: 10-16. DOI:10.1016/j.cej.2012.11.007 |
| [6] |
MATZEK L W, CARTER K E. Activated persulfate for organic chemical degradation: a review[J]. Chemosphere, 2016, 151: 178-188. DOI:10.1016/j.chemosphere.2016.02.055 |
| [7] |
ZHAO Y, WANG G L, LI L J, et al. Enhanced activation of pe-roxymonosulfate by nitrogen-doped graphene/TiO2 under photo-assistance for organic pollutants degradation: insight into N doping mechanism[J]. Chemosphere, 2020, 244: 125526. DOI:10.1016/j.chemosphere.2019.125526 |
| [8] |
SU D S, PERATHONER S, CENTI G. Nanocarbons for the development of advanced catalysts[J]. Chemical Reviews, 2013, 113(8): 5782-5816. DOI:10.1021/cr300367d |
| [9] |
李贺希, 陈静飞, 卢聪, 等. 光催化降解化学毒剂研究进展[J]. 材料工程, 2020, 48(11): 9-24. LI H X, CHEN J F, LU C, et al. Research progress in photocatalytic degradation of chemical warfare agents[J]. Journal of Materials Engineering, 2020, 48(11): 9-24. DOI:10.11868/j.issn.1001-4381.2020.000422 |
| [10] |
WANG G L, NIE X W, JI X J, et al. Enhanced heterogeneous activation of peroxymonosulfate by Co and N codoped porous carbon for degradation of organic pollutants: the synergism between Co and N[J]. Environmental Science: Nano, 2019, 6(2): 399-410. DOI:10.1039/C8EN01231H |
| [11] |
TSITONAKI A, PETRI B, CRIMI M, et al. In situ chemical oxidation of contaminated soil and groundwater using persulfate: a review[J]. Critical Reviews in Environmental Science and Technology, 2010, 40(1): 55-91. DOI:10.1080/10643380802039303 |
| [12] |
OLMEZ-HANCI T, ARSLAN-ALATON I, GENC B. Bisphenol A treatment by the hot persulfate process: oxidation products and acute toxicity[J]. Journal of Hazardous Materials, 2013, 263: 283-290. DOI:10.1016/j.jhazmat.2013.01.032 |
| [13] |
LEE Y C, LO S L, KUO J, et al. Persulfate oxidation of perfluorooctanoic acid under the temperatures of 20-40 ℃[J]. Chemical Engineering Journal, 2012, 198: 27-32. |
| [14] |
TAN C Q, GAO N Y, DENG Y, et al. Heat-activated persulfate oxidation of diuron in water[J]. Chemical Engineering Journal, 2012, 203: 294-300. DOI:10.1016/j.cej.2012.07.005 |
| [15] |
TAN C Q, GAO N Y, DENG Y, et al. Degradation of antipyrine by heat activated persulfate[J]. Separation and Purification Technology, 2013, 109: 122-128. DOI:10.1016/j.seppur.2013.03.003 |
| [16] |
GHAUCH A, TUQAN A M, KIBBI N. Ibuprofen removal by heated persulfate in aqueous solution: a kinetics study[J]. Chemical Engineering Journal, 2012, 197: 483-492. DOI:10.1016/j.cej.2012.05.051 |
| [17] |
ANTONIOU M G, DE LA CRUZ A A, DIONYSION D D. Degradation of microcystin-LR using sulfate radicals generated through photolysis, thermolysis and e- transfer mechanisms[J]. Applied Catalysis B: Environmental, 2010, 96(3/4): 290-298. |
| [18] |
GONG Y, ZHAO X, ZHANG H, et al. MOF-derived nitrogen doped carbon modified g-C3N4 heterostructure composite with enhanced photocatalytic activity for bisphenol A degradation with peroxymonosulfate under visible light irradiation[J]. App-lied Catalysis B: Environmental, 2018, 233: 35-45. DOI:10.1016/j.apcatb.2018.03.077 |
| [19] |
ZHOU D, YANG L P, YU L H, et al. Fe/N/C hollow nanospheres by Fe(iii)-dopamine complexation-assisted one-pot doping as nonprecious-metal electrocatalysts for oxygen reduction[J]. Nanoscale, 2015, 7(4): 1501-1509. DOI:10.1039/C4NR06366J |
| [20] |
RAICOPOL M, ANDRONESCU C, ATASIEI R, et al. Post-poly- merization electrochemical functionalization of a conducting polymer: diazonium salt electroreduction at polypyrrole electrodes[J]. Journal of the Electrochemical Society, 2014, 161(12): 103. DOI:10.1149/2.0871412jes |
| [21] |
DING X, XIAO D, JI L, et al. Simple fabrication of Fe3O4/C/g-C3N4 two-dimensional composite by hydrothermal carbonization approach with enhanced photocatalytic performance under visible light[J]. Catalysis Science & Technology, 2018, 8(14): 3484-3492. |
| [22] |
TANG J T, WANG J L. Fenton-like degradation of sulfametho-xazole using Fe-based magnetic nanoparticles embedded into mesoporous carbon hybrid as an efficient catalyst[J]. Chemical Engineering Journal, 2018, 351: 1085-1094. DOI:10.1016/j.cej.2018.06.169 |
| [23] |
ZHI L H, ZHANG S Y, XU Y Y, et al. Controlled growth of AgI nanoparticles on hollow WO3 hierarchical structures to act as Z-scheme photocatalyst for visible-light photocatalysis[J]. Journal of Colloid and Interface Science, 2020, 579: 754-765. DOI:10.1016/j.jcis.2020.06.126 |
| [24] |
WANG Z L, FAN Y P, WU R, et al. Novel magnetic g-C3N4/α-Fe2O3/Fe3O4 composite for the very effective visible-light-Fenton degradation of Orange Ⅱ[J]. RSC Advances, 2018, 8(10): 5180-5188. DOI:10.1039/C7RA13291C |
| [25] |
TAN C Q, DONG Y J, FU D F, et al. Chloramphenicol removal by zero valent iron activated peroxymonosulfate system: kinetics and mechanism of radical generation[J]. Chemical Engineering Journal, 2018, 334: 1006-1015. DOI:10.1016/j.cej.2017.10.020 |
| [26] |
WANG J L, WANG S Z. Activation of persulfate (PS) and pe-roxymonosulfate (PMS) and application for the degradation of emerging contaminants[J]. Chemical Engineering Journal, 2018, 334: 1502-1517. DOI:10.1016/j.cej.2017.11.059 |
| [27] |
LIU Y X, WANG Y. Gaseous elemental mercury removal using combined metal ions and heat activated peroxymonosulfate/H2O2 solutions[J]. AIChE Journal, 2019, 65(1): 161-174. DOI:10.1002/aic.16224 |
| [28] |
JI Y F, DONG C G, KONG D Y, et al. Heat-activated persulfate oxidation of atrazine: implications for remediation of groundwater contaminated by herbicides[J]. Chemical Engineering Journal, 2015, 263: 45-54. DOI:10.1016/j.cej.2014.10.097 |
 2021, Vol. 49
2021, Vol. 49


