文章信息
- 高新丽, 裴雷, 赵旭东, 高竹青, 黄宏亮
- GAO Xin-li, PEI Lei, ZHAO Xu-dong, GAO Zhu-qing, HUANG Hong-liang
- Tb3+修饰的MOF荧光探针的制备及L-色氨酸识别性能
- Preparation and L-Tryptophan sensing performance of Tb3+ decorated fluorescent MOF
- 材料工程, 2021, 49(6): 148-155
- Journal of Materials Engineering, 2021, 49(6): 148-155.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2021.000076
-
文章历史
- 收稿日期: 2021-01-27
- 修订日期: 2021-04-01
2. 太原科技大学 化学与生物工程学院, 太原 030024;
3. 天津工业大学 化学与化工学院, 天津 300387;
4. 天津工业大学 省部共建天津工业大学分离膜和膜过程国家重点实验室, 天津 300387
2. College of Chemical and Biological Engineering, Taiyuan University of Science and Technology, Taiyuan 030024, China;
3. School of Chemistry and Chemical Engineering, Tiangong University, Tianjin 300387, China;
4. State Key Laboratory of Separation Membranes and Membrane Processes, Tiangong University, Tianjin 300387, China
氨基酸是生物体蛋白质、多肽的主要成分,也是生物代谢过程中辅酶和核酸的前驱体,是人体不可或缺的分子[1]。氨基酸的含量直接关系到人体的健康,过多或过少均会诱发一些疾病(如癌症、白血病等)[2-3]。其中,色氨酸(Trp)参与调节蛋白质的合成,促进人体消化,同时作为神经递质的前体,能有效调控情绪、改善睡眠。一些肾功能衰竭、神经性及免疫性等疾病往往伴随Trp的代谢紊乱[4]。为了实现疾病的及时预防和早期诊断,氨基酸的快速灵敏检测具有重要的意义。目前,已报道的检测方法包括高效液相色谱法、毛细管电泳法、质谱法、电化学实验法等[5-8]。此类方法存在成本高、程序复杂、检测耗费时间长、不易通过肉眼识别等问题。与之相比,荧光分析法具有快速响应、选择性和灵敏性高等优点,在生物传感技术领域体现出良好的发展潜力。因此,有必要开发高效的荧光探针材料,以实现氨基酸的高效检测。目前,基于主客体氢键作用、π-π堆叠作用、有机反应、紫外光竞争等机理,已经有几类Trp荧光探针被报道,如BTAP5、石墨烯-罗丹明复合物、芘二酮、金属-有机骨架材料(metal-organic framework, MOF)等[9-13],然而材料的选择性、灵敏度等指标仍有待提升。
近些年来,作为一种由金属和有机配体组成的多孔骨架材料,MOFs已被广泛应用于吸附分离[14]、催化[15]、药物传输[16]、荧光检测[17]等方面,在环境工程和生物健康等领域发挥着重要作用。丰富的发光体系、可设计的成键位点及良好的骨架稳定性,使得荧光MOF材料具备良好的传感性能。目前,MOF材料已被应用于多种氨基酸的荧光识别,包括半胱氨酸(Cys)[17-18]、高半胱氨酸(GSH)[19]、组氨酸(His)[20]、谷氨酸(Glu)[21]、天冬氨酸(Asp)[22]等。对于Trp的检测,尽管已有MOF材料被报道[12-13, 23-25],然而材料的检测性能特别是检测限方面仍有待提高。另外,在荧光MOFs方面,镧系MOFs因其优异的光学性质如大Stoke位移、高色纯度以及相对较长的荧光寿命而受到了广泛的关注。其中,利用后合成修饰法在一些MOF材料上负载镧系金属元素已成为近年来在镧系MOF制备方面的重要途径之一,而MOF材料中的螯合基团如羧基[26]、吡啶[27]、氨基[28]等为具有发光特性的镧系离子提供了有效的负载位点。
本工作以羧基化的锆基材料UiO-66-(COOH)2为平台,利用后合成修饰法负载铽制备荧光探针。良好的水稳定性、生物相容性及材料配体中丰富的羧基基团,使得该MOF可作为良好的镧系金属(如Tb3+)负载基底材料。并进一步探索了Tb3+@UiO-66-(COOH)2对Trp检测的灵敏度、响应时间及抗干扰能力,并对荧光检测机制进行了研究。
1 实验材料与方法 1.1 试剂与仪器主要试剂:四氯化锆(ZrCl4),1, 2, 4, 5-均苯四甲酸(H4BTEC),六水硝酸铽(Tb(NO3)3·6H2O),羟乙基哌嗪乙磺酸(HEPES),L-丙氨酸(L-Ala),L-天冬酰胺(L-Asn),L-半胱氨酸(L-Cys),L-谷氨酰胺(L-Gln),L-甘氨酸(L-Gly),L-异亮氨酸(L-Ile),L-亮氨酸(L-Leu),L-甲硫氨酸(L-Met),L-脯氨酸(L-Pro),L-丝氨酸(L-Ser),L-苏氨酸(L-Thr),L-缬氨酸(L-Val),L-色氨酸(L-Trp)等均购自北京华威锐科化工有限公司。所购试剂直接使用而没有进行进一步的纯化。
主要仪器:MiniFlexⅡ X射线衍射仪;3H-2000PS1/2系列全自动比表面及孔径分析仪;F-200场发射透射电子显微镜;Nicolet iS50傅里叶变换红外分光光度计;UV-6000型紫外/可见分光光度计;Fluoromax-4荧光光谱仪;X射线光电子能谱仪。
1.2 样品制备UiO-66-(COOH)2制备:该材料的合成参考文献[29]报道的方法。在100 mL圆底烧瓶中加入4.3 g H4BTEC, 2.3 g ZrCl4和50 mL去离子水,充分搅拌后在100 ℃下回流反应24 h。为防止未反应的均苯四甲酸的析出,趁热过滤收集白色固体。进一步将所得固体分散于200 mL去离子水中,在100 ℃下二次回流,以清洗产物中残留的配体和金属。最后,将所得固体在100 ℃下干燥24 h。
Tb3+@UiO-66-(COOH)2的制备:在500 mL圆底烧瓶中,加入0.5436 g Tb(NO3)3·6H2O和200 mL乙醇,充分溶解后加入300 mg UiO-66-(COOH)2粉末,在室温下搅拌24 h,通过过滤收集白色固体。为了去除材料表面残留的Tb3+,所得固体用乙醇清洗2次。最后,将得到的固体在100 ℃下烘干24 h即可。
1.3 氨基酸识别性能研究 1.3.1 选择性实验以HEPES缓冲液(20 mmol/L,pH值为7.4)为溶剂配制浓度均为10 mmol/L的不同种类氨基酸溶液。取3 mL溶液加入4 mL的聚丙烯(PP)塑料管中,并加入3 mg Tb3+@UiO-66-(COOH)2固体样品,超声处理后在室温下陈化12 h,然后进行荧光光谱测试。实验所用的激发波长为322 nm,所用狭缝均为2.5 nm。
1.3.2 浓度影响实验用上述HEPES缓冲液作溶剂,分别配制浓度为1×10-5, 2×10-5, 4×10-5, 6×10-5, 8×10-5, 1×10-4, 1×10-3, 1×10-2, 1×10-1 mol/L的Trp氨基酸溶液。取3 mL加入3 mg的固体中,超声后陈化12 h,进行荧光光谱测试。测试条件同1.3.1。
1.3.3 动力学实验取3 mL浓度为0.01 mol/L的色氨酸溶液,加入3 mg Tb3+@UiO-66-(COOH)2,超声处理后立刻测试其荧光强度,然后每隔1 min测试其荧光强度,待荧光强度较稳定后每隔5 min测试一次荧光强度,直至荧光强度趋于稳定。测试条件同1.3.1。
1.3.4 抗干扰能力实验配制含有Trp氨基酸和另一种氨基酸的混合溶液,两种氨基酸的浓度均为0.1 mol/L。取3 mL加入3 mg Tb3+@UiO-66-(COOH)2固体中,超声后陈化12 h,进行荧光光谱测试。测试条件同1.3.1。
1.3.5 pH值影响实验以去离子水为溶剂,配制5组水溶液和5组Trp氨基酸水溶液(浓度为1×10-2 mol/L),用NaOH和盐酸溶液调节溶液pH值为2.0,4.0,6.4,8.0,10.0。取3 mL溶液加入3 mg Tb3+@UiO-66-(COOH)2固体中,超声后陈化12 h,进行荧光光谱测试。测试条件同1.3.1。
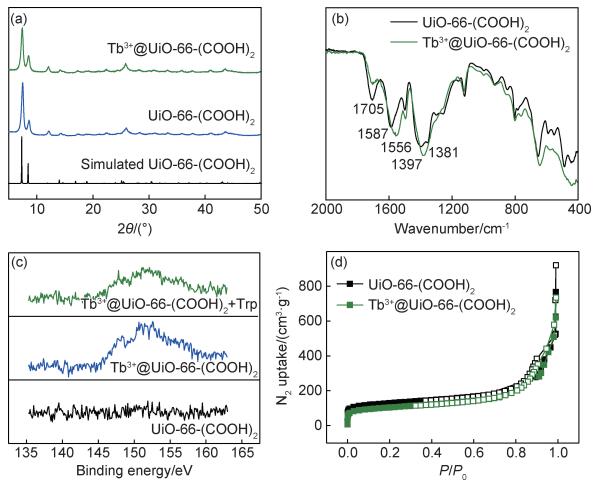
2 结果与分析 2.1 形貌与结构通过对比UiO-66-(COOH)2粉末XRD与其单晶模拟XRD谱图数据,如图 1(a)所示,发现两者的出峰位置较为一致,同时粉末XRD峰形尖锐,证明了基底材料的成功制备。在负载Tb3+之后,样品的XRD谱图并未有明显变化,说明了Tb3+@UiO-66-(COOH)2具有和原始材料相同的拓扑结构。在红外光谱中(图 1(b)),1705 cm-1处的峰对应于自由羧基的振动峰,配位羧基峰(—COO—Zr)的对称伸缩振动和不对称伸缩振动分别位于1397 cm-1和1587 cm-1,均来源于UiO-66-(COOH)2材料配体中的羧基基团;负载Tb3+后,自由羧基峰被明显削弱,同时配位羧基峰的位置也发生了明显的偏移(1556 cm-1和1381 cm-1),该结果共同表明了自由羧基和Tb3+的配位。进一步地,对比图 1(c)的XPS谱图黑线和蓝线,可以明显发现Tb3+@UiO-66-(COOH)2中含有Tb4d的峰,确认了Tb元素在样品中的存在。材料的多孔性通过77 K下氮气吸附-脱附曲线确定。经计算,UiO-66-(COOH)2的比表面积为418 m2/g,而对应于Tb3+@UiO-66-(COOH)2的数值为343 m2/g。负载Tb之后,材料仍具有良好的孔道性质。
|
图 1 材料的表征 (a)粉末和模拟XRD谱图;(b)红外光谱图;(c)Tb4d的XPS谱图;(d)77 K下N2吸附-脱附曲线图 Fig. 1 Characterization of materials (a)XRD of power and simulation; (b)FTIR spectra; (c)XPS of Tb4d region; (d)N2 adsorption-desorption isotherms at 77 K |
图 2为材料的TEM形貌图。可以看出UiO-66-(COOH)2材料由35 nm左右的不规则颗粒组成,与之前报道类似[30];负载Tb3+后(图 2(b)),材料颗粒尺寸主要分布在35~45 nm之间,且尺寸较为均匀。

|
图 2 UiO-66-(COOH)2(a)和Tb3+@UiO-66-(COOH)2(b)的TEM图 Fig. 2 TEM images of UiO-66-(COOH)2 (a) and Tb3+@UiO-66-(COOH)2 (b) |
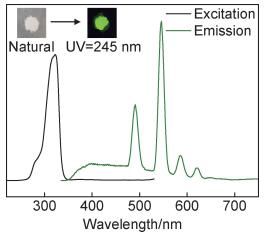
图 3为Tb3+@UiO-66-(COOH)2固体粉末的发光性质图。自然光下,UiO-66-(COOH)2和Tb3+@UiO-66-(COOH)2均为白色粉末,但在254 nm波长的紫外光照射下,Tb3+@UiO-66-(COOH)2表现为明亮的绿色荧光而前者无荧光发出。进一步利用荧光光谱仪测试固体粉末的激发光谱和发射光谱。之前的工作[31]表明UiO-66-(COOH)2的发射光谱为398 nm的宽峰,这一较弱的荧光信号源自配体的π→π*过渡[32]。经负载Tb3+之后,材料的发射光谱发生了明显的变化。在激发波长为322 nm下,共出现5个发射峰,其中400 nm处较弱的峰为有机配体(BTEC)的荧光峰;488, 544, 585, 621 nm等4处的峰均分别为归属Tb3+的不同电子能级跃迁,即5d4→7f6, 5d4→7f5, 5d4→7f4, 5d4→7f3跃迁,其中对应于最强发射峰(544 nm)的5d4→7f5跃迁是Tb3+的特征绿色荧光的主要原因。在发光机理方面,由配体向Tb3+的能量转移为材料发光的主要原因。
|
图 3 固体材料Tb3+@UiO-66-(COOH)2的激发和发射波谱(插图为自然光和254 nm紫外光照射下材料的发光性质) Fig. 3 Excitation and emission spectra of solid material Tb3+@ UiO-66-(COOH)2 (the illustration is the luminosity under natural light and 254 nm ultraviolet light) |
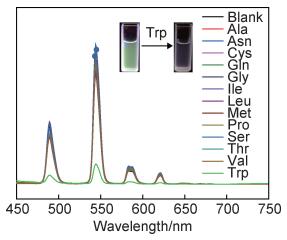
为了研究Tb3+@UiO-66-(COOH)2对氨基酸的选择性识别性能,样品分散于含有不同氨基酸的HEPES溶液中,氨基酸的种类包括Ala,Asn,Cys,Gln,Gly,Ile,Leu,Met,Pro,Ser,Thr,Val和Trp。如图 4所示,Tb3+@UiO-66-(COOH)2对不同氨基酸展现出了差异性的荧光响应,特别地,在Trp氨基酸溶液中,材料的荧光强度发生了明显的削弱,而其他氨基酸溶液的荧光降低程度较小或无降低。插图给出了样品在空白和Trp环境下的荧光实像图,可以看出,悬浊液的绿色荧光被明显淬灭。在此基础上,通过Stern-Volmer方程对氨基酸的淬灭效应进行定量分析:

|
(1) |
|
图 4 322 nm激发波长下Tb3+@UiO-66-(COOH)2在不同氨基酸溶液的荧光光谱(插图为材料在缓冲溶液和Trp溶液中的荧光实像图) Fig. 4 Fluorescence emission spectra of Tb3+@UiO-66-(COOH)2 under excitation wavelength of 322 nm in buffer solutions containing different amino acids (the illustrator is the real image of the material in blank solution and Trp solution) |
式中:I0和I分别是材料在氨基酸溶液中浸泡前后的荧光强度; C为溶液中的氨基酸浓度,0.01 mol/L;Ksv为淬灭系数, L/mol。经计算,Trp的淬灭系数为417.8 L/mol,远高于其他的氨基酸(平均为1.488 L/mol)。因此,该材料具有选择性检测Trp的潜力。
同时深入研究了不同浓度Trp氨基酸对Tb3+@UiO-66-(COOH)2的淬灭能力。图 5为不同情况下材料的荧光强度。如图 5(a)所示,随Trp浓度的升高,样品的荧光强度逐渐降低;当浓度低至10-5 mol/L时,材料的淬灭程度仍可达到30%,显示出材料对低浓度Trp响应的潜力。在浓度为10~100 μmol/L范围内,材料的荧光强度和浓度呈现良好的线性关系(图 5(b)),拟合得到的线性回归方程为I=-0.00438C+3.1695,相关系数R为0.9902。通过式(2)计算材料对Trp的检测限(limit of detection, LOD):
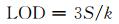
|
(2) |

|
图 5 不同情况下材料的荧光强度 (a)浓度范围为1×10-1~1×10-5 mol/L;(b)浓度范围为1×10-4~1×10-5 mol/L(线性区域);(c)时间范围0.5~135 min;(d)二元氨基酸混合溶液 Fig. 5 Intensity of Tb3+@UiO-66-(COOH)2 under various conditions (a)concentration range of 1×10-1-1×10-5 mol/L; (b)concentration range of 1×10-4-1×10-5 mol/L(linear region); (c)time range of 0.5-135 min; (d)binary amino acids solutions |
式中:S为10次空白样品荧光强度的标准偏差(0.00808);k为线性拟合方程的斜率(0.00438)。经测定、计算得到LOD为5.53 μmol/L。与其他荧光探针尤其是MOF材料相比[9-13, 23-25],该材料具有相对较好的检测限(表 1)。BTAP5和1, 8-pyrenedione虽然检测限较低,然而其适用体系为水和有机溶剂的混合液,有机相的存在限制了其在生物体内检测的应用。
| Material | Range/(μmol·L-1) | LOD/(μmol·L-1) | Solvent | Reference |
| BTAP5 | - | 0.28 | Water/DMSO | [9] |
| rGO-RhB compound | 200-2000 | 132.6 | Water | [10] |
| 1, 8-pyrenedione | 0-7 | 0.15 | Acetonitrile/Water | [11] |
| Cd(Ⅱ) carboxyphosphonates | 10-20 | - | Water | [12] |
| [Tb2(H3L)-(C2O4)3(H2O)4]·2H2O | 0-360 | 25.2 | Water | [13] |
| SUMOF-7Ⅱ | 167-500 | 167 | PBS | [23] |
| Tb(ppda)(npdc)0.5 | 0-200 | 69.9 | Water | [24] |
| Zn-Hbtc-BPY/Tb3+ | 0-196 | 15.2 | PBS (pH=7.4) | [25] |
| Tb3+@UiO-66-(COOH)2 | 10-100 | 5.53 | HEPES (pH=7.4) | This study |
进一步对Trp的荧光淬灭动力学进行了测试。如图 5(c)所示,快速的荧光淬灭发生在大约11 min,而最终的荧光强度则在35 min达到了平衡。最后,考虑到实际环境中,Trp氨基酸常和其他氨基酸共存,因此有必要调查在多元组分中的荧光响应能力。图 5(d)统计了波长在544 nm处12种其他氨基酸溶液的荧光强度,当向每份溶液中加入等量的Trp时,悬浊液的荧光强度均发生了显著的下降,且与Trp单组分体系的荧光强度较为接近。进一步反映材料具有良好选择性的同时,也体现了材料较好的抗干扰能力。
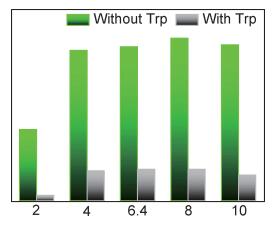
羧基和Tb3+的配位可能会受到pH值的影响,从而进一步影响材料对Trp氨基酸的检测性能。因此,为了优化检测条件,进一步研究了材料在不同pH值下的荧光检测性能。图 6为不同pH值对于Tb3+@UiO-66-(COOH)2荧光检测Trp的影响,如图 6所示,在不含Trp氨基酸的体系中,强酸溶液(pH值为2)破坏了羧基和Tb3+的结合,使材料自身发光强度明显降低。在pH值为4,6.4,8,10的水溶液中,材料的发光强度同上述缓冲液中的荧光强度类似,淬灭幅度也相似。因此,该材料可在较宽的pH值范围(4~10)内实现Trp的检测。
|
图 6 不同pH值对于Tb3+@UiO-66-(COOH)2荧光检测Trp的影响 Fig. 6 Intensity of Tb3+@UiO-66-(COOH)2 for detecting Trp under different pH values |
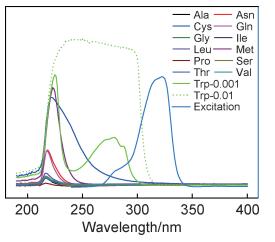
以上结果表明,Tb3+@UiO-66-(COOH)2能够选择性检测色氨酸。目前,基于镧系MOF的Trp荧光探针报道较少,检测机理仍需进一步完善。通常,待检测分子的紫外吸收光谱和荧光材料的发射或激发光谱的重叠会严重削弱材料的发光强度,这是由于被检测分子和荧光材料对紫外光的竞争或者发射光能量向被检测客体小分子转移。因此从光谱重合的角度对淬灭机理进行了探索。图 7为13种氨基酸溶液的紫外光谱图。由于材料的发射光谱远远偏离氨基酸的紫外吸收峰,因此本工作重点比对了材料的激发光谱和所测氨基酸的紫外吸收峰。
|
图 7 不同氨基酸缓冲液的紫外吸收光谱和材料的激发光谱图(除Trp外,其他氨基酸的浓度均为0.01 mol/L) Fig. 7 Ultraviolet absorption spectra of different amino acids HEPES solutions and fluorescence emission spectra of the material (the concentrations of all the amino acids solutions are 0.01 mol/L except Trp solution) |
如图 7所示,大部分氨基酸溶液(0.01 mol/L)的紫外吸收峰多集中在200~250 nm之间;Cys的吸收峰较宽,延伸至300 nm左右;而同等浓度下的色氨酸双吸收峰无法区分开来,因此进一步测定了其在0.001 mol/L浓度下的谱图,可以看出色氨酸的两个吸收峰分别位于227 nm和279 nm处。从图 7可以明显看出,色氨酸的紫外吸收谱与Tb3+@UiO-66-(COOH)2的激发光谱有很大的重合区域,意味着荧光材料和色氨酸同时对紫外光产生了强烈的竞争作用,导致Tb3+@UiO-66-(COOH)2的荧光在色氨酸溶液中发生淬灭;同时,由于半胱氨酸和材料的激发光谱也存在少量的重合区域,因此材料在Cys中的强度也有小幅的削弱;其他氨基酸的吸收峰和材料的激发峰几乎没有重合,故很难对样品的荧光产生大的淬灭作用。
3 结论(1) 通过后合成修饰法成功制备了新型荧光材料Tb3+@UiO-66-(COOH)2,材料中有机配体向Tb3+的能量转移使其在紫外灯照射下显示为绿色荧光。
(2) 在常见的多种氨基酸中,色氨酸能够灵敏地、选择性地淬灭材料的绿色荧光,检测限为5.53 μmol/L。
(3) Tb3+@UiO-66-(COOH)2用于识别色氨酸,其动力学结果表明35 min荧光淬灭达到了平衡,同时该材料还具有良好的抵抗其他氨基酸和溶液pH值干扰的能力。
(4) 检测机理为材料的荧光激发光谱和色氨酸的紫外吸收谱存在较大重合,二者对紫外光信号的竞争作用导致了荧光的淬灭。
| [1] |
FELIG P. Amino acid metabolism in man[J]. Annual Review of Biochemistry, 1975, 44(1): 933-955. DOI:10.1146/annurev.bi.44.070175.004441 |
| [2] |
JONES C L, STEVENS B M, D′ALESSANDRO A, et al. Inhibition of amino acid metabolism selectively targets human leukemia stem cells[J]. Cancer Cell, 2018, 34(5): 724-740. DOI:10.1016/j.ccell.2018.10.005 |
| [3] |
VETTORE L, WESTBROOK R L, TENNANT D A. New aspects of amino acid metabolism in cancer[J]. British Journal of Cancer, 2020, 122(2): 150-156. DOI:10.1038/s41416-019-0620-5 |
| [4] |
张将, 唐爱国. 色氨酸及其代谢产物检测的临床应用[J]. 实用预防医学, 2012, 19(4): 633-636. ZHANG J, TANG A G. Clinical application of determination of tryptophan and its metabolites[J]. Practical Preventive Medicine, 2012, 19(4): 633-636. DOI:10.3969/j.issn.1006-3110.2012.04.065 |
| [5] |
OLIVEIRA-BRETT A M, DICULESCU V C, ENACHE T A, et al. Bioelectrochemistry for sensing amino acids, peptides, proteins and DNA interactions[J]. Current Opinion in Electrochemistry, 2019, 14: 173-179. DOI:10.1016/j.coelec.2019.03.008 |
| [6] |
CREAMER J S, MORA M F, WILLIS P A. Enhanced resolution of chiral amino acids with capillary electrophoresis for biosignature detection in extraterrestrial samples[J]. Analytical Chemistry, 2017, 89(2): 1329-1337. DOI:10.1021/acs.analchem.6b04338 |
| [7] |
KASPAR H, DETTMER K, GRONWALD W, et al. Advances in amino acid analysis[J]. Analytical and Bioanalytical Chemistry, 2009, 393(2): 445-452. DOI:10.1007/s00216-008-2421-1 |
| [8] |
WANG X, HU F, ZHU L, et al. N, N′-diphenylthiourea electrochemical sensor for the detection of L-glutamate and aspartate in beef[J]. Journal of Food Science, 2020, 85(11): 3852-3857. DOI:10.1111/1750-3841.15494 |
| [9] |
WEI T B, CHEN J F, CHENG X B, et al. A novel functionalized pillar[J]. Organic Chemistry Frontiers, 2017, 4(2): 210-213. DOI:10.1039/C6QO00569A |
| [10] |
汪慧霞. 基于石墨烯-罗丹明复合物的荧光检测系统的研究[D]. 福州: 福建师范大学, 2019. WANG H X. Study on fluorescence detection system based on grapheme-rhodamine complex[D]. Fuzhou: Fujian Normal University, 2019. |
| [11] |
ZHANG Y, YAO W, LIANG D, et al. Selective detection and quantification of tryptophan and cysteine with pyrenedione as a turn-on fluorescent probe[J]. Sensor and Actuators B, 2018, 259: 768-774. DOI:10.1016/j.snb.2017.12.059 |
| [12] |
ZHAO Z, YANG D, XING B, et al. Cadmium(Ⅱ) carboxyphosphonates based on the mixed ligands: syntheses, crystal structures and recognition properties for amino acids[J]. RSC Advances, 2016, 6(95): 92175-92185. DOI:10.1039/C6RA20434A |
| [13] |
JIAO C, SUN M, LIU F, et al. Terbium oxalatophosphonate as efficient multiresponsive luminescent sensors for chromate anions and tryptophan molecules[J]. ACS Omega, 2018, 3(12): 16735-16742. DOI:10.1021/acsomega.8b02486 |
| [14] |
HIRSCHER M. Hydrogen storage by cryoadsorption in ultrahigh-porosity metal-organic frameworks[J]. Angewandte Chemie-International Edition, 2011, 50(3): 581-582. DOI:10.1002/anie.201006913 |
| [15] |
庄金亮, 刘湘粤, 杜嬛. TEMPO功能化锆基MOFs的合成及醇催化氧化性能[J]. 材料工程, 2020, 48(10): 169-175. ZHUANG J L, LIU X Y, DU H. Synthesis and alcohol catalytic properties of TEMPO functionalized Zr-based MOFs[J]. Journal of Materials Engineering, 2020, 48(10): 169-175. DOI:10.11868/j.issn.1001-4381.2020.000455 |
| [16] |
CAI W, WANG J, CHU C, et al. Metal-organic framework-based stimuli-responsive systems for drug delivery[J]. Advanced Science, 2019, 6(1): 1801526. DOI:10.1002/advs.201801526 |
| [17] |
PRAMANIK S, ZHENG C, ZHANG X, et al. New microporous metal-organic framework demonstrating unique selectivity for detection of high explosives and aromatic compounds[J]. Journal of the American Chemical Society, 2011, 133(12): 4153-4155. DOI:10.1021/ja106851d |
| [18] |
ZHAO X, ZHANG Y, HAN J, et al. Design of "turn-on" fluorescence sensor for L-Cysteine based on the instability of metal-organic frameworks[J]. Microporous and Mesoporous Materials, 2018, 268: 88-92. DOI:10.1016/j.micromeso.2018.04.019 |
| [19] |
LI Y A, ZHAO C W, ZHU N X, et al. Nanoscale UiO-MOF-based luminescent sensors for highly selective detection of cysteine and glutathione and their application in bioimaging[J]. Chemical Communications, 2015, 51(100): 17672-17675. DOI:10.1039/C5CC07783D |
| [20] |
CHANDRASEKHAR P, MUKHOPADHYAY A, SAVITHA G, et al. Remarkably selective and enantiodifferentiating sensing of histidine by a fluorescent homochiral Zn-MOF based on pyrene-tetralactic acid[J]. Chemical Science, 2016, 7(5): 3085-3091. DOI:10.1039/C5SC03839A |
| [21] |
XIA T, WAN Y, LI Y, et al. Highly stable lanthanide metal-organic framework as an internal calibrated luminescent sensor for glutamic acid, a neuropathy biomarker[J]. Inorganic Chemistry, 2020, 59(13): 8809-8817. DOI:10.1021/acs.inorgchem.0c00544 |
| [22] |
JI G, ZHENG T, GAO X, et al. A highly selective turn-on luminescent logic gates probe based on post-synthetic MOF for aspartic acid detection[J]. Sensors and Actuators B: Chemical, 2019, 284: 91-95. |
| [23] |
ABDELHAMID H, BERMEJO-GÓMEZ A, MARTÍN-MATUTE B. A water-stable lanthanide metal-organic framework for fluorimetric detection of ferric ions and tryptophan[J]. Microchimica Acta, 2017, 184(9): 3363-3371. DOI:10.1007/s00604-017-2306-0 |
| [24] |
LI Z, ZHAN Z, HU M. A luminescent terbium coordination polymer as a multifunctional water-stable sensor for detection of Pb2+ ions, PO43- ions, Cr2O72- ions, and some amino acids[J]. CrystEngComm, 2020, 22(40): 6727-6737. DOI:10.1039/D0CE01101K |
| [25] |
PAN H, XU S, NI Y. Rare-earth post-modified Zn-based coordination polymer microspheres: simple room-temperature preparation, fluorescent performances and application for detection of tryptophane[J]. Sensors and Actuators B, 2019, 283: 731-739. DOI:10.1016/j.snb.2018.12.044 |
| [26] |
LI L, SHEN S, AI W, et al. Facilely synthesized Eu3+ post-functionalized UiO-66-type metal-organic framework for rapid and highly selective detection of Fe3+ in aqueous solution[J]. Sensors and Actuators B, 2018, 267: 542-548. DOI:10.1016/j.snb.2018.04.064 |
| [27] |
LI Y A, REN S K, LIU Q K, et al. Encapsulation and sensitization of UV-vis and near infrared lanthanide hydrate emitters for dual- and bimodal-emissions in both air and aqueous media based on a porous heteroatom-rich Cd(Ⅱ)-framework[J]. Inorganic Chemistry, 2012, 51(18): 9629-9635. DOI:10.1021/ic300665a |
| [28] |
XU X Y, BING Y. Eu(Ⅲ) functionalized Zr-based metal-organic framework as excellent fluorescent probe for Cd2+ detection in aqueous environment[J]. Sensors and Actuators B: Chemical, 2016, 222: 347-353. DOI:10.1016/j.snb.2015.08.082 |
| [29] |
YANG Q, VAESEN S, RAGON F, et al. A water stable metal-organic framework with optimal features for CO2 capture[J]. Angewandte Chemie-International Edition, 2013, 52(39): 10316-10320. DOI:10.1002/anie.201302682 |
| [30] |
HU Z, KHURANA M, SEAH Y H, et al. Ionized Zr-MOFs for highly efficient post-combustion CO2 capture[J]. Chemical Engineering Journal, 2014, 124: 61-69. |
| [31] |
ZHAO X, LIU D, HUANG H, et al. Highly selective and sensitive metal-organic framework fluorescent probe for Cu2+ through rational design of binding sites[J]. Microporous and Mesoporous Materials, 2016, 224: 149-154. DOI:10.1016/j.micromeso.2015.11.042 |
| [32] |
HAO J N, YAN B. A water-stable lanthanide-functionalized MOF as a highly selective and sensitive fluorescent probe for Cd2+[J]. Chemical Communications, 2015, 51(36): 7737-7740. DOI:10.1039/C5CC01430A |
 2021, Vol. 49
2021, Vol. 49


