文章信息
- 宋鹏, 姜祥伟, 吴俊杰, 卢玉章, 董加胜, 楼琅洪
- SONG Peng, JIANG Xiang-wei, WU Jun-jie, LU Yu-zhang, DONG Jia-sheng, LOU Lang-hong
- DD421单晶高温合金在无SOx气氛下的低温热腐蚀硫化行为
- Sulfidation behavior in low-temperature hot corrosion of single crystal superalloy DD421 without SOx atmosphere
- 材料工程, 2021, 49(6): 109-115
- Journal of Materials Engineering, 2021, 49(6): 109-115.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000335
-
文章历史
- 收稿日期: 2020-04-17
- 修订日期: 2020-10-14
2. 中国科学院 金属研究所, 沈阳 110016
2. Institute of Metal Research, Chinese Academy of Sciences, Shenyang 110016, China
由于燃料或环境因素而沉积在高温热端部件表面上的腐蚀性沉积物,在氧和其他腐蚀性气体共同作用下致使部件表面发生加速腐蚀的现象称为热腐蚀。燃气轮机所用的燃料中通常含有多种杂质污染物(例如S,Cl,Na,K等);此外,大气中也可能存在其他污染物(例如海洋环境下大气中含有NaCl),这些污染物的存在使得燃机热端部件表面极易发生热腐蚀[1]。热腐蚀能够给燃机热端部件造成严重的侵害,其作用机理通常与热腐蚀温度有关[2-5]。由表面熔融Na2SO4(Tm=884 ℃)或NaCl (Tm=801 ℃)诱发的高温热腐蚀(又称Ⅰ型热腐蚀)通常发生在900~1000 ℃[5-8]。Ⅱ型热腐蚀也就是人们所熟知的低温热腐蚀通常发生在600~750 ℃。自从20世纪80年代被首次发现以来,Ⅱ型热腐蚀被普遍认为也是一种由熔融硫酸盐侵蚀高温部件的过程[9-14]。据文献报道,燃机叶片上服役温度较低的无涂层的部位,例如叶根区域,在700 ℃的低温和流动的O2-SO2-SO3气氛中,Na2SO4的出现会导致其遭受严重的热腐蚀。当叶片在海洋环境下服役时更易发生这种热腐蚀现象。此外,人们普遍认为当环境中不满足最低SOx分压时,Ⅱ型低温热腐蚀是不可能发生的[9, 12, 14]。
当存在Na2SO4腐蚀介质时,硫的侵入以及硫与合金元素的硫化反应通常是高温透平叶片发生热腐蚀损伤的主要原因[15]。在Ⅰ型高温热腐蚀中,熔融硫酸盐释放的硫元素侵入合金基体并引发合金内硫化。而Ⅱ型低温热腐蚀则是在SOx气氛作用下形成的熔融共晶Na2SO4-MSO4(M代表Ni或Co)导致的合金表面热腐蚀损伤(典型特征为局部点蚀)。综上所述,无论是在高温还是低温热腐蚀中硫化反应都是由熔融硫酸盐引发的。
然而,根据其他有关低温热腐蚀的研究,Lortrakul等[14]和Zhang等[16]分别从模拟热腐蚀实验中以及发生了真实腐蚀损伤的服役部件上发现了一种有关固态腐蚀过程的新现象。Zhang等研究发现,从正在服役的发动机零件上取下来的试样中能观察到典型的Ⅱ型热腐蚀坑,但腐蚀坑中的腐蚀产物主要由纳米级的硫化物和氧化物组成,而不是设想的共晶硫酸盐。Zhang等的研究认为:这一新现象表明硫化也可以直接通过固态反应进行,并将这一固态腐蚀过程描述为细小的硫化物和氧化物在合金腐蚀前沿协同共沉淀的过程[16],但其对固态腐蚀行为的详细机理解释得还不够清楚,特别是在不满足最低SOx分压时固态腐蚀硫化过程能否发生目前尚不清楚。
为了进一步研究不满足最低SOx分压时,固态Na2SO4盐是否也能够引发硫化行为,本工作在750 ℃无SOx的大气环境下分别对第二代镍基单晶高温合金DD421在熔融盐(90%Na2SO4+10%NaCl,质量分数,下同)和固态盐(纯Na2SO4)两种不同腐蚀介质中的硫化行为进行了对比研究,并结合热力学和微观组织分析对该类型的固态硫化反应机制进行了讨论。
1 实验材料与方法实验材料为中国科学院金属研究所自行研制的第二代镍基单晶高温合金DD421,该合金名义成分见表 1。首先采用金属所自行研制的高速凝固(HRS)设备制备尺寸为ϕ16 mm×220 mm的单晶合金试棒,随后对试棒进行标准热处理。利用电火花线切割机将标准热处理后的单晶试棒加工成20 mm×10 mm×1.5 mm的片状试样(其中样品轴向方向平行于试棒的〈001〉方向)。然后利用水砂纸将所有试片的表面打磨至800#,并进行倒角处理,再使用酒精和丙酮对试片进行超声清洗(清洗时间不低于5 min)并烘干。
| Cr | Co | Al | Ti | Re | Mo | W | Ta | Ni |
| 8.5 | 8.0 | 4.4 | 2.8 | 2.5 | 0.5 | 4.5 | 5.5 | Bal |
采用涂盐法进行热腐蚀性能实验。首先将清洗后的样品吹干后称重并记录每个试片的原始质量,然后将配制好的饱和Na2SO4溶液或90%Na2SO4+10%NaCl混合盐饱和溶液均匀涂覆于试片表面,涂盐量均控制在0.5 mg/cm2。混合盐中10%NaCl是为了保证在本实验温度下合金表面能够形成液态Na2SO4盐。用Ni-Cr丝将表面涂盐的试片悬挂于专用的悬挂架上,不同腐蚀介质下所用的悬挂架不能混用。随后将悬挂架连同试片放入750 ℃的箱式电阻炉中。为了避免混合盐对纯Na2SO4盐腐蚀气氛的污染,涂覆有不同盐类的合金试片须分别放入两个电阻炉中。合金试片在电阻炉中保温20 h后记为一个周次的热腐蚀实验,然后将试片从炉中取出并用沸水洗涤以去除表面残留的盐。将试片去盐烘干后进行称重,记录质量变化并检查表面状态,随后重新涂盐进行下一周次的热腐蚀实验。每种测试条件均采用3个平行试样。
利用配备有能谱(EDS)的S-3400型扫描电子显微镜(SEM)观察分析抛光后的试样腐蚀截面,采用X射线衍射仪(XRD)和EDS来鉴定腐蚀产物类型及定性分析腐蚀试样的截面元素分布。
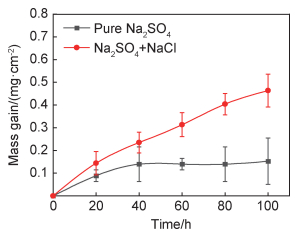
2 实验结果 2.1 热腐蚀动力学图 1为750 ℃条件下合金在两种不同腐蚀介质中的热腐蚀动力学曲线。涂覆混合盐的合金在整个腐蚀过程中,其热腐蚀动力学曲线基本符合抛物线规律,而涂覆纯盐的合金仅在40 h前呈现微小幅度的增重,随后合金增重基本保持恒定。很明显,在熔融盐腐蚀介质中合金具有更高的腐蚀增重速率,而表面涂覆固态盐的合金在整个热腐蚀过程中的增重非常小。热腐蚀100 h后涂覆有混合盐的合金平均增重约为0.47 mg/cm2,涂覆纯盐的合金平均增重约为0.15 mg/cm2。
|
图 1 涂覆有Na2SO4+NaCl混合盐和纯Na2SO4盐的实验合金在750℃时的热腐蚀动力学曲线 Fig. 1 Hot corrosion kinetics curves for the experimental alloys coated with mixtures of Na2SO4+NaCl salt and pure Na2SO4 salt corroded at 750 ℃ |
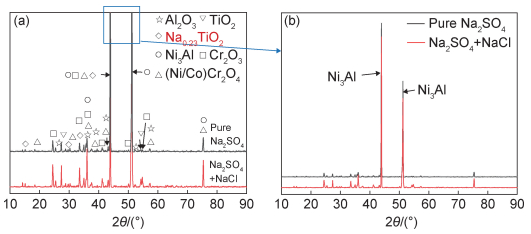
实验合金在750 ℃下两种不同腐蚀介质环境中热腐蚀100 h后的表面宏观形貌如图 2所示,可以明显看出:相比于涂覆纯盐的合金试样(见图 2(b)),涂覆混合盐的合金试样表面(见图 2(a))腐蚀程度更加严重,腐蚀表面形貌不平整,这也与图 1的热腐蚀动力学曲线相一致。对实验合金在750 ℃下不同腐蚀介质中热腐蚀100 h后的表面腐蚀产物进行XRD分析,结果如图 3所示。从图 3(a)中可以看出,涂覆有两种不同成分盐的合金在热腐蚀100 h后腐蚀产物几乎一致,都形成了典型的以Al2O3, Cr2O3和TiO2为主的氧化物,此外,还探测到了一定量的(Ni/Co)Cr2O4尖晶石。值得注意的是,在两种不同腐蚀介质中合金均无复杂腐蚀产物生成,并且相比于固态盐环境,在熔融盐环境下合金的表面腐蚀产物所测得衍射峰更强。而如图 3(b)所示,固态纯盐腐蚀介质下合金Ni3Al基体的主峰相比于在熔融盐环境下具有相对更强的衍射强度,这可以初步说明固态纯盐腐蚀介质下合金的腐蚀层厚度更小。

|
图 2 表面涂覆有混合盐(a)和纯Na2SO4盐(b)的实验合金在750 ℃时热腐蚀100 h后的表面宏观形貌 Fig. 2 Macroscopic morphologies of the experimental alloys coated with mixed salt (a) and pure Na2SO4 salt (b) after hot corrosion at 750 ℃ for 100 h |
|
图 3 涂覆有Na2SO4+NaCl混合盐和纯Na2SO4盐的实验合金在750 ℃时热腐蚀100 h后的腐蚀产物XRD谱图 (a)腐蚀产物XRD谱图;(b)Ni3Al的XRD完整谱图对比 Fig. 3 XRD patterns of the corrosion products of the experimental alloys coated with mixtures of Na2SO4+NaCl salt and pure Na2SO4 salt after hot corrosion at 750 ℃ for 100 h (a)XRD patterns of corrosion products; (b)comparison of complete XRD patterns of Ni3Al |
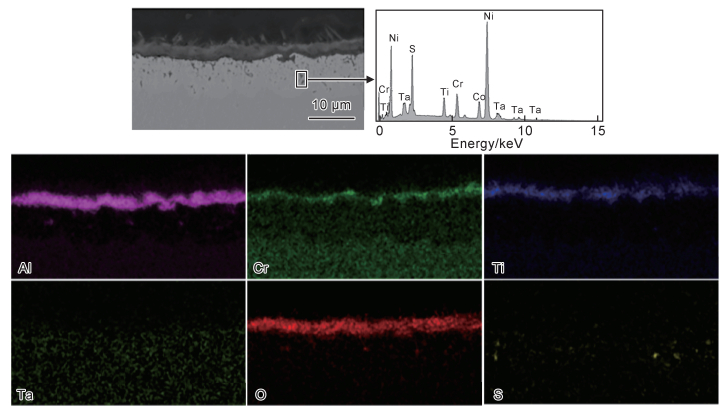
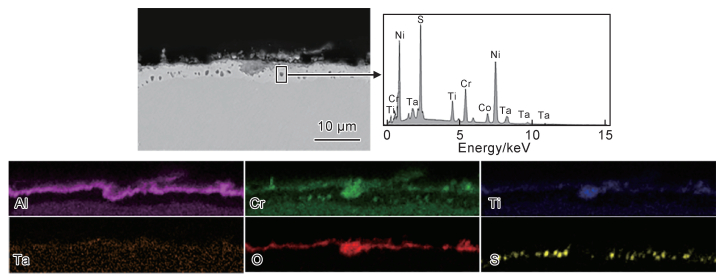
图 4为实验合金在750 ℃下不同腐蚀介质中热腐蚀100 h后的截面形貌图,图 5与图 6则分别为表面涂覆混合盐和纯Na2SO4盐的实验合金热腐蚀100 h后的截面EDS分析结果。可以看出涂覆有两种不同成分盐的合金其截面腐蚀产物基本相同,这与XRD分析结果(图 3)相一致。合金在热腐蚀后均形成了典型的热腐蚀三层结构,即以Cr2O3和TiO2为主的外氧化层,内Al2O3层及内硫化层。经EDS分析(见图 5和图 6)合金在不同腐蚀介质中的内硫化物种类也几乎一致,都包含了Ni, Cr, Ti的硫化物。特别值得注意的是,在固态盐环境下合金内部也生成了硫化物,且硫化物相比熔融盐环境下(约0.1 μm)具有更大的尺寸(约0.7 μm)。对不同腐蚀介质中的合金截面氧化层及内硫化层厚度进行统计,可以得出固态盐环境下氧化层厚度(约2.3 μm)及硫化层厚度(约2.1 μm)明显比在熔融盐环境下形成的氧化层(约4.9 μm)及硫化层(11.1 μm)薄。

|
图 4 涂覆有混合盐(a)和纯Na2SO4盐(b)的实验合金在750 ℃时热腐蚀100 h后的截面形貌 Fig. 4 Cross-section morphologies of the experimental alloys coated with mixed salt (a) and pure Na2SO4 salt (b) after hot corrosion at 750 ℃ for 100 h |
|
图 5 涂覆有混合盐的合金热腐蚀100 h后的截面EDS分析结果 Fig. 5 Cross-sectional EDS analysis results of alloy coated with mixed salt after 100 h of hot corrosion |
|
图 6 涂覆有纯Na2SO4盐的合金热腐蚀100 h后的截面EDS分析结果 Fig. 6 Cross-sectional EDS analysis results of alloy coated with pure Na2SO4 salt after 100 h of hot corrosion |
根据合金表面XRD(见图 3(a))及截面EDS(见图 5和图 6)分析结果,可以看出合金在不同腐蚀介质环境下热腐蚀100 h后腐蚀产物都以典型的简单氧化物为主,如Al2O3, Cr2O3和TiO2。利用HSC Chemistry® version 6.0软件计算合金所含元素在750 ℃下发生氧化的标准吉布斯自由能,结果如表 2所示。从计算结果可以看出合金中Al, Ti, Ta, Cr均为强氧化物形成元素,在热力学上更易发生氧化。但氧化反应不仅受热力学因素影响,动力学因素(如元素含量)也能影响合金中的氧化反应。Ta相比于Cr虽然在热力学上更易氧化,但合金中Ta含量小于Cr元素的含量,Ta发生氧化在动力学上处于劣势。研究表明,根据多元合金选择性氧化的规律及合金元素与氧亲和力的大小,只有当合金中产生偏析或局部氧过剩时才会发生Ta元素的氧化[17-18]。表面XRD(见图 3(a))及截面EDS(见图 5和图 6)分析结果已经表明合金热腐蚀100 h后并未生成明显的Ta的氧化物而是探测到了较多的Cr2O3,这是因为在Ta与Cr竞争氧化的过程中动力学因素起了主导作用。因此,在热力学和动力学因素共同影响的情况下,合金热腐蚀100 h后仅生成了Al, Cr, Ti这些强氧化物形成元素对应的氧化物。
| Reaction | ΔG750 ℃ /(kJ·mol-1) |
| 4/3Al+O2(g)=2/3Al2O3 | -902.217 |
| Ti+O2(g)=TiO2 | -758.600 |
| 4/5Ta+O2(g)=2/5Ta2O5 | -638.328 |
| 4/3Cr+O2(g)=2/3Cr2O3 | -577.017 |
| 2/3W+O2(g)=2/3WO3 | -386.706 |
| 2/3Mo+O2(g)=2/3MoO3 | -325.109 |
| 2Co+O2(g)=2CoO | -323.841 |
| 2Ti+O2(g)=2TiO | -293.110 |
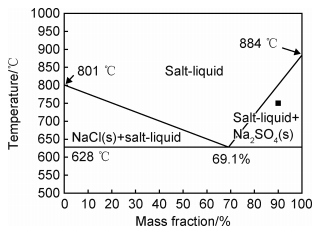
图 7为NaCl-Na2SO4体系的简化相图[19]。可以看出NaCl的加入降低了Na2SO4的熔点,含有10%NaCl的混合盐在750 ℃时为液固混合态,即存在熔融态Na2SO4盐。合金表面一旦存在熔融态腐蚀盐便会遭受典型的Ⅰ型热腐蚀,即液相侵蚀。在熔融盐环境下,以下反应均有可能发生[20]:
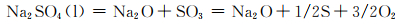
|
(1) |
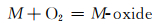
|
(2) |
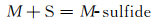
|
(3) |
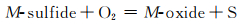
|
(4) |
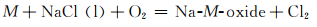
|
(5) |

|
(6) |
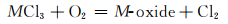
|
(7) |
因此,在热腐蚀初期合金中的硫化、氧化以及氯化反应处于竞争的状态,随着热腐蚀的进行最终某一反应会成为主导反应。在熔融盐环境中,来自大气中的O以及熔融Na2SO4释放的S会同时侵入合金基体并在内部各自形成自己的浓度梯度,当合金基体中某个区域的氧分压低于一临界值时硫化物便会在此生成[21-22]。由于金属原子在硫化物中的扩散速率要远高于其在氧化物中的扩散速率,因而硫化物的形成将使得热腐蚀加速[22-23]。
值得注意的是,合金表面混合盐中的NaCl也为液相,已有大量的研究表明NaCl在腐蚀初始阶段能够溶解合金的氧化皮并造成严重的腐蚀损害[12, 21, 24]。但事实上,本实验中合金热腐蚀100 h后表面的氧化层依然相对较为致密,这可能是由于混合盐中的NaCl含量少以及NaCl的易挥发性[21]导致液固混合盐很快转变为固态Na2SO4,因此在本实验中NaCl直接带来的腐蚀影响基本可以忽略。
3.3 固态盐环境下的热腐蚀从图 7中可以看到Na2SO4的熔点为884 ℃,因此本实验中纯Na2SO4盐在750 ℃条件下为固态。然而,合金表面在液态盐缺失的情况下其腐蚀前沿依然形成了大量的硫化物,这说明固态Na2SO4盐中的硫化行为是热腐蚀硫化物形成的重要来源之一。根据合金表面XRD(见图 3(a))及截面EDS(见图 5和图 6)分析结果,合金在固态盐环境下生成的氧化物主要以Al2O3, Cr2O3和TiO2为主。而合金热腐蚀中的氧化反应势必与硫化反应存在竞争关系。因此,为了探究固态Na2SO4盐中可能存在的硫化反应,针对主要氧化物形成元素Al/Cr/Ti,利用HSC Chemistry® version 6.0软件计算出了750 ℃时这些强氧化物形成元素及其氧化物与固态Na2SO4反应的标准吉布斯自由能,结果如表 3所示。由表 3可见,合金元素(Al/Cr/Ti)在750 ℃时可以自发地与固态Na2SO4反应,即本实验温度下合金元素与固态盐的直接反应是可以发生的。而本实验在无SOx气氛的大气环境下,涂覆有固态盐的合金经过100 h热腐蚀后其内部形成了明显的硫化物(见图 4(b)和图 6),而其中S的来源只能靠固态Na2SO4盐提供。这一结果证实了在无SOx气氛的大气环境下合金元素能够与固态Na2SO4盐发生反应,进而证实热腐蚀能够通过固态反应进行。
| Reaction | ΔG750 ℃ /(kJ·mol-1) |
| 8/3Al+2O2(g)=4/3Al2O3 | -1804.434 |
| 2Ti+2O2(g)=2TiO2 | -1517.200 |
| 8/3Cr+2O2(g)=4/3Cr2O3 | -1154.033 |
| 8/3Al+Na2SO4(s)=4/3Al2O3+Na2S(l) | -1122.107 |
| 2Ti+Na2SO4(s)=2TiO2+Na2S(l) | -834.874 |
| 8/3Cr+Na2SO4(s)=4/3Cr2O3+Na2S(l) | -471.707 |
| Al2O3+Na2SO4(s)=2NaAlO2+SO3(g) | 236.950 |
| 6TiO2+Na2SO4(s)=Na2Ti6O13+SO3(g) | 154.692 |
| Cr2O3+Na2SO4(s)=Na2Cr2O4+SO3(g) | 325.647 |
利用HSC Chemistry® version 6.0软件计算同等摩尔量的合金元素(Al/Cr/Ti)在750 ℃下的氧化反应吉布斯自由能得到的结果也列于表 3中。可以看出合金元素发生氧化的驱动力要比同固态盐反应的驱动力更强,这表明合金元素更容易参与氧化而不是与固态盐反应。然而,由于合金表面预先沉积了一层致密的固态盐膜,在一定程度上阻碍了合金与O2的接触,因此在腐蚀初始阶段氧化与固态硫化反应能够同时进行。图 8为750 ℃条件下涂覆纯Na2SO4盐的合金腐蚀过程示意图。将涂盐试片放入电阻炉中后,在热腐蚀初始阶段,合金表面氧化与固态硫化反应将会同时加速进行。随着表面氧化物的不断生成长大最终合金形成一层覆盖表面的氧化层。氧化层的形成进一步抑制了合金的氧化,同时氧化层内含有的大量微裂纹以及氧化物晶界可以作为合金元素向外扩散和硫元素向内扩散的快速通道,使得固态硫化反应继续进行。固态硫化反应产生的S穿过氧化膜侵入合金基体继续向内部扩散,并在内部建立一定的浓度梯度。当S扩散至氧分压足够低的区域时便同Ni/Cr/Ti等元素反应形成硫化物。随着反应的不断进行,氧化层不断增厚,元素通过氧化膜的扩散变得越来越困难,这进一步抑制了合金氧化与固态硫化。因而随着实验的进行,合金增重速率逐渐降低,后期增重几乎不变。

|
图 8 750 ℃时涂覆固态Na2SO4盐的合金腐蚀过程相关反应示意图 (a)腐蚀初始阶段;(b)氧化膜形成后期阶段 Fig. 8 Schematic diagram of the reactions during corrosion process of alloy with pre-coated solid Na2SO4 salt corroded at 750 ℃ (a)at the beginning of corrosion; (b)at the later stage of oxide layer formation |
此外,从图 4中可以看出纯Na2SO4盐介质中合金的腐蚀层明显比熔融混合盐介质中的腐蚀层更薄,这就使得在固态盐环境下通过固态硫化反应产生的S侵入基体后容易在较窄扩散区的腐蚀前沿发生积聚,因此该区域S元素的浓度较高,促使硫化物不断长大,最终导致其尺寸明显超过在熔融盐环境下同时期的硫化物。
4 结论(1) 在750 ℃熔融盐环境下合金中的硫化反应主要由液相熔融盐侵蚀所导致。热腐蚀100 h后合金主要的腐蚀产物为典型的氧化物(Al2O3, Cr2O3, TiO2)以及Ni/Cr/Ti的硫化物。相比于固态盐环境,合金在熔融盐环境下遭受了更严重的热腐蚀。
(2) 在750 ℃纯Na2SO4固态盐环境下,合金热腐蚀100 h后其腐蚀产物与混合盐实验中的产物基本相同,但其腐蚀层厚度相对更薄,硫化物尺寸相对更大。结合热力学和微观组织分析,本研究在低温热腐蚀中发现了一种新的固态硫化反应,明确了在无SOx气氛的腐蚀环境下合金元素能够与固态Na2SO4盐发生硫化反应。
| [1] |
ELIAZ N, SHEMESH G, LATANISION R M. Hot corrosion in gas turbine components[J]. Engineering Failure Analysis, 2002, 9(1): 31-43. DOI:10.1016/S1350-6307(00)00035-2 |
| [2] |
张莹, 高博, 王磊, 等. 一种新型钴基高温合金在900 ℃熔融NaCl中的热腐蚀行为[J]. 材料工程, 2018, 46(8): 134-139. ZHANG Y, GAO B, WANG L, et al. Hot corrosion behavior of a novel Co-base superalloy in molten NaCl at 900 ℃[J]. Journal of Materials Engineering, 2018, 46(8): 134-139. |
| [3] |
李萍, 秦鹏, 赵杰, 等. 涂覆Na2SO4-25%NaCl盐膜的Super304H的热腐蚀行为[J]. 材料工程, 2016, 44(2): 69-74. LI P, QIN P, ZHAO J, et al. Hot corrosion behavior of Super304H coated Na2SO4-25%NaCl film[J]. Journal of Materials Engineering, 2016, 44(2): 69-74. |
| [4] |
BOURHIS Y, JOHN C S. Na2SO4- and NaCl-induced hot corrosion of six nickel-base superalloys[J]. Oxidation of Metals, 1975, 9(6): 507-528. DOI:10.1007/BF00603857 |
| [5] |
DEB D, IYER S R, RADHAKRISHNAN V M. A comparative study of oxidation and hot corrosion of a cast nickel base superalloy in different corrosive environments[J]. Materials Letters, 1996, 29(1/3): 19-23. |
| [6] |
GURRAPPA I. Hot corrosion behavior of CM 247 LC alloy in Na2SO4 and NaCl environments[J]. Oxidation of Metals, 1999, 51(5/6): 353-382. DOI:10.1023/A:1018831025272 |
| [7] |
WENG F, YU H, WAN K, et al. The influence of Nb on hot corrosion behavior of Ni-based superalloy at 800 ℃ in a mixture of Na2SO4-NaCl[J]. Journal of Materials Research, 2014, 29(21): 2596-2603. DOI:10.1557/jmr.2014.282 |
| [8] |
KAMAL S, SHARMA K V, ABDUL-RANI A M. Hot corrosion behavior of superalloy in different corrosive environments[J]. Journal of Minerals and Materials Characterization and Engineering, 2015, 3: 26-36. DOI:10.4236/jmmce.2015.31004 |
| [9] |
CHIANG K T, PETTIT F S, MEIER G H. Low temperature hot corrosion[C]//High Temperature Corrosion.Proceedings of the International Conference. San Diego: National Association of Corrosion Engineers, 1983: 519-530.
|
| [10] |
LUTHRA K L. Low-temperature hot corrosion of cobalt-base alloys: Ⅰ morphology of the reaction-product[J]. Metallurgical and Materials Transactions A, 1982, 13(10): 1843-1852. DOI:10.1007/BF02647841 |
| [11] |
LUTHRA K L. Low-temperature hot corrosion of cobalt-base alloys: Ⅱ reaction-mechanism[J]. Metallurgical and Materials Transactions A, 1982, 13(10): 1853-1864. DOI:10.1007/BF02647842 |
| [12] |
PETTIT F. Hot corrosion of metals and alloys[J]. Oxidation of Metals, 2011, 76(1/2): 1-21. DOI:10.1007/s11085-011-9254-6 |
| [13] |
SUMNER J, ENCINAS-OROPESA A, SIMMS N J, et al. Type Ⅱ hot corrosion: kinetics studies of CMSX-4[J]. Oxidation of Metals, 2013, 80(5/6): 553-563. DOI:10.1007/s11085-013-9395-x |
| [14] |
LORTRAKUL P, TRICE R W, TRUMBLE K P, et al. Investigation of the mechanisms of Type-Ⅱ hot corrosion of superalloy CMSX-4[J]. Corrosion Science, 2014, 80: 408-415. DOI:10.1016/j.corsci.2013.11.048 |
| [15] |
KAI W, LEE C, LEE T, et al. Sulfidation behavior of Inconel 738 superalloy at 500-900 ℃[J]. Oxidation of Metals, 2001, 56(1/2): 51-71. DOI:10.1023/A:1010391319073 |
| [16] |
ZHANG W J, SHARGHI-MOSHTAGHIN R. Revisit the type Ⅱ corrosion mechanism[J]. Metallurgical and Materials Transactions A, 2018, 49(9): 4362-4372. DOI:10.1007/s11661-018-4755-4 |
| [17] |
徐仰涛, 沙岐振, 夏天东. 钽含量对Co-Al-W合金强化相和高温氧化行为的影响[J]. 中国有色金属学报, 2016, 26(2): 302-309. XU Y T, SHA Q Z, XIA T D. Effects of tantalum content on strengthening phase and high temperature oxidation behavior of Co-Al-W superalloy[J]. The Chinese Journal of Nonferrous Metals, 2016, 26(2): 302-309. |
| [18] |
赵双群, 董建新, 张麦仓, 等. 新型镍基高温合金在950 ℃和1000 ℃的氧化行为[J]. 稀有金属材料与工程, 2005, 34(2): 208-211. ZHAO S Q, DONG J X, ZHANG M C, et al. Oxidation behaviors of new Ni-based superalloy at 950 ℃ and 1000 ℃[J]. Rare Metal Materials and Engineering, 2005, 34(2): 208-211. DOI:10.3321/j.issn:1002-185X.2005.02.009 |
| [19] |
COOK L, McMURDIE H. Phase diagrams for ceramists:vol Ⅶ[M]. Westerville: the American Ceramic Society, 1989: 118.
|
| [20] |
GOEBEL J A, PETTIT F S. Na2SO4-induced accelerated oxidation (hot corrosion) of nickel[J]. Metallurgical Transactions, 1970, 1(7): 1943-1954. DOI:10.1007/BF02642794 |
| [21] |
TSAUR C C, ROCK J C, WANG C J, et al. The hot corrosion of 310 stainless steel with pre-coated NaCl/Na2SO4 mixtures at 750 ℃[J]. Materials Chemistry and Physics, 2005, 89(2/3): 445-453. |
| [22] |
CHANG J X, WANG D, LIU T, et al. Role of tantalum in the hot corrosion of a Ni-base single crystal superalloy[J]. Corrosion Science, 2015, 98: 585-591. DOI:10.1016/j.corsci.2015.05.066 |
| [23] |
HOLT A, KOFSTAD P. High temperature corrosion of iron in O2+4%SO2/SO3 at 500-800 ℃[J]. Materials Science and Engineering: A, 1989, 120/121: 101-104. DOI:10.1016/0921-5093(89)90725-9 |
| [24] |
CHEN Z, DONG T, QU W, et al. Influence of Cr content on hot corrosion and a special tube sealing test of single crystal nickel base superalloy[J]. Corrosion Science, 2019, 156: 161-170. DOI:10.1016/j.corsci.2019.05.001 |
 2021, Vol. 49
2021, Vol. 49