文章信息
- 刘宸希, 康红军, 吴金珠, 曹宁宁, 吴晓宏
- LIU Chen-xi, KANG Hong-jun, WU Jin-zhu, CAO Ning-ning, WU Xiao-hong
- 3D打印技术及其在医疗领域的应用
- 3D printing and its application in the field of medicine
- 材料工程, 2021, 49(6): 66-76
- Journal of Materials Engineering, 2021, 49(6): 66-76.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.001042
-
文章历史
- 收稿日期: 2019-11-13
- 修订日期: 2020-02-28
3D打印又称增材制造(AM),是一种以三维(3D)模型数据为基础,运用粉末状金属或塑料等可黏合材料,制造具有多级结构或复杂几何形状产品的技术[1]。作为一种快速发展且极具潜力的新型成型技术,3D打印技术在医学、航天、汽车和食品领域均具有广泛的应用。例如,3D打印膝关节半月板、心脏瓣膜,嫦娥四号卫星上搭载了多个3D打印铝合金构件,3D打印低速电动车,3D打印糖果、巧克力、寿司等。此外,在文化遗产保护和修复领域,也有3D打印技术的身影。例如,英国梅得斯通博物馆的研究人员利用3D打印技术重塑了2500年前木乃伊的脸部;来自哈佛大学和牛津大学的研究人员将3D打印技术应用于修复被ISIS组织摧毁的贝尔神庙等。
尽管3D打印技术应用范围很广,但是目前在生物医学领域的应用较多。1993年,麻省理工学院(MIT)获得基于喷墨打印原理的3D打印技术专利,此后MIT一直走在生物3D打印技术的前沿,领军人物是Robert Langer教授。国外在此领域较为出色的研究人员还有苏黎世联邦理工学院的Andre R. Studart教授,哈佛大学的Jennifer A. Lewis教授,加州大学洛杉矶分校的Ali Khademhosseini教授和康涅狄格大学的Savas Tasoglu教授等。
我国在生物3D打印领域的研究起步较晚,但是发展十分迅猛。目前以清华大学颜永年教授和刘冬生教授,西安交通大学卢秉桓院士,上海交通大学王成焘教授,浙江大学贺永教授和四川大学康裕建教授等为主要代表的科研团队,推动了我国医疗领域3D打印技术的发展。本综述主要介绍了3D打印技术在医疗领域的研究进展,系统展示了可用于3D打印医用材料以及3D打印技术在医疗领域的应用。最后,我们总结了3D打印技术在生物医学领域的应用前景和面临的挑战。
1 3D打印技术原理及分类1986年,Charles Hull[2]在立体光刻工艺的基础上开发了3D打印技术。3D打印技术的核心原理是“分层制造,逐层叠加”,打印过程主要分为5个部分:一是设计,利用计算机辅助设计软件(SolidWorks,AutoCAD和ZBrush等)设计数字3D打印对象;二是保存,将设计好的3D打印对象以3D打印机可读文件格式保存,常见的通用文件格式有立体光刻(STL)文件和虚拟现实建模语言(VRML);三是导入,将保存好的文件导入到3D打印机中;四是打印,针对原材料特性以及产品要求,选择合适的丝材,设置打印温度、速度和压力等相关参数;五是后处理,打印结束后对产品表面进行处理。
作为快速成型技术,一台3D打印机可以完成整个制造过程,工艺更为简化。3D打印技术适于小批量、具有复杂结构产品的生产,传统制造方式则专注于生产大规模、需要量产的部件,因此3D打印技术与传统制造技术可优势互补,共同推进现代制造业向智能化、数字化与网络化制造转型。近年来,3D打印技术不断发展,现已形成包括挤出成型、材料烧结和材料黏合等多种类3D打印技术,如表 1[3-11]所示。
| Principle | Technical term | Printing process | Applicable materials |
| Extrusion printing | Fused deposition modeling(FDM)[3] | The thermoplastic material is melted and laid on the building platform layer by layer until the object is formed | Polycarbonate, polypropylene, polylactic acid, polyester, wax and polyamide, etc |
| Bioprinting[4] | The biomaterial is extruded from the nozzle under pressure and laid layer by layer until the scaffold is constructed | Alginate, chitosan, gelatin, Collagen and fibrin, etc | |
| Material sintering | Selective laser sintering(SLS)[5] | The high-power laser beam melts the powder material and lays it layer by layer to form the object | Polyamide, ceramics, plastics, Thermoplastic powder, metal, etc |
| Electron beam manufacturing(EBM)[6] | EBM is similar to SLS, except that high-power electron beams are used to melt powder particles | Titanium, cobalt chromium alloy, etc | |
| Stereolithography (SLA)[7] | The UV laser beam selectively solidifies the photopolymer resin layer by layer, building it up in sequence until the object is formed | Photopolymers, plastics, glass, ceramics and epoxy resins, etc | |
| Continuous liquid interface production(CLIP)[8] | CLIP is similar to SLA, except that UV light passes through the base of the resin to solidify a specific area, and the printing platform is lifted up to create the 3D printed object | Photopolymer | |
| Material binding | Binder jetting/ inkjet[9] | The liquid bonding material is selectively dripped into a specific area of the powder layer until the final object is formed | Starch, hydrogel, water (binder) and gypsum (powder bed), etc |
| Polyjet[10] | Polyjet is similar to inkjet, but the photopolymer liquid is layered onto the construction platform, where UV light makes it instantly solidify | Polypropylene, polystyrene, polycarbonate, etc | |
| Lamination | Laminated object manufacturing (LOM)[11] | The layers of adhesive coated material are successively glued together and laser cut into the desired shape | Tissue paper, polyvinylcaprolactam, plastic and metal laminate, etc |
虽然人体具有强大的再生能力,但是不同组织的再生能力并不相同。细胞的再生能力受到组织类型、生长激素和物理尺寸等因素的影响,一旦组织损伤超过其自修复限度,就需要外部支持来帮助其完成修复过程。一般将外界干涉支持组织再生的方法称为组织工程(TE)[12]。构建组织工程人工器官需要三个要素,即种子细胞、支架材料和细胞生长因子,而支架材料作为组织工程的三要素之一,需要具有良好的生物相容性和一定的机械强度,其内部结构会影响细胞活性和细胞增殖。患者的病情各异,需要根据具体情况定制不同结构的支架,传统的制造方法难以满足这种个性化定制需求。3D打印技术的出现为患者带来了福音,它可以提供个性化定制服务,制造具有复杂结构的支架,并大幅提高支架的性能。用于3D打印的医用材料需要具备良好的生物相容性、可控的降解速率以及形态学上与体内组织相似等特性。根据材料的化学性质,用于3D打印的医用材料大致分为金属、陶瓷和聚合物等。
2.1 金属基生物材料金属基生物材料主要包括钛(Ti)基金属生物材料和钴(Co)基金属生物材料。Ti基金属生物材料因具有优异的生物相容性、抗疲劳性、耐腐蚀性和高比强度等特性,被广泛应用于生物医学领域[13]。
Ti基金属生物材料作为承重植入物时需要与人体组织之间建立完美的结合。前期研究表明,随着时间的推移,Ti基金属生物材料可能被坚硬的组织层包围,限制其发挥作用;此外由于应力屏蔽效应,使得传统的Ti64植入物出现与人骨机械性能不匹配的状况[14]。利用3D打印技术对Ti基金属生物材料进行表面改性不仅能够改善其表面磨损性能,还能制造多孔和分级结构以增强骨整合。Zhao等[15]利用电子束熔融(electron beam melting,EBM)技术制备分级Ti-6Al-4V网状结构,获得了具有低密度、高疲劳强度和可生物吸收等优点的“硬-软”梯度细胞结构,这种结构可优化组织生长,并在特定区域承受不同程度的机械应力,其性能均优于均质金属细胞结构。
尽管3D打印钛基金属植入物是应用最广泛的植入物之一,但其杨氏模量与骨骼的杨氏模量不匹配所引起的应力屏蔽效应是目前钛基金属材料存在的主要问题之一。未来,仍需探索更多的钛基金属材料处理策略,开发出生物相容性好和综合性能较优的新型医用钛基金属材料,进而有效地增强3D打印支架的骨整合能力。
钴基金属生物材料强度较高且耐磨,在医疗领域主要用于制备承重植入物、牙科植入物[16]以及整形外科重建手术中的辅助工具[17]等。Co基金属生物材料的高刚度特性易引发应力屏蔽效应,因而限制了其在生物医学领域的应用。为减少CoCr合金的应力屏蔽效应,Shah等[18]利用EBM技术制备了具有互连开孔结构的CoCr植入物,并将其植入骨缺损的绵羊体内。结果表明CoCr植入物的多孔网络结构中存在较高的骨细胞密度,证实了多孔CoCr构建体中骨向内生长的可能性。
对CoCr合金进行表面改性处理可增强其耐腐蚀性能,进一步拓宽其应用范围。Wang等[19]利用激光抛光技术对3D打印CoCr合金支架进行表面处理,处理后的CoCr合金组件耐腐蚀性得到显著提高,可防止由其制备的牙科植入物在口腔中被腐蚀,进而释放毒性物质[20]。这一探索对于制备在口腔修复学中应用的牙科植入物提供了新思路。
目前,CoCr合金是应用较多的钴基金属材料之一,其主要用于制备牙科植入物。在未来,需要探索利用不同的加工方法,或是在CoCr支架中掺杂其他物质,来减少CoCr合金支架应力屏蔽效应的可能性,进而促进骨整合过程,拓宽其应用范围。此外,还需寻找更为适合的表面处理方法以避免CoCr合金被腐蚀后释放有毒物质,以防止其对人体造成伤害。
2.2 生物陶瓷材料生物陶瓷材料在3D打印应用中的历史相对短一些,限制其应用的主要原因在于生物陶瓷的加工比较困难。生物陶瓷材料一般用于制备牙齿和骨骼植入物,利用3D打印技术制造精度更高的生物陶瓷牙齿和骨骼植入物,可满足患者对骨骼和牙齿更换的特殊需求。目前使用较多的生物陶瓷材料主要是磷酸钙(CaP)和生物活性玻璃(BG)。
CaP陶瓷材料,包括偏磷酸钙、正磷酸钙和焦磷酸钙[21]等。CaP与天然骨和牙齿的组成相似,具有优异的生物相容性,是使用范围较广的生物陶瓷材料。Carrel等[22]通过3D打印技术制备了多孔块状磷酸三钙和羟基磷灰石,将其填充到钛半球中,植入绵羊体内。取出后测试其中的新生骨量,数值是填充颗粒牛骨和颗粒磷酸三钙的钛半球的1.8倍。与现有骨替代物相比,在绵羊颅骨模型植入多孔块状磷酸三钙和羟基磷灰石后可增强垂直骨生长,其受控的多孔结构可促使骨床上生成更多的骨,表明这种支架可有效促进骨合成过程。
此外,陶瓷基复合材料植入物引起了学者们的广泛关注。Jakus等[23]在羟基磷灰石中掺杂聚己内酯(或聚乳酸)制得了一种新型生物材料——超弹性“骨”(HB)(图 1)。实验证明,3D打印的HB脊柱融合模型不会引起免疫反应,可与周围组织快速整合并支持新骨生长。HB克服了以往骨科植入物易引起免疫反应或其他不良生物学反应的缺陷,且在结合3D打印技术后植入体内时能够准确定位,减少了手术操作时间。
生物活性玻璃(BG)是一种以Na2O,CaO,SiO2和P2O5等为基本成分的硅酸盐玻璃,因其具有更为优越的力学性能,可有效地促进体外和体内成骨[24-26]。在临床上,BG主要用于制备整形外科和颌面外科的假体,BG颗粒可替代传统的骨移植来治疗慢性骨髓炎、软组织缺损[27]和伤口[28]等。Zhang等[29]以BG和锶(Sr)为原料,利用3D打印技术制备了含Sr中孔生物活性玻璃(Sr-MBG)支架。Sr-MBG支架具有均匀的相互连接的孔、高孔隙率和良好的磷灰石形成能力,可刺激成骨细胞增殖分化。
对MBG支架进行表面改性可进一步增强其生物学性能。Zhang等[30]制备了含有分级孔结构和功能性表面涂层的MBG-β-TCP支架,具有高抗压强度和优异的磷灰石矿化能力。MBG-β-TCP支架可增强体内新骨形成能力和人脐静脉内皮细胞的附着,使得血管生成基因表达显著增强。表明利用MBG纳米层修饰的3D打印支架可有效改善支架的生物学性能,这是一种改善支架内骨形成情况的新策略。
虽然BG具有良好的生物活性和骨传导性,但是BG固有的脆性限制了其在临床医学中的应用[31]。通过在BG材料中掺入其他可生物降解的聚合物来制备BG复合材料,可有效改善其性能,满足更为广阔的应用需求。
2.3 天然聚合物天然聚合物,例如,壳聚糖、聚乳酸和透明质酸等,具有良好的生物相容性、生物降解性,应用于生物体内时可避免免疫原性反应[32],故被广泛用于组织工程和再生医学中。
2.3.1 壳聚糖壳聚糖是一种天然聚合物,具有良好的生物降解性、生物相容性和可再生性[33]。壳聚糖链上的氨基质子化后具有可溶性,可溶性的壳聚糖应用比较广泛,例如,制备TE支架、生物传感器和药物输送[34]等。
在以往的研究中,已经证实炎症反应在组织修复中十分关键,恶性的炎症反应可能导致人体对植入物产生免疫排斥反应。因此,在选择植入物时,需要将可能的炎症反应考虑在内。Almeida等[35]通过3D打印技术制造出一种壳聚糖支架,来探究人体单核细胞/巨噬细胞在支架上的炎症反应。实验结果显示壳聚糖支架具有更大的孔隙结构,可显著地促进促炎症细胞因子的分泌,进而抑制一些可能的炎症反应,表明在制造植入物支架时选择具有适合的表面特性和几何形状的生物材料是至关重要的。
壳聚糖本身优异的生物学性质,使其不仅可用于制备植入物支架,还可作为抗菌剂对其他支架进行表面改性处理以避免可能的炎症反应。Mania等[36]在聚乳酸中掺杂壳聚糖制得了可用于熔融沉积成型(fused deposition modeling,FDM)工艺的3D打印抗菌长丝。通过与不含壳聚糖的支架进行对比分析发现,支架本身并不杀菌或抑菌,但是引入壳聚糖后,壳聚糖对金黄色葡萄球菌和大肠杆菌的抗菌活性均十分显著。因此,利用壳聚糖对3D打印支架进行表面改性将是一种有效的抑菌手段。基于壳聚糖良好的生物特性和优异的抗菌性能[37],其被植入人体后可避免可能的炎症反应,但壳聚糖支架的力学强度并不理想,因而需要探索壳聚糖与其他物质复合制备组织工程支架的方法,以期满足更多的医疗需求。
2.3.2 聚乳酸聚乳酸(PLA)是一种天然聚合物,具有优良的力学性能、可降解性和生物相容性,广泛应用于组织工程、药物输送和伤口愈合[38]。PLA可通过酯键水解降解,无需酶催化,且降解产物乳酸是人体代谢循环中存在的物质[39],使得PLA成为3D生物打印领域极具潜力的原料之一。
通过控制PLA支架的结构和可控孔隙形状等相关参数可制备出符合性能要求的骨科植入物,图 2列举了一些3D打印产品的微观图和实物图。Fairag等[40]利用3D打印技术设计并制造了具有不同孔径的微孔PLA支架。使用原代人成骨细胞比较支架上细胞生长、活性和骨样组织形成情况(图 2(a)), 实验结果显示,成骨细胞的增殖、代谢活性和骨基质蛋白质的产生情况均十分良好,表明PLA支架本身也能作为骨替代物来修复大段骨缺损。可定制PLA骨螺栓推入骨缺损处,从而允许骨髓干细胞渗透、黏附、增殖并形成新骨。
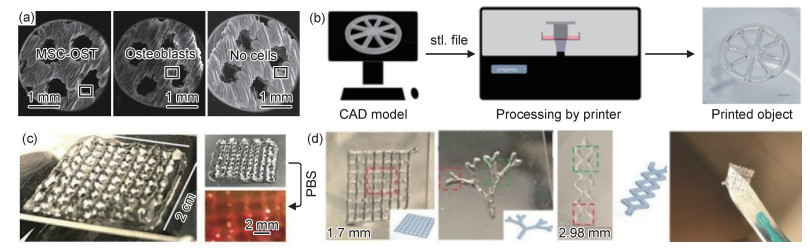
|
图 2 3D打印产品的微观图和实物图 (a)无细胞、成骨细胞和MSC-OST接种支架的SEM图像[40];(b)软骨模型构建过程[42];(c)3D打印水凝胶支架在空气和模拟体液(PBS)中的状态[49];(d)生物墨水打印的三种不同形状支架实物图[51] Fig. 2 Microscopic and physical pictures of 3D printing products (a)SEM images of cell-free, osteoblasts and MSC-OST inoculated scaffolds[40]; (b)cartilage model construction process [42]; (c)state of 3D printed hydrogel scaffolds in air and simulated body fluids (PBS)[49]; (d)photos of three scaffolds with different shapes printed by using bioink [51] |
聚乳酸因具有优异的可生物降解吸收性能而备受关注,但是其与细胞的亲和性较低,是限制其在组织工程中应用的主要因素之一。因此需要寻找合适的改性方法,改善聚乳酸材料表面的亲水性,使其成为一种理想的组织工程材料。
2.3.3 透明质酸透明质酸(HA)是一种广泛存在于结缔组织、上皮组织和神经组织中的天然糖胺聚糖,因其具有天然黏弹性、生物降解性和生物相容性,被认为是一种理想的骨组织工程支架材料[41]。
Lam等[42]以基于甲基丙烯酸化透明质酸(HAMA)的生物墨水(bioink)为原料,利用立体光固化成型(stereo lithography appearance,SLA)技术制备了软骨细胞密度不同的软骨模型(图 2(b))。研究显示软骨分化模式受细胞密度的影响,高细胞密度可增强软骨典型的带状分割,形成细胞外基质(ECM)的软骨细胞主要分布在表面区域,但在靠近载体膜的更深区域中也有少量分布。HAMA打印的体外软骨模型,可用于关节软骨缺损的治疗。
透明质酸也可作为一种辅助工具来帮助实现预期治疗效果。例如,制备功能性生物链以响应药物治疗过程。Mazzocchi等[43]将HA与胶原蛋白Ⅰ的复合产物用于打印含有原代人肝细胞和肝星状细胞的3D肝组织构建体,结果证明甲基丙烯酸化的Ⅰ型胶原和硫醇化HA可用于打印简单的生物链,支持肝细胞的生长,使其能够存活两周并适当地响应药物治疗,这一发现有望将其用于肝病的治疗。
尽管在3D打印医学领域,对HA的探索起步比较晚,但是HA相关产品的发展十分迅速。HA参与伤口自愈合过程的特性,赋予了相关支架潜在的抑菌能力。此外,通过交联反应,与其他物质复合等可进一步改善其性能,进而拓宽其应用范围。
2.4 合成聚合物3D打印的医学支架最终将应用于人体,因而生物相容性是一种材料是否适用于植入体的基本要求。此外,植入材料必须无细胞毒性、诱变性、致癌性,且不致引发过敏。目前可用于医疗领域的合成聚合物种类较少,主要集中于水凝胶、聚己内酯和聚醚醚酮等具有生物相容性的合成聚合物。
2.4.1 聚己内酯聚己内酯(PCL)是一种常见的聚合物,具有优异的生物相容性和生物降解性,由于酯键水解,PCL在人体体液中可缓慢降解,完全降解产物为二氧化碳和水[44]。此外,由于其优异的加工性能,在3D打印领域有着广泛的应用。
Kawai等[45]以PCL和磷酸三钙为原料,利用3D打印技术制备了功能梯度支架(FGS),所得FGS具有可控的孔隙率、生物降解性和一定的机械强度。将FGS植入到兔股骨颈和头部钻孔的骨隧道中,植入8周后取出,显示FGS支架上新骨向内生长,有含骨髓的骨形成,验证了FGS支架用于治疗早期股骨头坏死的可能性。
此外,科研人员对PCL复合材料高度关注。例如,Ho等[46]利用3D打印技术制备了孔结构受控的Biodentine(BD,主要成分为硅酸钙)/PCL复合支架,BD/PCL支架具有良好的磷灰石形成能力,并且能够支持人牙髓细胞的增殖和分化,证明其是一种有潜力的牙科植入物。
PCL优异的生物学性能、无毒的降解产物等优点使其在生物医学领域有着广泛的应用,但是仍存在一些缺陷。例如,PCL的熔点和分解温度较低,一般的加工方法并不适用,而且PCL的强度较低,所制备的支架力学性能不足。因此,需要探索不同的改性方法来提高PCL材料的生物学性能,使其更好地满足医疗需求。
2.4.2 水凝胶水凝胶的高含水量和力学特征与天然细胞外基质相似,因此水凝胶支架可用于模拟体内细胞环境,帮助建立细胞间、细胞与胞外基质间的联系[47]。在基于挤出水凝胶的3D打印成型方法中,对材料黏度的要求比较严格。挤出时,材料需要较低的黏度以便挤出,而沉积时,材料的黏度要足够高以防止材料在凝胶时分散,且在细胞培养过程中,水凝胶的力学性能不能随时间改变。现有的3D打印技术虽然可以通过调整材料来达到这些要求,但是这一过程往往是以牺牲细胞的活性为代价的[48]。鉴于此,学者们对水凝胶进行了许多尝试,以期打破现有局限。
Wang等[49]在透明质酸水凝胶中添加了腙化物,制备了由动态共价化学腙键组装的透明质酸水凝胶,这种水凝胶具有剪切稀化和自修复特性[50],意味着它可以满足3D打印不同阶段对水凝胶黏度的要求,且在打印完成后可长时间定型。将细胞包封在水凝胶中后打印,结果显示支架中细胞的存活率与打印前细胞的存活率相当(图 2(c)),证明3D打印构建体中细胞的活性与非打印构建体中细胞的活性没有差异,突破了以往3D打印水凝胶支架力学性能与细胞活性不能兼得的限制。在水凝胶中添加促进细胞增殖分化的物质,可制得功能性生物墨水,用于组织损伤修复过程。Faramarzi等[51]开发了一种基于海藻酸盐的水凝胶,可与富含血小板的血浆(PRP)结合形成生物墨水,使用此生物墨水打印的支架可控制PRP相关生长因子的释放以增强血管形成,并促进干细胞迁移(图 2(d)),用于体内受损组织的治疗。
目前,有关水凝胶的研究主要是向水凝胶中掺杂生长因子和干细胞等以制成功能性生物墨水,用于构建人体器官模型和修复组织缺陷。随着对水凝胶制备方法及其在医疗领域探索的不断深入,可对外界的物理、化学刺激做出快速反应的智能水凝胶将是未来的发展趋势。此外,还需探索水凝胶与其他材料复合的可能性,以进一步满足特定器官对于材料成分和结构仿真方面的特殊要求。
2.4.3 聚醚醚酮聚醚醚酮(PEEK)是一种有机热塑性聚合物,具有良好的生物相容性、耐热性、耐腐蚀性等,被称为“21世纪最有前途的材料”。与基于金属材料的植入物相比,PEEK的弹性模量和人骨的弹性模量更接近,能够满足人体正常的生理需要。
尽管PEEK具有与人体相适应的特性,但是PEEK支架是表面化学惰性的,为了更好的治疗效果常需要对其进行表面处理。Oladapo等[52]利用3D打印技术制备基于PEEK、羟基磷灰石和氧化石墨烯(PEEK-HAP-GO)支架以调节支架内部的孔隙率,实验结果显示通过对支架内部孔隙率的调整,可有效改善PEEK-HAP-GO支架与体内原有骨的界面整合,提高PEEK植入物的表面生物活性。
目前,3D打印的PEEK相关产品已成功应用于临床,如椎间植入物、胸骨和血管外支架。在未来几年中,其将对工程、医疗、牙科等领域产生更大的影响。
3 3D打印在医疗领域的应用3D打印作为一种快速兴起的技术,在医疗领域的应用范围不断扩大。3D打印技术在医疗领域的应用主要经历了以下几个阶段:第一阶段是制备患者特定解剖模型、解剖学操纵辅助工具[53];第二阶段是制备个性化的特异性植入物、在植入物上加载活性物质(例如生长因子和药物)[54];第三阶段是制造骨骼、软骨、韧带、半月板和其他结构[55];第四阶段是组织组件与单独打印的植入物组装在一起发挥作用[56]。目前在医疗领域,3D打印技术主要用于制备骨科植入物、皮肤代用品、神经修复、打印卵巢和药物释放等方面。
3.1 骨科3D打印技术在骨科的临床应用上有很多成功案例。2018年,中国的医生们已经成功实施了首例3D打印肱骨近端假体手术,3D打印截骨工具辅助膝关节置换术,3D打印人工颈椎椎体植入术等手术,为多名患者带来新的希望。本节将列举一些未来有希望在临床上进行应用的案例。
类固醇相关性骨坏死(SAON)是一种骨缺血性坏死,早期治疗的主要方法是利用髓芯减压术去除坏死骨以促进修复,后续用骨移植来填充骨缺损以避免随后的关节塌陷。Lai等[57]开发了一种聚(乳酸-乙醇酸)/β-磷酸钙/淫羊藿苷(PTI)支架,PTI支架具有优异的生物降解性、生物相容性和成骨能力,可以提供机械支撑,改善血管生成和调节成骨细胞分化过程,这种新型的PTI复合支架为SAON患者带来了福音。
椎间融合器是实现脊柱相邻椎间隙融合的主要植入物之一,其安全性和有效性直接影响相邻椎体骨融合的效果。Li等[58]以骨骼成熟的绵羊颈椎为融合模型,通过3D打印技术制造了多孔钛合金支架,在成熟绵羊上进行了骨融合实验,结果显示3D打印钛合金支架的刚度高于PEEK支架,与利用传统工艺制作的钛合金支架相比,应力屏蔽效应明显降低。取出后,3D打印的钛合金支架内部形成了连续的、紧密相连的骨组织,证明3D打印钛椎间融合器具有良好的生物相容性,可促进骨向构建体内部生长。
目前,3D打印技术在骨科方面的应用主要集中在骨科支架制备上。未来,3D打印的骨科支架性能将会得到进一步提升,更多的功能性骨科支架将被开发。
3.2 皮肤皮肤是身体对外部环境的屏障,对生物体的生存意义重大[59]。皮肤替代品作为促进伤口愈合的重要工具,长期以来被广泛用于患者伤口的治疗[60]。利用传统方法制造的皮肤替代品存在许多问题,例如,仿生学性能不足、生产成本高、尺寸单一、制备耗时长等[61]。因而人们急需一种可以实现低成本、标准化制造皮肤替代品的技术,3D打印技术的出现为解决这一问题提供了可行的方案。
典型的组织工程皮肤构建体缺乏皮肤的复杂特征。例如,皮肤色素沉着、毛囊甚至汗腺[62]。Ng等[63]利用来自正常人皮肤组织的三种不同的原代皮肤细胞:角质形成细胞(KCs)、黑素细胞(MCs)和成纤维细胞(FBs)进行实验,探究了制造具有均匀皮肤色素沉着的3D体外着色人体皮肤构建体的可行性。实验结果显示,在3D生物打印的人皮肤构建体中存在发育良好的角质形成细胞。这是黑色素转移过程中必需的细胞,而且根据对色素的追踪,发现其可在构建体上均匀分布。
3D打印皮肤构建体为皮肤缺陷或皮肤损伤患者的治疗提供了一种有效的解决方案,且3D体外有色人体皮肤构建体,可用于潜在的毒理学测试和基础细胞生物学研究。随着研究的深入,3D打印皮肤构建体或许可以在更多的方面帮助患者。
3.3 外周神经修复神经导管可以连接两个神经末梢,引导轴突再生,为施万细胞的聚集和增殖提供营养环境[64]。想要制造具有优良性能的神经导管需要考虑两个问题:一是原料选择,二是表面改性和支架制造。制备的神经导管应满足以下要求,一是可连接缺损的神经,二是可为轴突再生提供稳定的环境保障,三是在成功将受损神经连接后,神经导管可有效降解,为神经进一步生长提供空间。
功能性神经修复支架可在给予神经恢复空间的同时,释放相关的药物以加速修复过程。Tao等[65]制备了含药物的3D打印水凝胶导管,不仅为轴突伸长提供物理微环境,还可促进神经再生。这种功能性支架可有效促进坐骨神经损伤的形态学、组织病理学和体内功能的恢复,这是一种有前景的自体移植物,未来有望在临床中得到广泛应用。
目前3D打印技术在神经修复领域上的应用相对较少,但这是一个前景十分广阔的医学领域,它可以弥补传统治疗手段治标不治本的弊端,通过细胞不断增殖促进神经突触再生,有望恢复受损神经的功能。
3.4 3D打印卵巢卵巢位于女性盆腔内,主要功能是产生和排出卵细胞,分泌性激素,以促进女性性征发育并维持其正常活动。若卵巢出现问题,会导致女性不孕,并且影响患者的健康。
Laronda等[66]以水凝胶为原料,利用3D打印技术制得了具有不同几何形状孔隙的微孔水凝胶支架,分别探究了支架对卵巢卵泡细胞的支持情况。实验结果显示,随着支架内相互作用的增多,卵泡细胞扩散受限并且存活率增加,支架变得高度血管化。另外,在没有使用外源性血管生成因子情况下,生物假体卵巢在植入1周后即变得血管化。随后研究人员将其植入卵巢缺陷的小鼠体内,发现其卵巢功能完全恢复,且通过自然交配生产了幼崽。
3D打印女性卵巢旨在帮助成年妇女恢复产生雌性激素和生育的能力,3D打印卵巢目前还停留在实验室阶段,要想将其真正的应用于人体,还需解决血管分布等相关问题。
3.5 药物释放3D打印片剂能够实现药物的可控释放,患者可根据身体状况,灵活改变药物摄入量。而且在狭窄治疗指数药物使用上,3D打印技术提供了一种制造包含精确剂量药物片剂的方法,可降低剂量变化和用药错误带来的潜在风险。
目前可直接以药物为原料进行3D打印,可避免因载体不稳定性和不定载药量对治疗效果产生的影响。Kadry等[67]以羟丙基甲基纤维素和地尔硫卓(模型药物)为原料制得了3D打印机用长丝,随后打印得到的片剂以口服形式向大鼠给药,通过跟踪药物,准确绘制了药物释放曲线。
Pere等[68]利用3D打印技术制备了用于透皮输送胰岛素的聚合物微针贴片,该微针贴片以木糖醇作为载体来保持胰岛素的完整性和稳定性,并加快其释放速率。跟踪研究结果,无论如何设计微针,胰岛素均可在30 min内迅速释放且未被破坏,证明3D打印技术可用于制造具有生物相容性的微针贴片。
3D打印的微针贴片与传统注射胰岛素方式相比,可减轻患者痛苦,便于携带,并且胰岛素的释放速率可控。患者可针对当天身体状况,灵活改变胰岛素摄入量。此外,透皮微针是直接将药物释放到皮下脂肪中,避免了口服给药过程可能引起的副作用,可应用到激素类药物输送中,以避免由此引发的肥胖问题。未来3D打印透皮微针贴片或许可在更多的疾病治疗上帮助患者。
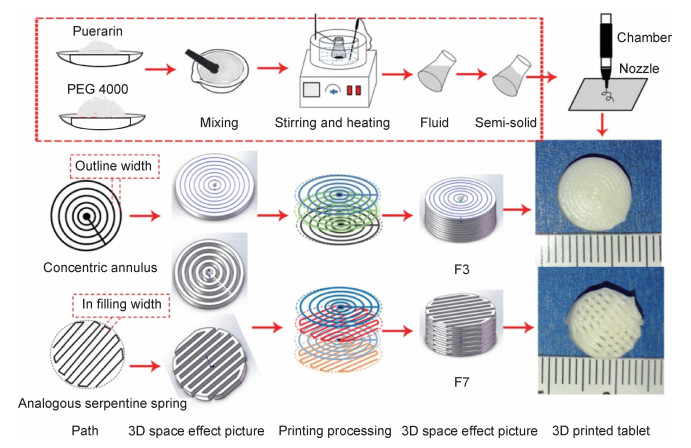
3D打印技术也可用于制备口腔崩解片剂(ODT),ODT在与唾液或口腔中的少量水接触后即可实现药物吸收,增强人体对药物的吸收度。Li等[69]利用3D打印技术在较低温度、无溶剂的情况下制备了速释葛根素片(图 3),通过对打印片剂内部结构的调节实现了对药物溶解速率的控制,且采用水溶性载体聚乙二醇来增强药物溶解性。克服了传统方法制备葛根素片溶解性差,生物利用度低的缺陷。
3D打印的口腔崩解片剂,可以调节其内部空隙大小,个性化给药,减少患者痛苦。同时也可以解决在部分特殊情况下无法获得足够饮用水服药的问题。未来,会有更多的药物应用到3D打印口腔崩解片剂中。
4 未来发展趋势近年来,3D打印技术已成功应用于医学领域,对一些需要植入物移植的疾病防治起到了关键性的作用,私人化定制的特点使得其能够更贴近患者的需求,为人体组织与植入物之间建立良好纽带提供坚实基础。相比于传统的植入物制造工艺,3D打印技术具有诸如速度更快、成本更低、生物相容性更好和炎症反应更小等显著优势。尽管3D打印的出现极大地改变了生物医学领域以及其他行业的技术现状,但是3D打印仍然存在一些问题。
3D成型植入物是静态的、无生命的。故将植入物移植到体内,其并不能随着内环境的变化而进行相关的适应性调整,因而无法达到理想的治疗效果;3D打印的细胞相关产品不能根据外界刺激进行相应分化,且常规3D打印过程会对细胞活性产生一定影响。尽管目前也有相关研究显示在水凝胶中添加腙化物可以不影响其中包封的细胞活性,但是目前这种探索仅进行了体外实验。
综合3D打印在医疗领域的研究现状可知,限制3D打印技术进一步发展的主要因素是3D打印材料。目前使用的固态医用材料主要来源于对金属基材料、水凝胶、磷酸钙等已有材料的复合改性。这些传统固态材料3D打印产品的特点是一次成型,几乎不会因为环境变化而改变。液态材料生物墨水是一种自定义材料,可根据产品需要添加相关的生长因子和营养物质等以满足细胞增殖分化所需。然而人体内的环境较为复杂,许多反应机制尚不明确,现有的生物墨水虽然能够打印出组织、器官,但并不能用于人体移植,仍需更多的探索和尝试。
基于此,4D打印技术应势而生。最初,4D打印被认为是“3D打印+时间”,随着研究的不断深入,4D打印的定义逐步完善,目前普遍认可的理论是:当3D打印结构受到预定刺激时,它的属性和功能会随时间变化。在生物医学领域常见的刺激是温度、水和磁场。利用可根据外界刺激进行调整的生物打印材料,4D打印可以制造出具有“活性”且结构更为复杂的,与天然组织结构非常相似的工程化组织结构。
4D打印技术在继承了3D打印技术优点的同时,弥补了现有3D打印的一些缺陷。例如,4D打印的血管内腔涂层内皮细胞膜可以减少血栓形成,防止血管堵塞;4D打印药物输送系统可根据内环境的pH值和温度变化改变药物封装和释放过程;4D打印的智能响应水凝胶可根据响应性动态重新配置结构且对细胞活性没有影响。在未来,4D打印技术在医学领域会有更为广阔的应用,解决组织工程和药物递送等领域的难题。
| [1] |
MURPHY S V, ATALA A. 3D bioprinting of tissues and organs[J]. Nature Biotechnology, 2014, 32(8): 773-785. DOI:10.1038/nbt.2958 |
| [2] |
HULL C, FEYGIN M, BARON Y, et al. Rapid prototyping: current technology and future potential[J]. Rapid Prototyping Journal, 1995, 1(1): 11-19. DOI:10.1108/13552549510732026 |
| [3] |
ZEIN I, HUTMACHER D W, TAN K C, et al. Fused deposition modeling of novel scaffold architectures for tissue engineering applications[J]. Biomaterials, 2002, 23(4): 1169-1185. DOI:10.1016/S0142-9612(01)00232-0 |
| [4] |
KOLESKY D B, TRUBY R L, GLADMAN A S, et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs[J]. Advanced Materials, 2014, 26(19): 3124-3130. DOI:10.1002/adma.201305506 |
| [5] |
OLAKANMI E O, COCHRANE R F, DALGARNO K W. A review on selective laser sintering/melting (SLS/SLM) of aluminium alloy powders: processing, microstructure, and properties[J]. Progress in Materials Science, 2015, 74: 401-477. DOI:10.1016/j.pmatsci.2015.03.002 |
| [6] |
RILL M, PLET C, THIEL M, et al. Photonic metamaterials by direct laser writing and silver chemical vapour deposition[J]. Nature Mater, 2008, 7(7): 543-546. DOI:10.1038/nmat2197 |
| [7] |
HOLLISTER S. Porous scaffold design for tissue engineering[J]. Nature Mater, 2005, 4(7): 518-524. DOI:10.1038/nmat1421 |
| [8] |
TUMBLESTON J R, SHIRVANYANTS D, ERMOSHKIN N, et al. Continuous liquid interface production of 3D objects[J]. Science, 2015, 347(6228): 1346-1349. DOI:10.1126/science.aaa3304 |
| [9] |
LIGON S C, LISKA R, STAMPFL J, et al. Polymers for 3D printing and customized additive manufacturing[J]. Chemical Reviews, 2017, 117(15): 10212-10290. DOI:10.1021/acs.chemrev.7b00074 |
| [10] |
MACDONALD N P, CABOT J M, SMEJKAL P, et al. Comparing microfluidic performance of three-dimensional (3D) printing platforms[J]. Analytical Chemistry, 2017, 89(7): 3858-3866. DOI:10.1021/acs.analchem.7b00136 |
| [11] |
REN K, ZHOU J, WU H. Materials for microfluidic chip fabrication[J]. Accounts of Chemical Research, 2013, 46(11): 2396-2406. DOI:10.1021/ar300314s |
| [12] |
LANGER R. Perspectives and challenges in tissue engineering and regenerative medicine[J]. Advanced Materials, 2009, 21(32/33): 3235-3236. |
| [13] |
ZHU J, LI P, GUO W, et al. Titanium-based metal-organic frameworks for photocatalytic applications[J]. Coordination Chemistry Reviews, 2018, 359: 80-101. DOI:10.1016/j.ccr.2017.12.013 |
| [14] |
ARABNEJAD S, JOHNSTON B, TANZER M, et al. Fully porous 3D printed titanium femoral stem to reduce stress-shielding following total hip arthroplasty[J]. Journal of Orthopaedic Research, 2017, 35(8): 1774-1783. DOI:10.1002/jor.23445 |
| [15] |
ZHAO S, LI S J, WANG S G, et al. Compressive and fatigue behavior of functionally graded Ti-6Al-4V meshes fabricated by electron beam melting[J]. Acta Materialia, 2018, 150: 1-15. DOI:10.1016/j.actamat.2018.02.060 |
| [16] |
MOHARAMZADEH K, BROOK I, VAN NOORT R. Biocompatibility of resin-based dental materials[J]. Materials, 2009, 2(2): 514-548. DOI:10.3390/ma2020514 |
| [17] |
TKACHENKO S, DATSKEVICH O, KULAK L, et al. Wear and friction properties of experimental Ti-Si-Zr alloys for biomedical applications[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2014, 39: 61-72. DOI:10.1016/j.jmbbm.2014.07.011 |
| [18] |
SHAH F A, OMAR O, SUSKA F, et al. Long-term osseointegration of 3D printed CoCr constructs with an interconnected open-pore architecture prepared by electron beam melting[J]. Acta Biomaterialia, 2016, 36: 296-309. DOI:10.1016/j.actbio.2016.03.033 |
| [19] |
WANG W J, YUNG K C, CHOY H S, et al. Effects of laser polishing on surface microstructure and corrosion resistance of additive manufactured CoCr alloys[J]. Applied Surface Science, 2018, 443: 167-175. DOI:10.1016/j.apsusc.2018.02.246 |
| [20] |
HALLAB N J, SKIPOR A, JACOBS J J. Interfacial kinetics of titanium-and cobalt-based implant alloys in human serum: metal release and biofilm formation[J]. Journal of Biomedical Materials Research: Part A, 2003, 65(3): 311-318. |
| [21] |
QI C, LIN J, FU L, et al. Calcium-based biomaterials for diagnosis, treatment, and theranostics[J]. Chemical Society Reviews, 2018, 47(2): 357-403. DOI:10.1039/C6CS00746E |
| [22] |
CARREL J, WISKOTT A, MOUSSA M, et al. A 3D printed TCP/HA structure as a new osteoconductive scaffold for vertical bone augmentation[J]. Clinical Oral Implants Research, 2016, 27(1): 55-62. DOI:10.1111/clr.12503 |
| [23] |
JAKUS A E, RUTZ A L, JORDAN S W, et al. Hyperelastic "bone": a highly versatile, growth factor–free, osteoregenerative, scalable, and surgically friendly biomaterial[J]. Science Translational Medicine, 2016, 8(358): 1-15. |
| [24] |
LIU X, RAHAMAN M N, FU Q. Bone regeneration in strong porous bioactive glass (13-93) scaffolds with an oriented microstructure implanted in rat calvarial defects[J]. Acta Biomaterialia, 2013, 9(1): 4889-4898. DOI:10.1016/j.actbio.2012.08.029 |
| [25] |
BROWN R F, DAY D E, DAY T E, et al. Growth and differentiation of osteoblastic cells on 13-93 bioactive glass fibers and scaffolds[J]. Acta Biomaterialia, 2008, 4(2): 387-396. DOI:10.1016/j.actbio.2007.07.006 |
| [26] |
FU Q, RAHAMAN M N, SONNY BAL B, et al. Mechanical and in vitro performance of 13-93 bioactive glass scaffolds prepared by a polymer foam replication technique[J]. Acta Biomaterialia, 2008, 4(6): 1854-1864. DOI:10.1016/j.actbio.2008.04.019 |
| [27] |
MIGUEZ-PACHECO V, HENCH L L, BOCCACCINI A R. Bioactive glasses beyond bone and teeth: emerging applications in contact with soft tissues[J]. Acta Biomaterialia, 2015, 13: 1-15. DOI:10.1016/j.actbio.2014.11.004 |
| [28] |
KARGOZAR S, BAINO F, HAMZEHLOU S, et al. Bioactive glasses: sprouting angiogenesis in tissue engineering[J]. Trends in Biotechnology, 2018, 36(4): 430-444. DOI:10.1016/j.tibtech.2017.12.003 |
| [29] |
ZHANG J, ZHAO S, ZHU Y, et al. Three-dimensional printing of strontium-containing mesoporous bioactive glass scaffolds for bone regeneration[J]. Acta Biomaterialia, 2014, 10(5): 2269-2281. DOI:10.1016/j.actbio.2014.01.001 |
| [30] |
ZHANG Y, XIA L, ZHAI D, et al. Mesoporous bioactive glass nanolayer-functionalized 3D-printed scaffolds for accelerating osteogenesis and angiogenesis[J]. Nanoscale, 2015, 7(45): 19207-19221. DOI:10.1039/C5NR05421D |
| [31] |
MAQUET V, BOCCACCINI A R, PRAVATA L, et al. Porous poly(α-hydroxyacid)/bioglass composite scaffolds for bone tissue engineering. Ⅰ: preparation and in vitro characterisation[J]. Biomaterials, 2004, 25(18): 4185-4194. DOI:10.1016/j.biomaterials.2003.10.082 |
| [32] |
NAIR L S, LAURENCIN C T. Biodegradable polymers as biomaterials[J]. Progress in Polymer Science, 2007, 32(8-9): 762-798. DOI:10.1016/j.progpolymsci.2007.05.017 |
| [33] |
CROISIER F, JEROME C. Chitosan-based biomaterials for tissue engineering[J]. European Polymer Journal, 2013, 49(4): 780-792. DOI:10.1016/j.eurpolymj.2012.12.009 |
| [34] |
KIM M Y, KIM J. Chitosan microgels embedded with catalase nanozyme-loaded mesocellular silica foam for glucose-responsive drug delivery[J]. ACS Biomaterials Science & Engineering, 2017, 3(4): 572-578. |
| [35] |
ALMEIDA C R, SERRA T, OLIVEIRA M I, et al. Impact of 3-D printed PLA- and chitosan-based scaffolds on human monocyte/macrophage responses: unraveling the effect of 3-D structures on inflammation[J]. Acta Biomaterialia, 2014, 10(2): 613-622. DOI:10.1016/j.actbio.2013.10.035 |
| [36] |
MANIA S, RYL J, JINN J, et al. The production possibility of the antimicrobial filaments by co-extrusion of the PLA pellet with chitosan powder for FDM 3D printing technology[J]. Polymers, 2019, 11(11): 1-17. |
| [37] |
张平生, 辛勇, 曹传亮, 等. 壳聚糖/羟基磷灰石表面修饰聚己内酯多孔骨支架的制备及性能[J]. 材料工程, 2019, 47(7): 64-70. ZHANG P S, XIN Y, CAO C L, et al. Preparation and properties of polycaprolactone porous bone scaffold modified with chitosan/hydroxyapatite on the surface[J]. Journal of Materials Engineering, 2019, 47(7): 64-70. |
| [38] |
魏泽昌, 蔡晨阳, 王兴, 等. 生物可降解高分子增韧聚乳酸的研究进展[J]. 材料工程, 2019, 47(5): 34-42. WEI Z C, CAI C Y, WANG X, et al. Research progress on toughening polylactic acid by renewable and biodegradable polymers[J]. Journal of Materials Engineering, 2019, 47(5): 34-42. |
| [39] |
NAIR A, TANG L. Influence of scaffold design on host immune and stem cell responses[J]. Seminars in Immunology, 2017, 29: 62-71. DOI:10.1016/j.smim.2017.03.001 |
| [40] |
FAIRAG R, ROSENZWEIG D H, RAMIREZ-GARCIALUNA J L, et al. Three-dimensional printed polylactic acid scaffolds promote bone-like matrix deposition in vitro[J]. ACS Applied Materials & Interfaces, 2019, 11(17): 15306-15315. |
| [41] |
COLLINS M N, BIRKINSHAW C. Hyaluronic acid based scaffolds for tissue engineering—a review[J]. Carbohydrate Polymers, 2013, 92(2): 1262-1279. DOI:10.1016/j.carbpol.2012.10.028 |
| [42] |
LAM T, DEHNE T, KRYGER J P, et al. Photopolymerizable gelatin and hyaluronic acid for stereolithographic 3D bioprinting of tissue-engineered cartilage[J]. J Biomed Mater Res B Appl Biomater, 2019, 107(8): 2649-2657. DOI:10.1002/jbm.b.34354 |
| [43] |
MAZZOCCHI A, DEVARASETTY M, HUNTWORK R, et al. Optimization of collagen type Ⅰ-hyaluronan hybrid bioink for 3D bioprinted liver microenvironments[J]. Biofabrication, 2018, 11(1): 15003. DOI:10.1088/1758-5090/aae543 |
| [44] |
LIM L T, AURAS R, RUBINO M. Processing technologies for poly(lactic acid)[J]. Progress in Polymer Science, 2008, 33(8): 820-852. DOI:10.1016/j.progpolymsci.2008.05.004 |
| [45] |
KAWAI T, SHANJANI Y, FAZELI S, et al. Customized, degradable, functionally graded scaffold for potential treatment of early stage osteonecrosis of the femoral head[J]. Journal of Orthopaedic Research, 2018, 36(3): 1002-1011. DOI:10.1002/jor.23673 |
| [46] |
HO C C, FANG H Y, WANG B, et al. The effects of biodentine/polycaprolactone three-dimensional-scaffold with odontogenesis properties on human dental pulp cells[J]. International Endodontic Journal, 2018, 51: 291-300. DOI:10.1111/iej.12799 |
| [47] |
MEALY J E, CHUNG J J, JEONG H, et al. Injectable granular hydrogels with multifunctional properties for biomedical applications[J]. Advanced Materials, 2018, 30(20): 1705912. DOI:10.1002/adma.201705912 |
| [48] |
RUTZ A L, HYLAND K E, JAKUS A E, et al. A multimaterial bioink method for 3D printing tunable, cell-compatible hydrogels[J]. Advanced Materials, 2015, 27(9): 1607-1614. DOI:10.1002/adma.201405076 |
| [49] |
WANG L L, HIGHLEY C B, YEH Y C, et al. Three-dimensional extrusion bioprinting of single- and double-network hydrogels containing dynamic covalent crosslinks[J]. J Biomed Mater Res: A, 2018, 106(4): 865-875. DOI:10.1002/jbm.a.36323 |
| [50] |
HIGHLEY C B, RODELL C B, BURDICK J A. Direct 3D printing of shear-thinning hydrogels into self-healing hydrogels[J]. Advanced Materials, 2015, 27(34): 5075-5079. DOI:10.1002/adma.201501234 |
| [51] |
FARAMARZI N, YAZDI I K, NABAVINIA M, et al. Patient-specific bioinks for 3D bioprinting of tissue engineering scaffolds[J]. Advanced Healthcare Materials, 2018, 7(11): 1701347. DOI:10.1002/adhm.201701347 |
| [52] |
OLADAPO B I, ZAHEDI S A, CHONG S, et al. 3D printing of surface characterisation and finite element analysis improvement of PEEK-HAP-GO in bone implant[J]. The International Journal of Advanced Manufacturing Technology, 2020, 106: 829-841. DOI:10.1007/s00170-019-04618-w |
| [53] |
GADIA A, SHAH K, NENE A. Emergence of three-dimensional printing technology and its utility in spine surgery[J]. Asian Spine Journal, 2018, 12(2): 365-371. DOI:10.4184/asj.2018.12.2.365 |
| [54] |
YING G L, JIANG N, MAHARJAN S, et al. Aqueous two-phase emulsion bioink-enabled 3D bioprinting of porous hydrogels[J]. Advanced Materials, 2018, 30(50): 1805460. DOI:10.1002/adma.201805460 |
| [55] |
ALJOHANI W, ULLAH M W, ZHANG X, et al. Bioprinting and its applications in tissue engineering and regenerative medicine[J]. International Journal of Biological Macromolecules, 2018, 107: 261-275. DOI:10.1016/j.ijbiomac.2017.08.171 |
| [56] |
VERMEULEN N, HADDOW G, SEYMOUR T, et al. 3D bioprint me: a socioethical view of bioprinting human organs and tissues[J]. Journal of Medical Ethics, 2017, 43(9): 618-624. DOI:10.1136/medethics-2015-103347 |
| [57] |
LAI Y, CAO H, WANG X, et al. Porous composite scaffold incorporating osteogenic phytomolecule icariin for promoting skeletal regeneration in challenging osteonecrotic bone in rabbits[J]. Biomaterials, 2018, 153: 1-13. DOI:10.1016/j.biomaterials.2017.10.025 |
| [58] |
LI P, JIANG W, YAN J, et al. A novel 3D printed cage with microporous structure and in vivo fusion function[J]. Journal of Biomedical Materials Research: Part A, 2019, 107(7): 1386-1392. DOI:10.1002/jbm.a.36652 |
| [59] |
FRUEH F S, MENGER M D, LINDENBLATT N, et al. Current and emerging vascularization strategies in skin tissue engineering[J]. Critical Reviews in Biotechnology, 2017, 37(5): 613-625. DOI:10.1080/07388551.2016.1209157 |
| [60] |
JIN Y, BI H. Current progress of skin tissue engineering: Seed cells, bioscaffolds, and construction strategies[J]. Burns & Trauma, 2013, 1(2): 63-72. |
| [61] |
NG W L, WANG S, YEONG W Y, et al. Skin bioprinting: impending reality or fantasy?[J]. Trends in Biotechnology, 2017, 34(9): 689-699. |
| [62] |
MACNEIL S. Progress and opportunities for tissue-engineered skin[J]. Nature, 2007, 445(7130): 874-880. DOI:10.1038/nature05664 |
| [63] |
NG W L, QI J T Z, YEONG W Y, et al. Proof-of-concept: 3D bioprinting of pigmented human skin constructs[J]. Biofabrication, 2018, 10(2): 025005. DOI:10.1088/1758-5090/aa9e1e |
| [64] |
GU X, DING F, YANG Y, et al. Construction of tissue engineered nerve grafts and their application in peripheral nerve regeneration[J]. Progress in Neurobiology, 2011, 93(2): 204-230. DOI:10.1016/j.pneurobio.2010.11.002 |
| [65] |
TAO J, ZHANG J, DU T, et al. Rapid 3D printing of functional nanoparticle-enhanced conduits for effective nerve repair[J]. Acta Biomaterialia, 2019, 90: 49-59. DOI:10.1016/j.actbio.2019.03.047 |
| [66] |
LARONDA M, RUTZ A, XI AO, S, et al. A bioprosthetic ovary created using 3D printed microporous scaffolds restores ovarian function in sterilized mice[J]. Nat Commun, 2017, 8: 1-10. DOI:10.1038/s41467-016-0009-6 |
| [67] |
KADRY H, Al-HILAL T A, KESHAVARZ A, et al. Multi-purposable filaments of HPMC for 3D printing of medications with tailored drug release and timed-absorption[J]. International Journal of Pharmaceutics, 2018, 544(1): 285-296. DOI:10.1016/j.ijpharm.2018.04.010 |
| [68] |
PERE C P P, ECONOMIDOU S N, LALL G, et al. 3D printed microneedles for insulin skin delivery[J]. International Journal of Pharmaceutics, 2018, 544(2): 425-432. DOI:10.1016/j.ijpharm.2018.03.031 |
| [69] |
LI P, JIA H, ZHANG S, et al. Thermal extrusion 3D printing for the fabrication of puerarin immediate-release tablets[J]. AAPS PharmSciTech, 2019, 21(1): 1-10. |
 2021, Vol. 49
2021, Vol. 49